
Хлор в химии - классификация, получение, свойства, формулы и определения с примерами
Содержание:
Хлор — химический элемент и простое вещество:
Химические элементы с наиболее ярко выраженными неметаллическими свойствами в периодической системе составляют VIIА-группу: фтор F, хлор Cl, бром Br, иод I и очень редко встречающийся в природе астат At. Эти элементы называются галогенами.
Хлор в природе
Наиболее распространенным в природе галогеном является хлор. Его массовая доля в земной коре составляет около 0,2 % — 11-е место по распространенности среди всех элементов. Широко распространены минералы и горные породы, содержащие хлориды, — соли соляной кислоты: галит (каменная или поваренная соль) NaCl, сильвин KCl, карналлит 

Хлор — один из химических элементов, без которых немыслимо существование живых организмов. Ионы хлора вместе с ионами натрия и калия регулируют водно-солевой обмен в организме человека. Хлор участвует в энергетическом обмене у растений, положительно влияет на поглощение корнями кислорода, а также соединений калия, кальция, магния.
Химический элемент хлор
Охарактеризуем хлор по плану, который вы применяли в 8-м классе.
Химический знак — Cl, относительная атомная масса — 35,5, атомный номер — 17. Этот элемент находится в третьем периоде в VIIА-группе.
Заряд ядра атома хлора равен 17+, следовательно, ядро содержит 17 протонов, а ядра двух его природных нуклидов 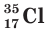 и
и 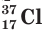 — соответственно 18 и 20 нейтронов.
— соответственно 18 и 20 нейтронов.
В атоме хлора 17 электронов, которые располагаются на трех электронных слоях: 17Cl 2e– , 8e– , 7e– .
На внешнем (незавершенном) электронном слое у атомов хлора находится по 7 электронов, следовательно, этот элемент относится к неметаллам. Максимальная положительная степень окисления хлора равна +7, формула его высшего оксида — 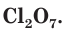 . Ему соответствует гидроксид, представляющий собой кислоту
. Ему соответствует гидроксид, представляющий собой кислоту 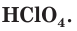
Степень окисления хлора в летучем водородном соединении равна –1, формула этого соединения — HCl.
Простое вещество
Хлор является веществом молекулярного строения. Его молекула состоит из двух атомов — 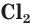 (рис. 35).
(рис. 35).

При обычных условиях хлор — желто-зеленый газ с резким запахом. Он в 2,5 раза тяжелее воздуха, ядовит. В Первую мировую войну хлор использовался даже в качестве боевого отравляющего вещества.
Растворимость хлора в воде небольшая: в одном объеме воды при 20 °С растворяется 2,5 объема хлора. Водный раствор хлора называется хлорной водой.
Химические свойства
Хлор является химически активным простым веществом. Он взаимодействует практически со всеми простыми веществами, за исключением кислорода, азота и благородных газов, образуя хлориды. С металлами хлор реагирует при слабом нагревании, а с некоторыми даже при обычных условиях, выступая в качестве окислителя:
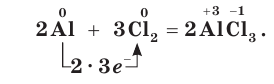
Как окислитель хлор реагирует с менее электроотрицательными неметаллами:
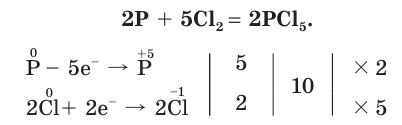
Хлор своеобразно реагирует с водородом. При обычной температуре в темноте реакция не происходит, но при сильном освещении или при нагревании смесь хлора и водорода может взорваться.
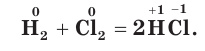
С большинством сложных веществ хлор также ведет себя как окислитель. Взаимодействуя с растворами бромидов и иодидов металлов, хлор вытесняет из них бром и иод:

Приведенные выше реакции подтверждают, что простое вещество хлор проявляет более сильные окислительные свойства, чем нижестоящие в группе галогены.
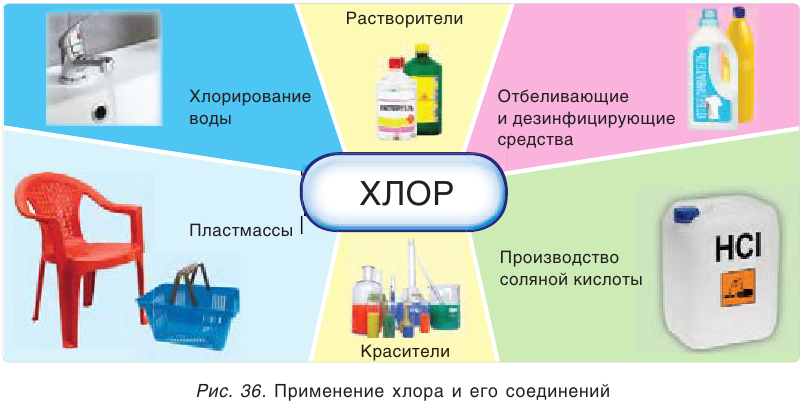
Применение хлора
По масштабам промышленного применения хлор намного превосходит все остальные галогены (рис. 36). В больших количествах хлор используется для обеззараживания питьевой воды. Хлор и его соединения применяются для отбеливания льняных и хлопчатобумажных тканей, бумаги, древесины и т. д. Особенно много его расходуется при производстве пластмасс, каучуков, красителей, различных растворителей. Огромны масштабы использования хлора в производстве соляной кислоты.
Хлор является самым распространенным галогеном.
Минимальная отрицательная степень окисления хлора равна –1, максимальная положительная — +7.
При обычных условиях простое вещество хлор — желто-зеленый газ с резким запахом, тяжелее воздух, ядовит.
Хлор взаимодействует непосредственно практически со всеми простыми веществами, за исключением кислорода, азота и благородных газов, а также со многими сложными веществами, выступая обычно в качестве окислителя.
Хлороводород и соляная кислота
Одним из важнейших соединений хлора является продукт его взаимодействия с водородом — хлороводород HCl. Это бесцветный газ с резким запахом, несколько тяжелее воздуха. Химическая связь в молекуле HCl — ковалентная полярная:
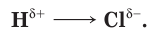
Молекула хлороводорода HCl полярна и представляет собой диполь.
Хлороводород очень хорошо растворяется в воде. Это легко проверить, если цилиндр, заполненный этим газом, опустить в чашку с водой (куда заранее было внесено несколько капель лакмуса). Вода быстро поднимется вверх, при этом раствор окрасится в красный цвет, что является свидетельством образования в цилиндре кислого раствора (рис. 37).


Соляная кислота
Раствор хлороводорода в воде — хлороводородная кислота, которую на практике чаще называют соляной кислотой. Это бесцветная жидкость с резким запахом. В концентрированной кислоте массовая доля HCl составляет около 37 %.
Соляная кислота является сильной одноосновной кислотой, в разбавленном растворе полностью диссоциирует на ионы:
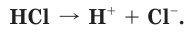
Соляная кислота проявляет характерные для кислот свойства. Она изменяет окраску индикаторов: лакмус и метилоранж в растворе HCl становятся красными. Соляная кислота взаимодействует с теми металлами, которые в ряду активности металлов расположены до водорода:
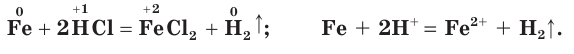
В этих реакциях ионы водорода выступают в качестве окислителя. Соляная кислота взаимодействует с основными оксидами:
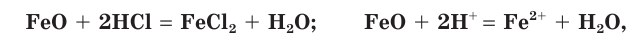
со щелочами и нерастворимыми основаниями:
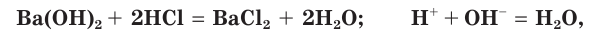
а также с солями:
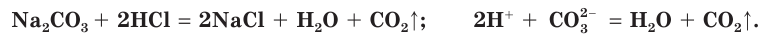
Реакции с солями идут только тогда, когда образуются осадок, газ или слабый электролит.
В организме человека соляная кислота вырабатывается клетками слизистой оболочки желудка и входит в состав желудочного сока. Массовая доля HCl в желудочном соке человека равна 0,3 % — 0,5 %. Соляная кислота в составе желудочного сока улучшает пищеварение, уничтожает большинство бактерий, которые попадают с пищей в желудок, что замедляет или даже останавливает гнилостный процесс. Желудок здорового человека вырабатывает до 2,5 дм3 желудочного сока в сутки. Желудочный сок начинает выделяться уже тогда, когда вы начинаете пережевывать пищу. Поэтому жевать жевательную резинку на голодный желудок вредно: в отсутствии пищи соляная кислота разрушительно действует на стенки желудка.
Продуктом взаимодействия хлора с водородом является хлороводород — бесцветный газ с резким запахом, тяжелее воздуха.
Раствор хлороводорода в воде представляет собой кислоту, которая называется хлороводородной или соляной.
Соляная кислота проявляет все типичные свойства кислот: взаимодействует с основаниями, основными оксидами, солями и металлами, стоящими в ряду активности до водорода.
Хлориды
Соли соляной кислоты называются хлоридами. Большинство хлоридов растворимы в воде. Так, например, большая часть растворенных в морской воде солей приходится на хлорид натрия. Объясняется это тем, что соли вымываются из горных пород и выносятся реками в моря и океаны. Но в засушливых и пустынных районах в результате интенсивного испарения воды концентрация солей в воде сильно повышается, и они выделяются в твердом виде. Так образуются солончаки (рис. 38).

Растворы хлоридов — обязательная составная часть живых организмов. В теле взрослого человека содержится примерно 200 г хлорида натрия, причем, около 45 г растворено в крови. Соль поддерживает нормальную деятельность клеток, из которых состоят все ткани и органы. Взрослому человеку необходимо получать в день примерно 5—6 г хлорида натрия, включая и ту соль, которая входит в состав готовых продуктов. Употребление избыточного количества поваренной соли приводит к ухудшению самочувствия: появлению головной боли, отекам, повышению артериального давления.
К практически нерастворимым хлоридам относится хлорид серебра(I) AgCl. Это свойство хлорида серебра(I) используется для обнаружения хлорид ионов в растворе. При добавлении к соляной кислоте или к раствору хлорида натрия раствора нитрата серебра(I)  выпадает белый творожистый осадок хлорида серебра(I) (рис. 39):
выпадает белый творожистый осадок хлорида серебра(I) (рис. 39):

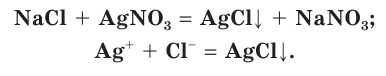
Такая реакция является качественной реакцией на ионы хлора, а нитрат серебра(I) служит реактивом на соляную кислоту и ее соли.
Если содержание хлорид-ионов в растворе невелико, то осадок не выпадает, а наблюдается помутнение раствора. Этой реакцией можно пользоваться для проверки наличия хлоридионов в питьевой воде.
Применение соляной кислоты и хлоридов
Соляная кислота и ее соли относятся к тем веществам, которые постоянно сопровождают человека, являясь неотъемлемой частью его жизни. В больших объемах соляная кислота расходуется в самых разнообразных областях практической деятельности человека: в химической, пищевой
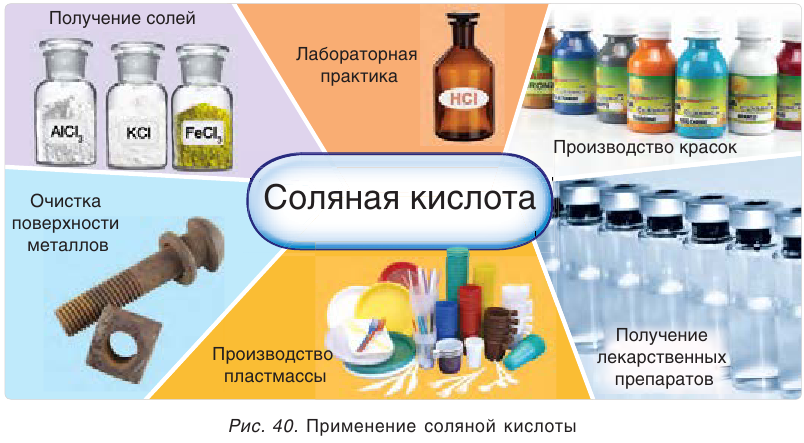
и фармацевтической промышленности, для обработки поверхности металлов и др. Как реагент соляная кислота используется во всех химических лабораториях (рис. 40).
Важнейшими солями соляной кислоты являются хлориды натрия и калия. Поваренная соль NaCl известна как пищевая добавка, которая служит консервантом при подготовке пищевых продуктов к длительному хранению.
Поваренная (каменная) соль издавна ценилась очень высоко. Ею вместо денег платили жалованье римским воинам и крестоносцам. В Китае изготавливали соляные монеты, на которых ставилось клеймо правителя. А в Эфиопии еще в XIX в. были в ходу соляные деньги — стандартные бруски каменной соли (см. рис.).

Хлорид натрия используют для профилактики и лечения простудных заболеваний. Посещение соляных пещер, воздух в которых чрезвычайно богат аэрозолем хлорида натрия, оказывает положительное влияние на состояние дыхательных путей и кожи детей и взрослых (рис. 41). Водный раствор хлорида натрия широко применяется в медицине для приготовления различных лекарственных препаратов.

Хлориды натрия и кальция используют для борьбы с гололедицей, а NaCl — в производстве химических препаратов, стекла и бумаги.
Хлорид калия KCl — ценное минеральное удобрение. Это основной экспортный продукт химической промышленности Беларуси (рис. 42). Хлориды других металлов используются в сельском хозяйстве, химической промышленности, медицине.
- Соли соляной кислоты называются хлоридами.
- Реактивом на соляную кислоту и ее соли служит раствор нитрата серебра(I).
- Соляная кислота и хлориды имеют важное значение для жизнедеятельности живых организмов.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |