
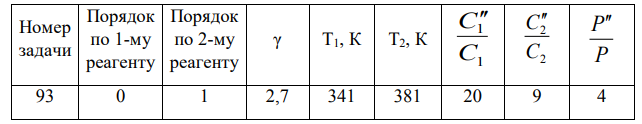
Большинство химических реакций являются обратимыми: одновременно с прямой реакций протекает обратная. В момент выравнивания скоростей прямой и обратной реакций в системе наступает состояние химического равновесия
 |
 |
Химия |
 |
 |
Решение задачи |
 |
 |
|
 |
 |
Выполнен, номер заказа №17022 |
 |
 |
Прошла проверку преподавателем МГУ |
 |
 |
|
Напишите мне в чат, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
|
Закажите у меня новую работу, просто написав мне в чат! |
Для реакции:
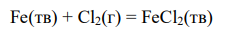
составьте кинетическое уравнение;
составьте выражение для константы равновесия;
вычислите, во сколько раз изменится скорость реакции при заданных изменениях:
16. температуры,
17. общего давления (при изменении объема системы),
18. концентраций реагентов
укажите, как необходимо изменить внешние параметры (температуру, общее давление, концентрации реагентов), чтобы сместить равновесие вправо.
Решение
Химическая реакция может быть охарактеризована скоростью ее протекания. Скорость химической реакции зависит от многих факторов, среди которых:
- природа реагирующих веществ;
- температура;
- концентрация реагирующих веществ;
- присутствие катализаторов.
Зависимость скорости реакции
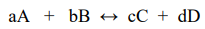
от концентраций реагирующих веществ может быть охарактеризовано кинетическим уравнением:
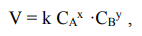
где: V – скорость химической реакции, k- константа скорости химической реакции, CA и CB - концентрации веществ А и В, x и y – порядки реакции по реагентам А и В, соответственно (порядки реакции могут определены исключительно экспериментально).
Для приведенной в условии задачи реакции
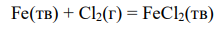
кинетическое уравнение имеет вид:


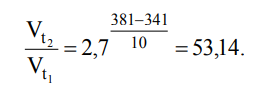
Таким образом, при повышении температуры на 40 0 скорость данной реакции возрастет в 53,14 раз. Большинство химических реакций являются обратимыми: одновременно с прямой реакций протекает обратная. В момент выравнивания скоростей прямой и обратной реакций в системе наступает состояние химического равновесия.
Константа химического равновесия характеризует взаимосвязь равновесных концентраций веществ, участвующих в данной реакции. Для реакции общего вида:

В случае гомогенного равновесия (все вещества находятся в одинаковом фазовом состоянии, реакция происходит в однородной, гомогенной среде) в правую часть данного выражения записывают равновесные концентрации всех участников этого равновесия.
Для гетерогенных равновесий (вещества находятся в разных фазовых cостояниях, реакция протекает в неоднородной, гетерогенной среде)
концентрацию твердых веществ считают практически неизменной и не записывают в правую часть выражения для константы равновесия.
Равновесие, отображенное схемой, приведенной в условии задачи, относится к разряду обратимых, выражение для константы равновесия имеет вид:
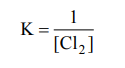
Изменение внешних условий приводит к смещению химического равновесия. Прогнозировать направление смещения равновесия можно с помощью принципа Ле Шателье: если на систему, находящуюся в равновесии, оказывается воздействие извне, то равновесие смещается в сторону той реакции, протекание которой максимально ослабляет внешнее воздействие. Поэтому:
нагревание благоприятствует протеканию эндотермической реакции H>0), а охлаждение, напротив, смещает равновесие в сторону протекание экзотермической реакции (H<0);
повышение общего давления в системе смещает равновесие в сторону реакции с образованием меньшего количества газообразных веществ, а понижение - большего;
добавление в реакционную систему какого-либо компонента ускоряет ту реакцию, где этот компонент расходуется, а отвод - реакцию, в которой это вещество образуется.
Исходя из этого, для смещения равновесия слева направо в рассматриваемой в задаче системе обратимых химических реакций, в которой прямая реакция происходит с выделением тепла (H < 0) и уменьшением (увеличением или уменьшением) количеств газообразных веществ (из 1 моль газов в результате реакции образуется 0 моль газообразных продуктов), НЕОБХОДИМО:
- температуру понизить..................... (повысить или понизить),
- давление повысить.........................(повысить или понизить)
- концентрацию исходных веществ Сl2 (формулы) повысить (повысить или понизить),
- концентрацию продуктов прямой реакции FeCl2 (формулы) понизить (повысить или понизить)

Похожие готовые решения по химии:
- Необходимо произвести вычисления и найти недостающие величины в водных растворах величины под номером 113
- Степени окисления атомов в простых веществах (построенных из атомов одного и того же элемента) принимаются равными нулю
- Электрохимическая схема - это условная запись, в которой представлена информация о аноде и катоде с указанием металлов, состава электролитов, а также особенностях конструкции данного гальванического элемента
- Объясните механизм защиты подземного стального трубопровода с помощью магниевого протектора, если почвенные воды в данной местности имеют ярко выраженный кислотный характер. Приведите электронные уравнения анодного и катодного процессов
- Таким образом, число протонов в ядре численно совпадает с атомным (порядковым) номером элемента в периодической системе Д.И. Менделеева. Число нейтронов можно вычислить по разности между массовым числом и числом протонов
- На основании положения химического элемента № 35 и его электронной формулы составьте прогноз его химических свойств, ответив на следующие вопросы
- Определите тип химической связи (неполярная ковалентная, полярная ковалентная или ионная) в веществах бромид кальция и дибром
- Изменения термодинамических функций H, S, G в ходе химической реакции позволяют судить об особенностях протекания данной реакции и ее природе
- Компания внедряет онлайн-систему отбора. Затраты на внедрение онлайн системы составят Наименование Сумма, руб. Затраты
- Изменения термодинамических функций H, S, G в ходе химической реакции позволяют судить об особенностях протекания данной реакции и ее природе
- Необходимо произвести вычисления и найти недостающие величины в водных растворах величины под номером 113
- В результате организационных мероприятий было снижено количество бракованных изделий на заводе на 0,5%, бракованные изделия реализуются

