
Для химической реакции, 2NO + Cl2 = 2NOCl вычислить тепловой эффект (∆Н0 ), изменение энтропии (∆S0 ), изменение энергии Гиббса (∆G0 ) и константу равновесия
 |
 |
Химия |
 |
 |
Решение задачи |
 |
 |
|
 |
 |
Выполнен, номер заказа №16718 |
 |
 |
Прошла проверку преподавателем МГУ |
 |
 |
|
Напишите мне в чат, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
|
Закажите у меня новую работу, просто написав мне в чат! |
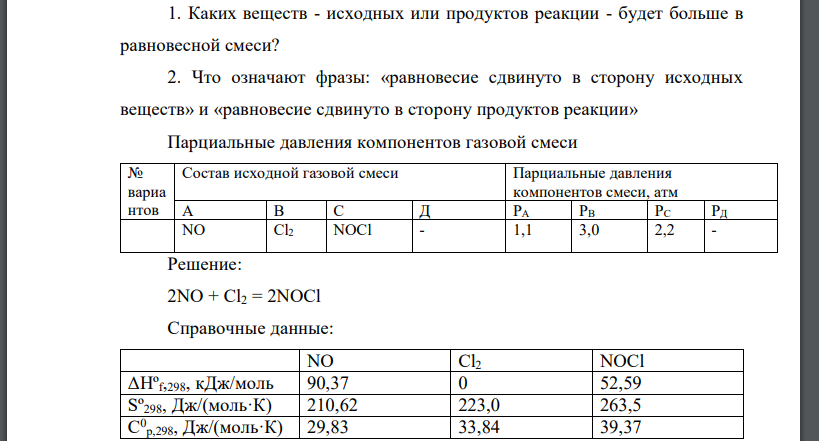
Для химической реакции, 2NO + Cl2 = 2NOCl вычислить тепловой эффект (∆Н0 ), изменение энтропии (∆S0 ), изменение энергии Гиббса (∆G0 ) и константу равновесия (K 0 ) при температуре Т = 398 К. Определить направление химической реакции, протекающей в газовой среде, заданного состава. Парциальные давления компонентов газовой смеси приведены в таблице 4. Проанализировать полученные результаты и ответить на следующие вопросы: 1. Каких веществ - исходных или продуктов реакции - будет больше в равновесной смеси? 2. Что означают фразы: «равновесие сдвинуто в сторону исходных веществ» и «равновесие сдвинуто в сторону продуктов реакции» Парциальные давления компонентов газовой смеси № вариа нтов Состав исходной газовой смеси Парциальные давления компонентов смеси, атм А В С Д РА РВ РС РД NO Cl2 NOCl - 1,1 3,0 2,2 -
Решение:
Справочные данные: По закону Кирхгоффа: Произведем необходимые расчеты: По уравнению Кирхгофа получаем: При повышении температуры на , по сравнению со стандартными условиями, тепловой эффект . Это связано с тем, что сумма теплоемкостей продуктов реакции суммы теплоемкостей исходных веществ, т.е. изменение средней изобарной теплоемкости . Изменение энтропии определяется по формуле После интегрирования, при условии , получаем Вычислим изменение энтропии реакции при Определим изменение энергии Гиббса по формуле . Подставляем значения и получаем По уравнению изотермы определим константу равновесия Выражение для константы равновесия рассматриваемой реакции имеет вид Подставляем значения из условия задачи и вычисляем константу равновесия при :

Похожие готовые решения по химии:
- Для уравнений реакций, приведенных в таблице 3 и считающихся сложными, и уравнений реакций, приведенных в таблице 5 и считающихся простыми, написать
- Приведены значения давлений пара веществ (Р1 и Р2) при температурах (t1, °С и t2, °С). Рассчитать удельную теплоту испарения веществ. Вещество t1,°С t2, °С Р1, кПа
- Смесь состоит из mA (г) компонента А и mВ (г) компонента В и находится при температуре t1 (С) (см. таблицу 9). Определить: а) температуру начала кипения смеси
- По данным, приведенным в таблице 10, для водных растворов слабых электролитов рассчитать величины, указанные в последнем столбце. Вещество А С, моль
- Из навески Н2С2О4∙2Н2О марки «х.ч.» массой 0,5500 г приготовили 100 см3 раствора. На титрование аликвоты 10,00 см3 этого раствора израсходовано 9,17 см3 раствора
- Рассчитайте массовую долю MnO2 в навеске руды массой 0,3710 г, если на титрование йода выделившегося при взаимодействии с раствором, содержащим
- На титрование 25,00 см3 воды израсходовано 7,24 см3 раствора комплексона III с молярной концентрацией 0,0500 моль/дм3 . Вычислите общую жесткость воды. Дано
- Проведите гравиметрический анализ хрома в хлориде хрома (III). Рассчитайте оптимальную массу навески и объем 10% раствора NH4OH (ρ = 0,956 г/см3 ) необходимого
- Дана зависимость составов жидкой (x) и газообразной (у) фаз от температуры (Т) для бинарной жидкой системы А - В при постоянном
- Найти среднее число выехавших на перекресток транспортных средств за время 𝑇, если вероятность выезда хотя бы одного
- При передаче сигнала возможно его искажение. 𝜉 − независимая случайная величина – число искаженных сигналов. Число сигналов
- Используя данные об удельном сопротивлении раствора электролита в воде r:

