
Автор Анна Евкова
Преподаватель который помогает студентам и школьникам в учёбе.
Для реакции: C2Cl4(г) + Cl2(г) = C2Cl6(г) составьте кинетическое уравнение; составьте выражение для константы равновесия
 |
 |
Химия |
 |
 |
Решение задачи |
 |
 |
|
 |
 |
Выполнен, номер заказа №16800 |
 |
 |
Прошла проверку преподавателем МГУ |
 |
 |
|
Напишите мне в чат, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
|
Закажите у меня новую работу, просто написав мне в чат! |
Описание заказа и 38% решения ( + фото):
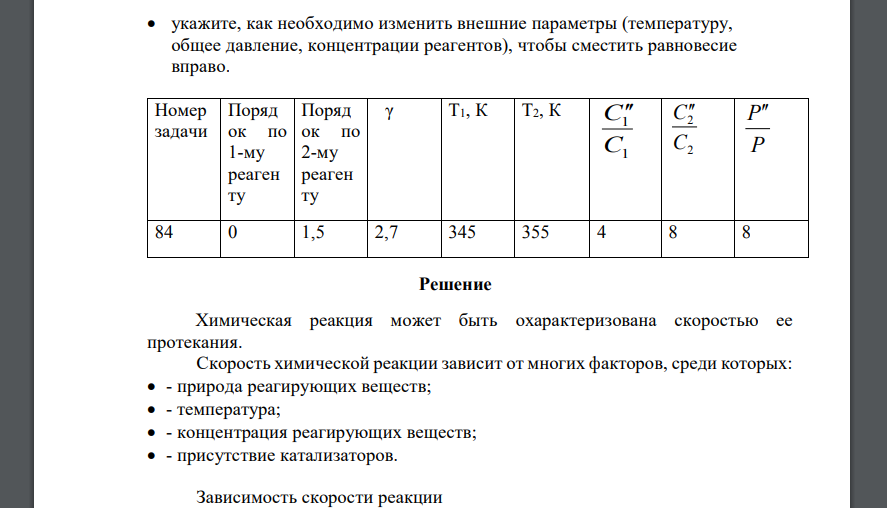
Для реакции: C2Cl4(г) + Cl2(г) = C2Cl6(г) составьте кинетическое уравнение; составьте выражение для константы равновесия; вычислите, во сколько раз изменится скорость реакции при заданных изменениях: 1. температуры, 2. общего давления (при изменении объема системы), 3. концентраций реагентов 245 укажите, как необходимо изменить внешние параметры (температуру, общее давление, концентрации реагентов), чтобы сместить равновесие вправо. Номер задачи Поряд ок по 1-му реаген ту Поряд ок по 2-му реаген ту γ Т1, К Т2, К 1 1 C C 2 2 C C P P 84 0 1,5 2,7 345 355 4 8 8
Решение
Химическая реакция может быть охарактеризована скоростью ее протекания. Скорость химической реакции зависит от многих факторов, среди которых: - природа реагирующих веществ; температура; концентрация реагирующих веществ; присутствие катализаторов. Зависимость скорости реакции от концентраций реагирующих веществ может быть охарактеризовано кинетическим уравнением: скорость химической реакции, k- константа скорости химической реакции, CA и CB - концентрации веществ порядки реакции по реагентам А и В, соответственно (порядки реакции могут определены исключительно экспериментально). Для приведенной в условии задачи реакции (г) кинетическое уравнение имеет вид: При повышении концентрации первого реагента в раза скорость реакции возрастет в не изменяется раз. При повышении концентрации второго реагента в раз скорость реакции возрастет в раз. При повышении давления в раз скорость реакции возрастет в Зависимость скорости реакции от температуры отображается формулой Вант-Гоффа: скорость реакции при температуре скорость реакции при температуре постоянная для данной реакции величина, называемая температурным коэффициентом реакции. Данные, приведенные в условии задачи: Вычисления по формуле Вант-Гоффа дают результат: Таким образом, при повышении температуры на 100 скорость данной реакции возрастет в раз. Большинство химических реакций являются обратимыми: одновременно с прямой реакций протекает обратная. В момент выравнивания скоростей прямой и обратной реакций в системе наступает состояние химического равновесия. Константа химического равновесия характеризует взаимосвязь равновесных концентраций веществ, участвующих в данной реакции. Для реакции общего вида: химические формулы веществ, стехиометрические коэффициенты, выражение для константы химического равновесия выглядит следующим образом: равновесные концентрации соответствующих веществ. В случае гомогенного равновесия (все вещества находятся в одинаковом фазовом состоянии, реакция происходит в однородной, гомогенной среде) в правую часть данного выражения записывают равновесные концентрации всех участников этого равновесия. Для гетерогенных равновесий (вещества находятся в разных фазовых cостояниях, реакция протекает в неоднородной, гетерогенной среде) концентрацию твердых веществ считают практически неизменной и не записывают в правую часть выражения для константы равновесия. Равновесие, отображенное схемой, приведенной в условии задачи, относится к разряду обратимых, выражение для константы равновесия имеет вид: Изменение внешних условий приводит к смещению химического равновесия. Прогнозировать направление смещения равновесия можно с помощью принципа Ле Шателье: если на систему, находящуюся в равновесии, оказывается воздействие извне, то равновесие смещается в сторону той реакции, протекание которой максимально ослабляет внешнее воздействие. Поэтому: нагревание благоприятствует протеканию эндотермической реакции а охлаждение, напротив, смещает равновесие в сторону протекание экзотермической реакции повышение общего давления в системе смещает равновесие в сторону реакции с образованием меньшего количества газообразных веществ, а понижение - большего; добавление в реакционную систему какого-либо компонента ускоряет ту реакцию, где этот компонент расходуется, а отвод - реакцию, в которой это вещество образуется. Исходя из этого, для смещения равновесия слева направо в рассматриваемой в задаче системе обратимых химических реакций, в которой прямая реакция происходит с выделением тепла и уменьшением (увеличением или уменьшением) количеств газообразных веществ (из 2 моль газов в результате реакции образуется 1 моль газообразных продуктов), НЕОБХОДИМО: температуру понизить (повысить или понизить), давление повысить (повысить или понизить)- концентрацию исходных веществ (формулы) повысить (повысить или понизить), концентрацию продуктов прямой реакции (формулы) понизить (повысить или понизить)
Решение
Химическая реакция может быть охарактеризована скоростью ее протекания. Скорость химической реакции зависит от многих факторов, среди которых: - природа реагирующих веществ; температура; концентрация реагирующих веществ; присутствие катализаторов. Зависимость скорости реакции от концентраций реагирующих веществ может быть охарактеризовано кинетическим уравнением: скорость химической реакции, k- константа скорости химической реакции, CA и CB - концентрации веществ порядки реакции по реагентам А и В, соответственно (порядки реакции могут определены исключительно экспериментально). Для приведенной в условии задачи реакции (г) кинетическое уравнение имеет вид: При повышении концентрации первого реагента в раза скорость реакции возрастет в не изменяется раз. При повышении концентрации второго реагента в раз скорость реакции возрастет в раз. При повышении давления в раз скорость реакции возрастет в Зависимость скорости реакции от температуры отображается формулой Вант-Гоффа: скорость реакции при температуре скорость реакции при температуре постоянная для данной реакции величина, называемая температурным коэффициентом реакции. Данные, приведенные в условии задачи: Вычисления по формуле Вант-Гоффа дают результат: Таким образом, при повышении температуры на 100 скорость данной реакции возрастет в раз. Большинство химических реакций являются обратимыми: одновременно с прямой реакций протекает обратная. В момент выравнивания скоростей прямой и обратной реакций в системе наступает состояние химического равновесия. Константа химического равновесия характеризует взаимосвязь равновесных концентраций веществ, участвующих в данной реакции. Для реакции общего вида: химические формулы веществ, стехиометрические коэффициенты, выражение для константы химического равновесия выглядит следующим образом: равновесные концентрации соответствующих веществ. В случае гомогенного равновесия (все вещества находятся в одинаковом фазовом состоянии, реакция происходит в однородной, гомогенной среде) в правую часть данного выражения записывают равновесные концентрации всех участников этого равновесия. Для гетерогенных равновесий (вещества находятся в разных фазовых cостояниях, реакция протекает в неоднородной, гетерогенной среде) концентрацию твердых веществ считают практически неизменной и не записывают в правую часть выражения для константы равновесия. Равновесие, отображенное схемой, приведенной в условии задачи, относится к разряду обратимых, выражение для константы равновесия имеет вид: Изменение внешних условий приводит к смещению химического равновесия. Прогнозировать направление смещения равновесия можно с помощью принципа Ле Шателье: если на систему, находящуюся в равновесии, оказывается воздействие извне, то равновесие смещается в сторону той реакции, протекание которой максимально ослабляет внешнее воздействие. Поэтому: нагревание благоприятствует протеканию эндотермической реакции а охлаждение, напротив, смещает равновесие в сторону протекание экзотермической реакции повышение общего давления в системе смещает равновесие в сторону реакции с образованием меньшего количества газообразных веществ, а понижение - большего; добавление в реакционную систему какого-либо компонента ускоряет ту реакцию, где этот компонент расходуется, а отвод - реакцию, в которой это вещество образуется. Исходя из этого, для смещения равновесия слева направо в рассматриваемой в задаче системе обратимых химических реакций, в которой прямая реакция происходит с выделением тепла и уменьшением (увеличением или уменьшением) количеств газообразных веществ (из 2 моль газов в результате реакции образуется 1 моль газообразных продуктов), НЕОБХОДИМО: температуру понизить (повысить или понизить), давление повысить (повысить или понизить)- концентрацию исходных веществ (формулы) повысить (повысить или понизить), концентрацию продуктов прямой реакции (формулы) понизить (повысить или понизить)


Похожие готовые решения по химии:
- Пpоизведите необходимые вычисления и найдите недостающие величины, обозначенные знаком "?" в стpоке табл.6, соответствующей номеpу Вашей
- Для реакций: 251 1) NaAsO2 + I2 + Na2CO3+ H2O → NaH2AsO4 + NaI + CO2 2) Cu(NO3)2 → CuO + NO2 + O2 Составьте уравнения методом электронного баланса
- Составьте схему гальванического элемента, напишите электронные уравнения электродных процессов и суммарное уравнение соответствующей
- Как протекает электрохимическая коррозия в .......................... среде при контакте металлов ......... и .......... ? Какой из металлов разрушается
- Определите символы элементов и найдите величины, помеченные знаком
- На основании положения химического элемента № 49 и его электронной формулы составьте прогноз его химических свойств
- Определите тип химической связи (неполярная ковалентная, полярная ковалентная или ионная) в веществах хлорид калия и трихлорид фосфора
- Вычислите стандартные величины H 0 298, S 0 298 и G 0 298 для реакции: C2Cl4(г) + Cl2(г) = C2Cl6(г) Объясните знак изменения энтальпии и энтропии
- Построить кривые титрования и подобрать индикаторы: а) 0,2Н HСl 0,2H раствором NaOH; п) 0,1М Н3РО4 0,1 раствором NаОН.
- Длинный сплошной алюминиевый цилиндр радиуса вращают вокруг его оси в однородном магнитном поле с индукцией
- Поле образовано точечным диполем с электрическим моментом р = 200 пКлּ м. Определить разность потенциалов U двух точек поля
- Расстояние между двумя точечными зарядами равно 5 см. Найти напряженность и потенциал поля в точке, находящейся на расстоянии

