
Электроотрицательность (EN) характеризует способность атомов элементов к смещению электронной плотности. В периоде системы элементов Д. И. Менделеева она возрастает слева направо, в подгруппе убывает сверху вниз (для s- и p-элементов
 |
 |
Химия |
 |
 |
Решение задачи |
 |
 |
|
 |
 |
Выполнен, номер заказа №17022 |
 |
 |
Прошла проверку преподавателем МГУ |
 |
 |
|
Напишите мне в чат, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
|
Закажите у меня новую работу, просто написав мне в чат! |
Электроотрицательность (EN) характеризует способность атомов элементов к смещению электронной плотности. В периоде системы элементов Д. И. Менделеева она возрастает слева направо, в подгруппе убывает сверху вниз (для s- и p-элементов). Тип химической связи (неполярная ковалентная, полярная ковалентная или ионная), образующейся в результате взаимодействия атомов А и В, можно установить по величине разности электроотрицательностей EN этих атомов:
- если она равна (или близка к) нулю, то электронная плотность распределена симметрично между атомами, химическая связь является неполярной ковалентной; такая связь наиболее характерна для молекул, образованных атомами одного и того же элемента.
- если она не равна нулю, но невелика (взаимодействуют атомы элементов-неметаллов), химическая связь относится к типу полярной ковалентной; при этом электронная плотность смещается от менее электроотрицательного атома А (положительный полюс А + ) к более электроотрицательному В (отрицательный полюс В - ).
- если она крайне велика (во взаимодействие вступают атом элемента А-типичного металла и атом элемента В-типичного неметалла), происходит передача электронов от менее электроотрицательного атома (он превращается в положительно заряженный ион А m+) к более электроотрицательному атому ( он превращается в отрицательно заряженный ион В n- ).
Процесс передачи электронов можно отобразить с помощью уравнений:
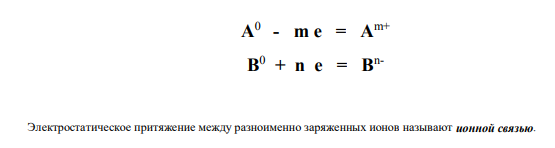
Для рассматриваемых в задаче веществ:
7.) разность электроотрицательностей атомов элементов цезия Cs и брома Br крайне различна, т.к. один из них металл, а второй неметалл,
8.) разность электроотрицательностей атомов элементов фосфора Р и брома Br различна, т.к. один из них неметалл, а второй также неметалл, поэтому типы химической связи: в этих веществах:
7.) ионаая
8.) ковалентная полярная.
В случае ионной связи (вещество CsBr) уравнения переходов нейтральных атомов в ионы:
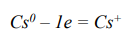
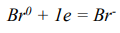
В случае ковалентной связи необходимо представить электронную схему молекулы (теория Льюиса) и схему перекрывания электронных орбиталей (метод ВС). Согласно простейшим представлениям о механизме образования ковалентной связи (теория Льюиса), атомы обобщают свои валентные электроны, достраивая свою электронную оболочку до октета (8 электронов) – конфигурации благородных газов. Исключение составляет атом водорода, способный достроить свою электронную оболочку лишь до двух электронов (электронная конфигурация атома гелия). Электронная схема молекулы показывает, сколько электронов обобщают атомы, при этом электрон изображается точкой. Число общих электронных пар между двумя атомами определяет кратность ковалентной связи: одна пара - одинарная, две пары - двойная, три пары - тройная.
Для построения электронной схемы необходимо:
10. определить общее число валентных электронов каждого атома по номеру группы в периодической системе Д.И. Менделеева,
11. выяснить, сколько электронов не достает каждому из них до октета,
12. построить схему обобщения, изображая электроны в виде точек
Электронная схема молекулы PBr3, в состав которой входит атом элемента P (VA группа периодической системы Д.И. Менделеева), имеющий 5 валентных электронов, и атом элемента Br, представителя группы VIIA, имеющий 7 валентных электронов, выглядит следующим образом:
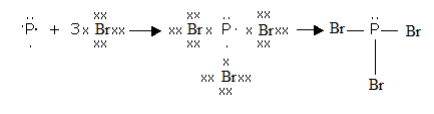
Поскольку в результате обобщения электронов между каждой парой атомов образовалось 1 общих электронных пар, то кратность данной ковалентной связи в молекуле PBr3 равна 1.
Одна из квантово-механических интерпретаций механизма образования ковалентной связи - метод ВС - предусматривает изображение схемы перекрывания орбиталей, соответствующих одиночным (неспаренным) валентным электронам каждого из атомов.
Для построения данной схемы необходимо: - составить электронные формулы атомов, образующих данную молекулу: - выбрать валентные электроны (электроны внешнего, последнего энергетического уровня, а также предпоследнего d-подуровня, если он застроен неполностью):
- распределить эти электроны по квантовым ячейкам (таким образом, чтобы наибольшее число ячеек было занято электронами), символизируя электрон со значением спинового квантового числа стрелкой, направленной вверх а электрон с ms = -1/2 стрелкой, направленной вниз .
- найти одиночные (неспаренные) валентные электроны и определить орбитали, которые им соответствуют; - нарисовать схему перекрывания орбиталей. Если неспаренные валентные электроны атома занимают разные подуровни, то в образовании ковалентной связи участвуют не «чистые» s- и pорбитали, а их гибриды.
Гибридные орбитали образуются в результате геометрического сложения обычных орбиталей (сферической s–орбитали и симметричной гантелеобразной р-орбитали) и представляют собой усредненные по форме орбитали (несимметричная гантелеобразная орбиталь, одна из лопастей которой увеличена по сравнению с исходной, а другая уменьшена по сравнению с исходной).
Число гибридных орбиталей равно числу исходных s– и р-орбиталей. Тип гибрида (sp, sp2 , sp3 ) указывает число и вид исходных орбиталей. Взаимное расположение гибридных орбиталей в пространстве должно обеспечивать максимальную симметрию:
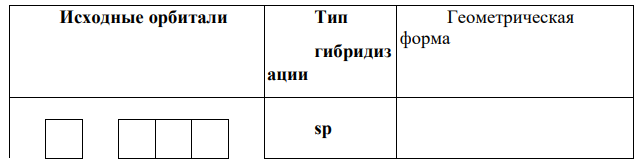
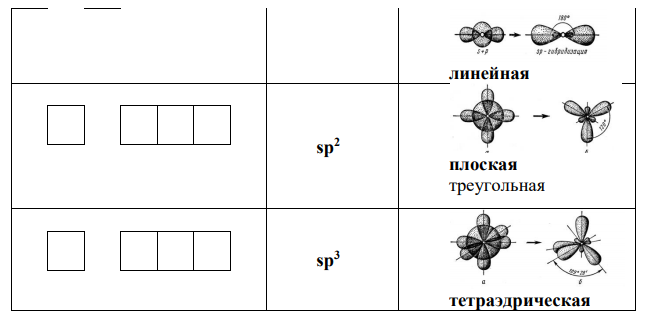
-схема перекрывания орбиталей для молекулы PBr3.:
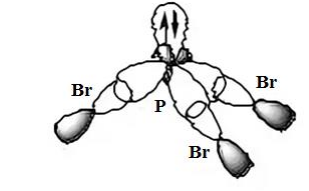
геометрическая форма молекулы: пирамида.

Похожие готовые решения по химии:
- Атомы элементов P в первой реакции и O во второй реакции (а также и вещества, в состав которых они входят PH3 в первой реакции и KClO3 во второй реакции) являются восстановителями (отдают электроны) и участвуют в процессе окисления (процессе отдачи электронов
- Катодный процесс заключается в восстановлении катионов, входящих в состав соли – электролита катода
- В чем различия в коррозии оцинкованного и луженого железа при нарушении целостности покрытий во влажной атмосфере? Приведите электронные уравнения анодного и катодного процессов в обоих случаях. Укажите продукты коррозии
- Как будет происходить электролиз водного раствора электролита NaCl (t = 25 мин, I = 8 А)? Приведите уравнение диссоциации электролита и поясните возможность участия каждого из образующихся ионов в электродных реакциях
- В случае ковалентной (полярной или неполярной) связи постройте электронные схемы молекул (теория Льюиса) и определите кратность связи, постройте схемы перекрывания электронных орбиталей (метод ВС) и определите геометрическую форму молекулы
- Химическая реакция может быть охарактеризована скоростью ее протекания. Скорость химической реакции зависит от многих факторов, среди которых
- Как будет происходить электролиз водного раствора электролита Hg(NO3)2 (t = 1 ч 35 мин, I = 15 А)? Приведите уравнение диссоциации электролита и поясните возможность участия каждого из образующихся ионов в электродных реакциях
- Укажите соответствие между положением элемента в периодической системе Д.И. Менделеева и его электронной формулой (номером внешнего энергетического уровня, общим числом валентных электронов, характером их распределения по энергетическим подуровням
- Укажите соответствие между положением элемента в периодической системе Д.И. Менделеева и его электронной формулой (номером внешнего энергетического уровня, общим числом валентных электронов, характером их распределения по энергетическим подуровням
- Как будет происходить электролиз водного раствора электролита Hg(NO3)2 (t = 1 ч 35 мин, I = 15 А)? Приведите уравнение диссоциации электролита и поясните возможность участия каждого из образующихся ионов в электродных реакциях
- Катодный процесс заключается в восстановлении катионов, входящих в состав соли – электролита катода
- Атомы элементов P в первой реакции и O во второй реакции (а также и вещества, в состав которых они входят PH3 в первой реакции и KClO3 во второй реакции) являются восстановителями (отдают электроны) и участвуют в процессе окисления (процессе отдачи электронов

