
При температуре T давление пара растворителя над раствором концентрации g, % (мас.) неизвестного нелетучего вещества в жидком растворителе равно p, Па (плотность
 |
 |
Химия |
 |
 |
Решение задачи |
 |
 |
|
 |
 |
Выполнен, номер заказа №16718 |
 |
 |
Прошла проверку преподавателем МГУ |
 |
 |
|
Напишите мне в чат, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
|
Закажите у меня новую работу, просто написав мне в чат! |
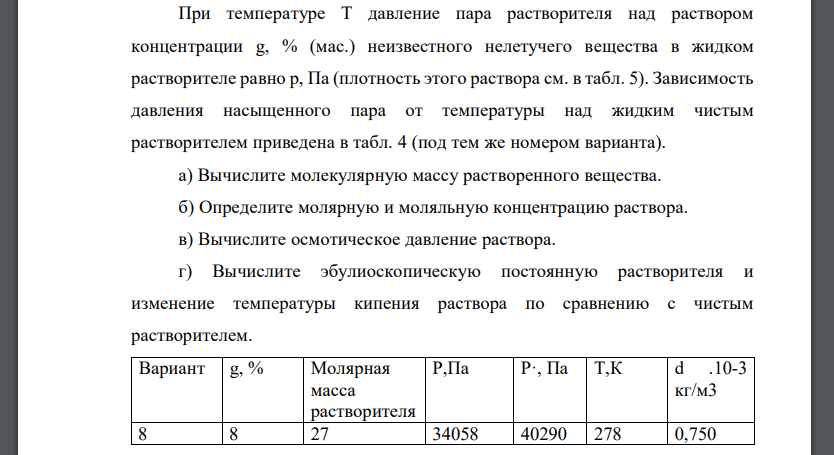
При температуре T давление пара растворителя над раствором концентрации g, % (мас.) неизвестного нелетучего вещества в жидком растворителе равно p, Па (плотность этого раствора см. в табл. 5). Зависимость давления насыщенного пара от температуры над жидким чистым растворителем приведена в табл. 4 (под тем же номером варианта). а) Вычислите молекулярную массу растворенного вещества. б) Определите молярную и моляльную концентрацию раствора. в) Вычислите осмотическое давление раствора. г) Вычислите эбулиоскопическую постоянную растворителя и изменение температуры кипения раствора по сравнению с чистым растворителем. Вариант g, % Молярная масса растворителя Р,Па Р·, Па Т,К d .10-3 кг/м3 8 8 27 34058 40290 278 0,750
Ответ:
Будем считать, что масса раствора равна г, тогда масса растворенного нелетучего вещества равна . Масса растворителя равна . Мольная доля растворителя равна Мольная доля растворенного вещества равна Химическое количество растворителя равно моль Для определения химического количества растворенного вещества составим пропорцию: Молярная масса вещества равна Молекулярная масса численно равна молярной массе Вычислим молярную концентрацию раствора: Определим моляльную концентрацию: . Осмотическое давление раствора равно Получаем график зависимости давления от температуры для чистого растворителя: 5. По графику определяем, что при давлении пара над чистым растворителем температура будет равна. Повышение температуры кипения при Рассчитаем эбулиоскопическую константу:

Похожие готовые решения по химии:
- Рассмотреть фазовую диаграмму, приведенную на рисунке. Номера рисунков даны в табл. 6. а) Рассмотрите фазовый состав полей. Дайте характеристику линий
- Рассчитайте растворимость соли А в воде и ее произведение растворимости по значениям удельного сопротивления насыщенного раствора малорастворимой соли
- По данным, приведенным в табл. 3 (даны номера вариантов), составьте: а) гальванический элемент, состоящий из двух окислительновосстановительных электродов
- Считая порядок данной реакции равным молекулярности, найдите константу скорости данной реакции, протекающей при заданной температуре T, пользуясь данными
- При 212°С и давлении 1,013·105 Па константа равновесия реакции PCl5 = PCl3 + Cl2 равна 2,55·105 Па. Рассчитайте степень диссоциации PCl5, константу равновесия Kc и общее
- Константа равновесия реакции 2NO + O2 = 2NO2 при 2673 К и давлении 1,013·105 Па равна 0,0035 Па–1 . Какой выход NO получится при этой температуре из смеси
- Зависимость константы равновесия реакции (табл. 3) от температуры выражается уравнением типа lgK = a/T + b·lgT + c·T + d а) определите численное значение
- По зависимости давления насыщенного пара от температуры: а) постройте график зависимости ln p от 1/T; б) рассчитайте среднюю теплоту испарения; в) определите
- Качественный химический анализ соединения. Соединение: оксалат калия. 6.1. Качественный анализ катиона (назвать группу и групповой реагент
- По зависимости давления насыщенного пара от температуры: а) постройте график зависимости ln p от 1/T; б) рассчитайте среднюю теплоту испарения; в) определите
- Образуется ли осадок гидроксида меди (II) при смешивании 0,1 моль/дм3 раствора сульфата тетраамминмеди (II) с равным объемом
- Рассчитать ионную силу раствора, полученного при смешивании равных объемов 0,5 моль/дм3 растворов хлорида свинца

