
Альдегиды в химии - свойства, формула, получение, номенклатура и определение с примерами
Содержание:
Альдегиды:
Органические соединения, в молекулах которых имеется карбонильная группа 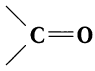
Карбонильные соединения делятся на две большие группы — альдегиды и кетоны. Со строением и свойствами альдегидов вы познакомитесь в данном параграфе.
Альдегидами называют органические соединения, в которых карбонильная группа 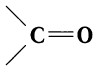
Для альдегидов группа атомов  является функциональной и называется альдегидной; сокращенно она записывается —СНО.
является функциональной и называется альдегидной; сокращенно она записывается —СНО.
Простейшим представителем альдегидов является метаналь
(формальдегид, или муравьиный альдегид)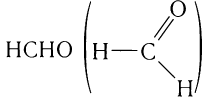 .
.
Это единственный альдегид, в молекуле которого карбонильная группа соединена с двумя атомами водорода.
В зависимости от строения углеводородного заместителя различают альдегиды:
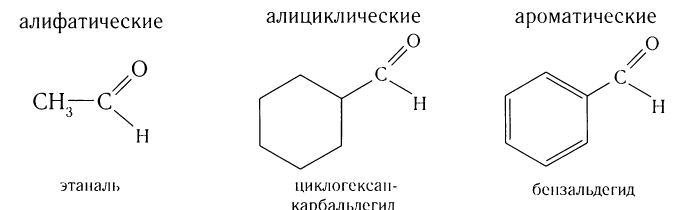
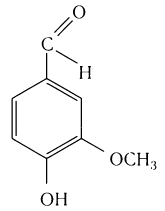
Многие альдегиды и их производные встречаются в живой природе. Например, в миндале обнаружены бензальдегид и его производные:
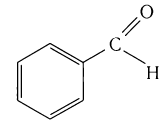
в корице — З-фенилпропеналь (коричный альдегид):
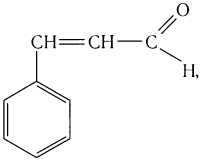
в стручках ванили — пахучее вещество ванилин:
В данном курсе химии вы познакомитесь с алифатическими альдегидами, производными алканов (насыщенных углеводородов).
Общая формула, отражающая химическое строение алифатических насыщенных альдегидов, 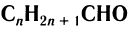 или
или 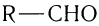 , где
, где 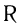 — алкильная группа.
— алкильная группа.
Общая формула насыщенных альдегидов
Общая формула насыщенных альдегидов 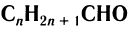 .
.
Общая формула, отражающая молекулярный состав насыщенных альдегидов, 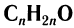 .
.
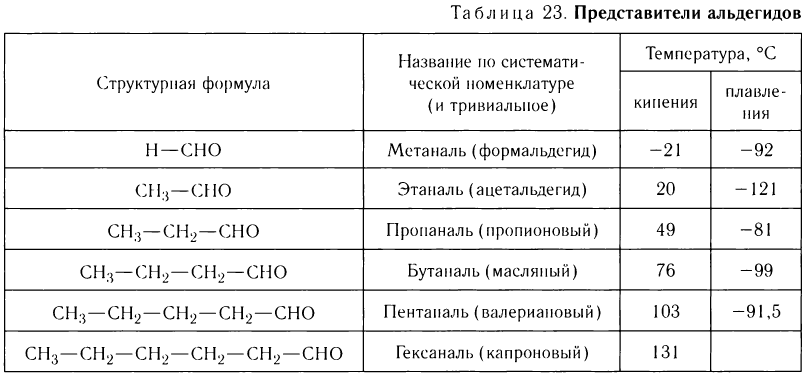
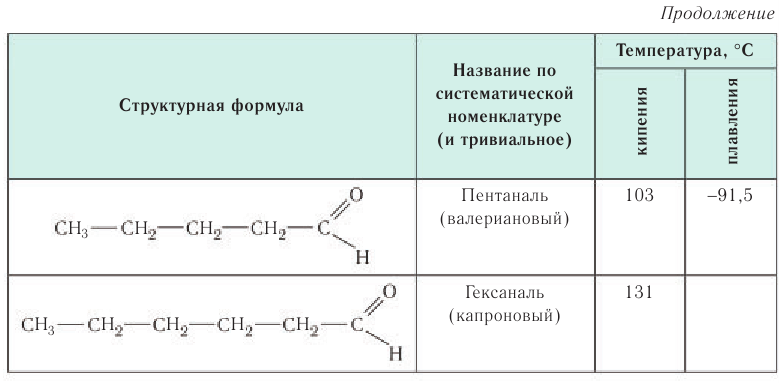
В таблице 23 приведены названия, сокращенные структурные формулы и некоторые физические свойства нескольких представителей насыщенных альдегидов.
Рассмотрим электронное строение карбонильной группы (рис. 51).
В карбонильной группе связь между атомами углерода и кислорода двойная. Атом углерода образует три 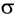 -связи, которые располагаются в одной плоскости под углом 120° друг к другу,
-связи, которые располагаются в одной плоскости под углом 120° друг к другу, 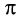 -связь С — О образована при перекрывании 2р-орбиталей атомов углерода и кислорода. Двойная связь С = О является сочетанием одной
-связь С — О образована при перекрывании 2р-орбиталей атомов углерода и кислорода. Двойная связь С = О является сочетанием одной 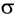 - и одной
- и одной 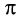 -связей. В силу высокой электроотрицательности атома кислорода электронная плотность двойной связи смещена в сторону атома кислорода(см. рис. 51). Атом кислорода приобретает частичный отрицательный заряд, а атом углерода — частичный положительный заряд:
-связей. В силу высокой электроотрицательности атома кислорода электронная плотность двойной связи смещена в сторону атома кислорода(см. рис. 51). Атом кислорода приобретает частичный отрицательный заряд, а атом углерода — частичный положительный заряд:
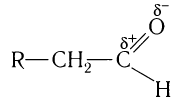
Связь С = О полярна.
Связь С = О короче и ее анергия больше, чем связи С = С.
Длина связи С = С - 0,134 нм, а С = 0 — 0,121 нм, энергия связи С = С - 620 кДж/моль, а С = 0 — 710 кДж/моль.
Полярность связи С = О сказывается на физических и химических свойствах альдегидов, которые являются высоко реакционноспособными веществами.
Номенклатура альдегидов
По правилам номенклатуры ИЮПАК названия альдегидов образуются от названий соответствующих алканов с добавлением суффикса -аль, например НСНО — метаналь, СН3СНО — этаналь.
При названии альдегидов с разветвленной углеродной цепью нумерация главной цепи начинается с атома углерода альдегидной группы.
Например:
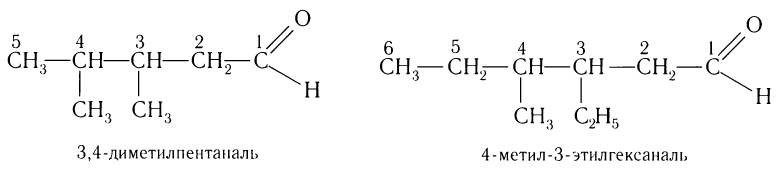
Для альдегидов сохраняются и тривиальные названия, например: НСНО — формальдегид, или муравьиный альдегид, СН3СНО — уксусный альдегид, СН3СН2СНО — пропионовый альдегид и т. д.
Изомерия альдегидов
Изомерия альдегидов обусловлена изомерией углеродной цепи.
Первые три члена гомологического ряда альдегидов — метаналь, этаналь, пропаналь — изомеров не имеют.
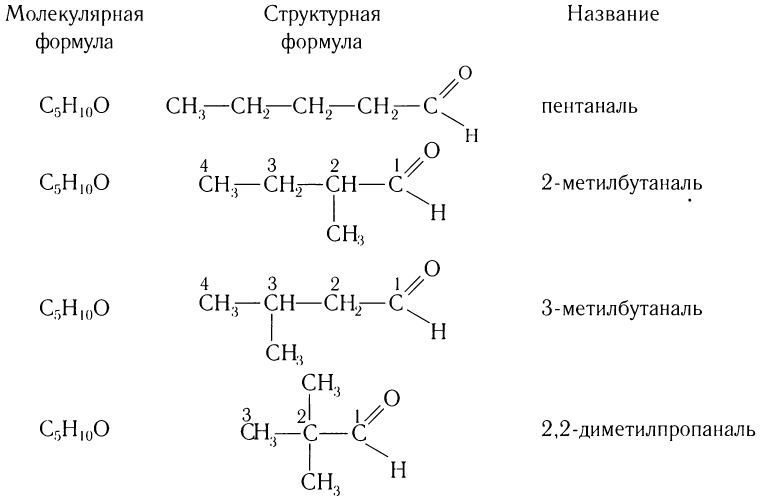
Число изомеров у альдегидов с увеличением числа углеродных атомов в молекуле сильно возрастает. Например, для альдегидов состава С5Н10О существует четыре изомера альдегида (без учета стереоизомеров).
Составу С6Н12О соответствует семь изомерных альдегидов (без учета пространственных изомеров) и т. д.
Физические свойства альдегидов
В обычных условиях метаналь (формальдегид, или муравьиный альдегид) находится в газообразном состоянии, имеет резкий неприятный запах, ядовит. Остальные альдегиды — жидкости или твердые вещества. Низшие альдегиды имеют резкий неприятный запах, а высшие альдегиды обладают цветочными запахами и широко применяются в парфюмерии.
Имеется характерный запах также у некоторых ароматических альдегидов и альдегидов ненасыщенного ряда. Например: фенилуксусный альдегид С6Н5СН2СНО имеет запах гиацинтов и потому его называют гиацинтовым.
Ознакомиться с характерными запахами некоторых альдегидов можно в домашних условиях. При выпечке широко используется ванилин, получающийся синтетически. Многим чистящим средствам, использующимся в домашнем хозяйстве, запах лимона придает синтетический альдегид строения
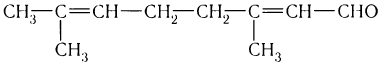 ,
,
Температуры кипения альдегидов более низкие, чем соответствующих спиртов. Это объясняется тем, что в альдегидах в отличие от спиртов отсутствуют межмолекулярные водородные связи.
Простейшие альдегиды легко растворяются в воде. Например, растворимость уксусного альдегида в воде неограниченная, формальдегида — хорошая (раствор альдегида с массовой долей 40 % называют формалином), растворимость пропионового альдегида:
44 г на 100 см3 (25 °С).
Органические соединения, в которых карбонильная группа связана с одним атомом водорода и одним углеводородным заместителем, называют альдегидами.
Общая формула насыщенных алифатических альдегидов 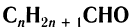 .
.
Структурная изомерия альдегидов обусловлена изомерией углеродной цепи.
Химические свойства альдегидов
Рассмотрим важнейшие химические свойства насыщенных алифатических альдегидов.
Реакции присоединения
По месту двойной связи С = О у альдегидов могут проходить реакции присоединения.
Альдегиды способны присоединять водород по связи С = О на никелевом или платиновом катализаторе с образованием первичных спиртов:
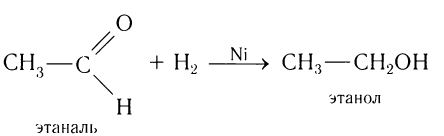
Гидрирование альдегидов относят к реакции восстановления. В промышленности реакцию гидрирования альдегидов используют для получения первичных спиртов.
В качестве эффективных восстановителей альдегидов используется алюмогидрид лития. В этих реакция он является источником гидридных анионов:
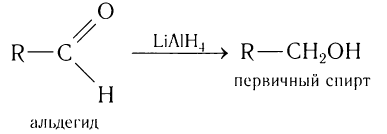
Реакция окисления
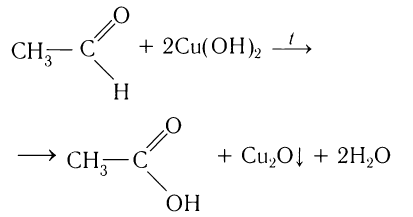
Альдегиды легко окисляются (значительно легче, чем спирты) в соответствующие карбоно-вые кислоты. Их можно окислить даже такими мягкими окислителями, как оксид серебра(І) и гидроксид меди(ІІ).
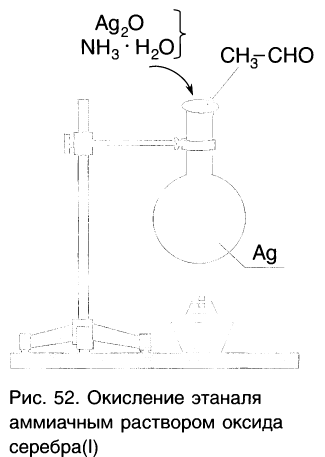
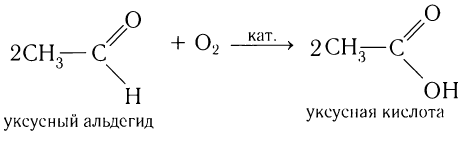
Так, если к аммиачному раствору оксида серебра(І) прилить раствор уксусного альдегида и смесь нагрет то происходит окисление альдегида с образованием уксусной кислоты. Внутренняя поверхность колбы, в которой нагревается смесь, покрывается при этом тонким слоем серебра (рис. 52).
Эту реакцию называют реакцией серебряного зеркала. Она является одной из качественных реакций для обнаружения альдегидной группы:
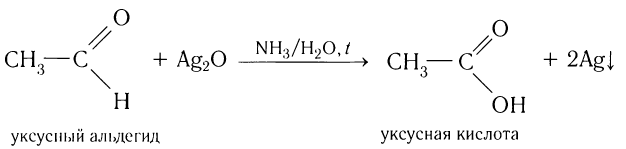
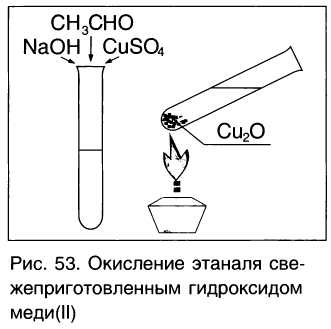
Другая качественная реакция на альдегиды — реакция со свежеприготовленным гидроксидом меди(ІІ). При окислении гидроксид меди(ІІ), имеющий светло - голубой цвет, восстанавливается в гидроксид меди(І) желтого цвета, который при нагревании превращается в оксид меди(І) красного цвета (рис. 53):
Окислить альдегиды в соответствующие кислоты можно также такими окислителями, как 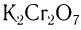 ,
, 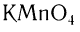 , или кислородом воздуха в присутствии катализатора:
, или кислородом воздуха в присутствии катализатора:
Высокая реакционная способность альдегидов обусловлена строением карбонильной группы.
Для альдегидов характерны реакции присоединения по месту двойной связи С=О и окисления по месту связи С — Н в альдегидной группе.
Получение альдегидов. Применение альдегидов и их производных
Получение:
Многие альдегиды и их производные используются в различных областях производства органических соединений.
Природными источниками для их промышленного получения являются углеводороды крекинга нефти, галогенпроизводные, спирты.
Рассмотрим лабораторные, а затем промышленные способы получения альдегидов.
Лабораторные способы:
1.Окисление первичных спиртов оксидом металла (СuО) или подкисленным раствором бихромата калия:
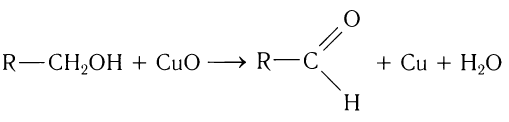
2. Гидратация ацетилена в условиях реакции Кучерова в присутствии солей двухвалентной ртути идет с образованием ацетальдегида:
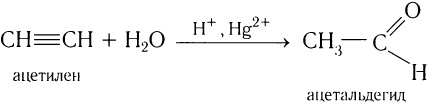
Промышленные способы:
1.Окисление алкенов в присутствии солей палладия:
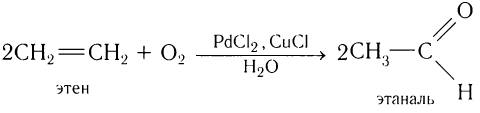
Этот метод является одним из современных промышленных методов и относится к экологически чистым.
2.Окисление спиртов. Спирты могут быть превращены в карбонильные соединения в результате окислительных процессов. При окислении первичных спиртов образуются альдегиды:
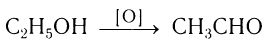
Метаналь (формальдегид) в промышленности получают окислением метанола кислородом воздуха в присутствии катализаторов (медь или серебро):
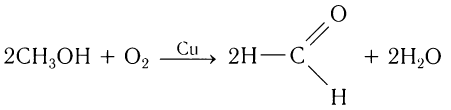
Получение альдегидов дегидрированием спиртов широко используется в современной промышленности. Само название класса органических соединений «альдегиды» возникло именно благодаря этому способу их получения (лат. alcohol dehydrogenates — спирт дегидрированный).
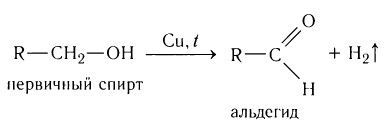
При пропускании паров спирта над катализатором при высоких температурах происходит дегидрирование первичных спиртов в альдегиды:
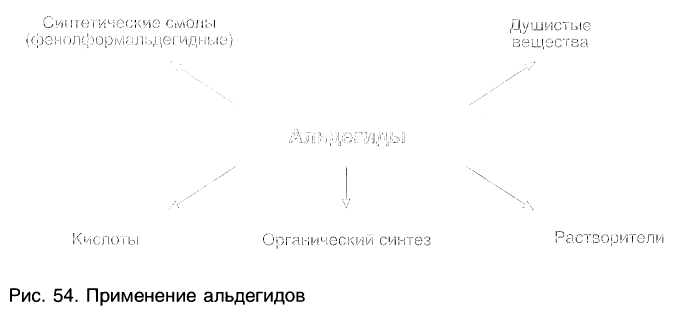
Применение альдегидов и их производных:
Альдегиды находят применение в различных областях промышленности. Формальдегид используется в качестве исходного сырья для получения фенолформальдегидных пластмасс, синтетического каучука и лекарственных средств.
А. М. Бутлеров н 1860 г. впервые синтезировал из формальдегида и аммиака органическое вещество гексаметилентетрамин, или уротропин, которое используется в медицине.
Ацетальдегид применяют для производства уксусной кислоты и уксусного ангидрида, этилацетата, хлораля.
Бензальдегид С6Н5СНО в природе встречается в связанном виде в листьях лавровишен, косточках персиков, абрикосов, слив, в горьком миндале. Он используется для получения душистых и лекарственных веществ, некоторых красителей.
Пропеналь СН2 = СН — СНО применяют для получения пластмасс, отличающихся боль-шой твердостью, глицерина, акриловой кислоты, лекарственных средств.
На рисунке 54 показаны области использования альдегидов.
Существуют лабораторные и промышленные способы получения альдегидов. К основным промышленным способам относят: окисление алкенов, спиртов, дегидрирование спиртов.
Альдегиды
Агьдегиды и карбоновые кислоты относятся к карбонильным соединениям (рис. 56). Карбонильными называют вещества, в состав которых входит карбонильная (или оксо-) группа 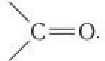 К карбонильным соединениям, кроме альдегидов и карбоновых кислот, относят кетоны.
К карбонильным соединениям, кроме альдегидов и карбоновых кислот, относят кетоны.
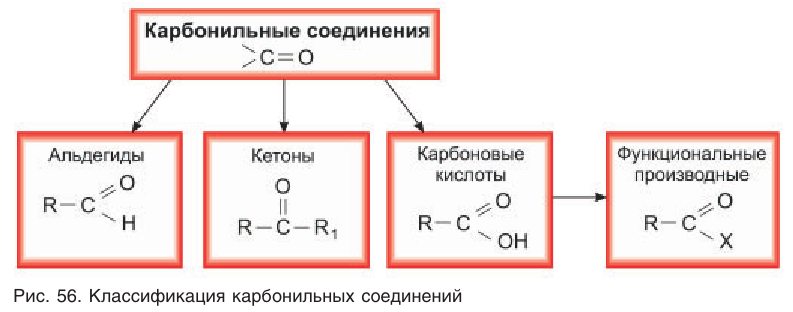
В молекулах альдегидов карбонильная группа связана с одним атомом водорода и одним углеводородным заместителем (R), а в кетонах — с двумя углеводородными заместителями ( ). В молекулах карбоновых кислот карбонильная группа входит в состав карбоксильной группы, состоящей из связанных между собой карбонильной и гидроксильной групп.
). В молекулах карбоновых кислот карбонильная группа входит в состав карбоксильной группы, состоящей из связанных между собой карбонильной и гидроксильной групп.
Карбонильные соединения в школьном курсе химии изучаются на примере альдегидов и карбоновых кислот. Рассматриваются также строение и свойства сложных эфиров — функциональных производных карбоновых кислот.
Строение: Альдегидами называют производные углеводородов, в молекулах которых атом водорода замещен на группу 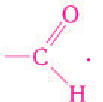
Карбонильную группу 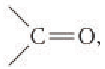 связанную с атомом водорода, называют альдегидной:
связанную с атомом водорода, называют альдегидной: 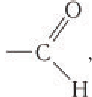 для альдегидов она является функциональной группой. Сокращенно альдегидная группа записывается
для альдегидов она является функциональной группой. Сокращенно альдегидная группа записывается 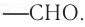 Общая формула альдегидов
Общая формула альдегидов 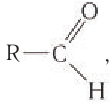 где R — углеводородный заместитель или атом водорода.
где R — углеводородный заместитель или атом водорода.
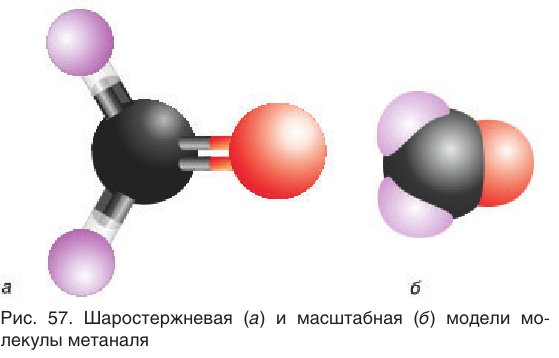
В молекуле простейшего альдегида метаналя 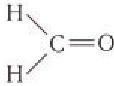 карбонильная группа связана с двумя атомами водорода. Шаростержневая и масштабная модели молекулы метаналя приведены на рисунке 57.
карбонильная группа связана с двумя атомами водорода. Шаростержневая и масштабная модели молекулы метаналя приведены на рисунке 57.
В зависимости от строения углеводородного заместителя, связанного с альдегидной группой, различают насыщенные, ненасыщенные, ароматические альдегиды и др. В данном курсе вы будете изучать строение и свойства альдегидов — производных насыщенных углеводородов (алканов).
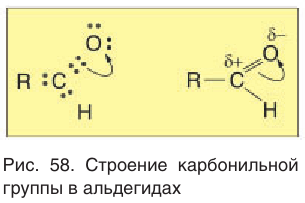
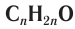 — общая формула, отражающая молекулярный состав альдегидов. Рассмотрим электронное строение карбонильной группы (рис. 58). В карбонильной группе между атомами углерода и кислорода две химические связи:
— общая формула, отражающая молекулярный состав альдегидов. Рассмотрим электронное строение карбонильной группы (рис. 58). В карбонильной группе между атомами углерода и кислорода две химические связи: 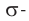 и
и 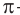 -связь. Атом углерода карбонильной группы в альдегидах образует три
-связь. Атом углерода карбонильной группы в альдегидах образует три 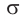 -связи, расположенные в одной плоскости под углом примерно 120° друг к другу. Вследствие большей электроотрицательности атома кислорода по сравнению с углеродным атомом связь
-связи, расположенные в одной плоскости под углом примерно 120° друг к другу. Вследствие большей электроотрицательности атома кислорода по сравнению с углеродным атомом связь  сильно поляризована за счет смещения электронной плотности л-связи к кислороду. При этом на атоме кислорода образуется избыток (
сильно поляризована за счет смещения электронной плотности л-связи к кислороду. При этом на атоме кислорода образуется избыток (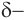 ), а на атоме углерода — недостаток (
), а на атоме углерода — недостаток (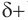 ) электронной плотности. Связь
) электронной плотности. Связь  полярна. Под влиянием карбонильной группы происходит смещение электронной плотности соседней с карбонильным центром связи
полярна. Под влиянием карбонильной группы происходит смещение электронной плотности соседней с карбонильным центром связи 
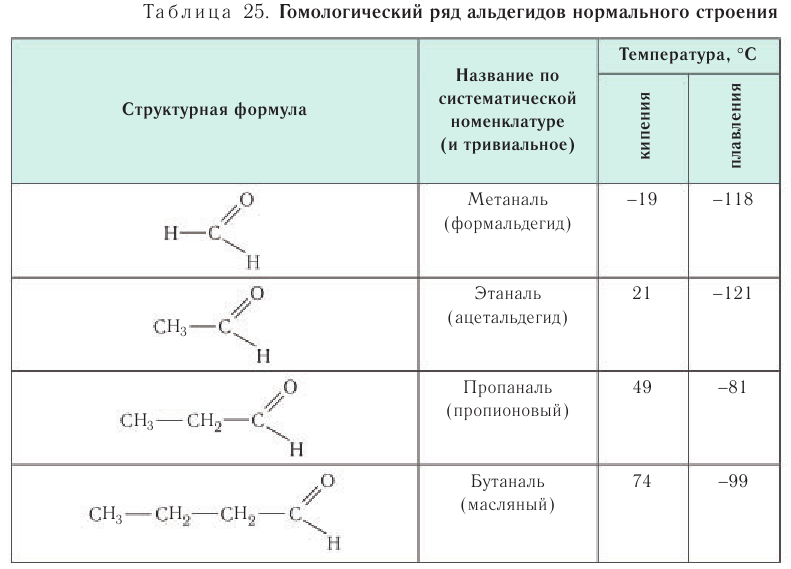
Номенклатура: По правилам номенклатуры ИЮПАК названия насыщенных альдегидов образуются из названий соответствующих алканов с добавлением суффикса -аль, например НСНО — метаналь, 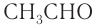 — этаналь. В таблице 25 приведены названия гомологов насыщенных альдегидов нормального строения по номенклатуре ИЮПАК и тривиальные.
— этаналь. В таблице 25 приведены названия гомологов насыщенных альдегидов нормального строения по номенклатуре ИЮПАК и тривиальные.
При названии альдегидов с разветвленной углеводородной цепью нумерация атомов углерода главной цени начинается с атома углерода альдегидной группы. Названия заместителей перечисляются в алфавитном порядке с указанием номера атома углерода, с которым они связаны. Например:
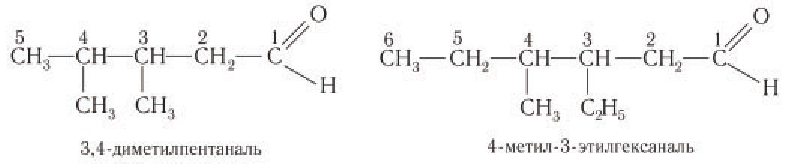
Для альдегидов сохраняются и тривиальные названия, например: НСНО — формальдегид, или муравьиный альдегид, 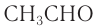 — уксусный альдегид,
— уксусный альдегид, 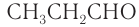 — пропионовый альдегид и т. д.
— пропионовый альдегид и т. д.
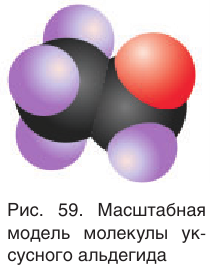
Масштабная модель молекулы уксусного альдегида приведена на рисунке 59.
Изомерия: Структурная изомерия альдегидов обусловлена изомерией углеродного скелета.
Первые три представителя класса — метаналь, этаналь, пропаналь — изомеров альдегидов не имеют.
Число изомеров у альдегидов с увеличением числа углеродных атомов в молекуле возрастает. Например, для альдегидов состава 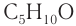 существует четыре изомера альдегида (без учета стереоизомеров):
существует четыре изомера альдегида (без учета стереоизомеров):
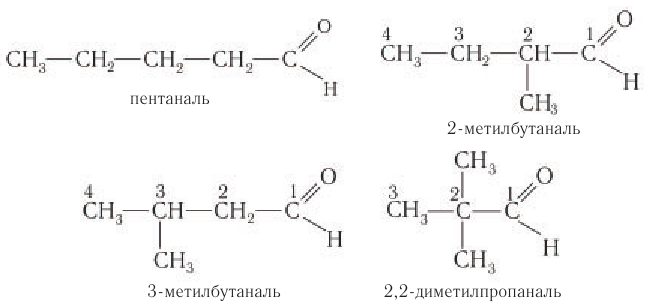
Составу 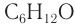 соответствует семь изомерных альдегидов (без учета стереоизомеров) и т. д.
соответствует семь изомерных альдегидов (без учета стереоизомеров) и т. д.
Для альдегидов характерна и межклассовая изомерия. Насыщенные альдегиды изомерны кетонам — карбонильным производным насыщенных углеводородов с тем же числом атомов углерода в молекуле, что и у альдегидов. К кетонам относятся производные углеводородов, молекулы которых содержат карбонильную группу 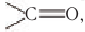 связанную с двумя углеводородными заместителями.
связанную с двумя углеводородными заместителями.
Например, простейший кетон ацетон 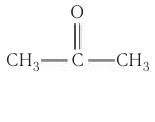 изомерен пропаналю
изомерен пропаналю 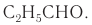 Молекулярная формула обоих веществ
Молекулярная формула обоих веществ 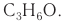
Ацетон — важнейший в промышленном отношении продукт, получаемый, как вам уже известно, кумольным методом как сопутствующий фенолу продукт.
Физические свойства: Метаналь (при и. у.) — бесцветный газ, альдегиды 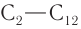 — жидкости, а начиная с альдегида
— жидкости, а начиная с альдегида 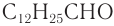 — твердые вещества. Низшие альдегиды имеют резкий запах, у альдегидов
— твердые вещества. Низшие альдегиды имеют резкий запах, у альдегидов 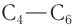 неприятный запах, высшие альдегиды обладают цветочными запахами.
неприятный запах, высшие альдегиды обладают цветочными запахами.
Имеется характерный запах также у некоторых ароматических альдегидов и альдегидов ненасыщенного ряда. Например, фенилуксусный альдегид 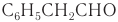 имеет запах гиацинтов, поэтому его называют гиацинтовым.
имеет запах гиацинтов, поэтому его называют гиацинтовым.
Низшие альдегиды хорошо растворяются в воде. Например, растворимость этаналя в воде неограниченная, метаналя (формальдегида) — хорошая (раствор с массовой долей альдегида 40% называют формалином). С увеличением молярной массы альдегидов их растворимость в воде уменьшается.
Температуры кипения и плавления альдегидов по мере увеличения молярной массы закономерно возрастают (см. табл. 25), но при этом они ниже, чем у соответствующих спиртов. Это явление связано с тем, что в молекулах альдегидов карбонильная группа не настолько полярна, чтобы образовывать водородные связи с другими молекулами этого же соединения, как это происходит у спиртов.
Альдегиды — производные углеводородов, у которых атом водорода замещен на группу —СНО.
Общая формула альдегидов — производных алканов — 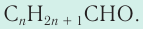
Структурная изомерия альдегидов обусловлена изомерией углеродного скелета.
Химические свойства альдегидов
Химические свойства альдегидов обусловлены наличием в составе молекул карбонильной группы с полярной  -связью. Альдегиды — химически активные соединения, для которых характерны реакции присоединения по связи
-связью. Альдегиды — химически активные соединения, для которых характерны реакции присоединения по связи  и окисления по связи
и окисления по связи  в альдегидной группе. Метаналь является самым химически активным альдегидом.
в альдегидной группе. Метаналь является самым химически активным альдегидом.
Реакции присоединения: Альдегиды способны присоединять водород по связи  на никелевом или платиновом катализаторе с образованием первичных спиртов.
на никелевом или платиновом катализаторе с образованием первичных спиртов.
Например, при пропускании паров этаналя вместе с водородом над нагретым никелевым катализатором происходит присоединение водорода и образуется спирт этанол:
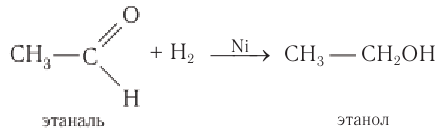
Гидрирование альдегидов относят к реакции восстановления.
В промышленности реакцию гидрирования альдегидов используют для получения насыщенных первичных спиртов.
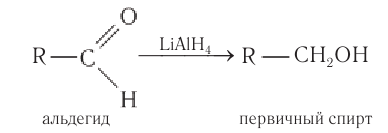
В качестве эффективных восстановителей альдегидов используется также алюмогидрид лития. В этих реакциях он является источником гидридных анионов:
Реакция окисления: Альдегиды способны не только восстанавливаться, но и окисляться значительно легче, чем спирты, при этом образуются соответствующие карбоновые кислоты. Альдегиды можно окислить даже такими мягкими окислителями, как оксид серебра(I) и гидроксид меди(II). Реакции окисления альдегидов протекают при расщеплении связи  в альдегидной группе.
в альдегидной группе.

Так, если к аммиачному раствору оксида серебра(I) прилить раствор уксусного альдегида и смесь нагреть, то происходит окисление альдегида с образованием уксусной кислоты. Внутренняя поверхность пробирки, в которой нагревается смесь, покрывается при этом тонким слоем серебра (рис. 60):
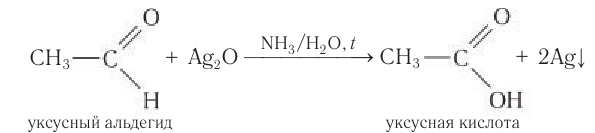
Это так называемая реакция серебряного зеркала, которая может служить качественной реакцией на альдегиды.
Если к свежеосажденному гидроксиду меди(II) прилить раствор уксусного альдегида и смесь нагреть, то также происходит окисление альдегида до уксусной кислоты. При этом гидроксид меди(II) светло-голубого цвета восстанавливается в гидроксид меди(I) желтого цвета, который при нагревании превращается в оксид меди(I) красного цвета:
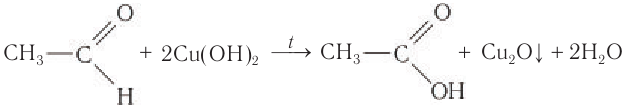
Эта реакция так же, как реакция серебряного зеркала, используется для качественного обнаружения альдегидов.
Окислить альдегиды в соответствующие кислоты можно также такими окислителями, как 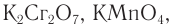 или кислородом воздуха в присутствии катализатора:
или кислородом воздуха в присутствии катализатора:
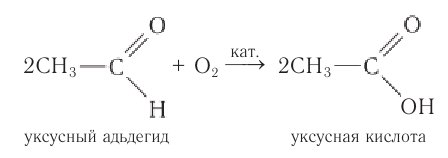
Высокая реакционная способность альдегидов обусловлена строением карбонильной группы.
Для альдегидов характерны реакции присоединения по двойной связи  и окисления по связи
и окисления по связи  в альдегидной группе.
в альдегидной группе.
Получение и применение альдегидов
Получение: Альдегиды получают окислением первичных насыщенных одноатомных спиртов. В лаборатории в качестве окислителей используют оксид меди(II) или пероксид водорода, в общем виде этот процесс можно записать так:
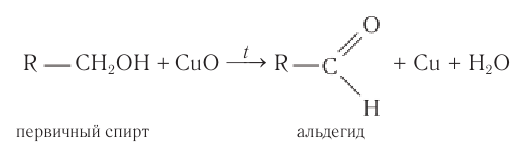
В промышленных условиях метаналь получают окислением метанола кислородом воздуха в присутствии медного или серебряного катализатора:
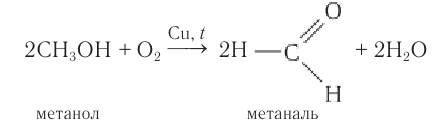
Этаналь получают аналогичным методом:
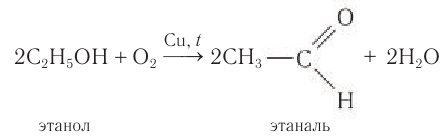
Уксусный альдегид был выделен в лаборатории немецким химиком Ю.Либихом в 1835 г., а первый представитель класса альдегидов — муравьиный альдегид — был получен в лаборатории также немецким химиком А. Гофманом в 1868 г.
Одним из современных промышленных методов получения низших альдегидов является окисление алкенов кислородом воздуха в присутствии хлоридов палладия и меди. Этаналь в промышленности получают преимущественно этим методом:
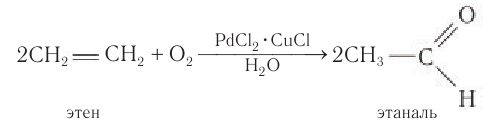
В современной промышленности широко используется такой способ получения альдегидов, как каталитическое дегидрирование первичных насыщенных спиртов. Так, например, при пропускании паров этанола при высокой температуре над поверхностью медного катализатора происходит дегидрирование этанола и образование этаналя:
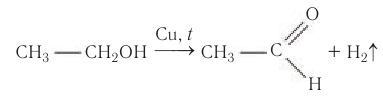
Этот способ получения альдегидов объясняет само название класса — спирт дегидрированный (от лат. alcohol dehydrogenates).
Этаналь можно получить гидратацией ацетилена в условиях реакции Кучерова в присутствии солей двухвалентной ртути:
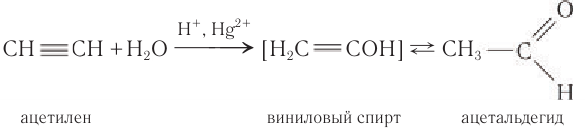
В реакции сначала к ацетилену идет присоединение воды по одной связи, и образуется ненасыщенный виниловый спирт, у которого гидроксильная группа связана с атомом углерода при двойной связи. Ненасыщенные спирты неустойчивы и легко изомеризуются. Поэтому виниловый спирт превращается в уксусный альдегид. Эта реакция впервые была открыта русским химиком М. Г. Кучеровым. Используемые в реакции в качестве катализатора соли ртути опасны для здоровья человека, поэтому эту реакцию для промышленного получения карбонильных соединений не используют.
Применение: Рассмотрим области применения важных в промышленном отношении альдегидов — метаналя и этаналя. Основное количество получаемого в промышленности метаналя (формальдегида) расходуется на производство фенолфор-мальдегидных смол, из которых получают фенолформальдегидные пластмассы (см. § 28). Полиформальдегид 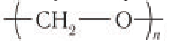 используется для изготовления пленок и волокон. Метаналь применяют для производства некоторых лекарственных веществ, в частности широко известного лекарства уротропин. Впервые уротропин из метаналя и аммиака в 1860 г. синтезировал А. М. Бутлеров.
используется для изготовления пленок и волокон. Метаналь применяют для производства некоторых лекарственных веществ, в частности широко известного лекарства уротропин. Впервые уротропин из метаналя и аммиака в 1860 г. синтезировал А. М. Бутлеров.
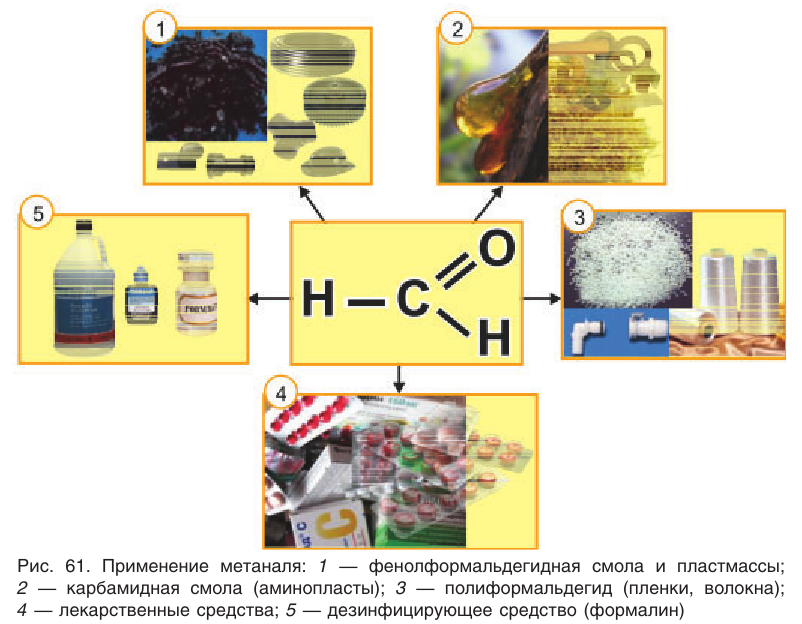
Метаналь используется обычно в виде водного раствора — формалина. Формалин обладает сильными дезинфицирующими свойствами. Его применяют для дезинфекции и дубления кож, хранения анатомических препаратов, в сельском хозяйстве — для протравливания семян.
На рисунке 61 показаны области применения метаналя.
Этаналь (уксусный альдегид) используют в промышленных масштабах для получения уксусной кислоты и ее производных.
В некоторых отраслях производства находят применение альдегиды, производные ненасыщенных и ароматических углеводородов. Например, ненасыщенный альдегид пропеналь 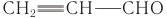 применяют для получения акриловой кислоты, глицерина, некоторых полимеров, лекарственных веществ.
применяют для получения акриловой кислоты, глицерина, некоторых полимеров, лекарственных веществ.
Ароматический альдегид бензальдегид 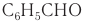 используется для получения душистых и лекарственных веществ, некоторых красителей. В природе бензальдегид встречается в связанном виде в листьях лавровишен, косточках персиков, абрикосов, слив, в горьком миндале.
используется для получения душистых и лекарственных веществ, некоторых красителей. В природе бензальдегид встречается в связанном виде в листьях лавровишен, косточках персиков, абрикосов, слив, в горьком миндале.
К основным промышленным способам получения альдегидов относят окисление алкенов и спиртов, дегидрирование спиртов.
Метаналь и этаналь используются во многих отраслях производства.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |