
При температуре T давление пара растворителя над раствором концентрации g, % (мас.) неизвестного нелетучего вещества в жидком растворителе равно p, Па (плотность этого раствора см. в табл.
 |
 |
Химия |
 |
 |
Решение задачи |
 |
 |
|
 |
 |
Выполнен, номер заказа №16908 |
 |
 |
Прошла проверку преподавателем МГУ |
 |
 |
|
Напишите мне в чат, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
|
Закажите у меня новую работу, просто написав мне в чат! |
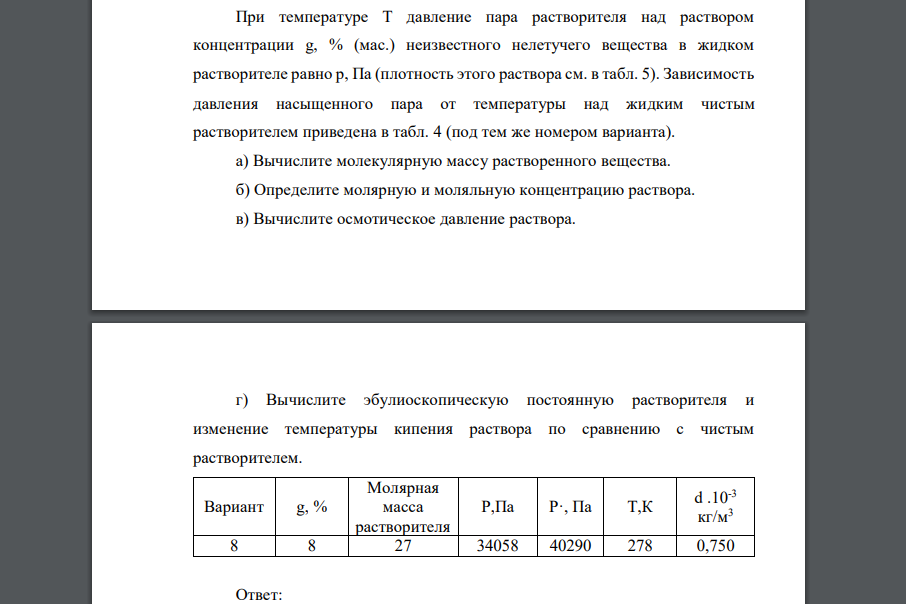
При температуре T давление пара растворителя над раствором концентрации g, % (мас.) неизвестного нелетучего вещества в жидком растворителе равно p, Па (плотность этого раствора см. в табл. 5). Зависимость давления насыщенного пара от температуры над жидким чистым растворителем приведена в табл. 4 (под тем же номером варианта). а) Вычислите молекулярную массу растворенного вещества. б) Определите молярную и моляльную концентрацию раствора. в) Вычислите осмотическое давление раствора. г) Вычислите эбулиоскопическую постоянную растворителя и изменение температуры кипения раствора по сравнению с чистым растворителем. Вариант g, % Молярная масса растворителя Р,Па Р·, Па Т,К d .10-3 кг/м3 8 8 27 34058 40290 278 0,750
Ответ: 1. Растворы подразделяются по степени взаимодействия растворителя и растворенного вещества на идеальные, предельно разбавленные, реальные (неидеальные). Идеальными растворами называются такие растворы, у которых сила взаимодействия между одноименными и разноименными молекулами одинакова. Идеальными будут такие растворы, образование которых из компонентов, взятых в одинаковом агрегатном состоянии и в любых соотношениях, не сопровождается изменением объема и тепловым эффектом, а изменение энтропии равно изменению энтропии при смешении идеальных газов. Предельно разбавленными растворами называются такие растворы, у которых растворитель подчиняется законом идеальных растворов, а растворимое вещество – законам реальных растворов. Неидеальными (реальными) растворами называются такие растворы, у которых силы взаимодействия между одноименными и разноименными молекулами различны. Реальные растворы не подчиняются закономерностям идеальных и предельно разбавленных растворов. Однако, введя вспомогательные величины, свойства неидеальных растворов тоже можно выразить через закономерности идеальных растворов. Способы выражения концентраций: 1) Молярная концентрация С (или молярность) – число молей вещества, растворенного в 1 м3 (или литре) раствора: Моляльная концентрация т (или моляльность) – число молей растворенного вещества в 1 кг или 1000 г растворителя: масса растворителя. 3) Процентная концентрация ω определяется количеством граммов вещества в 100 г (весовые) или 100 мл (объемные) раствора: вещества раствора или вещества раствора Мольная доля N – отношение числа молей ni одного компонента к суммарному числу молей n всех компонентов раствора:Молярная концентрация эквивалента (нормальность) показывает, какое количество моль эквивалентов растворенного вещества содержится в 1 л раствора. Молярную концентрацию эквивалента Сэ находят как отношение количества эквивалентов вещества nэ к объему раствора Среди растворов особенно интересны такие, для которых во всей области концентраций соблюдается простейшая линейная зависимость парциальных и общего давлений пара от концентрации. Если концентрацию выражать в мольных долях,давления насыщенного пара чистых компонентов А и В при данной температуре; мольные доли компонентов в жидкой фазе. Уравнения (·) являются математическим выражением закона Рауля, согласно которому при постоянной температуре парциальное давление napа каждого компонента равно давлению пара этого компонента в чистом виде, помноженному на его мольную долю в растворе. Для бинарного раствора, состоящего из компонентов удобнее использовать другую формулировку: Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе. Растворы двух летучих веществ, подчиняющиеся закону Рауля во всей области концентраций отназываются идеальными растворами. Этот тип растворов встречается редко. Идеальные растворы могут образовывать вещества, молекулы которых сходны по полярности, строению, химическому составу и, следовательно, взаимодействуют между собой с такой же силой FА-В, с какой взаимодействуют молекулы в чистых компонентах Именно этим можно объяснить зависимость давления насыщенного пара над идеальным раствором только от концентрации, а также тот факт, что идеальные растворы образуются из жидких компонентов без выделения и поглощения теплоты и без изменения объема т. е. объем полученного раствора равен сумме объемов компонентов. Изотермическая диаграмма х, р для идеальных растворов изображена на рис. В соответствии с уравнениями она состоит из трех прямых. Рис.1. Зависимость парциальных и общего давлений пара от состава для идеального раствора Для реальных растворов данные зависимости являются криволинейными. Если молекулы данного компонента взаимодействуют друг с другом сильнее, чем с молекулами другого компонента, то истинные парциальные давления паров над смесью будут больше, чем вычисленные по первому закону Рауля (положительные отклонения). Если же однородные частицы взаимодействуют друг с другом слабее, чем разнородные, парциальные давления паров компонентов будут меньше вычисленных (отрицательные отклонения). Реальные растворы с положительными отклонениями давления пара образуются из чистых компонентов с поглощением теплоты растворы с отрицательными отклонениями образуются с выделением теплоты Понижение температуры замерзания раствора ΔTзам не зависит от природы растворенного вещества и определяется лишь соотношением числа частиц растворителя и растворенного вещества. Рис.2. Зависимость температуры замерзания растворов от давления ОF есть зависимость давления пара над твердым растворителем, а кривые зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями соответственно. Можно показать, что понижение температуры замерзания раствора ΔTзам прямо пропорционально моляльной концентрации раствора: Уравнение называют вторым законом Рауля. Коэффициент пропорциональности Eкр – криоскопическая постоянная растворителя – определяется природой растворителя. Любая жидкость – растворитель или раствор – кипит при той температуре, при которой давление насыщенного пара становится равным внешнему давлению. Соответственно температуры, при которых изобара Р = 1 атм. пересечет кривые ОА, ВС и DE, представляющие собой зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями соответственно, будут температурами кипения этих жидкостей Рис.3. Зависимость температуры кипения растворов от давления эбулиоскопическая постоянная растворителя, не зависящая от природы растворенного вещества. Если разделить два раствора с различной концентрацией полупроницаемой перегородкой, пропускающей молекулы растворителя, но препятствующей переходу частиц растворённого вещества, будет наблюдаться явление самопроизвольного перехода растворителя через мембрану из менее концентрированного раствора в более концентрированный – осмос. Осмотические свойства раствора по количественно характеризуются величиной осмотического давления. Давление, которое необходимо приложить к раствору, чтобы предотвратить перемещение растворителя в раствор через мембрану, разделяющую раствор и чистый растворитель, есть осмотическое давление π. Осмотическое давление идеальных растворов линейно зависит от температуры и молярной концентрации раствора С и может быть рассчитано по уравнению: π = C·R·T Приведенное уравнение отражает принцип Вант-Гоффа: осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало бы тот же объем, который занимает раствор. 3. Метод определения молярной массы вещества по понижению температуры замерзания вещества называется криоскопией, а прибор, в котором проводится опыт называется криоскоп. масса растворенного вещества, г; G – масса растворителя, г. Метод определения молярной массы вещества по повышению температуры кипения раствора называется эбулиоскопией. Будем считать, что масса раствора равна тогда масса растворенного нелетучего вещества равнаМасса растворителя равна Мольная доля растворителя равна Мольная доля растворенного вещества равна Химическое количество растворителя равно Для определения химического количества растворенного вещества составим пропорцию: Молярная масса вещества равна Молекулярная масса численно равна молярной Вычислим молярную концентрацию раствора:Определим моляльную концентрацию: Осмотическое давление раствора равноПолучаем график зависимости давления от температуры для чистого растворителя: 5. По графику определяем, что при давлении пара 34058 Па над чистым растворителем температура будет равна Повышение температуры кипения при Рассчитаем эбулиоскопическую константу:
- Являются ли плотностями вероятностей некоторых случайных величин следующие функции: Построить их графики и найти соответствующие им
- Между двумя параллельными пластинками находится слой воды толщиной 0,5 мкм. Рассчитайте давление, сжимающее пластины, если угол смачивания равен
- Приведите уравнения реакций количественного определения бромкамфоры (Mr 231,14) в таблетках методом
- Получите гидроксимасляные кислоты из н-бутанола. Обладают ли эти соединения оптической активностью? Почему?

