
Расположите соединения в ряд по увеличению кислотности: фенол, этанол, о-крезол, хлорфенол, вода.
 |
 |
Химия |
 |
 |
Решение задачи |
 |
 |
|
 |
 |
Выполнен, номер заказа №16897 |
 |
 |
Прошла проверку преподавателем МГУ |
 |
 |
|
Напишите мне в чат, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
|
Закажите у меня новую работу, просто написав мне в чат! |
Расположите соединения в ряд по увеличению кислотности: фенол, этанол, о-крезол, хлорфенол, вода. Дайте объяснения на основании знаний об электронных эффектах в молекуле.
Ответ:
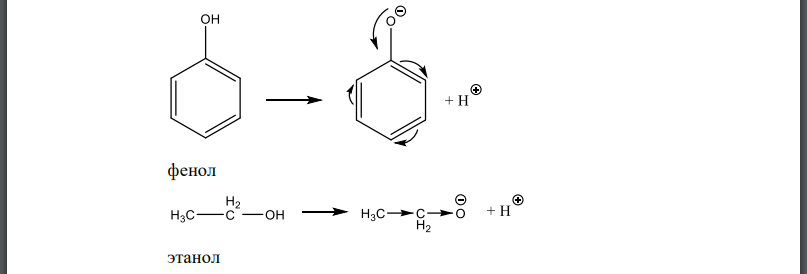
Кислоты – это вещества, способные выступать в качестве донора протона (т.е. его отдавать). Сила кислоты будет зависеть от стабильности аниона, т.е. от сопряженного основания, которое образуется при отрыве от молекулы. Чем стабильнее анион, тем выше кислотность данного соединения. Электроноакцепторные заместители способствуют делокализации электронной плотности, что ведёт к стабильности аниона и соответственно увеличению кислотности. Электронодонорные заместители наоборот способствуют концентрации электронной плотности в кислотном центре, что ведет к понижению кислотности и увеличению основности. Запишем уравнения диссоциации соединений и покажем делокализацию отрицательного заряда в образующихся анионах: фенол этанол крезол о-хлорфенол вода Из уравнений диссоциации видим, что делокализация отрицательного заряда имеет место в феноле, о-крезоле и о-хлорфеноле. Однако в случае охлорфенола введение электроноакцепторного атома хлора усиливает дефицит электронной плотности, возникающий на атоме кислорода, поэтому кислотные свойства о-хлорфенола выражены сильнее, чем фенола. Наличие донорной метильной группы в молекуле о-крезола приводит к повышению электронной плотности на атоме кислорода, поэтому кислотные свойства окрезола выражены слабее, чем фенола. Сравним кислотные свойства этанола и воды. Как было отмечено выше, наличие донорных заместителей повышает электронную плотность на атоме кислорода, кислотные свойства ослабевают, поэтому более сильно выражены кислотные свойства у воды. Получаем ряд по увеличению кислотности: 
Похожие готовые решения по химии:
- Получите из а) бензола – пикриновую кислоту; б) хлористого изопентила – трет-пентиловый спирт; в) ацетилена – 1-бутанол.
- Какие из приведенных соединений будут вступать в реакцию конденсации с уксусным альдегидом: 2-нитробутан, 2-нитро-2- метилпентан, м-нитротолуол?
- Получите из бензола бензойную и фенилуксусную кислоту. Можно ли данные кислоты получить малоновым синтезом?
- Запишите уравнения реакций и укажите реагенты для осуществления следующих превращений:
- Вычислить разность относительных электроотрицательностей атомов для связей в соединениях и определить: а) какая из связей характеризуется
- Вычислить теплоту образования газообразного бензола если теплота его сгорания равна
- Исходя из состава воздуха вычислить концентрацию азота и кислорода в нем (моль/л) при нормальных условиях.
- Определить массовую долю нормальность, моляльность и титр 0,8 М раствора если плотность раствора равна
- Для заданных аминокислот напишите уравнения диссоциации в водном растворе, состояния ионизации в сильно кислой и сильно щелочной средах
- Определить массовую долю нормальность, моляльность и титр 0,8 М раствора если плотность раствора равна
- Рассчитать нормальную концентрацию, поправочный коэффициент и титр по определяемому веществу для стандартного раствора
- Дайте обоснование и приведите особенности методов кислотноосновного титрования применительно к лекарственным средствам производным пара-аминобензойной

