
Автор Анна Евкова
Преподаватель который помогает студентам и школьникам в учёбе.
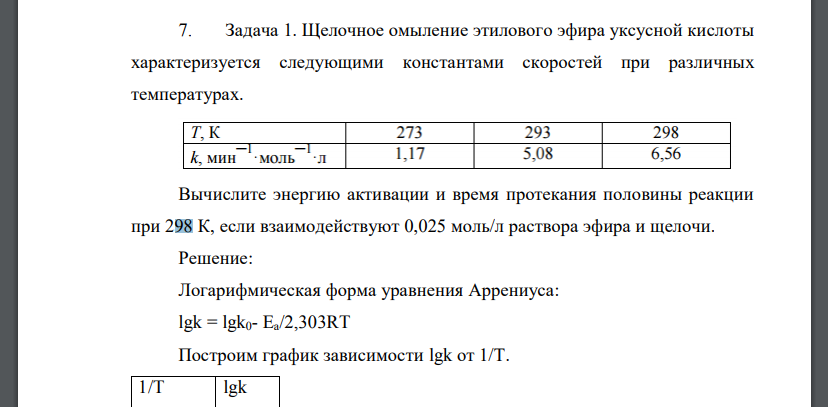
Щелочное омыление этилового эфира уксусной кислоты характеризуется следующими константами скоростей при различных
 |
 |
Химия |
 |
 |
Решение задачи |
 |
 |
|
 |
 |
Выполнен, номер заказа №16709 |
 |
 |
Прошла проверку преподавателем МГУ |
 |
 |
|
Напишите мне в чат, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
|
Закажите у меня новую работу, просто написав мне в чат! |
Описание заказа и 38% решения ( + фото):
Щелочное омыление этилового эфира уксусной кислоты характеризуется следующими константами скоростей при различных температурах.

Вычислите энергию активации и время протекания половины реакции при 298 К, если взаимодействуют 0,025 моль/л раствора эфира и щелочи.
Решение:
Логарифмическая форма уравнения Аррениуса: Построим график зависимости Реакция омыления является реакцией второго порядка. Период полупревращения определяется по формуле: мин. Ответ:
- Брошены две игральные кости: А – число очков на первой кости делится на 2, С – сумма очков на первой и второй кости делится
- Определите равновесные парциальные давления всех компонентов реакции и исходное давление вещества А
- При разложении пероксида водорода на платиновом катализаторе происходит выделение кислорода по реакции
- Реакция 2NO + O2 = 2NO2 протекает как реакция третьего порядка. При температуре 570 К константа скорости этой реакции равна

