
.В каких периоде, группе и подгруппе располагается данный элемент в периодической системе Д.И. Менделеева
 |
 |
Химия |
 |
 |
Решение задачи |
 |
 |
|
 |
 |
Выполнен, номер заказа №17022 |
 |
 |
Прошла проверку преподавателем МГУ |
 |
 |
|
Напишите мне в чат, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
|
Закажите у меня новую работу, просто написав мне в чат! |
На основании положения химического элемента № 31 и его электронной формулы составьте прогноз его химических свойств, ответив на следующие вопросы:
13.В каких периоде, группе и подгруппе располагается данный элемент в периодической системе Д.И. Менделеева?
14.Укажите соответствие между положением элемента в периодической системе Д.И. Менделеева и его электронной формулой (номером внешнего энергетического уровня, общим числом валентных электронов, характером их распределения по энергетическим подуровням).
15.К какому электронному семейству относится данный элемент? 16.Охарактеризуйте валентные состояния атомов данного элемента в основном и возбужденных состояниях с помощью электронно-графических формул.
17.Чему равны максимальная и минимальная степени окисления атомов этого элемента?
18.Каковы формулы высшего оксида и соответствующего гидроксида этого элемента?
Решение
Данный элемент располагается в периодической системе в периоде № 4, в группе № 3, в главной подгруппе. Электронная формула элемента имеет вид:
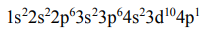
Номер внешнего энергетического уровня (n = 4) соответствует номеру периода. Общее число валентных электронов (электронов внешнего энергетического уровня, а также предвнешнего d-подуровня, если он застроен неполностью) для большинства элементов соответствует номеру группы.
Принадлежность элементов к главным или побочным подгруппам определяется типом электронного семейства: s- и p-элементы составляют главные подгруппы, d- и f-элементы образуют побочные подгруппы.
Классификация химических элементов по электронным семействам основана на характере застройки электронных оболочек.
В соответствии с ним элементы подразделяются на следующие электронные семейства:
- s-элементы (застройка внешнего s-подуровня, все внутренние слои застроены);
- p-элементы (застройка внешнего p-подуровня, все внутренние слои застроены);
- d-элементы (застройка предпоследнего d-подуровня);
- f-элементы (застройка третьего снаружи f-подуровня).
Исходя из указанной классификации элемент галлий Ga принадлежит к р-электронному семейству и находится в периодической системе в главной подгруппе.
Валентные состояния атомов определяются наличием одиночных неспаренных валентных электронов (спиновая валентность).
Для определения спиновой валентности элемента в основном (т.е. отвечающем его минимальной энергии) распределяем его валентные электроны по квантовм ячейкам в соответствии с принципом Паули и правилом Хунда:
Число одиночных неспаренных валентных электронов равно 1
Кроме представленного выше основного состояния атома можно представить возбужденные состояния, в которые атом переходит при получении им дополнительных порций энергии, и которые характеризуются переходами электронов из занятых ячеек в свободные в пределах данного уровня, что проявляется в изменении спиновой валентности элемента. Если свободные квантовые ячейки на данном энергетическом уровне отсутствуют, то возбужденные состояние невозможны, и спиновая валентность в таком случае постоянна.
Возбужденные состояния для атома рассматриваемого в задаче элемента можно отобразить следующими схемами:
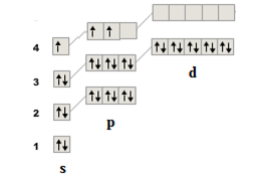
Значения спиновой валентности для каждого из них: 3.
Высшую (максимальную) степень окисления атом приобретает, отдав все свои валентные электроны. Поэтому для большинства элементов максимальная степень окисления равна номеру группы, в которой находится данный элемент в таблице Д.И. Менделеева.
Следовательно, для элемента галлий Ga максимальная степень окисления составляет: +3.
Низшая (минимальная) степень окисления соответствует числу электронов, необходимых атому для достройки внешнего электронного слоя до октета восьмиэлектронной структуры). Поэтому минимальную степень окисления можно вычислить по формуле: Nгруппы - 8.
Однако, присоединение электронов свойственно только атомам типичных неметаллов, поэтому для металлов и переходных элементов минимальная степень окисления равна нулю.
Рассматриваемый в задаче элемент галлий Ga проявляет минимальную степень окисления не проявляет отрицательные степени окисления.
Зная величины максимальной и минимальной степени окисления атомов элементов, можно составить формулы их соединений.
Оксиды - это соединения элементов с кислородом. Общая формула оксида: ЭmOn (Э-символ элемента, О-символ кислорода, числа m и n показывают количественное соотношение между атомами элементов). Кислород проявляет минимальную степень окисления -2 (элемент VI группы). Поэтому для обеспечения электронейтральности химической формулы необходимо подобрать следующие соотношения m:n для указанного в задаче элемента: галлий Ga и формула его оксида имеет вид: 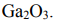
Гидроксиды - это основания (для типичных металлов и d-элементов, если их атомы находятся в степени окисления не выше +3) и кислоты (для типичных неметаллов и d-элементов в степенях окисления >3).
Общая формула основания: Me(OH)n 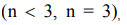 при этом число гидроксильных групп (ОН- ) соответствует валентности металла.
при этом число гидроксильных групп (ОН- ) соответствует валентности металла.
Для элемента, приведенного в условии задачи, формула основания имеет вид: Ga(OH)3 (если элемент не образует оснований, поставьте прочерк).
Наиболее распространенные кислоты, в состав которых входят атомы элементов в максимальной степени окисления, имеют общую формулу 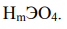
Используя значения степеней окисления атомов (H+1, O-2 , и высшей степени окисления элемента Э), составляем формулу кислоты: - (если элемент не образует кислот, поставьте прочерк). Для кислот с m = 3 или 4 (орто-кислоты) возможно отщепление молекулы воды (- H2O) и образование второй формы кислоты - мета-формы.(H 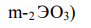 Для данного элемента образование мета-кислоты невозможно (возможно или невозможно), ее формула: -.
Для данного элемента образование мета-кислоты невозможно (возможно или невозможно), ее формула: -.

Похожие готовые решения по химии:
- В случае ковалентной (полярной или неполярной) связи постройте электронные схемы молекул (теория Льюиса) и определите кратность связи, постройте схемы перекрывания электронных орбиталей (метод ВС) и определите геометрическую форму молекулы
- Химическая реакция может быть охарактеризована скоростью ее протекания. Скорость химической реакции зависит от многих факторов, среди которых
- Как будет происходить электролиз водного раствора электролита Hg(NO3)2 (t = 1 ч 35 мин, I = 15 А)? Приведите уравнение диссоциации электролита и поясните возможность участия каждого из образующихся ионов в электродных реакциях
- Укажите соответствие между положением элемента в периодической системе Д.И. Менделеева и его электронной формулой (номером внешнего энергетического уровня, общим числом валентных электронов, характером их распределения по энергетическим подуровням
- Определите тип химической связи (неполярная ковалентная, полярная ковалентная или ионная) в веществах нитрид лития и дихлорид серы. В случае полярной или ионной связи укажите направление смещения электронов
- Изделие, изготовленное из стали, эксплуатируется в нейтральном растворе хлорида натрия. Какие металлы можно использовать в качестве протектора? Приведите электронные уравнения анодного и катодного процессов для одного из протекторов
- Как будет происходить электролиз водного раствора электролита KBr? Приведите уравнение диссоциации электролита и поясните возможность участия каждого из образующихся ионов в электродных реакциях
- Атомный (порядковый) номер химического элемента определяет заряд ядра его атомов. Ядро атома построено из нуклонов: протонов (заряд +1, масса 1) и нейтронов (заряд 0, масса 1
- Атомный (порядковый) номер химического элемента определяет заряд ядра его атомов. Ядро атома построено из нуклонов: протонов (заряд +1, масса 1) и нейтронов (заряд 0, масса 1
- Как будет происходить электролиз водного раствора электролита KBr? Приведите уравнение диссоциации электролита и поясните возможность участия каждого из образующихся ионов в электродных реакциях
- Химическая реакция может быть охарактеризована скоростью ее протекания. Скорость химической реакции зависит от многих факторов, среди которых
- В случае ковалентной (полярной или неполярной) связи постройте электронные схемы молекул (теория Льюиса) и определите кратность связи, постройте схемы перекрывания электронных орбиталей (метод ВС) и определите геометрическую форму молекулы

