
Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса с примерами
Содержание:
Вода ее элементный состав, молекулярное строение, формула и молярная масса:
Вода — одно из важнейших химических соединений, широко распространенное на земном шаре.
Вода — это сложное вещество, состоящее из двух атомов водорода и одного атома кислорода (рис. 29).
Молекулярная формула воды — 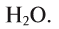
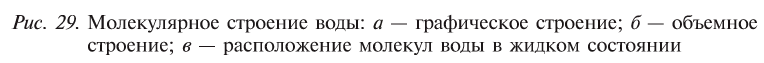
Относительная молекулярная масса воды равна сумме относительных атомных масс водорода и кислорода:
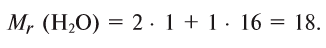
Следовательно, масса 1 моля воды — 18 г, а молярная масса воды — 18 г/моль.
Вода и её физические свойства
Чистая вода — прозрачная жидкость без цвета, вкуса и запаха. Вкус и запах воде придают растворенные в ней примеси. Многие физические свойства воды очень своеобразны. При соответствующих обстоятельствах они являются аномальными, т.е. отклоняются от привычных. Например, плотность воды при переходе из твердого состояния (лед) в жидкое не уменьшается, как у большинства веществ, а увеличивается (рис. 30). Плотность растет и при нагревании воды от 0°С до + 4°С, достигая своего максимума — 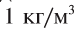 или 1 г/мл.
или 1 г/мл.
Еще одно свойство воды — это ее высокая теплоемкость (4,18 Дж/кг) (для сравнения: у песка —
0,79; известняка — 0,88; поваренной соли — 0,88; глицерина — 2,43; этилового спирта — 2,85). Поэтому вода в ночное время или при переходе от летнего сезона к зимнему медленно остывает, а в дневное время и при смене зимы летом так же медленно нагревается.
Вода замерзает при 0°С (при этой же температуре лед начинает таять) и превращается в пар (кипит) при 100°С.
Вода, являясь универсальным растворителем, растворяет многие органические и неорганические вещества.
Вода и её химические свойства
Молекулы воды очень устойчивы к нагреванию, но при температуре выше 1000°С пары воды начинают разлагаться на водород и кислород:
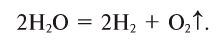
Реакционная способность воды очень велика.
Активные металлы, взаимодействуя с водой, выделяют из нее водород: 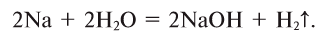

Рис. 30. Вода и лед
При взаимодействии с водой оксидов многих металлов и неметаллов образуются основания и кислоты:
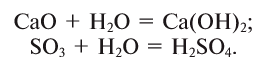
Некоторые соли образуют с водой соединения, называемые кристаллогидратами:
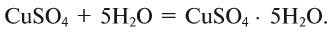
Нагретое железо вступает в реакцию с парами воды:
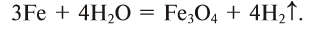
Вода катализирует ряд химических процессов: при ее отсутствии «гремучий газ» не взрывается даже при высокой температуре, угарный газ не горит в кислороде, натрий и фосфор не окисляются на воздухе, не взаимодействуют с хлором и не происходит травления стекла фтористым водородом.
Распространение воды в природе
Три четверти поверхности земного шара покрыто водой в виде океанов, морей, озер, рек. Вода распространена в атмосфере в виде паров, на горных вершинах и полюсах — в виде ледников и снега. Существуют также подземные воды, увлажняющие почву и горные породы.
Объем Мирового океана составляет 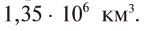 . На него приходится 97,2% всей воды на Земле. Вода в виде ледников на полюсах и горных вершинах составляет 2,1%, подземные грунтовые воды и пресная вода рек и озер — 0,6%, колодезная и соленая вода — 0,1%.
. На него приходится 97,2% всей воды на Земле. Вода в виде ледников на полюсах и горных вершинах составляет 2,1%, подземные грунтовые воды и пресная вода рек и озер — 0,6%, колодезная и соленая вода — 0,1%.
Вода имеет огромное значение в жизни растений, животных и людей. По современным представлениям, происхождение и развитие жизни на Земле было связано с морем. Вода — это среда, которая обеспечивает жизнедеятельность каждого организма посредством химических процессов, в ней протекающих. Кроме того, вода сама участвует в ряде биохимических процессов.
Аномальные физические свойства воды имеют важное значение в обеспечении жизненных процессов. Если бы плотность воды при переходе из жидкого состояния в твердое изменялась так же, как и у других веществ, то с приходом зимы поверхность воды, замерзая при 0°С, оседала бы ниже и уступала бы свое место более теплому слою, который также замерзал бы и оседал на дно. Таким образом вся вода превратилась бы в лед и многие формы жизни прекратили бы свое существование.
Но то, что вода при +4°С обладает максимальной плотностью, не дает происходить подобному явлению, так как обладающий меньшей плотностью лед остается на поверхности воды и предохраняет от замерзания более глубокие теплые слои.
Высокая теплоемкость воды также имеет большое значение для жизни на Земле. На нагревание воды необходимо затратить больше энергии, чем на нагревание любого другого вещества, т.е. вода, поглотившая тепло, нагревается при более низкой температуре, чем любая другая жидкость. Одна третья часть поглощаемой энергии Солнца расходуется на испарение воды Мирового океана и других водных бассейнов.
Вода выполняет специфическую роль терморегулятора и тем самым обеспечивает нормальную жизнедеятельность на поверхности Земли. Водные ресурсы земного шара могут быть как солеными, так и пресными, но все они имеют важное значение для промышленности.
Промышленность приспособлена для потребления в основном пресной воды. По имеющимся сведениям, в год на одного жителя планеты приходится в среднем 8000 л воды. Это количество воды используется как в бытовых, так в сельскохозяйственных и промышленных целях.
Только 10% расходуемой воды приходится на бытовые расходы, а остальное количество затрачивается на промышленность и сельское хозяйство. Для получения 1 кг сахара необходимо 400 л воды, для обработки 1 кг зерна — 1500 л, а для получения 1 кг синтетической резины необходимо примерно 2500 л воды.
В промышленности вода в основном используется как растворитель, охладитель и очиститель.
Пресная вода широко используется в сельском хозяйстве для полива полей и питья в животноводстве.
Повсеместное использование воды в промышленности связано с проблемами возникновения сточных вод и загрязнения окружающей среды. Для решения этих проблем необходим комплексный подход.
Не забывайте, что вода является бесценным богатством!
Меры по сохранению водных ресурсов от загрязнения
Для жизнедеятельности (т.е. для бытовых нужд, сельского хозяйства и промышленности) используют воды озер, рек, подземные воды и воды искусственных водоемов. Для водообеспечения большое значение имеет сохранение чистоты воды, которая загрязняется, проходя через систему канализационных сетей, промышленных предприятий, подвергаясь «обработке» путем смыва химических средств с полей.
Возвращаемые в водоемы сточные воды должны проходить соответствующую очистку, поскольку они могут быть загрязнены выбросами ферм, мусоросборников, городской канализацией, дренажными водами, остатками минеральных удобрений, инсектицидами, гербицидами, отходами больниц, торговых предприятий, общественного питания, заводов, фабрик и лабораторий. Такие воды должны быть подвергнуты многоступенчатой очистке. Сначала вода пропускается через механические фильтры, на которых задерживаются песок и другие частицы. Мелкие же частицы и многие бактерии осаждаются путем добавления в воду сначала извести, а затем сульфата алюминия. При пропускании воздуха через такую воду в ней усиливается разложение органических веществ. На последней стадии, чтобы очистить воду от бактерий, ее обрабатывают озоном или хлором. После такой стерилизации воду можно использовать для потребления.
При применении данного метода очистки вода очищается от вредных веществ. Но в некоторых случаях появляется необходимость ее очистки от ионов кальция и магния, повышающих жесткость воды. Эти ионы в сочетании с мылом образуют в воде нерастворимые соединения, отрицательно влияющие на эффективность синтетических моющих веществ. Такая вода при кипячении дает накипь. Многие подземные воды подвергаются такой очистке, потому что в результате взаимодействия известняка, а также других соединений магния и кальция содержание их ионов в воде возрастает. Эта вода обрабатывается гашеной или негашеной известью, а также содой. Потом проводят ее обработку квасцами. Такая вода полностью готова к употреблению.
Для очистки сточных вод существует особый способ, состоящий из трех стадий. На первой стадии очистку проходят 30% воды, на второй 60%, 10% воды не подвергаются очистке. При этом на первой стадии фильтрованием отделяются крупные твердые частицы, 60% которых могут выпасть в осадок. Если не подвергать такую воду вторичной очистке, то следует провести ее обеззараживание хлором и отправить в водоем.
При вторичной очистке посредством воздуха разлагаются органические вещества, увеличивается количество аэробных бактерий, которые, питаясь остатками органических веществ, очищают воду. Затем они осаждаются, а вода подвергается обработке хлором и сливается в водоем. На этой стадии можно осадить до 90% твердых частиц.
Вода, прошедшая первичную и вторичную обработку, может содержать значительное количество соединений фосфора и азота, что приводит к размножению водорослей в водоемах. Помимо этого, многие химические вещества, содержащиеся в сточных водах, пройдя эти стадии очистки, могут снова загрязнять окружающую среду и водные бассейны.
Однако полная очистка воды от многих металлов и органических веществ — очень дорогостоящая процедура. Поэтому вода в незначительных количествах подвергается третичной обработке, при которой с помощью специальных средств такие примеси ликвидируются.
Вода - один из лучших растворителей
Вода имеет огромное значение в жизни и практической деятельности человека. Процесс усвоения пищи связан с переводом питательных веществ в растворимые формы посредством воды. Все физиологически важные жидкости (кровь, лимфа и др.) — водные растворы. В основе многих сфер производственной деятельности лежат процессы, в которых используются водные растворы.
Жидкие растворы — это жидкие гомогенные (однородные) системы, состоящие из двух или более компонентов.
Общая поверхность Земли составляет 510100000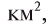 , 375000000
, 375000000 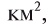 из них покрыто водой. Масса океанических и морских вод составляет (не учитывая растворенные в них соли) 1,4-1018 т, пресной воды суши и ледников — 4-1015 т; воды, входящей в состав живых организмов, почвы и горных пород, — 1017 т. В теле человека весом 70 кг содержится 49 кг воды, тела некоторых медуз содержат 98% воды.
из них покрыто водой. Масса океанических и морских вод составляет (не учитывая растворенные в них соли) 1,4-1018 т, пресной воды суши и ледников — 4-1015 т; воды, входящей в состав живых организмов, почвы и горных пород, — 1017 т. В теле человека весом 70 кг содержится 49 кг воды, тела некоторых медуз содержат 98% воды.
В природе вода широко распространена в виде растворенных в ней солей. Такие реки, как Ганг или Миссисипи, растворяют до 100 млн т солей в год, а все реки мира — 2,735 млрд т солей.
Почти все вещества растворяются в воде (рис. 31): некоторые — очень хорошо, другие — средне, а остальные — плохо.
Проходя через нижние слои атмосферы, дождевая вода может растворить значительное количество различных веществ. При выпаривании 1000 г дождевой воды остается 3—5 г твердого осадка.
Растворенные и попавшие в почву вещества, химически взаимодействуя с компонентами почвы и горных пород, активно участвуют в непрерывном процессе образования почвы и минералов, разрушения горных пород.

Рис. 31. Растворение различных веществ в воде:
1 — хлорид кальция; 2 — перманганат калия; 3 — пищевая соль; 4 — бихромат калия;5 — карбонат натрия; 6 — бертолетова соль

Рис. 32. Растворение сахара в воде
Вода — универсальный растворитель, который может растворять и газы (кислород, водород, углекислый газ и др.), и жидкости (спирт, кислоты и др.), и твердые вещества (соли, минералы и др.).
В воде растворяются в небольшом количестве даже те вещества, которые, казалось бы, совсем не растворяются в ней. К.В. Шееле, кипятя в течение 12 дней в колбе дистиллированную снеговую воду, отметил небольшое разъедание стенок колбы. А. Лавуазье, кипятя определенное количество воды в колбе в течение 101 дня, заметил, что масса сосуда уменьшилась на определенное число, а масса осадка, полученного после выпаривания воды, равняется этому числу. Следовательно, даже стекло незначительно растворяется в воде.
Способность вещества растворяться называется растворимостью.
Например, понаблюдаем растворение сахара в воде (рис. 32). При комнатной температуре (20°С) в 100 г воды может раствориться 200 г сахара. Большее количество сахара при этой температуре не растворится. Такой раствор называется насыщенным.
Мера растворимости определяется количеством вещества в насыщенном растворе при определенных условиях.
Растворимость определяется растворением вещества в 100 г растворителя. Если в растворителе растворяется больше 10 г вещества, то оно считается хорошо растворимым, если меньше 1 г — малорастворимым, если меньше 0,01 г — практически нерастворимым.
Растворимость многих твердых веществ возрастает с повышением температуры. Эту зависимость можно представить в виде графика (рис. 33).
Растворимость газов при повышении температуры уменьшается (при кипячении воды растворенные в ней газы выделяются).
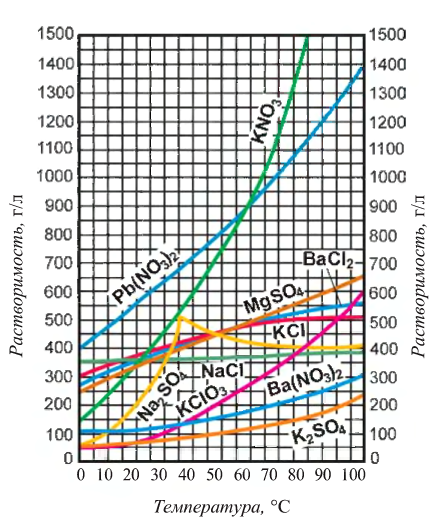
Рис. 33. Кривые растворимости различных солей
Но повышение давления приводит к возрастанию их растворимости (открывая бутылку минеральной воды, мы уменьшаем давление внутри сосуда, и поэтому растворенный в ней углекислый газ начинает интенсивно выделяться).
Понятие о растворах и их концентрациях
Раствор — это однородная система, состоящая из растворителя, растворенного вещества и продуктов их взаимодействия.
Вещество в растворе измельчено до молекул, атомов или других частиц и равномерно распределено между молекулами растворителя, так как размеры частиц растворенного вещества составляют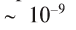 и меньше. Например, спиртовый раствор йода в аптеках представляет собой молекулы йода, распределенные между молекулами спирта. Это раствор, ничего не оставляющий на фильтре. Такие растворы называются истинными.
и меньше. Например, спиртовый раствор йода в аптеках представляет собой молекулы йода, распределенные между молекулами спирта. Это раствор, ничего не оставляющий на фильтре. Такие растворы называются истинными.
Растворы бывают жидкими, твердыми и газообразными. Примерами жидких растворов могут быть водные растворы соли, сахара, спирта; твердых растворов — золотометаллические изделия, сплавы типа дюралюминия; газообразных растворов — воздух или другие смеси газов.
При образовании растворов наблюдается выделение или поглощение тепла. Растворы могут хорошо проводить или не проводить электрический ток.
Растворы обладают свойствами как механических смесей, так и химических соединений (табл. 7).
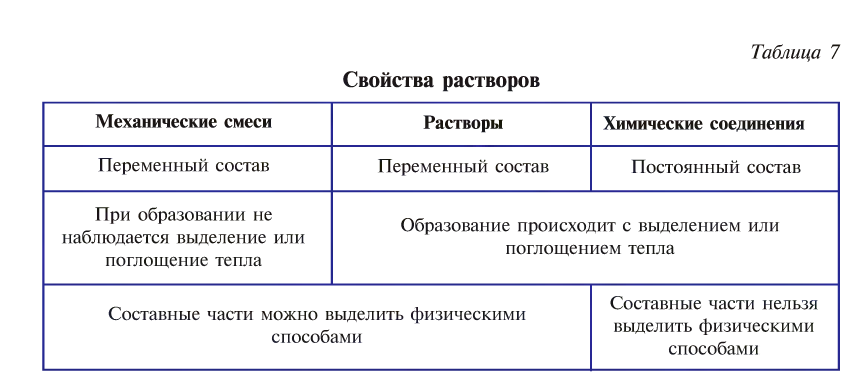
При практическом применении растворов важное значение имеет точное определение количества вещества, растворенного в общей массе раствора.
Состав раствора (в частности, количество растворенного вещества) можно установить различными способами и выразить в размерных величинах (концентрациях).
Когда речь идет о компонентах раствора, под ними подразумеваются чистые вещества, при смешивании которых образуется раствор. При этом большее количество вещества принимается за растворитель, а меньшее — за растворенное вещество (рис. 34).
Эти термины были приняты для удобства, потому что при смешивании двух компонентов их нельзя строго разделять. При образовании раствора из чистой жидкости и твердого вещества обычно за растворитель принимается жидкий компонент. Независимо от того, что является растворенным веществом — газ, жидкость или твердое тело, — когда мы говорим о составе раствора, то обязаны учитывать отношение растворенного вещества к раствору. Это относительное количество называется концентрацией и выражается в различных величинах.
Обычно в химии концентрация выражается:
- — в массовых долях вещества, растворенного в одной весовой части раствора;
- — в процентах растворенного вещества, содержащегося в 100 г раствора;
- — в молях или эквивалентах растворенного вещества, содержащегося в 1 л раствора.

Рис.34 Соли (а)и их растворы (б)
Массовая доля, процентная, молярная и нормальная концентрация вещества в растворе
Как уже было сказано при изучении предыдущей темы, при определении состава раствора необходимо учитывать природу и количество его компонентов.
Насыщенный раствор — это раствор, который при данной температуре не может растворить большего количества вещества.
Ненасыщенный раствор — это раствор, который при данной температуре продолжает растворять вещество.
Если количество растворенного вещества очень мало, то такой раствор называется разбавленным.
Если количество растворенного вещества будет достаточно высоким, то такой раствор называется концентрированным (рис. 35).
В химии в основном пользуются ненасыщенными растворами.

Рис. 35. Взаимодействие цинка с растворами серной кислоты различной концентрации
В химической практике для выражения количества растворенного вещества широко применяются следующие величины:
1. Массовая доля — отношение массы растворенного вещества
— отношение массы растворенного вещества к массе раствора
к массе раствора  , выражающееся обычно числами меньше 1:
, выражающееся обычно числами меньше 1: 
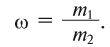
2. Процентная концентрация (С%) — выражение в процентах отношения массы растворенного вещества 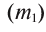 ) к массе раствора
) к массе раствора 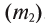 . Здесь масса раствора принимается за 100%; следовательно, С% < 100:
. Здесь масса раствора принимается за 100%; следовательно, С% < 100:
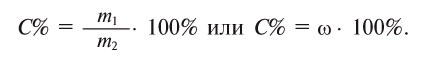
3. Молярная концентрация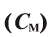 — отношение количества растворенного вещества в молях (М) к объему раствора (У), т.е. если в 1 л (1000 мл) раствора растворен 1 моль вещества, такой раствор называется одномолярным (1М):
— отношение количества растворенного вещества в молях (М) к объему раствора (У), т.е. если в 1 л (1000 мл) раствора растворен 1 моль вещества, такой раствор называется одномолярным (1М):
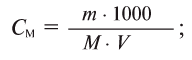
Здесь М — молярная масса вещества.
4. Нормальная концентрация 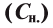 — отношение количества эквивалентов растворенного вещества (Е) к объему раствора (У), т.е. если в 1 л (1000 мл) раствора растворен 1 г-экв. вещества, такой раствор называется однонормальным (1н.):
— отношение количества эквивалентов растворенного вещества (Е) к объему раствора (У), т.е. если в 1 л (1000 мл) раствора растворен 1 г-экв. вещества, такой раствор называется однонормальным (1н.):
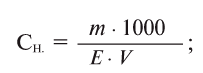
Здесь Е — эквивалентная масса вещества.
Зная нормальные концентрации растворов, можно легко подсчитать, в каких объемах их необходимо взять, чтобы они провзаимодействовали друг с другом без остатка. При взаимодействии друг с другом 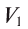 л раствора вещества А концентрации
л раствора вещества А концентрации 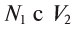 л раствора вещества Б концентрации
л раствора вещества Б концентрации 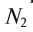 в реакцию вступают
в реакцию вступают 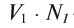 — эквивалентное количество вещества А с
— эквивалентное количество вещества А с 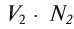 — эквивалентным количеством вещества Б. Зная то, что вещества прореагировали в эквивалентном количестве, можно вывести следующее равенство:
— эквивалентным количеством вещества Б. Зная то, что вещества прореагировали в эквивалентном количестве, можно вывести следующее равенство:
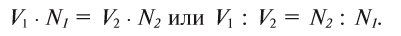
Таким образом, объемы растворов веществ, вступающих в реакцию, обратно пропорциональны значениям их нормальных концентраций.
На основе этой зависимости можно подсчитать не только необходимые для реакции объемы растворов, но и по ним — их концентрации.
Значение растворов для жизни человека
Растворы имеют очень важное значение для жизни человека. Конечно, самый большой класс растворов — эго водные растворы. Вода в живом организме занимает особое место как растворитель, переносчик питательных веществ, среда, обеспечивающая жизнедеятельность и осуществление различных процессов (таких, как регуляция температуры тела, вывод вредных веществ из организма).
Две трети части тела человека состоят из воды в виде различных растворов: кровь содержит 83% воды, мозг и сердце — 80%, кости — около 20—25%; 80% тела рыбы, 95—98% тела медузы, 95—99% тела водорослей, 50—75% тела растений суши составляет вода в виде различных растворов.
Основным компонентом клеток живых организмов являются водные растворы, которые имеют огромное значение как среда или непосредственный участник протекания жизненных процессов, обеспечивающих их существование.
К важному источнику нашего питания — растениям — вода проходит через почву. Основным условием урожайности также является вода. Вода растворяет органические и минеральные вещества в почве и поставляет их растениям. При недостатке воды растения не могут усваивать питательные вещества, ослабляется активность фотосинтеза, замедляется их рост, и в результате снижается урожайность.
Вода — растворитель, без которого сложно представить промышленные процессы. Вода является уникальной средой для протекания многих химических реакций. Без воды невозможно было бы дубить и перерабатывать кожу, крахмалить и красить ткани, производить мыло и г.д.
В медицине вода применяется при изготовлении различных лекарственных растворов, которые используются для лечения многих заболеваний.
Простая минерализованная вода представляет собой раствор различных целебных солей и используется в лечении и профилактике некоторых заболеваний.
Водные растворы различных веществ широко применяются в технике. Например, растворы кислот и оснований используются в простых энергетических аккумуляторах, позволяющих обеспечить электроэнергией автомобили и другие средства передвижения.
Помимо воды прочное место в жизни человека занимают бензин, растворы различных спиртов и органических кислот. Этиловый спирт широко используется при изготовлении как продтоваров, так и лекарственных препаратов или применяемых при охлаждении различных механизмов антифризов.
Мы также знакомы с использованием бензина и подобных ему растворителей в качестве средств химической чистки при выводе пятен с одежды.
Основу различных косметических средств, красок и лаков также составляют растворители.
Вся жизнь человека тесно связана с растворами.
Вычисление воды
Нахождение массовой доли растворенного вещества
Пример №1
Какова концентрация раствора, полученного смешением 50 г поваренной соли с 450 г воды?
Решение:
Найдем процентную концентрацию растворенного вещества по формуле:
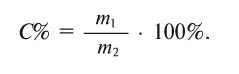
Для этого, сложив массы соли и воды — 50 и 450 г, получим массу образовавшегося раствора — 500 г.
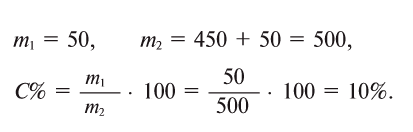
Ответ: 10%.
Пример №2
Концентрация солей в воде некоторых озер близ Аральского моря составляет 4%. Какое количество соли останется при выпаривании 10 кг такой озерной воды?
1-й способ. 4%-ный раствор — это значит, что в 100 г раствора содержится 4 г соли (в 100 кг раствора 4 кг соли). Если в 100 кг раствора содержится 4 кг соли, то в 10 кг раствора — х.
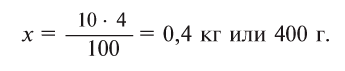
О т в е т: 0,4 кг или 400 г.
2-й с п о с о б. Из формулы 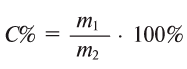 следует
следует
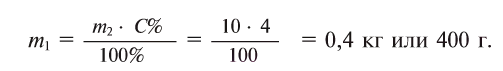
Ответ: 0,4 кг или 400 г.
Нахождение молярности растворенного вещества в растворе определенного объема.
Пример №3
Молярная концентрация в 2 л водного раствора гидроксида натрия содержится 16 г NaOH. Рассчитайте молярную концентрацию этого раствора.
Решение:
1) 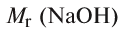 = 40. 1 моль NaOH - 40 г. Значит, A/(NaOH) = 40 г/моль;
= 40. 1 моль NaOH - 40 г. Значит, A/(NaOH) = 40 г/моль;
2) если в 2 л (2000 мл) раствора содержится 16 г NaOH, то в 1 л (1000 мл) раствора — 8 г NaOH; ^
3) содержание в 1000 мл раствора 8 г или 0,2 моля = 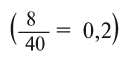 NaOH говорит о том, что он 0,2М или его концентрация — 0,2 моль/л.
NaOH говорит о том, что он 0,2М или его концентрация — 0,2 моль/л.
Ответ: 0,2 моль/л или 0,2М.
Пример №4
Сколько соли необходимо для приготовления 500 мл 2М раствора хлорида капьция? Как можно приготовить такой раствор?
Решение:
1) 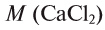 =111 г/моль;
=111 г/моль;
2) 2 моля 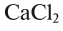 = 222 г;
= 222 г;
3) 2 моль/л значит, что в 1 л (1000 мл) раствора содержится 2 моля, т.е. 222 г 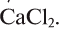 Теперь определим, сколько соли необходимо для приготовления 500 мл раствора. Если в 1000 мл содержится 222 г соли, то в 500 мл = х.
Теперь определим, сколько соли необходимо для приготовления 500 мл раствора. Если в 1000 мл содержится 222 г соли, то в 500 мл = х.
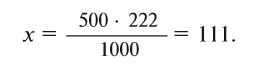
4) 111 г 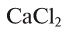 взвешивают на весах и насыпают в мерную колбу на 500 мл. Понемногу к соли добавляют воду до полного ее растворения. После растворения соли колбу заполняют до метки (500 мл) водой. Раствор хорошо перемешивают, выливают в сосуд с этикеткой и закрывают его горлышко крышкой или пробкой.
взвешивают на весах и насыпают в мерную колбу на 500 мл. Понемногу к соли добавляют воду до полного ее растворения. После растворения соли колбу заполняют до метки (500 мл) водой. Раствор хорошо перемешивают, выливают в сосуд с этикеткой и закрывают его горлышко крышкой или пробкой.
Ответ: 111 г.
Вода и её распространение в природе и свойства
Вода является самым широко распространенным веществом в земной коре. Примерно 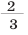 части (-70%) земной поверхности занимают океаны, моря, озера и реки. В почве, в атмосферном воздухе содержится значительное количество воды. Большая часть растений, животных, людей и других живых организмов (60-70%) состоит из воды. Без воды нет жизни на Земле.
части (-70%) земной поверхности занимают океаны, моря, озера и реки. В почве, в атмосферном воздухе содержится значительное количество воды. Большая часть растений, животных, людей и других живых организмов (60-70%) состоит из воды. Без воды нет жизни на Земле.
Для очистки воды от растворенных в ней веществ, т.е. для получения чистой воды, используют метод дистилляции.
Физические свойства
Вода - это бесцветная жидкость, без вкуса и запаха, при нормальном атмосферном давлении (101,3 кПа) и температуре 0 С - она замерзает, а при температуре 100
С - она замерзает, а при температуре 100  С - кипит. Ее плотность (при 4
С - кипит. Ее плотность (при 4 С) составляет 1 кг/дм
С) составляет 1 кг/дм или 1 г/мл, 1 г/см
или 1 г/мл, 1 г/см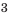 . Теплоемкость воды, по сравнению с другими жидкостями, значительно выше (4 кДж/кг), вследствие этого она нагревается постепенно, и медленно остывает. Данное свойство играет огромную роль в регулировании температуры воздуха. Так как плотность льда меньше плотности жидкой воды, она держится на ее поверхности. Это имеет большое значение для обитателей воды.
. Теплоемкость воды, по сравнению с другими жидкостями, значительно выше (4 кДж/кг), вследствие этого она нагревается постепенно, и медленно остывает. Данное свойство играет огромную роль в регулировании температуры воздуха. Так как плотность льда меньше плотности жидкой воды, она держится на ее поверхности. Это имеет большое значение для обитателей воды.
Химические свойства
Под действием постоянного тока вода разлагается (чистая вода не проводит электрический ток).
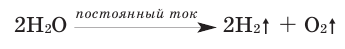
Вода также вступает во взаимодействие с галогенами (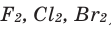 ):
):
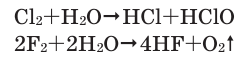
В обычных условиях вода вступает в реакцию с активными металлами (Li, Na, К, Са, Ва и др.). А при высокой температуре она может взаимодействовать с большинством малоактивных металлов (Mg, Zn, Fe и др.). Например:
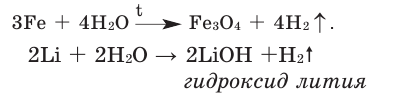
Влейте в пробирку немного воды и добавьте несколько капель фенолфталеина. Затем прикрепите пробирку к рукоятке штатива. Добавьте в воду бензин и опустите в эту смесь кусок металла натрия. Что вы наблюдаете? Напишите уравнение реакции. В чём причина изменения цвета воды и не смешивания бензина с водой?
Из металлов вода ни при каких условиях не вступает в реакцию с Сu, Hg, Ag, Pt, Аu.

Проблема загрязнения водных бассейнов
Без воды нет жизни. При потере живыми организмами 10-20% воды они погибают. Для нормальной жизненной деятельности в течение суток человеку требуется до 2 л воды (рис.1).

Вода является жизненной средой для тысяч растений и животных. Стабильность сохранения кислорода в атмосфере также связана с выделением его зелеными растениями в результате реакции фотосинтеза, протекающей с помощью воды.
Несмотря на то, что примерно 70% земной поверхности покрыто водой, с каждым годом все более обостряется проблема нехватки воды (рис.2). Это связано с употреблением людьми и всеми живыми существами лишь пресной воды. Большая же часть природных вод (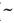 98%) соленая. Это непригодные для употребления морские и океанские воды. Большое количество запасов пресной воды сосредоточено в ледниках Арктики и Антарктиды, в недоступном для большинства людей озере Байкал и других озерах.
98%) соленая. Это непригодные для употребления морские и океанские воды. Большое количество запасов пресной воды сосредоточено в ледниках Арктики и Антарктиды, в недоступном для большинства людей озере Байкал и других озерах.

В сельском хозяйстве, городах, в сферах быта и промышленности потребность в воде все более возрастает. С каждым годом потребность в пресной воде ощущается все острее. В настоящее время 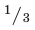 населения мира нуждается в питьевой воде. Если загрязнение атмосферы и земли представляет собой потенциальную опасность для человека, то загрязнение гидросферы - ежедневную опасность. Так как вода является растворителем, все отходы, смешавшись с водой, с легкостью в массовом порядке отравляют всех живых обитателей окружающей среды. Вследствие круговорота воды в природе и ее течения отравляющие вещества распространяются на большие территории. Особенно быстро это происходит благодаря рекам (до 100 км).
населения мира нуждается в питьевой воде. Если загрязнение атмосферы и земли представляет собой потенциальную опасность для человека, то загрязнение гидросферы - ежедневную опасность. Так как вода является растворителем, все отходы, смешавшись с водой, с легкостью в массовом порядке отравляют всех живых обитателей окружающей среды. Вследствие круговорота воды в природе и ее течения отравляющие вещества распространяются на большие территории. Особенно быстро это происходит благодаря рекам (до 100 км).
Загрязнение воды приводит к уменьшению количества растворенного в ней кислорода. Нехватка же кислорода затрудняет жизнедеятельность обитающих в воде растений и животных, нарушается нормальный ход биохимических процессов (рис.3).

Более всего вреда от загрязнения наносится источникам пресной воды, т.к. в быту, технике и сельском хозяйстве используются воды рек и пресных озер.
Промышленные отходы наряду с нарушением нормальной жизнедеятельности гидрофауны, меняют физико-химические свойства вод водоемов. Такие воды непригодны не только для питья, но и для оросительных и технических целей в сельском хозяйстве. Употребление людьми ряда живых организмов, приспособленных к условиям жизни в загрязненной воде (улитки, рыбы, водоросли и др.), приводит к возникновению все новых и новых болезней. Ряд канцерогенных веществ , постепенно накапливаясь в организмах живых обитателей воды, становятся опасными для жизни людей.
, постепенно накапливаясь в организмах живых обитателей воды, становятся опасными для жизни людей.
Загрязнение природных вод нефтью и нефтепродуктами чревато еще более тяжелыми последствиями (рис.4). Нефть является сильным ядом для всех обитателей воды (кроме некоторых бактерий).

 Канцерогенные вещества — это вещества, которые, накапливаясь в живых организмах, вызывают раковую болезнь
Канцерогенные вещества — это вещества, которые, накапливаясь в живых организмах, вызывают раковую болезнь
Попав в воду, нефть разливается по ее поверхности, образуя тонкую пленку, и тем самым закрывая доступ кислорода в воду из воздуха и затрудняя дыхание живым организмам. Одна капля нефти покрывает пленкой 1,5-2  водной поверхности. Было установлено, что ежегодно в мире сливается в гидросферу 12-15 миллионов тонн нефти.
водной поверхности. Было установлено, что ежегодно в мире сливается в гидросферу 12-15 миллионов тонн нефти.
Основными источниками загрязнения нефтью морей и океанов являются транспортирующие нефть танкеры, морские нефтяные залежи, нефтеперерабатывающие заводы, смазочные масла морских судов и лодок. Сегодня имеются такие участки мировых океанов и морей, где невозможно заниматься ловлей рыбы. В некоторых морях (например, в Средиземном море) выловленную рыбу и других морских животных невозможно употреблять в пищу из-за резкого запаха нефти.
Для очистки сточных вод применяются в последовательном порядке механический, физико-химический и биологический методы.
В настоящее время самым эффективным и современным методом обезвреживания воды считается очистка с использованием атомарного кислорода. При данном методе молекулы кислорода в специальном устройстве превращаются в атомы, которые уничтожают имеющиеся в воде бактерии, водоросли, плесневые грибки и вирусы. Таким образом обеспечивается охрана открытых водоемов от загрязнения. Атомарный кислород также легко окисляет многие органические и неорганические соединения, превращая их в безвредные вещества.
Что такое вода и из чего она состоит
Каждый из вас, услышав слово «раствор», наверное, представит себе прозрачную жидкость — бесцветную или окрашенную, а также вспомнит о воде, которая входит в состав многих растворов.
Почему вода растворяет то или иное вещество? Существует ли связь между способностью вещества растворяться и его строением? Что происходит при образовании раствора? Ответы на эти и другие вопросы вы найдете, внимательно прочитав эту страницу. Узнаете и о том, какие частицы существуют в растворах, поймете суть химических реакций с участием растворенных веществ. Кроме того, вы научитесь готовить растворы и проводить соответствующие вычисления.
Вода — наиболее распространенное соединение на нашей планете. Она покрывает свыше 2/3 поверхности Земли (рис. 1).
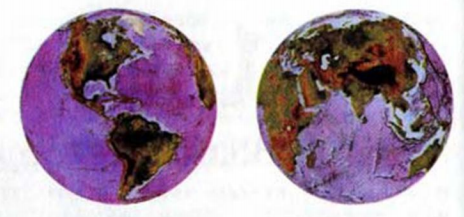
Рис. 1. Вода на поверхности Земли
Приблизительно 97 % всей воды находится в морях и океанах. Такая вода содержит многие растворенные вещества. На пресную воду приходится 3 %. Почти вся она сконцентрирована в снегах и льдах Антарктиды, Арктики, регионах с вечной мерзлотой. Реки и озера содержат лишь 0,03 % всей воды, имеющейся на планете. Именно эту воду человек использует для своих потребностей. Поэтому охрана водных ресурсов планеты от загрязнений является одной из важных задач, стоящих перед человечеством (рис. 2).

Рис. 2. Вода — наше богатство
Вода в незначительном количестве содержится в атмосфере, причем — в трех агрегатных состояниях: газообразном (водяной пар обуславливает влажность воздуха), жидком и твердом (туман, облака). Атмосферные осадки (дождь, снег), выпадая на земную поверхность, захватывают с собой пыль, некоторые растворившиеся газы и тем самым очищают воздух.
Вода содержится и в твердой оболочке планеты — литосфере, причем как в «свободном» состоянии (подземные воды), так и в «химически связанном» — в составе различных природных соединений и минералов.
Массовая доля воды в живых организмах составляет от 50 до 99 %, а в организме взрослого человека — около 65 %.
Природная вода всегда содержит примеси. Сравнительно чистую воду получают перегонкой. Ее называют дистиллированной и используют в научных исследованиях, некоторых производствах, для приготовления лекарств.
Строение молекулы воды
Химическая формула воды 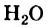 известна каждому из вас. Это — молекулярное вещество. Электронная и графическая формулы молекулы воды указывают на то, что два атома Гидрогена соединены с атомом Оксигена простыми ковалентными связями.
известна каждому из вас. Это — молекулярное вещество. Электронная и графическая формулы молекулы воды указывают на то, что два атома Гидрогена соединены с атомом Оксигена простыми ковалентными связями.

Обратим внимание на строение атомов Гидрогена и Оксигена (их электронные формулы вы составляли в 8 классе):
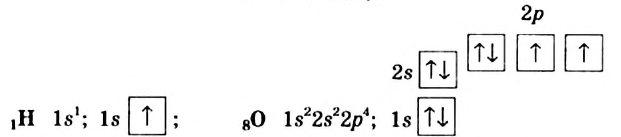
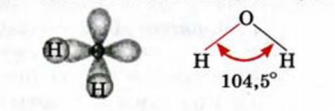
Каждая связь в молекуле воды образована s-электроном атома Гидрогена и одним р-электроном атома Оксигена. Два р-электрона атома Оксигена, участвующие в этих связях, являются неспаренными и находятся в разных орбиталях. Поскольку р-орбитали расположены перпендикулярно друг другу, молекула воды имеет угловое строение (Такое объяснение строения молекулы воды является упрощенным).. Правда, угол между прямыми, соединяющими центры атомов Гидрогена и Оксигена, составляет не 90°, а 104,5°:
На рисунке 3 изображены две модели молекулы воды. В шаростержневой модели стержни имитируют простые ковалентные связи между атомами, а в масштабной модели соблюдено соотношение размеров атомов и молекулы.
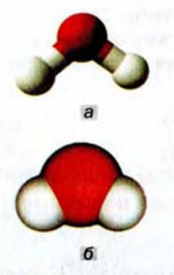
Рис. 3. Модели молекулы воды: а — шаро-стержневая; б — масштабная. Белые шарики — атомы Гидрогена, красные — атомы Оксигена
Поскольку Оксиген — более электроотрицательный элемент, чем Гидроген, то общие электронные пары смещены от двух атомов Гидрогена к атому Оксигена. Связи О-Н являются полярными. На атоме Оксигена сосредоточен небольшой отрицательный заряд, а на каждом из двух атомов Гидрогена — положительный:
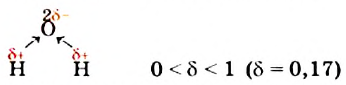
Итак, молекула воды со стороны атома Оксигена заряжена отрицательно, а с противоположной стороны, где размещены атомы Гидрогена, — положительно. Такую молекулу называют полярной; она является диполем (Термин происходит от греч. di(s) — дважды и polos — полюс), т. е. имеет два разноименно заряженных полюса. Ее условно изображают эллипсом, в который вписаны знаки « + » и « - » без указания величин зарядов:

Полярность молекулы воды существенно влияет на свойства этого вещества.
Водородная связь. Молекулы-диполи воды могут притягиваться друг к другу, а именно, атом 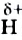 одной молекулы воды — к атому
одной молекулы воды — к атому 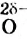 другой.
другой.
Электростатическое взаимодействие между молекулами с участием атомов Гидрогена называют водородной связью.
Водородную связь принято обозначать тремя точками:  . Эта связь значительно слабее ковалентной. Обязательное условие ее образования — наличие в молекуле атома Гидрогена, соединенного с атомом одного из наиболее электроотрицательных элементов (Флуора, Оксигена, Нитрогена).
. Эта связь значительно слабее ковалентной. Обязательное условие ее образования — наличие в молекуле атома Гидрогена, соединенного с атомом одного из наиболее электроотрицательных элементов (Флуора, Оксигена, Нитрогена).
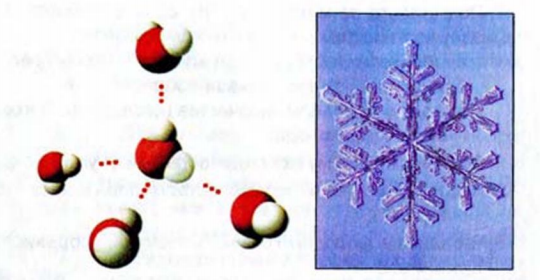
Рис. 4. Рис . 5.
Водородные связи Снежинка
Водородные связи существуют и в жидкой воде, и во льду. Каждая молекула воды соединена водородными связями с четырьмя другими (рис. 4). Это является причиной характерной формы снежинок (рис. 5). В жидкой воде часть водородных связей постоянно разрушается, но одновременно образуются новые связи.
Выводы:
Вода — одно из наиболее распространенных в природе соединений. Ее молекула содержит ковалентные полярные связи О-Н, имеет угловую форму и является полярной. На каждом атоме Гидрогена молекулы воды сосредоточен небольшой положительный заряд, а на атоме Оксигена — небольшой отрицательный заряд.
Молекулы воды притягиваются друг к другу вследствие электростатического взаимодействия между атомами Гидрогена и Оксигена разных молекул. Такое взаимодействие называют водородной связью.
Физические свойства воды
Каждому известно, что вода — бесцветная жидкость без вкуса и запаха, которая замерзает при температуре О °С, а закипает при 100 °С (при давлении 760 мм рт. ст.). Вода имеет плотность 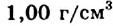 (при 4 °С), незначительную теплопроводность, почти не проводит электрический ток.
(при 4 °С), незначительную теплопроводность, почти не проводит электрический ток.
Температуры плавления льда и кипения воды значительно выше, чем, например, метана 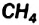 — сходного по составу соединения, молекула которого имеет почти такую же массу, что и молекула
— сходного по составу соединения, молекула которого имеет почти такую же массу, что и молекула 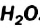 . Причина — наличие водородных связей между молекулами воды (Водородные связи между молекулами метана СН4 не образуются, поскольку ковалентная связь С-Н почти неполярна. Поэтому в обычных условиях метан является газом. Он превращается в жидкость при охлаждении до -164 °С при нормальном давлении)1. Чтобы разрушить эти связи, нужно израсходовать энергию, т. е. нагреть вещество.
. Причина — наличие водородных связей между молекулами воды (Водородные связи между молекулами метана СН4 не образуются, поскольку ковалентная связь С-Н почти неполярна. Поэтому в обычных условиях метан является газом. Он превращается в жидкость при охлаждении до -164 °С при нормальном давлении)1. Чтобы разрушить эти связи, нужно израсходовать энергию, т. е. нагреть вещество.
Лед немного легче воды; его плотность составляет 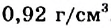 . (Другие вещества в твердом состоянии имеют большую плотность, чем в жидком.) Все молекулы во льду соединены водородными связями (§ 1). Это вещество имеет ажурную структуру со многими пустотами. При плавлении льда некоторые водородные связи разрываются, и «освободившиеся» молекулы воды заполняют пустоты. Вследствие этого вещество «уплотняется».
. (Другие вещества в твердом состоянии имеют большую плотность, чем в жидком.) Все молекулы во льду соединены водородными связями (§ 1). Это вещество имеет ажурную структуру со многими пустотами. При плавлении льда некоторые водородные связи разрываются, и «освободившиеся» молекулы воды заполняют пустоты. Вследствие этого вещество «уплотняется».

Рис. 6. В реке, покрытой льдом, жизнь продолжается
Лед не тонет в воде, и зимой водоемы обычно не промерзают до дна. Это спасает рыбу, других обитателей рек и озер от гибели (рис. 6).
Химические свойства воды
Вода проявляет достаточную химическую активность. Она реагирует со многими веществами — и простыми, и сложными.
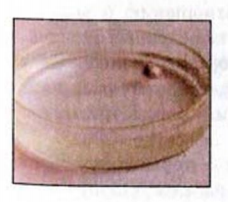
Рис. 7. Реакция натрия с водой
Реакции с простыми веществами и водой
Вам известно, что вода взаимодействует с наиболее активными металлами — щелочными (рис. 7) и щелочноземельными. Продуктами каждой реакции является основание (щелочь) и водород:
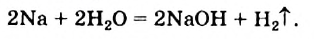
С магнием вода реагирует при нагревании.
С водой взаимодействуют и некоторые менее активные металлы, но при достаточно высокой температуре (реагентом является водяной пар). При этом вместо гндроксидов металлических элементов образуются оксиды:
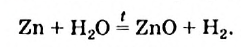
Вода реагирует и с некоторыми неметаллами. Взаимодействием водяного пара с раскаленным углем получают смесь газов, которую используют как топливо:
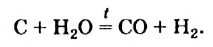
Реакции со сложными веществами и водой
Среди соединений, с которыми реагирует вода, — немало оксидов и солей.
Вода взаимодействует с некоторыми основными оксидами и почти со всеми кислотными. Такие химические превращения вы изучали в 8 классе. Все они являются реакциями соединения. Кислотные оксиды, взаимодействуя с водой, образуют соответствующие оксигенсо-держащие кислоты, а оксиды щелочных и щелочноземельных элементов — основания (щелочи):
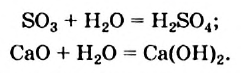
Из известных вам кислотных оксидов лишь один не вступает в реакцию с водой; его формула — 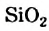 . Инертны по отношению к воде все амфотерные оксиды и многие основные оксиды.
. Инертны по отношению к воде все амфотерные оксиды и многие основные оксиды.
Вода реагирует с некоторыми солями. Часть этих химических превращений, которые являются реакциями соединения, рассмотрим в следующем параграфе.
Это интересно. Водяной пар в особых условиях реагирует с несолеобразующим оксидом СО:
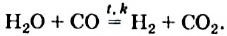
Разложение воды
Вода — термически устойчивое вещество. Ее молекулы начинают разрушаться при очень высокой температуре. При 2500 °С разлагается приблизительно 11 % всех молекул, а при 1000 °С — лишь 0,03 %. Продукты разложения воды — водород и кислород:
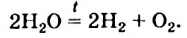
Воду можно разложить и с помощью электрического тока.

Рис. 8. Разложение воды постоянным электрическим током
Выводы:
Вода при обычных условиях — бесцветная жидкость с плотностью 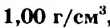 , не имеющая вкуса и запаха, которая кипит при 100 °С и замерзает при О °С. Лед немного легче воды.
, не имеющая вкуса и запаха, которая кипит при 100 °С и замерзает при О °С. Лед немного легче воды.
Вода взаимодействует со щелочными и щелочноземельными металлами, оксидами щелочных и щелочноземельных элементов, кислотными оксидами. При очень высокой температуре или действии постоянного электрического тока вода разлагается на водород и кислород.
Кристаллогидраты
Вода вступает в реакции соединения с некоторыми солями. При этом образуются вещества (тоже — соли), которые, кроме соответствующих катионов и анионов, содержат молекулы воды.
ЛАБОРАТОРНЫЙ ОПЫТ № 1
Реакция купрум(II) сульфата с водой
В маленькую фарфоровую чашку поместите немного порошка купрум(II) сульфата (соединение белого цвета) и добавьте несколько капель воды. Что наблюдаете?
Добавляйте к веществу воду (небольшими порциями) при перемешивании до его полного растворения.
Поставьте фарфоровую чашку на кольцо лабораторного штатива, зажгите спиртовку и осторожно выпаривайте из раствора воду до появления мелких голубых кристаллов.
Выпаривание можно проводить на предметном стекле. Необходимо нанести на него 2—3 капли раствора и держать стекло над пламенем.
В этом опыте купрум(II) сульфат превращается в новое вещество. Его химическая формула — 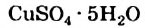 (читается «купрум-эс-о-четыре-на-пять-аш-два-о»). Тривиальное название соединения — медный купорос (Соединение применяют в сельском хозяйстве для борьбы с вредителями и болезнями растений), а химическое — купрум(II) сульфат, пентагидрат. В названиях таких веществ к слову «гидрат» добавляют приставку, которая происходит от греческого названия числа: моно- (1), ди- (2), три- (3), тетра-(4), пента- (5), гекса- (6), гейта- (7), окта- (8), нона- (9), дека- (10) и т. д. Приставка «нона» происходит от латинского названия числа.Точка в химической формуле означает, что медный купорос является соединением купрум(II) сульфата и воды, а не смесью этих веществ и не водным раствором купрум(II) сульфата. В соединении на каждую пару ионов —
(читается «купрум-эс-о-четыре-на-пять-аш-два-о»). Тривиальное название соединения — медный купорос (Соединение применяют в сельском хозяйстве для борьбы с вредителями и болезнями растений), а химическое — купрум(II) сульфат, пентагидрат. В названиях таких веществ к слову «гидрат» добавляют приставку, которая происходит от греческого названия числа: моно- (1), ди- (2), три- (3), тетра-(4), пента- (5), гекса- (6), гейта- (7), окта- (8), нона- (9), дека- (10) и т. д. Приставка «нона» происходит от латинского названия числа.Точка в химической формуле означает, что медный купорос является соединением купрум(II) сульфата и воды, а не смесью этих веществ и не водным раствором купрум(II) сульфата. В соединении на каждую пару ионов — 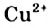 и
и 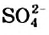 — приходится 5 молекул воды.
— приходится 5 молекул воды.
Уравнение реакции образования медного купороса:
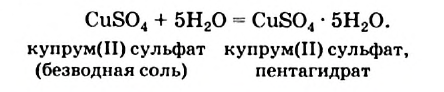
Кристаллические вещества, в состав которых входят молекулы воды, называют кристаллогидратами.
Рис. 9. Природные кристаллы гипса
Известно много кристаллогидратов. Среди Кристаллогидрат них — гипс 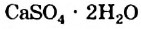 (рис. 9), железный купорос
(рис. 9), железный купорос 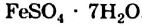 , горькая соль
, горькая соль 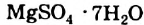 , кристаллическая сода
, кристаллическая сода 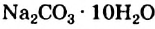 .
.
Воду, которая содержится в кристаллогидратах, называют кристаллизационной.
Часто кристаллогидраты и соответствующие безводные соединения имеют различную окраску (рис. 10).

Рис. 10. Некоторые кристаллогидраты и безводные соли
При нагревании кристаллогидраты разлагаются с выделением воды:
Решение задач на тему: Вода
При использовании кристаллогидратов нередко возникает потребность в различных расчетах.
Пример №5
Найти массовую долю воды в медном купоросе.
Дано: 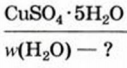
Решение:
1-й способ
1. Вычисляем молярную массу медного купороса:
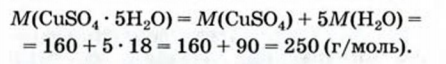
2. Составляем пропорцию и находим массовую долю воды в кристаллогидрате:
250 г (масса 1 моль кристаллогидрата) - 1 (или 100%),
90 г (масса 5 моль воды) - х;
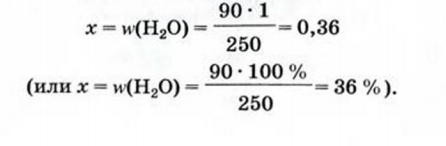
2-й способ
1. Вычисляем молярную массу медного купороса:
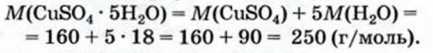
2. Находим массовую долю воды в криллогидрате по соотвутствующей формуле:
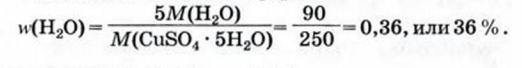
Ответ: 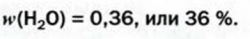
Пример №6
Какие массы кристаллизационной воды и безводной соли содержатся в 25 г медного купороса?
Дано: 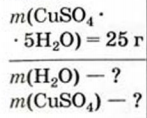
Решение
1-й способ
1. Вычислив молярную массу медного купороса (см. задачу 1), находим массу кристаллизационной воды:
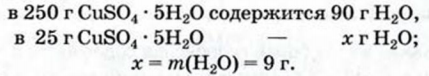
2. Рассчитываем массу безводной соли:
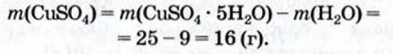
2-й способ
1. Вычисляем количество вещества кристаллогидрата:
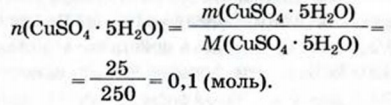
2. Находим количество вещества кристаллизационной воды в 0.1 моль кристаллогидрата:
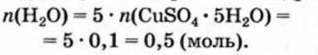
3. Рассчитываем массу кристаллизационной воды:
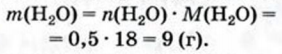
4. Вычисляем массу безводной соли:
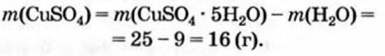
Ответ: 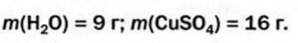
Выводы:
Кристаллические вещества, в состав которых входят молекулы воды, называют кристаллогидратами. При нагревании они разлагаются с образованием безводных соединений и воды.
Вода и растворы
Что общего у воздуха, морской воды, нефти, гранита, молока, ювелирного сплава, зубной пасты? Это — смеси веществ.
Вам известно, что смеси бывают однородными и неоднородными.
В неоднородной смеси можно увидеть невооруженным глазом или с помощью микроскопа твердые частицы, капельки отдельных веществ, пузырьки газов. Некоторые смеси этого типа имеют общие названия.
Неоднородную смесь жидкости и газа называют пеной. Она образуется, например, когда в стакан наливают из бутылки газированный напиток.
Хорошо взболтанную смесь двух жидкостей, которые не растворяются друг в друге, называют эмульсией. Примером эмульсии является молоко; его главные компоненты — вода и жидкие жиры.
Если перемешать жидкость с нерастворимым в ней, хорошо измельченным твердым веществом, получим суспензию. Суспензиями являются смеси воды с порошком мела, мукой, некоторые лекарственные препараты.
Растворы:
Однородные смеси отличаются от неоднородных тем, что в них равномерно распределены мельчайшие частицы веществ — атомы, молекулы, ионы. Эти частицы нельзя обнаружить даже с помощью мощного микроскопа.
Однородные смеси веществ называют растворами.
Наверное, каждый из вас полагает, что раствор — это жидкость. Но, кроме жидких растворов, существуют твердые и газообразные растворы (рис. 11).

Рис. 11. Растворы (однородные смеси): а — водный раствор  ; б — воздух; в — сплав меди и алюминия
; б — воздух; в — сплав меди и алюминия
Раствор содержит по меньшей мере два вещества. Это — его компоненты. Один из них называют растворителем, а остальные — растворенными веществами. Растворителем считают вещество, которое находится в таком же агрегатном состоянии, что и раствор.
Если агрегатное состояние всех веществ, образовавших раствор, одинаково, то растворителем считают вещество, масса которого наибольшая. Правда, для водных растворов существует традиция именно воду называть растворителем.
Вода растворяет многие вещества; это — лучший растворитель.
Различают концентрированные и разбавленные растворы. Разбавленный раствор содержит значительно больше растворителя, чем растворенного вещества, а концентрированный — наоборот.
Свойства раствора отличаются от свойств его компонентов. Например, водный раствор поваренной соли замерзает при температуре несколько ниже О °С, закипает при температуре, превышающей 100 °С, и, в отличие от воды и кристаллов натрий хлорида, хорошо проводит электрический ток.
Образование раствора:
Процесс образования раствора часто сопровождается не только физическими явлениями, но и химическими.
Рассмотрим, как происходит растворение в воде ионного вещества. При попадании кристалла такого вещества в воду к каждому иону, находящемуся на его поверхности, притягиваются молекулы воды своими противоположно заряженными частями (рис. 12). Если силы такого взаимодействия преобладают над силами притяжения между катионами и анионами в кристалле, ионы постепенно отделяются друг от друга и переходят в воду. Кристалл растворяется. В образовавшемся растворе находятся ионы растворенного вещества, соединенные с молекулами воды. Такие частицы называют гидратированными. Растворение натрий хлорида в воде можно проиллюстрировать такой схемой:
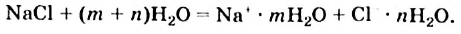
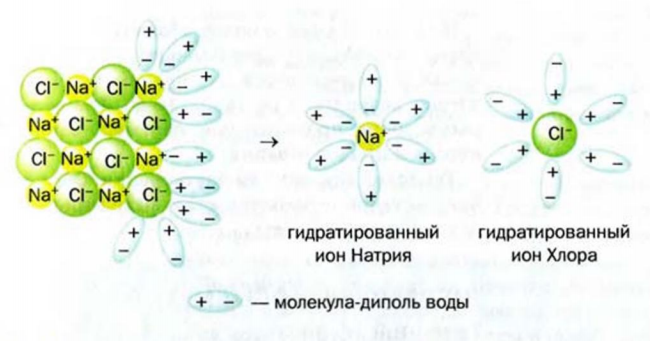
Рис. 12. Растворение ионного кристалла в воде
Образование гидратированных ионов обуславливает существование кристаллогидратов.
Растворение молекулярных веществ в воде может происходить по-разному. Если, например, молекулы кислорода, спирта, сахара, попадая в воду, остаются неизменными, то молекулы хлороводорода, сульфатной кислоты распадаются на ионы (§ 8). А растворение углекислого газа в воде сопровождается химической реакцией — образованием карбонатной кислоты. Правда, с водой реагирует лишь незначительная часть карбон(IV) оксида.
Процесс образования водного раствора можно разделить на три стадии:
- Взаимодействие частиц вещества и молекул воды.
- Отделение частиц вещества (молекул, ионов) друг от друга под действием молекул воды.
- Взаимная диффузия вещества и воды, т. е. проникновение частиц одного вещества между частицами другого (рис. 13).
При растворении газа в воде вторая стадия отсутствует.

Рис. 13. Диффузия окрашенных ионов  в воде при растворении калий перманганата
в воде при растворении калий перманганата
Для того чтобы твердое вещество растворялось быстрее, его измельчают, увеличивая таким образом поверхность будущего контакта частиц вещества с растворителем. Кроме того, растворение проводят при перемешивании, а иногда и при нагревании.
Тепловой эффект при растворении:
Образование раствора сопровождается выделением или поглощением теплоты.
ЛАБОРАТОРНЫЙ ОПЫТ № 2
Тепловой эффект при растворении вещества
В пробирку поместите приблизительно 1/2 чайной ложки натрий нитрата и добавьте 5 мл воды. Содержимое пробирки перемешивайте стеклянной палочкой для ускорения процесса растворения. Прикоснитесь рукой ко дну пробирки. Что ощущаете?
Появление теплового эффекта при растворении можно объяснить следующим образом. Взаимодействие частиц вещества и молекул воды (это — первая стадия растворения) происходит с выделением теплоты, а разъединение молекул или ионов вещества (вторая стадия растворения) — с поглощением теплоты. Если на первой стадии растворения выделяется больше теплоты, чем ее поглощается на второй, то происходит разогревание раствора. А если наоборот — раствор охлаждается.
Смешав спирт или сульфатную кислоту с водой, мы зафиксируем повышение температуры раствора (во втором случае — очень сильное). Причина состоит в том, что на второй стадии растворения этих веществ поглощается мало теплоты, так как взаимодействие между молекулами спирта или кислоты является довольно слабым.

Рис. 14. Правильное приготовление разбавленного раствора сульфатной кислоты
Существует правило приготовления разбавленного раствора сульфатной кислоты из концентрированного. Концентрированный раствор добавляют в воду (рис. 14), причем медленно, небольшими порциями, постоянно перемешивая и охлаждая сосуд водопроводной водой. Если же добавлять воду в концентрированную кислоту, то образующийся раствор может даже закипеть, а брызги кислоты — попасть на кожу и вызвать сильные ожоги.
Иногда при образовании раствора обнаружить тепловой эффект не удается (например, при растворении поваренной соли в воде). На самом деле он есть, но незначительный.
Коллоидные растворы:
Водные растворы крахмала и натрий хлорида внешне не отличаются друг от друга, они бесцветны и прозрачны. Но если на каждый раствор направить пучок света, то лишь в растворе крахмала мы увидим его «путь» (рис. 15).

Рис. 15. Прохождение света через раствор крахмала
Свет рассеивают очень большие молекулы этого вещества; каждая из них содержит тысячи соединенных атомов (О крахмале пойдет речь в § 31). Подобное явление наблюдается при прохождении солнечных лучей сквозь туман (рис. 16) или запыленный воздух. В первом случае свет отражают мелкие капельки воды, во втором — пылинки.

Рис. 16. Солнечные лучи в лесу
Растворы, содержащие большие частицы растворенных веществ, скопления многих атомов или молекул, называют коллоидными, а те, в которых находятся мельчайшие частицы веществ (отдельные атомы, молекулы, ионы), — истинными.
Это интересно. Размер молекулы воды - 0,25 нм.
Размеры частиц растворенных веществ в коллоидных растворах составляют от 1 до 100 нм (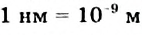 ), тогда как в истинных растворах они не превышают 1 нм.
), тогда как в истинных растворах они не превышают 1 нм.
Коллоидные растворы довольно устойчивы; частицы растворенных веществ в них длительное время не оседают. Одна из причин этого — наличие на их поверхности одноименных зарядов (частицы отталкиваются друг от друга и не «слипаются»). Вызвать осаждение частиц можно нагреванием коллоидного раствора или растворением в нем какой-либо соли (например, натрий хлорида).
Коллоидные растворы очень распространены в живой природе. Ими являются кровь, плазма крови, межклеточные жидкости, соки растений.
Общее научное название неоднородных смесей и коллоидных растворов — дисперсные системы.
Значение растворов:
Вещества, растворяясь в природной воде, «путешествуют» по планете, попадают на земную поверхность, участвуют в химических реакциях с образованием минералов, компонентов почвы. Растворы поступают в растения через корни и листву, а в организмы животных и человека — вместе с пищевыми продуктами, поставляя необходимые вещества.
Химические реакции в живых организмах протекают только в водных растворах (в основном, — коллоидных). В процессе пищеварения принимают участие слюна, желудочный сок, желчь. Вместе с мочой и потом из организма выводятся продукты жизнедеятельности, а иногда — и токсичные вещества.
Вода, которую мы пьем, в действительности является очень разбавленным раствором. В ней растворены ничтожно малые количества различных веществ, которые придают воде едва ощутимый вкус. Пить только чистую (дистиллированную) воду нельзя, так как организм не будет получать некоторые элементы и из него будут «вымываться» нужные вещества. При наличии в природной воде некоторых веществ и ионов она может иметь лечебные свойства, восстанавливать солевой баланс в организме. Жидкие лекарства в основном являются водными растворами.
Живые существа дышат кислородом, входящим в состав воздуха. А воздух — это природный газовый раствор. Если бы мы дышали чистым кислородом, то процессы окисления в организме происходили очень интенсивно, а этого наш организм не выдержал бы.
Без растворов не могут работать металлургические и химические заводы, предприятия легкой и пищевой промышленности, бытового обслуживания, медицинские учреждения.
Выводы:
Смеси веществ бывают однородными и неоднородными. В однородных смесях (растворах) равномерно распределены атомы, молекулы или ионы веществ.
При образовании раствора происходят физические и химические явления. Химические явления обусловлены взаимодействием частиц растворенного вещества и растворителя.
Процесс растворения вещества сопровождается выделением или поглощением теплоты.
Коллоидные растворы отличаются от обычных (истинных) тем, что содержат очень большие молекулы или скопления частиц растворенного вещества.
Растворимость веществ в воде
Характеризуя физические свойства какого-либо вещества, обычно указывают, растворяется ли оно в воде, спирте, других растворителях.
Свойство вещества образовывать с другим веществом раствор называют растворимостью.
Сульфатная и нитратная кислоты, этиловый спирт, ацетон смешиваются с водой в любых соотношениях с образованием растворов. Эти вещества имеют неограниченную растворимость в воде. Но для многих других веществ существует предел растворения.
ЛАБОРАТОРНЫЙ ОПЫТ № 3
Обнаружение ограниченной растворимости вещества в воде
Налейте в пробирку 2 мл воды и растворяйте в ней калий нитрат небольшими порциями при перемешивании стеклянной палочкой. Каждую порцию вещества добавляйте после полного растворения предыдущей. Зафиксируйте момент, когда растворение соли прекращается.
Оставьте пробирку со смесью веществ для следующего опыта.
Раствор, в котором при данных условиях вещество больше не растворяется, называют насыщенным (рис. 17), а тот, в котором еще можно растворить определенную порцию вещества, — ненасыщенным.

Рис. 17. Насыщенный раствор калий бромата 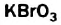 в воде
в воде
Растворимость большинства веществ можно оценить количественно. Для этого указывают максимальную массу вещества, которая может раствориться в 100 г растворителя при определенной температуре. Для газа обычно указывают его максимальный объем, растворяющийся в 100 г или 1 л растворителя при определенных температуре и давлении. Соответствующую физическую величину принято обозначать буквой S (от латинского слова solvere — растворять).
Веществ, абсолютно нерастворимых в воде, не существует. Если в серебряный сосуд налить воды, то ничтожное количество металла со временем растворится. Полученная «серебряная» вода имеет антимикробные свойства и, в отличие от обычной, может храниться неограниченное время.
Способность вещества растворяться в воде зависит от его строения, т. е. от типа частиц, из которых состоит вещество, а также от внешних условий — температуры, давления.
Зависимость растворимости веществ от их строения. Большинство ионных веществ хорошо растворяется в воде. Таким свойством обладают и вещества, которые, как и вода, состоят из полярных молекул. Вещества с неполярными молекулами, например азот 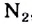 , метан
, метан 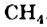 , имеют небольшую растворимость в воде либо нерастворимы в ней. Со времен алхимиков существует правило: подобное растворяется в подобном. Это правило используют и сейчас, хотя известны исключения из него.
, имеют небольшую растворимость в воде либо нерастворимы в ней. Со времен алхимиков существует правило: подобное растворяется в подобном. Это правило используют и сейчас, хотя известны исключения из него.
Зависимость растворимости веществ от температуры. Влияние температуры на растворимость вещества большей частью определяется его агрегатным состоянием.
Если в стакан налить холодной водопроводной воды и оставить в теплом месте, то спустя некоторое время на его стенках появятся пузырьки воздуха, который был растворен в воде (рис. 18). В теплой воде растворимость газов меньше, и «лишний» воздух выделяется из нее.
Растворимость газов в воде с повышением температуры уменьшается.
Определим с помощью эксперимента, как влияет температура на растворимость твердого вещества в воде.
ЛАБОРАТОРНЫЙ ОПЫТ № 4
Влияние температуры на растворимость твердого вещества
Осторожно нагревайте пробирку со смесью калий нитрата и его насыщенного раствора (эта смесь осталась после лабораторного опыта № 3). Содержимое пробирки периодически перемешивайте. Что наблюдаете?
Сделайте вывод относительно влияния температуры на растворимость калий нитрата в воде.

Рис. 18. Выделение пузырьков растворенного воздуха из нагретой водопроводной воды
Растворимость большинства твердых веществ в воде с повышением температуры увеличивается.
Некоторые соединения, в частности кальций гидроксид 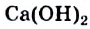 , кальций сульфат
, кальций сульфат 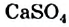 , литий сульфат
, литий сульфат 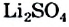 , при нагревании уменьшают свою растворимость в воде.
, при нагревании уменьшают свою растворимость в воде.
Зависимость растворимости вещества от температуры часто представляют графически — в виде кривой растворимости (рис. 19). На горизонтальной оси такого графика обозначают температуру, а на вертикальной — растворимость, т.е. максимальную массу вещества, которая растворяется при данной температуре в 100 г воды.
Точки на кривой растворимости отвечают составу насыщенных растворов, а область под кривой — ненасыщенным растворам.
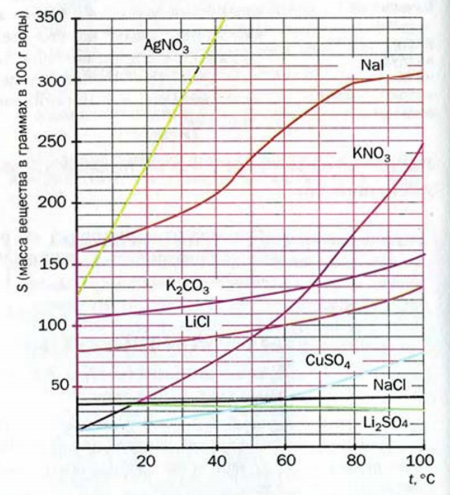
Рис. 19. Кривые растворимости некоторых солей в воде
Зависимость растворимости газов от давления:
Если открыть бутылку с газированным напитком, то углекислый газ, который был растворен в жидкости при повышенном давлении, начнет из нее быстро выделяться; жидкость вспенивается. Причина этого состоит в том, что раствор попадает в условия обычного давления, при котором растворимость газа намного меньше.
Растворимость газов и воде с повышением давления увеличивается.
Растворимость большинства газов в воде прямо пропорциональна давлению; соответствующий график является прямой линией. Если давление увеличить в несколько раз, то растворимость газа в воде возрастет во столько же раз (рис. 20).
Рис. 20. Влияние давления на растворимость газа в воде
На растворимость в воде твердых и жидких веществ давление не влияет.
Выводы:
Свойство вещества образовывать с другим веществом раствор называют растворимостью.
Большинство веществ имеет ограниченную растворимость в воле. Ее выражают максимальной массой вещества, которая может раствориться при определенной температуре (для газов — еще и при определенном давлении) в 100 г воды. Раствор, в котором содержится максимально возможное количество растворенного вещества, называют насыщенным.
Растворимость большинства твердых веществ в воде с повышением температуры возрастает, а от давления не зависит. Газы увеличивают растворимость в воде с понижением температуры и повышением давления.
ЭКСПЕРИМЕНТ:
Выращивание кристаллов медного купороса
Приготовьте насыщенный раствор медного купороса. Для этого насыпьте в стеклянный сосуд чайную ложку соединения и доливайте небольшими порциями, постоянно перемешивая, горячую воду до растворения кристаллов. В случае необходимости горячий раствор профильтруйте. Накройте сосуд листом бумаги и оставьте раствор охпаждаться до комнатной температуры.
Рис. 21. Выращивание кристалла медного купороса из насыщенного раствора
На следующий день вы увидите на дне сосуда кристаллы вещества: над ними будет насыщенный раствор. Достаньте пластмассовым пинцетом кристалл правильной формы, без дефектов, и положите его на бумагу. Слейте насыщенный раствор с оставшихся кристаллов в другой сосуд и осторожно положите на дно этого сосуда отобранный кристалл. Его можно подвесить на тонкой нити (рис. 21). Сосуд ничем не накрывайте и оставьте на несколько дней.
Вода будет постепенно испаряться из насыщенного раствора, на дне стакана появятся новые кристаллы вещества и вырастет тот. который был помещен в раствор. Удаляя мелкие кристаллы и переворачивая отобранный на разные грани для равномерного роста (делайте это с интервалом в несколько дней), можно вырастить красивый кристалл величиной в несколько сантиметров. Периодически добавляйте в сосуд новые порции холодного насыщенного раствора соединения.
Если мелкие кристаллы из сосуда не удалять, то образуются друзы — группы кристаллов, сросшихся друг с другом (рис. 22).

Рис. 22. Друзы кристаллов различных солей
Можно также выращивать кристаллы алюмокалменых квасцов  .
.
Количественный состав раствора. Массовая доля растворенного вещества
Человек использует в своей жизни много растворов. Среди них — спиртовый раствор иода, водные растворы аммиака и перекиси водорода, столовый уксус и уксусная эссенция (рис. 23). Обратите внимание на этикетки, имеющиеся на бутылках с этими растворами. Вы заметите возле названия растворенного вещества цифру и знак процента (%). Это — значение массовой доли растворенного вещества в растворе. Оно соответствует массе вещества (в граммах), которая содержится в 100 г раствора.

Рис. 23. Водные растворы, используемые в быту
Столовый уксус является водным раствором уксусной кислоты. Согласно этикетке на бутылке, в каждых 100 г уксуса содержится 9 г уксусной кислоты. Массе воды в 100 г уксуса составляет 100 г - 9 г = 91 г.
Если растворителем является водя, то па этикетках обычно не Указывают слова «водный раствор».
Для обозначения массовой доли растворенного вещества в растворе, как и массовой доли элемента в соединении, используют латинскую букву 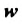 (дубль-ве).
(дубль-ве).
Вам известно, что массовую долю выражают не только в процентах, но и положительным числом, которое меньше единицы.
Формула для вычисления массовой доли растворенного вещества в растворе:
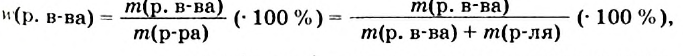
где 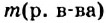 — масса растворенного вещества,
— масса растворенного вещества, 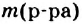 — масса раствора,
— масса раствора, 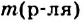 — масса растворителя.
— масса растворителя.
Массовая доля растворенного вещества в растворе отношение массы вещества к массе раствора.
Решение задач на тему: Вода и растворы
В повседневной жизни (например, при консервировании) нередко возникает необходимость приготовить водный раствор с определенной массовой долей растворенного вещества. Для этого обычно используют вещество и воду. Иногда разбавляют водой концентрированный раствор вещества, в частности уксусную эссенцию. В любом случае перед приготовлением раствора проводят необходимые расчеты.
Рассмотрим, как решают задачи на вычисление массовой доли растворенного вещества в растворе, а также задачи, в которых используют эту величину. Один из способов решения основан на составлении пропорции, другой предполагает расчет по соответствующей математической формуле.
Пример №7
В 144 г воды растворили 6 г щелочи. Рассчитать массовую долю щелочи в растворе.
Дано: 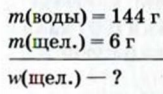
Решение:
1-й способ
1. Находим массу раствора:
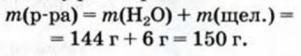
2. Определяем массу щелочи, кооторая содержится в 100 г раствора. Для этого составляем пропорцию и решаем ее:
в 150 г раствора содержится 6 г щелочи,
в 100 г раствора - х г щелочи;
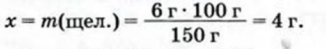
Отсюда 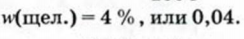
2-й способ
Вычисляем массовую долю щелочи в растворе по соответствующей формуле:
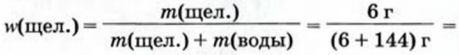 0,04. или 0,04 * 100% = 4 %.
0,04. или 0,04 * 100% = 4 %.
Ответ: 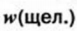 0,04, или 4%.
0,04, или 4%.
Пример №8
Какие массы соли и воды нужно взять для приготовления 400 г раствора соли с массовой долей растворенного вещества 0,2?
Дано: 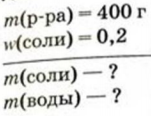
Решение:
1. Вычисляем массу соли, воспользовавшись формулой для массовой доли растворенного вещества:
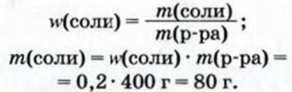
2. Находим массу воды:
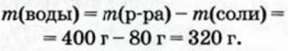
Ответ: 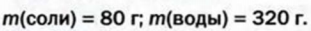
Пример №9
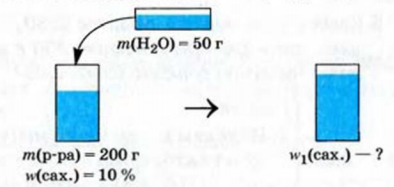
К 200 г в одного раствора сахара с массовой долей растворенного вещества 10 % добавили 50 г воды. Вычислить массовую долю сахара в образовавшемся растворе.
Дано: 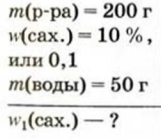
Решение: Условие задачи проиллюстрируем рисунком:
1. Вычисляем массу сахара в 200 г раствора:
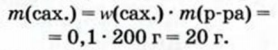
2. Находим массу образовавшегося раствора:
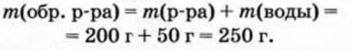
3. Рассчитваем массовую долю сахара в образовавшемся растворе по соответствующей формуле:
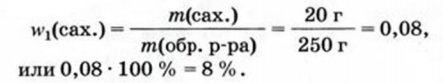
Ответ: 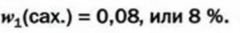
Пример №10
Какой объем воды нужно добавить к 45 г уксусной эссенции (раствор с массовой долей уксусной кислоты 80 %), чтобы приготовить 9 %-й раствор уксусной кислоты?
Дано: 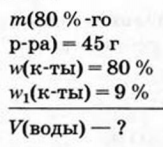
Решение:
1. Рассчитываем массу уксусной кислоты в 45 г уксусной эссенции:
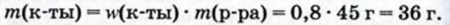
2. Вычисляем массу 9%-го раствора, в котором будут находиться 36 г кислоты:

3. Рассчитываем массу воды, которую нужно добавить к уксуссной эссенции:
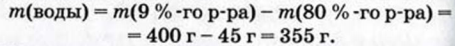
4. Находим объем воды:
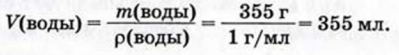
Ответ: 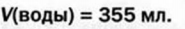
Пример №11
Какие массы медного купороса 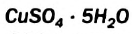 и воды необходимо взять для приготовления 200 г раствора с массовой долей купрум(II) сульфата
и воды необходимо взять для приготовления 200 г раствора с массовой долей купрум(II) сульфата  0,05?
0,05?
Дано: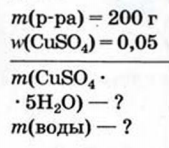
Решение:
1. Находим массу купрум(II) сульфата, которая будет находиться в 200 г раствора:
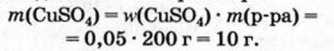
2. Вычисляем массу медного купороса, в которой содержится 10 г  :
:
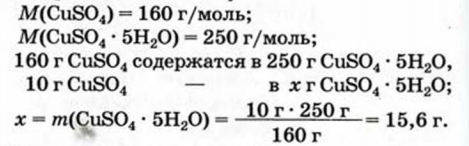
3. Рассчитываем массу воды:
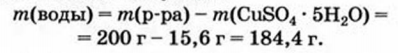
Ответ: 
Состав раствора, образованного двумя жидкостями, часто представляют соотношением их объемов. В химической лаборатории на бутылках с растворами кислот можно увидеть надписи «1:2», «1:4». Они свидетельствуют о том, что растворы приготовлены смешиванием одного объема кислоты с двумя или четырьмя объемами воды.
Выводы:
Количественный состав раствора характеризуют массовой долей растворенного вещества.
Массовая доля растворенного вещества является отношением массы вещества к массе раствора. Значение массовой доли, выраженное в процентах, численно равно массе растворенного вещества (в граммах), которая содержится в 100 г раствора.
Электролиты и неэлектролиты и вода
Общеизвестно, что металлы проводят электрический ток. Такое их свойство обусловлено наличием в металлах электронов, которые не удерживаются « своими» атомами и свободно перемещаются в веществе. Если соединить металлическую проволоку или пластину с батарейкой (аккумулятором), то эти электроны начнут перемещаться к положительно заряженному полюсу батарейки. В веществе возникнет электрический ток.
Рис. 25. Прибор для исследования электропроводности веществ, растворов, расплавов
Соли, основания, основные и амфотерные оксиды содержат заряженные частицы иного типа — ионы. Выясним с помощью эксперимента, способны ли вещества ионного строения проводить электрический ток.Перед проведением опытов соберем прибор, состоящий из стакана, двух электродов, лампочки и батарейки (рис. 25). Электродом может служить стержень или пластина из электропроводящего материала — металла или графита. Будем погружать электроды в твердые вещества, их расплавы, водные растворы. Обнаружим, что лампочка горит лишь тогда, когда электроды находятся в жидкости — расплаве или растворе ионного вещества (рис. 26).

Рис. 26. Обнаружение способности водных растворов и воды проводить электрический ток
Объясним результаты опытов.
В твердом веществе ионы соединены друг с другом. Поэтому вещество не проводит электрический ток. В жидкости (расплаве, растворе) ионы движутся хаотически (рис. 27). Если в нее погрузить электроды, соединенные с источником постоянного тока, движение ионов станет направленным. Положительно заряженные ионы (катионы) будут перемещаться к отрицательно заряженному электроду (катоду), а отрицательно заряженные (анионы) — к положительно заряженному электроду (аноду) (рис. 28).
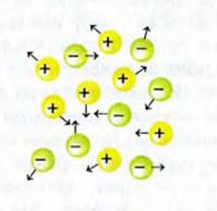
Рис. 27. Хаотическое движение ионов в расплаве или растворе ионного соединения
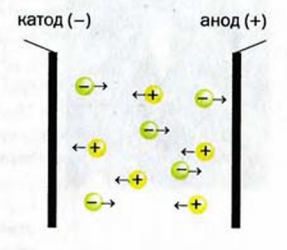
Рис. 28. Направленное движение ионов к электродам R РЯСПЛЯНР или рястворе ионного соединения
Электропроводными являются не только расплавы и водные растворы ионных веществ, но и водные растворы некоторых молекулярных веществ — кислот. Причина состоит в том, что во время растворения кислоты в воде часть ее молекул разрушается с образованием ионов. Этот процесс рассмотрим в следующем параграфе.
Соединения, водные растворы и расплавы которых проводят электрический ток, называют электролитами. Термин происходит от греческого слова lytos — разлагаемый.
Электролиты (в водном растворе): соли, щелочи, кислоты.
Общее название веществ, растворы и расплавы которых не проводят ток, — неэлектролиты. К ним относятся многие молекулярные вещества, а также все вещества атомного строения.
Значительный вклад в исследование электропроводности водных растворов сделал в начале кислоты XIX в. английский ученый Майкл Фарадей.
Майкл Фарадей (1791-1867)

Выдающийся английский физик и химик, член Лондонского королевского общества (Английской академии наук), почетный член Петербургской академии наук. Открыл законы, устанавливающие зависимость между количеством электричества и массами веществ, разлагающихся или образующихся при действии электрического тока (1833— 1834). Усовершенствовал способ сжижения газов и получил в жидком состоянии хлор, сероводород, аммиак, карбон(IV) оксид, нитроген(IV) оксид. Одним из первых начал изучать реакции, происходящие в присутствии катализаторов. Выполнил фундаментальные исследования по электричеству, магнетизму, сделал немало открытий в физике. Не имел высшего образования.
Электролиты (в расплавленном состоянии): соли, щелочи, ионные оксиды.
То, что ионы в растворе движутся к электродам, соединенным с батарейкой, можно доказать с помощью такого эксперимента. Лист фильтровальной бумаги помещают на стеклянную или полимерную пластину и смачивают бесцветным раствором электролита (например, натрий хлорида). Затем в центр листа наносят несколько капель раствора соли, которая содержит окрашенные катионы (купрум(II) сульфат 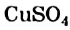 , никель(II) сульфат
, никель(II) сульфат 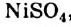 , кобальт нитрат
, кобальт нитрат 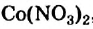 , феррум(III) хлорид
, феррум(III) хлорид 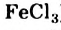 ) или анионы (калий перманганат
) или анионы (калий перманганат 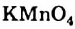 , калий дихромат
, калий дихромат 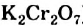 ). На бумагу с обеих сторон от центра кладут два электрода и соединяют их проволочками с батарейкой (рис. 29).
). На бумагу с обеих сторон от центра кладут два электрода и соединяют их проволочками с батарейкой (рис. 29).
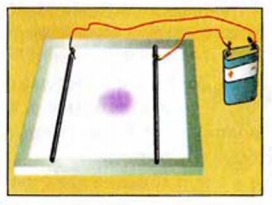
Рис. 29. Опыт по обнаружению движения ионов в растворе к электродам
Цветное пятно начинает смещаться к одному из электродов.
Выводы:
Соединения, водные растворы и расплавы которых проводят электрический ток, называют электролитами. К электролитам относятся все ионные вещества — щелочи, соли, основные и амфотерные оксиды, а также часть молекулярных веществ — кислоты (они проводят ток только в водном растворе). Другие вещества являются неэлектролитами.
Электролитическая диссоциация
Способность растворов или расплавов некоторых веществ проводить электрический ток обусловлена наличием ионов в этих жидкостях.
Распад вещества на ионы при его растворении или его растворении называют электрической диссоциацией. Термин происходит от латинского слова dissociatio — разъединение.
Теорию электролитической диссоциации веществ в растворах создал шведский ученый Сванте-Август Аррениус в 1887 году.
Сванте-Август Аррениус (1859-1927)

Выдающийся шведский ученый, академик Королевской академии наук Швеции, почетный член Петербургской академии, академий наук СССР и многих других стран. Один из основателей физической химии. Сделал значительный вклад в исследования растворов и химических реакций. Автор теории электролитической диссоциации (1887), за создание которой ученому была присуждена Нобелевская премия (1903). Объяснил зависимость скорости реакции от температуры, выдвинув представление об •активных молекулах- (1889). Математическая формула этой зависимости названа уравнением Аррениуса. Автор многих научных работ по химии, биологии, геологии, физике.
Вы уже знаете, что вещества, которые распадаются в растворе или расплаве на ионы, называют электролитами. Среди них есть соединения ионного и молекулярного строения.
Электролитическая диссоциация ионных веществ:
Молекулы воды благодаря электростатическому взаимодействию с ионами, расположенными на поверхности кристаллов, постепенно извлекают эти частицы из вещества (рис. 12). Кристаллы разрушаются, вещество растворяется. Оставаясь соединенными с молекулами воды, катионы и анионы электролита вместе с другими молекулами воды образуют раствор.
Электролитическую диссоциацию вещества, как и химическую реакцию, можно отобразить с помощью химического уравнения. Запишем уравнения электролитической диссоциации натрий хлорида и алюминий сульфата в водном растворе:
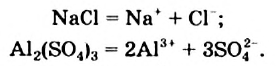
Водные растворы солей содержат ионы, из которых состоят эти вещества.
Соли - электролиты, которые диссоциируют в водных растворах или расплавах на катионы металлических элементов и анионы кислотных остатков.
В водных растворах щелочей содержатся катионы металлических элементов и гидроксид-ионы ОН . Уравнения электролитической диссоциации калий гидроксида и барий гидроксида:
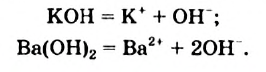
Основания — электролиты, которые диссоциируют в водных растворах или расплавах с образованием анионов такого типа - гидроксид-ионов 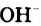 .
.
ЛАБОРАТОРНЫЙ ОПЫТ № 5
Обнаружение гидроксид-ионов в растворах щелочей с помощью индикатора
В двух пробирках находятся разбавленные растворы натрий гидроксида и барий гидроксида. Нанесите с помощью пипетки или стеклянной палочки каплю раствора из каждой пробирки на полоску универсальной индикаторной бумаги или другой индикатор. Что наблюдаете? Сделайте соответствующий вывод.
Наличие гидроксид-ионов в водных растворах щелочен обуслпаштпет общие химические спой-ства этих соединений. Так, щелочи одинаково действуют на определенный индикатор: фенолфталеин окрашивается в малиновый цвет, метилоранж — в желтый, лакмус — в синий, универсальный индикатор — в сине-зеленый. Таким образом, с помощью индикатора можно обнаружить в водном растворе щелочи ионы ОН , но не само вещество.
Нерастворимые основания на индикаторы не действуют.
В химии часто используют словосочетание « щелочная среда». Оно указывает на присутствие в растворе гидроксид-ионов.
Электролитическая диссоциация молекулярных веществ. В электролитах молекулярного строения — кислотах — ионы отсутствуют. Они образуются только при растворении веществ в воде.
Рассмотрим, как происходит этот процесс в водном растворе хлороводорода НСl — хлоридной кислоте.
В молекуле НСl существует полярная кова-лентная связь. Общая электронная пара смещена к более электроотрицательному атому Хлора (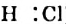 ). На атоме Хлора сосредотачивается небольшой отрицательный заряд (
). На атоме Хлора сосредотачивается небольшой отрицательный заряд ( ), а на атоме Гидрогена — положительный заряд (
), а на атоме Гидрогена — положительный заряд (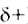 ). Таким образом, молекула хлороводорода является диполем:
). Таким образом, молекула хлороводорода является диполем: 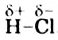 .
.
Это интересно. Заряд в атоме Гидрогена в молекуле НСl равен +0 2, а на атоме Хлора +0,2.
При растворении хлороводорода молекулы  и
и  притягиваются друг к другу своими противоположно заряженными частями (рис. 30).
притягиваются друг к другу своими противоположно заряженными частями (рис. 30).
Вследствие этого ковалентные связи во многих молекулах 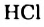 разрываются, и они распадаются, но не на атомы, а на ионы. Общая электронная пара, которая была смещена к атому Хлора, при разрушении молекулы
разрываются, и они распадаются, но не на атомы, а на ионы. Общая электронная пара, которая была смещена к атому Хлора, при разрушении молекулы 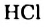 переходит в его «собственность»; атом Хлора превращается в ион
переходит в его «собственность»; атом Хлора превращается в ион 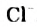 . Атом Гидрогена теряет свой единственный электрон и становится ионом
. Атом Гидрогена теряет свой единственный электрон и становится ионом 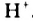 . Образовавшиеся ионы остаются окруженными молекулами воды, т. е. гидратированными.
. Образовавшиеся ионы остаются окруженными молекулами воды, т. е. гидратированными.
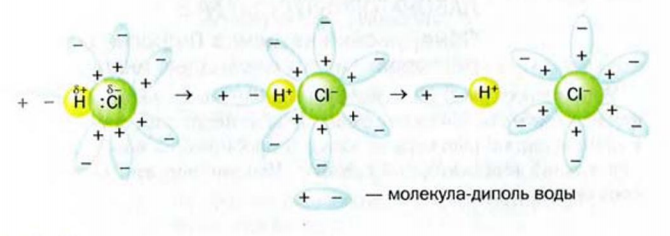
Рис. 30. Образование ионов из молекулы  в водном растворе
в водном растворе
Некоторые ионы 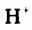 и
и 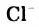 вследствие электростатического притяжения снова соединяются в молекулы. Поэтому уравнение электролитической диссоциации хлороводорода в водном растворе имеет такой вид':
вследствие электростатического притяжения снова соединяются в молекулы. Поэтому уравнение электролитической диссоциации хлороводорода в водном растворе имеет такой вид':
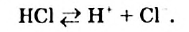
Участие воды в процессе электролитической диссоциации можно проиллюстрировать такой схемой:
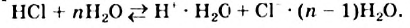
Знак обратимости  указывает на одновременное протекание двух процессов — прямого (слева направо) и обратного (справа налево). Эти процессы при неизменных концентрации раствоpa и температуре происходят с одинаковой скоростью. Поэтому число молекул и ионов в растворе со временем не изменяется.
указывает на одновременное протекание двух процессов — прямого (слева направо) и обратного (справа налево). Эти процессы при неизменных концентрации раствоpa и температуре происходят с одинаковой скоростью. Поэтому число молекул и ионов в растворе со временем не изменяется.
В хлоридной кислоте и водных растворах других кислот содержатся, кроме молекул воды, катионы Гидрогена  , анионы кислотных остатков, а также молекулы кислот.
, анионы кислотных остатков, а также молекулы кислот.
Кислоты — электролиты, которые диссоциируют в полных растворах с образованием катионов одного типа — ионов Гидрогена  .
.
Наличие ионов 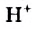 в водных растворах обуславливает общие химические свойства кислот, например, одинаковое действие на индикатор.
в водных растворах обуславливает общие химические свойства кислот, например, одинаковое действие на индикатор.
ЛАБОРАТОРНЫЙ ОПЫТ № 6
Обнаружение катионов Гидрогена в растворах кислот с помощью индикатора
В двух пробирках находятся разбавленные хлоридная и сульфатная кислоты. Нанесите с помощью пипетки или стеклянной палочки каплю раствора из каждой пробирки на полоску универсальной индикаторной бумаги. Что наблюдаете? Сделайте соответствующий вывод.
Таким образом, с помощью индикатора можно обнаружить в водном растворе ионы 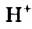 , но не определенную кислоту.
, но не определенную кислоту.
Нерастворимые кислоты на индикаторы не действуют.
Выражение «кислая среда» означает, что в растворе присутствуют катионы Гидрогена.
Диссоциация многоосновных кислот имеет ступенчатый характер; она происходит в несколько стадий. Рассмотрим этот процесс на примере трехосновной ортофосфатной кислоты 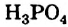 . Молекула этой кислоты содержит три атома Гидрогена. Сначала от молекулы отделяется один из них, превращаясь в ион
. Молекула этой кислоты содержит три атома Гидрогена. Сначала от молекулы отделяется один из них, превращаясь в ион 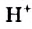 :
:
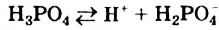 ; (1-я стадия)
; (1-я стадия)
затем, уже от иона 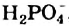 , — второй:
, — второй:
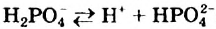 ; (2-я стадия)
; (2-я стадия)
и, наконец, — третий (от иона 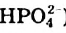 ):
):
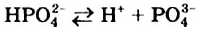 . (3-я стадия)
. (3-я стадия)
Обратите внимание: заряд иона в левой части второго (или третьего) уравнения равен сумме зарядов ионов в правой части.
На каждой стадии диссоциирует только часть молекул или ионов. Водный раствор ортофос-фатной кислоты содержит, кроме молекул воды, молекулы 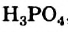 , катионы Гидрогена и различное количество анионов трех видов.
, катионы Гидрогена и различное количество анионов трех видов.
Щелочи и соли, в отличие от кислот, диссоциируют не ступенчато 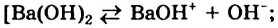
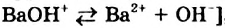 , а в одну стадию и полностью:
, а в одну стадию и полностью:
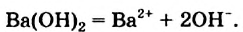
В раствор переходят ионы, из которых состоят эти соединения.
Названия ионов:
Название каждого иона состоит из двух слов.
Почти все катионы являются простыми (одноатомными. Существуют и сложные катионы, например ион аммония  . Их образуют металлические элементы, а также Гидроген. Первое слово в названии катиона — «ион» (или «катион»), а второе — название элемента в родительном падеже:
. Их образуют металлические элементы, а также Гидроген. Первое слово в названии катиона — «ион» (или «катион»), а второе — название элемента в родительном падеже:
 — ион Натрия;
— ион Натрия;
 — катион Гидрогена2;
— катион Гидрогена2;
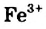 — ион Феррума(Ш).
— ион Феррума(Ш).
Название «ион Гидрогена» неоднозначно, так как Гидроген — единственный элемент, образующий и катион, и анион. В то же время название «ион Натрия» соответствует только катиону; Натрий как металлический элемент анионов не образует.
Анионы бывают простыми и сложными. Простые анионы образуют только неметаллические элементы. Один из вариантов составления названия простого аниона — такой же, как и для катиона:
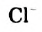 — ион Хлора;
— ион Хлора; 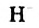 — анион Гидрогена.
— анион Гидрогена.
В другом варианте первое слово названия аниона состоит из корня названия элемента и суффикса «ид»; второе слово «ион» пишут после дефиса:
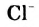 —хлорид-ион;
—хлорид-ион; 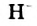 —гидрид-ион;
—гидрид-ион;
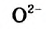 — оксид-ион;
— оксид-ион; 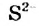 — сульфид-ион.
— сульфид-ион.
Названия сложных (многоатомных) анионов происходят от химических названий соответствующих кислот:
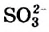 — сульфит-ион;
— сульфит-ион;
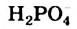 — дигидрогенортофосфат-ион.
— дигидрогенортофосфат-ион.
Название аниона 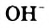 — гидроксид-ион.
— гидроксид-ион.
Выводы:
Распад вещества на ионы при его растворении или плавлении называют электролитической диссоциацией. В случае растворения ионного вещества (щелочи, соли) этот процесс заключается в переходе ионов из вещества в раствор. Электролитическая диссоциация молекулярного вещества (кислоты) происходит вследствие распада молекул на ионы.
Соли диссоциируют на катионы металлических элементов и анионы кислотных остатков, основания — с образованием гидроксид-ионов, а кислоты — с образованием катионов Гидрогена.
Не все молекулы кислоты распадаются в растворе на ионы. Электролитическая диссоциация многооснбвных кислот происходит в несколько стадий.
Индикаторы обнаруживают в растворе ионы 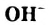 и
и 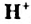 но не конкретное вещество — щелочь или кислоту.
но не конкретное вещество — щелочь или кислоту.
Это интересно. Известны простые анионы, содержащие по два или три одинаковых атома, — 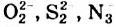 . Примеры соответствующих ионных соединений:
. Примеры соответствующих ионных соединений: 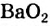 ,
, 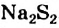 ,
, 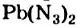 .
.
Степень электролитической диссоциации. Вода как электролит
Ионные вещества диссоциируют в водном растворе полностью, а молекулярные — частично. Во втором случае для количественной характеристики этого процесса используют величину, которую называют степенью электролитической диссоциации. (Для упрощения второе слово в названии термина далее указывать не будем.)
Степень диссоциации по отношение числа молекул электролита, распавшихся на ионы, к общему числу его молекул до ассоциации.
Степень диссоциации обозначают греческой буквой 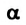 (альфа). Эту физическую величину выражают долей от единицы или в процентах:
(альфа). Эту физическую величину выражают долей от единицы или в процентах:
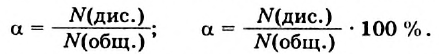
В приведенных формулах 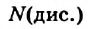 — число молекул электролита, распавшихся на ионы;
— число молекул электролита, распавшихся на ионы; 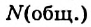 — число молекул электролита до диссоциации.
— число молекул электролита до диссоциации.
Интервалы значений степени диссоциации: 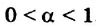 , или
, или 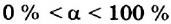 .
.
В приведенных выше формулах число продиссоциировавших молекул можно заменить числом образовавшихся катионов или анионов. Учитывая, например, что каждая молекула нитратной кислоты при диссоциации дает один ион 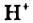 и один ион
и один ион 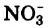
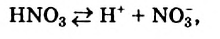
получаем:
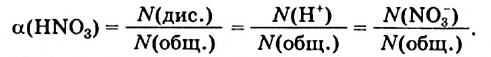
В формулу для степени диссоциации можно записать и количество вещества электролита (то, которое продиссоциировало, — в числителе, и общее, т. е. до диссоциации, — в знаменателе):
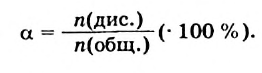
ЗАДАЧА. В растворе кислоты НА на каждую пару ионов  приходится четыре молекулы соединения. Вычислить степень диссоциации кислоты.
приходится четыре молекулы соединения. Вычислить степень диссоциации кислоты.
Дано: 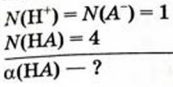
Решение: Пара ионов 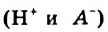 образовались из одной молекулы кислоты:
образовались из одной молекулы кислоты: 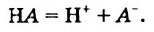
Значит, до диссоциации молекул кислоты 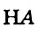 было
было
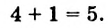
Вычисляем степень диссоциации кислоты:
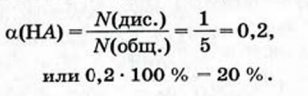
Ответ: 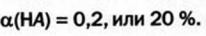
Слабые и сильные электролиты:
Если значение степени диссоциации равно, например, 0,01 или 0,001 (1 % или 0,1 %), то соединение незначительно распадается на ионы в растворе. Его называют слабым электролитом. Если же значение 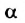 приближается к единице, или к 100 % (составляет, скажем, 90 % или 99 %), то соединение почти полностью диссоциирует. Это — сильный электролит.
приближается к единице, или к 100 % (составляет, скажем, 90 % или 99 %), то соединение почти полностью диссоциирует. Это — сильный электролит.
Вам известно, что ионные вещества — щелочи и соли — находятся в растворах только в виде соответствующих ионов. Для этих соединений 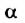 = 1 (100 %), и все они относятся к сильным электролитам.
= 1 (100 %), и все они относятся к сильным электролитам.
Что касается кислот (молекулярных веществ), то некоторые из них распадаются на ионы в растворах почти полностью, а другие — незначительно. Первые называют сильными кислотами, вторые — слабыми. Существуют и кислоты средней силы.
Приводим примеры важнейших кислот каждого типа; их формулы записаны в порядке уменьшения степени диссоциации соединений в растворах:
Мы назвали сильными кислотами те, которые активно взаимодействуют со многими веществами. Теперь вы знаете, что в растворах таких кислот содержится наибольшее количество катионов Гидрогена. Значит, химическая активность кислоты зависит от количества ионов 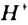 в ее растворе.
в ее растворе.
В предыдущем параграфе отмечалось, что многоосновные кислоты диссоциируют в несколько стадий. Каждую стадию можно охарактеризовать соответствующей степенью диссоциации:
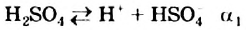 — степень диссоциации по первой стадии;
— степень диссоциации по первой стадии;
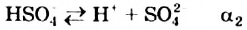 — степень диссоциации по второй стадии.
— степень диссоциации по второй стадии.
Кислота диссоциирует по первой стадии полнее, чем по второй:  . Это обусловлено двумя причинами:
. Это обусловлено двумя причинами:
- иону
 легче отделиться от электронейтральной частицы — молекулы
легче отделиться от электронейтральной частицы — молекулы  (1-я стадия диссоциации), чем от противоположно заряженной — иона
(1-я стадия диссоциации), чем от противоположно заряженной — иона 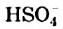 (2-я стадия);
(2-я стадия); - двухзарядный ион
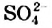 прочнее соединяется с катионом
прочнее соединяется с катионом 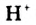 (это уменьшает диссоциацию по 2-й стадии), чем однозарядный ион
(это уменьшает диссоциацию по 2-й стадии), чем однозарядный ион 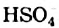 .
.
Вода как электролит:
Результаты опытов свидетельствуют о том, что чистая вода (например, дистиллированная, в которой нет растворенных электролитов) имеет чрезвычайно низкую электропроводимость. Это объясняется наличием в воде ничтожно малого количества ионов 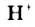 и
и 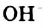 . Такие ионы образуются вследствие разрыва одной из полярных ковалентных связей в молекуле
. Такие ионы образуются вследствие разрыва одной из полярных ковалентных связей в молекуле  (§ 1).
(§ 1).
Итак, вода — очень слабый электролит. Она диссоциирует согласно уравнению
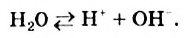
Ученые выяснили, что при температуре 25 °С только одна молекула воды из каждых 555 миллионов молекул распадается на ионы. Степень электролитической диссоциации воды составляет
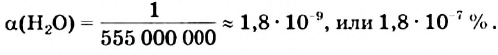
Выводы:
Степень диссоциации — это отношение числа молекул электролита, распавшихся на ионы, к общему числу его молекул. Степень диссоциации также выражают в процентах.
Если электролит распадается на ионы в незначительной мере, его называют слабым, а если полностью или почти полностью, — сильным. Среди кислот имеются электролиты всех типов, а щелочи и соли являются сильными электролитами, поскольку состоят из ионов.
Вода — очень слабый электролит.
Ионно-молекулярные уравнения. Реакции обмена между электролитами в растворе
Уравнения реакций с участием растворов электролитов — щелочей, кислот, солей, которые вы составляли в 8 классе, не передают сути химических превращений, поскольку в них записаны формулы веществ, а не формулы ионов.
Что же происходит на самом деле при взаимодействии электролитов в растворе? Выясним это, рассмотрев реакцию между растворами магний хлорида  и натрий гидроксида
и натрий гидроксида  :
:
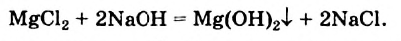
Раствор исходной соли содержит катионы Магния и анионы Хлора
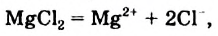
а раствор щелочи — катионы Натрия и гидроксид-ионы:
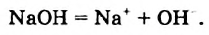
В результате реакции ионы  и
и  , соединяясь, образуют осадок малорастворимого основания
, соединяясь, образуют осадок малорастворимого основания 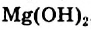 , а ионы
, а ионы 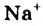 и
и 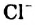 остаются в растворе.
остаются в растворе.
Изменим приведенное выше химическое уравнение с учетом состояния (диссоциированного, недиссоциированного) каждого реагента и продукта. Вместо формул обоих реагентов записываем формулы ионов, находившихся в растворах соединений до реакции, вместе с соответствующими коэффициентами (учитываем индекс 2 в формуле соли Магния и коэффициент 2 перед формулой щелочи):
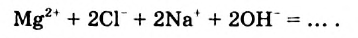
В правой части уравнения оставляем формулу 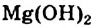 , а вместо формулы натрий хлорида записываем формулы соответствующих ионов с учетом коэффициента 2, который был в предыдущем уравнении:
, а вместо формулы натрий хлорида записываем формулы соответствующих ионов с учетом коэффициента 2, который был в предыдущем уравнении:
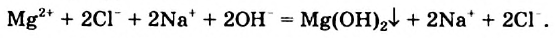
В обеих частях нового уравнения имеются одинаковые ионы — 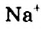 и
и 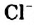 , причем каждый — в одинаковом количестве. Изъяв их, получаем запись, которую называют ионно-молекулярным уравнением (ногда используют сокращенный термин — «ионное уравнение»):
, причем каждый — в одинаковом количестве. Изъяв их, получаем запись, которую называют ионно-молекулярным уравнением (ногда используют сокращенный термин — «ионное уравнение»):
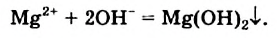
Ионно-молекуляриое уравнение — это уравнение, содержащее формулы веществ и формулы ионов.
Ионно-молекулярное уравнение указывает на то, что именно происходит при химическом превращении, какие частицы взаимодействуют в растворе и какие образуются. При составлении такого уравнения каждое вещество представляют в той форме (диссоциированной, недиссоциированной), которая преобладает в реакционной смеси или является в ней единственно возможной.
При составлении ионно-молекулярного уравнения придерживаются такой последовательности действий:
- Записывают «обычное» химическое уравнение (его называют молекулярным; такое название условное, поскольку молекул оснований и солей не существует; это — ионные вещества).
- По таблице растворимости определяют, какие реагенты и продукты реакции растворяются в воде, а какие — не растворяются.
- Выясняют, какие реагенты и продукты реакции являются сильными электролитами, а какие — слабыми электролитами или неэлектролитами.
- В молекулярном уравнении формулы растворимых сильных электролитов заменяют формулами соответствующих ионов, учитывая при этом индексы и коэффициенты. Сначала записывают катионы, затем — анионы.
- Из обеих частей полученного уравнения удаляют одинаковые ионы (в случае их наличия) в одинаковых количествах.
- Если все коэффициенты окажутся уравнение кратными, их делят на соответствующее число.
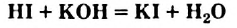
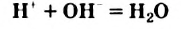
Теперь рассмотрим, как выполняют обратное задание. Составим молекулярное уравнение, которое отвечает ионно-молекулярному уравнению
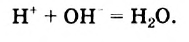
В левой части уравнения записаны только формулы ионов. Значит, соединения, которые взаимодействуют, должны быть растворимыми и сильными электролитами.
Ионы  образуются в растворе при диссоциации сильной кислоты (например,
образуются в растворе при диссоциации сильной кислоты (например, 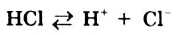 ), а ионы
), а ионы 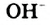 — при диссоциации щелочи (например,
— при диссоциации щелочи (например, 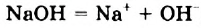 ). Выбрав в качестве реагентов хлоридную кислоту и натрий гидроксид, допишем в левую часть ионно-молекулярного уравнения ионы
). Выбрав в качестве реагентов хлоридную кислоту и натрий гидроксид, допишем в левую часть ионно-молекулярного уравнения ионы  и
и  :
:
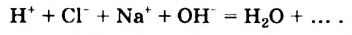
Ионы 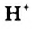 и
и 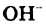 соединяются в молекулы слабого электролита — воды, а ионы
соединяются в молекулы слабого электролита — воды, а ионы 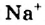 и
и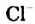 остаются в растворе. Допишем их в правую часть уравнения:
остаются в растворе. Допишем их в правую часть уравнения:
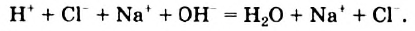
«Соединив» ионы в формулы соответствующих веществ, получаем молекулярное уравнение:
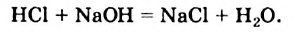
Таким образом, чтобы составить молекулярное уравнение к данному ионно молекулярному уравнению, необходимо заменить каждый ион формулой соответствующего сильного и растворимого электролита, а затем дописать формулы других реагентов (продуктов) — растворимых сильных электролитов.
Очевидно, что ионно-молекулярному уравнению 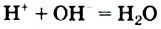 отвечают несколько молекулярных уравнений, так как реагентами могут быть другие щелочи и сильные кислоты. Среди этих уравнений есть и такие:
отвечают несколько молекулярных уравнений, так как реагентами могут быть другие щелочи и сильные кислоты. Среди этих уравнений есть и такие:
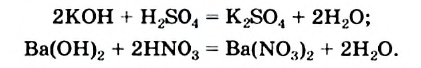
Отметим, что пара реагентов 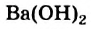 и
и  , не удовлетворяет условие задачи. Хотя барий гидроксид и сульфатная кислота — растворимые и сильные электролиты, однако при их взаимодействии образуется нерастворимая соль
, не удовлетворяет условие задачи. Хотя барий гидроксид и сульфатная кислота — растворимые и сильные электролиты, однако при их взаимодействии образуется нерастворимая соль  , формула которой должна быть в правой части ионно-молекулярного уравнения.
, формула которой должна быть в правой части ионно-молекулярного уравнения.
Это интересно. В некоторых ионно-молекулярных уравнениях (например, 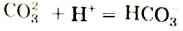 имеются лишь формулы ионов. Такие уравнения можно называть ионными.
имеются лишь формулы ионов. Такие уравнения можно называть ионными.
Реакции обмена между электролитами в растворе:
Рассмотренные в параграфе реакции относятся к реакциям обмена. В них соединения обмениваются своими составляющими — ионами.
Не все реакции обмена возможны. В 8 классе вы узнали, что реакция такого типа происходит, если ее продукт является малорастворимым, нерастворимым (он выделяется в виде осадка), газом или слабой кислотой. Теперь добавим, что реакция происходит и тогда, когда образуется слабый электролит, в том числе вода.
Таким образом, для выяснения возможности реакции обмена нужно иметь сведения о растворимости и силе электролитов. Необходимо также знать, что фторидная кислота 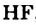 , хлоридная
, хлоридная 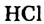 , иодидная
, иодидная 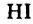 , сульфидная
, сульфидная 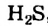 , нитратная
, нитратная  — летучие кислоты, а карбонатная
— летучие кислоты, а карбонатная  и сульфитная
и сульфитная  — неустойчивые.
— неустойчивые.
Обратите внимание на ионно-молекулярные уравнения, приведенные в параграфе. Каждое из них указывает на то, что в результате реакции обмени количество ионов в растворе уменьшается.
Рассмотрим случай, когда реакция обмена между электролитами не происходит. Если слить, например, растворы натрий гидроксида (щелочь) и калий хлорида (соль), то никаких изменений или внешних эффектов не заметим. Раствор останется бесцветным; из него не будут выделяться ни осадок, ни газ. Составляя ионно-молекулярное уравнение, обнаружим, что его левая и правая части одинаковы:
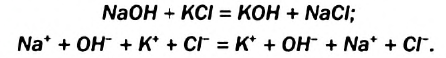
Полученный раствор содержит все ионы, которые были в растворах натрий гидроксида и калий хлорида. Следовательно, реакция между этими соединениями не происходит.
Изложенный выше материал касается реакций обмена, в которых оба реагента — растворимые и сильные электролиты. Если же, например, исходная соль нерастворима или исходная кислота — слабая, то вывод о возможности реакции делают после проведения соответствующего химического эксперимента.
Выводы:
Суть реакции, происходящей между электролитами в растворе, передает ионно-молекулярное уравнение; оно содержит формулы веществ и формулы ионов.
Ионно-молекулярное уравнение составляют, представляя растворимые сильные электролиты в диссоциированной форме, т. е. записывая формулы соответствующих ионов, а остальные вещества — в недиссоциированной форме.
Реакция обмена между электролитами в растворе происходит тогда, когда среди ее возможных продуктов имеется нерастворимое либо малорастворимое соединение, газ или слабый электролит.
В результате реакции обмена количество ионов в растворе уменьшается.
Гидролиз солей:
Если в раствор кальцинированной соды, или натрий карбоната, 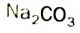 добавить каплю раствора фенолфталеина, то появляется малиновая окраска. Это указывает на наличие в растворе ионов
добавить каплю раствора фенолфталеина, то появляется малиновая окраска. Это указывает на наличие в растворе ионов 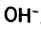 . Поскольку в соли таких ионов нет. делаем вывод: натрий карбонат взаимодействует с водой, и одним из продуктов этой реакции является натрий гидроксид:
. Поскольку в соли таких ионов нет. делаем вывод: натрий карбонат взаимодействует с водой, и одним из продуктов этой реакции является натрий гидроксид:
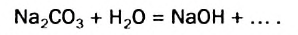
Можно предположить, что второй продукт — карбонатная кислота. Вы знаете, что эта кислота неустойчива и разлагается с образованием углекислого газа. Но выделения газа из раствора соды мы не наблюдаем. Значит, вторым продуктом реакции является другое вещество.
Простое сопоставление количества атомов каждого элемента в формулах двух реагентов и натрий гидроксида указывает на образование наряду со щелочью кислой соли 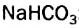 (Кислая соль — продукт неполного замещения атомов Гидрогена в молекуле кислоты на атомы (точнее, ионы) металлического элемента):
(Кислая соль — продукт неполного замещения атомов Гидрогена в молекуле кислоты на атомы (точнее, ионы) металлического элемента):
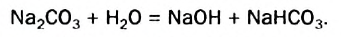
Известно, что с водой реагирует лишь незначительная часть соды. Одновременно происходит обратная реакция — между соединениями 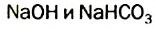 , (ее продукты —
, (ее продукты — 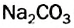 и вода). Учитывая это. записываем в химическом уравнении знак :
и вода). Учитывая это. записываем в химическом уравнении знак :
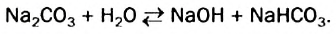
Рассмотренная реакция является реакцией обмена. Правда, обмен веществ своими частицами является неполным: лишь половина ионов Натрия в исходной соли обменивается на атомы Гидрогена.
Реакцию обмена между солью и водой называют реакцией гидролиза. Термин происходит от греческих слов hydor — вода и lysis — разложение.
Установлено, что с водой могут взаимодействовать соли, образованные слабыми основаниями или слабыми кислотами (сода образована слабой карбонатной кислотой). Среду раствора соли обуславливает сильный электролит (в нашем случае — натрий гидроксид), от которого происходит соль; он образуется при ее гидролизе. Так, растворы солей  имеют щелочную среду, а растворы солей
имеют щелочную среду, а растворы солей  — кислую.
— кислую.
Теперь вы сможете объяснить, почему в клетках таблицы растворимости. которые отвечают некоторым солям, имеются обозначения #. Каждая из этих солей происходит от слабого основания и слабой кислоты и поэтому подвергается полному гидролизу:
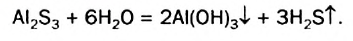
Качественные реакции на некоторые ионы
Часто возникает необходимость выяснить, содержит ли водный раствор определенные катионы или анионы. Если для обнаружения ионов  используют индикаторы, то для других ионов проводят химические реакции, сопровождающиеся особыми внешними эффектами (образование характерного осадка, выделение газа с определенными свойствами, появление или изменение окраски раствора). Такие реакции называют качественными.
используют индикаторы, то для других ионов проводят химические реакции, сопровождающиеся особыми внешними эффектами (образование характерного осадка, выделение газа с определенными свойствами, появление или изменение окраски раствора). Такие реакции называют качественными.
Предлагаем вам осуществить реакции, с помощью которых можно обнаружить в растворе некоторые анионы.
Карбонат-ионы можно также обнаружить в растворе, добавив к нему кислоту. Выделяется углекислый газ, не имеющий запаха. При пропускании этого газа в раствор кальций гидроксида образуется белый осадок кальций карбоната.
Для обнаружения в растворе некоторых анионов вместо аргентум нитрата можно использовать плюмбум(II) нитрат. Хлорид, бромид, сульфат, ортофосфат и карбонат Плюмбума(II) — белые осадки, а иодид — желтый (рис. 27).

Если исследуют очень разбавленные растворы, то некоторые реакции обмена могут не произойти, так как соли 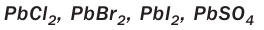 являются малорастворимыми.
являются малорастворимыми.
Поскольку хлорид-ионы выявляют в растворе, добавляя к нему раствор аргентум нитрата, то катионы Аргентума можно обнаружить, воспользовавшись хлоридной кислотой или раствором натрий хлорида.
Провести качественную реакцию с целью обнаружения определенных ионов часто не удается из-за наличия в исследуемом растворе некоторых других катионов или анионов. Вы не сможете, например, проверить с помощью соли 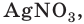 , имеются ли в растворе хлорид-ионы, если в нем находятся бромид-, иодид-, сульфат-, карбонат- или ортофосфат-ионы. Все перечисленные ионы соединяются с ионами
, имеются ли в растворе хлорид-ионы, если в нем находятся бромид-, иодид-, сульфат-, карбонат- или ортофосфат-ионы. Все перечисленные ионы соединяются с ионами 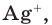 и образуются осадки соответствующих солей.
и образуются осадки соответствующих солей.
Качественные реакции используют не только для выявления тех или иных ионов, но и для распознавания соединений или их растворов. С помощью таких реакций обнаруживают токсичные катионы и анионы в промышленных стоках. Качественные реакции на нитрат-ионы дают возможность проверить, содержатся ли остатки удобрений (нитратов) в овощах.
Выводы:
Реакции с участием определенных ионов, протекающие с характерным внешним эффектом (образование осадка, выделение газа, появление или изменение окраски раствора), называют качественными реакциями. Их проводят с целью обнаружения различных ионов в растворе, распознавания соединений.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |