
Автор Анна Евкова
Преподаватель который помогает студентам и школьникам в учёбе.
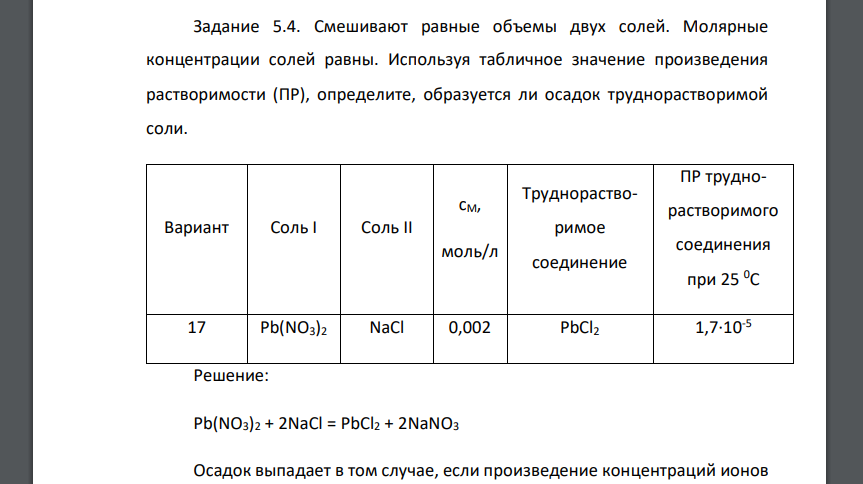
Смешивают равные объемы двух солей. Молярные концентрации солей равны. Используя табличное
 |
 |
Химия |
 |
 |
Решение задачи |
 |
 |
|
 |
 |
Выполнен, номер заказа №16707 |
 |
 |
Прошла проверку преподавателем МГУ |
 |
 |
|
Напишите мне в чат, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
|
Закажите у меня новую работу, просто написав мне в чат! |
Описание заказа и 38% решения ( + фото):
Смешивают равные объемы двух солей. Молярные концентрации солей равны. Используя табличное значение произведения растворимости (ПР), определите, образуется ли осадок труднорастворимой соли. Вариант Соль I Соль II cМ, моль/л Труднорастворимое соединение ПР труднорастворимого соединения при 25 0С 17 Pb(NO3)2 NaCl 0,002 PbCl2 1,7·10-5
Решение:
Осадок выпадает в том случае, если произведение концентраций ионов в растворе больше ПР. значит осадок не выпадает. Ответ:
Решение:
Осадок выпадает в том случае, если произведение концентраций ионов в растворе больше ПР. значит осадок не выпадает. Ответ:
Похожие готовые решения по химии:
- В данной окислительно-восстановительной реакции определите стехиометрические коэффициенты ионно-электронным методом
- Для двух металлов (табл. 6.2), находящихся в растворах своих солей с определенной концентрацией: -Составьте схему гальванического
- Составьте схемы электролиза и рассчитайте массу металла, выделяющегося на катоде, по приведенным данным при 3-х разных условиях
- Решить задачи согласно вариантам заданий 17. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется
- Проанализируйте данную Вам реакцию и укажите, какой она является: гомогенной или гетерогенной. 4.1.2. Запишите математическое выражение
- В определенном объеме раствора V л содержится m г вещества. Плотность раствора ρ (табл. 5.1). Рассчитайте: - Массовую долевую концентрацию
- Рассчитайте рН раствора кислоты или щелочи, если известна ее молярная концентрация СМ (моль/л). Номер варианта
- Составить молекулярное и ионно-молекулярное уравнения реакций гидролиза 4-х солей и оценить рН раствора: а) соль образована слабым
- Порог коагуляции. Правило Шульце - Гарди.
- Уравняйте реакции ионно-электронным методом, укажите Окислитель и восстановитель, рассчитайте ЭДС, определите направление протекания
- В данной окислительно-восстановительной реакции определите стехиометрические коэффициенты ионно-электронным методом
- Понятие агрегативной и кинетической неустойчивости дисперсной системы. Причины их вызывающие. Скрытая и явная коагуляции.

