
Теория химического строения органических соединений А. М. Бутлерова в химии с примерами
Содержание:
Органические соединения — это соединения, содержащие атомы Карбона, химически связанные с атомами Гидрогена. Они могут содержать и другие элементы-органогены (Оксиген, Нитроген, галогены и некоторые другие), например 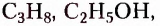
Органические вещества — преимущественно соединения молекулярного строения. Качественный состав большинства молекул органических веществ — это 2-4 химических элемента (Карбон, Гидроген, Оксиген, Нитроген).
В молекулах органических веществ Карбон четырёхвалентный.
Ковалентная связь — основной вид химической связи в молекулах органических соединений.
Закон — несомненное утверждение, которое при определённых условиях полностью подтверждается всей совокупностью исследуемых объектов. Из химии основной школы вам уже известны такие законы, как закон сохранения массы веществ, периодический закон, закон постоянства состава, закон Авогадро.
Количественный и качественный состав молекулы отражает молекулярная (эмпирическая) формула.
Роль теории в системе научных знаний. Существуют различные формы научных знаний, в частности факты, понятия, законы. Факты — это реальные события или конкретные характеристики, достоверные данные, установленные в процессе научного познания. Понятие является обобщённым мнением о телах, веществах, явлениях и т. д., возникающим на основании многих фактов. Более развитой и совершенной формой научных знаний, чем факты и понятия, является теория.
Теория — обоснованное и воспринятое научным сообществом научное знание, описывающее и объясняющее факты, выполняющее функцию предвидения, другие важные для науки функции.
Теорию характеризуют содержательная целостность, относительная стабильность. Благодаря разработке теорий достигается познавательный результат, получают объяснение факты, явления и т. д. Теорию нельзя считать полностью завершённой структурой. Зачастую новые факты и открытия дополняют и расширяют существующие теории, а иногда, наоборот, доказывают их несостоятельность ошибочность. Так было, например, в химии с теорией флогистона.
Как видим, основой для создания теории служат отдельные факты. В свою очередь в теории факты находят объяснение. Таким образом, факты и теория взаимосвязаны, неотделимы друг от друга. И том, что это действительно так, убедимся на примере теории химического строения органических соединений А. М. Бутлерова.
Теория химического строения органических соединений Л. М. Бутлерова
В XVII XVIII вв. строение органических веществ не рассматривали как чётко определённое и подлежащее установлению опытным путём. В этих обстоятельствах одному и тому же веществу могли приписывать несколько формул. В частности, для эта-нонон (уксусной) кислоты предлагалось восемь различных формул. Учёные открывали вещества с одинаковым количественным и качественным составом, но разными свойствами, однако причина такого явления оставалась неизвестной. Эти и многие другие научные факты нуждались в объяснении. Поэтому в середине XIX в. возникла настоятельная необходимость в создании теории химического строения органических соединений, которая бы объясняла состав и свойства органических веществ, упорядочивала множество известных фактов, прогнозировала открытие новых соединений.
Вспомните, что подобная ситуация сложилась в 60-е годы XIX в. в неорганической химии и её разрешение стало возможным лишь благодаря открытию периодического закона Д. И. Менделеевым.
Отдельные положения теории строения органических веществ были разработаны ранее. Так, английскому учёному А. Куперу принадлежит положение о способности атомов Карбона соединяться не только с атомами других элементов, но и между собой. Немецкий учёный Ф. Кекуле установил, что Карбон в органических соединениях четырёхвалентный. Однако эти учёные не смогли соединить разрозненные факты в целостную научную теорию, которая бы объясняла зависимость свойств веществ от их строения.
Химическое строение — это порядок соединения атомов в молекуле и характер их связи друг с другом.
Исключительная роль в создании, обосновании и подтверждении теории химического строения органических соединений принадлежит русскому учёному А. М. Бутлерову.

Александр Михайлович Бутлеров (1828-1886 родился в г. Чистополе Казанской губернии. В 16-летнем возрасте стал студентом физико-математического отделения Казанского университета, который в то время был центром естественнонаучных исследований в России. В 1849 г. окончил университет и начал работать в нём преподавателем. В 1851 г. защитил магистерскую диссертацию «Об окислении органических соединений о, а в 1854 г. — докторскую диссертацию «Об эфирных маслах». В 1857 г. в возрасте 29 лет стал профессором химии Казанского университета.
Во время заграничной поездки в 1857-1858 гг. А. М. Бутлеров начал цикл экспериментальных исследований, результаты которых были взяты за основу теории химического строения. Основные положения теории он сформулировал в докладе «О химическом строении вещества» на съезде немецких естествоиспытателей и врачей в сентябре 1861 г. В 1868 г. по рекомендации Д. И. Менделеева А. М. Бутлеров был избран профессором Петербургского университета, а в 1874 г. — академиком Петербургской академии наук. С 1878 по 1882 г. он был президентом и председателем отделения химии Русского физико-химического общества.
Кроме химии, А. М. Бутлеров много внимания уделял практическим вопросам сельского хозяйства, садоводства, пчеловодства, а позднее также и разведению чая на Кавказе.
Александр Бутлеров был первым, кто обосновал и экспериментально подтвердил, что строение молекулы можно определить химическим способом, то есть исследуя её химические свойства, и наоборот, зная строение вещества, можно предсказать его свойства. Отдельные известные тогда факты и положения, выводы из собственных опытов по получению органических веществ и исследованию их свойств он сформулировал как теорию химического строения органических соединений и доказал, что каждая молекула имеет определенное химическое строение, которое и определяет свойства вещества, а изучение химических превращений веществ позволяет установить их строение.
Основное положение теории химического строения: атомы в молекулах органических веществ соединены между собой химическими связями в строго определённой последовательности согласно их валентности.
Опираясь на это положение, А. М. Бутлеров отмечал, что каждому веществу свойственно лишь одно химическое строение, а следовательно, только одна структурная формула.
Структурная формула — формула вещества, отображающая последовательность соединения атомов в его молекуле.
При написании структурных формул исходят из того, что в органических соединениях валентность Карбона равна четырём, а между атомами Карбона может возникать одна, две или три химические связи.
Рассмотрим примеры некоторых органических веществ, с которыми вы ознакомились в основной школе, и напишем их структурные формулы:
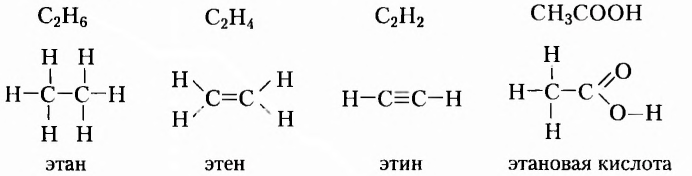
Обозначать все химические связи каждого атома не совсем удобно, да и места они занимают много. Поэтому довольно часто пользуются сокращённой формой записи:
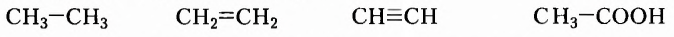
Структурные формулы отображают последовательность соединения атомов в молекуле, а не расположение их в пространстве. Посмотрите внимательно на следующие две структурные формулы и вы увидите, что обе формулы принадлежат одному веществу, так как являются идентичными, поскольку каждый из пяти атомов Карбона соединён одними и теми же химическими связями и в той же последовательности с другими атомами Карбона, а также с одинаковым количеством атомов Гидрогена:
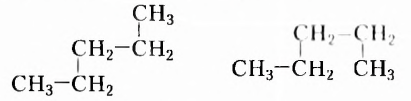
Приведёнными записями передано одно химическое строение, а это означает, что сделана запись структурной формулы одного и того же вещества, молекулярная формула которого 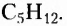
В разработанной А. М. Бутлеровым теории объясняется и такое важное химическое явление, как взаимное влияние атомов или групп атомов на свойства веществ. Кстати, это положение распространяется и на неорганические вещества.
Взаимное влияние атомов рассмотрим на примере воды, натрий гидроксида и этановой (другие названия — уксусная, ацетатная) кислоты:

Как видим, все три формулы содержат гидроксильную группу -ОН. Однако сочетание её с атомом Гидрогена даёт нейтральное вещество воду, с атомом щелочного элемента сильное основание, тогда как третье вещество это органическая кислота.
Созданная А. М. Бутлеровым в 1861 г. теория химического строения органических соединений получила дальнейшее развитие в грудах учеников и последователей учёного и до сих пор успешно функционирует. Современный этап в развитии этой теории ознаменовался дополнением её положением о пространственном строении веществ (стереохимии).
Теория строения органических соединений дала научное объяснение причин различных свойств веществ, имеющих одинаковый качественный и количественный состав. Об этом пойдёт речь в следующем параграфе.
Долгое время учёным не удавалось в лабораторных условиях синтезировать органические вещества, вследствие чего в начале XIX в. получила распространение виталистическая теория (от латин. virahs — жизненный). Согласно этой теории, вещества живой природы невозможно получить из неорганических веществ путём синтеза в лабораторных условиях. Псевдонаучность теории на протяжении десятилетий тормозила развитие органической химии. Вместе с тем учёные не оставляли попыток синтезировать в лаборатории те вещества, которые есть в живой природе, и добились успехов. В 1824 г. немецкий химик Ф. Вёлер синтезировал оксалатную (щавелевую) кислоту, а в 1828 г. — карбамид (мочевину); в 1842 г. русский учёный Н. Н. Зинин получил анилин -краситель, который в то время добывали только из растительного сырья; в 1845 г. немецкий химик Л. Кольбе синтезировал этановую (уксусную) кислоту; в 1854 г. французский учёный М. Бертло -жиры, в 1861 г. А. М. Бутлеров получил сахаристое вещество. Всё это доказало ошибочность виталистической теории и прекратило её существование.
Следующей была теория радикалов, согласно которой в химических реакциях с участием органических веществ устойчивые группировки атомов (радикалы), подобно кислотным остаткам неорганических веществ, без изменений переходят из молекул одного вещества к молекулам другого. Позже выяснилось, что не все химические реакции объясняются этой теорией. Поэтому в 40-50-х годах XIX в. появляется новая теория — теория типов.
Теория типов основывалась на утверждении, что некоторые неорганические вещества (водород, хлороводород, вода, аммониак) являются родоначальпыми для органических соединений. Положительное значение этой теории состояло в том, что она способствовала осуществлению классификации органических соединений. Однако, как и предыдущие, теория типов не выявляла зависимости между структурой и свойствами органических веществ. Поэтому и её постигла участь предыдущих теорий.
Явление изомерии, структурная изомерия, номенклатура насыщенных углеводородов
Информационная справка:
В молекулах органических веществ два атома Карбона могут соединяться между собой одной, двумя или тремя ковалент-ными связями. В соответствии с этим между атомами Карбона образуются одинарные, двойные, тройные связи. Различие между связями отражается на их прочности, длине, пространственном строении молекул, влияет на химические свойства соединений.
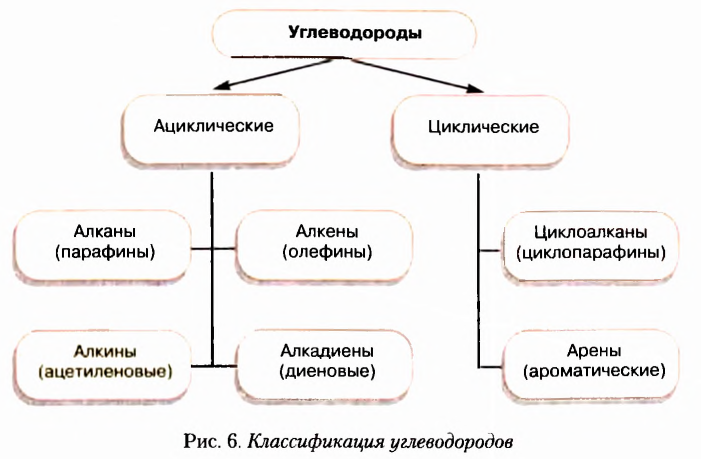
Вещества, молекулы которых состоят только из атомов Карбона и Гидрогена, получили название углеводороды. Среди них различают насыщенные, ненасыщенные, циклопарафины, ароматические.
Насыщенные углеводороды (их ещё называют алканами или парафинами) — это углеводороды, в молекулах которых между атомами Карбона существуют только одинарные связи.
Метан 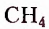 — первый представитель насыщенных углеводородов. Подобные ему по строению и свойствам соединения, состав молекул которых отличается на одну или несколько групп атомов
— первый представитель насыщенных углеводородов. Подобные ему по строению и свойствам соединения, состав молекул которых отличается на одну или несколько групп атомов 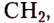 получили название гомологи.
получили название гомологи.
Гомологический ряд насыщенных углеводородов образован из веществ, состав молекул которых отображает общая формула 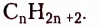
Первые десять представителей гомологического ряда насыщенных углеводородов имеют следующие названия и молекулярные формулы: метан 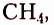 этан
этан 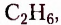 пропан
пропан 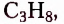 бутан
бутан 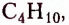 пентан
пентан 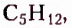 гексан
гексан 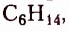 гептан
гептан 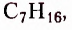 октан
октан 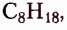 нонан
нонан 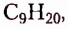 декан
декан 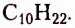
Явление изомерии
За несколько десятилетий до создания А. М. Бутлеровым теории химического строения органических соединений учёные узнали о существовании веществ с одинаковым качественным и количественным составом молекул, однако различных по свойствам. Этот факт требовал научного обоснования, которое и было сделано благодаря теории строения органических соединений А. М. Бутлерова. Эта теория объясняет проявление веществами одинакового качественного и количественного состава разных свойств тем, что соединения имеют различия в строении молекул. Такое явление называют изомерией.
Изомерия — явление существования веществ с одинаковым химическим составом, молекулярной формулой и относительной молекулярной массой, но с разным химическим строением или пространственным расположением атомов в молекуле.
Вещества с одинаковым качественным и количественным составом молекул, но разными строением и свойствами имеют общее название изомеры.
Изомерия — довольно распространённое в органической химии явление. Чем длиннее карбоновая цепь органического соединения, тем больше существует его изомеров. Например, гомолог метана пентан 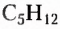 имеет 3 изомера, тогда как декан
имеет 3 изомера, тогда как декан 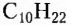 — 75 изомеров.
— 75 изомеров.
Структурная изомерия
Вы уже ознакомились со структурными формулами некоторых органических соединений и знаете, что структурные формулы — это химические формулы, отображающие состав вещества и порядок соединения атомов и его молекуле; химические связи в них обозначают чёрточками, каждая из которых соответствует одной единице валентности.
На рисунке 1 изображены структурные формулы всех возможных изомеров первых пяти представителей гомологического ряда насыщенных углеводородов: 1) метана 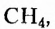 2) этана
2) этана 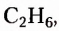 3) пропана
3) пропана 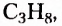 4) бутана
4) бутана 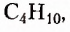 5) пентана
5) пентана 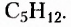
Как видим, каждой из первых трёх молекулярных формул соответствует только по одной структурной формуле. Относительно четвёртой и пятой молекулярных формул, при соблюдении положения о том, что атомы Карбона в органических соединениях имеют валентность 4, сделаны записи соответственно двух и трёх структурных формул. Бесспорно, что это изомеры. Явление изомерии в этом случае обусловлено различным порядком размещения атомов Карбона в карбон-карбоновой цеии. Такой вид изомерии получил название структурная изомерия.
Структурная изомерия — изомерия, обусловленная разной последовательностью соединения атомов Карбона в молекуле.
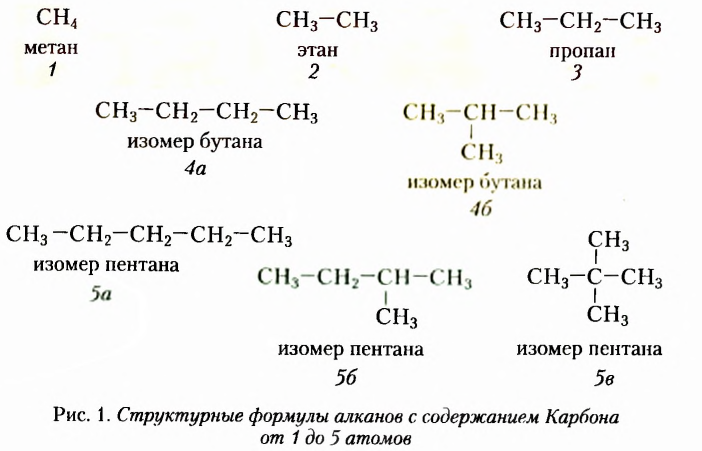
Более отчётливо структурную изомерию рассматриваемых веществ иллюстрируют их шаростержневые модели, изображённые на рисунке 2 (чёрные шарики моделируют атомы Карбона, светло-голубые — атомы Гидрогена).
Номенклатура насыщенных углеводородов
Поскольку каждому веществу соответствует только одна структурная формула, то возникает потребность различать, какая формула какому веществу принадлежит. С этой целью учёные разрабатывают правила составления индивидуальных названий веществ — номенклатуру.
Ознакомимся с номенклатурой насыщенных углеводородов. Первые четыре представителя гомологического ряда насыщенных углеводородов имеют исторические названия. Начиная с пятого, согласно международной номенклатуре, за основу названия взято латинское или греческое название числа атомов Карбона в молекуле соединения: пепта — 5, гекса — 6, гепта — 7, окта — 8 и т. д., к которому добавляют суффикс -ан.
Если углеводород имеет неразветвлённую цепь, перед названием пишут букву н и ставят дефис. Например:
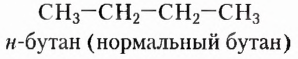
Названия насыщенных углеводородов разветвлённого строения составляют по следующим правилам:
1.В структурной формуле алкана разветвлённого строения определяют главную цепь атомов Карбона. Это самая длинная из возможных сплошная карбон-карбоновая цепь. Если в формуле можно выделить несколько цепей с одинаковым количеством атомов Карбона, то главной выбирают ту, у которой больше ответвлений, или заместителей.
2. Заместители — это атомы или группы атомов, замещающие в главной цепи один или несколько атомов Гидрогена. Для углеводородных заместителей, образованных из соответствующих насыщенных углеводородов, в названии используют суффикс -ил вместо суффикса -ан. Например:
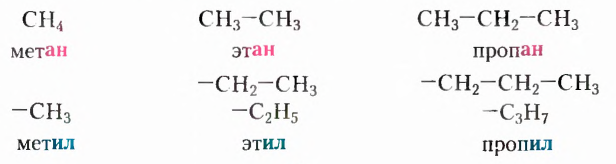
3. В главной цепи атомы Карбона нумеруют арабскими цифрами. Нумерацию начинают с того конца, к которому боковое ответвление размещено ближе. Если разные ответвления находятся на одинаковом расстоянии от обоих концов цепи, то нумерацию осуществляют с того конца, к которому ближе расположено ответвление с названием, употребляемым ранее по алфавиту. Если одинаковые ответвления, определяющие нумерацию цепи, равноудалены от обоих концов цепи, то нумерацию начинают с того конца, где больше ответвлений.
4. Полное название веществ дают в такой последовательности:
- определяют заместители и перечисляют их в алфавитном порядке, не считая числовых (множественных) приставок, которые могут быть перед названием заместителей. Перед названием заместителей указывают номера тех атомов Карбона главной цепи, возле которых они размещены;
- количество одинаковых заместителей передают в названии числовыми приставками: ди — если заместителей два, три — если три, тетра — если их четыре;
- сколько одинаковых заместителей в молекуле углеводорода, столько и цифр должно быть перед числовой приставкой. Цифры отделяют друг от друга запятыми, а после последней пишут дефис, числовую приставку и, не отступая от неё, название заместителя;
- не делая отступления от названий заместителей, записывают название насыщенного углеводорода главной цепи.
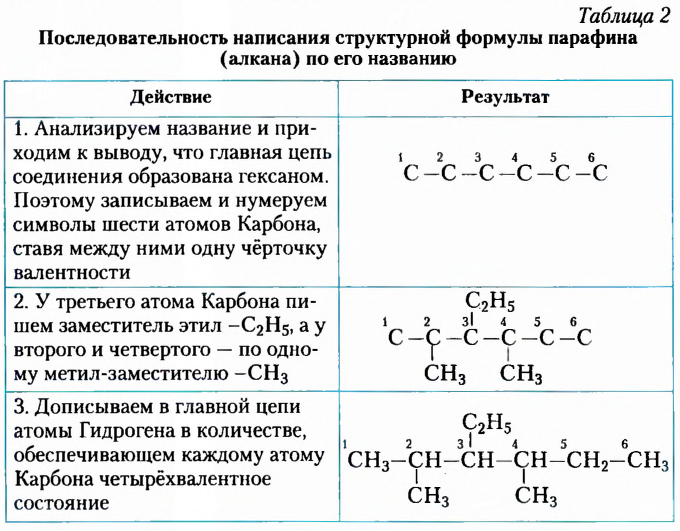
Потренируемся в составлении названия углеводорода, воспользовавшись приведённой формулой (см. табл. 1).


Обратитесь к рисунку 1 и назовите изомеры бутана и пентана по международной номенклатуре.
Часто приходится выполнять обратную процедуру — по названию вещества записывать его структурную формулу, как это показано в таблице 2 на примере 2,4-диметил-З-этилгексана.
Итак, чтобы безошибочно называть вещества или по названию составлять их структурные формулы, нужно знать и применять правила составления названий веществ — номенклатуру.
Составляя названия насыщенных углеводородов, указывают положение, количество и названия атомов или групп атомов, заместивших атомы Гидрогена в соединении, и название насыщенного углеводорода, который образует главную цепь.
Закреплению знаний о структурной изомерии и номенклатуре насыщенных углеводородов будет способствовать выполнение вами лабораторного опыта 1.
Современный этан в развитии теории строения органических веществ ознаменовался дополнением теории химического строения органических соединений положением о пространственном строении веществ.
Отрасль химии, изучающая пространственное строение молекул и его влияние на физические свойства веществ, направление и скорость реакций, называется стереохимией.
Одними из исследуемых в стереохимии объектов являются стереоизомеры — молекулы с одинаковыми составом и химическим строением, но с разным пространственным расположением атомов (групп атомов). Научные достижения стереохимии имеют большое значение. Установлено, что пространственное строение существенно влияет на свойства полимеров. Так, полипропилен стереорегулярного строения (полимер, из которого изготавливают прочные канаты, трубы и т. д.) обладает большей прочностью и износостойкостью, чем полипропилен нерегулярного пространственного строения.
Строение стереоизомеров влияет и на физиологическое действие лекарств. Поэтому знания стереохимии широко применяются в технологии полимеров, медицине и фармакологии.
Если структурная изомерия насыщенных углеводородов обусловлена только порядком размещения атомов в молекуле, то эта же изомерия у ненасыщенных углеводородов (алкенов, алкинов, диенов) зависит также и от положения двойной или тройной связи. Например, мы выяснили, что существуют три вещества с молекулярной формулой 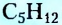 (см. рис. 1,5а-5в). А сколько структурных изомеров имеют молекулярную формулу
(см. рис. 1,5а-5в). А сколько структурных изомеров имеют молекулярную формулу 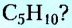 Оказывается, их вдвое больше:
Оказывается, их вдвое больше:
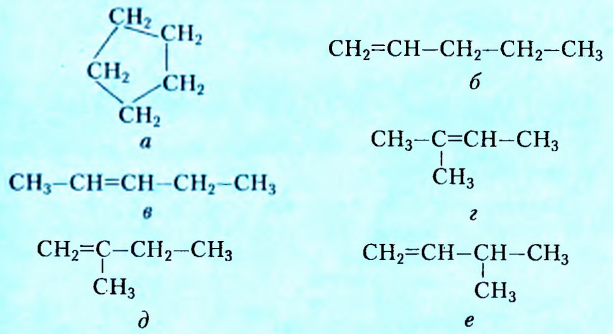
Названия этих веществ: а) циклопентан, б) пент-1-ен, в) пент-2-ен, г) 2-метилбута-2-ен, д) 2-метилбута-1-ен, е) З-метилбута-1-ен составлены в соответствии с номенклатурой циклопарафинов (а) и алкенов (б-е), то есть тех классов органических соединений, к которым они принадлежат. С правилами составления их названий вы сможете ознакомиться, используя дополнительную литературу.
Многообразие органических соединений, их классификация
Гибридизация орбиталей — выравнивание, перераспределение электронной плотности орбиталей валентных электронов атома, вследствие чего образуются гибридизированные орбитали.
В молекулах органических соединений гибридизации предшествует переход атома Карбона в возбуждённое состояние, вследствие чего образуются 4 неспаренных электрона — 1 s- и 3 р - электрона:
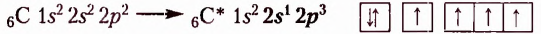
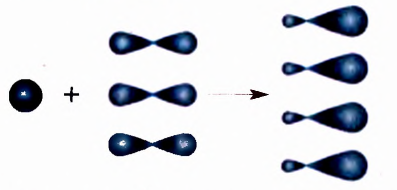
В случае гибридизации 1 s- и 3 р-орбиталей образуются 4 одинаковые электронные орбитали, имеющие форму несимметричной объёмной восьмёрки:  тогда как форма s-орбитали является сферической
тогда как форма s-орбитали является сферической  , а р-орбитали имеют форму симметричной объёмной восьмёрки
, а р-орбитали имеют форму симметричной объёмной восьмёрки 
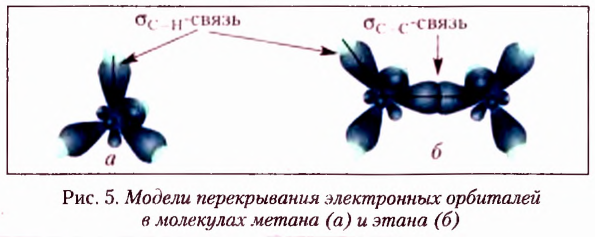
Химические связи, образованные перекрыванием орбиталей вдоль линии, проходящей через ядра двух атомов, получили название 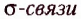 (сигма-связи). Их образование в молекуле метана и этана показано на рисунке 5.
(сигма-связи). Их образование в молекуле метана и этана показано на рисунке 5.
В молекулах ненасыщенных углеводородов негибридизированные р-орбитали образуют  -связи (пи-связи). Эта связь слабее
-связи (пи-связи). Эта связь слабее  и обычно первой разрывается при химических превращениях, что позволяет веществу легко вступать в реакции присоединения.
и обычно первой разрывается при химических превращениях, что позволяет веществу легко вступать в реакции присоединения.
Одинарная связь между двумя атомами — это  Двойная связь состоит из одной
Двойная связь состоит из одной 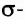 и одной
и одной 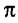 -связи, тройная — из одной
-связи, тройная — из одной 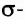 и двух
и двух 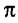 -связей:
-связей:
Классификация - это процесс и результат группирования объектов исследования или наблюдения по их определённым общим признакам.
Этен (историческое название этилен) 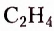 является родоначальником гомологического ряда алкенов — ненасыщенных органических соединений с одной двойной связью между атомами Карбона в молекуле. Общая формула соединений этого гомологического ряда
является родоначальником гомологического ряда алкенов — ненасыщенных органических соединений с одной двойной связью между атомами Карбона в молекуле. Общая формула соединений этого гомологического ряда 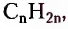 названия представителей заканчиваются суффиксом -ен.
названия представителей заканчиваются суффиксом -ен.
Этин (ацетилен) 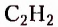 - родоначальник гомологического ряда ацетиленовых углеводородов (алкинов) — ненасыщенных органических соединений с одной тройной связью атомов Карбона в молекуле. Общая формула алкинов
- родоначальник гомологического ряда ацетиленовых углеводородов (алкинов) — ненасыщенных органических соединений с одной тройной связью атомов Карбона в молекуле. Общая формула алкинов 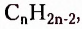 названия представителей заканчиваются суффиксом -ин.
названия представителей заканчиваются суффиксом -ин.
Современные достижения химической науки позволяют синтезировать вещества с заданными свойствами — высокой прочностью и стойкостью к истиранию, негорючих, устойчивых к действию кислот и щелочей, способных не пропускать вредные для живой природы лучи и т. д.
На сегодня известно более 10 млн органических соединений, и учёные продолжают успешно работать над созданием новых, неизвестных в природе. Без чёткой классификации такого огромного количества веществ было бы невозможно работать учёным, учиться студентам и ученикам.
Классификация органических соединений
Рассмотрение классификации органических соединений начнём с классификации по строению карбонового скелета. По этому признаку различают ациклические и циклические соединения. Их названия указывают на то, что соединения первой группы имеют незамкнутую цепь атомов Карбона, тогда как в соединениях второй группы атомы Карбона образуют замкнутые циклы.
Как вам известно, незамкнутая карбон-карбоновая цепь может быть линейной и разветвлённой (см. рис. 2).
Циклические органические соединения разделяют на карбо-циклические (в цикл входят только атомы Карбона) и гетероциклические (замкнутые цепи, содержащие помимо атомов Карбона атомы других химических элементов):
Ациклическими органическими соединениями называют соединения с незамкнутой цепью атомов Карбона.
Молекулам циклических органических соединений свойственны замкнутые цепи атомов Карбона.
Следующая классификация это наиболее общее разделение органических соединений на группы, в основе которого — качественный состав веществ.
Но качественному составу молекул органические соединения разделяют на углеводороды, оксигеносодержащие, нитрогеносодержащие (и некоторые другие) соединения.
В каждой из них есть соединения ациклического и циклического строения, с линейными и разветвлёнными карбоновыми цепями. Вместе с тем каждая из указанных групп веществ имеет и свою классификацию. Рассмотрим их.
Классификация углеводородов
Из информационной справки и текста параграфа вы узнали, что атомы Карбона могут соединяться между собой одинарными, двойными и тройными связями, а также замыкаться в циклы. С учётом этих признаков создана классификация углеводородов, которая схематично показана на рисунке 6.
Примеры применения углеводородов показаны на рисунке 7.

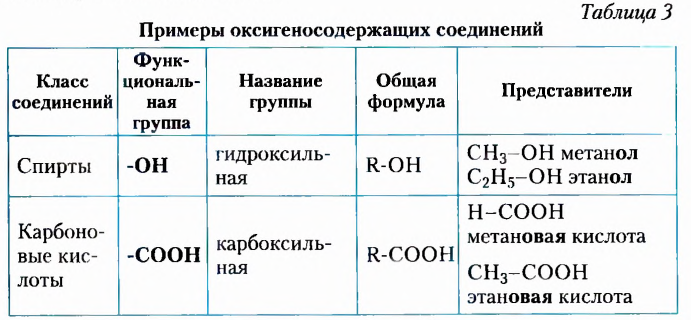
Классификация оксигеносодержащих органических соединений
Основным классификационным признаком этой группы органических веществ являются имеющиеся в их молекулах функциональные (характеристические) группы.
Функциональные (характеристические) группы — группы атомов, входящие в состав молекул всех представителей гомологического ряда и определяющие их общие свойства.
В общих формулах, выражающих состав оксигеносодержащих веществ, указывают функциональную группу, а остальной состав молекулы обозначают заглавной буквой R латинского алфавита. Дальнейшее знакомство с представителями оксигеносодержащих органических соединений различных классов убедит вас в том, что эта часть их молекул преимущественно являются углеводородным заместителем.
Записывая общие формулы того или иного класса оксигеносодержащих органических соединений, первым обозначают буквой R углеводородный заместитель, а после него —функциональную группу.
В таблице 3 представлены примеры отдельных классов оксигеносодержащих соединений.
Многообразие оксигеносодержащих соединений не исчерпывается приведёнными примерами. Ведь спирты бывают одноатомные (одна функциональная группа) и многоатомные: двухатомные, трёхатомные, к которым относится глицерол (или глицерин), и другие многоатомные спирты. Кроме того, карболовая цепь заместителя может быть линейной и разветвлённой, а функциональная группа -ОН — размещаться у любого атома Карбона. Всё это значительно увеличивает количество изомеров спиртов но сравнению с соответствующими углеводородами.
Убедитесь в атом, составив структурные формулы всех возможных изомеров спирта с молекулярной формулой 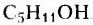 Их должно быть 6.
Их должно быть 6.
Наличие в молекуле сразу двух функциональных групп или образование в результате реакции нового сочетания остатков различных функциональных групп является следующим фактором многообразия оксигеносодержащих веществ. Так, с 9 класса и изученного на занятиях по биологии в 10 классе вы знаете о существовании углеводов, эстеров, таких биополимеров, как крахмал, целлюлоза и т. п.
Вспомните и запишите в рабочую тетрадь формулы этих веществ. Укажите, какие функциональные группы входят в состав их молекул.
Классификация нитрогеносодержащих органических соединений
В молекулах соединений этой группы обязательно содержатся атомы Нитрогена, Карбона, Гидрогена. Так, у аминов углеводородный заместитель соединён с одновалентной функциональной аминогруппой 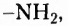 например этанамин
например этанамин 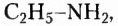 бензепамии (анилин)
бензепамии (анилин) 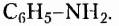 Существует также функциональная группа, образованная атомами Нитрогена и Оксигеиа, — нитрогруппа
Существует также функциональная группа, образованная атомами Нитрогена и Оксигеиа, — нитрогруппа 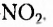 например нитробензен
например нитробензен 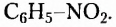 Атомы Нитрогена входят в состав аминокислот, белков, нуклеиновых кислот.
Атомы Нитрогена входят в состав аминокислот, белков, нуклеиновых кислот.
Причины многообразия органических соединений. Далеко не полное ознакомление с органическими соединениями позволяет выделить основные факторы их многообразия.
Первый — способность атомов Карбона соединяться между собой в разном количестве согласно их валентности.
Второй — существование структурных изомеров (структурная изомерия). Действительно, это общее явление органической химии присуще углеводородам, оксигеносодержащим, нитрогено-содержащим соединениям и т. д.
Третий — изомерия положения кратных связей. Как выяснилось, речь идёт о двойной и тройной связи. Поэтому к такому фактору многообразия органических соединений, как структурная изомерия, у ненасыщенных углеводородов добавляется изомерия положения кратных связей. Ещё одна причина — стереоизомерия.
Четвёртый — существование различных функциональных групп атомов: у спиртов - гидроксильной группы -ОН, у карболовых кислот — карбоксильной группы -СООН, у аминов - аминогруппы -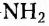 и т. д.
и т. д.
Пятый соединение нескольких из указанных факторов сразу. В частности, молекулы аминокислот сочетают в своём составе аминогруппу -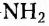 и карбоксильную группу -СООН и способны существовать в виде различных структурных изомеров.
и карбоксильную группу -СООН и способны существовать в виде различных структурных изомеров.
Парафин, из которого изготавливают свечи, — это смесь насыщенных углеводородов преимущественно неразветвлённого строения, в молекулах которых содержится от 18 до 40 атомов Карбона. Эта легкоплавкая химически малоактивная смесь (температура плавления 40-65 °С) получила разнообразное применение. Ею пропитывают бумагу и древесину, уменьшают трение деревянных деталей, чем удобно воспользоваться и в домашних условиях, например для лёгкого выдвигания ящиков шкафов.
Парафин глубокой очистки применяется как пищевая добавка (число Е 905), компонент многих косметических препаратов. Целебные свойства парафина известны уже несколько тысячелетий, а сегодня их с успехом используют в парафинотерапии, входящей в перечень услуг косметических салонов. К примеру, только за один сеанс парафинотерапии исчезают сухость, трещины, покраснение, шелушение кожи кистей рук, она становится мягче и более гладкой.
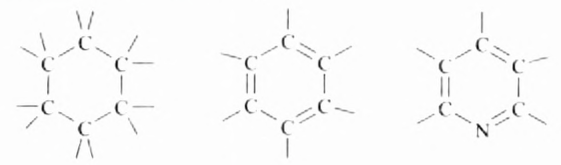
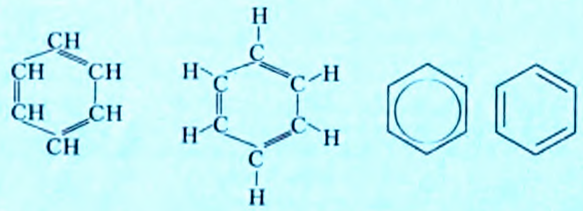
Из атомов Карбона и Гидрогена построены арены, или ароматические углеводороды, представителем которых является бензен 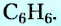 Его молекула и молекулы гомологов имеют особое, отличное от насыщенных и ненасыщенных углеводородов строение, поэтому их не классифицируют как ненасыщенные соединения, а изучают как отдельный класс. Существует несколько изображений структурной формулы бензена:
Его молекула и молекулы гомологов имеют особое, отличное от насыщенных и ненасыщенных углеводородов строение, поэтому их не классифицируют как ненасыщенные соединения, а изучают как отдельный класс. Существует несколько изображений структурной формулы бензена:
Гидроксильная группа -ОН является функциональной группой не только спиртов, но и оксигеносодержащих веществ фенолов. Первый представитель фенолов — соединение с таким же названием. Формулы вещества: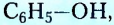
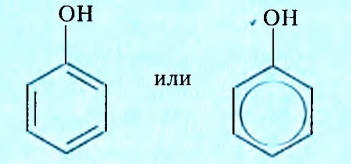
Как видим, углеводородный заместитель в составе фенола образован остатком бензена.
Два класса органических соединений — альдегиды и кетоны — содержат карбонильную группу
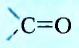
У альдегидов она соединена с углеводородным заместителем и с атомом Гидрогена, за исключением первого представителя, у которого обе валентности функциональной группы насыщены атомами Гидрогена.
Общая формула альдегидов 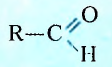
Группу атомов 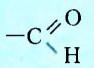 называют альдегидной.
называют альдегидной.
Названия альдегидов образуют от названий углеводородов с соответствующим количеством атомов Карбона в молекуле, добавляя к ним суффикс -аль. Например,

Обратите внимание, что заместитель метил в составе метана-ля отсутствует, название определил атом Карбона функциональной группы. Во втором веществе заместитель метил, название же альдегида — этаналь. Следовательно, подтверждается правило, что в названии отображают суммарное количество атомов Карбона в молекуле, а не только в заместителе.
У кетонов карбонильная группа соединена с двумя углеводородными заместителями. Такой представитель кетонов, как ацетон вам, безусловно, известен.
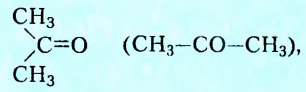
Его способность растворять в себе органические соединения получила применение в изготовлении лаков и красок. Ею можно воспользоваться и для удаления некоторых лаков и красок с различных поверхностей, тканей и т. д.
Отдельную группу образуют органические соединения, в молекулах которых два углеводородных заместителя соединены с одним атомом Оксигена, например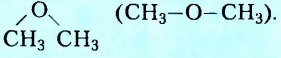
Их общее название этеры. Вещества этой группы рассматривают как производные спиртов или фенолов, в которых атом Гидрогена гидроксильной группы замещён на углеводородный остаток. Название соединения, формула которого приведена выше, — метоксиметан (диметиловый этер).
Органические вещества в живой природе
Углеводы — оксигеносодержащие соединения, состав молекул которых чаще всего соответствует общей формуле 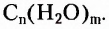 Их ещё называют сахарами или сахаридами. Одно из химических свойств большинства углеводов — гидролиз, в процессе которого вследствие химического взаимодействия с водой они превращаются в углеводы более простого химического строения. По этому признаку углеводы разделяют на моносахариды, дисахариды, полисахариды.
Их ещё называют сахарами или сахаридами. Одно из химических свойств большинства углеводов — гидролиз, в процессе которого вследствие химического взаимодействия с водой они превращаются в углеводы более простого химического строения. По этому признаку углеводы разделяют на моносахариды, дисахариды, полисахариды.
Моносахариды не подлежат реакции гидролиза. Наиболее распространёнными в природе моносахаридами являются пентозы (содержат 5 атомов Карбона в молекуле) и гексозы (содержат 6 атомов Карбона в молекуле). Например, 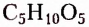 рибоза,
рибоза, 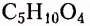 — дезоксирибоза,
— дезоксирибоза, 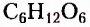 — глюкоза и фруктоза.
— глюкоза и фруктоза.
Дисахариды (ди — два) — соединения, молекулы которых образованы остатками двух моносахаридов, на которые они гидролизуются. Распространённые дисахариды: сахароза (известная в быту как сахар), лактоза (молочный сахар), мальтоза (солодовый сахар). Состав этих веществ передаёт молекулярная формула 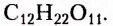
Полисахариды (поли — много) — природные высокомолекулярные углеводы с относительной молекулярной массой от нескольких сотен до сотен тысяч. Наиболее распространёнными представителями полисахаридов являются крахмал и целлюлоза. Состав их молекул отображает общая формула 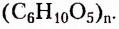 Молекулы этих углеводов образованы из остатков молекул глюкозы разного стереостроения.
Молекулы этих углеводов образованы из остатков молекул глюкозы разного стереостроения.
Эстеры — продукты взаимодействия карбоновых кислот и спиртов:
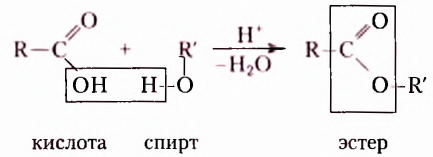
Жиры — это эстеры трёхатомного спирта глицерола (глицерина) и высших карбоновых кислот, например:
Белки — природные полимеры сложного строения, мономерами которых являются а-аминокислоты.
Нуклеиновые кислоты (РНК — рибонуклеиновая, ДНК — Дезоксирибонуклеиновая) — природные полимеры, структурными звеньями молекул которых являются нуклеотиды. В состав нуклеотида входят соединённые между собой остатки азотистого основания — гетероциклического соединения с атомами Карбона и Нитрогена в цикле, моносахарида рибозы 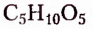 или дезоксирибозы
или дезоксирибозы 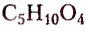 и ортофосфатной кислоты.
и ортофосфатной кислоты.
Удачным оказалось предложенное Е.-Я. Берцелиусом название соединений Карбона — органические. Если первоначально оно ориентировало на то, что эти вещества нельзя получить вне живого организма, то сейчас органические соединения — это прежде всего вещества, входящие в состав тел живой природы. Кроме того, они есть в составе нефти, природного газа, угля. На сегодня реальным стал синтез новых соединений Карбона, неизвестных в живой природе.
Вспомните из изученного на уроках биологии взаимосвязь строения биологически важных органических соединений с их функциями. Эти знания по биологии помогут вам успешно освоить содержание параграфа.
Многие природные органические соединения участвуют в процессах обмена веществ и энергии, без которых жизнь на Земле была бы невозможна. Поражает то, что указанные процессы слаженно происходят в уникальной природной лаборатории — клетке живого организма.
Больше всех представлены в живой природе углеводы, жиры, белки. В меньшем количестве, однако не менее важны, — органические вещества других групп, в частности нуклеиновые кислоты, витамины, красители, органические кислоты, душистые вещества. Каждая группа веществ выполняет свойственные ей функции, а все вместе они обеспечивают жизнедеятельность организмов — рост, развитие, защиту, воспроизводство себе подобных.
В химическом составе природных органических соединений преобладают несколько химических элементов, прежде всего Карбон, Гидроген, Оксиген, Нигроген. Классы соединений, в состав которых они входят, кратко охарактеризованы в информационной справке.
Остановимся подробнее на характеристике отдельных органических веществ, которые задействованы в обменных процессах, происходящих в живой природе.
Глюкоза
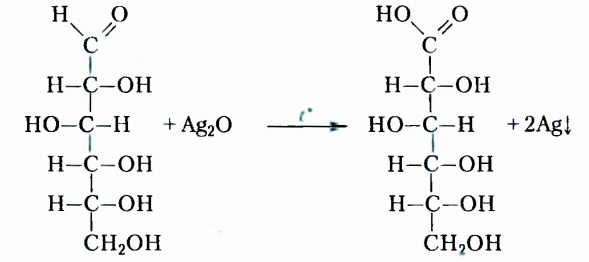
Это белое кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус. Молекулярная формула 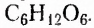 Молекула глюкозы может иметь ациклическое и циклическое строение. В молекуле ациклического строения порядок соединения шести атомов Оксигена с атомами Карбона таков, что один атом Оксигена входит в состав альдегидной группы, а остальные пять — в гидроксильные группы. Следовательно, это пятиатомный альдегидоспирт (нумерацию карбоновой цепи начинают с атома Карбона альдегидной группы):
Молекула глюкозы может иметь ациклическое и циклическое строение. В молекуле ациклического строения порядок соединения шести атомов Оксигена с атомами Карбона таков, что один атом Оксигена входит в состав альдегидной группы, а остальные пять — в гидроксильные группы. Следовательно, это пятиатомный альдегидоспирт (нумерацию карбоновой цепи начинают с атома Карбона альдегидной группы):
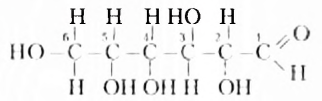
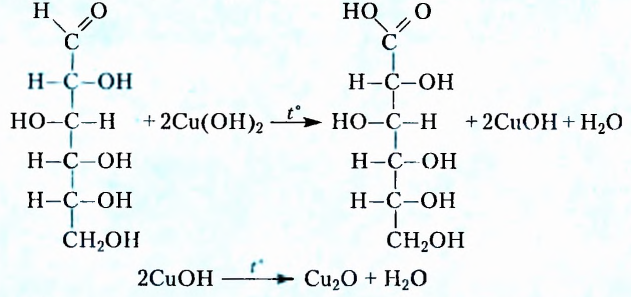
Такое строение молекул глюкозы обусловливает их способность вступать в реакцию «серебряного зеркала» со свежеприготовленным купрум( ) гидроксидом (см. с. 42-43).
) гидроксидом (см. с. 42-43).
Природа целиком и полностью удовлетворяет потребности человека в глюкозе, а также в других углеводах - сахарозе, крахмале, целлюлозе. Поэтому нет необходимости добывать их искусственно.
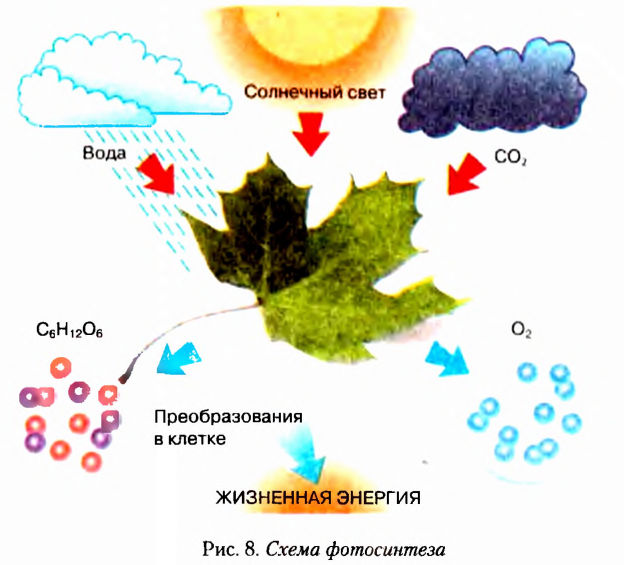
Вспомните, что называют фотосинтезом, при каких условиях он происходит. Объясните схему, изображённую на рисунке 8. Пользуясь рисунком, напишите уравнение реакции фотосинтеза.
Синтезированный зелёным растением моносахарид глюкоза может накапливаться в растениях (в частности, в клеточном соке плодов, придавая им сладкий вкус), а также превращаться в дисахариды или полисахариды. Глюкозой богаты мёд, спелые плоды плодово-ягодных культур, прежде всего винограда, поэтому у глюкозы есть и другое название — виноградный сахар.
Глюкоза — универсальный источник энергии для живых организмов, она участвует во многих реакциях обмена веществ. В организме человека глюкоза является обязательным компонентом крови и лимфы. Содержание глюкозы в крови — важный показатель состояния здоровья. Вот почему диагностируя некоторые заболевания, например сахарный диабет, проводят анализ крови по определению концентрации глюкозы, так называемую пробу на сахар.
Сахароза
Это дисахарид растительного происхождения, физические свойства которого подобны свойствам глюкозы. Молекулярная формула 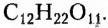 Вследствие гидролиза сахарозы образуются два моносахарида — глюкоза и фруктоза. Наибольшее содержание сахарозы в корнеплодах сахарной свёклы (около 25 %) и стеблях сахарного тростника (около 20 %), поэтому именно они являются сырьём для производства сахара. Уникальность этого производства заключается в том, что вещество создала природа, а человеку остаётся только выделить его в чистом виде.
Вследствие гидролиза сахарозы образуются два моносахарида — глюкоза и фруктоза. Наибольшее содержание сахарозы в корнеплодах сахарной свёклы (около 25 %) и стеблях сахарного тростника (около 20 %), поэтому именно они являются сырьём для производства сахара. Уникальность этого производства заключается в том, что вещество создала природа, а человеку остаётся только выделить его в чистом виде.
Вспомните общую схему производства сахара, изучаемую в 9 классе.
Крахмал и целлюлоза
Вы уже знаете, что эти полисахариды, молекулярная формула которых 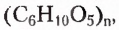 обладают достаточно разными физическими свойствами. Крахмал — белый, хрустящий на ощупь, нерастворимый в холодной воде порошок (с горячей водой образует вязкий клейстер). Целлюлоза — твердое волокнистое вещество. Известная всем вам вата — почти чистая целлюлоза (её содержание составляет примерно 98 %). Различия между этими полисахаридами наблюдаются и в химических свойствах, в частности способности гидролизоваться. В случае быстрого нагрева крахмала с небольшим количеством воды происходит частичный гидролиз с образованием декстринов, имеющих более короткие, чем у крахмала, цепи. При выпечке хлебобулочных изделий декстрины образуют хрустящую корочку, а при глажке накрахмаленного белья придают ему блеск. При полном гидролизе крахмала получают глюкозу:
обладают достаточно разными физическими свойствами. Крахмал — белый, хрустящий на ощупь, нерастворимый в холодной воде порошок (с горячей водой образует вязкий клейстер). Целлюлоза — твердое волокнистое вещество. Известная всем вам вата — почти чистая целлюлоза (её содержание составляет примерно 98 %). Различия между этими полисахаридами наблюдаются и в химических свойствах, в частности способности гидролизоваться. В случае быстрого нагрева крахмала с небольшим количеством воды происходит частичный гидролиз с образованием декстринов, имеющих более короткие, чем у крахмала, цепи. При выпечке хлебобулочных изделий декстрины образуют хрустящую корочку, а при глажке накрахмаленного белья придают ему блеск. При полном гидролизе крахмала получают глюкозу:
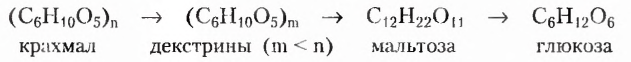
Гидролиз целлюлозы происходит труднее, чем крахмала, с образованием иных промежуточных веществ, однако конечным продуктом также является глюкоза.
На основе теории строения органических соединений Л. М. Бутлерова объясните разные свойства крахмала и целлюлозы.
Молекулы крахмала и целлюлозы отличаются порядком соединения мономеров при синтезе, степенью полимеризации и формой цепи. Если у целлюлозы она преимущественно линейная, то у крахмала наряду с линейными макромолекулами, характеризующимися спиралеобразной структурой, присутствуют и разветвлённые.
Крахмал — это запасное вещество растений, содержащееся в клубнях картофеля (около 25 %), зерновках пшеницы (около 75 %) и риса (до 80 %). Целлюлоза — основное конструкционное вещество стволов растений, оболочек клеток. Достаточно отметить, что ствол дерева на 50 % и более состоит из целлюлозы. Целлюлозу широко применяют в хозяйственной деятельности для изготовления искусственных волокон, лаков, пластмасс, взрывчатки, мебели, строительных материалов и т. д. Распространение углеводов в природе изображено на рисунке 9.
Жиры
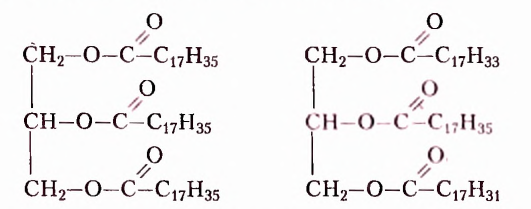
Подсолнечное и кукурузное масло, сливочное масло и сало, летучие жидкости с приятным ароматом цветов или фруктов имеют сходное строение, поскольку образованы взаимодействием спиртов и карбоновых кислот. Они принадлежат к классу оксигеносодержащих веществ — эстеров. Молекулы эстеров, обусловливающие неповторимые ароматы цветов и фруктов, содержат остатки одноатомных спиртов и низших карбоновых кислот — кислот с небольшим количеством атомов Карбона (менее 10). Эстеры, со держащие остатки глицерола (глицерина) и высших карбоновых кислот (более 10 атомов Карбона), получили название жиры. Общая формула жиров
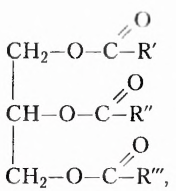

где  — остатки высших карбоновых кислот.
— остатки высших карбоновых кислот.
Природные жиры по происхождению разделяют на животные и растительные.
Жиры животного происхождения (свиной, говяжий, бараний жир, сливочное масло) содержат остатки насыщенных высших карбоновых кислот и являются преимущественно твёрдыми (исключение рыбий жир). В их состав входят остатки таких высших карбоновых кислот, как пальмитиновая 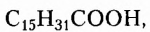 маргариновая
маргариновая 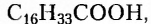 стеариновая
стеариновая 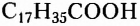 и некоторые другие.
и некоторые другие.
Жиры растительного происхождения, называемые ещё растительными маслами, содержат в основном остатки ненасыщенных высших карбоновых кислот, в частности олеиновой 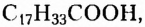 и имеют преимущественно жидкое агрегатное состояние (например, подсолнечное, кукурузное, оливковое масла). Однако существуют и твёрдые жиры растительного происхождения (пальмовое и кокосовое масла).
и имеют преимущественно жидкое агрегатное состояние (например, подсолнечное, кукурузное, оливковое масла). Однако существуют и твёрдые жиры растительного происхождения (пальмовое и кокосовое масла).
Обратите внимание, что в формулах пальмитиновой, маргариновой и стеариновой кислот содержатся одновалентные остатки насыщенных углеводородов (заместители 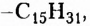
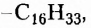
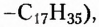 тогда как у олеиновой кислоты имеется одновалентный остаток ненасыщенного углеводорода
тогда как у олеиновой кислоты имеется одновалентный остаток ненасыщенного углеводорода 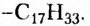
Распространение жиров в природе и жиров как продукта питания иллюстрирует рисунок 10.

Белки
Эти сложные нитрогеносодержащие биополимеры входят в состав всех организмов. Учёные исследовали более 1000 белков, некоторые из них удалось синтезировать. Синтез белка — настолько важная и сложная научная работа, что учёным, которые этим занимались, неоднократно присуждалась Нобелевская премия (1958, 1962, 1968, 2009 гг.).
Наибольшее содержание белков в коже, мышцах, хряшах, ногтях, волосах человека и животных. Белковую природу также имеют. ферменты — катализаторы химических реакций в организмах; гемоглобин — вещество в составе крови человека и некоторых животных, обеспечивающее перенос кислорода; антитела — вещества, продуцируемые иммунной системой и разрушительно действующие на вирусы и микробы, попадающие в организм. Высокое содержание белков в икринках рыб и земноводных, яйцах птиц.
Вспомните из курса биологии особенности размножения рыб, земноводных, птиц и обоснуйте необходимость большого содержания белка в икринке и яйце.
Мономерами белков являются 20 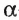 -аминокислот. Каждый белок характеризуется разным количеством аминокислотных остатков и последовательностью их соединения в полимере. «Ответственными» за синтез белков природа «назначила» нуклеиновые кислоты.
-аминокислот. Каждый белок характеризуется разным количеством аминокислотных остатков и последовательностью их соединения в полимере. «Ответственными» за синтез белков природа «назначила» нуклеиновые кислоты.
Вспомните из изученного на уроках биологии, как происходит синтез белка в клетке.
Состав белков организма человека зависит от пола, возраста, кулинарных предпочтений и других факторов.
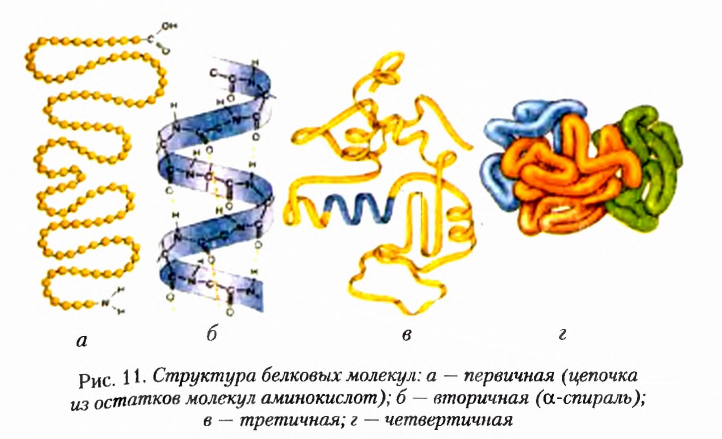
Структурные уровни организации веществ.
Общенаучные и философские взгляды на единство материального мира, научно-естественную картину мира стали основой для рассмотрения органических веществ в соответствии с уровнями структурной организации. В химии таковой является трёхуровневая структурная организация веществ, отвечающая современному состоянию развития науки. Уровни получили названия атомный, молекулярный, полимерный. Как вам известно, среди органических веществ нет простых веществ, а потому органическим соединениям присущи последние два уровня. Кроме того, целостность знаний об уровнях структурной организации органических веществ в общенаучном и философском аспектах детерминировала выделение ещё одного уровня, но уже в биологической науке. Его назвали клеточным.
Вспомните уровни организации живой природы.
Рассмотрим и сравним признаки молекулярного и полимерного уровней организации органических веществ.
На молекулярном уровне структурными единицами вещества являются молекулы, которые имеют постоянный качественный и количественный состав и постоянную относительную молекулярную массу, характеризуются наличием преимущественно ковалентных связей. Строение молекул — линейное, разветвлённое, циклическое. На этом уровне у вещества существуют структурные изомеры, оно имеет определённое пространственное строение.
На полимерном уровне структурной единицей вещества является макромолекула. Состав макромолекул переменный, относительная молекулярная масса характеризуется средним значением (исключение составляют белки и нуклеиновые кислоты). Свойства полимерного вещества зависят: от степени полимеризации, а он, как известно, может находиться в широких пределах; порядка соединения структурных звеньев в макромолекулах; взаимного пространственного размещения заместителей относительно главной цепи. У веществ полимерного уровня присутствуют не только ковалентные, но и межмолекулярные связи.
Вещества обоих уровней структурной организации имеют молекулярные кристаллические решётки.
На полимерном уровне организации веществ свойства органических соединений зависят прежде всего от состава структурных звеньев и степени полимеризации.
Для более полной характеристики уровня структурной организации веществ рассматривают также их пространственное строение. В пространственном строении веществ полимерного уровня прослеживаются различные конформации.
Конформации — геометрические формы, которые могут приобретать молекулы органических соединений при вращении атомов или групп атомов (заместителей) вокруг простых связей с сохранением химического строения, длины связей и валентных углов.
Показательны в этом плане белки. Вы уже знаете о первичной, вторичной, третичной и четвертичной структурах белковых молекул. Различные конформации участков полипептидных цепей и связи, возникающие между ними, обусловливают их пространственные формы. Убедиться в этом поможет рисунок 11.
Многие из вас пьют чай с сахаром и лимоном. Но, пожалуй, не все знают, что кружочек лимона в чашке сладкого чая — это не только вкусовая добавка, но и катализатор, способствующий быстрому гидролизу сахарозы и поступлению образованных продуктов в кровь.
Из углеводов человек преимущественно потребляет сахарозу (сахар).
Каждый мёд имеет своеобразный вкус, цвет, индивидуальный состав веществ — около 300. Однако основными в составе всех сортов мёда являются два углевода — глюкоза и её изомер фруктоза. На них приходится в среднем 80 % от общей массы мёда (фруктозы немного больше глюкозы), тогда как сахарозы в мёде лишь около 5 %. Содержание воды в составе мёда изменяется от 15 до 21 %. С увеличением количества глюкозы повышается способность мёда к кристаллизации, а фруктоза придаёт ему сладость. Мёд гигроскопичен, поэтому его нужно хранить закрытым.
Глюкоза и фруктоза попадают в мёд из нектара цветов преимущественно в готовом виде, некоторые компоненты этого целебного продукта образуются в результате химических реакций в ячейках сот. В состав мёда входят также соединения, придающие ему неповторимый аромат, витамины, органические кислоты и некоторые другие вещества. Всё это вместе делает мёд вкусным и целебным.
Анализ некоторых продуктов питания предусматривает определение наличия в них крахмала, глюкозы, сахарозы. Вы также можете провести распознавание этих веществ в лабораторных условиях и даже дома.
Крахмал выявляют с помощью раствора иода. Содержание даже незначительного количества крахмала в исследуемом продукте повлечёт посинение раствора йода. Этим можно воспользоваться для того, чтобы убедиться, что купленная вами сметана не содержит крахмала.
Растворы глюкозы и сахарозы внешне ничем не отличаются. Поэтому распознавание можно провести с помощью купрум( ) гидроксида при наличии щёлочи или с помощью аммониачного раствора аргентум
) гидроксида при наличии щёлочи или с помощью аммониачного раствора аргентум нитрата
нитрата  Под влиянием купрум(
Под влиянием купрум( ) гидроксида раствор глюкозы приобретает интенсивную синюю окраску, что характерно для многоатомных спиртов. При дальнейшем нагревании этого раствора цвет постепенно меняется на жёлтый, характерный для купрум(1) гидроксида, а впоследствии выпадает красно-оранжевый осадок купрум
) гидроксида раствор глюкозы приобретает интенсивную синюю окраску, что характерно для многоатомных спиртов. При дальнейшем нагревании этого раствора цвет постепенно меняется на жёлтый, характерный для купрум(1) гидроксида, а впоследствии выпадает красно-оранжевый осадок купрум оксида. Альдегидная группа глюкозы при этом окисляется, образуется глюконовая кислота:
оксида. Альдегидная группа глюкозы при этом окисляется, образуется глюконовая кислота:
При нагревании раствора глюкозы с аммониачным раствором аргентум нитрата наблюдается оседание серебра на стенках колбы (рис. 12). Поэтому реакция получила название «реакция серебряного зеркала
нитрата наблюдается оседание серебра на стенках колбы (рис. 12). Поэтому реакция получила название «реакция серебряного зеркала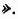 Описанный процесс отображают уравнения реакций:
Описанный процесс отображают уравнения реакций:
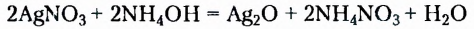
В отличие от глюкозы для сахарозы эти качественные реакции не характерны.
Подумайте, как экспериментальным путём распознать натуральный мёд и искусственный — полученный кристаллизацией сахарозы с добавлением крахмала.

Молекулы глюкозы могут быть как ациклического (см. с. 34), так и циклического строения, шестичленный цикл которых образован из 5 атомов Карбона и 1 атома Оксигена:
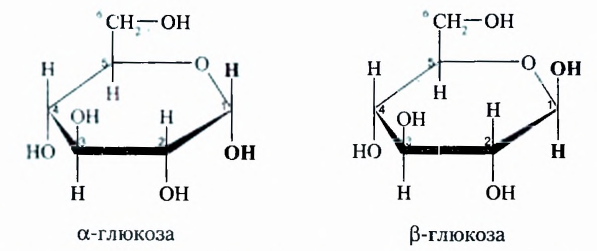
Отличие в этих двух формулах заключается в разном пространственном размещении гидроксильной группы -ОН у первого атома Карбона.
Жиры, белки, углеводы как компоненты пищи, их роль в организме
Одним из отличительных признаков живой природы является питание, благодаря которому организмы обеспечивают себя веществами для построения собственного тела и энергией для жизнедеятельности (роста и развития, движения, размножения и т. д.).
Постоянные затраты организмами веществ и энергии требуют регулярного поступления достаточного количества углеводов, жиров, белков. Вследствие фотосинтеза растения сами обеспечивают себя органическими веществами, необходимыми для роста и развития. В отличие от них животные и человек получают большинство органических веществ с пищей.
В зависимости от источников поступления органических веществ в качестве компонентов пищи животные делятся на растительноядные, плотоядные и всеядные. Человек (как биологический вид Homo sapiens) относится к всеядным существам.
Такие компоненты пищи, как жиры, белки, углеводы, не включаются в структуры тела человека в потребляемом виде. Из курса биологии вам известно, что сначала в органах пищеварения они подвергаются химическим превращениям, в результате которых расщепляются (гидролизуются) на молекулы веществ, из которых образовались.
Полисахариды и дисахариды гидролизуются на моносахариды, жиры — на глицерол (глинерин) и карбоновые кислоты, белки — на аминокислоты.
Жиры как компоненты пищи, их биологическая роль
Организм человека с продуктами питания получает жиры как растительного, так и животного происхождения. Что касается растительной пищи, то большинство жиров мы употребляем в виде различных сортов масла, а также с семенами подсолнечника и тыквы, плодами грецкого ореха и оливок.
Поступление жиров животного происхождения происходит преимущественно при употреблении сала, мяса, рыбы, сыра, сметаны, сливочного масла, молока и т. и. Одна из основных биологических функций жиров энергетическая, поскольку при окислении 1 г жира выделяется вдвое больше энергии, чем при окислении такой же порции белка. Вместе с тем жиры выполняют и другие функции: защитную (подкожный слой жира у животных защищает их организм от переохлаждения); транспортную (транспортируют жирорастворимые витамины); резервную (некоторым организмам, например верблюдам, свойственно откладывание жиров «про запас» с последующим их использованием в случае отсутствия корма и воды); структурную (входят в состав клеточных мембран).
Достаточное количество жиров в пищевом рационе человека — залог устойчивого иммунитета, слаженной работы
нервной системы. Избыточное потребление жиров может вызвать нарушения в обмене веществ и привести к различным
заболеваниям.
Понятие о незаменимых кислотах
В составе растительных масел и рыбьего жира в организм человека поступают остатки высших карбоновых (или жирных) кислот:
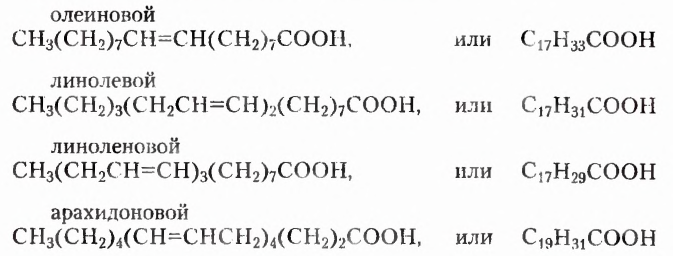
Углеводородные заместители первых трёх кислот состоят из 17 атомов Карбона, однако цепь олеиновой кислоты содержит одну двойную связь, в составе линолевой кислоты есть две двойные связи, у линоленовой — три изолированные двойные связи. Заместитель арахидоновой кислоты построен из 19 атомов Карбона и содержит четыре изолированные двойные связи. Указанные кислоты обеспечивают здоровое состояние кожи и волос, выполняют регуляторные функции, в частности нормализуют жировой обмен, способствуют снижению веса. При их острой нехватке замедляется рост, возникают заболевания кожи (дерматиты).
Жирные кислоты, а также аминокислоты разделяют на заменимые и незаменимые.
Заменимые кислоты, например олеиновая 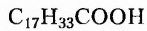 и пальмитиновая
и пальмитиновая 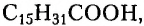 могут образовываться в организме человека.
могут образовываться в организме человека.
Незаменимыми называют кислоты, которые не синтезируются организмом человека, и поэтому должны поступать в него с продуктами питания или лекарственными препаратами. Так, незаменимыми для человека жирными кислотами являются линолевая 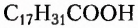 и арахидоновая
и арахидоновая 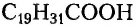 (хотя при определённых условиях организм может синтезировать её). Интересно, что в 12 чайных ложках семечек подсолнечника содержится суточная норма этой кислоты.
(хотя при определённых условиях организм может синтезировать её). Интересно, что в 12 чайных ложках семечек подсолнечника содержится суточная норма этой кислоты.
Вы уже выяснили, что жиры животного происхождения и растительные масла отличаются между собой химическим строением молекул (см. §4).
В состав молекул растительных жиров входят преимущественно остатки ненасыщенных высших карбоновых кислот (олеиновой, линолевой, линоленовой, арахидоновой), в состав молекул твёрдых жиров животного происхождения — преимущественно остатки насыщенных высших карбоновых кислот (пальмитиновой, маргариновой, стеариновой).
Как вы считаете, что экономически выгоднее в получении жиров — выращивание подсолнечника или выкармливание свиней?
Естественно, что выращивание подсолнечника требует значительно меньших затрат. Поэтому учёные предложили способ получать дешёвые твёрдые жиры из растительного масла путём его гидрирования (гидрогенизации) — присоединения водорода (при нафевании с участием катализатора). Покажем это на примере жира с тремя остатками олеиновой кислоты 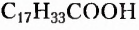 в молекуле:
в молекуле:
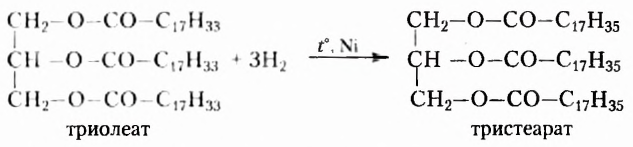
Таким образом из остатков ненасыщенных карбоновых кислот образуются остатки насыщенных кислот, жидкий жир превращается в твёрдый.
Полученная твёрдая масса имеет название саломас. Из неё изготавливают маргарины, спрэды (смеси молочных и растительных жиров), добавляя различные питательные вещества, красители, ароматизаторы и другие пищевые добавки.
Белки как компоненты пищи
Вам уже известно, что аминокислоты, в молекулах которых аминогруппа 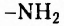 и карбоксильная группа -СООН расположены у одного атома Карбона (а-амино-кислоты), являются мономерами природных биополимеров — белков. Их общая формула:
и карбоксильная группа -СООН расположены у одного атома Карбона (а-амино-кислоты), являются мономерами природных биополимеров — белков. Их общая формула:

Известно более 100 аминокислот, однако в состав белковых молекул входят остатки только 20  -аминокислот, соединённых пептидной связью:
-аминокислот, соединённых пептидной связью:
Зелёные растения и многие бактерии способны синтезировать аминокислоты. У животных и человека эта способность ограничена. Обеспечение их организмов белками и аминокислотами происходит при потреблении корма и пищи. Продуктами питания с высоким содержанием белков являются рыба, мясо, яйца, икра, хлеб, молоко. Если содержание белков в пище превышает суточную потребность в них человека, то это не вредит организму, поскольку избыток аминокислот используется им как источник энергии
Как и жирные кислоты, аминокислоты делят на заменимые и незаменимые. Заменимые аминокислоты организм человека синтезирует сам при наличии избытка других  -аминокислот, а незаменимые должен получать с пищей. Для человека незаменимыми являются такие аминокислоты (ознакомьтесь с ними, формулы запоминать необязательно):
-аминокислот, а незаменимые должен получать с пищей. Для человека незаменимыми являются такие аминокислоты (ознакомьтесь с ними, формулы запоминать необязательно):
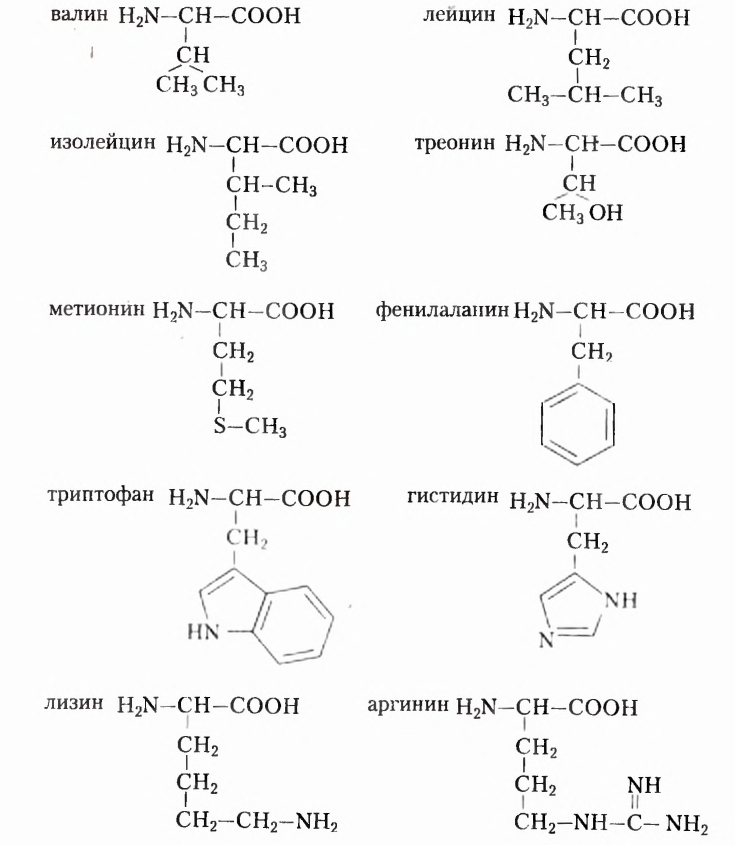
Аргинин отнесён к незаменимым аминокислотам потому, что организм новорождённых детей и детей раннего возраста не способен синтезировать суточную норму аргинина. С возрастом перечень незаменимых кислот несколько меняется, и поэтому у пожилых людей он меньше.
Если рацион человека богат такими продуктами питания, как мясо, яйца, молоко, сыр (рис. 13), то оснований волноваться относительно аминокислотного дисбаланса нет. Объясняется это тем, что большинство белков животного происхождения имеют схожий с белками человека аминокислотный состав. Белки же растительного происхождения беднее на незаменимые аминокислоты, чем животные. Наибольшее содержание белков в зерновках злаковых, особенно в пшенице, в плодах бобовых культур (соя, горох, фасоль).

Функции белков
Биологическая роль белков в сравнении со всеми другими органическими соединениями самая разнообразная. Об их энергетической функции уже упоминалось. При использовании белков как источника энергии они разлагаются на вещества, которые выводятся из организма с потом и мочой. Это аммониак 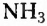 и карбамид (или мочевина)
и карбамид (или мочевина) 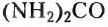 — основной конечный продукт распада белков в организме человека.
— основной конечный продукт распада белков в организме человека.
Вместе с тем более важной, чем энергетическая, считается строительная, или структурная, функция белковых молекул. Она заключается в том, что из молекул белков построены клеточные мембраны, белки входят в состав почти всех клеточных структур, а также это основные вещества мышц. Белковую природу имеют хрящи, сухожилия, ногти, когти, перья, волосы.
Защитная функция белков очень разнообразна: белки кожных покровов защищают организм снаружи; белки с общим названием иммуноглобулины обезвреживают болезнетворные бактерии и вирусы внутри организма; белковые соединения крови способны защитить организм от её потери при неглубоких порезах.
Вспомните механизм свёртывания крови. Какова в нём роль белков?
Ещё одна функция белков — ферментативная, или каталитическая. В организме животных и человека за считанные секунды слаженно и с большой скоростью происходят сложные реакции, на которых основан обмен веществ и энергии. Уникально то, что для этого достаточно температуры +36-38 °С и нормального атмосферного давления. Всё это происходит благодаря наличию и эффективному воздействию на химические превращения в клетках почти 2 тысяч видов ферментов.
Ферменты — катализаторы белковой природы, в миллионы
и миллиарды раз ускоряющие химические реакции в живых системах (неорганические катализаторы увеличивают скорость химических реакций в сотни и тысячи раз).
С участием ферментов происходят практически все биохимические процессы в клетке.
Вспомните определение катализаторов, приведите известные вам примеры каталитических реакций в неорганической и органической химии.
Белки мышц наделены сократительной, или двигательной, функцией, благодаря которой клетка, ткань или весь организм могут двигаться, изменять форму.
Запасающая функция белков отчётливо прослеживается на примере эндосперма семян растений, яйцеклеток рыб, земноводных, птиц. Эта функция особенно важна на ранних этапах развития нового организма.
Итак, перечень биологических функций белков достаточно велик и может быть продлён.
Углеводы как компоненты пищи и их роль в организме
В отличие от жиров и белков, поступающих в организм человека как с растительной, так и с животной нищей, углеводы (моносахариды, дисахарнды, полисахариды) — это компоненты преимущественно растительной пищи. Их содержание составляет более 80 % сухого вещества, тогда как пища животного происхождения содержит лишь 2 % углеводов. Главная функция углеводов — энергетическая. Почти 70 % вырабатываемой в организме человека энергии является продуктом обмена углеводов.
Углеводы — основной энергетический материал клеток.
В пищеварительной системе происходит гидролиз углеводов с образованием моносахаридов, которые кровь поставляет клеткам, где вследствие окисления выделяется энергия, образуются углекислый газ и вода.
Суточная потребность человека в белках, жирах и углеводах зависит от возраста, образа жизни, профессии, состояния здоровья и т. д. Но при любых условиях потребление углеводов в 4-5 раз превышает потребление жиров и белков.
Большую часть суточной нормы углеводов организм человека получает из растительной пищи в виде крахмала (картофель, хлеб, крупы, макароны), меньшую — в виде глюкозы (соки, фрукты) и сахарозы (сахар). С мясом поступает небольшое количество гликогена — полисахарида животного происхождения.
Клетчатка, или целлюлоза, для человека не имеет пищевой ценности, поскольку устойчива к действию ферментов и в организме не подвергается гидролизу. Однако её по праву можно отнести к растительным компонентам пищи, поскольку употребление клетчатки является обязательным для нормализации работы кишечника, выведения из организма вредных веществ. Основной источник клетчатки для организма человека — фрукты и овощи. Кроме того, клетчаткой богаты отруби, из которых специально для увеличения поступления клетчатки в организм человека выпекают некоторые виды хлеба.
Значение органических веществ в решении сырьевых проблем
Природные органические соединения — не только полезные компоненты пищи, отдельные из них используют также как сырьё в различных производствах. Это касается прежде всего древесины, которая на 50 % состоит из целлюлозы и является ценным строительным материалом, сырьём целлюлозно-бумажной промышленности, производства искусственных (ацетатного, вискозного) волокон. Крахмал, а также сахар в промышленных масштабах используют для производства медицинского спирта, а целлюлозу спирта технического назначения. Отдельные виды клея имеют белковое происхождение. Этанол как растворитель и обеззараживающее средство, крахмал в качестве наполнителя таблеток, вата, глюкоза и другие вещества и изделия из них получили широкое применение в фармацевтической промышленности. На основе многих природных органических соединений изготавливают косметическую продукцию.
В 9 классе вы ознакомились с понятием денатурация белков — разрушение их естественной пространственной структуры (вторичной, третичной, четвертичной, но с сохранением первичной). Термическую денатурацию белков хозяйки осуществляют почти ежедневно, готовя блюда из мяса или яиц.
Белки куриного яйца легко гидролизуются и быстро всасываются в кровь, утоляя чувство голода. Благодаря денатурации белков при отваривании яиц ускоряется их разложение в желудочно-кишечном тракте. Диетологи советуют употреблять яйиа всмятку.
Обратимая денатурация белков — очень редкое явление. К счастью, оно имеет место при таком заболевании, как сотрясение мозга. Для того чтобы результат лечения был положительным, нужно неукоснительно соблюдать рекомендации врача.
В последнее время на продуктах питания запестрели надписи-«Не содержит ГМО», «Без ГМО» (рис. 14). Что они означают?

Проблема обеспечения людей достаточным количеством продуктов питания в наши дни весьма актуальна. Один из способов её решения предложила генная инженерия. Он состоит в том, что на генном уровне изменяют наследственный материал (ДНК), в результате чего организм приобретает новые качества. К настоящему времени удалось модифицировать более 60 видов растений. Например, выведены сорта картофеля, которые не поедают колорадские жуки, зерновые культуры, которые не повреждаю! насекомые, устойчивые к средствам борьбы с вредителями и сорняками. В отдельных случаях изменения на генном уровне ускоряют рост растений, созревание плодов и т. д.
Подробнее с достижениями генной инженерии ознакомьтесь, рассмотрев таблицу 4.


Достижения генной инженерии вызывают не только восхищение, но и беспокойство. Ведь результаты исследований, которые бы гарантировали, что употребление ГМО не будет иметь негативных последствий для человека и его потомков, отсутствуют по той простой причине, что достоверными будут только результаты в третьем поколении, то есть примерно через 70-75 лет. Поэтому существуют опасения, что генетически модифицированные продукты могут вызвать изменения генотипа человека, а это очень опасно.
Медики советуют не пренебрегать собственным здоровьем и избегать продуктов с маркировкой «Содержит ГМО», оказывать предпочтение продуктам, выращенным на собственном огороде.
Витамины как компоненты пищи, их биологическая роль. Пищевые добавки, Е-числа
Понятие о витаминах. Сегодня ни у кого не вызывает сомнения утверждение о том, что витамины необходимы для жизнедеятельности человека и животных.
Витамины — низкомолекулярные органические соединения различных классов, которые в небольших количествах непременно нужны для обеспечения нормальной жизнедеятельности организмов.
Выделение витаминов как группы веществ произошло не по сходству строения и химических свойств соединений, а по их общему значению в живой природе — биологической роли.
Ещё полтора века назад о витаминах и понятия не имели, однако их недостаток приводил к тяжёлым заболеваниям рахитом, куриной слепотой, цингой.
Вспомните из биологии причины и симптомы этих заболеваний.
Изучение состава и свойств витаминов было предложено исследованиями русского врача Н. И. Лунина. Учёный экспериментально доказал, что для нормального функционирования организмов животных и человека, кроме органических соединений белков, жиров и углеводов, необходимы и другие, неизвестные в то время компоненты пищи. После их открытия они получили название витамины (от латин. vita - жизнь). Сейчас учёным удалось получить витамины в чистом виде, исследовать их строение и свойства, благодаря чему появилась возможность синтезировать витамины за пределами живого организма, то есть наладить промышленное производство.
К витаминам относят более 20 органических веществ природного происхождения, немало их аналогов синтезированы химическим путём. Витамины, кроме названия, имеют условные обозначения заглавными буквами латинского алфавита.
С обозначениями, названиями витаминов и средней суточной нормой их для взрослого человека ознакомьтесь, рассмотрев таблицу 5.

Из приведённых ниже для ознакомления (не для запоминания) формул видим, что витамины имеют весьма разнообразное химическое строение:
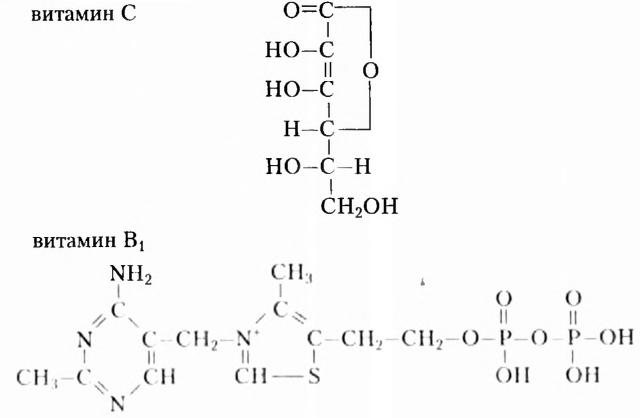
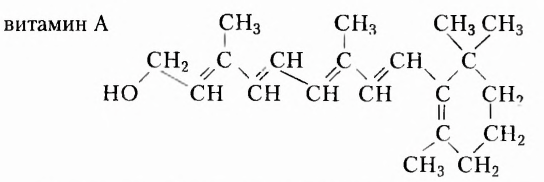
Состав витаминов характеризуется обязательным наличием атомов Карбона, Гидрогена, Оксигена и Нитрогена. Однако существуют витамины, качественный состав которых дополнен атомами других химических элементов.
По способности растворяться в воде витамины делят на водорастворимые (например.  ) и жирорастворимые (например,
) и жирорастворимые (например,  ). Водорастворимые витамины не накапливаются в организме человека, поэтому должны поступать постоянно. Для усвоения жирорастворимых витаминов витаминосодержащие блюда приправляют жирами.
). Водорастворимые витамины не накапливаются в организме человека, поэтому должны поступать постоянно. Для усвоения жирорастворимых витаминов витаминосодержащие блюда приправляют жирами.
Витамины и здоровье человека:
Потребность в витаминах каждого человека индивидуальна и зависит от возраста, состояния здоровья и даже времени года.
То, что витамины нужны в очень малом количестве, доказывает такое сравнение: если собрать все витамины, которые составляют суточную норму человека, в одну порцию, то она будет иметь размер, меньший семени проса. Однако для здоровья человека важна не масса, а биологическая роль витаминов.
Организм человека очень чувствителен к содержанию в нём каждого из витаминов, и ему одинаково опасны как их недостаток, так и избыток. При недостатке витаминов развивается заболевание гиповитаминоз, при избытке — гипервитаминоз. Состояние, когда витамины в организме отсутствуют, называют авитаминозом.
Организм человека так устроен, что не синтезирует большинства витаминов, а потому поступление их с пищей обязательно. С целью профилактики авитаминоза можно прибегнуть к употреблению витаминных препаратов — поливитаминов, одна таблетка которых содержит не только комплекс витаминов, но и неорганические компоненты (микроэлементы). Но перед тем, как воспользоваться изготовленными синтетическим способом витаминами, выясните, насколько сбалансированным по каждому из компонентов пищи является ваше питание, какие продукты преобладают в нём — рафинированные или нерафинированные, прошедшие тепловую обработку или нет, достаточно ли в нём витаминов.
Если ваша пища является разнообразной и полноценной, то и волноваться о недостатке витаминов не нужно.
Организм человека получает витамины с растительными и животными компонентами пищи. Во время приготовления и употребления блюд надо помнить, что несоблюдение правил хранения продуктов питания, нарушение технологии кулинарной обработки уменьшают содержание биологически активных веществ, особенно витаминов.
Биологическая роль витаминов: Витамины регулируют в организме обмен веществ через систему ферментов, комплексно действуя с ними. И недостаток даже одного витамина опасен, ибо нарушаются обменные процессы, вследствие чего развиваются разного рода заболевания.
Витамины — необходимый компонент сложного процесса обмена веществ. Их недостаток сказывается на самочувствии человека, работоспособности, устойчивости к различным заболеваниям.
С биологической ролью отдельных витаминов вы ознакомились, изучая биологию. Вспомним и рассмотрим источники поступления витаминов в организм человека, воспользовавшись рисунком 15.
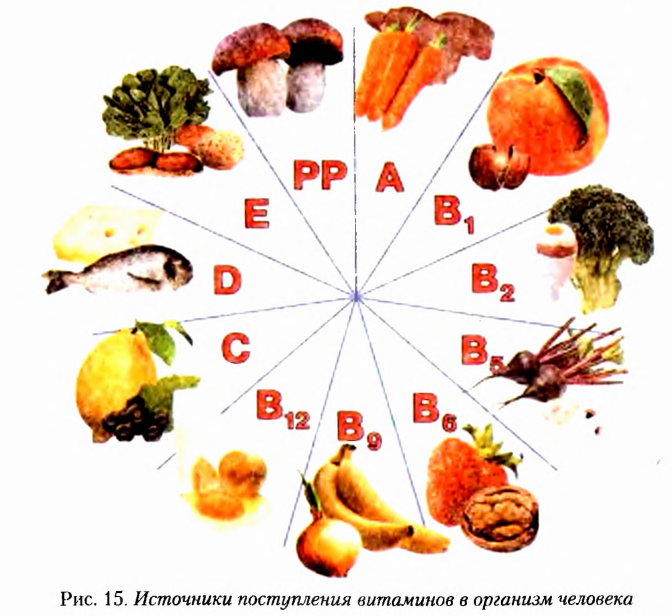
Витамин С (аскорбиновая кислота) повышает защитные силы организма, улучшает эластичность сосудов, делает организм устойчивым к заболеваниям дыхательных путей, стимулирует деятельность эндокринной и центральной нервной систем, способствует лучшему усвоению ионов Феррума и нормальному кроветворению.
Недостаток витамина С проявляется усталостью, кровоточивостью десен, снижением сопротивляемости организма инфекциям. В случае авитаминоза развивается такое заболевание, как цинга.
Источниками витамина С являются шиповник, кизил, чёрная смородина, плоды цитрусовых, красный перец, хрен, петрушка, зеленый лук, укроп, картофель, капуста, лесные ягоды и т. д.
Витамин А (ретинол) влияет на рост человека, улучшает состояние кожи, усиливает сопротивляемость организма инфекциям. При недостатке витамина А ухудшается зрение, что может привести к болезни, называемой куриная слепота, развивается сухость кожи, организм теряет массу.
В отличие от витамина С, которого больше всего и растительной пище, источниками витамина А являются продукты животного происхождения — рыбий жир, жиры молока, сливочное масло, сыр яйца, печень и т. д. В растениях содержится каротин, который при поступлении в организм человека при наличии жиров превращается в витамин А, то есть является провитамином.
Вещества пищи, превращающиеся в организме человека в витамины, получили название провитамины.
Каротином богаты морковь, красный перец, абрикосы, тыква и т д
Витамины группы В регулируют выработку энергии в организме. Они улучшают память, уменьшают боли при радикулитах, невритах, заболеваниях органов пищеварения.
Витамин  (тиамин) положительно влияет на мышцы и нервную систему, образует комплексы с ферментами, регулирующими обмен углеводов и аминокислот. Он содержится преимущественно в растениях (зёрнах пшеницы, гречихи, нроса, овса), орехах, абрикосах, шиповнике, капусте. Богат витамином В, пшеничный хлеб грубого помола. Тиамин есть также в молоке, мясе, яичном желтке дрожжах.
(тиамин) положительно влияет на мышцы и нервную систему, образует комплексы с ферментами, регулирующими обмен углеводов и аминокислот. Он содержится преимущественно в растениях (зёрнах пшеницы, гречихи, нроса, овса), орехах, абрикосах, шиповнике, капусте. Богат витамином В, пшеничный хлеб грубого помола. Тиамин есть также в молоке, мясе, яичном желтке дрожжах.
Витамин 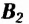 (рибофлавин) влияет на рост и восстановление клеток, участвует в процессах окисления в тканях тела человека, поддерживает нормальное функционирование органов зрения
(рибофлавин) влияет на рост и восстановление клеток, участвует в процессах окисления в тканях тела человека, поддерживает нормальное функционирование органов зрения
Природными источниками витамина 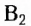 являются печень, молоко, яйца, дрожжи, а также зернобобовые растения, шиповник, абрикосы, капуста, помидоры.
являются печень, молоко, яйца, дрожжи, а также зернобобовые растения, шиповник, абрикосы, капуста, помидоры.
Витамин 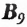 (фолиевая кислота) участвует в процессах кроветворения, а также в синтезе нуклеиновых кислот. Больше всего его в зелени и овощах — петрушке, фасоли, шпинате, салате, а также в печени, почках, хлебе, луке, бананах, сыре.
(фолиевая кислота) участвует в процессах кроветворения, а также в синтезе нуклеиновых кислот. Больше всего его в зелени и овощах — петрушке, фасоли, шпинате, салате, а также в печени, почках, хлебе, луке, бананах, сыре.
Витамин D (кальциферол) регулирует фосфорно-кальцневый обмен в организме. Он обеспечивает всасывание ионов Кальция в кишечнике и транспортировку их в костную ткань. При дефиците этого витамина в костях недостаточно откладывается соединений Кальция, у детей возникает заболевание рахитом.
Самыми богатыми источниками витамина D являются рыба и морепродукты.
Витамин Е (токоферол) способствует усвоению белков и жиров, участвует в процессах тканевого дыхания, влияет на работу мозга, нервной системы, мышц, задерживает старение, ускоряет заживление ран. Особенно важен он для людей, испытывающих большие физические нагрузки.
Источник витамина Е — преимущественно растения. Больше всего его в нерафинированном масле, особенно в подсолнечном, орехах, проросших зёрнах пшеницы и ржи, помидорах, петрушке, шпинате, плодах шиповника. В небольшом количестве витамин Е содержится в мясе, жире, молоке, печени.
Витамин PР(ниацин, или никотиновая кислота) задействован в клеточном дыхании и обмене белков, регулирует высшую нервную деятельность, работу органов пищеварения. Источниками витамина РР являются мясные продукты, особенно печень и почки, яйца, молоко, а также грибы, изделия из муки грубого помола, крупы (особенно гречневая). Содержание его в овощах незначительно.
Самостоятельно подготовьте информацию о биологической роли, источниках и значении других витаминов.
Витамины вместе с белками, жирами,.углеводами и неорганическими компонентами пищи обеспечивают рост и развитие организмов. Витамины не являются
источниками энергии или строительным материалом клеток, однако совместно с ферментами они регулируют обмен веществ и энергии. В этом состоит их биологическая роль.
Пищевые добавки, Е-числа: Вам хорошо известно применение поваренной соли, уксуса, соды, сахара, лимонной кислоты. Их в небольшом количестве непременно добавляют в продукты питания для улучшения вкуса, увеличения срока хранения и т. д. Отсюда и название пищевые добавки.
Пищевые добавки — это вещества, которые добавляют в продукты, чтобы продлить срок их годности (избежать быстрой порчи), изменить цвет, консистенцию и т. д.
В Европе для таких веществ разработана система кодификации с присвоением буквенных кодов — Е-чисел.
Нумерацию пищевых добавок начинают с числа 100 Серии «Е» от 100 до 199 — это красители, от 200 до 299 — консерванты, от 300 до 399 антиоксиданты. Далее идут загустители, эмульгаторы усилители вкуса и аромата, пеногасители. Такая классификация является условной, поскольку одно и то же вещество может быть, скажем, и консервантом, и антиоксидантом одновременно (например, натрий сульфит Е221). Перечни пищевых добавок, пригодных к использованию, утверждают соответствующими государственными постановлениями.
Многие пищевые добавки имеют природное происхождение. Например, Е330 — лимонная кислота, высокое содержание которых в плодах цитрусовых растений. В томатах, моркови содержится Е160а — каротин или провитамин А, Е101 — уже известный вам как витамин 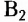 (рибофлавин). Классификация пищевых добавок и их функции приведены в таблице 6.
(рибофлавин). Классификация пищевых добавок и их функции приведены в таблице 6.

Сырокопчёные колбасы, изделия из варёного мяса, сгущённое молоко, сыры, икра зернистая, кремы, джемы, повидло, маргарин, майонез, безалкогольные напитки, печенье, соки — это лишь небольшая часть бесконечно длинного перечня продуктов, в изготовлении которых применяют пищевые добавки (рис. 16).

Кроме положительных результатов применения пищевых добавок, наблюдаются и побочные негативные -эффекты от их употребления человеком склонность к образованию раковых опухолей, заболевания пищеварительной системы, ночек, кожные высыпания и т. д. Поэтому после подтверждения вредного воздействия некоторых пищевых добавок принимается решение о запрещении их использования. Особую опасность представляет пренебрежение предельно допустимым содержанием добавок в продуктах.
Органические соединения и здоровье человека
Здоровье — состояние организма, при котором отсутствуют болезни и физические дефекты, а организм в целом и каждый орган в частности полноценно выполняют свои функции. Здоровый организм способен приспосабливаться к действию различных факторов, сохраняя стабильность показателей жизнедеятельности.
Организм человека — это открытая динамическая система, в которой здоровье не является чем-то статичным, то есть раз и навсегда данным. Под воздействием различных факторов оно варьирует в широких пределах — от абсолютного здоровья к болезненным состояниям.
Ятрохимия — направление в науке XVI и XVII вв., которое заключалось в поиске путей использования достижений химии в медицине. Главной задачей ятрохимии была разработка лекарств.
Фармакология — медико-биологическая наука о лекарственных препаратах и их воздействии на организм.
Салициловая (2-оксибензоатная) кислота ароматическая гидроксикарбоновая кислота, то есть соединение, молекула которого содержит бензеновое ядро и две разные функциональные группы — гидроксильную и карбоксильную:
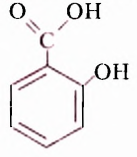
Влияние органических соединений на здоровье человека: Изучая основы здоровья, вы осознали, что наибольшей ценностью человека является его собственное здоровье, ознакомились с факторами влияния на здоровье, поняли, что человек может как поддерживать собственное здоровье, так и наносить ему вред. На основании материала предыдущих параграфов вы могли сделать вывод о том, насколько важны для здоровья человека органические компоненты пищи. Они нужны для восстановления тканей, функционирования клеток, обеспечения обмена веществ и энергии. Иначе говоря, их биологическая роль — яркое тому свидетельство. Поэтому возникает риторический вопрос: «Жить, чтобы есть, или есть, чтобы жить?» Врачи, диетологи, многовековой опыт существования человеческого общества помогают легко найти правильный ответ. Поскольку еда является источником жизненно необходимых веществ, питание должно быть таким, чтобы потреблённых жиров, белков и углеводов хватало для полноценного функционирования организма. Переедание не менее вредно, чем недоедание или голодание, а ожирение является серьёзным заболеванием.
От органических веществ как компонентов пищи зависят: продолжительность жизни, физическая и умственная работоспособность человека, самочувствие, а также рождение здоровых детей. Поэтому каждому нужно подобрать сбалансированное по содержанию органических веществ питание и придерживаться его.
Своеобразную «формулу» сбалансированного питания передаёт схема, изображённая на рисунке 19.
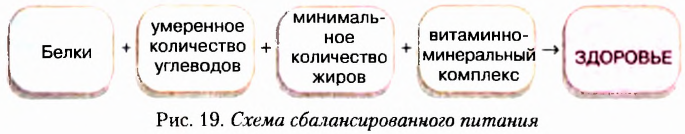
Вспомните, как в 9 классе на уроках биологии вы рассчитывали норму суточного индивидуального питания с учётом энергетической ценности компонентов пищи. Проведите такой расчёт с учётом энергетических затрат вашего организма сейчас.
Правильное питание в совокупности со здоровым образом жизни обеспечивают организму активное и полноценное функционирование на протяжении многих лет. Уместно отметить мнение учёных, что организм человека запрограммирован на среднюю продолжительность жизни 120 лет. Однако человек сознательными или неосознанными поступками значительно сокращает её.
Понятие о синтетических лекарственных препаратах: В случае заболевания довольно часто человек не полагается на силы собственного организма, а прибегает к использованию лекарственных препаратов.
Лекарственные препараты (лекарственные средства, лекарства) — это вещества или смеси веществ, которые употребляют для профилактики и лечения заболеваний.
В стремлении быстро выздороветь мы иногда даже стараемся увеличить суточную дозу лекарства, прибегаем к самолечению. Этого ни в коем случае нельзя делать, поскольку среди лекарств много таких, которые при неправильном использовании являются вредными для организма, а в некоторых случаях - и опасными для жизни.
Лекарственные препараты бывают растительного, животного и минерального происхождения, синтезированные на фармацевтических заводах или полученные с применением биотехнологий.
Люди издавна использовали растения и некоторые минералы в лечебных целях. Ныне в фармакологии получили применение более 200 видов лекарственных растений в виде настоек, экстрактов, отваров. Такие лекарственные формы составляют около 30 % общего количества лекарственных препаратов. Однако подавляющее большинство лекарств — это органические вещества, синтезированные на фармацевтических заводах.

Потребность в изобретении, создании и использовании эффективных лекарств беспокоила человечество ещё во времена ятрохимии, а в современном мире стала толчком к развитию фармацевтической промышленности.
Рассмотрим в качестве примера синтетический лекарственный препарат аспирин. Молекулярная формула его действующего вещества 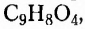 а структурная
а структурная
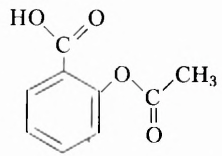
Впервые это вещество выделили из цветов вида спиреи (Spiraea ulmaria) и активно использовали в лечении ревматизма суставов ещё с середины XIX в. Вещество имеет название ацетилсалициловая кислота, ацетат салициловой кислоты. Из названия — ацетилсалициловая кислота — и приведённой формулы вещества можно понять, что в его образовании участвовали салициловая и ацетатная (этановая, уксусная) кислоты. И действительно, гидролизуясь, ацетилсалициловая кислота превращается в салициловую 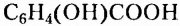 и ацетатную
и ацетатную  кислоты:
кислоты:
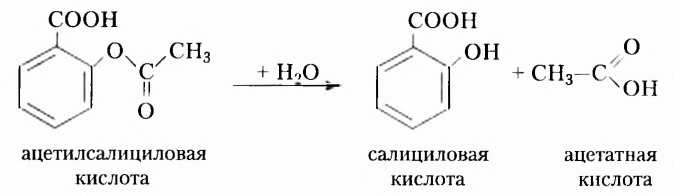
Аспирин употребляют в качестве обезболивающего, жаропонижающего и противовоспалительного средства. Однако ни в коем случае не следует заниматься самолечением с использованием аспирина, так как его прием может спровоцировать желудочное кровотечение, повреждение почек и дефекты слуха. Учитывая это, врачи не рекомендуют употреблять аспирин детям до 12 лет. Вместе с тем проведённые учеными исследования показывают, что людям, склонным к сердечно-сосудистым заболеваниям, желательно постоянно принимать аспирин в малых дозировках (не более 80 мг ацетилсалициловой кислоты в сутки), чтобы предотвратить образование тромбов в сосудах, избежать заболевания инфарктом миокарда. Кроме ацетилсалициловой кислоты, таблетки аспирина содержат порошок целлюлозы и крахмал. В аптеках можно приобрести как аспирин различных форм выпуска, так и лекарственные препараты с другими названиями (цитрамон, асфен, аскофен и т. д.), в состав которых входит ацетилсалициловая кислота (рис. 20).
Прочитайте на упаковке лекарственного препарата, сколько ацетилсалициловой кислоты содержится в одной таблетке, ознакомьтесь с перечнем заболеваний, которые лечат с его использованием, рекомендациями по употреблению. Рассчитайте максимальную суточную норму этого лекарственного препарата как жаропонижающего средства.
Чтобы свести к нулю побочное действие аспирина, нужно придерживаться следующих общих правил его приёма: употреблять аспирин после еды; перед употреблением растворить в тёплой воде; желательно запить молоком.
Ни один препарат в лечебной практике не используют так долго, как аспирин. В 1950 г. аспирин был занесён в Книгу рекордов Гиннеса как самое продаваемое во всём мире лекарство. И сегодня, безусловно, он есть в каждой домашней аптечке. Население нашей планеты ежегодно потребляет миллиарды таблеток этого препарата, в аптеках его отпускают без рецепта, стоимость его невысокая.
Задолго до изобретения аспирина люди искали способы преодоления лихорадки — так называют состояние, характеризующееся повышенной температурой и ломотой во всём теле. Методом проб и ошибок было установлено, что отвар коры ивового дерева (вербы) помогает в лечении. Кстати, Гиппократ около 2000 лет назад использовал экстракт ивовой коры для снятия жара и уменьшения боли.
Отвары коры ивы — доступные лекарства для каждого, кому нужна помощь в лечении простудных заболеваний. Для его приготовления одну столовую ложку измельчённой ивовой коры заливают одним стаканом воды комнатной температуры и кипятят на медленном огне в течение 20-30 мин. Химический анализ отвара коры ивы указывает на наличие в нём салициловой кислоты.

Это растение воспето в народных песнях. Тарас Шевченко взял с собой в ссылку ветку вербы и в кос-аральских песках вырастил из неё деревце. Изображение ивы видим на сделанном им рисунке, обратная сторона которого содержит надпись карандашом: «Т. Г. Шевченко. Верба. Офорт ».

С дохристианских времён считалось, что верба оберегает людей от нечистой силы, злых духов, защищает жилище от пожаров. Вербное воскресенье, последнее воскресенье перед Пасхой, — это большой христианский праздник. Освящённые веточки вербы хранят в домах как оберег.
Синтетическую салициловую кислоту широко применяют в медицине и косметологии благодаря её антисептическому действию. Она входит в состав мазей, наст, присыпок и спиртовых растворов для лечения инфекционных поражении кожи, ожогов, мозолей, бородавок, повышенного потоотделения стоп, выпадения волос, псориаза, угрей, экземы и т. д. (рис. 21).
Такой распространённый препарат, как анальгин, проявляет схожие с аспирином лечебные свойства — уменьшает боли различного происхождения, снижает температуру. Анальгин действует быстро и эффективно благодаря наличию в нём группы 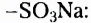
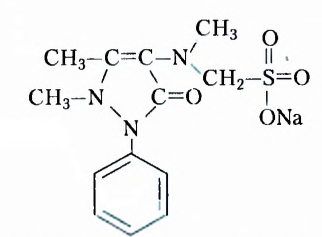
Именно эта группа влияет на растворимость анальгина: он легко всасывается и быстро создаёт лечебную концентрацию препарата в крови (лечебный эффект заметен уже через 20 мин после приёма препарата, достигает максимума через 2 ч).
Природные источники углеводородов
При стандартных условиях насыщенные углеводороды (алканы, или парафины) с числом атомов Карбона в молекуле 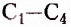 являются газами,
являются газами, 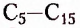 — жидкостями с характерным «бензиновым» запахом, с
— жидкостями с характерным «бензиновым» запахом, с 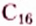 и далее — твердыми веществами.
и далее — твердыми веществами.
Благодаря высокой прочности одинарных С—С, С—Н связей парафины устойчивы к воздействию кислот, щелочей, окислителей.
Парафины не вступают в реакции присоединения, так как все связи атомов Карбона максимально использованы на образование одинарных связей.
Парафины горят с выделением большого количества тепла, например:
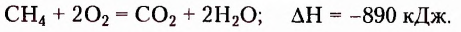
Парафинам характерны реакции замещения атомов Гидрогена на другие атомы или группы атомов. Реакции требуют инициирования путём нагревания, освещения, облучения и т. д.
При взаимодействии парафинов с хлором в зависимости от количественных соотношений веществ в реакции могут образовываться хлорометан 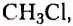 дихлорометан
дихлорометан 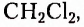 трихлорометан
трихлорометан  тетрахлорометан
тетрахлорометан 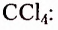
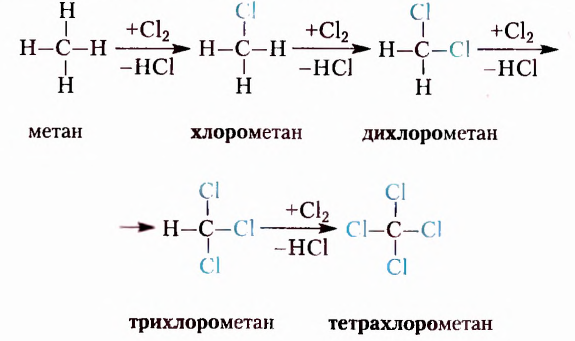
Соединениями Карбона, из которых построены тела организмов, не исчерпывается распространение органических веществ в природе. В древние геологические эпохи произошло образование углеводородов, которые ныне разведаны в залежах природного газа, нефти, каменного угля. Их образование учёные связывают с разного рода природными процессами. Одной из теорий является биогенная теория, согласно которой природные источники углеводородов образовались вследствие анаэробного разложения организмов. О составе и применении природных источников углеводородов вы узнаете из этого и последующих параграфов.
Природный газ как полезное ископаемое:
Природным газом называют смеси газов, которые в сжатом состоянии находятся в полостях пористых пород, образуя в недрах земли газоносные пласты. Они расположены на глубине от 800 м до нескольких километров, поэтому газ из них добывают через скважины, самопроизвольно природный газ очень редко выходит на поверхность земли.
Воспользовавшись дополнительными информационными источниками, подготовьте рассказ об этом интересном явлении, связанных с ним легендах и т. д.
Природный газ как смесь веществ: Природный газ на 80-98 % (в разных месторождениях разный процент) состоит из метана 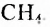 Остальное составляют другие газообразные насыщенные углеводороды: этан
Остальное составляют другие газообразные насыщенные углеводороды: этан 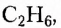 пропан
пропан 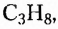 бутан
бутан 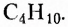 Кроме указанных парафинов, в небольших количествах присутствуют углеводороды, имеющие при атмосферном давлении жидкое агрегатное состояние (пептан, гексан, гептан), но в условиях повышенного давления находящиеся в газовой смеси, а также водород, сероводород (гидроген сульфид), углекислый газ, азот, гелий.
Кроме указанных парафинов, в небольших количествах присутствуют углеводороды, имеющие при атмосферном давлении жидкое агрегатное состояние (пептан, гексан, гептан), но в условиях повышенного давления находящиеся в газовой смеси, а также водород, сероводород (гидроген сульфид), углекислый газ, азот, гелий.
По суше природный газ транспортируют под давлением в не: сколько десятков атмосфер трубопроводами (рис. 25а), протяжённость которых — тысячи километров.
Специальные морские суда — газовозы — транспортируют природный газ водными путями (рис. 256) в сжатом или сжиженном состоянии.

Нужно отметить, что весь процесс поставки газа — от добычи и до поступления потребителям является герметичным (рис. 26).

Физические свойства природного газа. Природный газ бесцветен, почти вдвое легче воздуха, плохо растворим в воде, без запаха.
Как и во всех смесях, компоненты природного газа сохраняют свои свойства, а потому для их выделения применяют физические методы. В местах добычи, недалеко от месторождения, строят установки по очистке природного газа от неорганических газообразных примесей и воды, а также под подготовке его к транспортировке потребителям (рис 27)

Использование природного газа: В использовании природного газа в хозяйственной деятельности человека можно выделить два основных направления — источник энергии и сырьё для газоперерабатывающей промышленности.
Учитывая то, что реакции горения углеводородов экзотермические и сопровождаются выделением большого количества тепла (в среднем 50 кДж при сгорании 1 г вещества), природный газ широко используют как дешёвое и экологически чистое топливо для тепловых электростанций, котельных, жилых помещений, автомобилей. К газовым плитам в ваших домах также подведён природный газ. В экологическом отношении природный газ выгоден тем, что, сгорая, он образует меньше вредных веществ, чем другие виды топлива. Вместе с тем не исключается его участие в создании парникового эффекта.
Вспомните из 10 класса, в чём суть парникового эффекта.
Природный газ является ценным сырьём для производства многих органических и неорганических веществ. Основной компонент природного газа — метан — используют в производстве этена, этина (ацетилена), сажи, синтез-газа — смеси угарного газа с водородом (рис. 28).
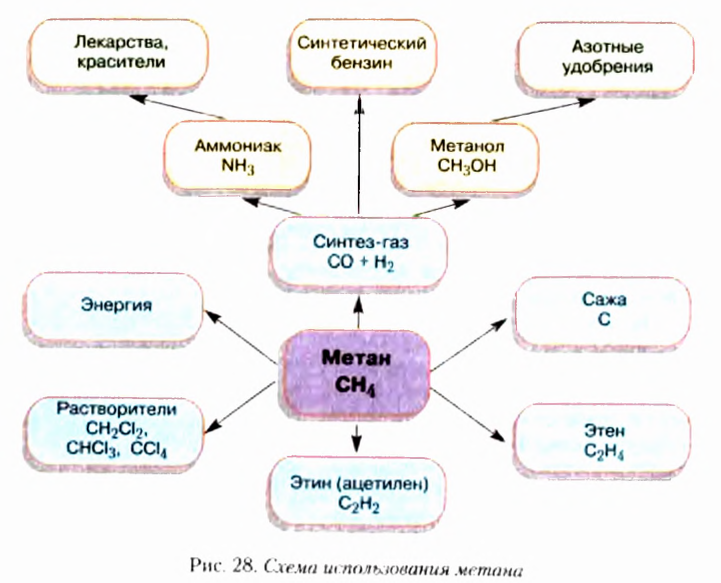
Синтез-газ образуется при нагревании метана с водяным паром при температуре 800 °С и наличии катализатора никеля:
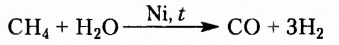
Как видно из рисунка 28, синтез-газ используют для производства многих веществ, в частности синтетического бензина. Для стран, где есть месторождения природного газа, это важно в плане решения проблемы с топливом для двигателей внутреннего сгорания.
Термическим разложением метана получают сажу и водород:
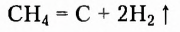
Кстати сказать, в производстве аммониака преимущественно используют водород, полученный из природного газа, а не из других источников.
Природный газ — ценный источник энергии и различных органических и неорганических веществ.
Попутный нефтяной газ: Такое название получила смесь газов, образовавшаяся вместе с нефтью и в условиях высокого давления находящаяся в ней в растворённом состоянии или образующая газовое скопление — «газовую шапку». Состав попутного нефтяного газа подобен составу природного газа, однако содержание метана значительно меньше, а его гомологов (до гексана включительно) — значительно больше (рис. 29).
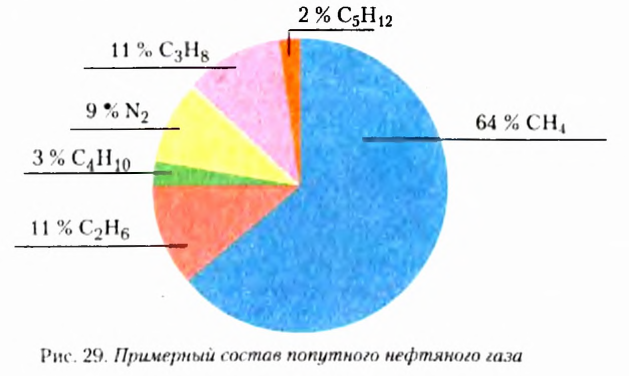
Долгое время попутный нефтяной газ элементарно сжигали в факелах, то есть не использовали как пенный источник энергии и химических веществ. Факелы горели круглосуточно, тепло и продукты сгорания поступали в атмосферу. Сейчас ситуация меняется к лучшему, и попутный газ получает промышленное применение. Многие из вас знают о его использовании для приготовления пропан-бутановой смеси, которой под давлением наполняют стальные баллоны. Их используют для работы газовых плит в случае, когда нет централизованного газоснабжения.
По экологическим и экономическим соображениям на автотранспорте всё чаще устанавливают двигатели, работающие на газовом топливе, а не на бензине (рис. 30а).

От сгорания газового топлива в двигателях автомобилей окружающая среда не загрязняется вредными соединениями Плюмбу-ма, как это имеет место при использовании бензина. Содержание угарного газа и выбросах значительно ниже, поскольку газ легче, чем пары бензина, смешивается с воздухом, из-за чего сгорание происходит более полно.
Среди различных источников энергии природного происхождения газовое топливо самое экологически чистое.
Природный газ в смеси с воздухом взрывоопасен. Если концентрация газа в воздухе превышает 15 %, возгорание происходит от зажжённой спички и даже от включения света. Чтобы уберечь людей и здания от возможного бедствия, в природный газ, который
не имеет запаха, добавляют вещества с устойчивым неприятным запахом. Вполне достаточно 1 % таких веществ в природном газе, чтобы обонятельный анализатор человека почувствовал их запах даже при незначительной утечке газа.
Бесспорно, вы знаете, как действовать в подобных ситуациях. Напомним, что необходимо сразу же открыть окна и двери (создать сквозняк), чтобы как можно скорее довести концентрацию природного газа в помещении до безопасного уровня. Если утечка газа произошла в помещении, то нужно немедленно перекрыть газовый кран. Если же аварийная ситуация возникла в газовой сети вне вашего дома — известить специальные службы.
К сожалению, время от времени мы получаем печальные известия об авариях на угольных шахтах. В основном они вызваны взрывами природного газа, который образовался в каменноугольных пластах и скопился в опасных концентрациях в местах работы шахтёров.
Запомните! При пользовании природным газом надо неукоснительно соблюдать правила безопасности.
О развитии и практическом внедрении химических знаний свидетельствует тот факт, что люди научились из остатков растений и мусора добывать биогаз, на 50-70 % состоящий из метана. Так, в Згуровском районе Киевской области функционирует завод по производству биогаза (рис. 31).

Проанализируйте экономические и экологические преимущества такого топлива.
Есть все основания полагать, что в будущем биогаз будет добываться в значительных количествах, а местным его производством заинтересуются многие хозяева.
На примере структурных формул молекулы метана, которые использовались в разные годы, отчётливо прослеживается эволюция знаний о химическом строении основного компонента природного газа — метана. На рисунке 32 приведено изображение формул метана, которые предлагали известные учёные и которыми пользовались в научной литературе в разное время.
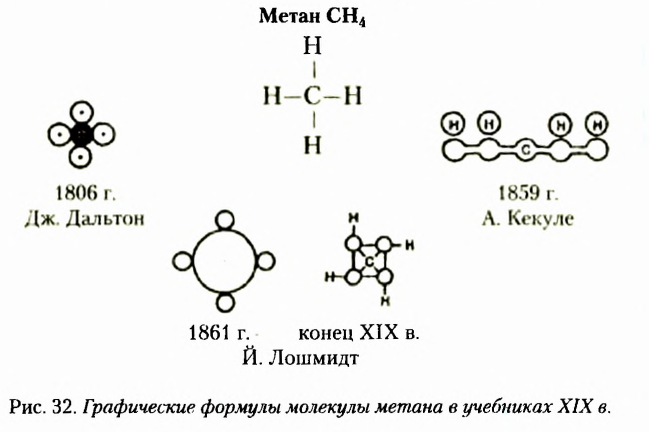
Стереохимия объясняет пространственное строение молекулы метана в форме правильного тетраэдра, в центре которого находится атом Карбона, а на вершинах расположены 4 атома Гидропена. Валентный угол везде одинаков и равен 109° 28' (рис. 33) Тетраэдрическое строение карбоновой цепи присуще всем гомологам метана.

Нефть, её состав, свойства и продукты перегонки
К соединениям, характеризующимся наличием только одинарных связей, кроме насыщенных углеводородов (парафинов), принадлежат циклопарафины, или циклоалканы В отличие от парафинов они имеют замкнутое (циклическое) строение карбоновой цепи:
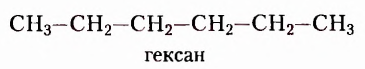
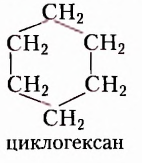
Цикл включает не менее 3-х атомов Карбона. Номенклатура циклоалканов подобна номенклатуре алканов, только к названию добавляют префикс цикло-:
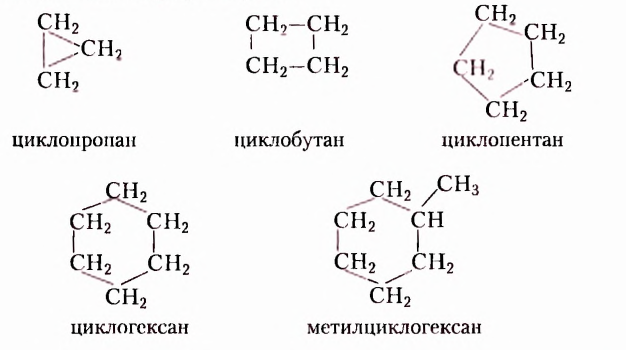
Циклопентан, циклогексан, а также их гомологи, русский ученый В. В. Марковников предложил называть нафтенами. поскольку они входят в состав нефти.
Арены, или ароматические углеводороды, — название гомологического ряда бензена 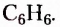 Происхождение названия связано с тем, что первыми были открыты именно те представители гомологического ряда, которые имели специфический запах.
Происхождение названия связано с тем, что первыми были открыты именно те представители гомологического ряда, которые имели специфический запах.
Особенностью электронного строения аренов является наличие единого для 6 атомов Карбона 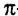 -облака, образованного из 6 негибридизированных р-электронов (рис. 34).
-облака, образованного из 6 негибридизированных р-электронов (рис. 34).
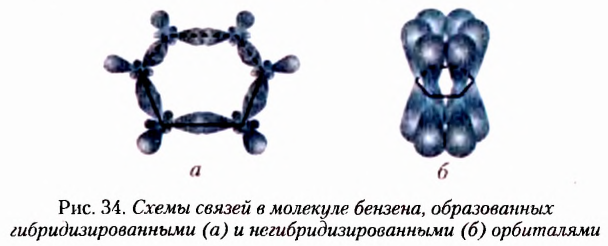
Связь, образованную таким образом, называют ароматической. По длине она занимает промежуточное положение между одинарной и двойной связью.
Особенность химической связи атомов Карбона в молекулах аренов отражается на их химических свойствах. Так, бензен легче вступает в реакции замещения (а), чем присоединения (б):
Как и все углеводороды, циклопарафины и арены горят с образованием воды и углекислого газа и выделением тепла.
Не менее важным по сравнению с природным газом источником органических соединений является нефть.
Нефть — природная жидкая маслянистая смесь углеводородов и некоторых неорганических веществ.
Основными углеводородами нефти являются парафины, циклопарафины, арены.
Нефть как полезное ископаемое: Залежи нефти встречаются на глубине от десятков метров до 6 км и более. На суше залежи этого ископаемого зачастую находятся на глубине 1-3 км, однако нефтеносные пласты есть и на дне морей и океанов. В настоящее время налажена промышленная добыча нефти с морских глубин (рис. 35).
Добывают нефть из скважин. Сначала это ископаемое может фонтанировать самопроизвольно благодаря сжатому попутному нефтяному газу. В дальнейшем для вытеснения нефти в скважину закачивают воздух или воду.
Это полезное ископаемое людям было известно давно. Упоминания о тёмной, со специфическим запахом жидкости, сочащейся из камней, находим в трудах древнегреческих и древнеримских историков — Геродота, Плутарха, Плиния. Уже в те времена люди использовали «каменное масло» (от латин. petroleum): в Египте и Вавилоне нефть применяли как дезинфицирующую мазь, вещество для бальзамирования. На Ближнем Востоке ею заправляли фонари, а византийцы смешивали нефть с серой и изготовляли зажигательные снаряды — в историю это оружие вошло под названием «греческий огонь».
До второй половины XIX в. нефть добывали из колодцев и использовали в натуральном виде, не подвергая никакой переработке. Эта так называемая сырая нефть длительное время применялась как обычное топливо и смазочный материал, пока изучение состава и свойств нефти не показало, насколько ценным сырьём она может быть.

Нефть как смесь веществ, состав нефти: В составе нефти насчитывается до 1000 компонентов — преимущественно веществ органического происхождения. Как уже отмечалось, углеводородная часть нефти состоит из парафинов, циклопарафинов, ароматических углеводородов (аренов). Больше всего в составе нефти жидких углеводородов, а в них в растворённом состоянии содержатся газообразные и твёрдые. Примерный углеводородный состав нефти — 30-35 % парафинов, 25-75 % циклопарафинов, 10 -20 % аренов. Он свидетельствует о том, что нефть различных месторождений отличается по содержанию конкретных углеводородов. Элементный состав нефти показан на рисунке 36.
Физические характеристики нефти. Это густая маслянистая жидкость со специфическим запахом. Из-за различий в количественном и качественном составе нефть разных месторождений может иметь чёрный, красно-коричневый или жёлто-зелёный цвет (рис. 37), встречается также нефть, почти не имеющая цвета.

Нефть — нерастворимая в воде жидкость, плотность нефти различных месторождений колеблется в пределах от 0,65 до 
Нерастворимость в воде и меньшая по сравнению с ней плотность — эти два свойства нефти создают особую экологическую опасность в случае вытекания нефти в воду рек, морей и т. д. Растекаясь по водной поверхности, нефтяное пятно препятствует доступу воздуха в водную среду; перья водоплавающих птиц, мех морских млекопитающих покрываются слоем нефти, от которого животным самостоятельно трудно избавиться.
Устранение последствий такого экологического бедствия требует значительных материальных затрат.

Понятие о переработке нефти: Добытую из скважины сырую нефть сначала обезвоживают и обессоливают, отделяют от примесей горных пород и газов, после чего отправляют на переработку. Существует два принципиально разных способа переработки нефти. В основе первого способа, получившего название прямая перегонка нефти, лежат физические методы разделения смесей, поэтому химический состав компонентов нефти не изменяется. За основу второго способа взяты химические превращения углеводородов нефти под воздействием температуры, давления и катализаторов, то есть процесс сопровождается образованием новых веществ.
Переработка нефти — сложный многостадийный процесс физической и химической природы, вследствие которого получают более 500 наименований разнообразных нефтепродуктов.
Важнейшие нефтепродукты — это: моторное топливо (авиационный и автомобильный бензин, реактивное и дизельное топливо); энергетическое топливо (топливо для газовых турбин и котелен); нефтяные масла (средства, предназначенные для уменьшения силы трения).
Нефтеперерабатывающие заводы (рис. 38) производят нефтепродукты и готовят сырьё для такой отрасли промышленности, как нефтехимия. Один завод перерабатывает в год в среднем от 5 до 15 млн т нефти.

Прямая перегонка (фракционная дистилляция) нефти: Как многокомпонентная смесь, нефть не имеет постоянной точки кипения. Поэтому при её нагревании вещества с низкой температурой кипения первыми переходят в газообразное состояние, тогда как вещества с высокой температурой кипения остаются жидкими.
На этом свойстве нефти базируется промышленный способ получения из неё отдельных групп веществ — фракций.
В нефтехимии под фракцией понимают смесь углеводородов, кипящих в определённом температурном интервале.
Каждая из фракций — это смесь углеводородов с определённым количеством атомов Карбона в молекуле. Разделить нефть на фракции можно даже в лабораторных условиях. Проведём демонстрационный опыт. Соберём прибор, представляющий собой лабораторную модель нефтеперегонной установки (рис. 39а): к круглодонной колбе 1 присоединим холодильник 2, конец которого совместим с колбой-приёмником 3. В колбу 1 нальём нефть, закроем пробкой с вмонтированным в неё термометром 4. Нагревая колбу 1, будем наблюдать, как сначала испаряются и конденсируются в холодильнике 2 легкокипящие компоненты смеси, а затем те, которые переходят в газообразное состояние при более высоких температурах (рис. 396).

В промышленности нефть нагревают в специальной трубчатой печи до температуры 320-350  . Компоненты нефти, температура кипения которых ниже указанной, переходят в газообразное состояние, сохраняя при этом целостность молекул. Далее смесь поступает в ректификационную колонну (рис. 40), где при определённой температуре происходит конденсация отдельных фракций — бензина, лигроина, керосина, газойля.
. Компоненты нефти, температура кипения которых ниже указанной, переходят в газообразное состояние, сохраняя при этом целостность молекул. Далее смесь поступает в ректификационную колонну (рис. 40), где при определённой температуре происходит конденсация отдельных фракций — бензина, лигроина, керосина, газойля.
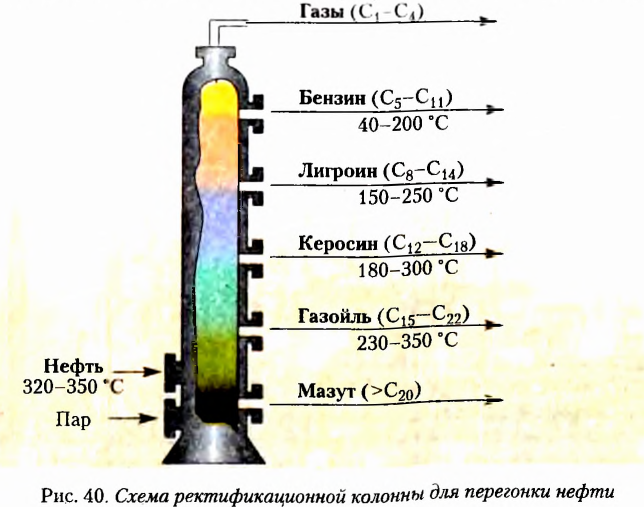
Так, самые лёгкие углеводороды, содержащие от 5 до 11 атомов Карбона, поднимаются выше всех и образуют жидкую светлую смесь углеводородов — бензин. Это основное горючее автомобильных двигателей. Лигроин — прозрачная желтоватая жидкость, смесь жидких углеводородов с содержанием атомов Карбона  Его применяют в качестве горючего в карбюраторных и дизельных двигателях, как растворитель в лакокрасочной промышленности. Углеводороды, содержащие от 12 до 18 атомов Карбона, образуют следующую фракцию — керосин — горючее для дизельных и реактивных двигателей. До изобретения электрического освещения люди пользовались керосиновыми лампами, фонарями, примусами. Фракция, в которую входят углеводороды с количеством атомов Карбона от 15 до 22, называется газойль. Это топливо дизельных двигателей. И наконец, последняя фракция — мазут — является смесью тяжёлых углеводородов, которые при температуре первичной перегонки нефти не достигают точки своего кипения, а потому стекают в нижнюю часть колонны. Мазут используют как сырьё для производства смазочных масел, котельного топлива, вазелина, гудрона.
Его применяют в качестве горючего в карбюраторных и дизельных двигателях, как растворитель в лакокрасочной промышленности. Углеводороды, содержащие от 12 до 18 атомов Карбона, образуют следующую фракцию — керосин — горючее для дизельных и реактивных двигателей. До изобретения электрического освещения люди пользовались керосиновыми лампами, фонарями, примусами. Фракция, в которую входят углеводороды с количеством атомов Карбона от 15 до 22, называется газойль. Это топливо дизельных двигателей. И наконец, последняя фракция — мазут — является смесью тяжёлых углеводородов, которые при температуре первичной перегонки нефти не достигают точки своего кипения, а потому стекают в нижнюю часть колонны. Мазут используют как сырьё для производства смазочных масел, котельного топлива, вазелина, гудрона.
Прямой перегонкой нефти (испарением в определённом интервале температур с последующим конденсированием веществ) получают фракции: бензин, лигроин, керосин, газойль, мазут.
Вторичная переработка нефти: Из года в год возрастают потребности в бензине, тогда как его выход при прямой перегонке нефти составляет от 5 до 20 %. Рост спроса на бензин побудил учёных к поиску новых способов переработки углеводородного сырья, входящего в состав нефти. Один из них — крекинг нефти — заключается в расщеплении больших молекул углеводородов на меньшие, то есть происходит химическое явление, в результате которого изменяется состав и строение углеводородов. Сырьём для крекинга является не только сырая нефть, но и отдельные фракции, полученные при прямой перегонке нефти. Продукты крекинга подвергают перегонке в условиях пониженного давления и, как и при первичной перегонке, разделяют на отдельные фракции: крекинг-бензин (выход бензина может составить 75 %), смазочные масла, гудрон и т. п.
В ходе выполнения лабораторного опыта 3 (см. с. 101) ознакомьтесь с образцами нефтепродуктов, закрепите знания о нефти, её составе и продукции нефтепереработки.
Октановое число: Взрывоопасным смесям, к которым относится и смесь бензина с воздухом, свойственно неконтролируемое самовоспламенение, сопровождающееся горением взрывного характера и называемое детонацией. Детонация приводит к преждевременному износу, перегреву, оплавлению деталей двигателя. Детонация проявляется характерной вибрацией, резким звуком (постукиванием) двигателя, увеличением расхода топлива, повышенным содержанием токсичных веществ в выхлопных газах и даже частичным разрушением деталей двигателя. Чтобы избежать детонации бензина в двигателе автомобиля, необходимо использовать топливо, рекомендованное для данной марки машин заводом-изготовителем. А оно, как свидетельствуют обозначения на бензозаправочных колонках, бывает разным — А-76, А-92, А-93, А-95 и т. д.
Выясним, что эти цифры означают. В общем они показывают детонационную стойкость бензина конкретной марки — его способность противостоять самовозгоранию при сжатии. В качестве стандарта горючего с низкой детонационной стойкостью принят н-гептан  Отметим, что большой детонационной стойкостью обладают углеводороды с разветвлённой карбоновой цепью. Одним из углеводородов, который имеет особенно высокую детонационную стойкость, является изомер октана (изооктан)
Отметим, что большой детонационной стойкостью обладают углеводороды с разветвлённой карбоновой цепью. Одним из углеводородов, который имеет особенно высокую детонационную стойкость, является изомер октана (изооктан) 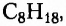 а именно 2,2,4-триметилпентан:
а именно 2,2,4-триметилпентан:
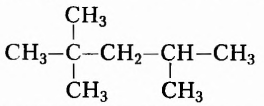
На специальных установках сравнивают поведение в моторе смесей н-гептана и изооктана, взятых в различных пропорциях, с поведением исследуемого топлива, то есть определяют октановое число бензина.
Октановое число — условная единица, численно равная проценту (по объёму) изооктана в смеси, образованной им с н-гептаном и по своим антидетонационным свойствам равноценной данной марке бензина.
Октановое число изооктана принято за 100, а нормального гептана — за 0. Таким образом, бензин марки А-95 — это горючее, оыдерживающее в двигателе сжатие, равноценное сжатию смеси, н состав которой входят 95 % изооктана и 5 % н-гептана.
Прокомментируйте, что означает марка бензина А-76.
Октановое число бензина определяют на специальных установках сравнением характеристик горения испытуемого топлива и эталонных смесей изооктана с н-гептаном. Чем выше октановое число бензина, тем выше его детонационная стойкость.
Применение продуктов перегонки нефти: Наибольшее применение продукты перегонки нефти получили в топливно-энергетической отрасли: бензин — как топливо для двигателей внутреннего сгорания, растворитель масел, каучука, очиститель тканей от жира; керосин — как горючее реактивных и дизельных двигателей; мазут — как топливо тепловых электростанций (ТЭС), заводов, кораблей и т. д. После перегонки мазута образуется твёрдый остаток гудрон, который используют для асфальтирования дорог. Широкое применение продуктов перегонки нефти в качестве топлива объясняется тем, что они имеют большую теплоту сгорания и не образуют твёрдого остатка.
В последние годы нефть и продукты её перегонки всё больше используются как ценное сырьё для химической промышленности. Пластмассы, синтетические волокна, синтетический каучук, метанол и этанол, аммониак, азотные удобрения, стимуляторы роста, протравливатели семян, смазочные масла и растворители, белково-витаминные концентраты, синтетическая этановая и другие кислоты, продукция фармацевтической и парфюмерной промышленности — вот неполный перечень изделий на основе нефти и продуктов её переработки (рис. 41).
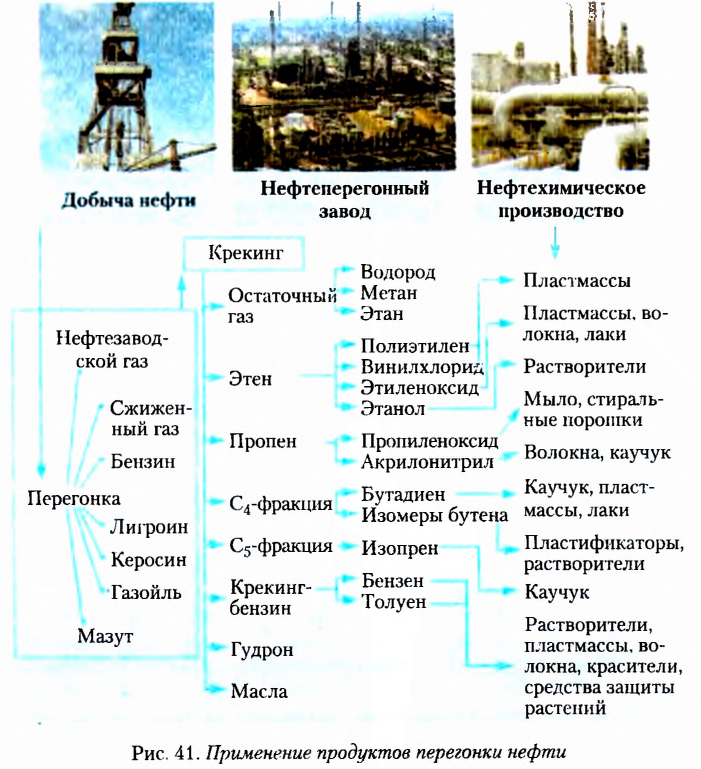
Крекинг (от англ. cracking — расщепление) — высокотемпературная переработка нефти и её отдельных фракций для получения продуктов с меньшей молекулярной массой. В процессе крекинга карбон-карбоновые одинарные связи разрываются, молекула расщепляется на молекулы насыщенного и ненасыщенного углеводородов:
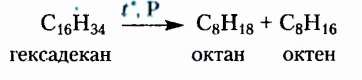
Во время крекинга может происходить изомеризация:
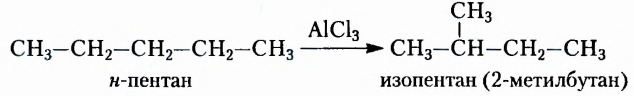
Основными продуктами крекинга являются компоненты моторных топлив. Существует несколько видов крекинга нефти и нефтепродуктов.
Термический крекинг протекает при температуре 450—550 °С и давлении 20 70 атм. Этому виду крекинга подвергают керосин, газойль, мазут и гудрон (один из продуктов вакуумной перегонки нефти).
Каталитический крекинг проводят при более низких, по сравнению с термическим, температуре и давлении (t° = 480-490 °С, Р = 1-5 атм) и наличии катализатора (смеси  Для каталитического крекинга основным сырьём является газойль. Выход бензина и его качество при применении этого вида крекинга более высокие, чем при термическом.
Для каталитического крекинга основным сырьём является газойль. Выход бензина и его качество при применении этого вида крекинга более высокие, чем при термическом.
Напишите уравнения реакций по схеме
Каменный уголь, продукты его переработки. Значение основных видов топлива в энергетике страны
Бензен (бензол) 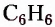 — токсичная, бесцветная жидкость со специфическим запахом, легче воды и нерастворимая в ней. Добывают промышленной переработкой каменного угля. Бензен получил широкое применение в химической промышленности как сырьё для производства полимера полистирена, фенола, красителей, фармацевтических препаратов и т. д.
— токсичная, бесцветная жидкость со специфическим запахом, легче воды и нерастворимая в ней. Добывают промышленной переработкой каменного угля. Бензен получил широкое применение в химической промышленности как сырьё для производства полимера полистирена, фенола, красителей, фармацевтических препаратов и т. д.
Структурная формула бензена  указывает на наличие в его молекуле одного бензольного кольца (ядра), поэтому он относится к одноядерным ароматическим углеводородам. Существуют также многоядерные ароматические углеводороды, представителями которых являются нафтален (нафталин) и антрацен, содержащие 2 и 3 бензольные кольца (ядра) соответственно:
указывает на наличие в его молекуле одного бензольного кольца (ядра), поэтому он относится к одноядерным ароматическим углеводородам. Существуют также многоядерные ароматические углеводороды, представителями которых являются нафтален (нафталин) и антрацен, содержащие 2 и 3 бензольные кольца (ядра) соответственно:
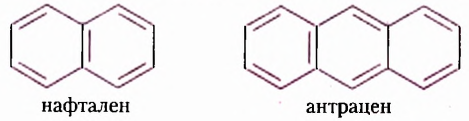
Гидроксильная группа -ОН является функциональной группой как спиртов, так и фенолов.
Фенолы — оксигеносодержащие органические соединения, в молекулах которых гидроксильные группы соединены с бензольным ядром, то есть являются заместителями атомов Гидрогена в молекуле бензена и его гомологов. Самый простой представитель этой группы веществ — соединение с одноимённым названием.
Фенол 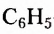 -ОН, структурная формула
-ОН, структурная формула 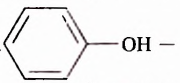
бесцветное кристаллическое вещество с температурой плавления +43 °С, малорастворимое в воде. Имеет характерный едкий запах. При попадании на кожу вызывает ожоги, сильный антисептик. Фенол применяют в производстве термореактивных полимеров, лекарств, красителей, взрывчатых веществ. Известный вам индикатор щелочной среды фенолфталеин имеет такое название потому, что для его получения используют фенол. Впервые фенол выделили в 1834 г. из продуктов переработки каменного угля и до сего времени получают этим способом.
Каменный уголь как топливо люди начали использовать раньше, чем природный газ и продукты переработки нефти. Долгое время они делали это только ради получения энергии.
Поинтересуйтесь историей транспорта, выясните, какие его виды работали на энергии, получаемой от сжигания угля.
В век атомной энергетики уголь всё ещё остаётся на первом месте в энергетическом балансе большинства стран мира. Вместе с тем с каждым годом растёт его роль как ценного сырья для производства разнообразных веществ.
Каменный уголь в природе: Залежи каменного угля образовались из отмерших миллионы лет назад остатков растений. Без доступа воздуха, в условиях повышенной температуры и давления произошли преобразования: торф бурый, уголь. каменный уголь. Эта твёрдая природная смесь веществ имеет чёрный., иногда тёмно-серый цвет, блестящую или матовую поверхность, плот-юность  (рис. 42).
(рис. 42).

Россия — одна из богатейших стран мира по разведанным запасам каменного угля и входит в десятку крупнейших мировых его экспортёров (рис. 43).
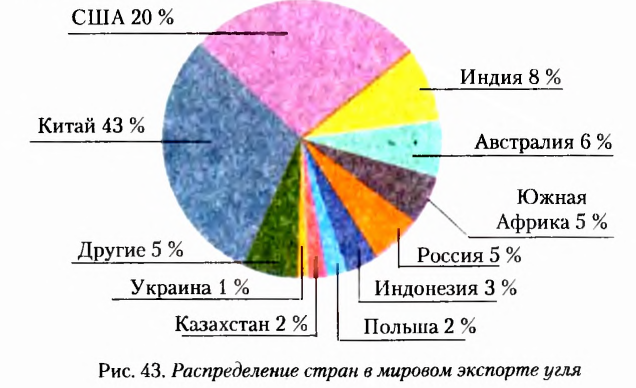
Состав каменного угля: В процессе развития химических знаний данные о составе и строении угля изменялись. Сейчас в составе угля различают органическую и неорганическую части. Органической части свойственна высокомолекулярная структура, включающая ациклические и циклические фрагменты и функциональные группы (рис. 44).
Как видим, органическая часть угля имеет сложное строение.
Атомы каких химических элементов образуют органическую часть угля?
Каменный уголь — природная смесь углерода (около 10 %), органических соединений сложного строения (около 80 %), влаги, неорганических примесей, остающихся после сжигания угля в виде твёрдого остатка — ишака.
Основные потребители каменного угля — энергетика (60 %), коксохимия (25 %), коммунальное хозяйство и другие отрасли промышленности (15 %).
Процесс переработки каменного угля: Существует несколько способов переработки этого полезного ископаемого, основным из которых является коксование.
Коксование — термическая переработка угля, заключающаяся в его нагревании без доступа воздуха до 900-1100 °С и выдерживании при этой температуре до 20 часов, вследствие чего уголь разлагается с образованием твёрдого кокса и летучих органических и неорганических (в основном воды) веществ.
Указанные продукты коксования — результат физических и химических преобразований, происходящих при переработке каменного угля.
Основным аппаратом, где осуществляется коксование угля, является коксовая печь. Она состоит из узких камер коксования шириной 0,4-0,5 м, длиной 13-16 м и высотой 4-7 м, куда одновременно загружают около 10 тыс. кг измельчённого каменного угля. Для обеспечения надлежащего протекания процесса коксования 60-70 печей объединяют в одну коксовую батарею (рис. 45, 46), в которой между печами располагают отопительные простенки. Необходимую для коксования тепловую энергию получают, сжигая природный или коксовый газ.

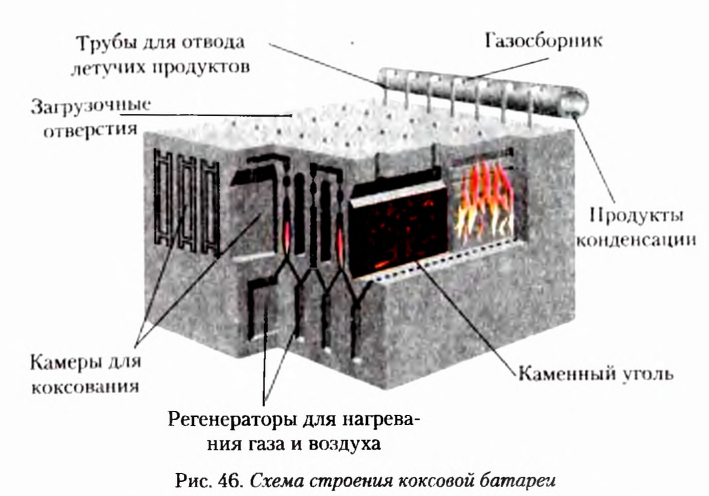
Во время коксования летучие соединения собирают в специальные сборники, после коксования образовавшийся кокс («коксовый пирог») специальным устройством выталкивают из печи (рис. 47а) для охлаждения, а печь загружают новой порцией каменного угля (рис. 47б).
Коксование — сложный периодический процесс, требующий специальных аппаратов — коксовых печей и больших затрат тепловой энергии.

Продукты переработки каменного угля и их использование: Переработку угля осуществляют в основном путём его коксования, газификации или гидрирования.
Основной продукт коксования — кокс - состоит на 96 98 % из углерода. Кокс получил промышленное применение в доменном и литейном производстве, цветной металлургии как восстановитель и топливо, а также он является сырьём для производства ацетилена и других веществ.

Вместе с коксом образуются каменноугольная смола и коксовый газ, которые являются богатыми источниками различных веществ.
Перегонкой и химической обработкой каменноугольной смолы добывают ароматические углеводороды: бензен и его гомологи, фенолы, нафтален (нафталин), антрацен, другие ценные вещества.
Коксовый газ содержит около 60 % водорода, 25 % метана, 5 % карбон( ) оксида, 4 % азота, 2 % нитроген(
) оксида, 4 % азота, 2 % нитроген( ) оксида, 2 % этена и 2 % других газов. Его используют для обогрева коксовых печей, а также подвергают химической переработке для получения разнообразных веществ.
) оксида, 2 % этена и 2 % других газов. Его используют для обогрева коксовых печей, а также подвергают химической переработке для получения разнообразных веществ.
Ещё одним продуктом коксования является надсмольная вода, представляющая собой водный раствор аммониака. Её обрабатывают сульфатной кислотой и получают минеральное удобрение аммоний сульфат.
Вспомните, что называют удобрениями, их классификацию, приведите примеры.
На основе летучих продуктов коксования на химических заводах получают удобрения, пластмассы, синтетические волокна, лаки, краски, искусственный графит и другие вещества.
Из неорганической части каменного угля в промышленных масштабах извлекают ванадий, германий, серу, молибден, цинк, свинец.
Одним из видов переработки твёрдою топлива является газификация угля — обработка низкосортного каменного угля, бурого угля и торфа смесью воздуха, водяного пара и углекислого газа. Часть угля сгорает, обеспечивая процесс газификации теплом, а вторая часть реагирует с окислителями, вследствие чего образуется газообразное топливо — генераторный газ — смесь водорода, угарного газа и других газов. Перспективным считают способ подземной газификации угля с целью перевода его в горючий газ. Идея :>того способа принадлежит Д. И. Менделееву.
Гидрирование угля — каталитический процесс обработки твёрдого топлива водородом при температуре около 500 "С и давлении 20-70 МПа. Продукты гидрирования — это преимущественно смесь лёгких углеводородов, по составу аналогичных лёгким нефтепродуктам, образующим фракцию бензина. Поэтому процесс гидрирования угля считают одним из перспективных способов получения синтетического бензина.
Основные продукты переработки каменного угля изображены на рисунке 49.
Значение основных видов топлива в энергетике страны. Энергетика страны - это электрическая энергия, произведённая атомными, гидро- и теплоэлектростанциями; энергия, которую получают сжиганием топлива в двигателях различных видов транспорта;
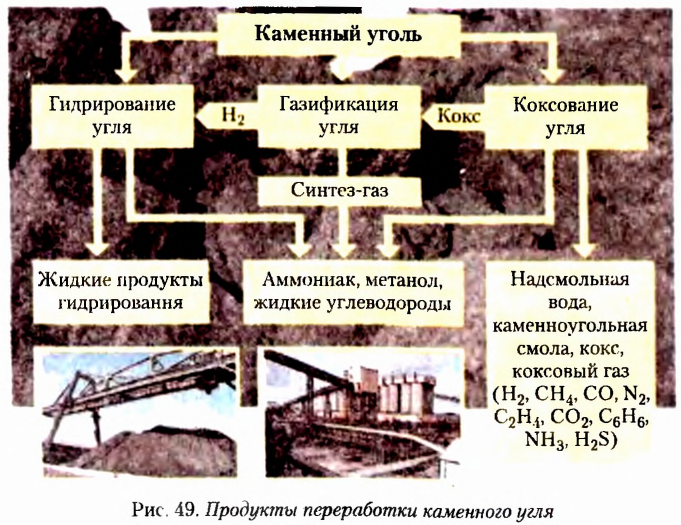
энергия, благодаря которой в системах отопления циркулирует горячая вода; энергия, выделяемая от сжигания кокса в домнах, природного газа в коксовых печах, газовых плитах; энергия в виде тепла или света, получаемая людьми для повседневных нужд от сжигания угля, угольных брикетов, дров, торфа.
Несмотря на то, что в настоящее время активно развивается атомная энергетика и мощной является гидроэнергетика, каменный уголь, газ и продукты переработки нефти занимают в мировой энергетике лидирующие позиции (рис. 50).
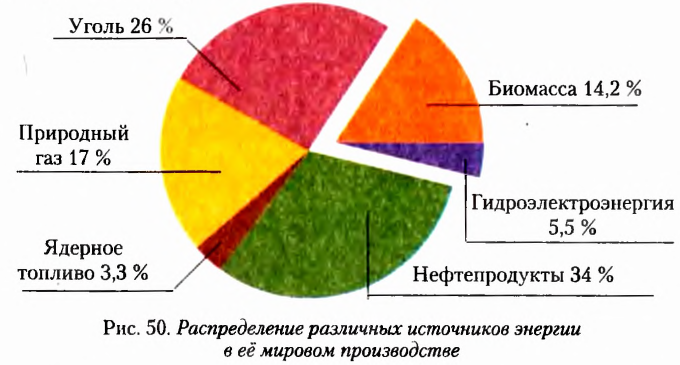
Вполне очевидны перспективы развития альтернативных источников энергии (солнечной, ветровой, биогаза). Сырая нефть непосредственно не используется, хотя продукты её переработки являются основными источниками энергии для автомобилей, самолётов, кораблей, тракторов и т. д. В частности, теплота сгорания мазута в 1,5 раза больше, чем лучших сортов угля. Кроме того, в отличие от угля при сгорании мазута не образуется твёрдый остаток. Благодаря указанным характеристикам мазут применяется на тепловых электростанциях, железнодорожном и водном транспорте.
Обобщите материал о природных источниках углеводородов как основных видах топлива и визуализируйте его в форме таблицы.
В этнографических музеях среди экспонатов старины можно увидеть утюги, нагрев которых осуществляли раскалёнными кусочками древесного угля. Древесный уголь применяется и в наше время. Благодаря особым свойствам (долго горит, точнее, тлеет, практически не образуя дыма и открытого пламени, а продуцируя только тепло) его используют в быту для приготовления блюд (барбекю, шашлык), в промышленности для производства кристаллического силиция (кремния), сероводорода, чёрных и цветных металлов, активированного угля. При сгорании 1 кг древесного угля выделяется 31 000-35 ООО кДж теплоты.
Что же представляет собой древесный уголь?
Древесный уголь — это микропористый богатый углеродом продукт разложения древесины без доступа воздуха. Установки по производству древесного угля работают в основном в лесхозах, а как сырьё используют древесные отходы.
Древесный уголь не является самостоятельным аллотропным видоизменением Карбона, а образован из разноориентированных мелких кристалликов графита.
Вспомните из 10 класса явление аллотропии и аллотропные видоизменения Карбона.
Древесный уголь гигроскопичен, легко поглощает запахи, то есть является хорошим адсорбентом. Многим из вас, наверное, известно, что при пищевых отравлениях употребляют таблетки активированного угля.
С именем русского учёного Д. И. Менделеева связано немало выдающихся страниц в развитии экономики и транспорта Донбасса.
Во время визита в г. Юзовку в 1888 г. учёный посетил металлургический завод и шахту при нём. Он интересовался оборудованием цехов, качеством металла, производимого на заводе, условиями труда металлургов и горняков.
Результат поездки Д. И. Менделеева в Юзовку — работа «Сила, основанная на берегах Донца», в которой открыватель периодического закона выразил своё восхищение неисчерпаемыми богатствами Донецкого края.

Охрана окружающей среды от загрязнений при переработке углеводородного сырья и использовании продуктов его переработки
Ежегодно в мире сжигается около 2,5 млрд т нефтепродуктов и более 20 млрд т каменного угля. Это приводит к попаданию в атмосферу большого количества вредных веществ и огромным затратам кислорода. За последние 50 лет кислорода было использовано столько же, сколько за всю предыдущую историю человечества.
Чтобы уберечь организм человека и всё живое на нашей планете от негативного влияния разного рода загрязнений, на государственном уровне устанавливают предельно допустимые концентрации (ПДК) вредных веществ.
Предельно допустимая концентрация — это такое количество вредного вещества, которое практически не влияет на здоровье человека и не имеет побочного действия на его потомков. Различают максимальную разовую и среднесуточную дозы воздействия вредного вещества.
При переработке углеводородного сырья обязательным является соблюдение норм ПДК веществ, попадающих в окружающую среду. Для этого устанавливают оборудование, предотвращающее прямые выбросы вредных веществ в биосферу, обезвреживающее или нейтрализующее их; используют отходы производства как повторное сырьё и т. д.
Охрана окружающей среды от загрязнения продуктами переработки каменного угля: Не только химическая промышленность, но и быт людей связан с использованием различных видов топлива, причём энергопотребление с развитием цивилизации неуклонно растёт. Всё это не только приносит человечеству пользу, но и имеет негативные последствия.' Рост объёмов добычи и использования природных источников углеводородов и полученных из них продуктов, уменьшение площадей зелёных насаждений наносят ощутимый урон окружающей среде, а иногда имеют и необратимые последствия. Рассмотрим некоторые конкретные примеры.
При сжигании каменного угля образуется также сульфур( ) оксид (сернистый газ)
) оксид (сернистый газ)  а вы уже знаете из 10 класса о его опасности для окружающей среды как одного из факторов кислотных дождей. Продукт переработки каменного угля — кокс — тоже содержит остатки серы, которые в доменной печи, где кокс используется в качестве источника тепловой энергии и восстановителя, выгорают с образованием сульфур(
а вы уже знаете из 10 класса о его опасности для окружающей среды как одного из факторов кислотных дождей. Продукт переработки каменного угля — кокс — тоже содержит остатки серы, которые в доменной печи, где кокс используется в качестве источника тепловой энергии и восстановителя, выгорают с образованием сульфур( ) оксида.
) оксида.
Вспомните химизм доменного процесса и сделайте вывод, почему доменное и коксохимическое производства располагают в непосредственной близости.
С целью охраны окружающей среды от загрязнения этим и другими вредными выбросами доменный газ улавливают и направляют в теплообменники для нагревания воздуха, подающегося в домну. Экологической безопасности способствует внедрение глубокой переработки химических продуктов коксования.
В местах проведения подземной добычи каменного угля создаётся угроза изменения ландшафта, случаются провалы земной поверхности над выработкой отработанных шахт (рис. 51).

Ещё одним негативным следствием добычи каменного угля является появление терриконов (рис. 52).
Терриконы — индустриально-производственные отходы, которые возвышаются вблизи каменноугольных шахт.
Более чем за столетний период добычи и переработки угля на территории Донецкого бассейна в терриконах и отвалах накопилось огромное количество угольных пород и отходов. Только в Донецкой области насчитывается более 600 терриконов. Под ними находятся значительные площади плодородных земель.

Терриконы наносят окружающей среде значительный вред ещё и тем, что в них продолжают протекать процессы окисления с образованием вредных веществ, внутри держится высокая температура и бывают случаи самовозгорания (рис. 53), что крайне опасно.
Горение терриконов, пылеобразование, другие негативные проявления их воздействия на окружающую среду вызывают
миграцию токсичных веществ, приводящую к загрязнению воздуха, ухудшению состояния подземных и поверхностных вод.
Продолжаются поиски способов рационального использования индустриально-производственных отходов, содержащихся в терриконах. Их склоны оформляют в виде террас, которые озеленяют неприхотливыми к условиям произрастания кустарниками и деревьями. Имеющиеся в терриконах вещества используют в изготовлении шлакоблоков, мощении дорог и т. д. Значительную работу по озеленению терриконов проводят сотрудники Донецкого ботанического сада. И всё же эта проблема остаётся до конца нерешённой.
Какие собственные проекты по утилизации отходов, накапливающихся в терриконах, вы можете предложить?
Охрана окружающей среды от загрязнения продуктами переработки нефти: Деятельность нефтеперерабатывающих заводов сопровождается широкомасштабным воздействием на окружающую среду. Негативное влияние нефтеперерабатывающих комплексов испытывают все элементы биосферы: поверхностные и подземные воды, воздух, почвенный покров, фауна и флора. Это влияние не обходит стороной и здоровье человека.

Сейчас вопрос выбросов в атмосферу веществ предприятиями по переработке углеводородного сырья, транспортными средствами, двигатели которых работают на добытом из нефти горючем, привлекает внимание мирового сообщества по причине опасности загрязнения окружающей среды, в частности проявления одного из его последствий — возникновения парникового эффекта.
Вспомните из курса химии 10 класса, какие газы получили название парниковые и в чём заключается сущность парникового эффекта.
В процессе добычи, подготовки и переработки нефти образуются устойчивые нефтяные эмульсии, нефтешламы и другие опасные отходы. На большинстве предприятий нефтедобывающей и нефтеперерабатывающей промышленности Места хранения отходов в случае их неправильной организации, эксплуатации и старения становятся источниками загрязнения атмосферного воздуха, почвенного покрова, поверхностных и подземных вод. Если не предпринимать соответствующих природоохранных мер, возможно загрязнение питьевой воды.
В случае полного сгорания углеводородов, входящих в состав бензина (или другого углеводородного топлива), конечными продуктами являются вода и углекислый газ. Благодаря растениям углекислый газ участвует в синтезе органических веществ и негативных экологических последствий (парникового эффекта, повышенного содержания 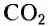 в составе воздуха) не возникает. Однако выхлопные газы содержат определённый процент токсичных и даже канцерогенных веществ. Вам известно, что в состав выхлопных газов автомобильных двигателей входят опасные для человека и всей живой природы угарный газ СО, нитроген(
в составе воздуха) не возникает. Однако выхлопные газы содержат определённый процент токсичных и даже канцерогенных веществ. Вам известно, что в состав выхлопных газов автомобильных двигателей входят опасные для человека и всей живой природы угарный газ СО, нитроген( ) оксид
) оксид 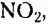 соединения Плюмбума. Чем больше пробег и срок эксплуатации автомобиля, тем больше вероятность его экологической опасности. Каждое из государств устанавливает свои предельно допустимые нормы содержания вредных выбросов, вводит технические осмотры машин с целью выяснения соответствия работы двигателя этим нормам. Однако в одних странах эти нормы выше, в других ниже. В одних государствах за их нарушение на владельца машины накладывается ощутимая санкция, у других — минимальные штрафы.
соединения Плюмбума. Чем больше пробег и срок эксплуатации автомобиля, тем больше вероятность его экологической опасности. Каждое из государств устанавливает свои предельно допустимые нормы содержания вредных выбросов, вводит технические осмотры машин с целью выяснения соответствия работы двигателя этим нормам. Однако в одних странах эти нормы выше, в других ниже. В одних государствах за их нарушение на владельца машины накладывается ощутимая санкция, у других — минимальные штрафы.
Поинтересуйтесь, какие мероприятия, касающиеся охраны окружающей среды от вредных выхлопных газов автомобилей, осуществляются в нашем государстве.
В наше время в мире выпущено и эксплуатируется столько автомобилей, построено столько промышленных объектов, что проблема загрязнения воздуха приобрела глобальный масштаб. Демократическое объединение стран Европы — Европейский Союз (ЕС) — для решения этой проблемы устанавливает нормы, действующие во всех его государствах-членах. Так, с 1993 г. в ЕС внедрена система контроля токсичности отработанных газов автомобильных двигателей. Она отображает нормы токсичности, известные под общим названием «Евро», которым должны соответствовать автомобили и другая техника в странах Евросоюза. По мере того, как нормы изменяются, и каждый раз в сторону ужесточения требований, им предоставляют новый цифровой номер. Экологические нормы в Евросоюзе, касающиеся работы двигателей автомобилей, получили названия «Евро-1» — «Евро-4». Ожидается утверждение «Евро-5» и всемирных экологических норм.
Соответствовать установленным стандартам « Евро» должны не только автомобили, но и горючее.
Больше всего проблем с соблюдением норм «Евро» возникает для владельцев старых автомобилей. Чтобы обеспечить работу личного транспорта в пределах разработанных стандартов, им приходится осуществлять переоборудование двигателей, применять каталитические нейтрализаторы и т. д.
Преимущества природного газа как топлива: Природный газ используется как топливо для электростанций, автомобилей, газовых плит и т. д. Изучая природный газ, мы отметили, что по сравнению с бензином он является более экологически чистым топливом для двигателей автомобилей. Переход с бензина на газовое топливо — это ещё один надёжный способ сохранения окружающей среды.
Газ легче, чем пары бензина, смешивается с воздухом, поэтому происходит более полное сгорание, благодаря чему меньше токсичных выбросов попадает в атмосферу. При использовании газа нагар в двигателе образуется гораздо медленнее, чем при использовании бензинового топлива. Тем самым уменьшаются выбросы вредных веществ в окружающую среду, увеличивается срок службы двигателя.
Перспектива замены бензина на природный газ вызвана ещё и экономическими факторами, ведь газовое топливо стоит в 3 раза дешевле бензина и ресурсы природного газа больше нефтяных. Важно и то, что автобусы и автомобили, переоборудованные на природный газ, экономят немало бензина. К тому же метан имеет октановое число 120, высокие октановые числа присущи и таким газам, как пропан и бутан (октановые числа 90-110).
Из природного газа осуществляют половину мирового производства водорода, который, является не только ценным химическим сырьём, но и перспективным экологически чистым видом топлива. Мировые лидеры автомобилестроения активно разрабатывают новые модели транспортных средств, работающих на водородном топливе (рис. 54).

Синтетические органические соединения
Синтез органических соединений различных классов на основе углеводородного сырья
Синтез — целенаправленный процесс соединения или объединения разрозненных предметов или понятий в единое целое.
Химический синтез — процесс образования сложных молекул из более простых. Различают неорганический и органический химический синтез. Примером неорганического синтеза является синтез аммониака 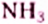 из азота
из азота  и водорода
и водорода  .
.
Органический синтез как направление научных исследований в органической химии касается разработки методов искусственного создания органических веществ.
Органический синтез как технологический процесс — промышленное производство органических соединений на основе углеводородного сырья (газа, нефти, каменного угля) и продуктов его переработки. Благодаря органическому синтезу добывают большое количество веществ, включая и те, которых нет в природе.
Сырьё — природные минералы или добытые промышленным способом вещества, из которых целесообразно производить ту или иную химическую продукцию.
Химическая технология как наука изучает вещества и процессы их превращения в химических производствах.
Синтез органических соединений: Согласно виталистической теории, господствовавшей в химии в начале XIX в., нечего было и думать о возможности создания органических соединений за пределами организма. И всё же XIX в. ознаменовался первыми синтезами (см. § 1). Эти синтезы развенчали виталистическую теорию как псевдонаучную и ознаменовали начало органического синтеза. Сейчас органический синтез в научном плане — это выдающиеся открытия учёных, а в практическом - весомые достижения химической технологии в производстве в промышленных масштабах различных органических соединений.
Характеризуя природные источники углеводородов, мы всё время выделяли два аспекта их использования — как источников энергии и как сырья для получения других веществ. Ведь производство многих веществ и материалов, без которых жизнь в постиндустриальном цивилизованном обществе невозможна, является результатом синтеза органических соединений различных классов на основе углеводородного сырья.
Продукция органического синтеза разнообразна. Это пластмассы. синтетические волокна, каучуки, спирты, кислоты, поверхнос-тно-активные вещества (ПАВ), смазочные масла, синтетические виды топлива, растворители, лакокрасочные материалы, химические средства защиты растений, синтетические лекарственные препараты, душистые вещества, фотохимические материалы и много-много других (рис. 55).

Органический синтез является крупнотоннажным производством, все процессы которого автоматизированы, а для их интенсификации подбирают оптимальные температуру, давление, высокоэффективные катализаторы. Однако опасность загрязнения окружающей среды существует. Природа страдает ещё и от того, что даже незначительные выбросы в атмосферу, попадание в водоёмы сырья и отдельных продуктов органического синтеза, многие из которых токсичны, наносят вред живым организмам.
Углеводородное сырьё для синтеза органических соединений: Почти до середины XX в. основой органического синтеза были вещества, выделяемые из каменноугольной смолы, образующейся при коксовании каменного угля, а также сырьё растительного и животного происхождения. Однако с 20-х годов прошлого века важное значение для органического синтеза получили достижения нефтехимии, повлёкшие постепенную замену каменноугольного сырья нефтью. В органическом синтезе начал использоваться и природный газ, в частности, основная его составляющая — метан 
Для синтеза органических соединений сырьём служат органические вещества, входящие в состав нефти, природного газа, каменного угля, а также вещества, выделяемые из них путём первичной переработки (например, продукты прямой перегонки нефти).
Метан в больших количествах используют для добывания этина (ацетилена), метанола, метаналя, метановой кислоты:
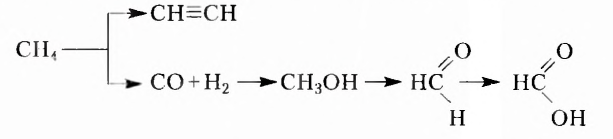
Проиллюстрируйте схему соответствующими уравнениями реакций, назовите вещества.
Каждое из рассматриваемых веществ является промежуточным продуктом в получении новых, не менее важных веществ. В частности, метаналь, или формальдегид, — важное сырьё для производства пластмасс, лаков, клеев и других материалов. У метаналя, как и у метановой кислоты, углеводородный заместитель отсутствует, а функциональная карбонильная группа 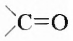 соединена с двумя атомами Гидрогена.
соединена с двумя атомами Гидрогена.
Сравните состав метаналя и метановой кислоты. Воспользовавшись материалом рубрики «Эрудитам на заметку» § 4, предложите, как в лабораторных условиях можно превратить метаналь в метановую кислоту.
Распространённым в органическом синтезе является окисление воздухом твёрдых парафинов неразветвлённого строения, вследствие чего образуются высшие спирты и высшие жирные кислоты (содержащие более 10 атомов Карбона). Они необходимы для производства поверхностно-активных веществ, синтетических моющих средств, мыла и т. д.
Из этена (этилена) 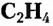 , в промышленном органическом синтезе получают этанол, этановую (уксусную) кислоту, полиэтилен. Чтобы получить этановую кислоту, нужно провести несколько реакций (стадий), например, по следующей схеме:
, в промышленном органическом синтезе получают этанол, этановую (уксусную) кислоту, полиэтилен. Чтобы получить этановую кислоту, нужно провести несколько реакций (стадий), например, по следующей схеме:
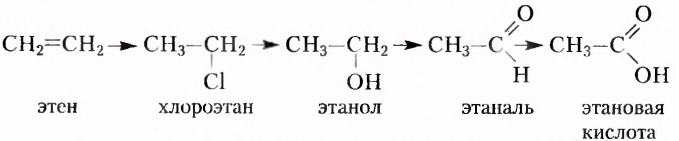
Попробуйте проиллюстрировать схему соответствующими уравнениями реакций.
Вы уже знаете, что одно и то же соединение можно добывать из различных веществ и разными способами. Рассмотрим это положение на примере синтеза этанола 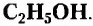 Его можно добыть из этена в одну стадию, осуществив реакцию гидратации при нагревании до температуры 300 °С с использованием ортофосфатной кислоты в качестве катализатора и давлении 10 МПа:
Его можно добыть из этена в одну стадию, осуществив реакцию гидратации при нагревании до температуры 300 °С с использованием ортофосфатной кислоты в качестве катализатора и давлении 10 МПа:
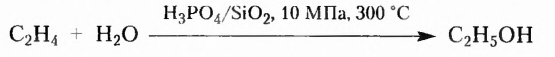
В промышленности этот способ получил широкое применение. Добытый этанол (его ещё называют техническим этиловым спиртом) является ценным сырьём для синтеза каучуков, красителей, лекарственных препаратов и т. д.
Для медицинских целей, а также для изготовления спиртных напитков этанол добывают спиртовым брожением глюкозы, полученной из сахарозы или крахмала:
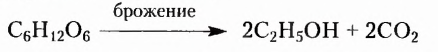
Реакция протекает при наличии дрожжей, а добытый этим способом этанол называют ещё винным спиртом.
Другой способ промышленного получения этанола основывается на использовании древесины. Опилки подвергают гидролизу в присутствии разбавленной сульфатной кислоты при температуре 150-170 
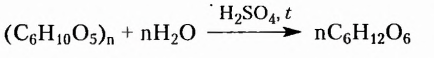
Из полученной глюкозы добывают этанол, который называют гидролизным спиртом.
Этен используют как углеводородное сырьё органического синтеза в производстве стирена (стирола) 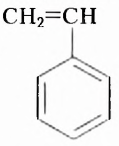 из которого в дальнейшем добывают полимеры.
из которого в дальнейшем добывают полимеры.
Ценным углеводородным сырьём органического синтеза является этим (ацетилен) 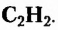 Из него получают этаналь
Из него получают этаналь 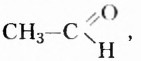 а также акрилонитрил
а также акрилонитрил 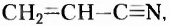 винилхлорид
винилхлорид 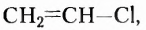 являющиеся мономерами для синтеза полимеров полиакрилонигрила, из которого изготавливают искусственный мех, и поливинил-хлорида, из которого изготавливают искусственную кожу, линолеум, профили пластиковых окон.
являющиеся мономерами для синтеза полимеров полиакрилонигрила, из которого изготавливают искусственный мех, и поливинил-хлорида, из которого изготавливают искусственную кожу, линолеум, профили пластиковых окон.
Используя арены (ароматические углеводороды), получают фенол 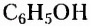 и ацетон
и ацетон 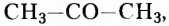 синтезируют смазочные масла, поверхностно-активные вещества. Окислением аренов получают герефталевую кислоту
синтезируют смазочные масла, поверхностно-активные вещества. Окислением аренов получают герефталевую кислоту  которая служит мономером в производстве волокна лавсан и компонентом термостойких пластмасс. Из хлоропроизводных аренов получают эффективные гербициды, изоляционные масла для трансформаторов и растворители.
которая служит мономером в производстве волокна лавсан и компонентом термостойких пластмасс. Из хлоропроизводных аренов получают эффективные гербициды, изоляционные масла для трансформаторов и растворители.
Рассмотренными примерами не ограничивается ассортимент продукции органического синтеза. На сегодня он насчитывает несколько миллионов соединений.
Итак, на основе углеводородного сырья осуществляют разнообразные синтезы, продукты которых имеют большое практическое значение (рис. 56).
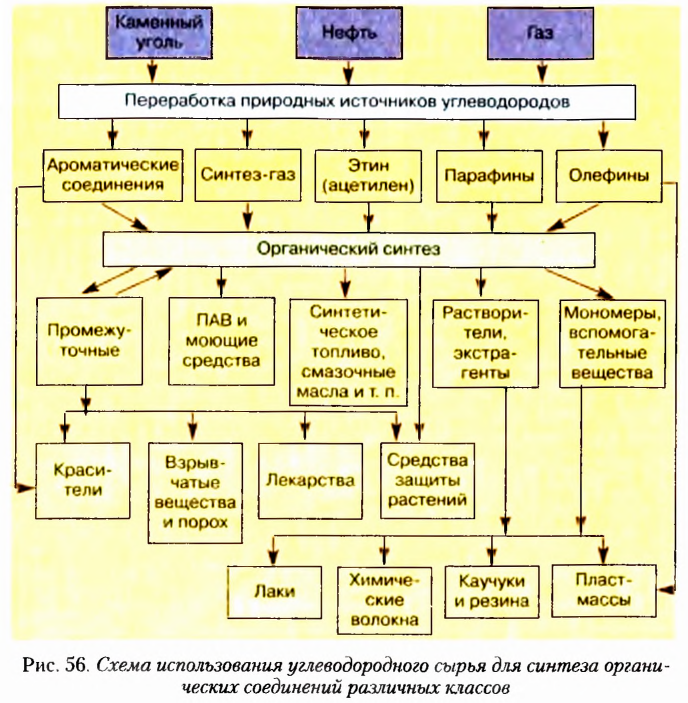
Реакции, на которых базируются синтетические методы получения органических веществ: В процессе синтеза органических соединений имеют место различные типы реакций, большинство из которых вы уже знаете. Рассмотрим некоторые конкретные примеры.
Гидрирование, или гидрогенизация, — процесс присоединения водорода. У ненасыщенных соединений он происходит по месту разрыва кратных (двойной, тройной) связей, в условиях повышенного давления, температуре в интервале 20-200 °С и при участии катализаторов. Например:
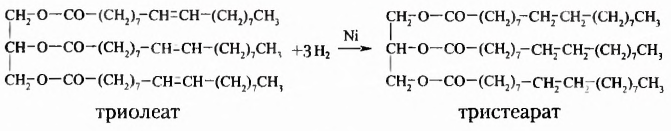
На этой реакции основан промышленный способ превращения жидких жиров (растительного масла) в твёрдые.
Дегидрирование — реакция отщепления водорода. Вследствие этого процесса образуются менее насыщенные по сравнению с исходными веществами продукты реакции. Дегидрированием синтезируют альдегиды и кетоны из спиртов, алкены из алканов, бензен и его гомологи из соответствующих циклопарафинов и др. Например:
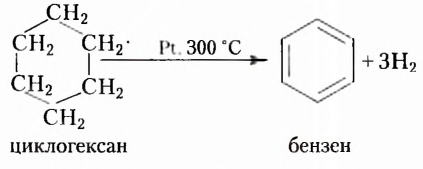
Гидратация — процесс присоединения воды. Так, гидратацией этина (ацетилена) в промышленности добывают этаналь (уксусный альдегид), который используют для синтеза этановой (уксусной) кислоты:
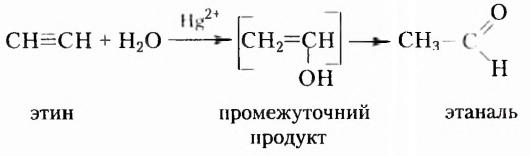
Дегидратация — отщепление молекул воды. Примером получения органического соединения с участием двух реакций сразу (дегидратации и дегидрирования) является добывание бута-1,3-диена — мономера одного из каучуков:
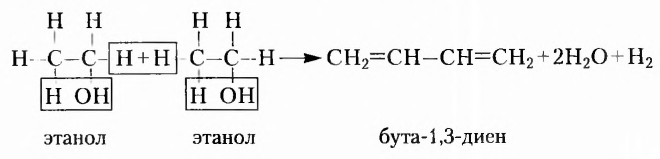
Галогенирование — введение атомов галогенов (Флуора, Хлора, Брома, Иода) в молекулу органического соединения. Галогенированием метана получают растворители, например трихлорометан (хлороформ), теграхлорометан:
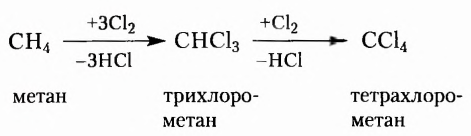
Хлорированием бензена, протекающем под воздействием света, добывают гексахлороциклогексан (гексахлоран), который используется в сельском хозяйстве как инсектицид:
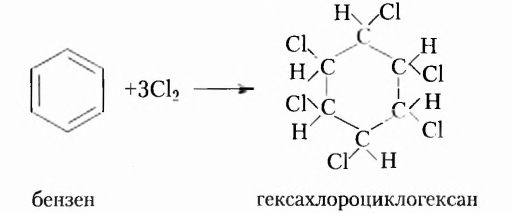
Нитрование - реакция введения в соединение нитрогруппы  Так, выделенный из каменноугольной смолы бензен (бензол)
Так, выделенный из каменноугольной смолы бензен (бензол) 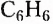 подвергают нитрованию смесью, состоящей из концентрированных нитратной и сульфатной кислот:
подвергают нитрованию смесью, состоящей из концентрированных нитратной и сульфатной кислот:
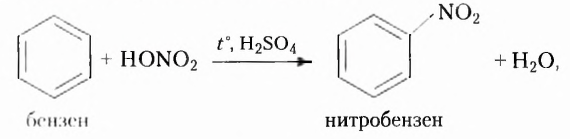
а полученный нитробензен (нитробензол) 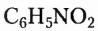 превращают в анилин (аминобензен)
превращают в анилин (аминобензен) 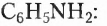
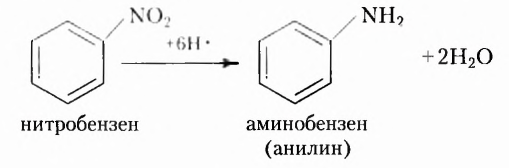
Анилин — один из важнейших продуктов химической промышленности. Из него изготавливают красители, лекарственные препараты, взрывчатые вещества, высокомолекулярные соединения и т. д.
Сравнение качественного и количественного состава нитробензена и аминобензена указывает на различие в составе функциональных групп этих веществ.
Реакция превращения нитробензена в анилин была открыта русским химиком Н. Н. Зиминым в 1842 г. Отныне в органической химии это именная реакция, что является доказательством важности рассматриваемого способа добывания анилина. Один из зарубежных современников Н.Н. Зинина подчёркивал что если бы учёный, кроме этого синтеза, ничего больше не сделал, то его фамилию всё равно нужно было бы вписать в историю химии золотыми буквами. И действительно, с открытием этого синтеза началось промышленное производство красителей, которое положило начало развитию промышленности органического синтеза.
Эстерификация взаимодействие органической или оксигеносодержащей неорганической кислоты со спиртом, вследствие чего образуются эстеры. Например, при взаимодействии этановой кислоты 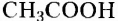 с пентанолом
с пентанолом 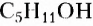 образуется эстер, имеющий запах груши:
образуется эстер, имеющий запах груши:
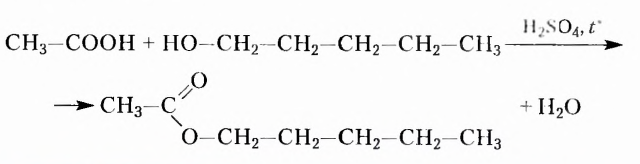
Благодаря разнообразным синтетическим методам из углеводородного сырья добывают большое количество органических веществ различных классов, используемых в дальнейшем в различных отраслях химической промышленности.
Эфирные масла — летучие душистые вещества, выделенные из определённого вида эфиромасличных растений (например, из роз, лаванды, ванили, ландыша, розмарина, мяты, шалфея, эвкалипта, кориандра). Добывать их из натурального сырья сложно и слишком дорого. Так, розовое масло содержит более 200 различных соединений. Чтобы выделить 1 кг такого масла, нужно переработать 3 т лепестков роз! Поэтому современная парфюмерная промышленность преимущественно использует продукцию органического синтеза. В наше время налажено
производство почти всех натуральных душистых веществ синтетическим способом, а также синтезированы душистые вещества, аналогов которых не существует в природе.
О том, что душистые вещества относятся к разным классам органических соединений, вы сделаете вывод, взглянув на структурные формулы соединений, причастных к созданию аромата миндаля (а), ванили (б), жасмина (в), роз (г):
Парфюмерная продукция, кроме природных и синтетических душистых веществ, содержит фиксаторы запаха, этанол, воду, бальзамы, красители и т. д. В зависимости от содержания душистого вещества и спирта парфюмерную продукцию подразделяют на духи (20-50 % душистых веществ), одеколоны (2-8 % душистых веществ, до 80 % спирта, остальное - вода) и туалетную воду (1-1,5 % душистых веществ, 59-68 % спирта, остальное — вода).
Научные достижения биохимии, генетики, молекулярной биологии и химической технологии положили начало такой отрасли общественного хозяйства, как биотехнология.
Биотехнология — совокупность промышленных способов добычи полезных продуктов с использованием живых организмов и биохимических процессов.
Сам термин «биотехнология» возник в 70-х годах XX в. (от греч. bios — жизнь, techne — искусство, мастерство, logos — слово, учение), хотя биотехнологические процессы человек осуществлял давно занимался хлебопечением и виноделием, изготовлением сыра и других молочных продуктов. В настоящее время на основе отходов промышленной переработки углеводородов нефти, природного газа, древесины и т. д. с помощью микроорганизмов биотехнологическая промышленность производит такие ценные продукты, как витамины, гормоны, кормовые белки, антибиотики, ферменты, аминокислоты, бактериальные удобрения, средства защиты растений, метанол, органические кислоты (уксусную, лимонную, молочную) и множество другой продукции.
По сравнению с традиционным органическим синтезом биохимические процессы протекают в более мягких условиях, без использования высоких температур и давления, а высокая производительность микроорганизмов позволяет осуществлять технологические процессы непрерывно. Кроме того, получаемая продукция нетоксична для человека и животных. Эти и многие другие факторы способствуют стремительному развитию биотехнологической промышленности.
Биотехнология — это современное направление в синтезе органических соединений, позволяющее получать ценную продукцию, способствующее решению экологических проблем путём переработки сельскохозяйственных, промышленных и бытовых отходов.
Пластмассы
Полимеры — высокомолекулярные соединения, макромолекулы которых состоят из большого количества структурных звеньев, последовательно соединённых между собой химическими связями. Относительная молекулярная масса таких соединений составляет от нескольких тысяч до нескольких миллионов.
Дословно с греческого полимер — это молекула, состоящая из многих (poli) частей (meros).
Полимеры бывают природные (белки, крахмал, целлюлоза, нуклеиновые кислоты, натуральный каучук и др.) и синтетические (полиэтилен, полипропилен, синтетический каучук и др.).
Полимеры являются продуктами реакций полимеризации и поликонденсации.
Полимеризация — реакция последовательного соединения молекул исходных веществ, получивших название мономеры, в одну макромолекулу.
Поликонденсация — процесс образования высокомолекулярных соединений вследствие взаимодействия функциональных групп молекул мономеров.
Постоянно повторяющиеся участки полимерной цени называют структурными (элементарными) звеньями, а число этих звеньев в полимерной цепи — степенью полимеризации.
При написании формулы полимера в скобках указывают структурное звено, а за скобками буквой п как нижним индексом обозначают степень полимеризации. Это показано в схеме полимеризации:
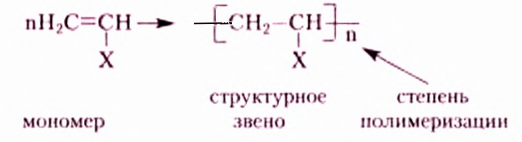
Органические вещества как основа современных материалов:
Рассматривая белки, жиры, углеводы, мы акцентировали внимание на их биологической роли. Однако органические вещества выполняют в жизни человека и другие функции. В частности, их широко используют как материалы.
Материалы — то, из чего строят дороги, дома, мосты, изготавливают машины, посуду, мебель, одежду и т. д.
Человек использовал материалы издавна. Сначала это были материалы природного происхождения (кожа, древесина, камень, глина). Благодаря развитию химии и химической промышленности в настоящее время создано много материалов, имеющих полезные свойства, однако не существующих в природе. Этим прежде всего можно объяснить большое разнообразие современных материалов синтетического происхождения. На сегодня рост их производства намного опережает рост производства металлов.
Понятие о пластмассах. Основными представителями полимерных материалов являются пластмассы, каучуки, волокна.
Пластмассы — это материалы на основе
полимеров, которые способны при нагревании приобретать заданную форму и сохранять её после охлаждения.
По масштабам производства среди полимерных материалов пластмассы занимают первое место. Основным в их составе является высокомолекулярное соединение — полимер. Кроме него, в состав пластмасс входят стабилизаторы (антиоксиданты, свето-стабилизаторы), которые способствуют сохранению свойств пластмасс в процессе их переработки и использования; пластификаторы, повышающие эластичность и снижающие хрупкость пластмасс;
красители, которые придают материалу нужную окраску; наполнители (древесная и кварцевая мука, ткань, стекловолокно, асбест, бумага, молотая слюда и т. д.). Наполнители улучшают механические свойства материала и уменьшают его себестоимость. Например, используя стекловолокно, получают материалы с механической прочностью, не уступающей стали. Наполнение воздухом или азотом делает пластмассы лёгким теплоизоляционным материалом.
Молекулы полимеров могут иметь линейное, разветвлённое и сшитое (в плоскости или пространстве) строение. Это сказывается на свойствах пластмасс, в частности обусловливает такие их свойства, как термопластичность и термореактивность. Термопластичные пластмассы, или термопласты, можно многократно размягчать нагреванием и изготавливать изделия различной формы. Термореактивные пластмассы, или реактопласты, после затвердевания изделия не подлежат повторному расплавлению или повторной переработке. Как первые, так и вторые получили широкое применение в хозяйственной деятельности человека.
Подумайте, каким явлением — физическим или химическим — является изготовление изделий из пластмасс.
К термопластам относятся полиэтилен, полипропилен, поливинилхлорид, полистирен, к реактопластам — фенолформальдегидные смолы.
Полиэтилен  продукт полимеризации этена (историческое название — этилен) C2Hj, твёрдое, полупрозрачное вещество, термопластичное, немного жирное на ощупь (напоминает парафин), горит голубым неярким пламенем, без запаха, легче воды, не растворяется в ней, не токсично. Как материал может быть разного цвета в зависимости от добавленных красителей (рис. 57).
продукт полимеризации этена (историческое название — этилен) C2Hj, твёрдое, полупрозрачное вещество, термопластичное, немного жирное на ощупь (напоминает парафин), горит голубым неярким пламенем, без запаха, легче воды, не растворяется в ней, не токсично. Как материал может быть разного цвета в зависимости от добавленных красителей (рис. 57).
Среди известных полимеров полиэтилен имеет наипростейшее строение. Его получают полимеризацией этена, создавая соответствующие условия (давление, температуру, катализатор):
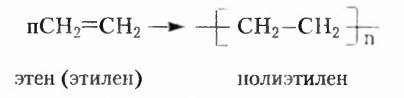
Из приведённой схемы становится понятно, что образование макромолекулы полиэтилена произошло вследствие разрыва двойных связей в молекулах мономеров. Отныне в макромолекуле полимера присутствуют лишь одинарные связи. Другими словами, по химическому строению полиэтилен относится к насыщенным соединениям.

Шаростержневая модель образованного полимера изображена на рисунке 58 (в модели выделено структурное звено).
Вам известно, что насыщенные углеводороды от ненасыщенных можно отличить с помощью качественных реакций. Так, ненасыщенные углеводороды при обычных условиях вступают в реакции присоединения и окисления, насыщенные — нет.
Вспомните, что одной из качественных реакций на ненасыщенные соединения является их окисление раствором калий перманганата, и назовите признак этой реакции.
Чтобы выяснить, к термопластичным или термореактивным пластмассам принадлежит полиэтилен, насыщенным или ненасыщенным соединением является этот полимер и его отношение к действию кислот и щелочей, выполним демонстрационный опыт. Кусочек образца полиэтилена поместим на предметное стекло и будем нагревать. Спустя некоторое время попробуем стеклянной палочкой изменить форму образца — это легко удаётся. Следовательно, полиэтилен относится к термореактивным пластмассам.

Исследуем характер горения полиэтилена, для этого кусочек образца закрепим в пинцете и подожжём. Наблюдаем, что образец быстро вспыхивает и горит неярким голубым пламенем без копоти (рис. 59а).
Чтобы установить отношение полиэтилена к кислотам, щёлочам и раствору калий перманганата, продолжим выполнение опыта. В четыре пробирки (рис. 59б) нальём по 5 мл растворов нитратной кислоты (1), сульфатной кислоты (2), щёлочи (3) и калий перманганата (4). В каждую из них поместим по несколько кусочков полиэтилена. Можем наблюдать, что ни в одном из растворов полиэтилен не изменяется.
На основании результатов опыта можно сделать вывод, что полиэтилен — термопластичный, устойчивый к действию кислот, щёлочей и окислителей.
Полиэтилен в отличие от своего мономера этена (этилена) проявляет химические свойства насыщенных соединений.
Он устойчив к действию кислот, щёлочей, окислителей, изменяет форму при нагревании и сохраняет приобретённую форму после охлаждения.
Устойчивость полиэтилена при комнатной температуре к действию органических растворителей обусловливает его широкое применение в изготовлении посуды, труб, ёмкостей для хранения и транспортировки кислот, щёлочей. Однако горячая концентрированная нитратная кислота разрушает полиэтилен.

Почти половина всего полиэтилена используется в производстве полиэтиленовой плёнки и как упаковочный материал. Благодаря нетоксичности полиэтилен используется как материал для изготовления водопроводных труб, удобных изделий домашнего обихода. Высокие диэлектрические показатели полиэтилена позволяют применять его для изоляции проводов.
Широкое применение полиэтилена объясняется удачным сочетанием таких его свойств, как лёгкость, простота переработки, высокая химическая стойкость, термопластичность, отсутствие электропроводности.
Ознакомление со свойствами других термопластов: Такие полимеры, как полипропен (полипропилен), поливинилхлорид и полистирен (полистирол) образуются по сходной с этеном схеме полимеризации. Выяснить их образование поможет рисунок 60.
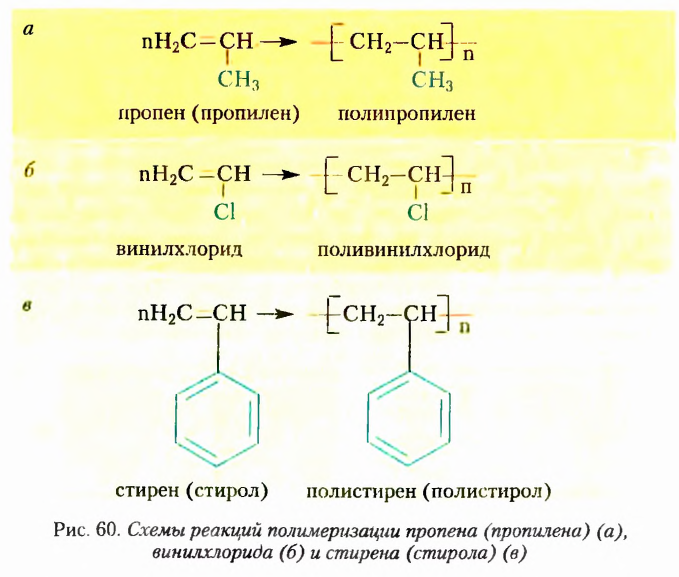
Как видим, главная цепь этих полимеров построена из одинаковых групп атомов, а отличаются только боковые ответвления.
Учитывая химическое строение полипропилена, поливинилхлорида и полистирена, спрогнозируйте, каким будет их отношение к нагреванию, растворам кислот, щелочей, окислителей.
Для подтверждения или опровержения предположения продолжим демонстрационный опыт с этими полимерами, аналогично выполненному с полиэтиленом. Все исследуемые вещества проявляют устойчивость к действию кислот, щёлочей и раствора калий перманганата, а также все размягчаются при нагревании. Однако горят они по-разному: полипропилен — так же, как и полиэтилен, а поливинилхлорид и полистирен сгорают с копотью, причём поливинилхлорид в отличие от полистирена вне пламени не горит (рис. 61, 62).
Полиэтилен, полипропилен и полистирен — термопластичные пластмассы, устойчивые к действию кислот, щёлочей, окислителей.

Полипропилен 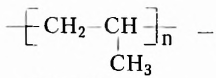 продукт полимеризации пропена (пропилена)
продукт полимеризации пропена (пропилена) 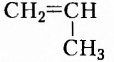 , твердый, жирный на ощупь, молочно-белого цвета, термопластичный, легче поды и нерастворимый в ней. Полипропилен также характеризуется высокой устойчивостью к действию кислот, щёлочей, растворов солей и многих других агрессивных сред. Горит ярким пламенем. При комнатной температуре полипропилен не растворяется в большинстве органических растворителей, а с повышением температуры набухает или растворяется, в частности в бензене.
, твердый, жирный на ощупь, молочно-белого цвета, термопластичный, легче поды и нерастворимый в ней. Полипропилен также характеризуется высокой устойчивостью к действию кислот, щёлочей, растворов солей и многих других агрессивных сред. Горит ярким пламенем. При комнатной температуре полипропилен не растворяется в большинстве органических растворителей, а с повышением температуры набухает или растворяется, в частности в бензене.
Полипропилен используют подобно полиэтилену, но изделия из него выдерживают большую нагрузку и нагрев, чем полиэтиленовые. Большая устойчивость к многочисленным сгибаниям и истиранию обеспечивает высокую прочность полипропиленовых канатов, сеток, технических тканей. Кроме того, его применяют в изготовлении обуви и одежды, игрушек, расчёсок, футляров, посуды и т. п. (рис. 63).

Поливинилхлорид  продукт полимеризации винилхлорида (хлоровинила)
продукт полимеризации винилхлорида (хлоровинила)  , белый порошок, устойчивый к действию кислот и щёлочей, легко окрашивается, диэлектрик, обладает высокой механической прочностью, не горит, однако сравнительно легко разлагается при нагревании, выделяя гидроген хлорид. Применяется в качестве изоляционного материала электрического провода и антикоррозионного материала для покрытия днищ автомобилей, в производстве линолеума, искусственной кожи для обуви, профилей металлопластиковых окон, клеёнки, деталей химической аппаратуры, труб (рис. 64). Из поли-винилхлорида изготавливают также плащи от дождя и т. п.
, белый порошок, устойчивый к действию кислот и щёлочей, легко окрашивается, диэлектрик, обладает высокой механической прочностью, не горит, однако сравнительно легко разлагается при нагревании, выделяя гидроген хлорид. Применяется в качестве изоляционного материала электрического провода и антикоррозионного материала для покрытия днищ автомобилей, в производстве линолеума, искусственной кожи для обуви, профилей металлопластиковых окон, клеёнки, деталей химической аппаратуры, труб (рис. 64). Из поли-винилхлорида изготавливают также плащи от дождя и т. п.

Полистирен (полистирол) 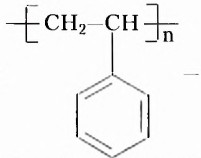 продукт полимеризации стирена (стирола), твёрдый прозрачный стекловидный материал. Он достаточно устойчив к действию щелочей и кислот, кроме горячей нитратной; растворяется во многих органических растворителях. Полистирен размягчается при температуре
продукт полимеризации стирена (стирола), твёрдый прозрачный стекловидный материал. Он достаточно устойчив к действию щелочей и кислот, кроме горячей нитратной; растворяется во многих органических растворителях. Полистирен размягчается при температуре  и в отличие от уже рассмотренных полимеров при нагревании довольно легко деполимеризуется, то есть разлагается с образованием молекул мономера. Полистирен легко воспламеняется и горит на воздухе с выделением большого количества копоти.
и в отличие от уже рассмотренных полимеров при нагревании довольно легко деполимеризуется, то есть разлагается с образованием молекул мономера. Полистирен легко воспламеняется и горит на воздухе с выделением большого количества копоти.
Как весьма термопластичный материал, полистирен легко поддается формовке. Из него изготавливают изделия, не требующие больших механических нагрузок, например декоративно-отделочные материалы, облицовочную плитку. Учитывая нетоксичность полистирена, его используют для изготовления посуды, канцелярских принадлежностей, галантерейных изделий, игрушек, осветительной аппаратуры (рис. 65). Как хороший диэлектрик полистирен используется для изготовления деталей электро- и радиоаппаратуры, кабельной изоляции.

Разновидностью полистирена является пенополистпирен (пенопо-лисгпирол), или пенопласт. Каждый из вас его хорошо знает, стоит лишь напомнить, что бытовую технику (телевизор, холодильник и т. п.) мы покупаем упакованными в пенопласт. В процессе изготовления этого материала к полистирену добавляют вспениватели, в частности воздух, и он приобретает структуру застывшей пены с закрытыми порами. Такой материал очень лёгкий, прочный, устойчив к деформации. Сейчас пенопласт — эффективный и универсальный тепло- и звукоизоляционный, а также упаковочный материал (рис. 65).
Благодаря тепло- и звукоизоляционным свойствам пенопласт получил широкое применение.
Высотные здания (более 20 этажей) имеют внешнюю теплоизоляцию из пенопласта. Не будь этого материала, какую бы массу имели высотные дома, изготовленные только из кирпича и бетона?!
Политетрафлуороетен (политетрафторэтилен, тефлон, фторопласт-4) 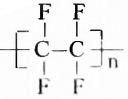 — продукт полимеризации тетрафлуороэтена (прежнее название — тетрафторэтилен)
— продукт полимеризации тетрафлуороэтена (прежнее название — тетрафторэтилен) 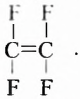
По сравнению с уже рассмотренными полимерами тефлон выпускается в меньших количествах, однако получил широкое применение благодаря своим свойствам - высокой температуре плавления, большой твёрдости, термической и химической стойкости, низкому коэффициенту трения. По химической стойкости он превышает такие металлы, как платина и золото. На него не действуют органические растворители, растворы даже горячих концентрированных кислот, в том числе и нитратной, щёлочей и т. п. Более того, не существует ни одного растворителя, в котором тефлон хотя бы набухал. Специфическая структура молекул обусловливает уникальные физические и химические свойства фторопластов, которые отсутствуют у других материалов. Эти свойства обеспечили полимеру широкое применение в авиации, радиотехнике, пищевой, фармацевтической и холодильной промышленности. Инертность тефлона к маслам, кислотам и жирам позволяет изготавливать из него различную посуду для приготовления и хранения пищевых продуктов, лекарственных препаратов (рис. 66). Он не влияет на физиологические процессы, поэтому используется в изготовлении искусственных хрящей и костей.

Фенолформальдегидные смолы 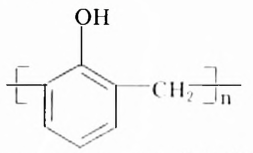 продукт поликонденсации двух мономеров — фенола
продукт поликонденсации двух мономеров — фенола 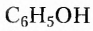 и метаналя (формальдегида) НСНО. Характер взаимодействия веществ зависит от их количественного соотношения и от природы катализатора: может образоваться как полимер линейного строения, так и трёхмерный полимер. Пространственное структурирование делает полимер термореактивным.
и метаналя (формальдегида) НСНО. Характер взаимодействия веществ зависит от их количественного соотношения и от природы катализатора: может образоваться как полимер линейного строения, так и трёхмерный полимер. Пространственное структурирование делает полимер термореактивным.
Фенолформальдегидные смолы и пластмассы на их основе относятся к наиболее распространённым термореактивным пластмассам. Из них изготавливают ламинат, облицовочные материалы, лаки, клеи и т. д. Фенолформальдегидные смолы в комплексе с порошкообразными наполнителями (древесной мукой, бумагой, слюдой, графитом и др.) являются тем материалом, из которого производят панели и различные детали для радиоаппаратуры, корпуса телефонных аппаратов, электрические выключатели, штепсельные розетки, патроны для электроламп и т. п. (рис. 67).

Пластмассы — современные синтетические материалы с широким спектром применения. Благодаря своим свойствам они преимущественно успешно заменяют такие материалы, как древесина, чугун и сталь, кирпич, силикатное стекло и т. п.
Полиметилметакрилат (органическое стекло, плексиглас) — продукт полимеризации метилметакрилата:

Эго твёрдое, бесцветное, прозрачное, светостойкое, устойчивое к действию кислот и щёлочей вещество; не разбивается при ударе и не растворяется во многих органических растворителях.
Из-за своей прозрачности полимер получил название органическое стекло. Его можно красить в любой цвет. В отличие от обычного силикатного стекла органическое стекло легко обрабатывается механическим способом и склеивается. Ценным его свойством является способность пропускать до 74 % ультрафиолетового излучения, тогда как обычное оконное стекло пропускает его лишь 0,6 %. Поэтому из органического стекла изготавливают различные светотехнические изделия, в частности фонари стоп-сигналов и указатели поворотов автомобилей, стёкла иллюминаторов самолётов, линзы для лазерной техники, фотоаппаратов, микроскопов, биноклей, стёкла очков и т.д. Из него также изготавливают вазы, пуговицы, линейки, ручки и много других изделий. Водными дисперсиями (типа латекса) полиметилметакрилата пропитывают древесину, кожу, ткали, бумагу, повышая их водостойкость и придавая им блеск. Благодаря физиологической инертности и высокой механической прочности этот полимер широко применяют для изготовления зубных и глазных протезов.
Синтетические каучуки
Кроме алканов, алкенов, алкинов, аренов и циклопарафинов, существуют также алкадиены (диеновые углеводороды, диены).
Алкадиены, или диеновые углеводороды, — это углеводороды с двумя двойными связями в молекуле, их общая формула 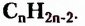
Две двойные связи в молекулах алкадиенов могут быть размещены около одного атома Карбона С=С=С—С или у разных С—С—С—С, С=С—С—С=С. Диеновые углеводороды способны вступать в реакции полимеризации. Наиболее широко в промышленности используются алкадиены, у которых двойные связи размещены через одну одинарную, например С=С-С=С.
В составлении названий диеновых углеводородов придерживаются следующих общих правил: главная цепь молекулы должна включать обе двойные связи. Нумерацию атомов Карбона в цепи осуществляют так, чтобы двойные связи получили наименьшие номера. Название алкадиена образуют от названия соответствующего алкана (с таким же числом атомов Карбона), в котором суффикс -ан заменяют на -диен после корня названия цифрами указывают положение двойных связей. Если есть заместители, то сначала указывают номера атомов Карбона, у которых они размещены, и названия заместителей. Например:

Бута-1,3-диен и 2-метилбута-1,3-диен являются сырьём для производства полимеров с общим названием каучуки.
Натуральный, или природный, каучук. Коренное население Южной Америки уже в XVII в. умело выделять из млечного сока (латекса) тропического растения гевеи природный каучук, которым пропитывали ткани и обувь, благодаря чему те не пропускали воду, изготавливали из каучука упругие мячи.
Способ собирания натурального каучука не изменился до сих пор (рис. 68а). Чтобы добыть каучук из каучуконосных деревьев,делают на коре дерева узкий спиралеобразный надрез. Белый сок (латекс) медленно стекает в сосуд, закреплённый под надрезом (рис. 686). Через несколько часов после надрезания собирается около 150 г сока (надрезы можно делать каждые два дня). Сок густеет и застывает, превращаясь в комочки, а затем высыхает. Это и есть каучук-сырец. Он твердеет на холоде и размягчается на солнце.

Натуральный (природный) каучук — это высокомолекулярный ненасыщенный углеводород с относительной молекулярной массой 15-500 тысяч, мономером которого является диеновый углеводород 2-метилбута-1,3-диен (его ещё называют изопрен 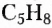 ). Ознакомьтесь с фрагментом записи молекулы натурального каучука (пунктиром выделено структурное звено):
). Ознакомьтесь с фрагментом записи молекулы натурального каучука (пунктиром выделено структурное звено):
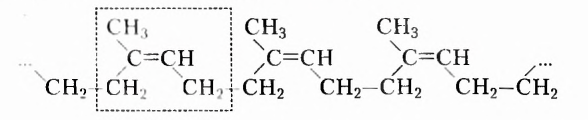
Реакцию полимеризации изопрена при наличии катализатора передает схема
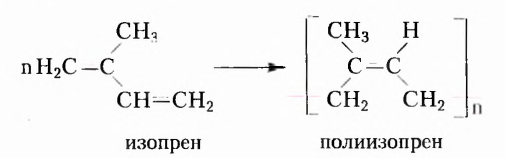
Как видим, каждое структурное звено каучука содержит одну двойную связь.
Каучуки — ненасыщенные полимерные соединения.
Их макромолекулы имеют линейную структуру, хотя и закручены в клубок.
Каучук — эластичный материал (рис. 69): каждый раз под влиянием физических нагрузок макромолекулы каучука раскручиваются, а после прекращения действия силы возвращаются в прежнее состояние. Каучук не растворяется в таких распространённых растворителях, как вода, спирт, ацетон, однако в некоторых других растворителях, например сероуглероде или скипидаре, он растворяется с образованием вязкой массы, её используют как клей.
Для европейцев каучук был почти неизвестен до 1823 г., пока в Англии не начали производство плащей от дождя, ткань для которых обрабатывали натуральным каучуком. Выяснилось, однако, что такие плащи пригодны к использованию только в прохладную дождливую погоду, в жару они становятся липкими, а в холод — грубыми, жёсткими и неэластичными. Лишь с изобретением в 1839 г. вулканизации — способа превращения каучука в резину — стало возможным широкое применение натурального каучука.
Вулканизация каучукаи резина: Выясним, зачем нужно вулканизировать каучук.
Как и все ненасыщенные вещества, невулканизированный каучук проявляет значительную химическую активность. В частности, под влиянием атмосферного кислорода он быстро утрачивает эластичность, становится хрупким. Вместе с тем вулканизированный каучук имеет большую механическую прочность и твёрдость, упругость и эластичность, устойчив к действию растворителей. Резиновую пластинку можно тысячи раз сгибать и разгибать, резиновый шланг — скручивать и раскручивать, и они не повредятся.

Ни один из материалов, изготовленный на основе природного сырья, не имеет такой эластичности, как резина. Она устойчива к истиранию. Так, шины автомобиля, преодолев расстояние в 1000 км, теряют лишь 80-100 г резины. А некоторые сорта резины стираются меньше, чем сталь. Таким образом, вулканизация улучшает физические характеристики каучука, делает его более пригодным к использованию.
Вулканизация - процесс взаимодействия каучука с серой, вследствие чего образуется ценный материал с улучшенными свойствами — резина.
Вулканизацию проводят обычно при умеренном нагревании, заполняя специальные формы смесью каучука, серы, наполнителя, иногда красителей и других добавок. Одновременно с вулканизацией формируется и само изделие. В качестве наполнителя чаще всего используют сажу. Вспомните, что шины автомобилей, мотоциклов, скутеров, велосипедов и т. п. имеют чёрный цвет.
Прочность и износостойкость каучуков усиливают наполнители. Самым распространённым наполнителем является сажа.
Улучшенные, по сравнению с каучуком, свойства резины объясняются тем, что линейный полимер приобретает трёхмерную структуру. Атомы Сульфура вступают в реакцию с макромолекулами каучука по месту разрыва двойных связей и «сшивают» их, образуя сульфидные мостики, которые могут состоять из различного количества атомов Сульфура (рис. 70).
Серы берут не более 10 % от общей массы, поэтому не все двойные связи разрываются.
Кстати, мягкая резинка, которой вы пользуетесь для стирания написанного, изготовлена из каучука, содержащего 3 % серы. Автомобильные шины содержат 5-6 % серы. Если же серы взять из расчёта более 30 % от массы каучука, то вулканизация закончится образованием твёрдого, не эластичного и не электропроводного материала — эбонита. Он широко применяется в электротехнике в качестве изоляционного материала.
Сначала потребности в натуральном каучуке полностью удовлетворялись теми его количествами, которые получали специальной обработкой сока каучуконосных растений. Но с каждым годом спрос на каучук рос, увеличивался перечень изделий из него. Вследствие стремительного развития промышленного применения натурального каучука, и прежде всего в автомобиле- и самолётостроении, натурального каучука стало не хватать. Ведь для добывания 1 т этого вещества необходимо на протяжении 5 лет собирать сок 270 деревьев гевеи, засевать десятки гектаров полей травянистыми каучуконосными растениями, например коксагызом. К тому же эти растения произростают не везде, а лишь в жарком и влажном климате. Поэтому возникла необходимость разработать способы замены натурального каучука синтетическим.
Синтетический каучук: Впервые синтетический каучук в промышленных масштабах был произведён в бывшем СССР в 1932 г. по методу, разработанному С. В. Лебедевым.
Сергей Васильевич Лебедев (1874-1934) — учёный, основоположник промышленного способа получения синтетического каучука, академик Академии наук СССР. Его научные исследования касаются полимеризации, изомеризации, гидрирования ненасыщенных соединений. За изобретение способа добывания синтетического каучука был удостоен высоких государственных наград. Ныне в России его именем назван Научно-исследовательский институт синтетического каучука, сотрудником которого он был. С 1995 г. Российская академия наук присуждает премию имени С. В. Лебедева «За выдающееся работы в области химии и технологии синтетического каучука и других синтетических полимеров.

Мономером в этом процессе был бута-1,3-диен. Его полимеризацию осуществляли при температуре 40-60 °С и давлении 6-8 атм, используя металлический натрий в качестве катализатора. Сначала сырьём были пищевые продукты. Этапы производства передаёт схема
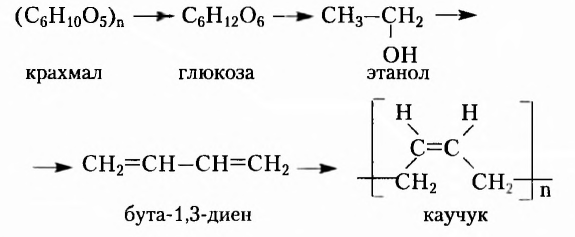
В настоящее время бута-1,3-диен получают синтетическим способом из попутного нефтяного газа и продуктов переработки нефти.
Синтетический каучук является тем материалом, из которого производят в большом количестве резину, используемую для изготовления шин и других изделий. Из года в год растёт потребность в синтетическом каучуке, а следовательно, увеличивается его производство, поскольку натурального каучука недостаточно для обеспечения всех потребностей в этом полимерном материале.
Синтетические каучуки по химическим и физическим свойствам подобны натуральным. И всё же сначала синтетический каучук по основному свойству — эластичности — уступал натуральному.
Как выяснилось, причина заключалась в том, что он не имел стерео-регулярного строения: наряду со звеньями, в которых атомы Гидрогена размещались по одну сторону главной цепи 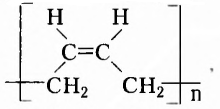 были и такие, в которых атомы Гидрогена размещались по разные стороны
были и такие, в которых атомы Гидрогена размещались по разные стороны 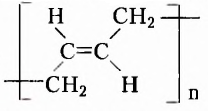 .
.
Стереорегулярное строение — это упорядоченное пространственное расположение одинаковых заместителей в молекуле.
У натурального каучука такими заместителями являются группы 
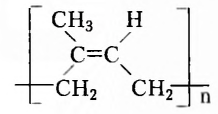
Применяя катализаторы, регулирующие стереостроение каучука, теперь добывают синтетические каучуки, которые по свойствам не уступают натуральным. А используя в качестве мономеров диеновые углеводороды, в молекулах которых атом Гидрогена замещён на другой атом или группу атомов, добывают различные каучуки специального назначения (например, фторопреновые и хлоропреновые каучуки). В частности, хлоропреновый каучук — негорючий, свето- и термостойкий, благодаря чему он является незаменимым материалом в самолётостроении.
Перечень резиновых изделий на основе синтетических каучуков насчитывает около 50 тысяч наименований. Больше всего синтетических каучуков использует машиностроительная промышленность. Из синтетических каучуков изготавливают технические изделия, резиновую обувь, прорезиненные ткани, бытовые резиновые изделия, медицинские товары и т. п. (рис. 71). Каучуки и резина

имеют высокие диэлектрические свойства, поэтому в электротехнике они незаменимы как изоляция проводов и оболочки кабеля, для изготовления защитных перчаток и ковриков. Каучуки являются компонентами клеев, антикоррозионных материалов, связующим веществом при изготовлении твёрдого ракетного топлива.
Ознакомьтесь с образцами каучуков, выполняя лабораторный опыт 6.
Каучук и резина являются основными материалами, выпускаемыми шинной и резиново-асбестовой отраслями промышленности. Самые мощные предприятия расположены в Днепропетровске, Белой Церкви, Запорожье, Киеве, Лисичанске, Горловке, Одессе, Сумах, Харькове.
Наполнитель резины — сажу — производят в Дашаве, Стаханове, Кременчуге.
Ещё один способ получения каучуков — кополимеризация.
Кополимеризация — процесс совместной полимеризации двух или более мономеров.
Примером кополимеризации является получение бутадиен-стиренового каучука. Название указывает, что для получения этого полимера используют два мономера: бута-1,3-диен и старен. Схематически кополимеризацию бута-1,3-диена со стиреном можно записать так:
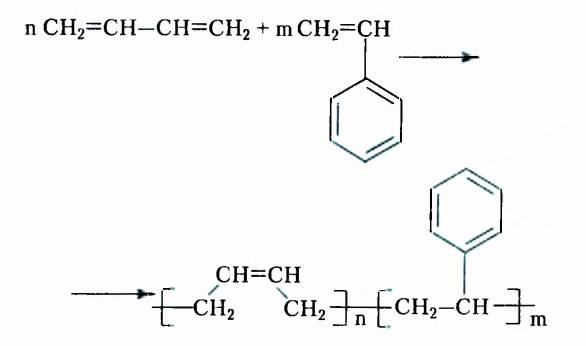
Бутадиен-стиреновый каучук легко вулканизируется, хорошо смешивается с наполнителями и другими каучуками. Как каучук общего назначения, его широко применяют для изготовления протекторов и других деталей автомобильных и велосипедных шин, резиновой обуви, а также в радиотехнической промышленности. В настоящее время он занимает первое место по объёмам производства среди всех каучуков (около 50 % общего выпуска).
Волокна. Искусственные и синтетические волокна
Природный полимер целлюлоза 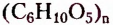 является продуктом поликонденсации глюкозы. Реакцию отображает схема
является продуктом поликонденсации глюкозы. Реакцию отображает схема
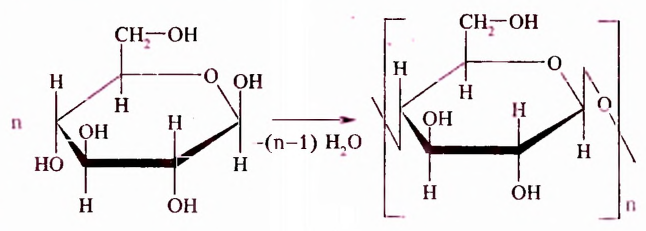
Каждое структурное звено целлюлозы имеет циклическое строение и содержит три гидроксильные группы -ОН:
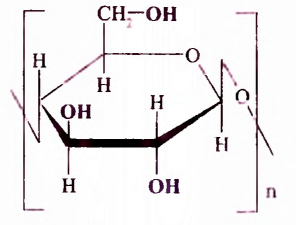
Чтобы подчеркнуть это, молекулярную формулу целлюлозы можно записать так: 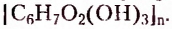 За счёт гидроксильных групп целлюлоза вступает в реакцию эстерификации — взаимодействует с оксигено-содержащими кислотами, вследствие чего образуются эстеры (сложные зфиры).
За счёт гидроксильных групп целлюлоза вступает в реакцию эстерификации — взаимодействует с оксигено-содержащими кислотами, вследствие чего образуются эстеры (сложные зфиры).
Целлюлоза обусловливает механическую прочность и эластичность растительных тканей. В древесине её содержание составляет 40-55 %, в волокнах хлопчатника, расположенных вокруг семян, 90-98 %, в волокнах льна и конопли — 60-85 %.
Аминокислоты — это органические кислоты, молекулы которых содержат одну или несколько аминогрупп  Положение аминогруппы относительно карбоксильной обозначают буквами греческого алфавита
Положение аминогруппы относительно карбоксильной обозначают буквами греческого алфавита  и т. д., например
и т. д., например  -аминомасляная кислота по современной систематической номенклатуре — 3-аминобутановая кислота:
-аминомасляная кислота по современной систематической номенклатуре — 3-аминобутановая кислота:
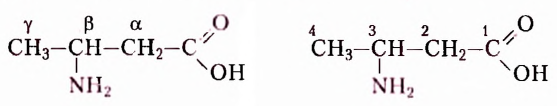
Природные полимеры белки — продукт поликонденсации  -аминокислот. В приведённой схеме показано взаимодействие трёх молекул
-аминокислот. В приведённой схеме показано взаимодействие трёх молекул  -аминокислот и выделены группы атомов, за счёт которых структурные звенья белковой молекулы соединены между собой:
-аминокислот и выделены группы атомов, за счёт которых структурные звенья белковой молекулы соединены между собой:
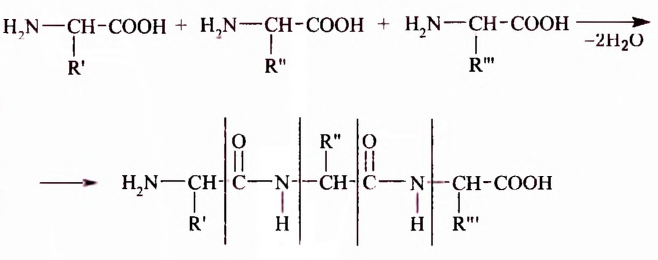
Группу атомов 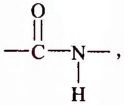 с помощью которой соединены остатки молекул аминокислот, называют пептидной связью. В случае получения синтетических соединений из аминокислот эту связь называют амидной.
с помощью которой соединены остатки молекул аминокислот, называют пептидной связью. В случае получения синтетических соединений из аминокислот эту связь называют амидной.
Из белковых молекул состоят натуральный шёлк и шерсть — тонкая длинная шерсть животных (овец, коз, верблюдов), из которой изготавливают пряжу, а из неё — шерстяную ткань.
Волокна — это материалы, состоящие из длинных и гонких нитей или отрезков нитей, пригодных для изготовления пряжи и тканей. По происхождению их разделяют на натуральные (природные) и химические. Натуральные волокна изготавливают из природного сырья. Люди издавна использовали природные волокнистые материалы для изготовления одежды и различных предметов домашнего обихода, парусов и т.п. В качестве сырья использовали выращенные летом, а затем вымоченные в воде и отделённые от кострицы (непригодной для прядения части растительного стебля) коноплю и лён. В настоящее время из материалов растительного происхождения на фабриках изготавливают льняные и хлопчатобумажные ткани, из шерсти животных — шерстяные ткани, из коконов тутового шелкопряда - натуральный шёлк.
Со второй половины XIX в. спрос на ткани значительно возрос, а произведённых натуральных волокон не хватало. Поэтому возникла необходимость в получении волокон химическим способом. Учёные использовали знания о составе и строении природных полимеров — целлюлозы и белка, из которых образованы натуральные волокна хлопка и шерсти.

Классификация волокон: Среди натуральных волокон различают волокна растительного, животного и минерального происхождения. Классификацию химических волокон осуществляют в зависимости от происхождения сырья, из которого их производят. Если сырьём для производства химического волокна является природный полимер, волокно называют искусственным. Если же сырьём являются продукты органического синтеза, то и волокно называют синтетическим.
Для производства химических волокон пригодны полимеры с длинными, линейными или слегка разветвлёнными макромолекулами, имеющие достаточно большие молекулярные массы и способные или плавиться без разложения, или растворяться в доступных растворителях. Современная лёгкая промышленность производит большое количество сортов тканей из натуральных, химических и комбинированных волокон. Каждый из них имеет как преимущества, так и недостатки. Поэтому огульно говорить о волокне, из которого изготовлена ткань, что оно плохое или хорошее, нельзя. Поскольку одно и то же волокно может быть непригодным для одних целей и незаменимым для других.
Ознакомьтесь с классификацией волокон, воспользовавшись рисунком 72.
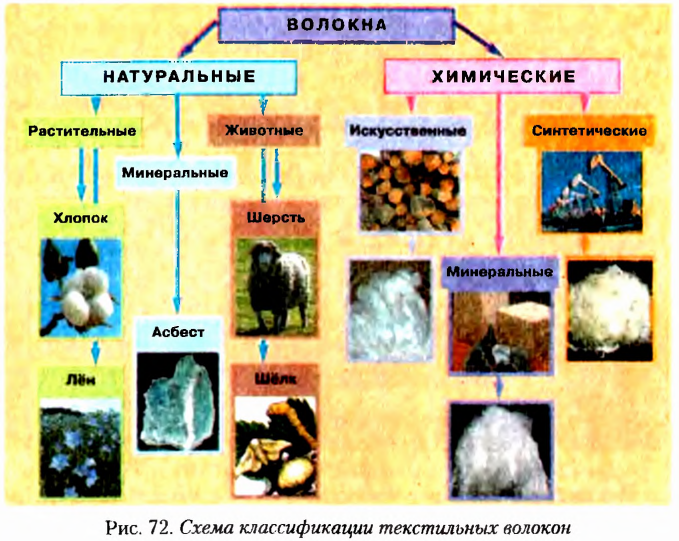
Успехи учёных и технологов в создании волокон неоспоримы. Так, сейчас изготавливают сверхпрочные, термостойкие, хемостойкие, эластичные, негорючие и многие другие виды волокон.
Искусственные волокна: К искусственным волокнам относятся волокна, изготовленные химической обработкой природного сырья целлюлозного и белкового происхождения. Сначала готовят прядильный раствор, так как для изготовления химических волокон необходимо, чтобы молекулы сырья были подвижны. Только при таких условиях их можно расположить вдоль оси образуемого волокна и сформировать нить.
Сделать твёрдое вещество подвижным можно двумя способами: нагреть его выше температуры плавления или рас творить. Первый способ для целлюлозы непригоден, поскольку от нагревания она разрушается. Поэтому остановились на втором. Природный полимер целлюлозу обрабатывают определённым веществом, а полученные продукты реакции растворяют в соответствующих растворителях. Образовавшуюся однородную жидкую смесь по специальным технологиям превращают в волокна. К примеру, диацетаг целлюлозы 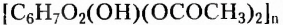 и триацетат целлюлозы
и триацетат целлюлозы 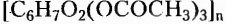 — эстеры целлюлозы и этановой (другие названия — ацетатная, уксусная) кислоты — растворяют в смеси дихлорометана
— эстеры целлюлозы и этановой (другие названия — ацетатная, уксусная) кислоты — растворяют в смеси дихлорометана 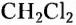 и этанола
и этанола 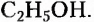 Чтобы изготовить из такой гомогенной жидкой массы волокно, её продавливают сквозь тоненькие отверстия. Струи раствора опускаются вниз, а навстречу им подаётся нагретый воздух. При таких условиях дихлорометан и этанол испаряются, а диацетат целлюлозы и триацетат целлюлозы образуют волоконца, которые затем скручивают в нити.
Чтобы изготовить из такой гомогенной жидкой массы волокно, её продавливают сквозь тоненькие отверстия. Струи раствора опускаются вниз, а навстречу им подаётся нагретый воздух. При таких условиях дихлорометан и этанол испаряются, а диацетат целлюлозы и триацетат целлюлозы образуют волоконца, которые затем скручивают в нити.
Какие процессы в производстве этого искусственного волокна относятся к химическим явлениям, а какие — к физическим?
Изготовленное из ацетатов целлюлозы ацетатное волокно (ацетатный шёлк) устойчиво, имеет низкую теплопроводность, поэтому хорошо сохраняет тепло, мягкое, мало мнётся, почти не «садится» от стирки, имеет приятный блеск. При всём том ацетатное и другие химические волокна, обладая многими ценными свойствами, уступают натуральным волокнам по гигиеническим характеристикам.
Для того чтобы получить другое искусственное волокно — вискозное, целлюлозу обрабатывают раствором щёлочи и сероуглеродом  Из полученной густой вязкой массы удаляют растворители и формируют волокно с упорядоченным расположением молекул целлюлозы. Вискозное волокно во многом сходно с натуральными волокнами льном и хлопком. У него шелковистый блеск, ткань из вискозного волокна приятна на ощупь, мягкая, гигроскопичная, легко и равномерно окрашивается. Сквозь неё хорошо проникает воздух, в одежде из такой ткани тело «дышит», что в жару создаёт ощущение прохлады. Благодаря перечисленным свойствам вискозное волокно завоевало широкую популярность и используется в больших количествах. Более тонкое, чем шёлк, вискозное микроволокно под названием микромодал внешне походит на натуральный шёлк, бархатистое, мягкое и очень лёгкое. Чаще всего это волокно используют для изготовления носков и колготок.
Из полученной густой вязкой массы удаляют растворители и формируют волокно с упорядоченным расположением молекул целлюлозы. Вискозное волокно во многом сходно с натуральными волокнами льном и хлопком. У него шелковистый блеск, ткань из вискозного волокна приятна на ощупь, мягкая, гигроскопичная, легко и равномерно окрашивается. Сквозь неё хорошо проникает воздух, в одежде из такой ткани тело «дышит», что в жару создаёт ощущение прохлады. Благодаря перечисленным свойствам вискозное волокно завоевало широкую популярность и используется в больших количествах. Более тонкое, чем шёлк, вискозное микроволокно под названием микромодал внешне походит на натуральный шёлк, бархатистое, мягкое и очень лёгкое. Чаще всего это волокно используют для изготовления носков и колготок.
К искусственным волокнам, изготовленным на основе целлюлозы, относится и медноаммиачное волокно, применяемое в производстве ковров, технических тканей и трикотажных изделий.
Ценным в производстве химических волокон является то, что в процессе их изготовления можно изменять свойства волокна, а значит, из одного волокнообразующего полимера получать широкий ассортимент изделий, улучшать их внешний вид (рис. 73).
Впервые производство искусственного волокна было начато в конце XIX в В качестве сырья использовали эстер целлюлозы и нитратной кислоты. За прошедшие годы усовершенствовалась технология производства, были созданы основные виды искусственных волокон.
Искусственные волокна получают переработкой природных полимеров, в основном целлюлозы, химическим способом. Они намного дешевле натуральных, их износостойкость больше. Примерами волокон этой фуппы являются вискозное волокно, ацетатный шёлк, медноаммиачное волокно.

Синтетические волокна: Химические волокна, которые формируют из синтетических полимеров, то есть в их производстве натуральное (природное) сырьё не используется, называют синтетическими.
Хотя производство синтетических волокон началось позже, чем производство искусственных, — в 60-е годы XX в., однако в настоящее время оно растёт значительно быстрее по сравнению с производством искусственных волокон. Объясняется это доступностью относительно дешёвого сырья, спросом на синтетические волокна, обусловленным их ценными свойствами.
В качестве сырья для производства синтетических волокон используют продукты переработки нефти, каменного угля, природного газа. Из них сначала добывают полимер, который затем превращают в волокно (подобно тому, как это происходит при производстве искусственных волокон), а термопластичные полимеры просто расплавляют.
В искусственных волокнах основу составляет природный полимер, тогда как синтетические волокна изготавливают только из продуктов переработки углеводородного сырья, которые химическая промышленность производит в больших количествах.
Ныне популярны такие химические волокна, как полипропиленовое, поливинилхлоридное и полиуретановое волокна, капрон, полиэстер, акрил, эластан и т. д. Их производство из года в год растёт, поскольку они практичны в не комфортных условиях, лёгкие, прочные, долговечные, быстро сохнут, слабо мнутся. Поэтому многие синтетические волокна («синтетика») используются в производстве модной одежды, спортивной одежды и обуви, спецодежды, необходимой для безопасного пребывания в экстремальных условиях, а также других товаров. Рассмотрим конкретные примеры синтетических волокон.
Полипропиленовое волокно (на этикетках изделий часто обозначается РР) — синтетическое волокно, изготовленное из расплава полипропилена. Все те свойства полипропилена, которые рассматривались в § 14, характерны и для этого синтетического волокна. Оно также устойчиво к действию отбеливателей, кислот и органических растворителей, его не портят плесень, бактерии и насекомые. Спецодежда, ковры, одеяла, ткани для верхней одежды - это лишь некоторые примеры применения этого волокна.
Полиэстер, или полиэфир (РЕ), в частности лавсан, - волокно, сформированное из продукта поликонденсации двухатомного насыщенного спирта этиленгликоля и терефталевой кислоты.
Из него изготавливают искусственный мех и ковры. Довольно широко используется в производстве комбинированных тканей, в составе которых могут быть шерсть, хлопок, лён. Из таких тканей шьют верхнюю одежду — костюмы, пальто, рубашки, платья, а также гардинно-тюлевые изделия.
Поливинилхлоридное волокно формируют из раствора поливинилхлорида. Рассматривая несколько ранее полимеры, мы отмечали такое свойство поливинилхлорида, как негорючесть. Это же свойство присуще и волокну, которое вам приходилось не раз видеть, поскольку изготовленными из него тканями обиты сидения автомобилей, самолётов, современных электричек и т. д.
Эластан (полиуретановое волокно), или спандекс, формируют из растворов и расплавов полиуретана. Основное свойство этого волокна, как и каучуков, — эластичность. Спандекс добавляют ко многим видам других натуральных и искусственных тканей для того, чтобы они хорошо облегали фигуру, длительное время сохраняли форму, не сковывали движений, были лёгкими и удобными. Добавки эластана содержатся в такой одежде, как спортивные костюмы, блузки, рубашки, брюки, купальные костюмы. Недостаток этого волокна заключается в чувствительности к действию света и быстрому потускнению.
Капрон (найлон-6) — синтетический полимер, структурными звеньями которого являются остатки е-аминокапроновой кислоты, соединённые амидными связями. Химическое строение этой аминокислоты таково, что функциональные группы  и -СООН расположены у крайних атомов Карбона:
и -СООН расположены у крайних атомов Карбона: 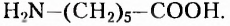 Это делает возможным протекание реакции поликонденсации по схеме
Это делает возможным протекание реакции поликонденсации по схеме
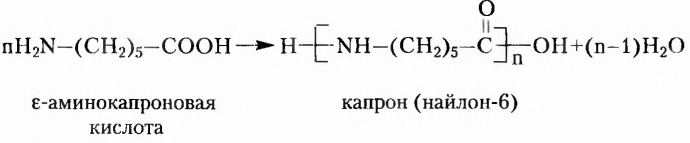
Как видим, при создании капрона прототипом послужили природные полимеры — белки.
Капроновое волокно и некоторые другие (найлон-6,6, или анид, и т.п.) образованы за счёт амидных связей, а потому получили название полиамидные волокна. Среди природных волокон аналогично образованы волокна шерсти и шёлка.
Капрон — твёрдое вещество белого цвета, устойчивое к действию большинства растворителей. При температуре 210 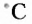 оно размягчается. Из расплава капрона можно легко вытягивать нити даже в лабораторных условиях.
оно размягчается. Из расплава капрона можно легко вытягивать нити даже в лабораторных условиях.
Проведём демонстрационный опыт. Расплавим в фарфоровой чашке капрон, стеклянной палочкой подхватим каплю расплава и начнём вытягивать из него нить, прикрепив её к другой палочке и прокручивая, как показано на рисунке 74.

Капроновое волокно эластичное, очень прочное, устойчивое к истиранию и множественным перегибам, из него делают канаты. Это волокно негигроскопично. Рыбакам такие свойства капрона хорошо известны, поскольку из капроновых волокон изготавливают рыболовные сети, леску. Много капрона перерабатывают в комбинированные волокна, из которых изготавливают спортивные костюмы, чулки, носки и т.д. Однако капрон имеет и нежелательные свойства — он неустойчив к нагреванию, действию кислот и щелочей. Из-за отсутствия гигроскопичности капрон неудобен для тела.
Выяснить отношение волокон различных видов к нагреванию и концентрированным растворам кислот и щёлочей поможет демонстрационный опыт. Небольшие образны волокон (рис. 75) — хлопка (1), шёлка натурального (2), вискозного (3), капронового (4) и полиэстерного (лавсана) (5) — поместим каждое в две пробирки каждое (рис. 76а,б).

Не нарушая порядка расположения волокон в пробирках, по очерёдно проверим, как на них действуют концентрированные растворы нитратной кислоты (рис. 76а) и натрий гидроксида (рис. 766).
Результаты опыта свидетельствуют, что устойчивым к действию нитратной кислоты является полиэстерное волокно, а к действию щёлочи — хлопок, капрон и лавсан.
Определить, какую основу — синтетическую или натуральную — имеет волокно, можно ещё по его отношению к нагреванию и по характеру горения. Целлюлозные волокна (хлопок, ацетатное, вискозное) вспыхивают быстро и сгорают, распространяя запах жжёной бумаги. Комочек, который остаётся после их сгорания, легко растирается пальцами. Белковые волокна (шерсть, шёлк) сгорают аналогично целлюлозным, распространяя запах жжёного пера. Синтетические полиамидные волокна (например, капрон) сначала плавятся, а затем сгорают, распространяя резкий мышиный запах. Полиэстерные волокна (в частности, лавсан) плавятся и быстро сгорают. После прекращения горения синтетических волокон остаётся нехрупкий комочек, который пальцами не растирается.
Чтобы подробнее ознакомиться со свойствами волокон, выполните лабораторный опыт 7. Он поможет вам усвоить новый материал.
Органические соединения в быту
В быту практически ежедневно человек имеет дело с продуктами химической промышленности. Действительно, как можно обойтись без них при стирке белья, мытье посуды, уходе за мебелью, умывании, чистке зубов, мелком ремонте дома и т.д.? Все используемые при этом средства получили название бытовые химикаты, а отрасль промышленности, что их производит, — бытовая химия.
Бытовые химикаты — это отдельные химические вещества, а чаще смеси веществ, которые используются в быту с определённым назначением. Повседневную жизнь современного человека невозможно представить
без систематического использования достаточно большого количества бытовых химикатов различного назначения.
В зависимости от назначения бытовые химикаты разделяют на группы, которых сейчас насчитывается около 20. Основными среди них являются: моющие и дезинфицирующие средства, средства личной гигиены, средства для чистки, ухода за жильём и предметами обихода, садом и огородом, автомобильным транспортом и т.д. К продукции бытовых химикатов относятся также клеи, аоразивные материалы, лакокрасочные средства, парфюмерия и косметика. Ежегодно в мире производится около 30 млн т средств бытовой химии.
Рассмотрите схему, приведённую на рис. 78 (см. с. 180). которая ознакомит вас с разнообразием продукции бытовой химии. Какими из них пользуется ваша семья?
Современные высокоэффективные средства бытовой химии это полезные достижения человечества. Они помогают нам в повседневной жизни и довольно безопасны для здоровья при правильном их использовании. Разработка современных средств бытовой химии происходит в направлении совершенствования их гигиенических и физико-химических показателей с целью соответствия требованиям безопасного использования потребителями.
Примеры бытовых химикатов: Возможно, самое широкое бытовое применение получили моющие средства — стиральные порошки, твёрдое и жидкое мыло. Чистая вода удаляет с загрязнённой поверхности лишь те вещества, которые в ней хорошо растворимы. Однако многие органические загрязнения вола не смывает, удалить их помогает добавление к воде моющих средств.
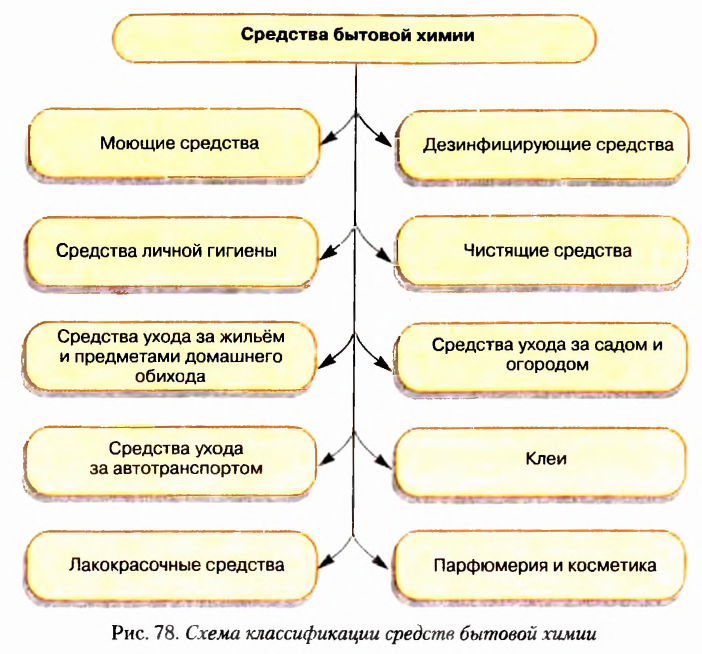
Каждая хозяйка знает, что жирная посуда плохо моется даже в горячей воде. Но достаточно использовать небольшую каплю одного из многочисленных ныне бытовых химикатов, например жидкости для мытья посуды «Гала», которую производят в г. Днепродзержинске Днепропетровской области, и посуда приобретёт сияющую чистоту. Надо заметить, что при работе с бытовыми химикатами их прямое контактирование с кожей рук в основном является нежелательным. Поскольку могут иметь место раздражение в виде покраснений, ощущение зуда и т. п. Поэтому работать надо в защитных перчатках или пользоваться разного рода щётками. Подробнее ознакомиться со свойствами моющих средств вы сможете в § 18.
Рассмотрим примеры и краткие характеристики бытовых химикатов других групп.
Дезодоранты для помещений, поглотители запахов стали привычными в наших собственных домах, не говоря уже о местах общего пользования. Широкое применение получили дезодоранты для тела.
Ухаживать за обувью, другими изделиями из кожи и кожезаменителей нам помогают кремы для обуви и кожаной одежды.
Многие волокна способны электризоваться, то есть накапливать электрические заряды. Эта способность присуща таким волокнам, как нитрон, лавсан, ацетатное волокно, а также капрон, частично шерсть и шёлк. Для предотвращения электризации изделий из синтетических тканей следует пользоваться антистатиками. Интересно, что льняные и хлопчатобумажные ткани поглощают влагу, это способствует стеканию электрических зарядов, вследствие чего эти ткани не электризуются.
В бытовых химикатах для чистки посуды, раковин, газовых плит и кафеля содержатся твёрдые инертные вещества — абразивы, облегчающие механическое разрушение твёрдых загрязнений, и дезинфицирующие компоненты. В частности, по надписи на этикетке средства «Тест» узнаём, что в качестве абразива в нём использован порошок доломита 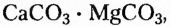 а как обеззараживающее вещество — хлоринол. Вообще Хлор является тем химическим элементом, атомы которого входят в состав многих дезинфицирующих средств. Среди бытовых химикатов этой группы выделяют средства мягкой дезинфекции, применяемые для обеззараживания кожи, одежды, белья, и средства сильной дезинфекции, предназначенные для чистки и обеззараживания обуви, туалетов, раковин, ванн,а также средства для дезинфекции помещений. Это такие средства, как «Белизна», «Доместос», «Мистер Мускул» и др. (рис. 79).
а как обеззараживающее вещество — хлоринол. Вообще Хлор является тем химическим элементом, атомы которого входят в состав многих дезинфицирующих средств. Среди бытовых химикатов этой группы выделяют средства мягкой дезинфекции, применяемые для обеззараживания кожи, одежды, белья, и средства сильной дезинфекции, предназначенные для чистки и обеззараживания обуви, туалетов, раковин, ванн,а также средства для дезинфекции помещений. Это такие средства, как «Белизна», «Доместос», «Мистер Мускул» и др. (рис. 79).

Отметим, что универсального дезинфицирующего средства нет.
Общим для всех обеззараживающих средств является их быстрое и полное растворение в воде или образование устойчивых эмульсий, эффективное действие, длительное хранение, малая токсичность для людей.
Разнообразие кондиционеров, антистатиков, ополаскивателей для тканей (рис. 80), шампуней, бальзамов для тела и т.п. не оставит равнодушной ни одну хозяйку.

Чтобы приклеить обои, отремонтировать лыжи или обувь, склеить разбитый предмет, провести мелкий ремонт мебели, мы обязательно воспользуемся клеем.
Клеи - это полимеры или соединения на их основе, которые применяют как бытовые химикаты для соединения различных материалов.
По-настоящему универсальною клея нет (хотя клей с таким названием и существует). Поэтому условно универсальными считают тс из них, которыми можно склеивать несколько различных материалов. Для склеивания бумаги рекомендуют пользоваться клеями «Силикатный», «Аго», «Марс», «Резиновый», «Момент-1», «Синтетический для бумаги». Для ремонта мебели и выполнения столярных работ применяют поливинилацетатные клеи «ПВА», «ПВА-М», а также «Синтетический столярный», для склеивания металлов — «Эпоксидный универсальный».
К группе лучших клеев, смол и лаков относятся эпоксидные — им свойственна высокая клеевая способность по отношению к стеклу, фарфору, металлам, пластмассам, дереву и очень высокая прочность склеивания. В быту широко используют клеи типа БФ, БФ-2, БФ-5, изготовленные на основе фенолформальдегидных смол.
Действие клеев основывается на их способности взаимодействовать с поверхностями склеиваемых материалов. Прочность сцепления клеем двух поверхностей определяется силами межмолекулярного взаимодействия (электростатическими силами) или химическими силами, которые приводят к образованию химической связи. В состав клея входят полимеры (клеевые вещества), растворители, наполнители, пластификаторы и т. п. Безопасность клея зависит от свойств всех его компонентов. Химическая промышленность выпускает большой ассортимент клеев.
Краски, лаки, малярные грунтовки и шпаклёвки — это ещё одна отдельная группа бытовых химикатов.
Самой прибыльной отраслью является парфюмерно-косметическая промышленность, продукция которой также принадлежит к бытовым химикатам.
Парфюмерные средства — средства, которые при применении выполняют гигиенические и эстетические функции.
Косметические средства — средства, применяемые для ухода за кожей, волосами, полостью рта, то есть они выполняют
гигиенические, профилактические и эстетические функции.
Надо отметить, что косметика (косметические средства) тесно связана с гигиеной, поскольку многие косметические средства (лосьоны, кремы, шампуни) выполняют и косметическую, и гигиеническую функции.
До недавнего времени для чистки зубов широко применяли зубные порошки, состоящие из абразивного материала: чаще всего это очищенный мел, где абразивом является кальций карбонат 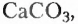 реже — кальций гидрогенортофосфат
реже — кальций гидрогенортофосфат 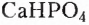 или смеси этих веществ. К абразивным материалам для придания порошкам лёгкости и рыхлости добавляют магний оксид MgO, полученный прокаливанием
или смеси этих веществ. К абразивным материалам для придания порошкам лёгкости и рыхлости добавляют магний оксид MgO, полученный прокаливанием 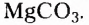 В некоторые сорта порошков вводят магний пероксид, имеющий отбеливающие свойства, в небольших количествах включают поверхностно-активные вещества, а также душистые вещества, обычно это ментол или экстракт мяты.
В некоторые сорта порошков вводят магний пероксид, имеющий отбеливающие свойства, в небольших количествах включают поверхностно-активные вещества, а также душистые вещества, обычно это ментол или экстракт мяты.
В настоящее время на смену зубному порошку приходят разнообразнейшие зубные пасты, которые в соответствии с назначением разделяют на гигиенические и лечебно-профилактические. Первые только очищают и освежают полость рта, а вторые обладают лечебным действием и используются для профилактики заболеваний зубов.
Немало продукции бытовой химии выпускают в аэрозольной упаковке. В качестве веществ, создающих давление в аэрозольных баллонах, оказались удобными фреоны — группа галогеносодержащих веществ: кипящие при невысоких температурах, летучие, инертные, безвредные для организма человека. Фреоны также используют в промышленных и бытовых холодильниках как хладагенты. Одним из таких веществ является дифлуородихлорометан 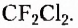
Будучи неядовитыми и достаточно инертными у поверхности Земли, в верхних слоях атмосферы, граничащих с озоновым слоем, фреоны подвергаются фотохимическому разложению с выделением анионов Хлора, под влиянием которых разрушается озоновый слой, а он, как вам уже известно из природоведения и химии, играет чрезвычайно важную роль в сохранении жизни на Земле. Это своеобразный фильтр, который задерживает вредное ультрафиолетовое излучение Солнца. Поэтому на уровне международного соглашения принято решение о сокращении производства аэрозольных баллонов, содержащих фреоны, холодильников с хладагентами фреонами.
Приведённый далеко не полный перечень бытовых химикатов, рассмотренные примеры убеждают в чрезвычайном разнообразии веществ, которые человек использует в повседневной жизни с пользой для себя. Они имеют много ценных физических и химических свойств, однако зачастую оказывают негативное влияние на природу. Об этом надо всегда помнить и быть осторожными и рассудительными в обращении с ними.
Каждое средство бытовой химии имеет маркировку, этикетки с информацией о названии изделия, массе или ёмкости, сроке годности, назначении и способе применения, условиях хранения, а также предупреждающие надписи и меры предосторожности, наименование предприятия-производителя, его местонахождение, товарный знак, дату изготовления и т. д. Безусловно, вам известно, что среди бытовых химикатов немало ядовитых или oiнеопасных. На них есть предупреждающие надписи и знаки, например «Яд», «Огнеопасно», «Беречь от огня», «Не распылять вблизи открытого огня», «Беречь от попадания в глаза» и т.п., а также информация о правилах и условиях безопасного их использования.
Краски имеют дополнительные маркировочные данные, марка, цвет, расход на 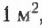 , правила обращения с товаром, вид растворителя.
, правила обращения с товаром, вид растворителя.
Из приведённой на этикетках, упаковке или в инструкции информации о бытовом химикате становится известно, содержит ли он ядовитые вещества, кислоты и щёлочи, под влиянием которых нарушается прочность тканей, может ли вызвать ожоги и т. д.
Среди имеющихся в вашем доме бытовых химикатов найдите средства с разного рода предупреждающими надписями. Проанализируйте, насколько тщательно вы их придерживаетесь.
Выполните лабораторный опыт 8 и возьмите себе за правило быть всегда внимательными при работе с бытовыми химикатами.
Общие правила обращения с бытовыми химикатами: Необходимо осознавать, что все предметы бытовой химии действуют эффективно только в определённых условиях, которые всегда указаны в инструкции. Каждый бытовой химикат имеет конкретные, присущие только ему свойства, и от этого зависят последствия обращения с ним. Однако есть и общие правила (см. рубрику «Полезно и интересно»), которых следует придерживаться при использовании химикатов в быту.
Любое средство, если его употреблять не по назначению или в избыточном количестве, может быть вредным для здоровья человека. Если же его использовать в соответствии с целевым назначением, согласно инструкции, то оно будет вполне безопасным и безвредным.
Перед тем, как воспользоваться любым бытовым химикатом, необходимо внимательно ознакомиться с инструкцией, поскольку небрежное отношение
к приведенным в них рекомендациям и предостережениям представляет- опасность для здоровья.
Мыло и синтетические моющие средства
Имеющиеся в природной воде соли Кальция и Магния обусловливают её жёсткость. В жёсткой воде плохо развариваются овощи, трудно стирать вещи мылом.
Временная жёсткость воды — это жёсткость, обусловленная кальций гидрогенкарбонатом 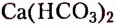 и магний гидрогенкарбонатом
и магний гидрогенкарбонатом 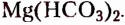 Устранить её можно обычным кипячением или химическим способом.
Устранить её можно обычным кипячением или химическим способом.
Постоянную жёсткость обусловливают хлориды и сульфаты Кальция и Магния. В отличие от временной жёсткости, её можно устранить лишь химическим способом.
При производстве мыла жиры подвергают гидролизу, нагревая в присутствии щёлочи. Продуктами этой реакции являются глицерол и натриевые или калиевые соли высших карбоновых кислот. Например:
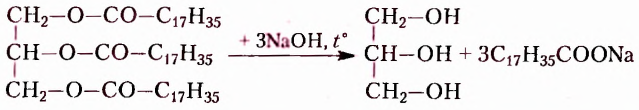
Вещества, загрязняющие тело, одежду и другие вещи, достаточно разнообразны по составу и строению. Вместе с тем они малорастворимы или нерастворимы в воде, а следовательно, вода не может справиться с большинством загрязнений, имеющих место в повседневной жизни. Чтобы избавиться от таких загрязнений, нужны бытовые химикаты из группы моющих средств. В быту широкое применение получили такие средства, как мыло, стиральные порошки, жидкости для мытья посуды, шампуни и т. д.
Понятие о мыле и его моющем действии: Трудно поверить, но до изобретения мыла жир и грязь с кожи удаляли только водой, золой и мелким речным песком. А в наше время мыло — самое распространённое, эффективное и надёжное моющее средство. Если два раза подряд помыть руки с мылом, никаких дезинфицирующих средств не потребуется. Мыло применяют при обработке тканей, в производстве косметики, водоэмульсионных красок и т. п.
Основные вещества мыла — это растворимые в воде соли Натрия и Калия высших карбоновых кислот, углеводородный заместитель которых содержит от 11 до 17 атомов Канона, например натрий стеарат 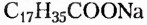 и калий пальмиат
и калий пальмиат 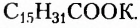 Их добывают в процессе гидролиза жиров (уравнение реакции приведено в информационной справке) или синтетическим способом из продуктов переработки нефти. Добавками в мыле являются красители, ароматизаторы, антисептические вещества, увлажняющие вещества (глицерол, касторовое масло), наполнители (оксиды Титана и Цинка).
Их добывают в процессе гидролиза жиров (уравнение реакции приведено в информационной справке) или синтетическим способом из продуктов переработки нефти. Добавками в мыле являются красители, ароматизаторы, антисептические вещества, увлажняющие вещества (глицерол, касторовое масло), наполнители (оксиды Титана и Цинка).
Мыло — предназначенный для мытья и стирки бытовой химикат, в состав которого входят соли Натрия и Калия
высших карбоновых кислот, углеводородные заместители которых содержат от 11 до 17 а,томов Карбона, а также различные добавки.
Такие свойства мыла, как твёрдость, растворимость в воде, способность к пенообразованию, моющее действие, зависят от того, соли каких высших карбоновых кислот преобладают в его составе.
В частности, соли пальмитиновой кислоты придают мылу твёрдость и высокое пенообразование, олеиновой — растворимость в холодной воде и моющую способность, стеариновой — усиливают действие мыла в горячей воде. Высококачественные сорта мыла изготавливают с добавлением солей лауриновой кислоты 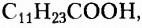 содержащейся в кокосовом масле.
содержащейся в кокосовом масле.
Моющее действие мыла объясняется особым строением солей, входящих в его состав (рис. 82).
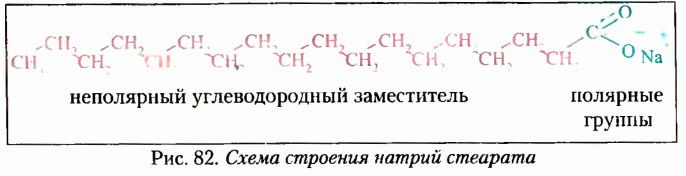
В строении натрий стеарата различают две части: первая (на рис. 82 выделена красным цветом) образована углеводородным заместителем, она неполярная и не смачивается водой, вторая (на рис. 82 выделена синим цветом) — полярная, поскольку в ней ион натрия 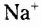 заряжен положительно, a ipynna атомов -СОО — отрицательно. Полярное строение этой части обеспечивает ей смачивание водой. Благодаря такому строению мыло способно «оторвать» частички грязи, не смачивающиеся водой, от поверхности ткани, посуды или кожи рук и удерживать их в растворе.
заряжен положительно, a ipynna атомов -СОО — отрицательно. Полярное строение этой части обеспечивает ей смачивание водой. Благодаря такому строению мыло способно «оторвать» частички грязи, не смачивающиеся водой, от поверхности ткани, посуды или кожи рук и удерживать их в растворе.
История создания и производства мыла: Исторические источники указывают, что в Вавилоне мыло производили приблизительно в 2800 г. до н. э. Как вы понимаете, это не было массовым производством. Вообще до XIV в. мыло имело ранг лекарственного средства, которое можно было приобрести только в аптеке. Впервые промышленным способом начали изготавливать мыло в 1424 г. в Севоне (Италия).
Животные жиры недешёвое сырьё мыловаренной промышленности. Синтетические жирные кислоты, то есть продукты органического синтеза, значительно дешевле, поскольку сырьём для их получения являются парафины нефти, которые подвергают каталитическому окислению кислородом воздуха.
Учитывая, что в состав мыла входят натриевые или калиевые соли высших карбоновых кислот, напишите одно из уравнений превращения соответствующего парафина в мыло.
В соответствии с назначением различают сорта хозяйственного и туалетного мыла (рис. 83).

Отличие состоит в происхождении сырья. В хозяйственном мыле почти половина солей добыта из продуктов переработки нефти, тогда как в туалетном мыле преобладают соли, полученные из натурального сырья — жиров. Не случайно мыловаренные заводы являются «соседями» нефтеперерабатывающих предприятий и жирокомбинатов.
К бытовым химикатам относятся и моющие средства для детей. Поинтересуйтесь, в чём заключается особенность их состава по сравнению с обычным туалетным мылом.
Почему мыло не используют для стирки в жёсткой воде: Основным недостатком мыла является то, что его моющее действие резко ухудшается в жёсткой воде. При стирке в такой воде мыла расходуется на 20-30 % больше, чем при стирке в мягкой воде. А всё потому, что катионы Кальция и Магния, которые обуславливают жёсткость воды, образуют с анионами высших карбоновых кислот, входящих в состав мыла, нерастворимые соли. Поэтому при стирке белья в жёсткой воде протекают реакции, завершающиеся образованием осадков:
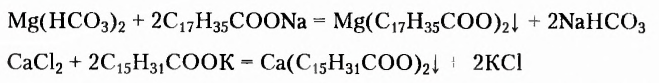
Полученные нерастворимые соли оседают на ткани, забивая в ней поры, делают её грубой, менее эластичной, с плохой воздухо- и влагопроницаемостью. У ткани появляется сероватый оттенок, краски тускнеют, прочность снижается, ткань быстрее рвётся.
Указанных нежелательных последствий можно избежать, если вместо мыла использовать синтетические моющие средства.
Понятие о синтетических моющих средствах (CMC). По сравнению с мылом CMC — это моющие средства нового поколения, достижение химиков и технологов XX в. Их производство основано на использовании дешёвого сырья, каким являются продукты переработки нефти и газа.
Основу CMC составляют органические соединения, имеющие сходное с мылом строение, но в отличие от него не образуют малорастворимых или нерастворимых в воде солей Кальция и Магния. Такие средства одинаково хорошо моют и стирают как в мягкой, так и в жёсткой воде. Некоторые средства пригодны даже для стирки в морской воде. Интересно, что CMC действуют не только в горячей воде, как это характерно для хозяйственного мыла, но и в воде низкой температуры, что важно при стирке тканей из искусственных и синтетических волокон.
Преимуществом синтетических моющих средств по сравнению с обычным мылом является то,что они не теряют своих моющих свойств в жёсткой воде.
Для достижения одинакового моющего результата синтетических моющих средств надо значительно меньше, чем мыла. Чтобы сравнить свойства мыла и синтетических моющих средств, выполните лабораторный опыт 9.
Вполне очевиден экономический результат от замены мыла стиральным порошком, стиральной пастой или жидким синтетическим моющим средством. Вся эта продукция бытовой химии в большом количестве производится и безо всяких oграничений продаётся в хозяйственных отделах предприятий торговли (рис. 84).

Предназначенные для -стирки синтетические моющие средства различают в соответствии с тем, для какой ткани они рекомендованы. Отдельно выпускают средства для стирки шерстяных, шёлковых и синтетических тканей. Есть стиральные порошки универсального действия.
Зайдите в хозяйственный отдел одного из магазинов и по этикеткам на различных синтетических моющих средствах выясните, какие из них предназначены для стирки изделий: а) шерстяных; б) синтетических; в) искусственных; г) хлопчатобумажных, а какие — универсального действия. Эта информация вам будет полезна.
Состав синтетических моющих средств: Как и мыло, CMC имеют моющую основу и различные добавки (ферменты, или биодобавки, отбеливатели, ароматизаторы, красители и т. д.). По химическому составу моющая основа — это различные органические соединения, имеющие подобно мылу две части, а потому взаимодействующие с веществами загрязнений на ткани и переводящие их в раствор. За такое действие синтетические моющие средства и мыло получили название поверхностно-активные вещества (ПАВ).
Синтетические моющие средства — достаточно сложные смеси, которые, кроме моющей основы, содержат различные добавки. CMC, поступающие в продажу, могут быть порошкообразными, жидкими, в виде паст.
Ферменты, или энзимы, как добавки синтетических моющих средств: При стирке изделий, имеющих загрязнения биологического происхождения (например, пятна крови, молока, пота), используют синтетические моющие средства, содержащие ферменты. Об их наличии свидетельствует надпись на упаковке «био». Однако следует помнить, что ферменты — это белки, а потому нельзя применять их при температуре воды свыше 40 °С.
Объясните, что произойдет, если не соблюсти этих температурных пределов.
В порошках содержатся отбеливатели, однако в разном количестве. В порошках для стирки цветного белья их меньше, тогда как порошки для белых вещей содержат большее количество отбеливателей, благодаря чему бельё становится белоснежным. Это так называемые оптические отбеливатели. А есть ещё химические отбеливатели, они удаляют пятна от сока, кофе и т.д.
Бытует мнение, что чем больше пены, тем лучшим будет результат стирки. Это справедливо только для мыла. А вот в случае синтетических моющих средств прямой зависимости между эффектом стирки и пенообразующей способностью средства не существует. Моющая способность современных синтетических моющих средств не определяется количеством пены. Созданы порошки, которые почти не пенятся, но прекрасно удаляют загрязнения. Для стиральных машин обильная и стойкая пена нежелательна, поскольку затрудняет стирку - из-за иены снижается механическое воздействие на ткань, необходимое для удаления загрязнений, жидкость может переливаться через край. Поэтому для стиральных машин выпускают малопенящиеся средства, содержащие стабилизаторы пены.
К названию моющих средств, предназначенных для использования в стиральных машинах, часто добавляют слово «автомат».
При стирке синтетическими моющими средствами и последующей сушке изделия из тканей могут стать грубыми на ощупь. Во избежание этого в порошок добавляют ополаскиватели.
Ныне мировое производство синтетических моющих средств исчисляется десятками миллионов тонн в год. Однако почти 70 % CMC потребляют жители наиболее развитых стран, хотя таких государств лишь пятая часть.
Защита окружающей среды от загрязнения синтетическими моющими средствами: Недаром говорят: нет яда, существует превышение дозы. Это касается и синтетических моющих средств.
Человек всегда рассматривал окружающую среду как источник своих жизненных ресурсов, использовал её для удовлетворения собственных потребностей, не учитывая при этом возможные экологические последствия.
Менее века назад, когда масштабы производства моющих средств (сначала мыла) были небольшими, от того, что воду после стирки выливали куда-угодно, природа не страдала. Сегодня же, особенно в местах выброса отходов банно-прачечных комбинатов, происходят необратимые изменения в растительном и животном мире. Не проходит бесследно неконтролируемое выливание воды после стирки белья, мойки автомобилей разнообразными синтетическими моющими средствами и в индивидуальных хозяйствах.
Надо отметить, что синтетические моющие средства могут вызвать аллергию, раздражение кожи рук, органов зрения и дыхания. Поэтому должны быть соблюдены меры индивидуальной защиты.
Чтобы защитить окружающую среду от загрязнения синтетическими моющими средствами, нужно использовать их в умеренных количествах. Тогда будет больше гарантии, что средство используется полностью и не образуется его избыток, попадающий в окружающую среду. Актуальными ныне являются поиски промышленных способов утилизации избыточного поступления синтетических моющих средств в почву и водоёмы.
Органические растворители, их применение
Растворимость — способность вещества образовывать с другими веществами однородные системы.
Истинным раствором принято называть однородную смесь переменного состава, содержащую два и более компонента. В ней даже с помощью микроскопа нельзя разглядеть частицы растворённого вещества.
В растворе различают растворитель и растворённое вещество. Растворитель — это компонент, агрегатное состояние которого не изменяется при растворении. Содержание растворителя, как правило, больше содержания растворённого вещества, в его среде равномерно распределены частицы растворённого вещества.
Водные растворы имеют более низкую температуру замерзания и более высокую температуру кипения, чем вода.
Одним из способов выражения содержания растворённого вещества в растворе является массовая доля растворённого вещества. Она определяется по формуле
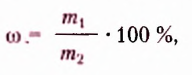
где 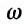 — массовая доля растворённого вещества,
— массовая доля растворённого вещества, 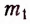 — масса растворённого вещества,
— масса растворённого вещества, 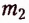 — масса раствора.
— масса раствора.
Понятие об органических растворителях: Вы изучали свойства растворов на основе растворителя воды. В этом полярном растворителе растворяется много веществ с ионной и ко-валентной полярной связями. Достаточно заглянуть в таблицу растворимости оснований, кислот, амфотерных гидроксидов и солей, чтобы привести примеры таких веществ.
Приведите примеры растворимых в воде оснований, кислот, солей и напишите уравнения их электролитической диссоциации. Вспомните, какая роль полярных молекул воды в этих процессах.
По растворимости в воде органические вещества уступают неорганическим. Из известных вам органических веществ хорошо растворяются в воде глюкоза, сахароза, этановая (уксусная) кислота, этанол. По растворимости в воде этанол превосходит многие неорганические вещества — его содержание может достигать 96 %. Исходя из общего правила, что в растворе растворитель имеет большую массу, чем растворённое вещество, правильнее о таком растворе было бы сказать как о растворе воды в спирте.
Вполне возможно, что летом в вашей семье будут консервировать овощи, используя в качестве консерванта уксус — раствор с массовой долей этановой (уксусной) кислоты 9 %. Маринады для огурцов готовят из расчёта 80 г такого раствора на 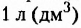 воды. Вычислите массовую долю кислоты в маринаде, считая, что плотность уксуса составляет
воды. Вычислите массовую долю кислоты в маринаде, считая, что плотность уксуса составляет 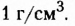
Большинство органических соединений растворяется в веществах подобной природы — органических растворителях, примером которых является этанол, бензен, ацетон, гексан, бензин, керосин, галогенопроизводные насыщенных углеводородов и т.д. (рис. 85). О некоторых из них и их растворах вы уже знаете, стоит хотя бы вспомнить йодную настойку (раствор йода в этаноле), бензин, ацетон и другие жидкости для разбавления лаков и красок, снятия лака с ногтей и т.п.

Применение органических растворителей: Органические растворители получили широкое применение в лакокрасочной промышленности. При покраске гомогенными жидкими смесями растворители испаряются и образуется твёрдое покрытие. Без органических растворителей не работала бы ни одна химчистка.
В способности органического растворителя керосина растворять масляную краску убедимся на таком демонстрационном опыте. Наполним на треть (половину) один стакан водой, а другой — керосином (рис. 86а). Поместим в оба стакана по капле масляной краски и колебательными движениями перемешаем их содержимое. Будем наблюдать, что краска в стакане с водой осталась без изменений, а в стакане с керосином растворилась (рис. 86б). Поэтому делаем вывод, что при покраске масляными красками щётку и пятна на одежде будет легко отмыть керосином.
Удаление пятен, как и любая обработка вещей - стирка, глажка и т.д., происходит в определённой последовательности и с соблюдением чётких правил, которые необходимо помнить, чтобы не испортить вещи. Вот некоторые из них.
Перед тем, как выбрать средство для работы, нужно определить, из какого волокна изготовлена ткань и чем она загрязнена. Здесь имеет значение также давность загрязнения: свежее пятно удалить значительно легче. Особенно это касается пятен от фруктов и ягод.
Перед удалением загрязнения с ткани необходимо выяснить действие средств для удаления пятен на её химическую основу и красители. Для этого средство испытывают на незаметном участке вещи (например, внутреннем шве, под пояском или внутри кармана).

Тампоном из ваты, смоченным подготовленным средством, обрабатывают маленький участок ткани с целью проверки, не изменяется ли под его воздействием цвет и структура ткани. Чтобы не испортить вещь, не следует применять концентрированные раствйры для удаления пятен. Если пятно сразу полностью не удаляется, то нужно повторить обработку 2-3 раза, чередуя её с промыванием.
Пятна желательно удалять при достаточном освещении, лучше всего днём.
Удаление пятен с помощью растворителей следует производить с изнаночной стороны ткани. Это предотвращает образование «ореолов», которые трудно потом удалить. «Ореол» образуется и от неправильного нанесения средства на пятно — наносить следует только от его краёв к центру. Тереть надо слегка, круговыми движениями, пока пятно не исчезнет. Желательно не касаться ткани средством за пределами пятна. Предотвратить образование «ореолов» на ткани можно, смочив место вокруг пятна водой.
При удалении пятен с шерсти и натурального шёлка ни в коем случае нельзя применять щёлочи и щелочные препараты, а с хлопчатобумажных и льняных тканей — препараты, содержащие сульфатную, хлоридную и нитратную кислоты. Для ацетатного и вискозного шёлка, а также большинства искусственных тканей нельзя использовать уксусную кислоту и ацетон. В домашних условиях для чистки одежды из этих тканей применяют концентрированный мыльный раствор. Синтетические ткани (капрон, лавсан и т. д.) можно испортить действием бензина и бензена.
Для эффективного удаления пятна следует знать также характер загрязнения. Об основных способах удаления пятен в домашних условиях вы узнаете, ознакомившись с таблицей 7.
Как показывает практический опыт, на одежду чаще всего попадают чай, жир, фруктовый сок, чернила, ржавчина. Пятна от них не исчезают после стирки. Однако существуют органические растворители, с помощью которых можно избавиться от этих пятен в домашних условиях. И в этом вы убедитесь во время выполнения практической работы.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |