
Органические соединения в химии - формулы, реакции и определения с примерами
Содержание:
Периодический закон и значение периодической таблицы элементов:
Из исторических источников известно, что до открытия периодического закона такие ученые-энциклопедисты как Аль Фаргоний, Абу Райхон Беруни, М. В Ломоносов, И. Деберейнер, Л. Мейер, У. Одлинг, Ж. Ньюлендс, Ж. Дюма. А. Шанкуртуа пытались объяснить природную связь между веществами.
Периодический закон имеет большое теоретическое и практическое значение как общий закон, научно обосновавший природную связь между химическими элементами.
В 1869 году, когда Д. И. Менделеев сформулировал периодический закон было известно 63 химических элемента.
В настоящее время из 109 химических элементов 46 открыты на основе законов периодической таблицы.
Значение периодического закона беспредельно при обосновании таких фундаментальных понятий как химическая связь, валентность, электроотрицательность, степень окисления.
Целый ряд понятий, вытекающих из периодического Закона, расширил представления о строении вещества, стал основой для развития таких наук, как физика, физхимия, геохимия, геология, минералогия, космохимия, ядерная физика.
Для понимания значения периодического закона и периодической таблицы химических элементов необходимо, основываясь на современных знаниях о строении атома,самостоятельно решать задачи и упражнения.
Пример:
Напишите электронную конфигурацию элементов, внешний электронный слой которых имеет a) 2s2, b) 3s2, d) 4s2 изображение и определите, какие это элементы.
Решение: Используя периодическую таблицу химических элементов определим, что это элементы 2 группы. Элемент, внешний электронный слой которого соответствует 2s2 является Be, 3s2 - это Mg, 4s2 - Са. Электронная формула этих элементов следующая: Be 1s2 2s2; Mg 1s2 2s2 2p6 3s2; Ca 1s2 2s2 2p6 3s2 3p6 4s2.
Теория строения органических соединений и значение изомерии
До XIX века свойства органических соединений всесторонне были изучены такими известными учеными как И. Берцеллиус, А. Лавуазье, А. Кекуле, А. Купер, Г. Колбе, М. Бертло, Н. Зининым, А. Фаворским.
К XIX веку определенная А. М. Бутлеровым теория строения дала возможность научно обосновать природную связанность органических соединений. Вместе с этим была показана возможность получения органических соединений, которые имея одинаковый состав, могут иметь различное строение.
В результате органическая химия обогатилась научно теоретическими основами, что способствовало развитию органической химии как науки.
На основе химического строения органических соединений начался синтез новых веществ и предсказание их свойств, изобретение новых не встречающихся в природе органических соединений. Во второй половине XX века по предложению А. Г. Максумова соединить теорию химического строения с электронной и пространственной, а также предложение современного варианта этой теории дали возможность глубже объяснить физико-химические свойства веществ. На сегодняшний день, за счет искусственных и синтетических соединений, количество органических веществ составляет свыше 5 млн.
Для изучения теории строения органических соединений и явления изомерии большое значение имеет самостоятельное решение задач и упражнений
Свойства неорганических и органических - веществ, применение и генетическая связь между ними
Для изучения свойств неорганических и органических веществ большое значение имеет знание атомного и молекулярного строения вещества.
Из курса химии вы знаете об атомном, молекулярном строениях, их возникновении, химической связи. Развивая свои теоретические знания, в 9 классе вы укрепили знания о связанности свойств органических соединений, молекулярного строения,гибридизации атомов в молекуле с различными проявлениями изомерии.
Например, хотя поваренная соль считается важным для организма химическим соединением, составляющие его атомы хлора и натрия в отдельности ядовитые и разъедающие вещества. Если тетраокись серы (IV) имеющий молекулярную массу равную 64 газ, то, вещества с относительно низкой молекулярной массой, такие как метиловый спирт (46) - жидкости. А вещества, имеющие одинаковый атомный состав, такие как метиловый эфир муравьиной кислоты и уксусная кислота (С2Н4O2) проявляют различные свойства.
Следовательно, прежде чем изучить свойства веществ и область применения, необходимо знать их строение.
Неорганические и органические вещества составляют всю природу и переходят друг в друга. Эту мысль вы осознаете в процессе изучения неорганической и органической химии.
Выполните следующее задачи и упражнения. Постарайтесь понять связь между строением и свойствами вещества, взаимный переход неорганических веществ в органические, т.е. генетическую связь между ними.
Пример:
1. Напишите необходимые уравнения реакций получения бутана, используя метан и неорганические вещества.
Решение:
1. Получение метил бромида из метана:
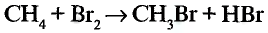
2. Получение этана путем нагревания метил бромида с металлическим натрием (реакция Вюрца):
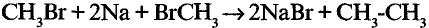
3. Получение бромида этана (этил бромид):
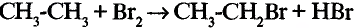
4. Получение бутана путем нагревания бромида этана с натрием:
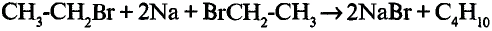
Значение химических реакций в химическом производстве
Изучая научные основы химии, вы имеете определенные знание о веществах, применяемых в народном хозяйстве, и убедились, что химия - это волшебная наука. Волшебность заключается в том, что из газообразных веществ можно получить жидкости или из твердых веществ-газы, а из них ткани или лекарственные препараты. Многие химические вещества вырабатываются на химических предприятиях. Например, азотные, фосфорные, калийные минеральные удобрения, азотная, фосфорная, серная кислоты, черные и цветные металлы, продукты нефти, угля и природного газа вырабатываются на химических предприятиях.
Предприятия химического производства - включают в свой состав целый ряд процессов, направленных на изучение химического состава сырья. На химических предприятиях научные, теоретические и практические знания изучает химическая технология.
Следовательно химическая технология - это наука, изучающая способы производства качественной продукции при малом расходе сырья и энергии.
В основе процессов химического производства лежат химические реакции. Внедрение науки о скорости химической реакции, факторов, влияющих на скорость химических реакций, химического равновесия, факторов, влияющих на химическое равновесие, теоретических основах химической кинетики в химическую технологию - означает ее развитие быстрыми темпами.
Вы ознакомились с закономерностями таких необратимых реакций как горение угля, серы и обратимых реакций как окисление оксида серы (IV), связывание азота с водородом, окисление аммиака. Внедрение этих реакций в производство являются основной задачей технологического процесса.
Пример решения задачи:
Напишите уравнение реакции взаимодействия твердого вещества А с водой, в результате которого образуется ненасыщенное соединение в газообразном состоянии, из которого образуется органическая кислота в жидком состоянии. Укажите названия веществ А и В .
Решение: Предположим, что веществом А является карбид кальция, которое при взаимодействии с водой образует газообразное углеводородное соединение ацетилен. Из ацетилена при взаимодействии с водой в присутствии аммиачного раствора окись серебра (I) образуется уксусный альдегид, из которого в свою очередь-уксусная кислота.
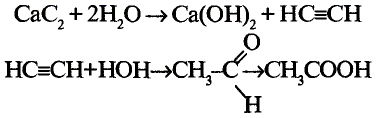
Что такое органические соединения
Среди соединений различных элементов отдельную группу представляют соединения углерода, так называемые органические соединения. Этот термин появился в начале XIX в. и не случайно имеет общий корень со словом «организм». Тогда считалось, что органические вещества можно выделить из продуктов растительного п животного происхождения и изучать в готовом виде, но невозможно получить из других веществ, то есть химическим способом.
Действительно, живые организмы — это своеобразные химические лаборатории, где образуются и разлагаются органические вещества. Но, как оказалось, их можно получить и з лабораторных условиях. Со временем было разработано множество способов получения органических веществ синтезом, в частности из неорганических веществ. Но название "органические соединения" сохранилось, и отрасль химической науки, изучающая соединения углерода, традиционно называют органической химией. Следует отметить, что оксиды углерода, карбонаты и некоторые другие соединения углерода относят к неорганическим.
Углерод — основной химический элемент органических соединений

Рис. 69. Продукты и материалы органической химии
Мыло, уксус, масло, сахар, бумага, резина состоят из органических веществ
Атомы углерода образуют молекулы разнообразной формы:
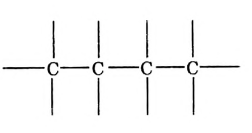
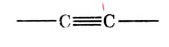
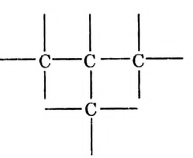
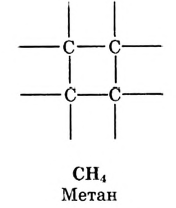
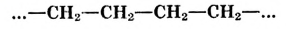
Фрагмент молекулы полиэтилена
Нас окружают преимущественно органические вещества: из них изготовлены мебель, одежда, обувь. И пищевые про дукты — жиры, сахар — относятся к ор ганическим соединениям, как и бумаг для учебника, который ты сейчас чита ешь, изготовленная из целлюлозы (рис 69). Из органических веществ формируются растительные и животные организмы, а жизненно важные биохимические процессы, происходящие в них, являют ся реакциями органических соединений
Люди издавна использовали органические вещества и их превращения. Об рабатывая жиры пеплом растительного происхождения, получали мыло — органическое соединение, производили красители растительного и животного происхождения — индиго, пурпур и др. Вино уксус изготовляли способом брожения виноградного сока (при этом взаимодействуют органические вещества). Средства древней медицины и косметики так же содержали органические вещества.
Особенности органических соединений
Какие же особенности соединений углерода обусловливают их изучение от дельно от соединений других элементов? Прежде всего, соединений углерода во много раз больше, чем таких, которые его не содержат. Сейчас известно более 20 миллионов органических веществ. С каждым годом их количество пополняет ся 200—300 тысячами новых, получен ных синтетически. А вот неорганических веществ известно не более 200 тысяч.
Атомы углерода обладают способностью последовательно соединяться между собой, образуя молекулы разнообразной формы: прямые и разветвлённые, длинные и короткие цепи, кольца.
Известны соединения, молекула которых содержит один атом углерода, как п известном тебе газе метане 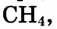 а есть и такие, в состав которых входят тысячи этих атомов, например полиэтилен. Кроме того, в молекулах органических веществ могут быть атомы водорода, кислорода, азота, галогенов, серы, фосфора и других элементов.
а есть и такие, в состав которых входят тысячи этих атомов, например полиэтилен. Кроме того, в молекулах органических веществ могут быть атомы водорода, кислорода, азота, галогенов, серы, фосфора и других элементов.
В отличие от неорганических веществ качественный состав органических соединений представлен несколькими химическими элементами, при этом количественный — значительно разнообразнее.
Валентность большинства элементов и неорганических соединениях — величина переменная (вспомни соединения, и которых сера, фосфор, азот имеют разную валентность), а элементы органических соединений проявляют значительно меньше валентных состояний. Углерод в органических веществах всегда четырёхвалентный.
В органических соединениях углерод всегда четырёхвалентный
В органических веществах преобладают ковалентные связи между атомами
Разнообразнее в неорганических веществах также виды химических связей — ионная, ковалентная, металлическая. А органические вещества образуются преимущественно посредством ковалентных связей, хотя среди них имеются ионные соединения.Кристаллические решётки большинства органических соединений молекулярные, поэтому они легкоплавкие, часто обладают запахом. Ионные неорганические вещества тугоплавкие, устойчивы к нагреванию (температура плавления хлорида натрия 800 "С). Органические соединения сгорают с образованием воды, углекислого газа и выделением теплоты либо разлагаются при нагревании до 300— 400 "С (рис. 70). Горючесть органических веществ обусловливает их использование в виде топлива и горючего (уголь, древесина, керосин, бензин и др.).
Для проведения реакции между неорганическими веществами ты обычно использовал их водные растворы. Но органические вещества преимущественно нерастворимы в воде. Для выведения с ткани пятен органического происхождения, например жирных, необходимы специальные органические растворители, а не вода.

Рис. 70. При сгорании древесины образуются углекислым газ и вода
Изучая химические свойства неорганических веществ, ты наблюдал образование осадка, газа, изменение окраски. Причем эффект проявлялся сразу же после смешивания веществ, то есть реакции протекали быстро, практически мгновенно. Органические вещества реагируют между собой обычно медленно. Реакции могут протекать в нескольких направлениях, с образованием различных побочных продуктов.

В уравнениях реакций органических соединений записывают только основные продукты, поэтому вместо знака равенства принято ставить стрелку.
Несмотря на существенные различия между органическими и неорганическими веществами, разделение их на эти две группы условно. Ведь образование и реакции органических и неорганических веществ протекают в соответствии с теми же законами. Среди органических веществ есть растворимые в воде соединения, электролиты (например, соли органических кислот), термостойкие (например, тефлон применяют как жаростойкое покрытие посуды).
Органические и неорганические вещества объединяет способность к взаимному превращению. Вспомни круговорот веществ в природе (рис. 71). Из неорганических веществ углекислого газа и воды к растениях синтезируется органическое вещество глюкоза. В виде корма она используется животными как источник энергии, но при этом снова превращается в углекислый газ и воду. Так же можно наблюдать превращения соединений азота, кислорода, водорода, фосфора.
Органические и неорганические вещества обладают способностью к взаимопревращению
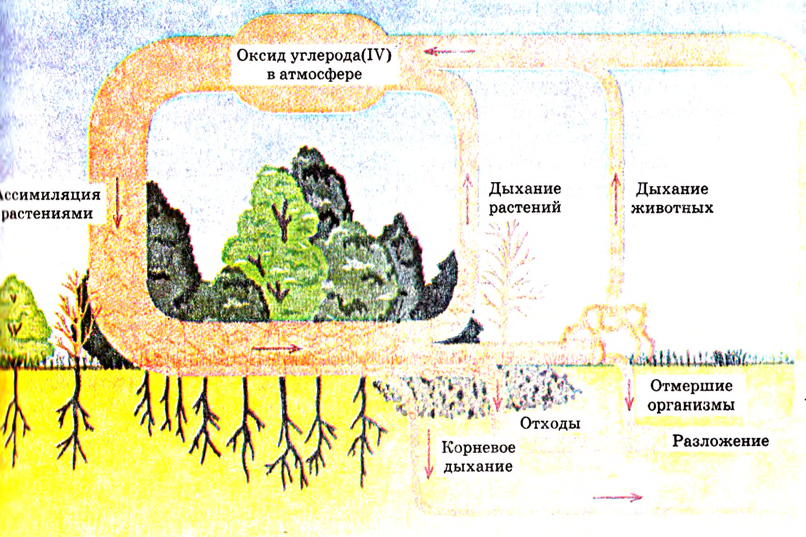
Рис. 71. Круговорот углерода
Выводы:
- Органическая химия изучает соединения углерода. Органические соединения широко распространены: из них производят пищевые продукты, ткани, лекарства, бумагу, горючее и многое другое.
- Органические вещества — это основа растительных и животных организмов.
- Атомы углерода в органических соединениях могут образовывать молекулы разнообразной формы.
- Характерные признаки органических соединений: преобладание ко* валентных связей между атомами, молекулярные кристаллические решётки, горючесть, плохая растворимость в воде. Разделение на органические и неорганические вещества — условно.
Метан
Простейшим органическим соединением, в составе которого только один атом углерода и четыре атома водорода, является метан, его молекулярная формула 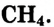
Для понимания электронного строения молекулы метана вспомни электронное строение атома углерода.
Его электронная формула 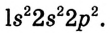 В основном состоянии во внешнем электронном слое атома размещаются 4 электрона: два s- и два р-электрона, а одна р-орбиталь остаётся свободной (рис. 72).
В основном состоянии во внешнем электронном слое атома размещаются 4 электрона: два s- и два р-электрона, а одна р-орбиталь остаётся свободной (рис. 72).
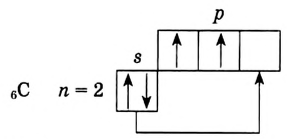
Рис. 72. Основное состояние атома углерода
При образовании соединения атом углерода переходит в возбуждённое состояние, а один s-электрон перемещается на свободную р-орбиталь (рис. 73). Таким образом в атоме углерода во внешнем слое содержатся четыре неспаренных электрона, благодаря которым образуются четыре связи с другими атомами, то «сть углерод проявляет валентность четыре.
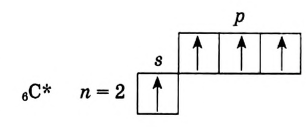
Рис. 73. Возбуждённое состояние атома углерода
Атомы водорода имеют по одному электрону и являются одновалентными.
Отдавая четыре электрона, атом углерода образует четыре ковалентных связи четырьмя атомами водорода.
Обозначив валентные электроны точками, получим электронную формулу метана:
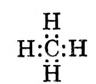
Заменим точки, обозначающие электронные пары, чёрточками (связями) получаем структурную формулу метана:
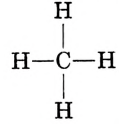
Структурные формулы, которыми обычно пользуются в органической химии, являются плоскостными схемами молекул, отображающими лишь последовательность размещения атомов в молекулах. Реальное их строение отличается от схематичного изображения, поскольку атомы размещаются в трёхмерном пространстве. Доказано, что молекуле метана имеет форму правильной тригональной пирамиды (тетраэдра). Если атом углерода вписать в эту геометрическую фигуру, то четыре валентных связи будут направлены под углом 109,5° к вершинам тетраэдра, где размещаются атомы водорода (рис. 74).
Тетраэдрическое направление связей даёт возможность валентным электронам находиться на максимальном расстоянии один от другого. Такое строение молекулы обусловлено электронным строением атома углерода и подтверждается физико-химическими исследованиями.
Тетраэдр 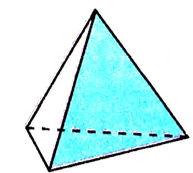
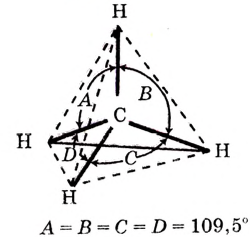
Рис. 74. Тетраэдрическое строение молекулы метана
Реальное строение молекул можно представить, используя модели. Для конструирования моделей атомы углерода и водорода изготавливают в виде шариков, п химические связи — в виде стержней, поэтому такие модели называют шаро-стержневыми (рис. 75).
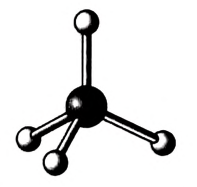
Рис. 75. Метан: шаростержневая модель молекулы
Используют также масштабные модели, в которых размеры атомов и связей передаются точнее, пропорционально реальным размерам молекул (рис. 76).
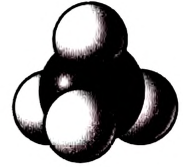
Рис. 76. Метан: масштабная модель молекулы
Физические свойства и распространение в природе:
При нормальных условиях метан — газ, бесцветный, без запаха, почти в два раза легче воздуха. В воде почти не растворяется, но хорошо растворим в органических растворителях.
Природный газ, поступающий в газовую магистраль, на 98 % состоит из метана и имеет, как ты уже знаешь, неприятный запах. Это объясняется добавлением специальных веществ с характерным запахом.
Как основной компонент природного газа метан образовался в недрах Земли. По мнению учёных, это происходило в результате высокотемпературных реакций.
В природе метан образуется в процессе гниения растительных остатков без доступа воздуха. На болотах он проявляется в виде пузырьков (болотный газ) на поверхности воды (рис. 77). В угольных шахтах может скапливаться рудничный газ — это также метан.
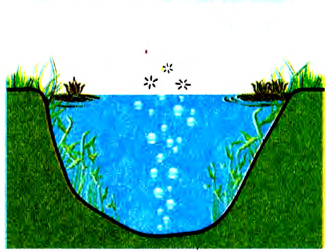
Рис. 77. Образование метана в заболоченном водоёме
5 "Химия", 9кл.
Метан есть не только на Земле. Он пре обладает в атмосфере планет Юпитер и Сатурн.
Химические свойства:
Реакции окисления: Одно из важнейших химических свойств метана известно тебе из повседневной жизни — это реакция горения. Реакция протекает при сгорании природного газа, поступающего по газопроводам. В процессе сгорания метана, как и других органических веществ, образуются вода и углекислый газ:
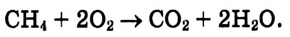
Продукты реакции можно обнаружить опытным путём.
Опыт. Метан, собранный в цилиндре, надо поджечь или опустить газоотводящую трубку с пламенем метана в стеклянный цилиндр. Через некоторое время на стенках цилиндра образуется роса. Добавим в цилиндр известковой воды; стекая по стенкам цилиндра, она становится мутной. Следовательно, при горении метана выделяются вода и углекислый газ. Эти продукты образовались из углерода и водорода, которые есть в составе метана. Опыт подтверждает качественный со» став данного соединения.

Рис. 78. Горение метана в газовой конфорке кухонной плиты
Кроме продуктов окисления выделяется также большое количество теплоты (рис. 78). Термохимическое уравнение реакции горения метана записывают так:
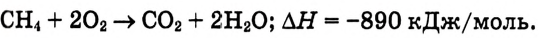
С химической точки зрения, горение метана — это реакция полного окисления. При недостатке кислорода метан окисляется не полностью — протекает реакция частичного окисления, и вместо оксида углерода образуются углерод (в виде сажи) и оксид углерода
образуются углерод (в виде сажи) и оксид углерода Это очень токсичное вещество без запаха и цвета. Важно знать, что при неполном окислении метана в бытовых газовых приборах его пламя приобретает жёлтую окраску, поскольку частицы углерода раскаляются.
Это очень токсичное вещество без запаха и цвета. Важно знать, что при неполном окислении метана в бытовых газовых приборах его пламя приобретает жёлтую окраску, поскольку частицы углерода раскаляются.
Метан образует взрывоопасные смеси с кислородом и воздухом. Взрыв может произойти даже от искры, если концентрация метана достигает критической. Поэтому необходимо соблюдать правила безопасности, регулярно проветривать помещение, где установлены газовые нагревательные приборы.
В обычных условиях метан не взаимодействует с окислителями, например с перманганатом калия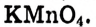
Горение — это реакция полного окисления
Жёлтое пламя газовой горелки — показатель неполного сгорания метана и образования токсичных веществ
Метан — взрывоопасное соединение
Метан не взаимодействует с окислителями
Опыт. Пропустим метан через раствор перманганата калия. Фиолетовая окраска раствора не исчезает, реакция не протекает.
Кроме того, на метан не действуют кислоты и щёлочи.Реакция разложения. При нагревании метана до высокой температуры (свыше 1000 °С) без доступа кислорода протекает реакция разложения с образованием углерода и водорода:
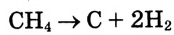
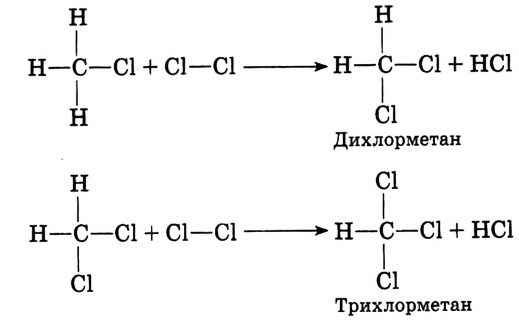
Реакция замещения: Метан вступает в реакцию с хлором  При освещении стеклянной колбы со смесью этих двух газов ультрафиолетовыми лучами или при нагревании протекает реакция хлорирования метана:
При освещении стеклянной колбы со смесью этих двух газов ультрафиолетовыми лучами или при нагревании протекает реакция хлорирования метана:
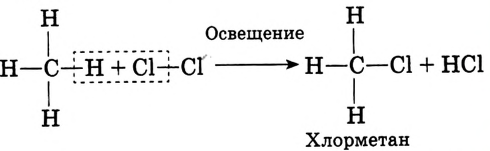
При рассеянном солнечном свете реакция протекает медленно, можно наблюдать постепенное исчезновение жёлто-зелёной окраски хлора, который используется на взаимодействие с метаном.
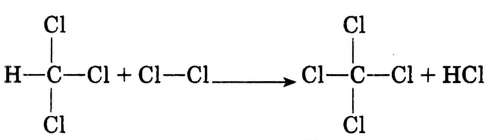
По химическому характеру — это реакция замещения. Она не прекращается на первой стадии, а протекает до полного замещения всех атомов водорода:
 Тетрахлорметан
Тетрахлорметан
Суммарное уравнение полного хлорирования метана:
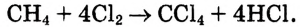
На практике образуется смесь одно-, двух-, трёх-, четырёхзамещённых соединений, так называемых хлорпроизводных метана.
Итак, сделаем выводы о химической активности метана. Для того чтобы он прореагировал, его необходимо нагреть до высокой температуры или поджечь, использовать такой активный реагент, как хлор. Следовательно, метан — достаточно инертное соединение. Для него характерны реакции замещения, он не вступает в реакции присоединения.
Для метана характерны реакции замещения
В обычных условиях метан инертное соединение
Применение метана: Хотя состав метана как основного компонента болотного и рудничного газов был определён в начале XIX в., широко использовать его начали лишь спустя столетие. Благодаря теплоте, выделяющейся при сгорании метана, он применяется во многих промышленных процессах и как относительно дешёвое топливо для бытовых потребностей.Метан — основной компонент биогаза, который образуется при разложении бытовых и сельскохозяйственных органических отходов.

Рис. 80. Тетрахлорметан — средство для гашения огня
Биогаз можно использовать для отопления помещений, это сэкономит природный газ, запасы которого ограниченны. Одновременно решается проблема утилизации отходов органического происхождения.
Широко применяются продукты химических превращений метана: углерод (сажа) — для производства резины, типографской краски; водород — в синтезе аммиака; хлорметан 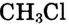 — в органическом синтезе; дихлорметан
— в органическом синтезе; дихлорметан 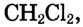 три-хлорметан
три-хлорметан 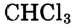 — как растворители; трихлорметан (другое название — хлороформ)
— как растворители; трихлорметан (другое название — хлороформ)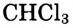 продолжительное время использовался в медицине как обезболивающее при хирургических операциях; тетрахлорметан
продолжительное время использовался в медицине как обезболивающее при хирургических операциях; тетрахлорметан 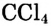 — для гашения огня (рис. 80). Продукты термического разложения и неполного окисления метана являются исходными для производства пластмасс, используются в органическом синтезе.
— для гашения огня (рис. 80). Продукты термического разложения и неполного окисления метана являются исходными для производства пластмасс, используются в органическом синтезе.
Выводы:
- Метан — простейшее органическое соединение.
- В молекуле метана, как и в других органических соединениях, атом углерода — четырёхвалентный, то есть образует четыре ковалентных связи. Молекула метана имеет тетраэдрическое строение. Метан — химически устойчивое соединение в стандартных условиях. В специальных условиях он вступает в реакции окисления и замещения.
- Метан горит с образованием углекислого газа и воды. Метан — основной компонент природного газа.
- Метан используют как топливо, а продукты его химической переработки — в различных отраслях хозяйства.
Гомологи метана
Тебе необходимо знать: молекулярные и структурные формулы, названия десяти гомологов метана, их общую формулу;
Понимать сущность понятий: насыщенные углеводороды, парафины, гомологи, гомологический ряд;
Уметь: объяснять пространственное строение углеродной цепи насыщенных углеводородов; составлять уравнения химических реакций гомологов метана, объяснять их применение;
Сравнивать: физические свойства гомологов метана.
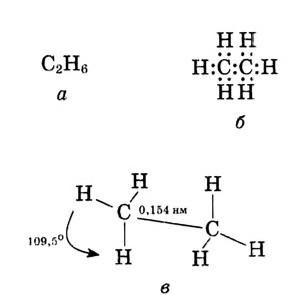
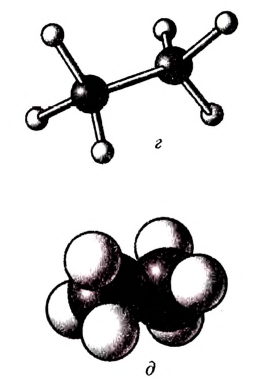
Рис. 81. Этан: а — молекулярная формула; б — электронная формула; в — геометрия молекулы; г — шаростержневая модель молекулы; д — масштабная модель молекулы
Состав и строение молекул: Ты уже знаешь, что атомы углерода обладают способностью соединяться между собой, образуя цепи. Если два атома углерода соединяются ковалентной связью, отдавая по одному электрону, то у каждого из атомов остаются по три электрона, которые могут образовать общие электронные пары с тремя атомами водорода. Химический состав такого соединения Его электронная и структурная формулы:
Его электронная и структурная формулы:
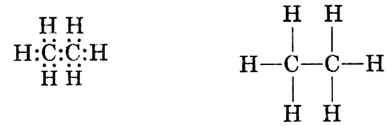
Это соединение — этан (рис. 81).Запишем электронную формулу соединения углерода с водородом, которая включает три последовательно соединённых атома углерода, при этом помним, что углерод четырёх-, а водород — одновалентный:
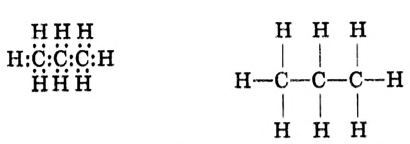
Молекулярная формула пропана (именно так называют это соединение) — 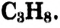 Данные соединения содержат лишь атомы углерода и водорода, которые полностью использовали свои валентности, то есть валентности атомов углерода полностью насыщены атомами водорода. Такие соединения называют насыщенными (предельными) углеводородами. К ним относится и метан.
Данные соединения содержат лишь атомы углерода и водорода, которые полностью использовали свои валентности, то есть валентности атомов углерода полностью насыщены атомами водорода. Такие соединения называют насыщенными (предельными) углеводородами. К ним относится и метан.
В таблице 6 приведены характеристики насыщенных углеводородов по возрастанию числа атомов углерода в молекулах.
Названия первых четырёх соединений этого ряда сложились исторически, а начиная с пентана, образуются от греческих или латинских числительных с добавлением суффикса -ан.
Структурные формулы можно записать в упрощённом виде. Например, для этана 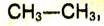 пропана
пропана
Таблица 6. Насыщенные углеводороды
| Название соединения | Молекулярная формула | Структурная формула (сокращённая) |  |
| Метан | 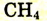 |
-162 | |
| Этан | 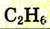 |
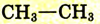 |
-89 |
| Пропан | 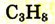 |
 |
-42 |
| Бутан | 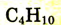 |
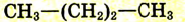 |
-0,5 |
| Пентан | 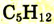 |
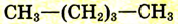 |
36 |
| Гексан | 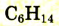 |
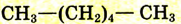 |
69 |
| Гептан | 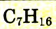 |
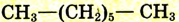 |
98 |
| Октан | 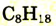 |
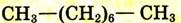 |
126 |
| Нонан | 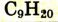 |
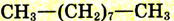 |
151 |
| Декан | 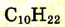 |
 |
174 |
Чтобы собрать модель молекулы метана, к одному шарику большего диаметра присоедини, используя спички (химические связи), шарики меньшего диаметра. Соблюдай тетраэдрическое направление химических связей, то есть под углом 109,5° одна к другой.
Для изготовления моделей молекул гомологов метана последовательно соедини шарики большего диаметра и соответствующее количество шариков меньшего диаметра. Следи, чтобы атомы углерода были четырёхвалентные!
Соединяя атомы углерода с соблюдением тетраэдрического направления химических связей, обрати внимание, что цепь атомов может приобретать различную форму (рис. 82).
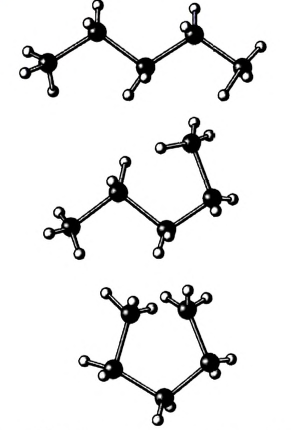
Рис. 82. Модели пространственных форм молекулы пентана
В молекулах насыщенных углеводородов вокруг углерод-углеродных связей при нормальных условиях возможно свободное вращение. В результате молекула может приобретать другие формы-, как можно убедиться на опыте с моделями молекул. Зигзагообразное строение углеродной цепи — энергетически наиболее выгодное, поскольку атомы в этом случае максимально удалены один от другого (рис. 82).
Помни: какую форму не имела бы углеродная цепь, последовательность соединения атомов в молекуле остаётся во всех случаях одинаковой и выражается структурной формулой. Не изменяются также углы между атомами углерода (109,5°) и длина связей. Между атомами углерода она составляет 0,154 нм (рис. 81).
Физические свойства: Агрегатное состояние веществ ряда, который начинается метаном, изменяется (при нормальных условиях) постепенно от газообразного до твёрдого с увеличением количества атомов углерода в молекуле.
Согласно константам (таблица 6) первые четыре вещества при нормальных условиях — это газы, далее идут жидкости, а начиная с углеводорода состава  (в таблице не приводится) — твёрдые вещества.
(в таблице не приводится) — твёрдые вещества.
Насыщенные углеводороды не растворяются в воде, но растворимы в органических растворителях.
Соединения состава  имеют характерный «бензиновый» запах.
имеют характерный «бензиновый» запах.
Пропан и бутан легко сжижаются при повышенном давлении. Смесь этих газов (баллонный газ) используется как топливо для бытовых потребностей.
Основной природный источник насыщенных углеводородов — нефть.
Химические свойства: По химическим свойствам эти углеводороды похожи на метан: горят, разлагаются при нагревании, вступают в реакции замещения с хлором, не вступают в реакции присоединения:
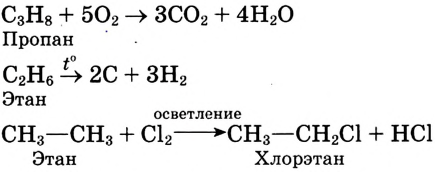
Насыщенные углеводороды — основа химического состава нефти
Насыщенные углеводороды вступают в реакции горения, разложения, замещения
Все эти реакции протекают при определённых дополнительных условиях: нагревание до температуры разложения или возгорания, наличие света.
Термин парафины происходит от лат. parum — мало и affinis — родственный, сродство
При стандартных условиях насыщенные углеводороды относительно инертные, не реагируют с кислотами, щелочами, не окисляются таким сильным окислителем, как перманганат калия. В этом можно убедиться на опыте, воздействуя на различные насыщенные углеводороды растворами указанных веществ.
Именно химической устойчивостью насыщенных углеводородов, относительной инертностью объясняется их другое название — парафины.
Итак, насыщенные углеводороды, или парафины, имеют подобные свойства, но отличаются количественным составом молекул.
Внимательно рассмотри таблицу 6. Это отличие выражается количеством групп 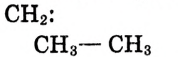 этан
этан
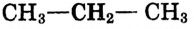 пропан
пропан
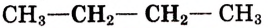 бутан
бутан
Соединения, которые имеют подобное строение молекул, подобные химические свойства и различаются между собой по составу на одну или несколько групп 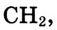 называются гомологами, а ряд таких соединений — гомологическим рядом (от греч.
называются гомологами, а ряд таких соединений — гомологическим рядом (от греч. 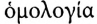 — соответствие). Группа
— соответствие). Группа 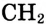 — гомологическая разность состава.
— гомологическая разность состава.
Явление гомологии характерно для органических веществ. Рассмотренные нами метан, этан, пропан, бутан и другие углеводороды относятся к гомологическому ряду метана.

Рис. 83. Газозаправочная станция
Общая формула парафинов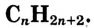 Зная её, можно вывести формулу каждого из этих соединений. Например, формула насыщенного углеводорода, который содержит 15 атомов углерода,
Зная её, можно вывести формулу каждого из этих соединений. Например, формула насыщенного углеводорода, который содержит 15 атомов углерода, 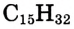 (пентадекан).
(пентадекан).
Рис. 84. Зажигалка работает на сжиженном газе

Рис. 85. Бензозаправочная станция
Применение: Как и метан (см. с. 135), его гомологи широко применяют в разных отраслях. Пропан и бутан — газы, которые легко сжижаются. Этим обусловлено их использование в виде сжиженного баллонного газа в быту, на транспорте и т. д. (рис. 83, 84). С точки зрения экологии, этот вид горючего наиболее приемлем для окружающей среды. Как и метан, его гомологи являются сырьём для многих органических веществ, из которых, в свою очередь, получают другие соединения.
Гомологи метана состава 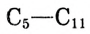 — основа горючего для автомобильных двигателей (рис. 85).
— основа горючего для автомобильных двигателей (рис. 85).
Парафин — это смесь твёрдых углеводородов с числом атомов углерода в молекуле от 18 до 35. Его используют в медицине, в производстве моющих средств, пласт масс, свечей, жевательной резинки и др.
Медицинское применение имеет озокерит, или горный воск, — ископаемое вещество нефтяного происхождения, смесь углеводородов, смол, минеральных веществ.
Выводы:
- Гомологи метана относятся к группе насыщенных углеводородов, или парафинов.
- Общая формула насыщенных углеводородов
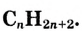
- Молекулы парафинов имеют зигзагообразное строение углеродной цепи.
- Температуры плавления и кипения парафинов возрастают с увеличением их молекулярных масс.
- В природе насыщенные углеводороды содержатся в нефти. Парафины — обычно химически инертны, но при определённых условиях вступают в реакции окисления, разложения, замещения. Парафины горят с образованием углекислого газа и воды. Парафины используют в разных отраслях: как топливо, сырьё для синтеза других веществ, в медицине и т. д.
Этилен и ацетилен
*Согласно правилам, принятым международным научным сообществом, в научной литературе используют соответственно названия этен и этин.
Состав и строение молекул: Существуют углеводороды, в которых содержание водорода будто меньше, чем это необходимо для насыщения четырёхвалентного углерода. Например, в соединении состава 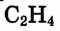 не хватает двух атомов водорода, а в соединении состава
не хватает двух атомов водорода, а в соединении состава 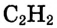 — четырёх атомов водорода. Именно эта ненасыщенность объясняет название группы соединений — ненасыщенные (непредельные) углеводороды.
— четырёх атомов водорода. Именно эта ненасыщенность объясняет название группы соединений — ненасыщенные (непредельные) углеводороды.
Обратимся к химическому строению данных веществ.
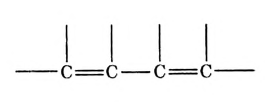
Особенность состоит в том, что атомы углерода в этих соединениях связаны между собой двойными или тройными связями.
В молекуле этилена 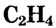 атомы углерода, связываясь между собой, используют не по одному электрону, как в молекуле этана
атомы углерода, связываясь между собой, используют не по одному электрону, как в молекуле этана 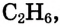 а по два, и образуют две общие электронные пары, то есть две ковалентные связи. По два валентных электрона, оставшихся у атомов углерода, используются для связей с атомами водорода.
а по два, и образуют две общие электронные пары, то есть две ковалентные связи. По два валентных электрона, оставшихся у атомов углерода, используются для связей с атомами водорода.
Электронная и структурная формулы этилена:
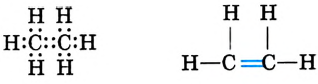
Валентные углы в молекуле этилена — 120°, длина углерод-углеродной связи — 0,134 нм (рис. 86).
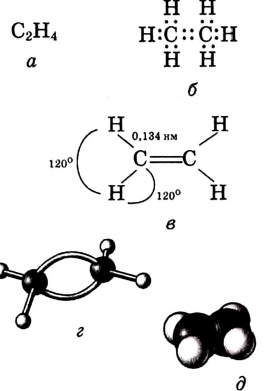
Рис. 86. Этилен: а — молекулярная формула; б — электронная формула; в — геометрия молекулы; г — шаростержневая модель молекулы; д — масштабная модель молекулы
В молекуле ацетилена 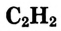 атомы углерода используют для связи между собой по три электрона, образуя три общих электронных пары, то есть тройную связь. Каждый атом углерода отдаёт по одному электрону из оставшихся для образования связи с атомом водорода.
атомы углерода используют для связи между собой по три электрона, образуя три общих электронных пары, то есть тройную связь. Каждый атом углерода отдаёт по одному электрону из оставшихся для образования связи с атомом водорода.
Электронная формула ацетилена 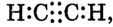 структурная формула ацетилена
структурная формула ацетилена 
Валентные углы в молекуле ацетилена — 180°, длина углерод-углеродной связи — 0,120 нм (рис. 87).
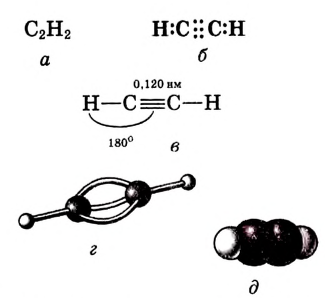
Рис. 87. Ацетилен: а — молекулярная формула; б — электронная формула; в — геометрия молекулы; г — шаростержневая модель молекулы; д — масштабная модель молекулы
Двойные и тройные связи называют кратными, в отличие от ординарных (обычных, простых) у насыщенных углеводородов.
Физические свойства этилена и ацетилена: Этилен — бесцветный газ, почти без запаха, мало растворим в воде, немного легче воздуха. Ацетилен также бесцветный газ, со слабым фруктовым запахом, почти не растворим в воде, немного легче воздуха.
В природе ацетилен не встречается в свободном состоянии в виду высокой активности молекул. Выделяется при некоторых процессах обмена в тканях растительных и животных организмов. Этилен образуется при переработке нефти, получают его синтезом, в частности из неорганических веществ.
Химические свойства этилена и ацетилена:
Реакции окисления: Как и другие углеводороды, этилен и ацетилен горят, то есть полностью окисляются, с образованием оксида углерода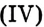 и воды и выделением теплоты:
и воды и выделением теплоты:
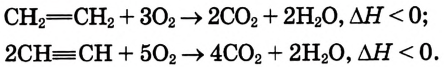
Опыт 1. Получим этилен, используя прибор, изображённый на рис. 88. Подожжём газ возле конца газоотводной трубки, — наблюдается свечение пламени. Вспомни, что метан горит почти бесцветным пламенем.
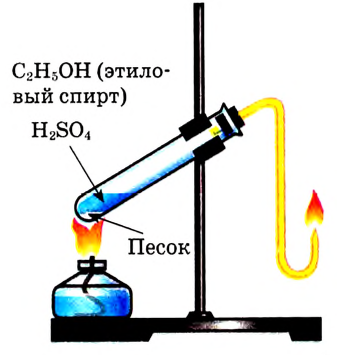
Рис. 88. Получение этилена в лаборатории
Объяснить это различие можно исходя из состава молекул метана и этилена. Массовая доля углерода в метане составляет 75 %, а в этилене — 86 %.
Следовательно, этилен при разложении в пламени образует по сравнению с метаном больше частиц углерода, они накаляются, что и обусловливает свечение. В верхней части пламени частицы сгорают до углекислого газа.
Можно предположить, что ацетилен будет гореть ещё ярче, поскольку массовая доля углерода в его молекуле 92 %. Убедимся в этом на опыте.
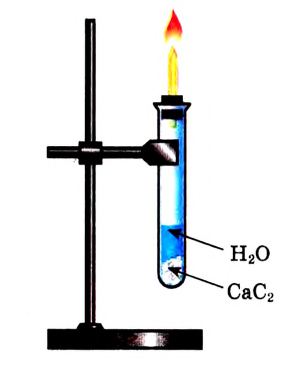
Рис. 89. Получение ацетилена в лаборатории
Опыт 2. Получим ацетилен в приборе, изображённом на рис. 89. Подожжём газ, который выделяется, и убедимся, что ацетилен горит коптящим пламенем.
Для полного сгорания ацетилена, например при ацетиленовой сварке металлов, в пламя дополнительно подают воздух или кислород.
Ненасыщенный характер углерод-углеродных свйзей обусловливает характерные химические свойства этилена и ацетилена.
Выясняя химическую активность метана, мы проводили опыт с раствором перманганата калия: его окраска не изменилась. Ненасыщенные углеводы этилен и ацетилен проявляют значительную активность в этой реакции.
Опыт 3. Пропустим этилен или ацетилен в пробирку с раствором перманганата калия. Фиолетовая окраска раствора исчезает, что подтверждает протекание химической реакции.
Этилен и ацетилен вступают в реакцию частичного окисления под воздействием такого окислителя, как перманганат калия. В результате образуются продукты сложного строения, поэтому мы не записываем уравнение реакции. Она характерна для всех ненасыщенных соединений и используется как качественная реакция для обнаружения кратной связи в молекуле.
По сравнению с метаном этилен и ацетилен проявляют значительную химическую активность
Молекулы ненасыщенных углеводородов имеют кратные связи между атомами углерода
Реакция присоединения: Если для насыщенных углеводородов характерна реакция замещения, то для ненасыщенных — реакция присоединения. В присутствии катализатора (платины, никеля) по месту кратной связи может присоединяться водород:
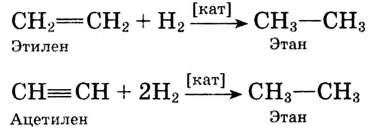
Для этилена и ацетилена характерна реакция присоединения по кратной связи
Поскольку ацетилен менее насыщенный, то последнюю реакцию можно рассматривать как двухстадийную: сначала образуется этилен, потом — этан:
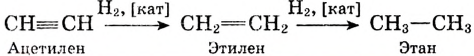
Гидрированием ненасыщенные углеводороды превращают в насыщенные
Реакцию присоединения атомов водорода называют реакцией гидрирования.
Опыт. Пропустим газ этилен или ацетилен в колбу с бромной водой. Вскоре наблюдаем её обесцвечивание, то есть происходит присоединение молекул брома по кратным связям молекул этилена и ацетилена.
В случае с ацетиленом присоединяются две молекулы брома. (Почему?)
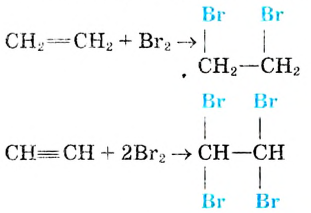
Реакция с бромной водой также используется для обнаружения в молекуле кратной связи.
Итак, ацетилен и этилен — это вещества с высокой химической активностью.
Как для ненасыщенных соединений для них характерны реакции присоединения. Разный состав молекул и разная кратность углерод-углеродных связей обусловливают различия в протекании этих реакций для этилена и ацетилена.
Применение этилена и ацетилена: Этилен и ацетилен — это многотоннажные промышленные продукты. Они об разуются в процессе переработки углеводородов, содержащихся в нефти. Из эти лена получают многие ценные продукты Это, прежде всего, полиэтилен, его используют в производстве пластмассы. Из этилена получают также этиловый спирт, он нашёл применение в производстве ценных органических продуктов. Продукт присоединения хлора к этилену — дихлорэтан — растворитель и средство для уничтожения вредителей сельскохозяйственных культур. А продукт присоединения хлороводорода — хлорэтан — анестезирующее вещество.
Этилен и ацетилен — химически активные соединения
Этилен и ацетилен — ценное химическое сырьё
Нефтепродукты — это источник получения этилена и ацетилена
Фрукты и овощи выделяют этилен в процессе созревания. Ты, наверное, заметил, если зелёные помидоры положить в пакет вместе с красными, то вскоре они также покраснеют. Это происходит под воздействием этилена, его выделяют спелые помидоры. Поэтому этилен используют для ускорения созревания овощей и фруктов. Некоторые соединения обладают способностью разлагаться с образованием этилена. Если такое соединение внести в растение в период созревания плодов, то этот процесс можно ускорить благодаря выделению этилена.
С открытием способа получения ацетилена из карбида кальция в конце XIX в. его начали использовать для освещения. Впрочем, эта сфера применения не получила развития, поскольку взрывы смеси ацетилена с воздухом нередко приводили к несчастным случаям.
Благодаря высокой теплотворной способности ацетилен используется для газосварки металлов. Ацетилен-кислородное пламя имеет температуру 2800 °С и легко плавит сталь (рис. 90).
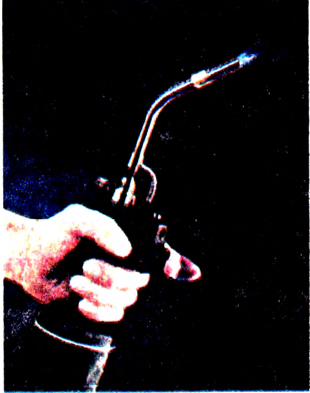
Рис. 90. Ацетиленовая горелка
Ацетилен — исходный продукт для производства пластмасс и синтетического каучука, сырьё для синтеза уксусной кислоты.
Выводы:
- Этилен и ацетилен — ненасыщенные углеводороды. В молекуле этилена атомы углерода соединяются двойной, а в молекуле ацетилена — тройной связью.
- Химическая активность этилена и ацетилена обусловлена ненасыщенным характером химических связей.
- Этилен и ацетилен горят светящимся пламенем, окисляются активными окислителями, вступают в реакции присоединения. Используя реакцию гидрирования, ненасыщенные углеводороды можно преобразовать в насыщенные.
- Этилен используют для производства пластмассы, других органических веществ и материалов.
- Из ацетилена синтезируют ценные органические вещества, используют при сварочных работах.
Полиэтилен
Состав и строение полиэтилена: Молекулы этилена обладают способностью вступать в реакцию соединения между собой, образуя длинные цепи с высокими значениями молекулярных масс. В результате образуется полимер.
Процесс последовательного соединения молекул низкомолекулярного вещества с образованием высокомолекулярного называют полимеризацией (от греч. 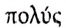 — многочисленный и
— многочисленный и  — часть).
— часть).
Полиэтилен образуется в результате реакции полимеризации этилена
В результате полимеризации этилена образуется полимер этилена полиэтилен:
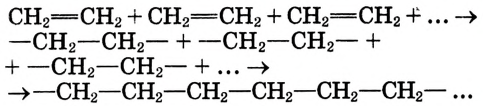
Или в сокращённом виде:
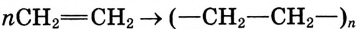
Этилен Полиэтилен
Реакция протекает в условиях высокого давлении и температуры при наличии катализатора.
Исходные низкомолекулярные вещества называют мономерами (от греч.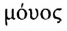 — один). Этилен — мономер в реакции полимеризации.
— один). Этилен — мономер в реакции полимеризации.
В структуре полимера можно выделить фрагменты, повторяющиеся по всей длине цепи, в полиэтилене это группы 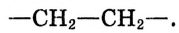
Группы атомов, которые повторяются и составляют основу химического строения полимерной цепи, называют мономерными звеньями.
Число 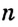 в формуле полимера, показывающее, сколько мономерных звеньев соединяется, называют степенью полимеризации.
в формуле полимера, показывающее, сколько мономерных звеньев соединяется, называют степенью полимеризации.
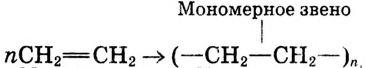
Мономер Полимер
Степень полимеризации
В массе полимера имеются молекулы длинные и короткие, с высшей и низшей степенями полимеризации, соответственно с большей и меньшей молекулярными массами. Поэтому принято говорить о средней молекулярной массе полимера.
Свойства полиэтилена: На ощупь полиэтилен кажется жирным, напоминает твёрдый парафин. Причина — в сходстве состава и строения этих веществ: парафин относится к высшим углеводородам  в его структуре, как и в структуре полиэтилена, повторяются группы
в его структуре, как и в структуре полиэтилена, повторяются группы 
Полиэтилен — твёрдое вещество белого цвета, но легко окрашивается в различные цвета, не тонет в воде. Плавится в пределах 102—105 °С или 125—137 °С, в зависимости от способа получения полимера.

Рис. 91. Упаковочную пленку из полиэтилена изготовляют выдавливанием расплавленного полимера через кольцеобразное отверстие. В полимерную трубу накачивают воздух
Процесс плавления полимеров имеет свои особенности. Это обусловлено взаимодействием между молекулами, которые имеют значительную длину и в массе полимера образуют клубки. При нагревании в расплавленное состояние переходят прежде всего менее короткие молекулы, потом — длинные, поэтому у полимеров широкий интервал температур плавления, а не точка плавления, как у низкомолекулярных веществ.
В расплавленном состоянии полиэтилену можно придать любую форму, которая сохраняется после охлаждения полимера (рис. 91). Эту особенность называют термопластичностью.
Полиэтилен — достаточно прочный материал. Плёнку из полиэтилена можно согнуть, смять, но трудно разорвать. Полиэтилен не проводит электрический ток. Устойчив к кислотам, щелочам, бромной воде, раствору перманганата калия, чем похож на насыщенные углеводы, к которым, собственно, и относится по своему строению.
- Полиэтилен — термопластичный полимер
- Полиэтилен — химически инертное соединение
Применение полиэтилена: Свойства полиэтилена обусловливают его широкое применение (табл. 8).
Таблица 8. Свойства и применение полиэтилена
| Свойства | Применение |
| Химическая устойчивость | Изготовление: деталей аппаратов для работы в агрессивной среде; тары для хранения химически агрессивных жидкостей; посуды и водопроводных труб, антикоррозийного покрытия |
| Водо- и газонепроницаемость | Изготовление упаковочных материалов, плёнки для теплиц |
| Электроизоляционные свойства | Изготовление изоляционных материалов для электропроводов |
Для того чтобы придать полимеру необходимые эксплуатационные свойства, то есть превратить его в пластмассу — материал, из которого можно изготавливать разнообразные изделия, к полимерной массе добавляют специальные вещества. Например, пластификаторы превращают твёрдый полимер в эластичный материал. Чтобы пластическая масса стала пористой, к ней добавляют вещества, при разложении которых выделяются газы; так получают пенопласты. Для повышения термо-, свето- и химической стойкости добавляют стабилизаторы и антиоксиданты, для окрашивания — пигменты, против наэлектризованности — антистатики; в пластмассы вводят также наполнители — кварц, мел, волокна и др., что снижает стоимость материала и улучшает его механические свойства. Благодаря разным добавкам из одного и того же полимера можно производить разные по свойствам материалы, а из них изготовлять разнообразные изделия, например детали конструкций и обувь.
Пластмасса =полимер + пластификатор + стабилизатор + антиоксидант + пигмент + антистатик + наполнитель

Рис. 92. Рис. 93.
Современный спортивный инвентарь, обувь, одежду изготовляют с использованием разнообразных полимерных материалов
Пластмассы относятся к современным материалам и широко применяются в технике, сельском хозяйстве, быту (рис, 92, 93). Это обусловлено свойствами и тем, что их использование экономически очень выгодно. В частности, низкая плотность (лёгкость), химическая стойкость, низкая теплопроводность, возможность окрашивания, высокие оптические свойства, а также возможность изменять свои свойства в широких пределах, меняя структуру полимеров.
Значительные преимущества пластмасс заключаются в технической и технологической простоте изготовления изделий, экономичности методов получения и переработки, низкой энергоёмкости данных процессов, следовательно, — высокой продуктивности производства.
Эксплуатационные недостатки пластмасс связаны преимущественно с их низкой термостойкостью, горючестью, хрупкостью. Использование полиэтилена, например, ограничивается его низкой температурой плавления.
Полиэтилен может поглощать жиры, смазочные материалы, различные загрязнения, поэтому со временем утрачивает свои свойства.
Ты ознакомился только с одним видом пластмасс, а именно — на основе полиэтилена. Промышленность выпускает огромное количество пластмасс на основе других полимеров. Это уже известные тебе полистирол, полихлорвинил, полипропилен, тефлон и др.
Выводы:
- Полиэтилен образуется в результате реакции полимеризации. В реакции полимеризации этилен является мономером, а полиэтилен — полимером.
- При наличии молекул разной длины полимер не имеет постоянных молекулярной массы и температуры плавления. Полиэтилен — термопластичный материал.
- Полиэтилен обладает химической устойчивостью, водо- и газонепроницаемостью, электроизоляционными свойствами. Для получения пластмассы к полимеру добавляют специальные вещества.
Метанол и этанол
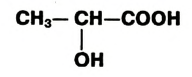
Формулы спиртов записывают сокращённо:

Метанол (метиловий спирт)

Этанол (этиловый спирт)
Тебе необходимо знать: молекулярную, структурную и электронную формулы этанола и метанола;
понимать: сущность понятия «функциональная группа»; отрицательное влияние этанола на организм;
уметь: составлять уравнения реакций спиртов, объяснять их применение.
Состав и строение молекул: Как уже отмечалось, молекулы органических соединений, кроме атомов углерода и водорода, могут содержать атомы кислорода. Представь, что в молекуле метана один атом водорода замещается гидроксильной группой —ОН. Химическое строение такого соединения — метанола — выражается структурной формулой: 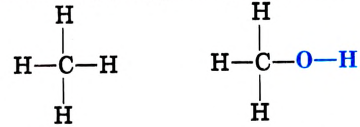
Метан Метанол
Замещаем атом водорода в молекуле этана и получаем соединение этанол:
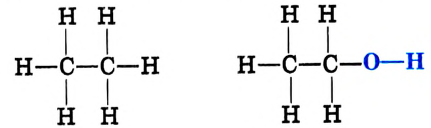
Этан Этанол
Эти соединения относятся к классу спиртов.
Поскольку в составе молекул указанных спиртов одна гидроксильная группа,
то такие спирты называют одноатомными (рис. 94).

Рис. 94. Масштабная модель молекулы метанола
Учитывая четырёхвалентность атомов углерода и двухвалентность атомов кислорода, запишем электронные формулы простейших спиртов метанола и этанола:

Метанол Этанол
Атом кислорода как более электроотрицательный оттягивает на себя электронную плотность связи О—Н. В результате такого смещения на атоме водорода образуется частичный положительный заряд, а на атоме кислорода — частичный отрицательный заряд (обозначается греческой буквой  — «дельта»):
— «дельта»):
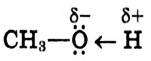
В таком случае говорят, что связь — поляризованная, молекула — полярная. Полярность спиртов влияет на их физические и химические свойства.
Физические свойства метанола и этанола: В стандартных условиях метанол и этанол — жидкости, легче воды, имеют специфический запах; как полярные соединения хорошо растворимы в полярном растворителе — воде. 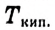 метанола равняется 65
метанола равняется 65 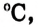 этанола — 78
этанола — 78 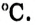
Молекулы метанола и этанола — полярные
Химические свойства метанола и этанола:
Реакция полного окисления: Спирты, как и все органические соединения, горят. Метанол и этанол мгновенно загораются при поджигании и горят синеватым, почти незаметным пламенем с выделением большого количества теплоты. Происходит реакция полного окисления:
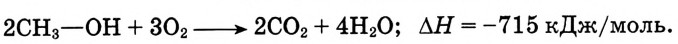
Реакции замещения: Поскольку электронная плотность связи О—Н смещена к атому кислорода, то атом водорода становится более подвижным и легче отщепляется. Под воздействием активных металлов, таких как натрий, калий, магний, алюминий, происходит замещение атома водорода гидроксильной группы атомом металла.
Опыт. В пробирку с этиловым спиртом кладём кусочки натрия. Сразу же происходит реакция с выделением газа — водорода.
В результате взаимодействия образуется также этилат натрия:

Этилат натрия
Каплю полученного раствора переносим из пробирки на стекло и выпариваем — на стекле образуются кристаллы этилата натрия.
Реакции спиртов протекают с разрывом связи
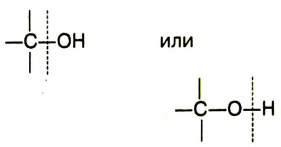
Реакции спиртов могут протекать и с отщеплением гидроксильной группы.
Спирты взаимодействуют с галогеноводородами. Например, если сухой хлороводород пропускать через спирт, протекает реакция замещения гидроксильной группы атомом галогена:
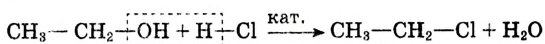
Хлорэтан
Итак, ты убедился, что свойства (функции) спиртов определяются наличием гидроксильной группы. Такая группа называется функциональной. Молекулы органических соединений могут иметь одну, несколько разных или одинаковых функциональных групп.
Физиологическое действие метанола и этанола. Метанол — очень ядовитая жидкость. Попадание в организм метанола объёмом 10 мл приводит к слепоте, а 25 мл — к смерти.
Метанол и этанол — очень похожие жидкости, различают их только химическим способом или по температуре кипения. Случается, что люди по ошибке употребляют метанол вместо этанола, это приводит к тяжёлым последствиям.
По действию на организм этанол является наркотиком, который в небольших дозах вызывает опьянение, а в значительных — провоцирует даже смерть. Злоупотребление напитками, содержащими этанол (иначе — алкоголь), приводит к страшному заболеванию — алкоголизму.
Группу атомов, определяющих характерные химические свойства (функции) вещества, называют функциональной группой
Употребление алкоголя очень опасно для молодого организма
В особенности алкоголь опасен для молодого организма. Даже небольшие дозы
сказываются на скорости реакции, способности сосредоточиться или выполнять умственную работу. Большие дозы алкоголя действуют как яд на все системы человеческого организма. Специфическое изменение настроения после употребления алкоголя, возбуждение крайне обманчивы, так как затем наступает фаза угнетения центральной нервной системы, физическая и психическая заторможённость.
У молодёжи алкоголизм развивается быстрее, поскольку в неокрепшем организме процессы обмена протекают интенсивнее.

Рис. 95. Подготовка винограда к изготовлению вина в Древнем Египте

Рис. 96. Установка для дистилляции спирта
Применение метанола и этанола: Впервые метанол, или метиловый спирт, получен в XVII в., а изучен — в первой половине XIX в. Его также называют древесным спиртом по первому из известных методов производства — сухой перегонке древесины.
Этиловый спирт, этанол, винный спирт, алкоголь — названия-синонимы одного соединения, которое является основой алкогольных напитков и наиболее известным из класса спиртов. Археологические раскопки подтверждают, что уже древнейшие цивилизации умели изготавливать вино и пиво (рис. 95, 96). Похоже, что алкоголь стал первым соединением, синтезированным человеком. Впервые в литературе упоминается о собственно этиловом спирте как «горючей воде», полученной перегонкой вина, ещё в VIII в., а элементный состав этанола был определён в начале XIX в.
Метанол и этанол — растворители. Это их свойство используется в органическом
синтезе и лабораторной практике. Этанол как растворитель применяется в фармацевтике, медицине (экстрагирование, приготовление настоек и др.), пищевой промышленности (рис. 97).

Рис. 97. Этанол применяется в фармацевтике как растворитель
В результате химических превращений из этих спиртов получают вещества, являющиеся исходными для производства пластмасс и каучука.
Этанол используется в синтезе уксусной кислоты, а в смеси с бензином — как горючее.
- К одноатомным спиртам относятся соединения, в которых углеводородная группа соединяется с одной функциональной гидроксильной группой.Функциональная группа определяет свойства веществ.Спирты — полярные соединения. Электронная плотность связи С—О смещена к электроотрицательному кислороду.Метанол и этанол горят с выделением большого количества теплоты. По гидроксильной группе спирты вступают в реакции замещения с разрывом связей О—Н и С—ОН.
- Метанол и этанол используют как растворители в органическом синтезе; этанол — в пищевой промышленности, фармацевтике, медицине. Спирты — исходные вещества для производства пластмасс и каучука. Метанол и этанол (в больших количествах) — ядовиты.
Глицерин
Глицерин-трёхатомный спирт
Состав и строение молекулы: Кроме одноатомных спиртов, содержащих в молекуле одну функциональную гидроксильную группу, выделяют многоатомные спирты, в состав которых входят две или несколько гидроксильных групп. Важнейший из них глицерин (употребляют также название глицерол) — трёхатомный спирт. Структурная формула глицерина
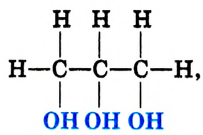 или сокращённо
или сокращённо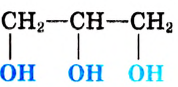
Физические свойства глицерина: Это густая сиропообразная жидкость без запаха и цвета, сладкая на вкус, хорошо растворима в воде. Свойства глицерина отражает его название — «масличный сахар», известное в XVIII в., когда глицерин впервые получили из оливкового масла.
Глицерин-от греч.  сладкий
сладкий
ЛАБОРАТОРНЫЙ ОПЫТ 15
Растворимость глицерина в воде:
Смешай в пробирке воду и глицерин (по 1 мл). Добавь к смеси ещё 1 мл глицерина. Растворяется ли он? Сделай вывод о растворимости глицерина в воде.
Химические свойства глицерина: Наличие гидроксильных групп определяет сходство глицерина с одноатомными спиртами. Он вступает в те же реакции, но при участии трёх гидроксильных групп.
Реакция полного окисления (горения) протекает, как и у других органических веществ, с образованием углекислого газа и воды.
Реакция замещения: Глицерин вступает в реакцию замещения с металлическим натрием.
Опыт. В пробирку с глицерином опустим кусочек натрия, нагреем. Реакция протекает с выделением водорода.
Свойства глицерина обусловлены наличием в молекуле трёх функциональных гидроксильных групп
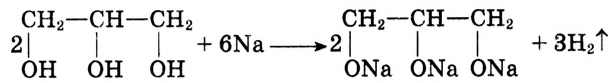
Реакция с гидроксидами металлов: В отличие от одноатомных многоатомные спирты взаимодействуют с гидроксидами щелочных и тяжёлых металлических элементов. В результате реакции глицерина с гидроксидом меди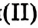 образуется раствор синего цвета. Продукт реакции — соединение сложного строения, поэтому уравнение реакции не записываем.
образуется раствор синего цвета. Продукт реакции — соединение сложного строения, поэтому уравнение реакции не записываем.
Применение глицерина: Глицерин — это продукт, имеющий широкое применение. Благодаря гигроскопичности используется в парфюмерии и фармацевтике как смягчающее средство или основа мазей, добавка к мылу, в пищевой промышленности — как добавка к напиткам (ликёрам). В кожевенном производстве и текстильной промышленности — при обработке пряжи и кожи для их смягчения и эластичности. Из глицерина получают взрывчатое вещество нитроглицерин, из которого изготавливают динамит. Нитроглицерин обладает сосудорасширяющим действием, в виде лекарства применяется при сердечных заболеваниях (рис. 98).
- Глицерин — трёхатомный спирт.Глицерину свойственны реакции, типичные для одноатомных спиртов, а также обусловленные наличием нескольких гидроксильных групп.Реакцию глицерина с гидроксидом меди
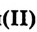 используют для аналитического определения глицерина.Глицерин применяют в кожевенной, пищевой, текстильной промышленности, для производства мыла, косметических кремов, лекарств.
используют для аналитического определения глицерина.Глицерин применяют в кожевенной, пищевой, текстильной промышленности, для производства мыла, косметических кремов, лекарств.
Уксусная кислота
Состав и строение молекулы: Характерный запах столового уксуса знаком всем. Он обусловлен уксусной кислотой 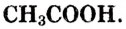 Структурная и электронная формулы уксусной кислоты:
Структурная и электронная формулы уксусной кислоты:

Это соединение относится к классу карбоновых кислот, которые характеризуются наличием функциональной карбоксильной группы —СООН.
С некоторыми карбоновыми кислотами ты уже ознакомился. Ощущение жжения после укуса муравья объясняется муравьиной кислотой в составе яда, выделяемого насекомым. Масляная кислота придаёт неприятный запах прогорклому сливочному маслу, выделяется потовыми железами человека. Столовый уксус — это раствор уксусной кислоты. В квашеных огурцах и капусте, кислом молоке содержится молочная кислота, в цитрусовых — лимонная (рис. 99).

Рис. 99. Карбоновые кислоты содержатся во многих пищевых продуктах
* Международное научное название — этановая кислота.
Физические свойства уксусной кислоты:
Уксусная кислота — бесцветная жидкость, летучая, с резким специфическим запахом, растворяется в воде в любых пропорциях, раствор кислый на вкус. В быту известна в виде 3—9-процентного водного раствора (столовый уксус) или 30-процентного водного раствора (уксусная эссенция).
Химические свойства уксусной кислоты:
Эти свойства обусловлены наличием функциональной карбоксильной группы.Электронная плотность связи О—Н смещается к атому кислорода как более электроотрицательному элементу
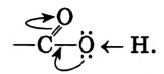
В результате связь О—Н поляризуется, атом водорода приобретает дополнительную подвижность (способность отщепляться), что и обусловливает кислотные свойства уксусной кислоты.
Электролитическая диссоциация: Чтобы убедиться в кислотных свойствах уксусной кислоты, проведи следующий опыт.
В результате отщепления атома водорода карбоксильной группы уксусная кислота проявляет кислотные свойства
Степень диссоциации уксусной кислоты очень низкая: в растворе объёмом 1 л и содержанием 0,1 моль кислоты при н. у. всего три молекулы из ста миллионов распадаются на ионы водорода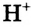 и ацетат-ионы
и ацетат-ионы 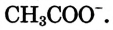 Следовательно, уксусная кислота — слабый электролит, поэтому в ионных уравнениях реакций её формулу записывают в молекулярном виде.
Следовательно, уксусная кислота — слабый электролит, поэтому в ионных уравнениях реакций её формулу записывают в молекулярном виде.
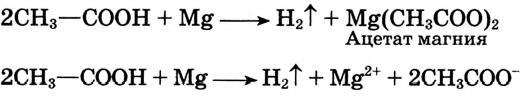
Взаимодействие с металлами, щелочами, основными оксидами, солями: С этими соединениями уксусная кислота реагирует так же, как неорганические кислоты.
Употребляется также название уксусной кислоты-ацетатная кислота. Соли ацетатной кислоты ацетаты.
В результате реакции между уксусной кислотой и магнием образуются водород и соль (ацетат магния). Ацетаты — общее название солей уксусной (ацетатной) кислоты.
Уксусная кислота реагирует со щёлочью, образуя соль и воду:
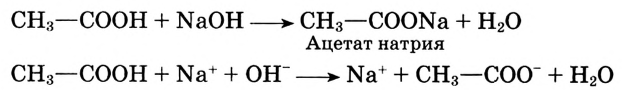
Проверь на опыте взаимодействие уксусной кислоты с основным оксидом. Напиши уравнение реакции.
Уксусная кислота — слабая, но может вытеснять ещё более слабые кислоты из их солей, например карбонатов.
Взаимодействие со спиртами: Как представитель класса карбоновых кислот уксусная кислота взаимодействует со спиртами. Если к смеси этилового спирта с серной кислотой (это катализатор реакции) добавить уксусную кислоту и смесь нагреть, то появляется приятный эфирный запах. Это образуется этиловый эфир уксусной кислоты — вещество, которое относится к классу сложных эфиров (рис. 101):
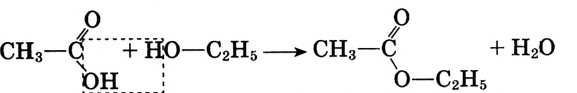
Этиловый эфир уксусной кислоты
Рис. 101. Масштабная модель молекулы метилового эфира уксусной кислоты
Происходит реакция эстерификации.Сложные эфиры — очень распространённые соединения. Запах фруктов, цветов, специй обусловлен преимущественно сложными эфирами (рис. 102). Обычно эфиры имеют приятный запах. Промышленность производит разнообразные синтетические эфиры. Из них изготавливают эссенции, которые добавляют к прохладительным напиткам, конфетам, кремам, парфюмерным и косметическим изделиям. Например, этиловый эфир уксусной кислоты используют как ароматизатор мыла.

Рис. 102. Запах специй обусловлен преимущественно эфирами
Применение уксусной кислоты: Уксусная кислота в виде винного уксуса известна людям издавна, поскольку образуется в результате уксуснокислого брожения (скисания) вина. Но получили её в почти чистом виде лишь в XVIII в. В начале XIX в. был определён состав уксусной кислоты, а её структурная формула — в середине XIX в.
В больших количествах уксусная кислота используется в органическом синтезе, при производстве искусственного волокна, лекарственных препаратов, химических средств защиты растений. Она имеет широкое применение как растворитель, а в пищевой промышленности — как средство для консервирования и приправа.
Выводы:
- Уксусная кислота относится к классу карбоновых кислот. Молекулы карбоновых кислот содержат функциональную карбоксильную группу, соединённую с углеводородной группой.Карбоксильная группа поляризована, электронная плотность связи О—Н смещена к более электроотрицательному атому кислорода, поэтому облегчается отщепление атома водорода.Уксусная кислота взаимодействует с металлами, щелочами, солями, спиртами.Уксусная кислота — это продукт, широко используемый в разных отраслях хозяйства и для бытовых потребностей.
Жиры
Состав и строение молекул: Сложные эфиры могут образовываться различными карбоновыми кислотами и спиртами. Но наибольшее значение имеют те, которые образованы трёхатомным спиртом глицерином и высшими карбоновыми кислотами. К последним относятся, например, стеариновая кислота 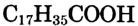 и олеиновая кислота
и олеиновая кислота 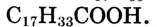 Первая — насыщенная кислота, вторая — ненасыщенная, в её углеводородной части имеется двойная связь между атомами углерода, поэтому в молекуле олеиновой кислоты на два атома водорода меньше:
Первая — насыщенная кислота, вторая — ненасыщенная, в её углеводородной части имеется двойная связь между атомами углерода, поэтому в молекуле олеиновой кислоты на два атома водорода меньше:
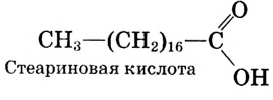
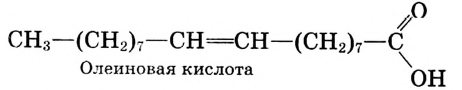
Высшие карбоновые кислоты содержат не менее 6 атомов Углерода
Если углеводородную группу молекулы карбоновой кислоты обозначить R, то формулу кислоты можно записать в общем виде:
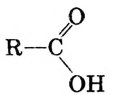
Жиры — эфиры глицерина и высших карбоновых кислот
Образование жира можно представить в виде уравнения реакции эстерификации:
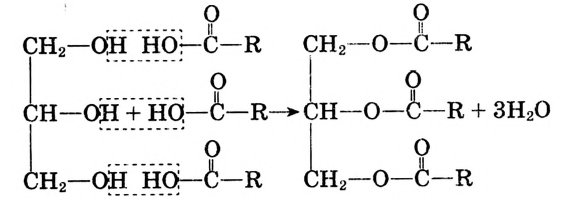
Глицерин Карбоновая кислота Жир
Химическую природу жиров начали изучать в первой половине XIX в. Впервые жир тристеарин синтезировал французский химик М. Бертло (1854 г.).
Физические свойства жиров: Состав и строение углеводородных т рупп влияют на свойства жиров.
Вот как, например, изменяются их температуры плавления:
| Состав углеводородной группы | Название жира | 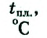 |
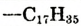 |
Тристеарин | 65 |
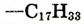 |
Триолеин | -4 |

Бертло Пьер Эжен Марселей (1827—1907)
Французский химик, член Парижской АН. Один из основателей синтетической органической химии. Синтезировал ацетилен, бензол, фенол, метан, жиры и другие соединения, изготовил бездымный порох. Автор трудов в области термохимии, химической кинетики, агрохимии, истории химии. Общественный деятель, педагог
Как видим, жир, образованный насыщенной кислотой, твёрдый в стандартных условиях, а ненасыщенной кислотой — жидкий. Жидкие растительные жиры также называют растительными маслами (рис. 103). В состав масел (подсолнечного, кукурузного, оливкового и др.) входят остатки преимущественно ненасыщенных кислот, в состав животных жиров (говяжьего, бараньего и др.) — остатки насыщенных кислот. Сливочное масло содержит смешанные эфиры насыщенных и ненасыщенных кислот.

Рис. 103. Растительные жиры
Жиры легче воды и нерастворимы в ней, но растворяются в органических растворителях.
Химические свойства жиров:
Реакция окисления: При длительном хранении на воздухе под действием тепла и света жиры портятся, приобретают неприятные запах и вкус. Это результат окисления жиров, сопровождается этот процесс образованием свободных карбо-новых кислот и других кислородсодержащих органических соединений, часто вредных для здоровья.
Появление неприятного запаха, вкуса или цвета жира свидетельствует об окислении и непригодности для питания
Химическим способом растительное масло можно превратить в твёрдый жир
Реакция присоединения: В отличие от твёрдых молекулы жидких жиров имеют двойные углерод-углеродные связи. Как ты уже знаешь, по месту двойной связи возможна реакция присоединения, в частности атомов водорода (реакция гидрирования). В результате ненасыщенное соединение становится насыщенным, а жидкий жир — твёрдым.
Гидрирование жиров происходит по следующей схеме:
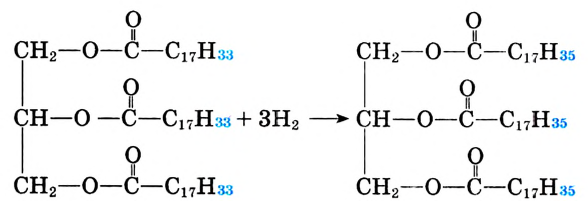
Триолеин Тристеарин
Гидролиз (от греч.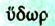 — вода
— вода  — разложение) — это реакция обмена между веществом и водой. В этом случае говорят, что вещество гидролизирует
— разложение) — это реакция обмена между веществом и водой. В этом случае говорят, что вещество гидролизирует
Процесс гидрирования жиров используется в производстве маргарина (от греч. 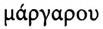 — жемчужина»). Негидрированные жиры легко окисляются по двойным связям, а гидрирование замедляет эти процессы. Кроме того, можно производить твёрдые жиры, похожие на сливочное масло. На маргарин перерабатывают дешёвые жидкие масла, рыбий и китовый жиры. Твёрдые жиры имеют преимущества перед жидкими, поскольку не содержат двойных связей. Следовательно, они медленнее окисляются, их легче транспортировать, фасовать и т. д.
— жемчужина»). Негидрированные жиры легко окисляются по двойным связям, а гидрирование замедляет эти процессы. Кроме того, можно производить твёрдые жиры, похожие на сливочное масло. На маргарин перерабатывают дешёвые жидкие масла, рыбий и китовый жиры. Твёрдые жиры имеют преимущества перед жидкими, поскольку не содержат двойных связей. Следовательно, они медленнее окисляются, их легче транспортировать, фасовать и т. д.
Чтобы гидрированный жир был пригоден для употребления, к нему добавляют вкусовые, ароматические вещества, красители.
Реакция гидролиза: Это очень важная реакция жиров.Жиры гидролизируют с образованием трёхатомного спирта глицерина и карбоновых кислот:
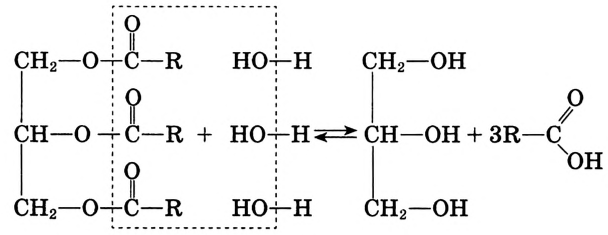
Если гидролиз жира проводить при наличии щёлочи, то образуется соль соответствующей карбоновой кислоты. Соли высших карбоновых кислот называют мылами.
Стеарат натрия — основа твёрдого мыла
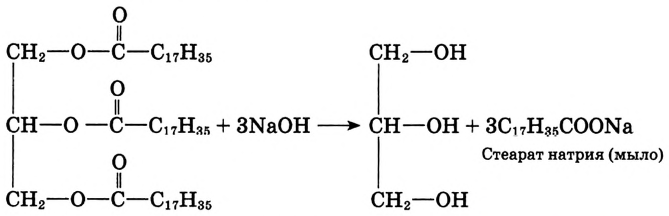
Поскольку в результате щелочного гидролиза жира образуется мыло, то эту реакцию называют омылением жира.
Биологическое значение жиров: Наряду с белками и углеводами жиры — биологически активные вещества. Они входят в состав клеток растительных и животных организмов и являются для них источником энергии. При окислении 1 г жира выделяются 37,7 кДж энергии, что вдвое больше, чем при окислении 1 г белка или углевода.

Рис. 104. Подсолнечник — основной источник растительного масла в России
Основное количество жиров, ходимых человеку, содержится в мясе, рыбе, молочных и зерновых продуктах. Если в организм человека с пищей поступает больше энергии, чем расходуется, то образуются и откладываются в тканях организма жирообразные вещества. Таким образом аккумулируется энергия.
Согласно данным современной медицины чрезмерное употребление жиров, образованных насыщенными кислотами, то есть животных жиров, может привести к накоплению веществ, затрудняющих движение крови в артериях, ответственных, в частности, за снабжение кровью мозга. Более полезными считаются жиры, образованные ненасыщенными кислотами, то есть растительные масла. В подсолнечном масле, например, массовая доля ненасыщенных карбоновых кислот составляет 91 % (рис. 104).
Выводы:
Жиры — это сложные эфиры глицерина и высших карбоновых кислот.Образование твёрдых жиров связано с насыщенными карбоновыми кислотами, а жидких жиров — с ненасыщенными. Жиры вступают в реакции окисления, гидрирования, гидролиза. Гидрированием жидких жиров получают маргарин.Гидролизом (омылением) жиров получают мыло.Жиры — биологически активные вещества.

Рис. 105. Цветёт рапс — источник технического масла

Рис. 106. Биодизельное топливо получают из рапсового масла
Углеводы и глюкоза
Прежде ты изучал химические реакции, в результате которых одни органические соединения превращались в другие или окислялись до углекислого газа и воды. В природе постоянно происходит обратный процесс: из углекислого газа и воды образуются органические вещества, из которых состоят растительные организмы. Например, под влиянием солнечнои энергии в зеленых листках растении протекает реакция фотосинтеза, в результате образуется глюкоза (рис. 107). В процессе принимает участие зелёный пигмент хлорофилл, поглощающий солнечную энергию. В общем виде процесс фотосинтеза выражается уравнением:

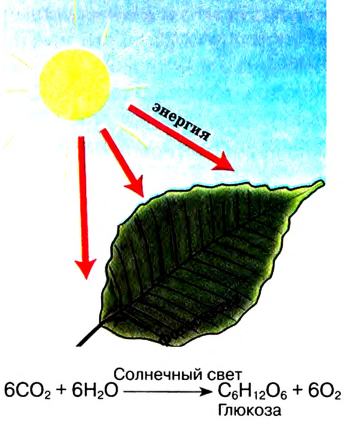
Рис. 107. Глюкоза образуется в растениях в процессе фотосинтеза
В растениях из глюкозы образуются сахароза, крахмал и целлюлоза. Эти соединения относятся к классу углеводов. Это название сложилось исторически, поскольку первые из изученных соединений данного класса содержали в молекулах, кроме атомов углерода, атомы водорода и кислорода в соотношении Н : О как 2 : 1, то есть аналогично воде — отсюда «углеводы».
— отсюда «углеводы».
Состав и строение молекулы: Молекулярная формула глюкозы 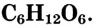 Молекула глюкозы, сложное строение которой мы не рассматриваем, содержит пять гидроксильных групп —ОН.
Молекула глюкозы, сложное строение которой мы не рассматриваем, содержит пять гидроксильных групп —ОН.
Физические свойства глюкозы: Глюкоза широко распространена в природе. Это бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус. В свободном состоянии глюкоза содержится во многих фруктах, в частности винограде (отсюда название глюкозы — виноградный сахар), в мёде, имеется она в корнях, листках и цветках растений, в крови человека и животных (до 0,1 %) (рис. 108).
Рис. 108. Я. ван Утрехт. Натюрморт с виноградом
Химические свойства глюкозы. Реакция окисления: В результате полного окисления глюкозы сильными окислителями образуются углекислый газ и вода.
Взаимодействие с гидроксидом меди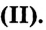
Поскольку молекула глюкозы содержит функциональные гидроксильные группы, можно предположить, что это вещество будет вступать в реакцию, характерную для многоатомных спиртов.
В процессе скисания молока, квашения капусты глюкоза превращается в молочную кислоту
Реакция брожения: Из химических свойств глюкозы следует выделить реакции брожения. Этот вид химического взаимодействия протекает под воздействием катализаторов — ферментов, которые вырабатываются микроорганизмами. Например, под влиянием ферментов дрожжей и без доступа воздуха глюкоза превращается в этиловый спирт, — происходит спиртовое брожение.
Процесс можно упрощённо выразить следующим уравнением:
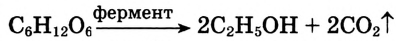
Применение и биологическое значение глюкозы: Человеческий организм легко усваивает глюкозу и использует её как источник энергии, которая выделяется при окислении глюкозы в клетках. Суммарно этот процесс можно выразить уравнением:
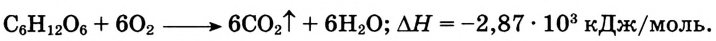
Как питательное вещество глюкоза используется в медицине для поддержания жизнедеятельности ослабленного организма (рис. 109). Её раствор вводят непосредственно в кровь, поскольку именно она переносит глюкозу к клеткам организма.

Рис. 109. Глюкоза — как лекарственное средство
ВЫВОДЫ
- Глюкоза относится к классу углеводов. Глюкоза — распространённое в природе соединение,растениях в процессе реакции фотосинтеза.Как многоатомный спирт глюкоза взаимодействует с меди
 Важной реакцией глюкозы является брожение. Глюкоза — биологически активное вещество.
Важной реакцией глюкозы является брожение. Глюкоза — биологически активное вещество.
Сахароза
Состав молекулы: К классу углеводов относится также сахароза, или свекловичный, тростниковый сахар. Молекулярная формула 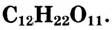 В природе синтезируется из глюкозы.
В природе синтезируется из глюкозы.
Физические свойства сахарозы: Это бесцветное кристаллическое вещество, сладкое на вкус, хорошо растворимое в воде. При нагревании до 190—200 "С кристаллы плавятся, из расплавленной массы после застывания образуется леденец, а потом — карамель.
Сахароза содержится в растениях, особенно много её в корнеплодах сахарной свёклы (16—20 %) и стеблях сахарного тростника (14—26 %)(рис. 110).


Рис. 110. Сахарный тростник и сахарная свёкла — источники сахарозы
Сахароза в виде тростникового сахара была известна ещё в древности и использовалась как лекарственное средство. Родиной сахара считают Индию.
Россия — один из крупнейших производителей сахара в мире

Бунге Николай Андреевич (1842—1915)
Окончил Киевский университет, профессор этого учебного заведения. Работал в области электрохимии и химической технологии. Исследовал электролиз растворов неорганических и органических соединений, усовершенствовал методику газового анализа. Изучал процесс производства сахара из сахарной свёклы и условия протекания этого процесса. Сделал значительный научный вклад в развитие отечественной сахарной промышленности.
В Европе сахар-сырец из сахарного тростника появился в XVI в., а из сахарной свёклы впервые был выделен в середине XVIII в. относится к крупнейшим мировым производителям сахара.
Поскольку сахароза — ценный пищевой продукт, её производят в большом количестве (рис. 111). Процесс состоит в выделении сахарозы из природного сырья (например, сахарной свёклы), очистке и кристаллизации продукта. Прежде всего, моют и измельчают корнеплоды, потом обрабатывают массу горячей водой. Как хорошо растворимое в воде соединение сахароза переходит в раствор. После извлечения сахара остаток (жом) используется как корм для скота. Чтобы очистить раствор сахарозы, его сначала обрабатывают известковым молоком, а потом пропускают через него углекислый газ. В осадке остаётся карбонат кальция, а прозрачный раствор обесцвечивают, обрабатывая оксидом ceры(IV). Далее раствор выпаривают, сахароза кристаллизуется, то есть образуется сахарный песок. Побочные продукты кристаллизации — патока и меласса — используются в производстве дрожжей, этанола, кондитерских изделий. Способом повторного растворения и кристаллизации получают сахар-рафинад, он содержит 99,9 % сахарозы.
Важным показателем для производства сахара является сахаристость свёклы. Селекционеры работают над новыми сортами этой культуры с высоким содержанием сахара. Сахаристость снижается при длительном хранении корнеплодов, поэтому на сахарных заводах их стараются перерабатывать как можно быстрее.

Рис. 111. Общий вид сахарного завода
Выводы:
Сахароза — это углевод.Сахароза синтезируется в растениях, известна как свекловичный,тростниковый сахар.Сахароза — ценный пищевой продукт.
Крахмал
Состав и строение молекулы: Состав молекулы крахмала выражается общей формулой 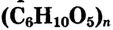
 составляет от нескольких сотен до нескольких тысяч).
составляет от нескольких сотен до нескольких тысяч).
Фрагмент полимерной цепи можно записать следующим образом:
Крахмал — природный полимер, синтезируется в растениях из глюкозы согласно реакции:
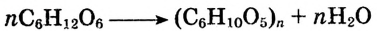
Крахмал-природный полимер
Свойства крахмала. Крахмал — белый аморфный порошок. В холодной воде — нерастворим, в горячей воде набухает, образуя клейстер. В этом можно убедиться на опыте.
Характерное химическое свойство крахмала — его реакция с иодом (иодо-крахмальная реакция).
Биологическое значение крахмала: Накопленный растениями крахмал расщепляется под действием ферментов с образованием глюкозы, в результате её окис-дения высвобождается энергия. Если растения накапливают энергию в виде крахмала, то животные — в виде гликогена (углевода, подобного по структуре крахмалу). Процесс усвоения крахмала организмом человека начинается в полости рта, с его гидролиза под действием ферментов до глюкозы. Процесс гидролиза можно представить в общем виде: к каждому из мономерных звеньев крахмала присоединяется молекула воды, полимерная цепь разрывается, образуются молекулы глюкозы:
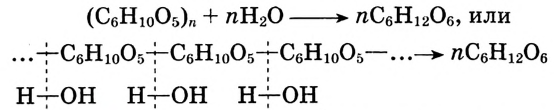
Избыток глюкозы откладывается в печени в виде «запасного» углевода гликогена. В случае необходимости, например при физических нагрузках, гликоген превращается, подобно крахмалу в растениях, в глюкозу, питающую организм.
Теперь ты знаешь, что в человеческом организме энергия запасается в виде жиров и углеводов и высвобождается в процессе их окисления. По мнению специалистов, энергетические потребности человека на 60 % должны удовлетворяться за счёт растительной пищи, в частности овощей и фруктов.
Приведённое выше уравнение реакции — суммарное. Реально гидролиз протекает постепенно, с образованием промежуточных продуктов — декстринов, молекулярная масса которых меньше, чем у крахмала. Приготовление отварного или жареного картофеля, выпекание хлеба, глаженье накрахмаленного белья связаны с частичным гидролизом крахмала и образованием декстринов. С пищей декстрины усваиваются организмом лучше^чем крахмал (рис. 113).

Рис. 113. К. Билокур. Завтрак
Выводы:
- Крахмал — природный полимер.Растения накапливают энергию в виде крахмала.В горячей воде крахмал образует клейстер.Характерной реакцией крахмала является гидролиз.Для выявления крахмала используют иодокрахмальную реакцию.
Целлюлоза
Состав и строение молекул целлюлозы: Из звеньев состава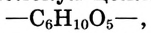 как и у крахмала, состоят цепные молекулы другого природного полимера — целлюлозы, или клетчатки.
как и у крахмала, состоят цепные молекулы другого природного полимера — целлюлозы, или клетчатки.
Целлюлоза (от лат. celula — ячейка, клетка) — основное вещество оболочек растительных клеток

Рис. 114. Срез оболочки растительной клетки под электронным микроскопом (видна волокнистая структура целлюлозы)
Целлюлоза широко распространена в природе, поскольку из неё состоят оболочки растительных клеток. Если крахмал — источник энергии, то целлюлоза — строительный материал растений. Растительные волокна (хлопковые, конопляные, льняные) и древесина на 45 % состоят из целлюлозы. Почти чистая целлюлоза известна тебе в виде ваты и фильтровальной бумаги.
Внешний различия между этими волокнами и крахмалом очевидны, хотя полимерные цепи крахмала и целлюлозы представлены одинаковыми звеньями. В чём же причина таких различий? Общая формула целлюлозы, как и крахмала,—  Но степень полимеризации, молекулярная масса целлюлозы намного больше:
Но степень полимеризации, молекулярная масса целлюлозы намного больше: составляет 10—14 тысяч, относительная молекулярная масса — несколько миллионов.
составляет 10—14 тысяч, относительная молекулярная масса — несколько миллионов.
Кроме того, некоторые молекулы крахмала имеют разветвлённое строение, а молекулы целлюлозы — нитевидные, линейные, поэтому могут образовывать волокна (рис. 114).
Имеются и другие существенные особенности внутреннего строения, их мы не рассматриваем, но они также обусловливают различия между крахмалом и целлюлозой.
Применение целлюлозы: На протяжении столетий целлюлозу в виде древесины использовали как топливо.
При этом из целлюлозы можно получить много полезных веществ посредством химической переработки. Например, искусственный шелк, спирты, взрывчатые вещества. Из целлюлозы изготавливают бумагу. Учитывая огромное значение бумаги, можно утверждать, что развитие современной цивилизации в значительной степени связано с целлюлозой.
У жвачных животных и термитов в органах пищеварения под действием ферментов происходит гидролиз клетчатки и её усвоение (рис. 115).

Рис. 115. Жвачные животные способны усваивать целлюлозу

Рис. 116. Биомасса растений накапливает огромное количество энергии
В организме человека целлюлоза, получаемая с растительной пищей, не расщепляется, следовательно, не усваивается.
На Земле в биомассе растений, основным компонентом которой является целлюлоза, сосредоточено огромное количество энергии. Оказывается, эту энергию можно высвободить, используя продукты переработки биомассы (рис. 116). Современная наука рассматривает её как перспективное сырьё для получения углеводородов и других органических веществ. Это достигается методами биотехнологии и предполагает использование ферментов (биохимических катализаторов). Правда, стоимость полученных продуктов пока достаточно высока, но таким образом к нефти, природному газу и каменному углю — источникам органических соединений — можно отнести также биомассу.
Выводы:
Целлюлоза — углевод полимерного строения. Целлюлоза — строительный материал растений. Целлюлоза горит с выделением большого количества теплоты. Химическая переработка целлюлозы — это получение многих ценных веществ.
Аминокислоты
Примеры аминокислот:
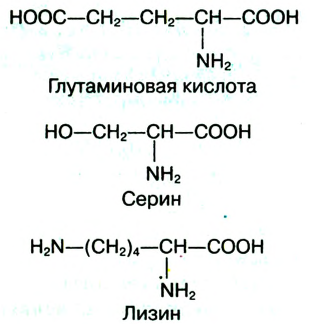
Состав и строение молекулы: Ты уже знаешь, что в состав растительных и жи-вотных организмов входят представители таких классов органических соединений, как жиры и углеводы. Не менее важными для функционирования живых организмов являются белки. Это высокомолекулярные соединения, образующиеся из аминокислот.
Впервые предположение о том, что аминокислоты являются «кирпичиками», из которых состоят белки, высказал выдающийся биохимик и химик Иван Яковлевич Горбачевский.
В чём же отличие аминокислот и кар-боновых кислот, которые ты изучал ранее? Карбоновые кислоты содержат функциональную карбоксильную группу —СООН, аминокислоты — две функциональные группы: карбоксильную и аминогруппу —
Если в молекуле уксусной кислоты 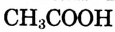 один атом водорода в метильной группе заменить аминогруппой, то образуется аминоуксусная кислота
один атом водорода в метильной группе заменить аминогруппой, то образуется аминоуксусная кислота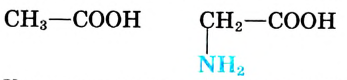
Уксусная кислота Аминоуксусная кислота
Электронная и структурная формулы аминоуксусной кислоты:
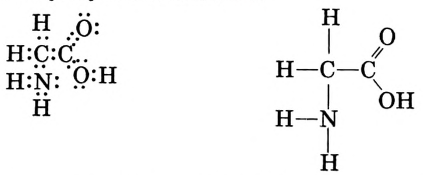
Аминоуксусная кислота — простейшая из аминокислот. Некоторые из них содержат две карбоксильные группы или две аминогруппы, гидроксильные и серосодержащие группы.
Физические свойства: Аминокислоты — бесцветные кристаллические вещества с высокими температурами плавления, большинство из них хорошо растворимы в воде.
Химические свойства: Карбоксильная и аминогруппа — противоположны по своему химическому характеру: первая
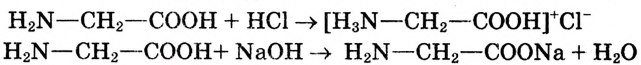
Главной особенностью аминокислот является взаимодействие молекул между собой. В реакцию вступают противоположные по своим функциям группы: карбоксильная группа одной молекулы и аминогруппа — другой. В результате реакции образуются ди-, три-, полипептиды и выделяется вода.
Связь между остатками аминокислот называют пептидной, а группу  пептидной группой.
пептидной группой.
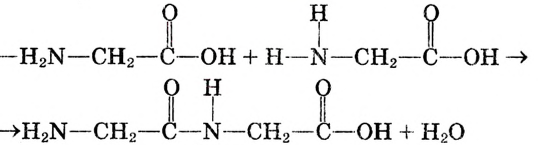
Дипептид
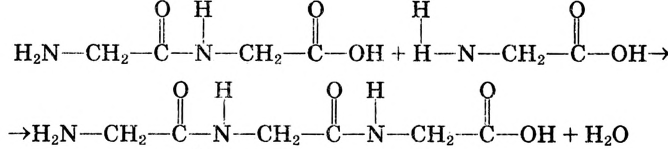
Трипептид
Именно благодаря пептидным связям аминокислоты соединяются в молекулах белков.
Биологическое значение аминокислот: В составе белков 20 аминокислот, восемь из которых незаменимые. Это название объясняется тем, что животные организмы, в отличие от растений, не способны самостоятельно синтезировать данные аминокислоты. Следовательно, необходимые для жизнедеятельности аминокислоты должны поступать в готовом виде, с пищей (рис. 117). Дефицит аминокислот может стать причиной заболевания, поэтому ослабленным людям аминокислоты, как лекарство, вводят непосредственно в кровь.Полученные синтетическим путём аминокислоты используют для подкормки скота.
Выводы:
Молекулы аминокислот содержат две функциональных группы: амино- и карбоксильную.Аминокислоты относятся к амфотерным соединениям. Образование полипептидов — важнейшее химическое свойство аминокислот.Аминокислотные остатки соединяются между собой пептидными связями.Аминокислоты имеют биологическое значение.

Рис. 117. В рыбе содержится много незаменимых аминокислот
Белки
Фишер Эмиль Герман (1852—1919)
Немецкий химик, член Берлинской АН. Научные труды посвящены химии физиологически активных веществ. Синтезировал ряд углеводов, в частности глюкозу и фруктозу. Установил, что аминокислоты связываются между собой пептидными связями, образуя полипептиды; впервые получил дипептид. Лауреат Нобелевской премии 1902 г.
Строение белков: Полимерная полипептидная цепь — основа молекулы каждого белка. Впервые синтез полипептидов осуществил немецкий учёный Э. Фишер в 1903—1907 гг.
Каждый белок имеет набор аминокислот, соединённых в определённой, присущей только ему последовательности.
Ты уже знаешь, что лишь 20 аминокислот принимают участие в построении белковых макромолекул, а количество комбинаций соединённых в разной последовательности аминокислотных остатков достигает 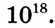 Молекулярная масса некоторых белков составляет сотни миллионов.Строение белков очень сложное и обусловлено не только последовательностью аминокислотных остатков. Длинные цепи белковых молекул скручиваются в спирали, спирали — в клубки, располагающиеся определённым образом в пространстве (рис. 118,119). В совокупности это определяет особенности каждого белка. В виду такой сложности расшифровка структуры природных белков — очень сложная задача.
Молекулярная масса некоторых белков составляет сотни миллионов.Строение белков очень сложное и обусловлено не только последовательностью аминокислотных остатков. Длинные цепи белковых молекул скручиваются в спирали, спирали — в клубки, располагающиеся определённым образом в пространстве (рис. 118,119). В совокупности это определяет особенности каждого белка. В виду такой сложности расшифровка структуры природных белков — очень сложная задача.
Свойства белков: Белки очень отличаются по своим свойствам, которые зависят от наличия в их составе остатков аминокислот с разными функциональными группами, способными вступать в характерные реакции.
Денатурация: Среди белков различают нерастворимые в воде и образующие коллоидные растворы. Ко вторым относится белок куриного яйца. Именно с этим раствором удобно проводить опыты.
Опыт. К белку куриного яйца в пробирке добавим воду, смесь размешаем. Убедимся, что образовался прозрачный раствор. Нагреваем раствор белка и наблюдаем, как он свёртывается, или денатурируется.
Именно этот процесс денатурации наблюдается при кулинарной обработке белковых пищевых продуктов — мяса, яиц, рыбы.
С химической точки зрения, денатурация — разрушение сложной структуры белка, в результате он утрачивает биологическую активность (рис. 120). Этот процесс необратимый. Поэтому, например, высокая температура опасна для человеческого организма. При этом белки теряют биологическую активность, живые клетки погибают.
Аналогично воздействие сильных кислот, например серной. В случае попадания кислоты на кожу можно получить химический ожог.
атом азота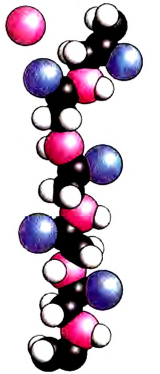
Рис. 118. Фрагмент модели полипептидной цепи
Рис. 119. Модель одной из четырёх полипептидных цепей белка гемоглобина (в центре — ион 

Рис. 120. Схема денатурации белка
Цветные реакции:
ЛАБОРАТОРНЫЙ ОПЫТ:
Цветные реакции белков
К раствору белка в пробирке добавим такой же объём раствора щёлочи и несколько капель слабого раствора сульфата меди Что происходит? Как изменилась окраска раствора? К раствору белка добавим концентрированную азотную кислоту. Белок свёртывается и постепенно окрашивается в жёлтый цвет.
Что происходит? Как изменилась окраска раствора? К раствору белка добавим концентрированную азотную кислоту. Белок свёртывается и постепенно окрашивается в жёлтый цвет.
Взаимодействие белков с концентрированной азотной кислотой и гидрок-сидом меди — это цветные реакции белков, которые используют для их аналитического определения.
— это цветные реакции белков, которые используют для их аналитического определения.
Гидролиз: Кислоты, щёлочи или ферменты (если речь идёт о живом организме) расщепляют полимерную белковую молекулу на аминокислоты. Гидролиз — это процесс, обратный образованию полипептидной цепи. В процессе гидролиза молекулы воды присоединяются в местах пептидных связей, последние разрушаются, пептидные группы замещаются карбоксильными и аминогруппами. Следовательно, белок расщепляется на отдельные аминокислоты, из которых он состоит: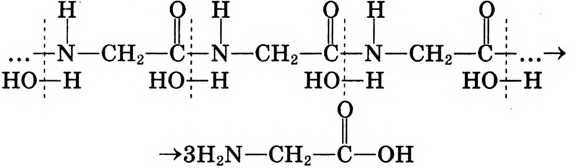
Белки могут разлагаться под действием микроорганизмов. В результате образуются не аминокислоты, а аммиак,сероводород, фенол, другие вещества с неприятным запахом. Появление запаха свидетельствует о том, что происходит процесс разложения (гниения) белка. Вспомним, насколько неприятен запах протухших яиц, несвежего мяса или рыбы. Замораживание продуктов, маринование, копчение снижают активность микроорганизмов или даже уничтожают их. Процесс разложения замедляется, и продукты сохраняются значительно дольше.
При низкой температуре процесс разложения белка замедляется

Рис. 121. С мясом организм человека получает значительное количество белков
Биологическое значение белков: Белки в составе пищи непосредственно не усваиваются организмом. Сначала они расщепляются до аминокислот под действием веществ, находящихся в пищеварительном тракте. Далее аминокислоты всасываются в кровь, которой переносятся к клеткам организма, где синтезируются белки, характерные именно для него.
Белки — основной строительный материал живых организмов. Мышцы, гемоглобин крови, волосы, кожа, ферменты имеют белковую природу.
Запас аминокислот, необходимый для нормального функционирования, может пополняться в организме человека за счёт белков пищи (рис. 121). Это в особенности важно для молодого организма в процессе роста и развития. Поэтому пища молодого человека должна содержать достаточное количество белков. Богаты белками мясо, рыба, молоко, твёрдый сыр, яйца, бобовые, орехи.
Для подкормки сельскохозяйственных животных используют белковую массу, которую производят из углеводородов нефти, природного газа или отходов переработки древесины способом микробиологического синтеза. Некоторые виды микроорганизмов способны использовать углеводороды как питательную среду и вырабатывать на её основе белковую массу.
Выводы:
- Белки — природные полимеры, образующиеся из аминокислот.Состав белков чрезвычайно разнообразен благодаря разной последовательности аминокислотных остатков.Строение белков отличается большой сложностью.Каждый белок имеет определённую последовательность остатков аминокислот.Важное биологическое значение имеет способность белков к гидролизу.Белки можно обнаружить с помощью цветных реакций.Белки — основной строительный материал клеток всех животных организмов.
Нуклеиновые кислоты
Моносахариды — общее название углеводов простого строения. Глюкоза также относится к моносахаридам
Азотистые основания:
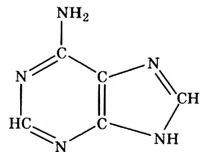
Аденин
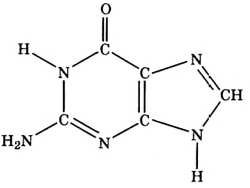
Гуанин
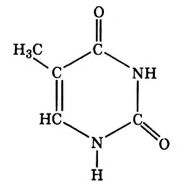
Тимин
Состав и строение молекул. Среди природных органических веществ важную роль играют нуклеиновые кислоты (НК). Они имеются в каждой живой клетке и контролируют её работу.
Впервые чистые нуклеиновые кислоты получил И. Я. Горбачевский в 90-х годах XIX в.
В начале XX в. выяснилось, что в состав НК входят азотистые основания (аденин, гуанин, тимин, урацил, цито-зин), моносахариды (рибоза 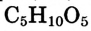 и дезоксирибоза
и дезоксирибоза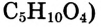 и остаток фосфорной кислоты.
и остаток фосфорной кислоты.
Установлено, что существуют два типа НК: в состав одних входит рибоза, в состав других — дезоксирибоза. Названия кислот соответственно рибонуклеиновая (РНК) и дезоксирибонуклеиновая (ДНК). Следовательно, в состав НК входят фрагменты азотсодержащих соединений, углеводов и фосфорной кислоты.
НК — полимерные соединения. В общем виде схему полимерной цепи можно представить следующим образом:
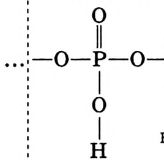 моносахарид-азотистое основание(нуклеозид)
моносахарид-азотистое основание(нуклеозид)
Нуклеотид
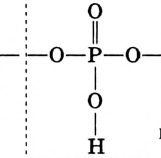 моносахарид-азотистое основание(нуклеозид)
моносахарид-азотистое основание(нуклеозид)
Нуклеотид
 моносахарид-азотистое основание(нуклеозид)
моносахарид-азотистое основание(нуклеозид)
Нуклеотид
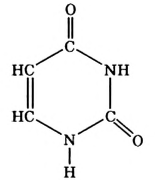 Урацил
Урацил
 Цитозин
Цитозин
Моносахариды
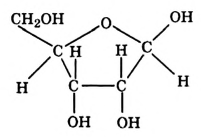 Рибоза
Рибоза
В молекуле НК азотистое основание связано с моносахаридом — этот фрагмент называют нуклеозидом. Нуклеозид, соединённый с остатком фосфорной кислоты, образует нуклеотид. Нуклеотиды являются мономерными звеньями в полимере НК.
ДНК и РНК содержат разные азотистые основания. В составе ДНК — аденин, гуанин, тимин, цитозин, РНК — аденин, гуанин, цитозин, урацил.
В макромолекулах ДНК и РНК соединяются тысячи нуклеотидов. Молекулярная масса НК составляет от нескольких сотен тысяч до нескольких миллиардов.
Двойная спираль ДНК: Представляет собой две полинуклеотидныё цепи, закрученные в двойную спираль (рис. 122). Каждое азотистое основание одной цепи направлено вглубь спирали и связано слабыми межмолекулярными связями с азотистым основанием другой цепи. Важно, что аденин всегда размещается с тимином, а цитозин — с гуанином.
Следовательно, азотистые основания как бы дополняют друг друга. Иными словами, они располагаются по принципу комплементарности.
Модель двойной спирали ДНК предложили в 1953 г. американский учёный Д. Уотсон и английский учёный Ф. Крик, их исследования были отмечены Нобелевской премией (1962 г.).
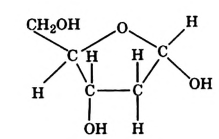 Дезоксирибоза
Дезоксирибоза

Рис. 122. Модель двойной спирали ДНК
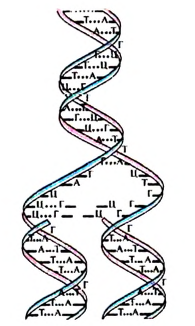
Рис. 123. Схема двойной спирали ДНК и её репликации
Биологическая роль ДНК: Открытие структуры ДНК имеет огромное научное значение, поскольку эта структура связана с функциями ДНК в организме. Двойная спираль ДНК — это хранилище наследственной информации. Она записана (закодирована) в виде последовательности азотистых оснований в полинуклеотидной цепи. Каждая тройка последовательно расположенных оснований (триплет) — это своеобразная «буква» генетического кода, единица наследственной информации; её называют кодоном.
Передача информации происходит благодаря способности ДНК к репликации (от лат. replicatio — отображение). ДНК удваивается, чтобы обеспечить дочернюю клетку полным набором соответствующих молекул. В момент деления клетки разрываются межмолекулярные связи, двойная спираль начинает раскручиваться, разделяясь на две цепи. На каждой из них строится дополнительная цепь за счёт нуклеотидов, которые поступают из окружающей среды, размещаясь по принципу комплементарности. Образуются новые связи между азотистыми основаниями. В результате происходит точное воспроизведение исходной двойной спирали (рис. 123).
Этот процесс является молекулярной основой наследственности. Любая ошибка в воспроизведении двойной спирали может стать причиной мутации.
Не менее важна ещё одна функция ДНК: она направляет синтез белка в организме. Последовательность азотистых оснований в НК определяет последовательность аминокислотных остатков в белке. Каждой аминокислоте соответствует определённый кодон. Следовательно, структура молекул НК определяет структуру молекул белков.
Выводы:
- Нуклеиновые кислоты — это природные полимеры. Мономерные компоненты НК — нуклеотиды — состоят из химически связанных нуклеозидов (азотистое основание + углевод) и остатков фосфорной кислоты.Различают два типа НК — рибонуклеиновые (РНК) и дезоксирибонуклеиновые (ДНК). Они отличаются составом углеводов и азотистых оснований.Каждая НК обладает определённой последовательностью нуклеотидов. ДНК имеет форму двойной спирали, в которой образуются межмолекулярные связи между азотистыми основаниями.Азотистые основания в ДНК располагаются по принципу комплементарное.Триплет азотистых оснований — это кодон генетической информации. Генетическая информация передаётся посредством репликации ДНК.
Природные и синтетические органические соединения

Рис. 124. Каменный уголь, как и нефть, — неисчерпаемые источники органических соединений
Ты ознакомился с важнейшими органическими веществами — представителями разных классов: углеводородов, спиртов, сложных эфиров, углеводов, аминокислот, белков, карбоновых и нуклеиновых кислот. Эти соединения отличаются по составу, строению и свойствам, но при всём разнообразии способны к взаимному превращению. Из простейших можно получить более сложные, от соединений одного класса перейти к соединениям другого.
Каковы же источники получения органических веществ? Различают органические соединения, существующие в природе либо полученные из природных веществ, а также изготовленные синтетическим способом, посредством химических превращений из других органических или неорганических веществ. К природным органическим продуктам относятся нефть, природный газ, уголь (то есть полезные ископаемые органического происхождения), а также продукты растительного (древесина, сахар, крахмал, растительные масла, натуральный каучук, хлопковое и льняное волокно) и животного (аминокислоты, белки, жиры, шерсть) происхождения (рис. 124—126). Многие органические вещества содержит планктон.

Рис. 125. Резервуар для хранения сжиженного природного газа

Рис. 126. Органические продукты природного происхождения
К синтетическим органическим продуктам относятся пластические массы, синтетические волокна и каучуки, химические средства защиты растений, лекарственные препараты, красители, мыло и другие моющие средства, фотоматериалы, ароматические, вкусовые вещества и т. д. (рис. 127—129).
Благодаря взаимным превращениям органических веществ можно проводить синтезы, направленные на получение веществ с заранее определёнными свойствами. Так, из сравнительно простых по строению углеводородов, содержащихся в нефти или каменном угле, можно синтезировать многие сложные вещества, необходимые и полезные для человека.
Синтетическая органическая химия подарила человечеству огромное количество веществ, не существующих в природе, при этом значительно более дешёвых по сравнению с полученными из природного сырья. Поинтересуйся у пожилых людей, как изменились на протяжении их жизни материалы, из которых изготовляют одежду, предметы быта, какие изменения произошли на транспорте, в строительстве, в приготовлении и хранении пищи, в стирке и чистке одежды и т. п. Ты убедишься, насколько продукты синтетической органической химии изменили нашу жизнь, сделали её комфортнее.

Рис. 127. Эти предметы с твоего письменного стола изготовлены из синтетических материалов

Рис. 128. На синтетической резине ездят все автомобили

Рис. 129. Синтетические моющие средства
Источники получения органических веществ — выделение их из природного сырья и химический синтез. Синтез даёт возможность получать вещества с заранее определёнными свойствами. Синтетическая органическая химия обеспечивает ценными веществами все отрасли общественного производства.
Что такое органические соединения
Вы изучали органические соединения, состоящие из атомов углерода и водорода — углеводороды, узнали о составе, структуре, свойствах, применении предельных, непредельных, ароматических углеводородов, об их природных источниках — газе, нефти, каменном угле.
Углеродные скелеты являются основой строения молекул и других классов органических соединений, в составе которых кроме атомов углерода и водорода содержатся атомы кислорода и азота. Наличие этих атомов придает веществам специфические свойства, отличные от свойств углеводородов.
Кислород- и азотсодержащие соединения играют ведущую роль в функционировании живых организмов (растений и животных), входят в состав пищи (это известные вам из биологии человека жиры, белки, углеводы), являются основой древесины, из которой изготовляют бумагу, натуральных и синтетических волокон, мыла, лекарств, красителей и пр.
Знакомые вам термины — спирт, уксусная кислота, эфир — это названия кислородсодержащих органических веществ сравнительно простого строения. Именно с них мы начинаем изучение нового раздела курса химии.
Предельные одноатомные спирты
Состав и строение молекул спиртов: Как уже отмечалось, в молекулы органических соединений кроме атомов углерода и водорода могут входить атомы кислорода. Представим, что в молекуле метана один атом водорода замещен гидроксильной группой. Химическое строение такого соединения — метанола — выражается структурной формулой:
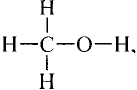 или сокращенно
или сокращенно 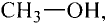 или
или 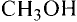
Замещая атом водорода в молекуле этана, получим соединение — этанол — такого химического строения:
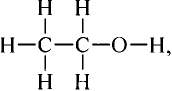 или
или 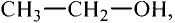 или
или 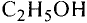
В этих соединениях углеводородные радикалы метил  и этил
и этил 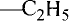 соединены с гидроксильной группой
соединены с гидроксильной группой 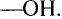 Наличие последней является признаком класса органических веществ, которые называются спиртами.
Наличие последней является признаком класса органических веществ, которые называются спиртами.
Общую формулу предельных одноатомных спиртов можно вывести из общей формулы предельных углеводородов путем замещения атома водорода на гидроксильную группу.
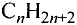 - общая формула предельных углеводородов
- общая формула предельных углеводородов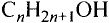 - общая формула предельных одноатомных спиртов
- общая формула предельных одноатомных спиртов
Если углеводородный радикал обозначить буквой R, общая формула спиртов записывается как 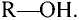
Если в состав молекул спиртов входит одна гидроксильная группа, такие спирты принадлежат к одноатомным. Далее вы узнаете о существовании многоатомных (двух-, трехатомных и т. д.) спиртов.
Учитывая четырехвалентность атомов углерода и двухвалентность атомов кислорода, запишем электронные формулы простейших спиртов метанола и этанола:
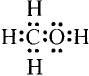 - Метанол
- Метанол
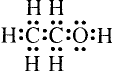 - Этанол
- Этанол
Атом кислорода как более электроотрицательного элемента оттягивает на себя электронную плотность связи  В результате такого смещения эта связь поляризуется, на атоме водорода образуется частичный положительный заряд, а на атоме кислорода — частичный отрицательный (обозначается греческой буквой дельта
В результате такого смещения эта связь поляризуется, на атоме водорода образуется частичный положительный заряд, а на атоме кислорода — частичный отрицательный (обозначается греческой буквой дельта 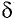 ):
):
В таком случае говорят, что молекула полярна. Полярность спиртов отражается на их физических и химических свойствах.
Предельные одноатомные спирты образуют гомологический ряд (табл. 1).
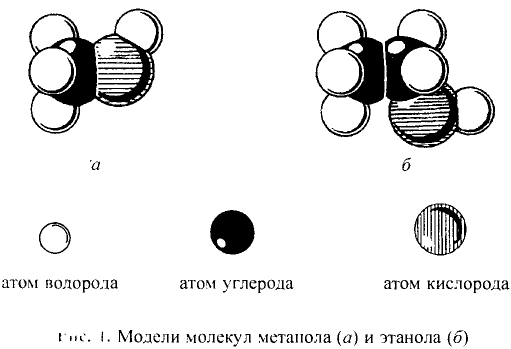

Предельным одноатомным спиртам свойственна изомерия, обусловленная строением углеродного скелета и положением гидроксильной группы.
Для спирта состава 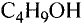 возможны изомеры:
возможны изомеры:
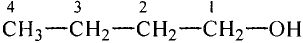 - Бутанол-1
- Бутанол-1
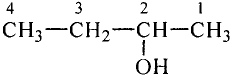 - Бутанол-2
- Бутанол-2
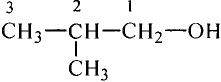 - 2-Метилпропанол-1
- 2-Метилпропанол-1
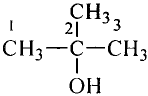 - 2-Метилпропанол-2
- 2-Метилпропанол-2
Международные названия спиртов образуют от названий соответствующих углеводородов с добавлением суффикса -ол. Чтобы дать название спирту, необходимо пронумеровать углеродную цепь, начиная от гидроксильной группы, перед названием указать место и название радикала, после названия — место гидроксильной группы.
Физические свойства метанола и этанола: Метанол и этанол при нормальных условиях жидкости. Будучи полярными соединениями, они хорошо растворимы в воде, легче воды, имеют специфический запах. Температура кипения метанола — 65 °С, этанола — 78 °С.
Вода — полярный растворитель. Вспомните, какова растворимость неполярных предельных углеводородов, сравните ее с растворимостью полярных спиртов. Сделайте вывод.
Метиловый спирт — очень ядовитое вещество, попадая в организм, 10 мл метанола вызывают слепоту, 25 мл — смерть.
Этиловый спирт по действию на орг анизм является наркотиком, который в небольших дозах вызывает опьянение, а в больших — даже смерть. Злоупотребление напитками, содержащими этанол (иначе — алкоголь), приводит к страшному заболеванию — алкоголизму.
Метанол и этанол — очень похожие жидкости, различить их можно только химическим путем или по температуре кипения. Случается, что люди ошибочно употребляют метанол вместо этанола и это приводит к трагическим последствиям.
Химические свойства метанола и этанола: Спирты, как и все органические соединения, горят. Метанол и этанол мгновенно вспыхивают при поджигании и горят синеватым, почти незаметным пламенем с выделением большого количества теплоты. Происходит реакция полного окисления:
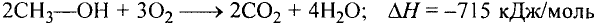
Благодаря тому, что электронная плотность связи  смещена к атому кислорода, атом водорода становится более подвижным, легче отщепляется. Под воздействием активных металлов, таких как натрий, калий, магний, алюминий, происходит замещение атома водорода на атом металла.
смещена к атому кислорода, атом водорода становится более подвижным, легче отщепляется. Под воздействием активных металлов, таких как натрий, калий, магний, алюминий, происходит замещение атома водорода на атом металла.
В пробирку с этиловым спиртом опустим кусочки натрия. Сразу же начинается реакция с выделением газа. Это водород.
В результате взаимодействия образуется также этилат натрия:

Если каплю раствора из пробирки перенести на стекло и испарить, то на стекле образуются кристаллы этилата натрия.
Реакции спиртов могут происходить и с отщеплением гидроксильной группы. Спирты взаимодействуют с галогеноводородами. Например, если сухой хлороводород пропускать через спирт или нагревать спирт с концентрированной соляной кислотой, происходит реакция замещения гидроксильной группы на галоген:
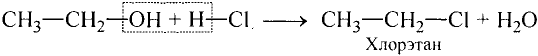
Если этанол нагревать выше 170 °С в присутствии концентрированной серной кислоты, происходит реакция дегидратации (отщепление воды), и спирт превращается в непредельный углеводород — этилен:
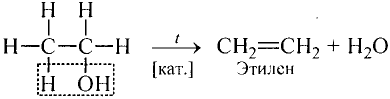
О некоторых других свойствах спиртов вы узнаете далее.
Как вы могли убедиться, свойства (функции) спиртов определяются наличием гидроксильной группы. Такая группа называется функциональной. В молекулах органических соединений могут содержаться одна или несколько одинаковых или различных функциональных групп.
Применение метанола и этанола: Метиловый спирт впервые был получен в XVII в., а изучен в первой половине XIX в. Его называют еще древесным спиртом, поскольку первым из известных методов его получения был метод сухой перегонки древесины.
Этиловый спирт, этанол, винный спирт, алкоголь — назва-ния-синонимы одного соединения, являющегося основой алкогольных напитков и наиболее известного из всех спиртов. Археологические раскопки свидетельствуют, что в эпоху древнейших цивилизаций умели изготовлять вино и пиво. Похоже, что алкоголь был первым веществом, синтезированным человеком. Первое литературное упоминание о собственно этиловом спирте как «горючей воде», полученной перегонкой вина, относится к VIII в. А элементный состав этанола был определен в начале XIX в.
Метанол и этанол — растворители. Это их свойство используется в органическом синтезе, в лабораторной практике. Этанол как растворитель находит применение в фармации, медицине (экстрагирование, изготовление настоек и пр.), пищевой промышленности.
С помощью химических превращений из этих спиртов получают вещества, являющиеся исходными для производства пластмассы и каучука.
Этанол используется для синтеза уксусной кислоты, в смеси с бензином — как горючее.
Глицерин
Состав и строение молекулы глицерина: Кроме одноатомных спиртов, то есть тех, в молекулах которых содержится одна функциональная группа, существуют многоатомные спирты, в состав которых входят две и более гидроксильные группы. К ним принадлежит глицерин — трехатомный спирт. Структурная формула глицерина
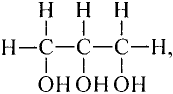 или сокращенно
или сокращенно 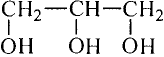
Физические свойства глицерина: Это густая сиропообразная жидкость без запаха и цвета, сладкая на вкус, хорошо растворимая в воде. Свойства глицерина отражены в его названии «масляный сахар», употребляемом в XVIII в., когда глицерин был получен впервые из оливкового масла.
Лабораторная работа 1
Опыты с глицерином
Опыт 1. Растворимость глицерина в воде. Смешайте в пробирке воду и глицерин (приблизительно по 1 мл). Добавьте к смеси еще 1 мл глицерина. Растворяется ли он? Сделайте вывод о растворимости глицерина в воде.
Химические свойства глицерина: Наличие гидроксильных групп обусловливает сходство глицерина и одноатомных спиртов, он вступает в те же реакции, но с участием трех гидроксильных групп.
Реакция полного окисления (горения) происходит, как и у других органических веществ, с образованием углекислого газа и воды.
Глицерин вступает в реакцию замещения с металлическим натрием. В пробирку с глицерином опустим кусочек натрия. Нагреем содержимое. Реакция происходит с выделением водорода.

В реакциях глицерина с галогеноводородами происходит замещение гидроксильных групп на галоген:
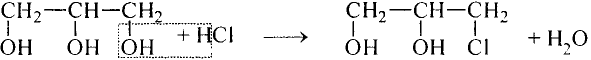
Характерной реакцией глицерина является образование раствора синего цвета с гидроксидом меди(II).
Опыт 2. Взаимодействие глицерина с гидроксидом ме-ди(П). В пробирку налейте 1 мл раствора гидроксида натрия или калия и добавьте несколько капель раствора сульфата меди(И). Наблюдайте образование осадка гидроксида меди(И). К осадку добавьте глицерин, смесь взболтайте. Наблюдайте образование прозрачного раствора синего цвета.
Продукт реакции имеет сложное химическое строение, поэтому мы не записываем уравнение реакции.
Эта химическая проба служит для определения многоатомных спиртов.
Применение глицерина: Глицерин — продукт, имеющий широкое применение. Благодаря гигроскопичности он используется в парфюмерии и фармации как смягчающее средство или основа мазей, добавка к мылу. В пищевой промышленности — как добавка к напиткам. В кожевенном производстве и текстильной промышленности — для обработки кожи и пряжи с целью их умягчения и придания им эластичности. Из глицерина получают взрывчатое вещество нитроглицерин, который используется для производства динамита. Спиртовый раствор нитроглицерина оказывает сосудорасширяющее действие и в виде лекарства используется при сердечных заболеваниях.
Фенол
Состав и строение молекулы фенола: В том случае, когда гидроксильная группа соединена непосредственно с бензольным ядром, образуется соединение фенол, представитель класса фенолов. Молекулярная формула  Структурная формула:
Структурная формула:
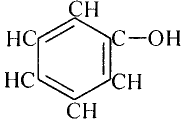
Физические свойства фенола: Фенол — кристаллическое вещество, бесцветное, имеет характерный запах. При хранении в неплотно закрытой посуде приобретает розовый цвет вследствие окисления. Фенол—легкоплавкое вещество 
Поместим пробирку с фенолом в посуду с горячей водой: вещество расплавится.
В холодной воде фенол растворяется плохо. Но если добавить в пробирку с фенолом горячей воды, наблюдается его быстрое растворение.
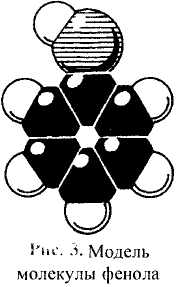
Химические свойства фенола: По наличию в молекуле фенола гидроксильной группы можно предположить сходство между фенолом и спиртами, а по наличию бензольного ядра — сходство с бензолом. Выясним это.
- Вспомните, как взаимодействует этанол с металлическим натрием. Составьте уравнение реакции.
Нагреем фенол в пробирке до плавления и поместим в него кусочки металлического натрия. Наблюдается выделение водорода, образуется также фенолят натрия в результате реакции замещения гидроксильного водорода на натрий:
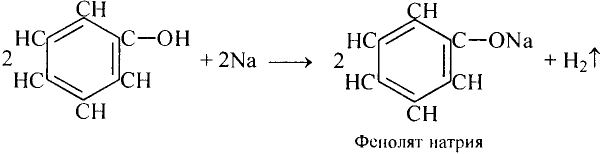
Следовательно, фенол реагирует с натрием так же, как и спирты. Но наличие в молекуле фенола бензольного ядра обусловливает различие в химическом поведении фенола и предельных одноатомных спиртов.
Например, этанол не реагирует с раствором щелочи, а фенол вступает в эту реакцию, образуя фенолят:
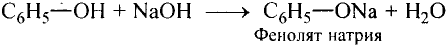
В этой реакции фенол ведет себя как кислота, нейтрализующая щелочь с образованием соли и воды. Учитывая кислотные свойства фенола, его называют еще карболовой кислотой. хотя это очень слабая кислота.
Мы рассмотрели реакции фенола по гидроксильной группе. Теперь рассмотрим реакции по бензольному ядру.
Вы уже знаете, что бензол не реагирует с бромной водой. Если же к раствору фенола добавить бромную воду, происходит реакция замещения (бромирования) с образованием белого осадка трибромфенола:
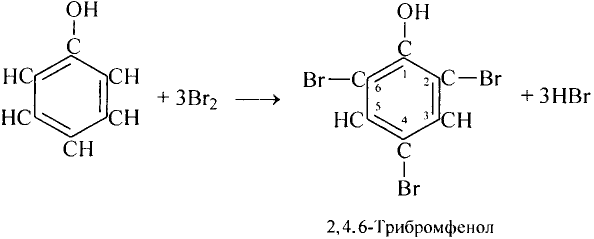
На примере реакций фенола вы ознакомились с явлением взаимного влияния атомов в молекуле. Бензольное ядро так влияет на гидроксильную группу, что облегчается отщепление гидроксильного водорода и фенол проявляет кислотные свойства; гидроксильная группа так влияет на бензольное ядро, что облегчается замещение водородных атомов бензольного ядра и фенол реагирует с бромной водой.
Взаимное влияние атомов в молекуле имеет электронную природу и детальнее изучается в полном курсе органической химии.
Характерной реакцией фенола, с помощью которой его можно определить среди других веществ, является реакция с раствором хлорида железа(III). В результате сливания растворов веществ образуется соединение фиолетового цвета. Его формула не приводится из-за сложности строения.
Применение фенола: Фенол впервые был выделен из каменноугольной смолы в первой половине XIX в. Его применение тесно связано с развитием синтетической органической химии. Фенол является исходным веществом для производства красителей, лекарственных препаратов, пластических масс, взрывчатых веществ.
Фенол обладает антисептическими свойствами, которые были обнаружены еще во второй половине XIX в. Благодаря этим свойствам его раствор (5%-й) используется для обеззараживания помещений, хирургических инструментов. Фенол добавляют в некоторые сорта мыла, им протравливают древесину, чтобы предотвратить ее гниение.
Вместе с тем фенол — токсическое вещество, которое может вызвать ожоги кожи. Поскольку фенол является продуктом коксохимической промышленности, то вместе с другими промышленными отходами попадает в сточные воды, тем самым загрязняя окружающую среду.
Альдегиды
Состав и строение молекул альдегидов: К классу альдегидов принадлежат вещества, в молекулах которых функциональная альдегидная группа 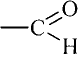 соединена с углеводородным радикалом (в простейшем из этих веществ — с атомом водорода).
соединена с углеводородным радикалом (в простейшем из этих веществ — с атомом водорода).
Общая формула альдегидов
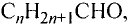 или
или 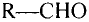
По сравнению со спиртами в составе молекул альдегидов на два атома водорода меньше. Это отражается в названии «альдегиды», производной от слов «алкоголь» и «дегидрирование», то есть дегидрированный алкоголь.
Название первого члена гомологического ряда — метаналь, или формальдегид, или муравьиный альдегид:

Следующий в гомологическом ряду — этаналь, или ацетальдегид, или уксусный альдегид.
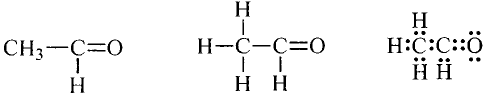
Традиционные названия альдегидов происходят от названий кислот, в которые превращаются эти альдегиды в результате окисления (в приведенных примерах — от муравьиной и уксусной кислот).
Международные названия альдегидов образуются от известных вам названий углеводородов прибавлением суффикса -аль. Таким образом, следующий в гомологическом ряду — пропаналь
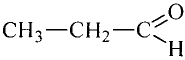
Физические свойства ацетальдегида: Это летучая бесцветная жидкость, хорошо растворимая в воде, имеет характерный резкий запах.
Химические свойства ацетальдегида: Двойная связь между атомами углерода и кислорода в альдегидной группе поляризована за счет оттягивания электронов атомом кислорода как более электроотрицательного элемента. На нем возникает частичным отрицательным заряд, а на атоме углерода— частичный положительный заряд:
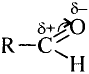
Именно это определяет химическую активность альдегидов. Они легко вступают в реакции окисления. Полное окисление (горение) происходит по схеме:
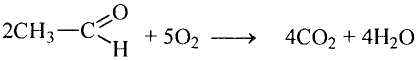
Частичное окисление ацетальдегида можно провести с помощью гидроксида меди(II). К свежеприготовленному осадку гидроксида меди(II), полученному в результате сливания растворов сульфата меди(II) и гидроксида натрия, добавим раствор ацетальдегида, смесь нагреем. В пробирке образуется желтый осадок гидроксида меди(I), который быстро разлагается на оксид меди(I) красного цвета и воду:
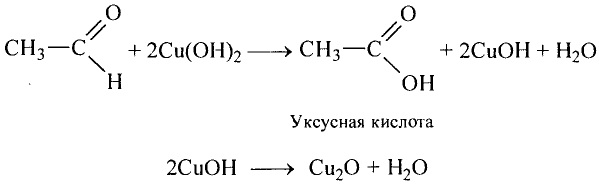

Окислить ацетальдегид можно и другим реактивом — аммиачным раствором оксида серебра(I). В результате нагревания в тщательно вымытой пробирке смеси этого реактива с уксусным альдегидом на стенках посуды выпадает осадок металлического серебра, покрывающего стенки блестящим слоем. По этому признаку реакция называется реакцией «серебряного зеркала».
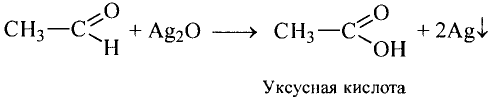
Приведенные реакции являются характерными для альдегидов и используются с целью их аналитического определения.
Поскольку альдегидная группа содержит двойную связь, можно предположить, что альдегид будет вступать в реакцию присоединения по месту этой связи.
Присоединяя водород, ацетальдегид превращается в этиловый спирт:
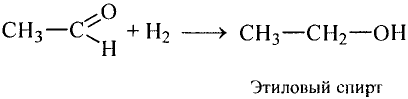
Таким образом можно восстановить альдегид в спирт. С другой стороны, спирт можно окислить до альдегида.
Лабораторная работа:
Окисление спирта в альдегид
Медную проволочку раскалите в пламени спиртовки. Когда она покроется медной окалиной  опустите ее в пробирку с этиловым спиртом. Ощущается характерный запах уксусного альдегида.
опустите ее в пробирку с этиловым спиртом. Ощущается характерный запах уксусного альдегида.
Обратите внимание на цвет медной проволочки — окалина восстанавливается до металлической меди. Реакция происходит по уравнению:
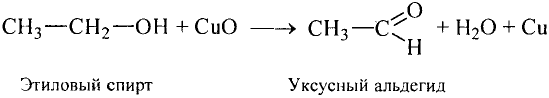
Рассмотренные реакции окисления и восстановления важны для осуществления взаимных превращений веществ различных классов.
Применение уксусного альдегида: Реакция окисления обусловливает применение этого соединения для получения уксусной кислоты. В небольших количествах уксусный альдегид образуется при обмене веществ в организме человека, например в результате метаболизма алкоголя. Избыток ацет-альдегида очень вреден и вызывает неприятные ощущения, которые используются для лечения алкоголизма.
Предельные одноосновные карбоновые кислоты
Состав и строение молекул карбоновых кислот: Характерный запах столового уксуса известен всем. Он обусловлен присутствием уксусной кислоты. В предыдущем параграфе рассматривалось ее образование в результате реакции окисления уксусного альдегида. В молекуле уксусной кислоты имеется углеводородный радикал и группа атомов 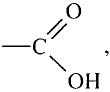 называемая карбоксильной группой. Эта функциональная группа характерна для нового для вас класса органических соединений — карбоновых кислот.
называемая карбоксильной группой. Эта функциональная группа характерна для нового для вас класса органических соединений — карбоновых кислот.
Мы рассмотрим карбоновые кислоты, в молекулах которых содержится предельный углеводородный радикал и одна карбоксильная группа — предельные одноосновные карбоновые кислоты. Общая формула соединений этого ряда
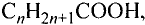 или
или 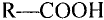
Простейшая из карбоновых кислот муравьиная:
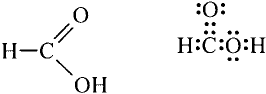
Далее в гомологическом ряду следует уксусная:
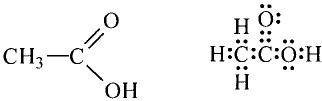
Названия этих и других кислот сложились традиционно, а по международной номенклатуре их названия образуются из названий углеводородов с добавлением суффикса -ов, окончания -а и слова кислота.
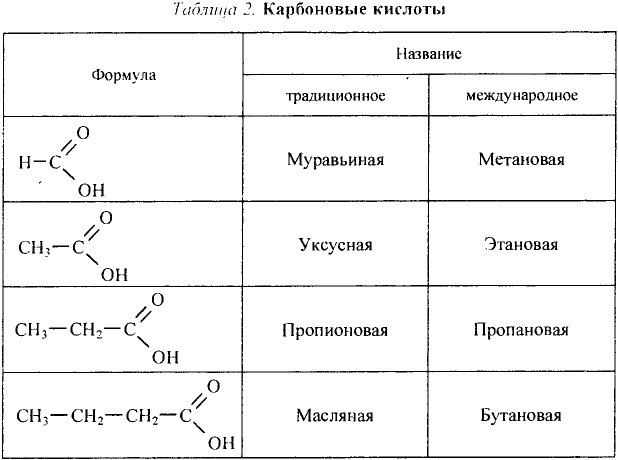
С некоторыми карбоновыми кислотами вам приходилось встречаться. Ощущение жжения после укуса муравья вызывается муравьиной кислотой, которая входит в состав яда, выделяемого этими насекомыми. Столовый уксус — это раствор уксусной кислоты. Причина неприятного запаха у прогорклого сливочного масла — присутствие масляной кислоты. Последняя также выделяется потовыми железами человека.
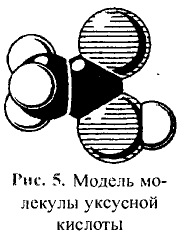
Физические свойства уксусной кислоты: Уксусная кислота — бесцветная жидкость, летучая, имеет резкий специфический запах, смешивается с водой в любых пропорциях, раствор кислый на вкус. В быту известна в виде 3—9%-го водного раствора (уксус) или 80%-го водного раствора (уксусная эссенция).
Химические свойства уксусной кислоты: Они обусловлены наличием функциональной карбоксильной группы. Электронная плотность связи 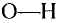 смещается к атому кислорода как более электроотрицательного элемента
смещается к атому кислорода как более электроотрицательного элемента 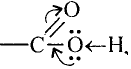 связь поляризуется, атом водорода в результате приобретает дополнительную подвижность (способность отщепляться), что и обусловливает кислотные свойства уксусной кислоты.
связь поляризуется, атом водорода в результате приобретает дополнительную подвижность (способность отщепляться), что и обусловливает кислотные свойства уксусной кислоты.
Лабораторная работа 3
Действие уксусной кислоты на индикаторы
В две пробирки налейте по 1—2 мл раствора уксусной кислоты. К содержимому одной пробирки добавьте несколько капель раствора лакмуса, к другой — раствора метилового оранжевого. Наблюдайте изменение окраски индикаторов. Какой цвет приобретают исследуемые растворы?
Изменение окраски индикаторов свидетельствует о кислотной среде, которая создается благодаря электролитической диссоциации уксусной кислоты.
- С образованием каких ионов диссоциируют неорганические кислоты? Напишите уравнение электролитической диссоциации азотной кислоты.
Степень диссоциации уксусной кислоты очень низкая: в 0,1-молярном растворе при н. у. только три молекулы из ста миллионов распадаются на ионы  и ацетат-ионы
и ацетат-ионы 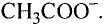 Значит, уксусная кислота — слабый электролит, поэтому в ионных уравнениях реакций ее формула записывается в молекулярном виде.
Значит, уксусная кислота — слабый электролит, поэтому в ионных уравнениях реакций ее формула записывается в молекулярном виде.
Подобно неорганическим кислотам уксусная кислота взаимодействует с металлами, щелочами, основными оксидами, солями. В этом можно убедиться на опытах.
Лабораторная работа:
Взаимодействие уксусной кислоты с металлами, щелочами:
Опыт 1. Взаимодействие уксусной кислоты с магнием. К раствору уксусной кислоты в пробирке добавьте порошка магния или поместите в нее магниевую стружку. Наблюдайте выделение газа.
В результате реакции между уксусной кислотой и магнием образуется водород и соль ацетат магния. Ацетаты — общее название солей уксусной (ацетатной) кислоты.
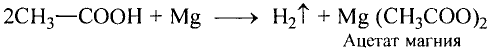
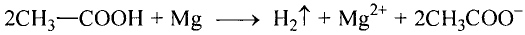
Опыт 2. Взаимодействие уксусной кислоты с гидроксидом натрия. К 1—2 мл раствора гидроксида натрия в пробирке добавьте несколько капель фенолфталеина. К окрашенному раствору каплями добавляйте раствор уксусной кислоты до обесцвечивания содержимого пробирки. О чем это свидетельствует?
- Вспомните взаимодействие неорганических кислот со щелочами. Как называется эта реакция? Приведите пример, составьте уравнение реакции.
Уксусная кислота реагирует со щелочью, образуя соль и воду:


Как представитель класса карбоновых кислот уксусная кислота имеет особенности по сравнению с неорганическими кислотами. В этом можно убедиться на таком опыте (рис. 6). К смеси этилового спирта с серной кислотой (это катализатор реакции) добавим уксусной кислоты и смесь нагреем. Появляется приятный эфирный запах, свидетельствующий об образовании этилового эфира уксусной кислоты — вещества, принадлежащего к классу сложных эфиров:
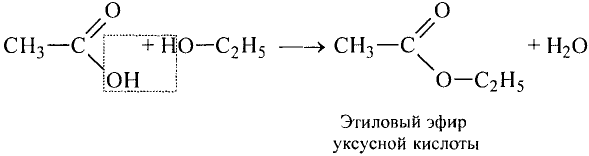
Если проводить эту реакцию в приборе, изображенном на рисунке 6, продукт реакции (эфир) можно собрать под слоем льда.
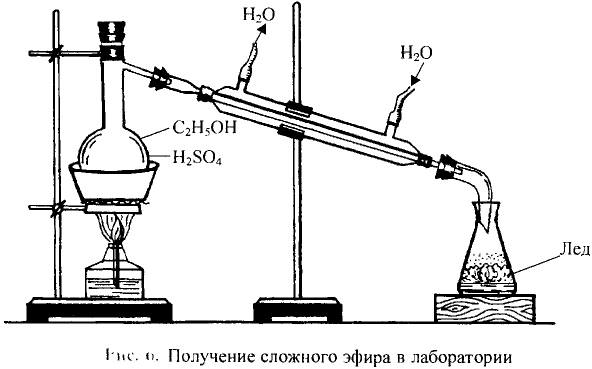
Применение уксусной кислоты: Уксусная кислота в виде винного уксуса известна людям издавна, поскольку образуется в результате уксуснокислого брожения (скисания) вина. Но в чистом виде ее выделили только в VIII в. В начале XIX в. был определен состав уксусной кислоты, а структурная формула ее была предложена в середине XIX в.
В больших количествах уксусная кислота используется в органическом синтезе, при производстве лекарственных препаратов, искусственного волокна, химических средств защиты растений. Она широко используется и как растворитель. В пищевой промышленности применяется как консервирующее средство и вкусовая приправа.
Взаимосвязь между углеводородами, спиртами, альдегидами и карбоновыми кислотами
Вы уже знаете, что окислением этанола можно получить уксусный альдегид, а из него — уксусную кислоту. На основании этих сведений можно составить такую общую схему превращения этих веществ:
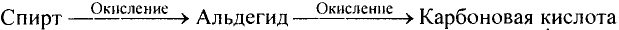
Возможны и обратные реакции—восстановление при участии катализаторов. Из уксусной кислоты можно получить этанол:
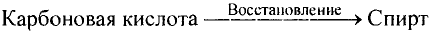
В свою очередь, этанол можно получить из этилена с помощью реакции гидратации (присоединения воды):
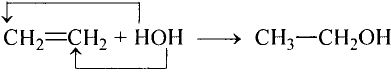
Этилен можно получить дегидрированием этана:
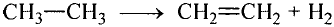
Таким образом, углеводороды, спирты, альдегиды, карбоновые кислоты генетически связаны между собой.
Цепочка превращений веществ, изученных вами, имеет такой вид:
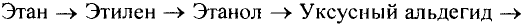
Предельные углеводороды можно получить путем синтеза из углерода и водорода, а кислоту окислить до углекислого газа и воды. Таким образом, можно перейти от неорганических веществ к органическим, а от них — опять к неорганическим.
- Дополните последнюю схему названными превращениями с участием неорганических веществ. Составьте уравнения реакций.
Эти превращения свидетельствуют о единстве и взаимосвязи между органическими и неорганическими веществами.
Знание взаимных превращений веществ имеет огромное практическое значение, поскольку эти превращения лежат в основе разнообразных синтезов, которые можно вести целенаправленно, предвидя продукты реакций и направляя эти реакции в нужную сторону.
- Имеет ли теоретическое значение взаимосвязь между веществами? Дайте обоснованный ответ.
Сложные эфиры
Реакция этерификации: Рассмотренная реакция между уксусной кислотой и этиловым спиртом, в результате которой образуется сложный эфир, называется реакцией этерификации.
Экспериментально установлено, что от молекулы карбоновой кислоты отщепляется гидроксильная группа, а от молекулы спирта — атом водорода, за счет этого образуется молекула воды:
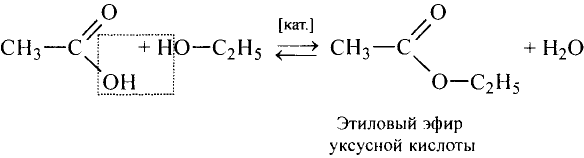
Эта реакция обратима: наряду с этерификацией происходит гидролиз (от гр.— разложение водой) эфира с образованием спирта и кислоты. После установления равновесия в реакционной смеси содержатся кислота, спирт, эфир, вода.
Обратимость этой реакции составляет определенное неудобство для получения эфиров, поэтому, чтобы увеличить выход продукта реакции, необходимо сместить ее равновесие в нужном направлении. С этой целью можно увеличивать концентрацию одного из исходных веществ. Можно также удалять из зоны реакции один из продуктов, тем самым стимулируя его образование. Для удаления эфира его отгоняют, а воду удаляют с помощью осушивающих средств.
Теперь представим, что наша цель — получить кислоту из эфира при помощи реакции гидролиза. Для этого необходимо связать химически кислоту или спирт, чтобы они не вступали в реакцию этерификации, и тем самым сместить равновесие реакции влево. Для связывания кислоты можно использовать щелочь, которая в реакции с кислотой образует соль. Реакция будет происходить таким образом:
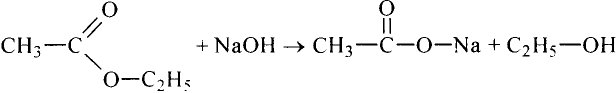
Спирт можно отделить отгонкой, а кислоту получить, действуя на соль более сильной кислотой, вытесняющей уксусную из ее солей:

На этом примере мы убедились, как на основании теоретических знаний можно спланировать синтез и получить нужное вещество.
Применение сложных эфиров: Как правило, эфиры имеют приятный запах и благодаря этому используются в парфюмерной и пищевой промышленности. Например, метиловый эфир масляной кислоты имеет запах яблок, а пентиловый эфир (от пентанола) уксусной кислоты пахнет бананами. Из этих и других эфиров изготовляют эссенции, которые добавляют к прохладительным напиткам, конфетам, кремам, парфюмерным и косметическим изделиям. Поскольку кроме природных ароматических веществ используются и синтетические, то эфиры производятся в промышленности в большом количестве.
Жиры и мыло
Состав и строение молекул жиров: Сложные эфиры могут образовываться разнообразными карбоновыми кислотами и спиртами. Наибольшее значение имеют те, которые образованы трехатомным спиртом глицерином и высшими карбоновыми кислотами. К последним относятся, например, стеариновая кислота состава 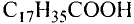 и олеиновая кислота состава
и олеиновая кислота состава 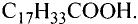
Первая — предельная кислота, вторая — непредельная. В ее углеводородном радикале имеется двойная связь между углеродными атомами, поэтому в молекуле олеиновой кислоты на два водородных атома меньше:
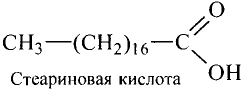
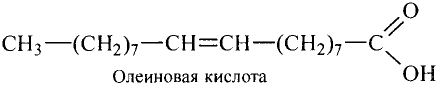
Сложные эфиры карбоновых кислот и глицерина называются жирами. Если формулу карбоновой кислоты записать в общем виде 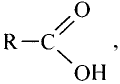 то образование жира можно представить уравнением реакции этерификации:
то образование жира можно представить уравнением реакции этерификации:
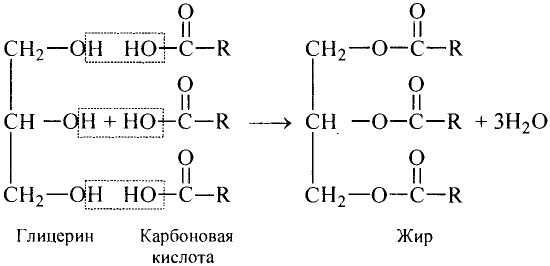
Химическую природу жиров начали изучать в первой половине XIX в. Синтез жира тристеарина впервые осуществил французский химик М. Бертло в 1854 г.
БЕРТЛО ПЬЕР ЭЖЕН МАРСЕЛЕН (1827—1907)

Французский химик, член Академии наук. Один из основателей синтетической органической химии, исследования которого нанесли поражение учению о «жизненной силе». Ученый синтезировал ацетилен, бензол, фенол, метан, жиры и ряд других соединений.
Автор трудов в области термохимии, химической кинетики, агрохимии, истории химии. Общественный деятель, педагог.
Физические свойства жиров: Состав и строение углеводородных радикалов влияют на свойства жиров. Вот как, например, изменяются их температуры плавления:

Как видим, жир. образованный предельной кислотой, в обычных условиях твердый, непредельной — жидкий. В состав жидких растительных масел (подсолнечного, кукурузного, оливкового и др.) входят остатки преимущественно непредельных кислот, в состав твердых животных жиров (говяжьего, бараньего и др.) — остатки предельных кислот.
Жиры легче воды и нерастворимы в ней, но растворяются в органических растворителях.
- Сравните опытным путем растворимость растительного масла в воде, спирте, бензине. Опишите (устно) этот опыт.
Жиры наряду с белками и углеводами принадлежат к биологически активным веществам. Они входят в состав клеток растительных и животных организмов и являются для них источником энергии. В результате окисления 1 г жира выделяется 37,7 кДж энергии, вдвое больше, чем при окислении I г белка или углевода.
Основное количество жиров, употребляемых человеком, содержится в мясе, рыбе, молочных и зерновых продуктах. В случае, когда в организм человека с едой поступает больше энергии, чем используется им, образуются жирообразные вещества, отлагающиеся в тканях организма. Таким образом он аккумулирует энергию.
В соответствии с данными современной медицины чрезмерное употребление жиров, образованных предельными кислотами, то есть животных жиров, может привести к накоплению веществ, затрудняющих ток крови в артериях, в частности тех, которые поставляют кровь в мозг. Более полезными для употребления признаются жиры, образованные непредельными кислотами, то есть растительные масла. В составе, например, подсолнечного масла содержится 91 % непредельных карбоновых кислот.
Химические свойства жиров: В молекулах жидких жиров в отличие от твердых имеются двойные углерод-углеродные связи. Как вам уже известно, по месту двойной связи возможна реакция присоединения, в частности водорода. В результате этой реакции непредельное соединение превращается в предельное, а жидкий жир — в твердый.
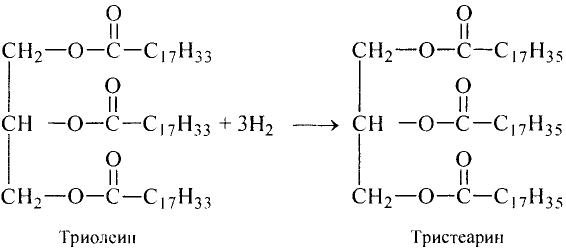
Процесс отвердевания (гидрирования ) жиров лежит в основе производства маргарина (от греч. слова, означающего жемчужина). Негидрированные жиры прогоркают, окисляясь по двойным связям, у них появляются неприятные запах и вкус. Гидрирование жиров замедляет эти процессы, кроме того, позволяет из более дешевых растительных масел получать более ценные твердые жиры.
Жиры как сложные эфиры подвергаются гидролизу.
Жиры гидролизируют с образованием трехатомного спирта глицерина и карбоновых кислот.
Если проводить гидролиз тристеарина в присутствии щелочи, образуется соль стеариновой кислоты, известная как основа мыла:
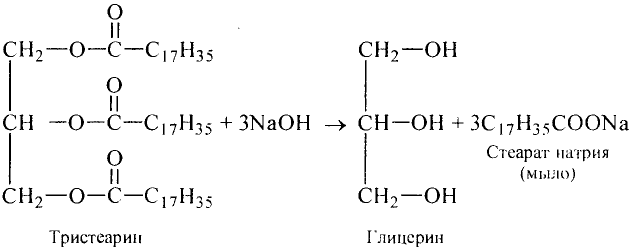
Поскольку в результате щелочного гидролиза жира образуется мыло, то реакция называется омылением жира.
Натриевые соли высших карбоновых кислот — основная составная часть твердого мыла, соли калия — жидкого мыла.
Для получения мыла из жира в промышленности вместо щелочи используют соду  Мыло, полученное непосредственно в результате этой реакции, называется ядровым и известно как хозяйственное. Туалетное мыло отличается от хозяйственного наличием добавок: красителей, ароматизаторов, антисептиков и др.
Мыло, полученное непосредственно в результате этой реакции, называется ядровым и известно как хозяйственное. Туалетное мыло отличается от хозяйственного наличием добавок: красителей, ароматизаторов, антисептиков и др.
Моющее действие мыла — сложный физико-химический процесс. Мыло является посредником между полярными молекулами воды и неполярными частицами загрязнений, нерастворимыми в воде. Если обозначить углеводородный радикал буквой R, то состав мыла можно выразить формулой  По химической природе мыло — это соль, ионное соединение. Кроме полярной группы
По химической природе мыло — это соль, ионное соединение. Кроме полярной группы 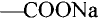 в его составе имеется неполярный радикал R, в состав которого могут входить 12—17 атомов углерода. Во время мытья молекулы мыла ориентируются на загрязненной поверхности таким образом, что полярные группы обращены к полярным молекулам воды, а неполярные углеводородные радикалы — к неполярным частицам загрязнения. Последние как бы попадают в окружение молекул мыла и легко смываются с поверхности водой (рис. 9).
в его составе имеется неполярный радикал R, в состав которого могут входить 12—17 атомов углерода. Во время мытья молекулы мыла ориентируются на загрязненной поверхности таким образом, что полярные группы обращены к полярным молекулам воды, а неполярные углеводородные радикалы — к неполярным частицам загрязнения. Последние как бы попадают в окружение молекул мыла и легко смываются с поверхности водой (рис. 9).
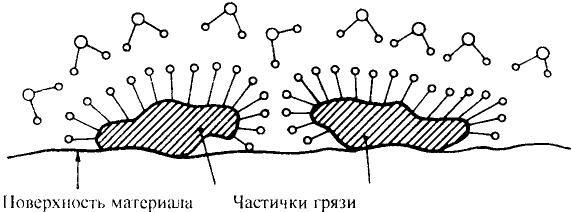
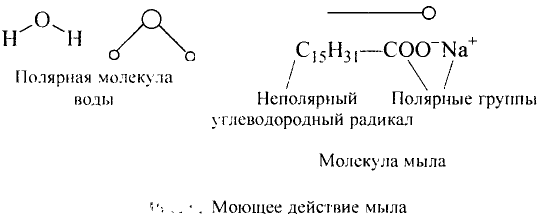
В жесткой воде образуются нерастворимые магниевые и кальциевые соли карбоновых кислот, поэтому мыло теряет свое моющее действие, а соли оседают на поверхности изделия:
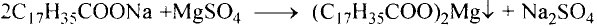
Синтетические моющие средства, при всем разнообразии их химического состава, имеют подобное мылу строение молекул, в которых есть растворимая в воде полярная часть и нерастворимый углеводородный ради кат Но они, в отличие от мыла, являются солями другой химической природы и в жесткой воде не образуют нерастворимых соединений. В этом состоит преимущество синтетических моющих средств перед обыкновенным мылом.
Лабораторная работа:
Сравнение свойств мыла и синтетического моющего средства
Приготовьте в колбе или химическом стакане по 20—25 мл 1%-х растворов хозяйственного мыла и любого стирального порошка в дистиллированной воде. В две пробирки налейте по 2—3 мл жесткой воды (из крана). Добавьте в одну пробирку раствор мыла, в другую — стирального порошка, встряхните содержимое пробирок.
В какой пробирке образуется более устойчивая пена? Какого средства приходится добавлять больше для образования устойчивой пены?
Мыло и синтетические моющие средства принадлежат к так называемым поверхностно-активным веществам (ПАВ). Их широкое применение часто связывают с загрязнением окружающей среды, в частности водоемов. Дело в том, что к синтетическим моющим средствам добавляют фосфаты, которые в водоемах превращаются в вещества, питающие микроорганизмы, бурное размножение которых может привести к заболачиванию водоемов. Поэтому современные ПАВ должны химически или биологически разлагаться после использования на безопасные вещества, не загрязняющие стоки.
Углеводы и глюкоза
До сих пор мы рассматривали химические реакции, в результате которых одни органические соединения превращались в другие или окислялись до углекислого газа и воды. В природе постоянно происходит обратный процесс: из углекислого газа и воды образуются органические вещества, из которых построены растительные организмы. Под влиянием солнечной энергии в зеленых листьях растений происходит реакция фотосинтеза, в результате которой образуется глюкоза. Процессу способствует, то есть является катализатором, зеленый пигмент хлорофилл, поглощающий солнечную энергию. В общем виде процесс фотосинтеза выражается уравнением:

В растениях из глюкозы образуется сахароза, крахмал и целлюлоза. Эти соединения принадлежат к классу углеводов. Такое название сложилось исторически, поскольку первые из изученных соединений этого класса содержали в молекулах кроме атомов углерода атомы водорода и кислорода в соотношении Н : О как 2 : 1, то есть как в воде,— отсюда «углеводы».
Состав и строение молекулы глюкозы: Молекулярная формула глюкозы 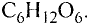 Ее структуру можно представить такой формулой:
Ее структуру можно представить такой формулой:
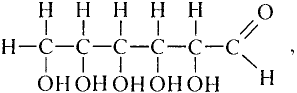 или сокращенно
или сокращенно 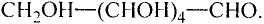
Как видим, в молекуле глюкозы имеется альдегидная группа и пять гидроксильных групп. Значит, глюкоза является многоатомным спиртом и альдегидом одновременно, или альдегидоспиртом.
Физические свойства глюкозы: Глюкоза очень распространена в природе. Это бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус. В свободном состоянии она содержится во многих фруктах, в частности в винограде (отсюда название глюкозы — виноградный сахар), в меде, есть она и в корнях, листьях и цветках растений, в крови человека и животных (около 0,1 %).
Химические свойства глюкозы: Поскольку молекула глюкозы содержит функциональные альдегидную и гидроксильные группы, можно предположить, что это вещество будет вступать в реакции, характерные для альдегидов и многоатомных спиртов.
Как многоатомный спирт глюкоза реагирует с гидроксидом меди(II).
Лабораторная работа:
Взаимодействие глюкозы с гидроксидом меди(II)
В пробирку налейте 1 мл раствора гидроксида натрия и добавьте несколько капель раствора сульфата меди(II). Наблюдайте образование осадка гидроксида меди(II). К осадку добавьте раствор глюкозы и смесь взболтайте. Наблюдайте образование прозрачного раствора синего цвета (уравнение реакции мы не записываем из-за сложности строения продукта).
Как альдегид глюкоза вступает в реакцию «серебряного зеркала», реагируя с аммиачным раствором оксида cepeopa(I).
В этой реакции альдегидная группа глюкозы окисляется до карбоксильной:
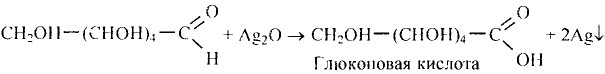
Среди химических свойств глюкозы едва ли не важнейшим является реакция брожения. Это такой вид химического взаимодействия, которое происходит под влиянием природных катализаторов — ферментов, вырабатываемых микроорганизмами. Например, под влиянием ферментов дрожжей глюкоза может превращаться в этиловый спирт— происходит спиртовое брожение.
Процесс можно выразить таким уравнением:
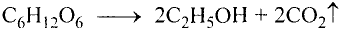
Применение глюкозы: Человеческий организм легко усваивает глюкозу и использует ее как источник энергии, которая выделяется в результате окисления глюкозы в клетках организма. Суммарно этот процесс можно выразить уравнением:
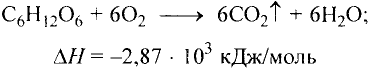
Как питательное вещество глюкоза используется в медицине для поддержания жизнедеятельности ослабленного организма. Ее раствор вводят прямо в кровь, поскольку именно она переносит глюкозу к клеткам организма.
Изомер глюкозы фруктоза имеет ту же молекулярную формулу 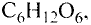 но другое химическое строение. Пчелиный мед состоит преимущественно из глюкозы и фруктозы.
но другое химическое строение. Пчелиный мед состоит преимущественно из глюкозы и фруктозы.
Сахароза
Состав молекулы сахарозы: К классу углеводов принадлежит также сахароза, или свекловичный, или тростниковый, сахар. Молекулярная формула сахарозы 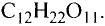 Это соединение имеет строение более сложное по сравнению с сахарозой.
Это соединение имеет строение более сложное по сравнению с сахарозой.
Физические свойства сахарозы: Сахароза — бесцветное кристаллическое вещество, сладкое на вкус, хорошо растворимое в воде. При нагревании до 190—200 °С кристаллы плавятся. расплавленная масса после застывания образует карамель.
Сахароза содержится в растениях, особенно много ее в корнеплодах сахарной свеклы (16—20 %) и стеблях сахарного тростника (14—26 %).
Производство сахарозы: Сахароза в виде тростникового сахара была известна с древнейших времен и использовалась как лекарственное средство. В Европе сахар появился в XVI в., а из сахарной свеклы был впервые выделен в середине XVIII в.
Поскольку сахароза — ценный пищевой продукт, ее производят в большом количестве. Производство состоит в выделении из природного сырья, например сахарной свеклы, очистке и кристаллизации продукта. С этой целью прежде всего моют и измельчают корнеплоды, затем обрабатывают массу горячей водой. Будучи хорошо растворимым в воде веществом. сахароза переходит в раствор. Обработкой последовательно известковым молоком, затем углекислым газом очищают раствор сахарозы. Далее его выпаривают, сахароза кристаллизуется— образуется сахарный песок. Путем повторного растворения и кристаллизации получают сахар-рафинад.
Важным показателем для производства сахара является сахаристость свеклы. Селекционеры работают над выведением сортов свеклы с высоким содержанием сахара. Сахаристость утрачивается при длительном хранении корнеплодов, поэтому на сахарных заводах стремятся перерабатывать их как можно быстрее.
Крахмал
Состав и строение молекулы крахмала. Состав молекулы крахмала выражается формулой 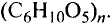 Это природный полимер, который синтезируется в растениях из глюкозы по реакции:
Это природный полимер, который синтезируется в растениях из глюкозы по реакции:
Полимерные цепи крахмала неоднородны, среди них имеются линейные и разветвленные, длинные и короткие (рис. 10). Число звеньев в полимере составляет от одной до пяти тысяч.
Крахмал содержится во всех растениях, а в некоторых — в большом количестве. Клубни картофеля содержат по массе от 12 до 20 %, зерна пшеницы — 57—75 и риса — 62—82 % крахмала. Он накапливается в растениях и используется ими как источник энергии, необходимой, например, для прорастания семян.
Физические свойства крахмала: Крахмал — белый аморфный порошок. В холодной воде нерастворим, оседает на дне сосуда. В горячей воде набухает, образуя клейстер. В этом можно убедиться на опыте.
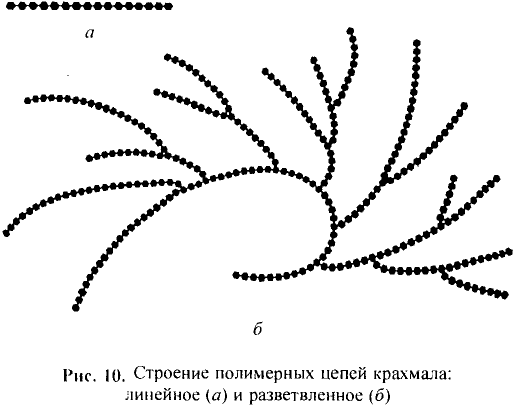
Лабораторная работа:
Отношение крахмала к воде
В пробирку насыпьте немного крахмала, добавьте холодной воды. Размешайте смесь, дайте ей отстояться. Что наблюдаете? Растворился ли крахмал в холодной воде?
Закипятите воду в стакане. Вылейте смесь из пробирки, перемешивая, в горячую воду. Что наблюдаете? Сделайте вывод об отношении крахмала к воде.
Сохраните крахмальный клейстер для следующего опыта.
Крахмал можно получить из картофеля механическим способом. Рассмотрите рис. 11. Зерна крахмала плавают в клеточном соке, их можно извлечь оттуда. Для этого картофель измельчают, промывают водой и отцеживают. Вместе с водой крахмал проходит через сито, затем отстаивается. Далее воду сливают и продукт высушивают.
Химические свойства крахмала: Накопленный растениями крахмал расщепляется под воздействием ферментов с образованием глюкозы, в результате окисления которой освобождается энергия.
Если растения запасают энергию в виде крахмала, то животные — в виде гликогена (углевода, близкого по структуре к крахмалу). Процесс усвоения крахмала начинается в ротовой полости с его гидролиза до глюкозы под влиянием ферментов. Излишки глюкозы откладываются в печени в виде «запасного» гликогена. В случае необходимости, например при физической нагрузке, гликоген превращается, как и крахмал в растениях, в глюкозу, которая питает организм.
Таким образом, в человеческом организме энергия запасается в виде жиров и углеводов и высвобождается в результате их окисления. По мнению специалистов, энергетические потребности человека должны удовлетворяться на 60 % за счет растительной пищи, в частности овощей и фруктов.
Процесс гидролиза можно воссоздать в лаборатории, прокипятив крахмал с водой в присутствии серной кислоты. При гидролизе к каждому мономерному звену крахмала присоединяется молекула воды, полимерная цепь рвется и образуются молекулы глюкозы:
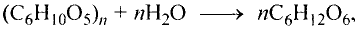 или
или
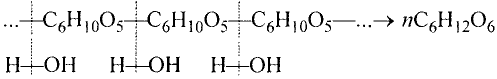
Приведенное выше уравнение реакции — суммарное. В действительности гидролиз происходит последовательно с образованием промежуточных продуктов — декстринов, имеющих меньшую, чем у крахмала, молекулярную массу. Варение и жаренье картофеля, выпекание хлеба, глаженье накрахмаленного белья связаны с частичным гидролизом крахмала и образованием декстринов. В составе пиши декстрины усваиваются организмом легче, чем крахмал.
Характерным химическим свойством крахмала является его реакция с йодом (йодкрахмальная реакция).
Лабораторная работа:
Взаимодействие крахмала с йодом
К предварительно приготовленному крахмальному клейстеру добавьте каплю спиртового раствора йода. Наблюдайте появление синей окраски.
Эта реакция используется для обнаружения крахмала или йода.
Применение крахмала: Промежуточные продукты гидролиза крахмала — смесь декстринов и глюкозы (патоку) — используют в кондитерской промышленности для производства конфет, добавляют в тесто для кондитерских изделий. Крахмал является сырьем для производства этилового спирта. С этой целью крахмал подвергают гидролизу, и в результате образуется глюкоза, которая далее с помощью спиртового брожения превращается в этанол.
В текстильной промышленности крахмал используют для проклеивания тканей, в бумажной — для склеивания бумаги и картона, в медицине — для изготовления присыпок, паст, капсул для лекарственных препаратов.
Целлюлоза
Состав и строение молекулы целлюлозы: Из звеньев состава 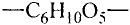 такого же, как и у крахмала, построены цепные молекулы другого природного полимера — целлюлозы, или клетчатки.
такого же, как и у крахмала, построены цепные молекулы другого природного полимера — целлюлозы, или клетчатки.
Целлюлоза (от лат. cellula — клетка) широко распространена в природе, поскольку из нее образуются оболочки растительных клеток. Если крахмал — источник энергии, то целлюлоза— строительный материал растений. Растительные волокна (хлопковые, конопляные, льняные) в основном, а древесина на 45 % состоят из целлюлозы. Почти чистая целлюлоза известна вам в виде ваты и фильтровальной бумаги.
Внешнее различие между этими волокнами и крахмалом очевидно, хотя полимерные цепи крахмала и целлюлозы построены из одинаковых звеньев. В чем же причина различия? Ответ однозначен — в составе и строении молекул. Общая формула целлюлозы, как и крахмала,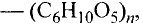 однако степень полимеризации и молекулярная масса целлюлозы намного больше, чем у крахмала: n составляет 10—14 тысяч, относительная молекулярная масса — несколько миллионов.
однако степень полимеризации и молекулярная масса целлюлозы намного больше, чем у крахмала: n составляет 10—14 тысяч, относительная молекулярная масса — несколько миллионов.
Кроме того, как вам известно, молекулы крахмала имеют линейное и разветвленное строение, молекулы же целлюлозы ниткообразные, линейные, поэтому могут образовывать волокна (рис. 12).
Имеются также и другие существенные особенности внутреннего строения, которые мы не рассматриваем, но которые тоже обусловливают различия между крахмалом и целлюлозой.
Химические свойства целлюлозы: Целлюлоза окисляется (горит) с образованием углекислого газа и воды и выделением энергии:
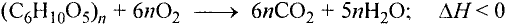
Именно эта реакция происходит при сжигании древесины.
Как и крахмал, целлюлоза подвергается гидролизу при нагревании с разбавленными кислотами, превращаясь в глюкозу. Суммарное уравнение реакции:
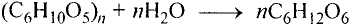
У жвачных животных и термитов в органах пищеварения имеются вещества, под влиянием которых происходит гидролиз клетчатки и ее усвоение. В организме человека целлюлоза. потребляемая в составе растительной пищи, не гидролизирует, а значит не усваивается им.

Целлюлоза подвергается частичному гидролизу при силосовании соломы, кукурузы и пр., поэтому такие продукты являются ценным кормом для сельскохозяйственных животных.
В результате нагревания древесины без доступа воздуха происходит разложение целлюлозы с образованием древесного угля, метанола и ряда других ценных кислородсодержащих соединений.
Применение целлюлозы: Целлюлоза широко применяется в виде древесины (назовите, где именно), тканей (каких?), из нее изготовляют бумагу. Все это позволяет утверждать, что современная цивилизация в значительной мере зависит от целлюлозы.
Чтобы изготовить бумагу из целлюлозы, ее необходимо прежде всего выделить из древесины. С этой целью применяют специальные вещества, растворяющие сопутствующие компоненты, но не растворяющие целлюлозу, которую можно отделить фильтрованием.
Большое количество ценных веществ образуется в результате химической переработки целлюлозы. Среди них— искусственный шелк, взрывчатые вещества, спирты.
В биомассе растений, основным компонентом которой является целлюлоза, на земном шаре запасено огромное количество энергии. Оказывается, эту энергию можно освободить, используя продукты переработки биомассы. Современная наука рассматривает ее как перспективное сырье для получения углеводородов и других ценных органических веществ. Это достигается методами биотехнологии, которая предусматривает использование ферментов (биохимических катализаторов). Полученные таким образом продукты пока имеют сравнительно высокую стоимость, но в будущем к нефти, природному газу и каменному углю как источникам органических соединений добавится еще и биомасса.
Аминокислоты и белки
Вы уже знаете, что в состав растительных и животных организмов входят представители таких классов органических соединений, как жиры и углеводы. Не менее важными для функционирования живых организмов являются белки. Это высокомолекулярные соединения, состоящие из звеньев аминокислот.
Идею о том, что аминокислоты являются «кирпичиками», из которых построены белки, впервые высказал выдающийся украинский биохимик и химик Иван Яковлевич Горбачевский.
В чем состоит отличие аминокислот от изученных вами карбоновых кислот? Карбоновые кислоты содержат функциональную карбоксильную группу 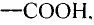 а аминокислоты — две функциональные группы: карбоксильную и аминогруппу
а аминокислоты — две функциональные группы: карбоксильную и аминогруппу 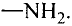
Аминогруппу можно рассматривать как остаток молекулы аммиака. Если в молекуле уксусной кислоты 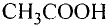 один атом водорода в метильной группе заместить на аминогруппу, образуется аминоуксусная кислота
один атом водорода в метильной группе заместить на аминогруппу, образуется аминоуксусная кислота
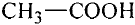 - Уксусная кислота
- Уксусная кислота
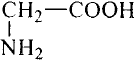 - Аминоуксусная кислота
- Аминоуксусная кислота
Электронная и структурная формулы аминоуксусной кислоты:

Аминоуксусная кислота — простейшая из аминокислот. Среди них имеются такие, которые содержат две карбоксильные или две аминогруппы, ароматические радикалы, гидроксильные и серосодержащие группы. Примеры аминокислот приведены в табл. 3.

По физическим свойствам аминокислоты — бесцветные кристаллические вещества с высокими температурами плавления, большинство из них хорошо растворимы в воде.
Карбоксильная и аминогруппы противоположны по химическому характеру: первая является носителем кислотных свойств, а вторая — основных. Поэтому аминокислоты принадлежат к амфотерным соединениям.
Важнейшей особенностью аминокислот является взаимодействие молекул между собой. В реакцию вступают противоположные по функциям группы: карбоксильная группа одной молекулы и аминогруппа другой. В результате реакции образуются ди-, три-, ... полипептиды и выделяется вода:
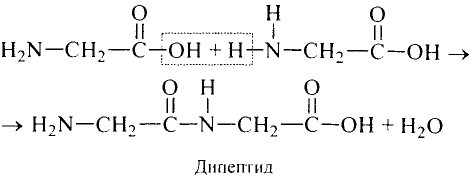
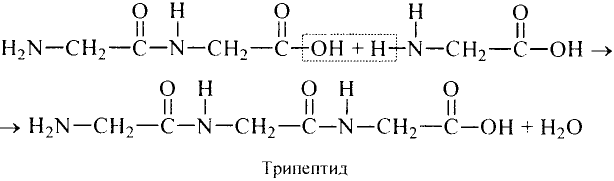
Связь между остатками аминокислот называется пептидной связью, а группа  пептидной группой.
пептидной группой.
Строение белков: Полимерная полипептидная цепь — основа строения молекулы любого белка. Первые синтезы полипептидов осуществил немецкий ученый Э. Фишер в 1903— 1907 гг.
ФИШЕР ЭМИЛЬ ГЕРМАН (1852—1919)
Немецкий химик, член Берлинской All. Научные труды посвящены химии физиологически активных веществ.
Синтезировал ряд углеводов, в частности глюкозу и фруктозу. Установил, что аминокислоты связываются между собой при помощи пептидных связей, образуя полипептиды, впервые получил полипептид. Лауреат Нобелевской премии 1902 г.

Каждый белок имеет набор аминокислот, соединенных в определенной, свойственной только ему последовательности. Около 20 аминокислот принимают участие в построении белковых молекул, а число соединенных в разной последовательности аминокислотных остатков достигает 10 . Молекулярная масса некоторых белков составляет сотни миллионов.
Строение белков очень сложное и обусловлено не только последовательностью аминокислотных остатков. Длинные цепи белковых молекул скручиваются в спирали, спирали — в клубки, которые определенным образом размещаются в пространстве (рис. 13. 14). Все это в совокупности определяет особенности каждого белка в отдельности. Из-за такой сложности расшифровать структуру природных белков — чрезвычайно сложная задача.
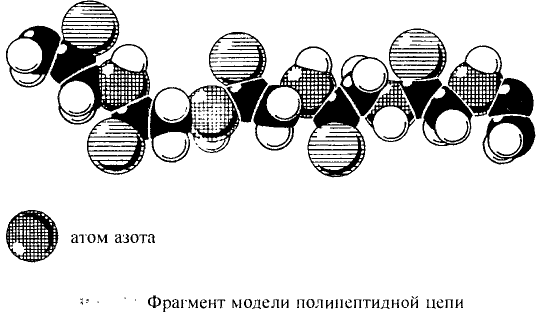
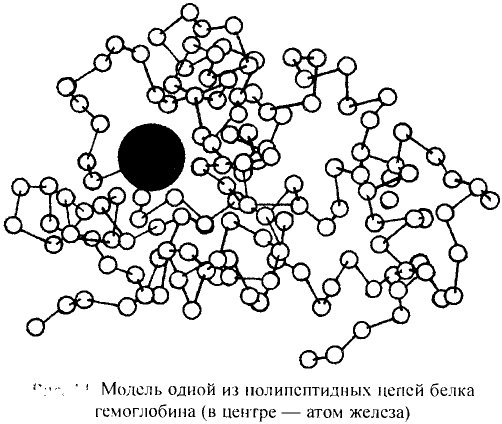
Свойства белков: Белки очень различаются между собой по свойствам, которые зависят от наличия в их составе аминокислот с разными функциональными группами, способными вступать в характерные для них реакции.
Среди белков имеются растворимые в воде и такие, которые образуют коллоидные растворы. К числу первых принадлежит белок куриного яйца. Именно с этим раствором удобно проводить опыты.
Нагреем раствор белка, наблюдая при этом, как он сворачивается, или денатурирует (от лат. denatarare — лишать природных свойств). Именно этот процесс денатурации имеет место при кулинарной обработке белковых пищевых продуктов— мяса, рыбы, яиц.
С химической точки зрения денатурация — это разрушение сложной структуры белка, которое приводит к потере им биологической активности (рис. 15). Это необратимый процесс, поэтому, например, высокая температура опасна для человеческого организма. При этом белки теряют биологическую активность, живые клетки погибают. То же самое происходит и при действии на белки сильных кислот, например серной. Попадание кислоты на кожу может вызвать химический ожог.

Лабораторная работа:
Цветные реакции белков
К раствору белка в пробирке добавьте такой же объем раствора щелочи и несколько капель слабого раствора сульфата меди(II).
Что наблюдается? Как изменилась окраска раствора?
Если к раствору белка добавить концентрированной азотной кислоты, белок сворачивается и постепенно окрашивается в желтый цвет.
Взаимодействие белков с концентрированной азотной кислотой и раствором гидроксида меди(II) — это так называемые цветные реакции белков, используемые для их аналитического определения. При помощи первой определяется наличие бензольных колец в структуре белка, а вторая позволяет определить наличие пептидных связей.
Важным химическим свойством белков является их способность к гидролизу. Под воздействием кислот, щелочей или ферментов (в случае живого организма) происходит расщепление полимерной белковой молекулы на аминокислоты. Гидролиз — процесс, обратный образованию пол и пептидной цепи. При гидролизе молекулы воды присоединяются по месту пептидных связей, последние разрушаются, вместо пептидных групп образуются карбоксильные и аминогруппы. Таким образом белок расщепляется на отдельные аминокислоты, из которых он состоит:
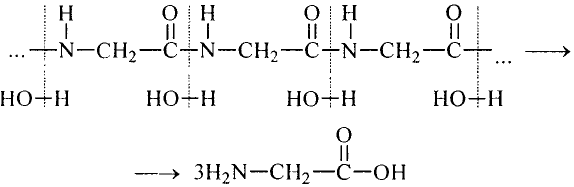
Трудно переоценить биологическое значение этого процесса. Белки, входящие в состав пищи, прежде всего расщепляются (гидролизируют) до аминокислот под воздействием веществ, содержащихся в пищеварительном тракте, затем аминокислоты всасываются в кровь и уже ею переносятся в печень. где организм синтезирует белки, характерные именно для него.
Белки являются основным строительным материалом животных организмов, точнее их клеток. Мышцы, гемоглобин крови, волосы, кожа, ферменты, имеют белковую природу.
Если растения синтезируют аминокислоты из веществ, которыми питаются, то животные и человек лишены природой такой способности. Для нормального функционирования они должны постоянно пополнять запас аминокислот преимущественно за счет белков пищи, то есть получать их в готовом виде. Это особенно важно для молодого организма, который растет и развивается. Поэтому пища должна содержать достаточное количество белков. Наиболее богаты белками мясо, рыба, молоко, сыр, яйца, орехи, бобовые. Больным, ослабленным людям иногда вводят аминокислоты как лекарство, тем самым облегчается их усвоение и поддерживаются силы организма.
Для откорма сельскохозяйственных животных используют синтетические аминокислоты. Белковую массу можно получить также из углеводородов нефти, природного газа или отходов переработки древесины путем микробиологического синтеза. Некоторые виды микроорганизмов способны использовать углеводороды как питательную среду и вырабатывать при этом белковую массу.
Белки могут разлагаться под воздействием микроорганизмов. В результате образуются не аминокислоты, а аммиак, сероводород, фенол, другие вещества с неприятным запахом. Его появление свидетельствует о том, что происходит процесс разложения (гниения) белка. Вспомните, какой неприятный запах имеют протухшее яйцо, испорченные мясо или рыба. Замораживание продуктов, маринование, копчение понижают активность микроорганизмов или даже уничтожают их, процесс разложения замедляется, и продукты сохраняются дольше.
Искусственные и синтетические волокна
Как вам известно, натуральные волокна — хлопок, лен, шерсть, шелк — вырабатывают из природных волокнистых материалов. Природный полимер целлюлоза также имеет волокнистую структуру, однако она недостаточно упорядочена, чтобы из нее можно было выработать нитки. С этой целью необходимо перестроить структуру вещества. Это достигается химическим путем: целлюлозу, выделенную из древесины, обрабатывают специальными веществами, продукт растворяют.
В растворе полимерные молекулы становятся более подвижными, теперь из них можно формировать волокно (растворитель при этом испаряется). Таким образом производят искусственные (ацетатное или вискозное) волокна, а из них — искусственный (ацетатный или вискозный) шелк.
Волокна можно производить и синтетическим путем. Если хлопок— полимерный материал, мономер которого целлюлоза. то шерсть и шелк — полимеры белковой природы, молекулы которых образуются путем соединения аминокислот. Как оказалось, подобную структуру имеет полимер аминокапроновой кислоты состава 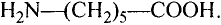 Общая формула полимера:
Общая формула полимера:
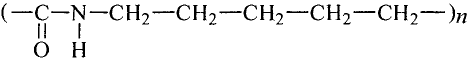
Волокно, изготовленное из такого полимера, называется капрон. Оно прочное, не вытирается, не поглощает влагу (именно поэтому быстро высыхает), хотя и имеет некоторые недостатки.
Взаимосвязь между органическими веществами, их многообразие
Изучая органические вещества, вы постепенно переходили от простейших, таких, как метан, к более сложным и сложнейшим, таким, как белки. Между метаном и белками располагается огромное количество соединений, разнообразных по строению и свойствам. Попытаемся обобщить признаки, обусловливающие это многообразие.
Прежде всего, это характер углеродного скелета. Молекулы органических веществ с одинаковым числом углеродных атомов могут иметь форму закрытых и открытых цепей. Например, гексан, принадлежащий к предельным углеводородам, и бензол, ароматический углеводород. Обе молекулы содержат по шесть углеродных атомов, соединенных, однако, разным способом.
Другой признак — характер межуглеродных связей.
Между атомами углерода могут устанавливаться простые и кратные, а также ароматические связи.
Наличие функциональных групп обусловливает существование разных классов органических соединений (спиртов, альдегидов, карбоновых кислот, сложных эфиров и пр.), а также соединений, содержащих несколько функциональных групп,— аминокислот, углеводов и многих других, не изучаемых вами из-за их сложности.
Изомерия — еще одна из причин многообразия органических веществ. Благодаря этому явлению из одного и того же количества атомов могут образоваться разные по строению, а значит, и свойствам, вещества.
Кроме изученных вами видов изомерии углеродного скелета существуют еще и другие виды изомерии, обусловленные не только химическим, но и пространственным строением молекул.
Изменение состава молекулы на группу  обусловливает появление нового соединения — члена гомологического ряда. Поскольку гомологи имеют сходные свойства, то, зная поведение одного из них, можно в общих чертах охарактеризовать свойства целого ряда. Например, по свойствам метанола можно описать свойства насыщенных одноатомных спиртов. Гомология также является одной из причин многообразия органических веществ.
обусловливает появление нового соединения — члена гомологического ряда. Поскольку гомологи имеют сходные свойства, то, зная поведение одного из них, можно в общих чертах охарактеризовать свойства целого ряда. Например, по свойствам метанола можно описать свойства насыщенных одноатомных спиртов. Гомология также является одной из причин многообразия органических веществ.
Способность некоторых органических соединений к реакции полимеризации позволяет расширить число этих соединений. прежде всего получаемых синтетически.
Названные признаки в совокупности обусловливают существование огромного количества органических соединений. Все элементы периодической системы не способны образовывать столько соединений, сколько их образует один элемент — углерод.
При всем многообразии органические вещества способны к взаимопревращениям: из менее сложных можно получить более сложные благодаря химическим реакциям, от соединений одного класса перейти к соединениям другого класса. Например. начертим путь превращения этана в сложный эфир:
- Из этана дегидрированием получаем этилен.
- Этилен гидратацией превращаем в этанол.
- Этанол окисляем до уксусного альдегида и уксусной кислоты.
- Из этанола и уксусной кислоты получаем этиловый эфир уксусной кислоты.
В эту цепочку превращений можно включить и неорганические соединения (например, этан можно получить из простых веществ). Таким образом, органические вещества генетически связаны между собой и с неорганическими веществами.
Взаимосвязи и взаимопревращения органических веществ имеют огромное значение для практики. Они позволяют осуществлять синтезы, направленные на получение веществ с заданными свойствами. Так, из сравнительно простых по строению углеводородов можно синтезировать огромное количество сложных веществ, необходимых и полезных человеку.
Углеводороды составляют основу продуктов переработки нефти и природного газа, поэтому являются наиболее доступным химическим сырьем. Нефтехимическая промышленность обеспечивает производство огромного количества синтетических продуктов: каучуков, моющих средств, волокон, пластмасс. лекарств и др.
В чем отличие органических соединений от неорганических
С древних времен люди пользовались не только минералами, но и возможно теми веществами, которые получали из растений и животных. Эти вещества человечество использовало для приготовления пищевых продуктов, одежды, столь необходимых в развитии человечества лекарственных, лакокрасочных, косметических препаратов. Человеку давно известны такие продукты растительного и животного происхождения, как сахар, масло, жир, эфирные масла, красящие и возбуждающие вещества. На основе того, что все вышеперечисленные вещества имеют растительное и животное происхождение или являются продуктами их переработки, появилось такое понятие, как "органические вещества", а раздел, изучающий эти вещества, стал называться органической химией.
Долгое время из-за отсутствия возможности определить строение веществ, являющихся продуктами жизнедеятельности живых организмов, и синтезировать их, среди ученых бытовало мнение, что органические вещества возникают в результате некой "жизненной силы" (виталистическое учение; vis, vitalis - жизненная сила). Однако впоследствии накопились факты, которые опровергли это ошибочное мнение.
- Органические вещества, издавна известные человеку: уксус, спирт, сахар, эфирные масла, красители.
- Элементы, содержащиеся в составе органических соединений: углерод, водород, кислород, азот, фосфор, сера.
- Первые синтезированные органические вещества - щавелевая кислота и мочевина (немецкий ученый Ф. Велер, 1824 - 1828).
- Синтез анилина (русский ученый Н. Н. Зинин, 1842).
- Синтез уксусной кислоты (немецкий ученый Г. Кольбе и английский ученый Е. Франкланд, 1845).
- Синтез жира (французский ученый М. Бертло, 1854).
- Синтез сахаристого вещества (русский ученый А. М. Бутлеров, 1861).
В результате ученые признали, что органические вещества возникают из неорганических.
В настоящее время органическую химию можно назвать химией соединений углерода, а в качестве органических веществ принято считать соединения углерода с другими элементами. Некоторым органическим соединениям (оксиды углерода карбиды, соли угольной кислоты) характерны свойства типичных неорганических веществ и поэтому они изучаются в курсе неорганической химии.
Количество органических веществ исчисляется миллионами. Органические вещества считаются основным материалом, составляющим основу растительного и животного организма.
Органические вещества по сравнению с неорганическими неустойчивы и при нагревании легко меняются, а многие из них являются горючими. В их составе обязательно имеется углерод и водород и при горении образуется углекислый газ и вода.
Химическая реакция между органическими веществами протекает медленнее, чем между неорганическими.
В настоящее время многие вещества, имеющиеся в растительном и животном организмах (витамины, гормоны, красители), а также не встречающиеся в живой природе (искусственное и синтетическое волокно, синтетический каучук, пластмассы, средства борьбы с вредителями сельского хозяйства, антибиотики и другие лекарственные препараты) синтезированы.
Отличие органических и неорганических веществ:
Таблица 13
| № | Органические вещества | Неорганические вещества | |
| 1 | При нагревании | Расщепляется Превращается в уголь | Расщепляется или не изменяется |
| 2 | При горении | Образуется СO2 и вода | Не горит. Некоторые образуют различные вещества |
| 3 | В составе | Обязательно наличие С | Входят атомы различных веществ |
По строению органические соединения бывают: насыщенные СnН2n+2 (углерод может образовать связь четырьмя атомами других элементов), ненасыщенные СnН2n (между двумя атомами углерода имеется двойная связь 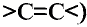 и ненасыщенные с тройной связью СnН2n-2 (между двумя атомами углерода имеется тройная связь
и ненасыщенные с тройной связью СnН2n-2 (между двумя атомами углерода имеется тройная связь 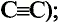 а также циклические: насыщенные СnН2n, ненасыщенные, ароматические углеводороды.
а также циклические: насыщенные СnН2n, ненасыщенные, ароматические углеводороды.
Теория строения органических соединений
Химическое строение - это порядок соединения атомов в молекуле и их взаимодействие.
В 1827 году шведский химик И. Ю. Берцелиус ввел понятие об органическом соединении и его химическом строении. Он определил, что органическая химия - это химия веществ растительного и животного происхождения.
Основу любого предмета составляет теория. Силу любой теории определяет возможность объяснить известные факты и предсказывать новые.
Научную основу органической химии составляет теория химического строения.
В 1858-1861 гг. русский ученый А. М. Бутлеров в Париже и Шпейере (16 сентября 1861 г.) выступил с докладом, посвященном основам теории химического строения.
- Атомы и молекулы реальны. Атомы в молекулах соединены не беспорядочно, а посредством химической связи и в определенной последовательности, согласно их валентности.
- Свойство вещества зависит не только от качественного и количественного состава, но и от химического строения молекулы.
- Атомы или группа атомов в молекуле оказывают прямое или косвенное влияние друг на друга.
Рассмотрим подробнее основные положения теории химического строения А. М. Бутлерова.
Первое положение: До A. M. Бутлерова ученые утверждали, что состав одного вещества можно выразить несколькими формулами и что определить его невозможно. А. Кекуле вывел 20 формул одной только уксусной кислоты. А многие ученые не верили в реальность атомов и молекул. Существующие правила валентности в то время не могли объяснить многообразие органических веществ.
А.М.Бутлеров, исходя из реальности атомов и молекул, обобщил существующие факты:
В 1823 году Ю. Либихом и Ф. Вёлером было открыто явление изометрии.
В 1876 году Ж. Дьюма и Р. Вулей на основе радикалов органических соединений была предложена первая теория строения.
Открытие валентности элементов (Е. Франкланд, 1852).
Определение четырехвалентности углерода (А. Кекуле, 1857).
Определение способности атомов соединиться друг с другом (А. Купер, А. Кекуле, 1957).
Введение валентных черточек, обозначающих химическую связь в атомных соединениях (А. Купер, 1858).
Разделение понятия "атом" и "молекула" и четкое их определение (Международный съезд в Карлсруэ, 1860).
А. М. Бутлеров ввел понятие о химическом строении вещества. Последовательная (упорядоченная) связь атомов в молекуле называется химическим строением.
Углерод в органических соединениях четырехвалентен и его атомы, соединяясь, образуют линейные, разветвленные и циклические цепи.
А. М. Бутлеров четко определил, что любое органическое вещество имеет конкретное химическое строение, которое выражается только одной формулой.
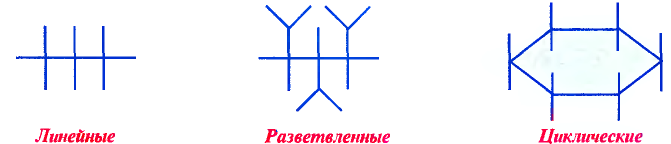
Например, в молекулах этана, этилена, ацетилена связанность атомов выражается следующим образом:
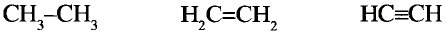
На основе структурной формулы можно предвидеть некоторые свойства вещества.
Химическое строение и свойства определенного вещества можно определить, изучив его реакции образования.
Второе положение: До А. М. Бутлерова знали о существовании изомеров, но не могли объяснить явление изомерии.
Вещества, имеющие одинаковую молекулярную массу, количественный и качественный состав, но различное химическое строение и обладающие поэтому различными физическими и химическими свойствами, называются изомерами.
А. М. Бутлеров сумел объяснить это явление. По его утверждению, разнообразие свойств веществ зависит от различного строения этого вещества. Действительно, диметиловый эфир и этиловый спирт имеют одинаковый качественный и количественный состав, однако различие свойств этих веществ объясняется различием в их строении:
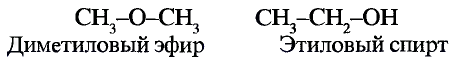
Некоторые свойства диметилового эфира и этилового спирта
Таблица 14
| Вещество | Формула | Струк-турная формула | Агре- гатное состояние, n.sh. | Темпе-ратура кипения, °С | Взаимо- действие с щелочными металлами |
| Диметиловый эфир | C2H6O | CH3-O-CH3 | Газ | -23,6 | - |
| Этиловый спирт | C2H6O | CH3-CH2-OH | Жидкость | 78,6 | + |
Атомы свободно вращаются вокруг  связей. Поэтому насыщенным углеводородам из-за разнообразного соединения атомов углерода присуща изомерия углеродного скелета. Ненасыщенным углеводородам присуща разветвленная изомерия и изомерия положения двойной связи. Расположение замещающих групп по разным сторонам двойной связи (если замещающие группы находятся по одну сторону плоскости двойной связи, то образуется цис-, а если они находятся по разные стороны плоскости двойной связи - транс-изомерия) приводит к образованию геометрической (пространственной) изомерии.
связей. Поэтому насыщенным углеводородам из-за разнообразного соединения атомов углерода присуща изомерия углеродного скелета. Ненасыщенным углеводородам присуща разветвленная изомерия и изомерия положения двойной связи. Расположение замещающих групп по разным сторонам двойной связи (если замещающие группы находятся по одну сторону плоскости двойной связи, то образуется цис-, а если они находятся по разные стороны плоскости двойной связи - транс-изомерия) приводит к образованию геометрической (пространственной) изомерии.
А. М. Бутлеров, предположив существование двух изомеров бутана, в 1867 году синтезировал их:
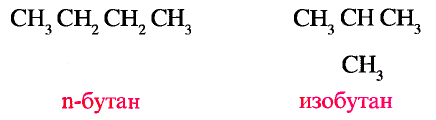
Теория химического строения дала объяснение многообразию органических соединений. Она смогла показать, что причиной тому является изомерия и способность четырехвалентного углерода образовывать разветвленные и циклические цепи.
Третье положение: Из неорганической химии известно, что в таких соединениях, как вода (Н2O), аммиак (NH3) и соляная кислота (НСl) водород ведет себя по-разному. В соляной кислоте водород легко замещается металлами, в воде только щелочным и и щелочноземельными металлами, а из аммиака его вытеснить очень трудно. Это объясняется различным влиянием кислорода, хлора и азота на атом водорода.
По мнению А. М. Бутлерова, атомы в молекулах взаимодействуют друге другом на основе химического соответствия. Образование молекулы происходит на основе химического взаимодействия атомов, что приводит к определенному порядку в молекулах. Поэтому свойства одного и того же элемента в различных соединениях отличаются от свойств элемента, состоящего из одних и тех же атомов. Взаимодействие атомов является главным в теории химического строения.
Таким образом, А. М. Бутлеров понятие "химическое строение" объяснил не только как упорядоченность атомов в молекуле, но и как порядок их взаимосвязи и взаимодействия. В то время он не знал, как можно изобразить взаимодействие атомов, но понимал, что они соединяются в определенном порядке и не являются суммой а томов в молекуле.
Теория химического строения органических соединений нашла свое дальнейшее развитие в трудах таких русских ученых, как А. М. Зайцев, В. В. Марковников, А. Е. Арбузов.
Узбекский ученый А. Г. Максумов, связав теорию химического строения с электронным и пространственным строением, усовершенствовал существующую формулировку закона: "Природа сложной частицы связана с её составом, а также химическим, электронным и пространственным строением".
Современная электронная теория строения вещества подтвердила правильность теории химического строения А. М. Бутлерова и объяснила химическую связь и природу взаимодействия атомов в молекуле. Связанность атомов в органических молекулах на основе обычной ковалентной  и двойной
и двойной 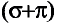 связей, четырехвалентность атома углерода, объясняющаяся его электронным строением, зависимость свойств вещества не только от состава, но и от природы химической связи, изменения электронного строения при образовании химической связи, зависящее от поляризации ковалентной связи, которая является результатом различной электроотрицательности атомов или группы атомов, - все это нашло свое подтверждение в современной электронной теории строения вещества.
связей, четырехвалентность атома углерода, объясняющаяся его электронным строением, зависимость свойств вещества не только от состава, но и от природы химической связи, изменения электронного строения при образовании химической связи, зависящее от поляризации ковалентной связи, которая является результатом различной электроотрицательности атомов или группы атомов, - все это нашло свое подтверждение в современной электронной теории строения вещества.
Предельные углеводороды
Углеводороды - самые простые органические вещества. Они состоят из атомов водорода и углерода. По характеру связи между атомами углерода в углеродном скелете, они подразделяются на предельные, непредельные и ароматические.
Предельные углеводороды: атомы углерода соединены друг с другом обычной связью, а остальные его валентности до предела предельны атомами водорода.
Предельные углеводороды подразделяются на ациклические и циклические.
Ациклические углеводороды - алифатические углеводороды некольцевого строения.
Циклические углеводороды - углеводороды кольцевого строения.
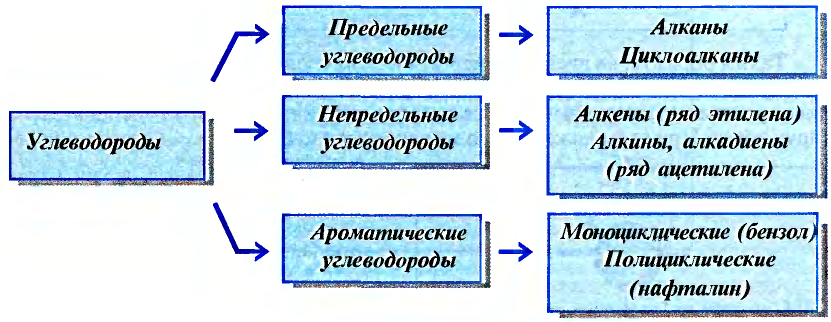
Предельные углеводороды ещё называют алканами, парафинами, алифатическими углеводородами.
Алканы - предельные углеводороды с открытой цепью
Они образуют гомологический ряд углеводородов, состав которых можно выразить общей формулой: СnН2n+2.
Ряд веществ, схожих по своему составу и химическим свойствам, но отличающихся друг от друга на СН2 гомологическую разность, называется гомологическим рядом.
В гомологический ряд предельных углеводородов входят: СН4, С2Н6, C3H8, С4Н10, С5Н12...и т.д.
Электронное строение алканов: Молекула метана имеет тетраэдрическое строение, величина угла между двумя С-Н связями равна 109°28'. Молекула этана состоит из двух углеродных тетраэдров и величина угла в С-Н связи также равна 109°28'. Все другие алканы имеют зигзагообразное пространственное строение, где величина угла С-Н связи в углеводородной цепи также равна 109°28'. Чтобы понять это, рассмотрим электронное строение метана. В невозбужденном состоянии атом углерода имеет ls22s22p2 электронное строение (А). В возбужденном состоянии наблюдается разделение 2s2 электронной пары и переход одного из электронов на 2р-орбиталь (Б).

Таким образом, на внешнем энергетическом уровне возбужденного атома углерода имеется четыре валентных электрона: один 2s и три 2р - электрона. 2р - электронных облака размещаются по осям х, у, z под углом 90° относительно друг друга. При этом кажется, что между углеродом и четырьмя атомами водорода ковалентная связь неодинакова. Если одна связь образуется между 2s-облаком углерода и 1s-облаком водорода, то остальные 3 связи образуются между 2рx, 2рy, 2pz электронными облаками углерода и 1s-электронным облаком водорода. На основе результатов эксперимента доказало, что в молекуле метана энергия в С-Н связи равномерно распределена и молекула симметрична- имеет форму правильного тетраэдра.
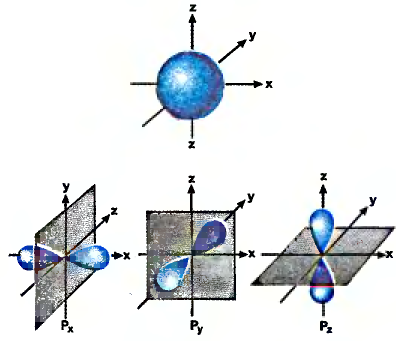
Рис. 16
В 1931 году великий ученый XX века Л. К. Полинг объяснил это явление. По его предположению, при образовании связи электронные облака перекрываются и выравниваются по форме орбиталей и энергии. Это явление называется гибридизацией, а вновь образованные орбитали - гибридными орбиталями.
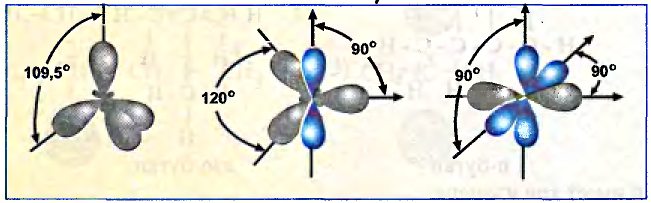
Рис. 17
В образовании С-Н связи в метане участвует гантелеобразная гибридная орбиталь, обозначаемая sp3 символом. Вытянутая гантелеобразная гибридная орбиталь сильнее перекрывается орбиталями присоединяемых атомов, что приводит к устойчивости молекулы. Эти sp3 гибридные орбитали, перекрываясь с четырьмя s орбиталями водорода и образуя 4s связи под углом 109°28' относительно друг к другу, формируют устойчивую молекулу тетраэдрической формы.
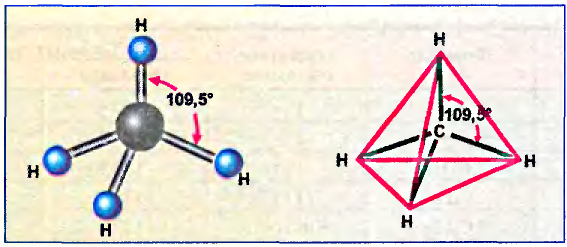
Рис. 18
В образовании  связи в молекуле алканов всегда участвуют sp3 орбитали. Молекула этана образуется семью s-связями: одна sp3-sp3 (С-С) связь и шесть sp3-s (С-Н) связей. Таким образом в алканах все связи гибридные. [Тетраэдрическая гибридизация свойственна NH4+, BH4+ ионам и частично наблюдается в молекуле воды (поэтому между ОН связью угол больше 90° и равен 104°; 90° характерен в основном негибридным
связи в молекуле алканов всегда участвуют sp3 орбитали. Молекула этана образуется семью s-связями: одна sp3-sp3 (С-С) связь и шесть sp3-s (С-Н) связей. Таким образом в алканах все связи гибридные. [Тетраэдрическая гибридизация свойственна NH4+, BH4+ ионам и частично наблюдается в молекуле воды (поэтому между ОН связью угол больше 90° и равен 104°; 90° характерен в основном негибридным  связям). В таких соединениях, как H2S, РН3, AsH3 угол связей равен 90°, и поэтому там гибридизация не наблюдается. Молекулы алканов неполярны.
связям). В таких соединениях, как H2S, РН3, AsH3 угол связей равен 90°, и поэтому там гибридизация не наблюдается. Молекулы алканов неполярны.
Изомерия и номенклатура: В гомологическом ряду алканов наблюдается изомерия углеродного скелета. Метан, этан, пропан не имеют изомеров. Бутан имеет два изомера С4Н10.
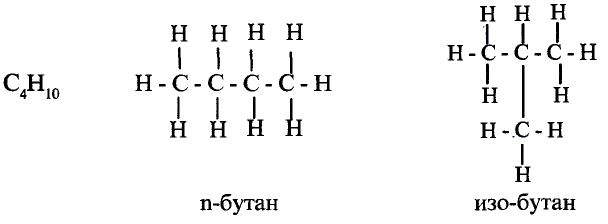
Пентан имеет три изомера.
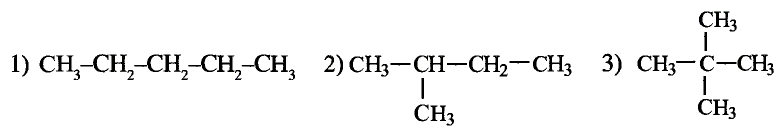
Обратите внимание на таблицу 14. В названии насыщенных углеводородов прибавляется окончание -ан. Метан, этан, бутан, пентан и т. д.
Предельные углеводороды. Общая формула СnН2n+2
Таблица 14
| Алкан | Формула | Агрегатное состояние | Температура, °C | |
| плавления | кипения | |||
| Метан | CH4 | Газ | -189,5 | -161,4 |
| Этан | C2H6 | Газ | -183 | -88,6 |
| Пропан | C3H8 | Газ | -189,9 | -42,2 |
| Бутан | C3H10 | Газ | 138,3 | -0,5 |
| Пентан | C5H12 | Жидкость | -129,7 | +36,0 |
| Гексан | C6H14 | Жидкость | -94,3 | +68,7 |
| Декан | C6H22 | Жидкость | -29,7 | +174,0 |
| Гексадекан | C16H34 | Твердый | +18,2 | +270,0 |
Если из молекулы насыщенного углеводорода отщепить один водород, то оставшаяся группа атомов называете» радикалом, и к названию радикала прибавляется окончание - ил. Метил, этил, пропил, пентил и т.д.
Наименования изомеров одинакового состава неодинаковы, например изомеры пентана. Поэтому на международных совещаниях по теоретической и практической химии была выработана номенклатура органических веществ.
При названии углеводородов применяются следующие правила и порядок:
1. Обращается внимание на углеводородную цепь и выделяется основная (самая длинная). Нумерация производится с того конца, к которому ближе присоединенный углеводородный радикал.
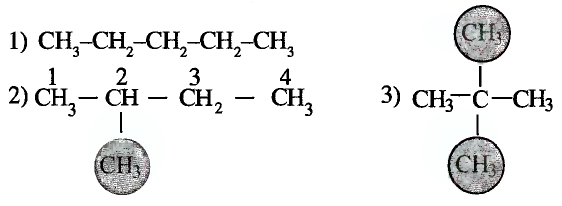
2. Обращается внимание к какому пронумерованному основанию цепи присоединен радикал. Если присоединен к одному углероду, то радикал в названии повторяется дважды: 2 метил, 2,2-диметил и т.д.
3. Название неразветвленной углеводородной цепи не изменяется.
1) n-пентан.
При названии углеводорода в начале указывается радикал и номер углерода, к которому он присоединен, затем называется название основной цепи.
2) 2-метилбутан 3) 2,2-диметилпропан
Гексан имеет 5 изомеров, определим их названия.
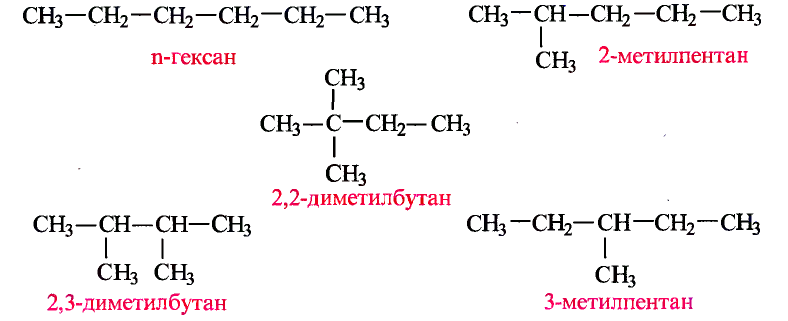
Физические свойства и распространенность в природе: По мере увеличения числа атомов углерода в углеводородах увеличивается их температура плавления и кипения. Все алканы легче воды и не растворимы в ней. Они широко распространены в природе и имеются в составе нефти, природного и попутного газа.
Химические свойства: Так как у алканов все валентности насыщены, то с химической точки зрения они инертны. Химические свойства алканов рассмотрим на примере метана.
Метан
Физические свойства и распространенность в природе: Метан - простейший представитель алканов, газообразное вещество без цвета, запаха, легче воздуха и плохо растворимое в воде. В составе природного газа на его долю приходится 90-98%. Он входит в состав торфа и попутных газов, образующихся при сухой перегонке каменного угля и переработке нефти.
В большинстве случаев метан еще называют болотным или рудным газом. Он образуется при гниении растений без доступа воздуха, при медленном распаде каменного угля.
Химические свойства: Метан также как и другие представители алканов не участвует в реакциях присоединения, не взаимодействует с перманганатом калия и растворами щелочей, а также на него не воздействуют бромная вода и холодный раствор концентрированной серной кислоты. Реакции окисления протекают только при высокой температуре.
Горение. Метан горит голубоватым пламенем (продемонстрируйте горение природного газа. Природный газ на 90-98% состоит из метана):
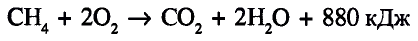
В результате выделения большого количества энергии при горении, метан применяется в качестве горючего. Смесь метана с кислородом в соотношении 1:2 и с воздухом 1:10 взрывоопасна.
Будьте осторожны при отоплении общественных зданий с использованием природного газа!
Разложение. При сильном нагревании (выше 1000°С) метан разлагается на простые вещества: водород и углерод:
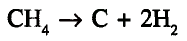
Реакции замещения. С галогенами, разбавленной азотной и серной кислотой метан вступает в реакции замещения. Галогенизация начинается под воздействием света. Под действием света разрываются ковалентные связи в молекуле галогена. При этом образуется свободный атом галогена (например хлора) с большой кинетической энергией и нечетным количеством электронов: С12  2С1. Атом галогена взаимодействует с углеводородом и образует радикал углеводорода: СН4+ С1
2С1. Атом галогена взаимодействует с углеводородом и образует радикал углеводорода: СН4+ С1 НС1 + СН3. Свободный углеводородный радикал вновь взаимодействует с молекулой галогена и образует атом галогена. Подобные реакции, представляющие собой цепь последовательных превращений, называют цепными реакциями. Протекают они по свободно-радикальному механизму и в результате образуется смесь галогеновых производных:
НС1 + СН3. Свободный углеводородный радикал вновь взаимодействует с молекулой галогена и образует атом галогена. Подобные реакции, представляющие собой цепь последовательных превращений, называют цепными реакциями. Протекают они по свободно-радикальному механизму и в результате образуется смесь галогеновых производных:
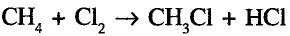 метилхлорид
метилхлорид
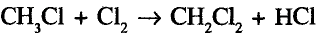 дихлорметан
дихлорметан
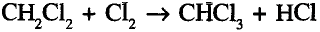 трихлорметан (хлороформ)
трихлорметан (хлороформ)
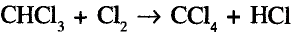 тетрахлорметан
тетрахлорметан
Под воздействием ультрафиолетовых лучей метан взаимодействует с хлором со взрывом:
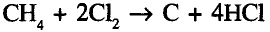
Получение: В производстве метан получают следующими методами:
1) при взаимодействии водорода и графита при температуре 500°С и в присутствии никелевого катализатора:
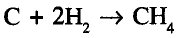
2) из водяного газа (этим методом можно получить и другие алканы):
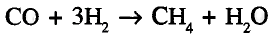
В лабораторных условиях метан получается следующими методами:
1) при взаимодействии карбида алюминия с водой:
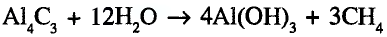
2) при нагревании смеси твердых ацетата натрия и гидроксида натрия:
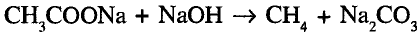
Алканы можно получить также при взаимодействии металлического натрия и галогенпроизводных углеводородов (реакция Вюрца):
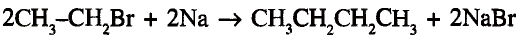
Применение метана и других алканов: Метан имеет большое практическое значение. Он применяется в качестве сырья при производстве многих химических продуктов. Такие вещества, как ацетилен, метанол, формальдегид являются готовой продукцией и важнейшим сырьем химического производства.
Особое место занимают окисление алканов, имеющих 20-25 атомов углерода. Таким путем получаются синтетические жирные кислоты с различной длиной углеводородной цепи, которые применяются для получения мыла, моющих средств, смазочных материалов, лаков, эмалей. Алканы применяются также и в качестве горючего.
Предельные циклические соединения (циклопарафины, циклоалканы, нафтены, полиметилены, цикланы).
Циклоалканы - предельные углеводороды с замкнутой цепью
Общая формула гомологического ряда циклоалканов - СnН2n. Их название образуется прибавлением к соответствующему алкану приставки - цикло. Например, С3Н6 - циклопропан, С4Н8 - циклобутан, С6Н2 - циклогексан.
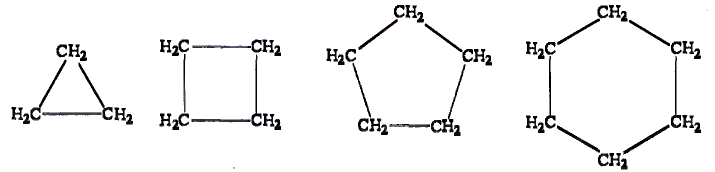
Циклоалканы впервые были выделены русским ученым В. В. Марковниковым в составе бакинской нефти и изучены. По физическим и химическим свойствам циклопарафины близки к парафиновым углеводородам: их агрегатное состояние в зависимости от числа атомов углерода в молекуле бывает газообразным, жидким и твердым. Химически малоактивны, горючи и атомы водорода в них могут замещаться галогенами. Устойчивость кольца циклоалканов различна; до пяти членов растет, с увеличением числа членов - уменьшается (теория Байера).
При определенных условиях происходит взаимодействие с галогенами и галогенводородами с образованием галогенпроизводных углеводородов с открытой цепью:
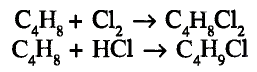
Непредельные углеводороды
- Непредельные углеводороды - это углеводороды, в молекулах которых атомы углерода связаны друг с другом посредством двойной или тройной связи.
- Важнейшими представителями непредельных углеводородов являются алкены (ряд этилена), алкадиены (ряд диеновых), алкины (ряд ацетилена).
- Алкены -углеводороды, в молекулах которых одна двойная связь.
- Алкадиены - углеводороды, в молекулах которых две двойные связи.
- Алкины - углеводороды, в молекулах которых одна тройная связь.
Алкены также называются олефинами, углеводородами этиленового ряда. Они образуют гомологический ряд с общей формулой СnН2n.
| Формула | Наименование | ||
| Эмпирическая | Структурная | Тривиальное | Международное |
| C2H4 | СН2=СН2 | Этилен | Этен-1 |
| C3H6 | СН2=СН-СН2 | Пропилен | Пропан-1 |
| C4H8 | СН2=СН-СН2-СН3 | Бутилен | Бутен-1 |
| C5H10 | СН2=СН-СН2-СН2-СН3 | Амилен | Пентен-1 |
| C6H12 | СН2=СН-(СН2)3-СН3 | Гексилен | Гексен-1 |
| C7H14 | СН2=СН-(СН2)4-СН3 | Гептилен | Гептен-1 |
| C8H16 | СН2=СН-(СН2)5-СН3 | Октилен | Октен-1 |
| C9H18 | СН2=СН-(СН2)6-СН3 | Нонилен | Нонен-1 |
| C10H20 | СН2=СН-(СН2)7-СН3 | Децилен | Децен-1 |
Алкины - углеводороды ацетиленового рада. Образуют гомологический ряд с общей формулой СnН2n-2.
| Формула | Наименование | ||
| Эмпирическая | Структурная | Тривиальное | Международное |
| C2H2 |  |
Ацетилен | Этан |
| C3H4 |  |
Метилацетилен | Пропин |
| C4H6 |  |
Этиладетилен | Бугин-1 |
| C5H8 | 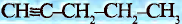 |
Пропилацетилен | Пентин-1 |
| C6H10 |  |
Бутилацетилен | Гексин-1 |
Электронное строение (на примере этена (этилена) и этина (ацетилена)). Алканы при сильном нагревании отщепляют водород, превращаясь в непредельные углеводороды
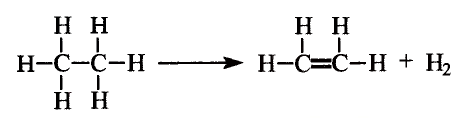
При этом, если расстояние между атомами углерода в этане составляет 0,154 нм, то в молекуле этилена оно уменьшается до 0,133 нм. Угол между связями соответственно увеличивается с 109°28' до 120°.
Современная теория строения вещества объясняет это следующим образом. За счет отделившихся атомов водорода соответствующие 2р-электрона атома углерода в этилене образуют  связь. Таким образом, атомы углерода связываются друг с другом посредством двойной связи, из которой одна
связь. Таким образом, атомы углерода связываются друг с другом посредством двойной связи, из которой одна  а другая
а другая  связь.
связь.
За счет sp2-гибридизации угол изменяется до 120°. В отличие от этана в этилене происходит гибридизация между одной s- и двумя р- орбиталями (рx и рy). Третья рz орбиталь, образующая  связь и обладающая минимальной электронной плотностью на плоскости
связь и обладающая минимальной электронной плотностью на плоскости  связи, в гибридизации не участвует. В результате у каждого атома углерода образуется три sp2 гибридных орбиталей, которые, удаляясь друг от друга, образуют на плоскости угол между осями 120°. Между углеродами гибридные орбитали образуют одну
связи, в гибридизации не участвует. В результате у каждого атома углерода образуется три sp2 гибридных орбиталей, которые, удаляясь друг от друга, образуют на плоскости угол между осями 120°. Между углеродами гибридные орбитали образуют одну  , а между водородами две
, а между водородами две  связи. Поэтому
связи. Поэтому 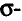 связи расположены на одной плоскости, а
связи расположены на одной плоскости, а  связь размещается на плоскости, перпендикулярной к первой. Такое размещение
связь размещается на плоскости, перпендикулярной к первой. Такое размещение  связи приводит к устойчивости молекулы этилена, но лишает ее свободного вращения. Поэтому в соединениях с двойной связью наблюдается геометрическая изомерия.
связи приводит к устойчивости молекулы этилена, но лишает ее свободного вращения. Поэтому в соединениях с двойной связью наблюдается геометрическая изомерия.
Геометрическая стереоизомерия возникает в результате различного пространственного расположения замещающих групп относительно двойной связи
Структурная изомерия связана с разветвленностью углеродной цепи и расположением двойной связи
Рис. 19
Длина связи между атомами углерода в этине гораздо короче, чем в этене 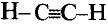 (0,120 нм). Угол между связями равен 180° и молекула имеет линейное строение. Сближение атомов углерода этина объясняется образованием второй
(0,120 нм). Угол между связями равен 180° и молекула имеет линейное строение. Сближение атомов углерода этина объясняется образованием второй  связи за счет
связи за счет  электронов атомов углерода. Тройная связь этина состоит из одной
электронов атомов углерода. Тройная связь этина состоит из одной  и двух
и двух  связей. В результате sp- гибридизации угол оказывается равным 180°. В отличие от этена в этине участвуют в гибридизации одна s и одна р-орбиталь. В результате каждый атом углерода становится обладателем двух sp гибридных облаков. Эти гибридные орбитали участвуют в образовании одной s-связи между атомами углерода и одной
связей. В результате sp- гибридизации угол оказывается равным 180°. В отличие от этена в этине участвуют в гибридизации одна s и одна р-орбиталь. В результате каждый атом углерода становится обладателем двух sp гибридных облаков. Эти гибридные орбитали участвуют в образовании одной s-связи между атомами углерода и одной  связи между s- орбиталями водорода. Молекула этина обладает пятью связями, из которых три
связи между s- орбиталями водорода. Молекула этина обладает пятью связями, из которых три  и две
и две  связи.
связи.
Изомерия: У алкенов, начиная с бутена, наблюдается структурная и геометрическая стереоизомерия, а у алкинов (начиная с бутана) - только структурная. Название алкенов образуется путем прибавления окончания -ен, а у алкинов —ин к наименованию соответствующего алкана, нумерация начинается со стороны кратной связи. Положение кратной связи обозначается номером после названия главной цепи.
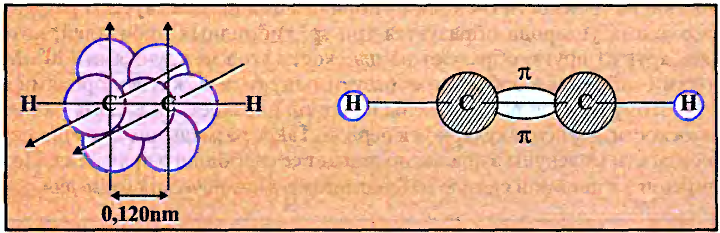
Рис. 20
Количество изомеров ненасыщенных углеводородов намного больше, чем у насыщенных. Потому что в структуре ненасыщенных углеводородов имеется 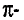 связь, которая также может менять свое местоположение. Изомеры пентена и их номенклатура.
связь, которая также может менять свое местоположение. Изомеры пентена и их номенклатура.
1) Изомерия за счет перемещения двойной связи:
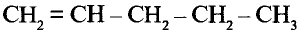 - пентен-1
- пентен-1
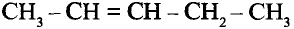 - пентен-2
- пентен-2
2) Изомерия за счет разветвления цепи:
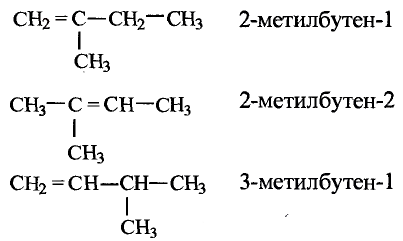
Стереоизомеры: Если замещающие группы находятся по одну сторону плоскости двойной связи, то перед наименованием алкена ставится префикс цис-, если по разные стороны, то - транс-. Например, бутен имеет цис- и транс-изомеры.
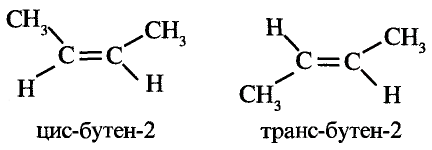
Физические свойства: Низшие алкены - газообразные вещества, начиная с С5Н10 и по С14Н28- это жидкости, высшие алкены - твердые вещества. Все алкены нерастворимы в воде и частично растворимы в спирте.
У алкинов первые три представителя это газы, начиная с С4 по С8 - жидкости, а высшие представители - твердые вещества.
Химические свойства: В отличие от алканов алкены и алкины химически активны. Рассмотрим их химические свойства на примере этилена - этена и ацетилена - этина. Образование р-электронами перекрывания за плоскостью молекулы приводит к уменьшению устойчивости 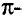 связи, что и является причиной химической активности ненасыщенных углеводородов. В химическую реакцию сначала вступают углероды при двойной или тройной связи. Поэтому для них характерны реакции присоединения.
связи, что и является причиной химической активности ненасыщенных углеводородов. В химическую реакцию сначала вступают углероды при двойной или тройной связи. Поэтому для них характерны реакции присоединения.
Присоединение галогенов (галогенирование):
При взаимодействии с бромной водой алкены и алкины ее обесцвечивают. Эта реакция применяется для качественного определения непредельных углеводородов.
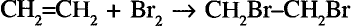 1,2-дибромэтан
1,2-дибромэтан
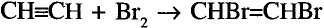 1,2-дибромэтен
1,2-дибромэтен
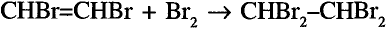 1,1,2,2-тетрабромэтан
1,1,2,2-тетрабромэтан
Присоединение водорода (гидрогенизация).
Эта реакция осуществляется в присутствии платины, палладия, никеля или другого металла в качестве катализатора:
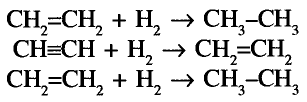
Присоединение галогеноводородов (правило Марковникова ):
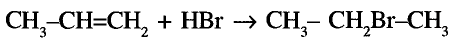 2-бромпропан
2-бромпропан
Присоединение галогенводородов к алкинам происходит при температуре 120-180°С и в присутствии активированного угля или солей ртути (II):
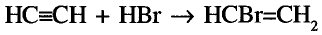 бромэтан
бромэтан
Современная теория строения вещества объясняет это следующим образом. Метальный радикал отдает электронную плотность (положительный индуктивный эффект), а винильный радикал  - притягивает к себе электроны (отрицательный индуктивный эффект). В результате несимметричная двойная связь частично поляризуется. Поэтому Н+ катион присоединяется к атому углерода с большей электронной плотностью, а Вr- анион - с меньшей.
- притягивает к себе электроны (отрицательный индуктивный эффект). В результате несимметричная двойная связь частично поляризуется. Поэтому Н+ катион присоединяется к атому углерода с большей электронной плотностью, а Вr- анион - с меньшей.
Присоединение веществ с активным атомом водорода к веществам, содержащим двойную связь, осуществляется в соответствии с правилом Марковникова: атомы водорода присоединяются к наиболее гидрогенизирован-ному атому углерода (остальная часть молекулы присоединяется к наименее гидрогенизированному атому углерода).
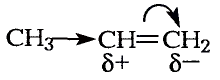
Присоединение воды (гидратация):
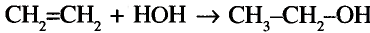 этанол
этанол
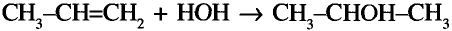 пропанол-2
пропанол-2
Присоединение воды к алкенам происходит также по правилу Марковнико-ва. Эта реакция обратима. Получение спиртов протекает при высоком давлении, температуре в присутствии фосфорной кислоты в качестве катализатора. При нагревании спиртов в присутствии концентрированной серной кислоты образуются алкены.
В промышленности присоединение воды к алкинам имеет особое значение: 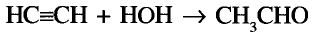 - уксусный альдегид
- уксусный альдегид
Эта реакция осуществляется в присутствии солей ртути - HgSO4, Hg(NO3)2.
Уксусный альдегид - важнейшее сырье для промышленности. Он применяется для получения пластмасс, этанола, уксусной кислоты. Эта реакция была осуществлена в 1881 году русским ученым М. Г. Кучеровым и носит его имя.
Окисление. Алкены и алкины легко окисляются. Водный раствор перманганата калия окисляет этилен до этиленгликоля, а ацетилен - до щавелевой кислоты:

Эта реакция, также как и реакция с бромной водой, применяется как качественная реакция на ненасыщенные углеводороды.
В присутствии кислорода и на воздухе алкены горят светло-желтым, а ацетилен - ярким ослепляющим пламенем:
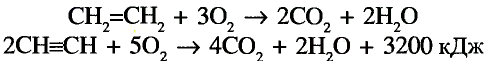
Реакция горения ацетилена применяется для резки и сварки металлов. Полимеризация. Алкенам и алкинам характерна реакция полимеризации.
- Полимеризация - это последовательное соединение молекул с образованием веществ с еще большим молекулярным весом
- В результате полимеризации образуется высокомолекулярное соединение
- Молекулу полимера называют макромолекулой
- Низшие молекулярные соединения, образующие макромолекулы, называются мономерами
При высокой температуре и давлении ( 15 1987 кПа) этилен превращается в полиэтилен. При этом двойная связь разрывается и образуются свободные связи:
15 1987 кПа) этилен превращается в полиэтилен. При этом двойная связь разрывается и образуются свободные связи:
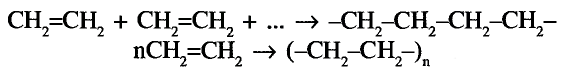
n - степень полимеризации. Эта величина непостоянна. Поэтому молекулярная масса полимера, обычно, усредненная величина. В этой реакции этилен-мономер, полиэтилен - полимер. Более подробно полимеры рассмотрим в разделе высокомолекулярных соединений.
Реакция полимеризации ацетилена в зависимости от условий протекания приводит к образованию различных соединений.
При пропускании ацетилена над раскаленным до 800°С углем, происходит образование бензола: 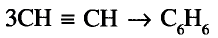
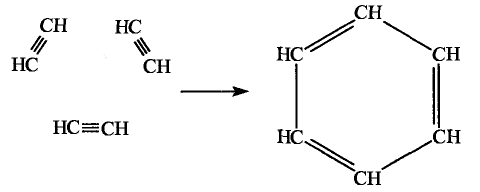
В присутствии солей меди (I) ацетилен образует винилацетилен:
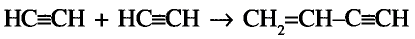
Винилацетилен является важнейшим сырьем в получении хлоропренового каучука.
Кислотные свойства. В отличие от алканов и алкенов, ацетилен обладает кислотными свойствами, т. е. его водород способен замещаться металлом. Например, если через аммиачный раствор солей серебра или меди пропустить ацетилен, то образуемые ацетилениды выпадают в осадок:
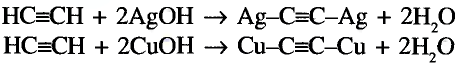
Ацетилениды меди и серебра при ударе взрываются. Карбид кальция также считается ацетиленидом.
Под воздействием кислот из ацетиленидов выделяется ацетилен:
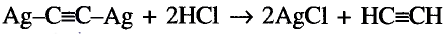
Кислотные свойства ацетилена объясняются сильной поляризацией С-Н связи по сравнению с этаном и этеном. Различие С-Н связи в алканах, алкенах и алкинах зависит от характера С-С связи.
Согласно современной теории строения вещества, насколько больше s-орбитали атома углерода участвуют в образовании  связи, настолько сильнее притягиваются электронные пары и сильнее поляризуется С-С связь. Поэтому у ацетилена С-Н связь поляризована сильнее, чем у алканов и алкенов.
связи, настолько сильнее притягиваются электронные пары и сильнее поляризуется С-С связь. Поэтому у ацетилена С-Н связь поляризована сильнее, чем у алканов и алкенов.
В образовании с-связи доля s-орбиталей у алканов составляет 25% (р-орбиталей 75%), алкенов - 33% (р-орбиталей 67%), алкинов - 50% (р-орбиталей 50%).
Получение. Соединения с двойной или тройной связью можно получить путем отщепления некоторых атомов у насыщенных углеводородов. Получение алкенов и алкинов основано именно на этом принципе.
Соединения с двойной связью получаются при реакциях отщепления галогенов из дигалогенпроизводных [1]; галогенида водорода из галогенпроизводных [2]; выделении воды из спирта [3]; отщеплении водорода из алканов (дегидрогенизация) [4]. Нижеследующие уравнения реакций напишите сами. При протекании этих реакций водород отщепляется от наименее гидрогенизированного атома углерода (правило Зайцева):
- 1. 1,2-дибромпропан + металлический цинк
- 2.2-бромбутан + (спирт, щелочь)
- 3. 2-бутанол + (А12O3 при 350-500°С или концен. H2SO4, ZnCl2)
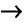
- 4. бутан + (Сr2О3, А12O3 при 450-600°С+КOH)
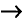
При крекинге и пиролизе нефтепродуктов получаются газы, состоящие из ненасыщенных алкенов (при 700°С 43% алкенов):
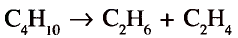
В условиях производства этилен получается дегидрогенизацией этана, частичной гидрогенизацией ацетилена, а в лабораторных условиях дегидратацией этанола в присутствии концентрированной серной кислоты:
Ацетилен же и в промышленности и в лабораторных условиях получают из метана и карбида кальция.
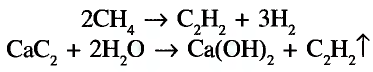
Применение: Этилен и ацетилен являются важнейшим сырьем в современной химической технологии органических веществ. Большая часть этилена применяется в получении полиэтилена. Остальная часть - в синтезе таких органических веществ, как этанол, хлорэтан, винилхлорид, стирол и др. Свойство этилена способствовать дозреванию применяется при перевозке сельскохозяйственной продукции (в особенности фруктов) на дальние расстояния. Из ацетилена получают этиловый спирт, уксусную кислоту, синтетические каучуки, поливинил хлорид и полифторвинильные пластмассы.
Углеводороды, имеющие в молекуле две и более двойных связей
При наименовании алкадиенов и полиенов к названию соответствующего ал-кана прибавляется окончание -диен и цифрой указывается местоположение двойной связи.
Таблица 17
| Формула | Наименование | ||
| Эмпирическая | Структурная | Тривиальное | Международное |
| C3H4 | СН2=C=СН2 | Пропадиен | |
| C4H6 | СН2=C=CH-СН3 | Бутадиен-1,2 | |
| СН2=CH-CH=СН2 | Дивинил | Бутадиен-1,3 | |
| C5H8 | СН2=C=CH-СН2-СН3 | Пентадиен-1,2 | |
| СН2=CH-CH=СН-СН3 | Пентадиен-1,3 | ||
| СН2=CH-CH2-СН=СН2 | Пентадиен-1,4 | ||
| СН2=C(CH3)-СН=СН2 | Изопрен | 2-метилбутадиен-1,3 | |
Изомерия: Для алкадиенов характерна структурная и стереоизомерия. Если в вышепредставленной таблице такие изомеры, как бутадиен-1,2 и бутадиен-1,3, пентадиен-1,2 и пентадиен-1,3, а также пентадиен-1,4 отличаются по месту расположения двойных связей, то 2-метилбутадиен-1,3 отличается разветвленнос-тью углеродной цепи.
Электронное строение: Из вышепредставленной таблицы видно, что местоположение двойных связей может быть различно. Большой практический интерес представляют те алкадиены, в молекуле которых двойные связи чередуются. Наиболее важные из них дивинил и изопрен. У дивинила все атомы расположены на одной плоскости, и длина двойной связи в цепи 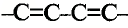 равна 0,133 нм, а длина
равна 0,133 нм, а длина
Рис. 21
простой связи между ними 0,146 нм. Отсюда видно, что длина этой связи равна средней величине длины простой (0,154 нм) и двойной (0,133 нм) связи.

Физические свойства: Дивинил - бесцветный газ, кипящий при -5°С. Изопрен - бесцветная жидкость, кипящая при 34°С.
Химические свойства: Алкадиены также как и алкены обесцвечивают бромную воду и присоединяют галогеноводороды. При этой реакции одновременно разрываются две двойные связи, присоединение происходит к первому и четвертому атому углерода, а между вторым и третьим атомами углерода образуется двойная связь:
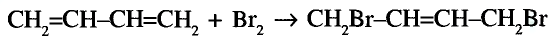
Таким образом, у диеновых углеводородов реакция присоединения протекает с переносом двойной связи (миграция двойной связи).
Полимеризацией алкадиенов (дивинила) получают полимерные каучуки (ци-виниловый каучук):
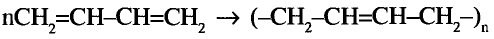
Природный каучук: Каучук - высокоэластичный материал, получаемый из латекса млечного сока некоторых тропических растений, таких как гивея. Латекс - коллоидный раствор каучука в воде. При нагревании или воздействии кислоты каучук коагулируется. Затем он отделяется от жидкости и высушивается. Каучук растворяется в сульфиде углерода, бензине и бензоле. Важнейшее свойство каучука это его эластичность и водонепроницаемость. Природный каучук считается полимером изопрена. При образовании молекулы каучука изопрен полимеризуется:
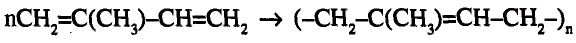
Молекула каучука имеет линейное строение. Метиленовые группы природного каучука  располагаясь по одну сторону двойной связи, образуют молекулы стереорегулярного строения в цис-положении. Молекулы каучука сильно закручены и изогнуты, при его растягивании молекулы выпрямляются и образец каучука удлиняется. После прекращения воздействия на молекулу, в результате перемещения внутреннего тепла, звенья принимают исходное изогнутое положение и размеры каучука сокращаются.
располагаясь по одну сторону двойной связи, образуют молекулы стереорегулярного строения в цис-положении. Молекулы каучука сильно закручены и изогнуты, при его растягивании молекулы выпрямляются и образец каучука удлиняется. После прекращения воздействия на молекулу, в результате перемещения внутреннего тепла, звенья принимают исходное изогнутое положение и размеры каучука сокращаются.
При нагревании каучук размягчается и становится липким, а при низких температурах - жестким и хрупким. Эти недостатки устраняются при нагревании его с серой.
Вулканизация - процесс получения резины при нагревании каучука с серой
Сера присоединяется по месту двойных связей полимера и как бы "сшивает" молекулы каучука друг с другом. В результате образуется резина - сшитый полимер, имеющий пространственное строение. Резина, по сравнению с сырым каучуком, эластичнее, устойчива к температуре и не растворима в растворителях (например, в бензине она нерастворима). Это объясняется тем, что в резине кроме межмолекулярных сил линейных макромолекул имеются силы химических связей. Если при вулканизации каучука добавляется до 32% серы, то полученный продукт называется эбонитом. Эбонит - твердое вещество с изоляционными свойствами. Каучук имеет большое народнохозяйственное значение, он широко применяется в автомобильной, авиационной и электротехнической промышленности, а также в медицине.
Ароматические углеводороды
Изомерия и номенклатура: В ароматических углеводородах наблюдается изомерия положения углеводородного радикала. Ниже приведены изомеры ксилола: орто-ксилол или 1,2-диметилбензол; мета-ксилол или 1,3-диметилбензол; пара-ксилол или 1,4-диметил бензол.
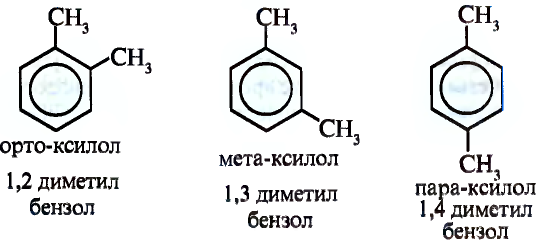
Электронное строение: Самым простым представителем ароматических углеводородов является бензол По эмпирической формуле - это сильно ненасыщенное соединение. В 1865 году немецкий ученый А. Кекуле предложил для бензола циклическое строение с шестью членами, где двойные связи чередуются.
Однако эта формула не полностью отражает свойства бензола. Бензол не проявляет свойства ненасыщенных углеводородов: не обесцвечивает бромную воду и раствор перманганата калия, ему характерны реакции присоединения. Кроме этого сила химической связи между атомами углерода в бензольном кольце одинаково сильная, строение их одинаково и расстояние между ними равно 0,139 нм (в простой связи это расстояние равно 0,154 нм; в двойной - 0,133 нм). Эти факты подтверждены современной теорией строения атома. Согласно этой теории каждый атом углерода в бензольном кольце находится в состоянии 8р2-гибридизации. С соседними атомами углерода и водорода углерод связан 3 мя простыми  связами. В результате образуется шестигранник, где С-С и С-Н связи расположены на одной плоскости. Четвертое гантелеобразное р-электронное облако, которое не участвует в гибридизации, расположено перпендикулярно к этому шестиугольнику и перекрывает эту плоскость и сверху и снизу, в результате возникает общая для всех атомов углерода шестиэлектронная
связами. В результате образуется шестигранник, где С-С и С-Н связи расположены на одной плоскости. Четвертое гантелеобразное р-электронное облако, которое не участвует в гибридизации, расположено перпендикулярно к этому шестиугольнику и перекрывает эту плоскость и сверху и снизу, в результате возникает общая для всех атомов углерода шестиэлектронная  связь.
связь.
Современная структурная формула бензола изображается при помощи шестиугольника, внутри которого двойные связи представляются либо непрерывной линией - кругом, либо пунктиром, а также формулой Кекуле.
Физические свойства: Бензол - летучая, легковоспламеняющаяся, бесцветная, нерастворимая в воде жидкость со своеобразным запахом. Пары бензола с воздухом образуют взрывоопасную смесь. Жидкий бензол и его пары ядовиты. Многие ароматические углеводороды, в нормальных условиях, бесцветные жидкости, нерастворимые в воде.
Химические свойства: Бензол и другие ароматические углеводороды отличаются от насыщенных и ненасыщенных углеводородов. Им, по сравнению с насыщенными углеводородами, характерны легко идущие реакции замещения.
Реакции замещения:
Галогенирование - это замещение в бензольном кольце атома водорода в присутствии катализатора (А1С13, FeCl3, Fe):
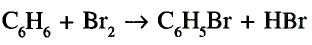
Полученный бромбензол - бесцветная жидкость, тяжелее воды и кипящая при 156°С.
Нитрование - это замещение атома водорода в бензольном конце на нитро-группу в присутствии серной кислоты:
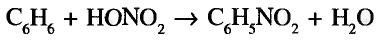
Реакции сульфонирования - это замещение атома водорода остатком серной кислоты - SO2OH группу:
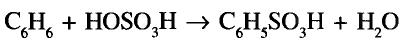
Реакции присоединения:
Гидрогенизация - насыщение бензольного кольца водородом протекает в присутствии никелевого или платинового катализатора, при 200°С и 5066,25 кПа:
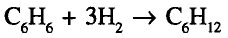 циклогексан
циклогексан
Эта реакция обратима и при 300°С и атмосферном давлении происходит дегидрогенизация.
Присоединение галогенов - галогены присоединяются к бензолу под воздействием света, например хлор. Под воздействием ультрафиолетовых лучей образуется гексахлорциклогексан:
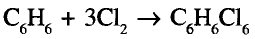 гексахлорциклогексан
гексахлорциклогексан
Реакции окисления:
Бензол устойчив к воздействию окислителей. При взаимодействии с кислородом горит сильно дымя:
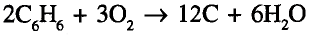
Получение: Бензол и его гомологи выделяются из каменноугольной смолы, которая образуется при коксовании каменного угля. В настоящее время арены выделяют и из нефти (см. Химические свойства ацетилена).
Применение: Бензол и его гомологи применяются для получения нитробензола, высокомолекулярных соединений, хлорбензола, красок, лекарств, препаратов, применяемых для борьбы с сельскохозяйственными вредителями.
Природные источники углеводородов
Каменный уголь, нефть и природный газ, а также продукты их переработки требуют при их ежедневном применении определенной безопасности.
Основными природными источниками углеводородов считаются каменный уголь, нефть, природный газ.
Каменный уголь: Кроме топлива уголь применяется в получении кокса, который необходим для плавления железа в металлургической промышленности.
Получение кокса осуществляется на специальных предприятиях по производству кокса. Каменный уголь нагревается в специальных коксовых печах до 1000°С без доступа воздуха, что называется сухой перегонкой (коксованием), в результате образуется пористое соединение (субстанция) - кокс, состоящее из смеси летучих веществ, углерода и пепла. При охлаждении этой смеси до 25-79°С образуются такие вещества, как каменноугольная смола, аммиачная вода и коксовый газ.
До недавнего времени каменноугольная смола выбрасывалась как отход газовой и коксохимической промышленности, сейчас она используется в качестве сырья для получения целого ряда органических веществ. Для этого она направляется на фракционную перегонку, в результате образуется несколько фракций: 1) при температуре кипения 170°С - легкое масло, состоящее из аренов и его производных (бензола, толуола, ксилолов и т.д.); 2) в интервале температур кипения 170-230°С - среднее масло, состоящее из фенола нафталина; 3) в интервале температур кипения 230-270°С - тяжелое масло, состоящее из нафталина и его гомологов; 4) при 270-350°С - антраценовое масло, состоящее из антрацена, фенантрена и т.д; 5) пек (гарь) черная остаточная масса.
Аммиачная вода, являясь водным раствором, состоящим го хлорида аммония и карбоната, используется в производстве азотных удобрений.
В состав коксового газа входят бензол, толуол, ксилолы, фенол, аммиак, сероводород, цианистые соединения и другие вещества. Из коксового газа отдельно отделяют аммиак, сероводород, цианистые соединения, затем бензол и другие ценные вещества.
Сжигание каменного угля - это не самый эффективный способ его использования. Самый эффективный путь с точки зрения экологии и экономики - это переработка в газообразные и жидкие виды топлива, извлечение ценных примесей и т.д. В настоящее время разработаны технологии, способные перерабатывать уголь в жидкие топлива - бензин, дизельное топливо, мазут.
Нефть - маслянистая жидкость, от желтого или бурого до темного цвета, состоящая из смеси газообразных жидких и твердых углеводородов, со своеобразным запахом, легче воды, и с плотностью от 730 до 860 кг/м3.
Кроме углеводородов го нефти получают нафтеновые кислоты, серу и соединения азота. Состав нефти различных месторождений неодинаков. Нефть, являющаяся основным источником жидкого топлива для двигателей внутреннего сгорания и ценным сырьем химической промышленности, используется для получения синтетического каучука, пластмасс, химических волокон и многих других продуктов. При переработке нефть предварительно очищается от газов, воды и сернистых соединений, нафтеновых кислот и солей. Затем она направляется на фракционную перегонку. При этом образуется несколько фракций: 1) бензин (35-195°С), содержащий углеводороды С4-С12; 2) керосин (200-300°С), содержащий углеводороды С9-С16; 3) выше 300°С образуется мазут, состоящий из углеводородов, кипящих при высокой температуре.
При вторичной перегонке бензина и керосина получают специальное топливо различной марки, различные сорта авиационного и автомобильного топлива, бытовой, легкий, тяжелый керосин. Керосин - топливо для ракетных двигателей.
Мазут является топливом для паровых котлов и сырьем для получения смазочных масел, вазелина, парафина. Он перегоняется под воздействием сильно нагретого пара (для предотвращения расщепления углеводородов). Из мазута получают целый ряд минеральных масел, такие как автомобильное, автол, авиационное.
Остатки нефтеперегонки, называемые нефтяным огаром (пек) или асфальтом, применяются как дорожное покрытие.
При прямой перегонке нефти общий выход бензина составляет 5-14%. Для увеличения выхода бензина за счет других фракций, его подвергают крекингу:
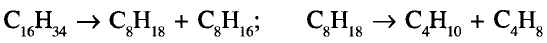
Крекинг нефти увеличивает выход нефти до 65-70%. Большое практическое значение имеют и газы, которые образуются при крекинге. Они содержат ненасыщенные углеводороды, которые являются сырьем химической промышленности.
При добыче нефти встречаются растворенные или свободные природный и попутные газы. В их составе метана меньше и они, в основном, своем составе имеют этан, пропан, бутан и другие углеводороды.
Нефтехимические предприятия (заводы по переработке, перегонке нефти, заводы органического синтеза) занимают одно из первых мест по загрязнению окружающей среды, наносят вред организму человека. Поэтому для сохранения чистоты и защиты окружающей среды является актуальной проблемой сегодняшнего дня внедрение безотходных технологий, проектирование конструкций, позволяющих комплексную переработку сырья.
Природные газы: Состав природного газа изменяется также в зависимости от месторождения его основную часть составляет метан, остальную такие газообразные углеводороды, как этан, пропан, бутан, пентан.
Природные газы используются как топливо и являются сырьем химической промышленности. В качестве сырья используются также метан, пропан, бутан и другие углеводороды, которые отделяются путем низкотемпературного фракционирования или адсорбции, затем фракционирования.
Большие запасы каменного угля, нефти и газа, поэтому соответствующие перерабатывающие отрасли химической промышленности работают эффективно.
В настоящее время перед человечеством стоит проблема решения все возрастающей потребности в энергии, которую можно решить заменив органическое топливо энергией солнца, ветра, силой рек, морей, океана, атомной энергией, использованием биологических отходов, а высвободившееся органическое топливо решит проблему химического сырья. Именно в этой области многие ученые ведут свои исследования.
Кислородосодержащие органические соединения
Одноатомные спирты
До настоящего момента мы изучали органические соединения, состоящие из углерода и водорода. Кроме этих элементов известны многие вещества, в состав которых входит кислород. Это - спирты, фенолы, альдегиды, кетоны, органические кислоты, простые и сложные эфиры.
- Спирты - углеводородные производные, в составе которых один или несколько атомов водорода замещены на функциональную группу - ОН.
- Спиртам характерна водородная связь.
- Общая формула спиртов ROH, где R - углеводородный радикал, и в зависимости от радикала различают насыщенные и ненасыщенные спирты.
- В зависимости от количества гидроксогрупп, различают одноатомные (одна ОН-группа) и двухчили многоатомные (несколько ОН-групп) спирты.
- Спирты называются первичными, если гидроксогруппа присоединена к первичному атому углерода (R-CH2-OH), вторичными - если к вторичному атому углерода (R2CH-OH), и третичными - если к третичному атому к углерода (R3C-OH). R может быть различным углеводородным радикалом.
Одноатомные насыщенные спирты имеют общую формулу СnН2n+1ОН и образуют гомологический ряд, в котором они отличаются друг от друга СН2-метиленовую группу. Простейшие представители гомологического ряда метанол, этанол, пропанол.
Номенклатура: При наименовании спиртов, наряду с тривиальной (метиловый, этиловый, пропиловый спирты, глицерин), широко применяется и международная номенклатура. При этом к наименованию соответствующего углеводорода добавлением суффикса -ол и цифрой указывается тот атом углерода, при котором находится ОН-группа, причем нумерацию начинают с ближайшего к гидроксогруппе углерода.
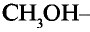 метанол
метанол 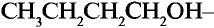 бутанол-1 (бутан- 1-ол)
бутанол-1 (бутан- 1-ол)
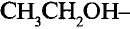 этанол
этанол
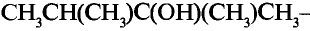 2,3-диметилбутанол-2
2,3-диметилбутанол-2
Изомерия: Спиртам характерна как изомерия углеродного скелета, так и положения гидроксильной группы. Поэтому спирты в отличие от соответствующих углеводородов имеют больше изомеров. Изомерия начинается с пропанола (пропанол-1 и пропанол-2).
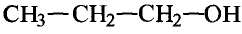 пропанол-1
пропанол-1
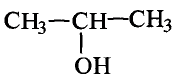 пропанол-2
пропанол-2
Межклассовую изомерию одноатомных спиртов можно наблюдать в ряду простых эфиров.
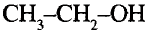 этанол
этанол
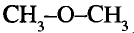 диметиловый спирт
диметиловый спирт
Физические свойства: Спирты, имеющие в своем составе до 15 атомов углерода - жидкости (с водородной связью), свыше - это твердые вещества. Все спирты легче воды. Метанол, этанол и пропанол полностью растворяются в воде. С повышением молекулярной массы растворимость спиртов в воде уменьшается. Высшие спирты в воде не растворимы. По сравнению с соответствующими углеводородами высокая температура плавления, кипения и растворимость спиртов объясняется наличием водородной связи.
Химические свойства: Химические свойства спиртов зависят от гидроксильной группы и углеводородного радикала. Спирты, как и все органические вещества, горят:
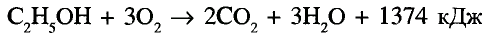
Химические реакции, связанные с гидроксильной группой, можно классифицировать следующим образом:
1. Реакции, идущие с разрывом О-Н связи:
Взаимодействуя с активными металлами, спирты образуют этилаты
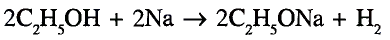 этилат натрия
этилат натрия
Образование простых эфиров (спирты, взаимодействуя друг с другом, образуют простые эфиры)
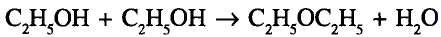 диэтиловый эфир
диэтиловый эфир
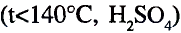
Образование сложных эфиров (спирты, взаимодействуя с органическими и неорганическими кислотами, образуют сложные эфиры)
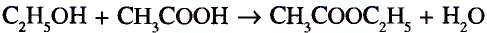 уксусноэтиловый эфир
уксусноэтиловый эфир
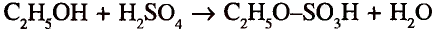 сульфоэтил эфир
сульфоэтил эфир
2. Реакции, идущие с разрывом С-О связи:
Взаимодействуя с галогенводородными кислотами, спирты образуют галогеналканы
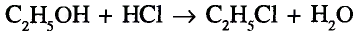
(реакция протекает при нагревании в присутствии H2SO4)
3. Химические реакции, идущие с участием и гидроксильной группы и углеводородного радикала.
При дегидратации спиртов в зависимости от условий образуются различные алкены
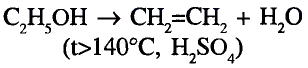
Одновременной дегидрогенизацией и дегидратацией можно получить бутадиен-1,3.
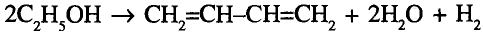 бутадиен-1,3
бутадиен-1,3
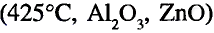
Окисление. Спирты под воздействием сильных окислителей (М: KMnO4+H2SO4) образуют альдегиды и кислоты.
при окислении в первой стадии образуется альдегид:
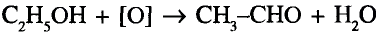 уксусный альдегид
уксусный альдегид
при продолжении окисления образуется кислота:
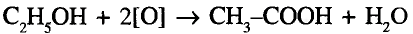 уксусная кислота
уксусная кислота
Метиловый спирт: Метиловый спирт (метанол, карбинол, древесный спирт) - простой одноатомный спирт, подвижная бесцветная жидкость, сильный яд (при попадании в организм около 30 г метанола приводит к потере зрения, свыше - к смерти). Метанол синтезируется при взаимодействии оксида углерода (II) и водорода при температуре 300-400°С, давлении 5 мПа и в присутствии оксида цинка и оксида меди (II) в качестве катализаторов:
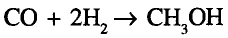
Метанол также можно получить при сухой перегонке древесины. Он применяется при получении формальдегида, красок, фотореактивов, фармацевтических препаратов и в качестве растворителя.
Этиловый спирт: Этиловый спирт - бесцветная подвижная жидкость. Кипит при 78,3°С и замерзает при -114°С. Используется в термометрах, которые применяются для измерения низких температур, горит слабо-ярким пламенем. Этиловый спирт образуется при брожении сахаристых веществ. Сущность брожения в том, что глюкоза, или виноградный сахар С6Н12O6, образующийся из крахмала, под воздействием ферментов расщепляется на спирт и углекислый газ:
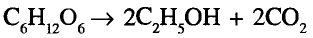
Природные продукты, богатые крахмалом - это картофель, злаки, используются для производства спирта. В настоящее время широко применяется метод получения спирта из древесины.
В промышленности большое значение имеет способ получения этанола прямой гидратацией этилена, образуемого при крекинге нефти.
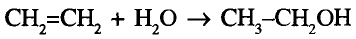
Реакция осуществляется при температуре 260-300°С, давлении 7,5-10 мПа ив присутствии соответствующего катализатора.
В будущем будет широко внедрен способ получения этанола из древесины и отходящих газов нефтеперерабатывающей промышленности.
Этиловый спирт используется в производстве синтетического каучука, пластмасс, парфюмерных изделий, лекарств, как растворитель в производстве лаков, консервации анатомических препаратов, диэтилового эфира, красок, уксусной кислоты, бездымного пороха и др., а так же в двигателях внутреннего сгорания.
Этанол оказывает отравляющее воздействие на организм, нарушая обмен веществ, и даже употребление небольших количеств приводит к алкоголизму. Это способствует заболеваниям печени и сердца, дегенеративным изменениям мозга, нарушению психики и наследственным изменениям.
Многоатомные спирты
Строение и физические свойства: Этиленгликоль (двухатомный) и глицерин (трехатомный) являются важнейшими представителями гомологического ряда многоатомных спиртов. Гидроксильные группы в них и других многоатомных спиртах находятся у различных атомов углерода: при одном атоме углерода не может находиться две гидроксильные группы, так как это приводит к неустойчивости соединения (сравните с угольной кислотой, которая существует только в водном растворе).
Этиленгликоль и глицерин-сиропообразные жидкости, хорошо растворимые в воде. Этиленгликоль ядовитый, а глицерин гигроскопичное, неядовитое, хорошо усваиваемое организмом вещество.
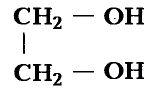 этандиол (этиленгликоль)
этандиол (этиленгликоль)
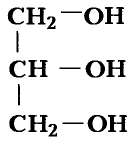 пропантриол (глицерин)
пропантриол (глицерин)
Химические свойства. Из-за наличия гидроксильной группы свойства многоатомных спиртов схожи со свойствами одноатомных спиртов:
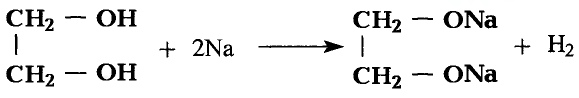
этиленгликолят натрия
Взаимодействуя с органическими и минеральными кислотами, образуют сложные эфиры:
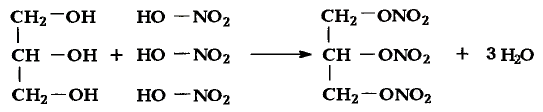 тринитроглицерин
тринитроглицерин
Нитроглицерин - тяжелая маслянистая жидкость, которая взрывается при легком встряхивании и нагревании. Применяется в медицине и изготовлении динамита. При взаимодействии глицерина с карбоновыми кислотами образуются сложные эфиры.
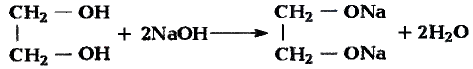 этиленгликолат натрия
этиленгликолат натрия
Алкоголяты меди имеют ярко-синий цвет. Взаимодействие многоатомных спиртов с гидроксидом меди (II) является качественной реакцией.
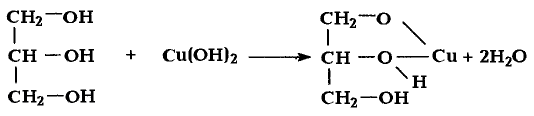 глицерат меди (II)
глицерат меди (II)
Получение и применение. Многоатомные спирты получаются при взаимодействии галогенпроизводных соответствующих углеводородов с водными растворами щелочей:
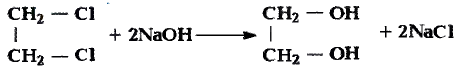
1,2-дихлорэтан
Глицерин получают из жиров, непищевого (синтетическим способом из газов, образуемых при крекинге нефти) сырья.
В зимнее время водные и спиртовые растворы глицерина и этиленгликоля применяются в качестве антифриза - жидкости, не замерзающей при низких температурах, которую заливают в радиаторы авто-и авиамоторов.
Этиленгликоль применяется в производстве синтетического волокна лавсана, глицерин же применяется при получении синтетической смолы и взрывчатых веществ (нитроглицерина).
Глицерин широко применяется как гигроскопичное вещество. В медицине глицерин используется для смягчения кожи рук и приготовления мазей, в кожевенном производстве, в текстильной промышленности - для отделки тканей с целью придания им мягкости и эластичности.
Фенолы
Подобно углеводородам с открытой цепью у ароматических углеводородов известны гидроксипроизводные.
Гидроксипроизводные ароматических углеводородов, в молекулах которых гидроксильные группы связаны с бензольным ядром, называются фенолами.
Простой фенол - одноатомное гидроксипроизводное бензола.
Электронное строение фенола: В феноле гидроксильная группа связана с бензольным ядром, который проявляет отрицательный индукционный эффект. При взаимодействии свободной электронной пары кислорода с я-электронами бензола, электронная плотность от кислорода сдвигается в сторону С-О связи, кислород же сильнее притягивает к себе электронную пару О-Н 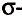 связи. Поэтому водород в гидроксильной группы фенола более подвижен, чем в спиртах. Фенол обладает свойствами слабой кислоты. Вместе с тем гидроксильная группа, в первую очередь, приводит к перераспределению электронной плотности бензольного ядра. В результате водород бензольного ядра в положении 2,4,6 становится более подвижным. Фенолы по сравнению с бензолом легко вступают в реакцию.
связи. Поэтому водород в гидроксильной группы фенола более подвижен, чем в спиртах. Фенол обладает свойствами слабой кислоты. Вместе с тем гидроксильная группа, в первую очередь, приводит к перераспределению электронной плотности бензольного ядра. В результате водород бензольного ядра в положении 2,4,6 становится более подвижным. Фенолы по сравнению с бензолом легко вступают в реакцию.
Физические свойства фенола: Фенол - бесцветное кристаллическое вещество с характерным запахом (под воздействием кислорода, окисляясь, он приобретает светло-розовый цвет). Фенол при 42,3°С плавится, а при 182°С кипит. Частично растворим в воде (в 100 г воды растворяется 6 г фенола). Обладает сильными антисептическими (убивает микробы) свойствами. Сильный яд. При попадании на кожу образует долго незаживающие раны и водянистые пузыри.
Химические свойства: Простой фенол С6Н5ОН называется также карболовой кислотой, которая проявляет кислотные свойства (слабее угольной кислоты). Кроме металлического натрия фенол с другими щелочами образует устойчивые растворы фенолятов (сравните с одноатомными спиртами):
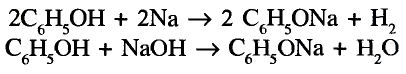
Феноляты не гидролизуются, однако под воздействием минеральной кислоты и даже угольной, разлагаются:
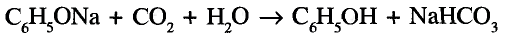
В отличие от бензола фенол реагирует с бромной водой, обесцвечивает ее и образует трибромфенол:
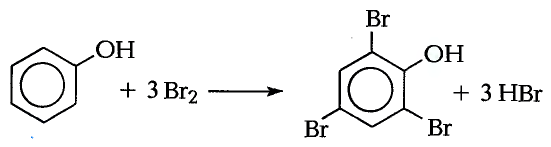
Фенол получают также "способом кумола".
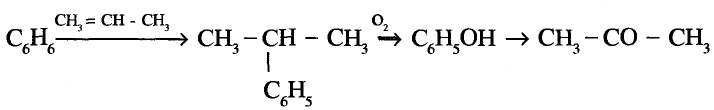
Взаимодействуя с формальдегидом, фенол образует формальдегидную смолу.
Получение и применение: Для промышленных целей фенол получают из каменноугольной смолы. Определенная часть фенола по следующей схеме, синтетическим способом, получается из бензола:
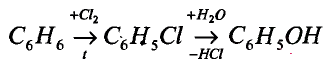
Фенол применяется при производстве лекарственных препаратов, фотопроявителей, как дезинфицирующее средство (он сильный антисептик). Большое количество его расходуется для производства фенопластов.
Фенол, имеющийся в составе отходов, оказывает вредное воздействие на окружающую среду. Для защиты воды и воздуха от фенолсодержащих отходов необходимо внедрение безотходных технологий: газы, содержащие фенол, можно каталитически окислить, сточные воды озонировать или выделить его с помощью растворителей.
Альдегиды
Классификация и номенклатура: Тривиальные названия альдегидов образуются прибавлением слова альдегид к латинскому названию соответствующей карбоновой кислоты.
По международной номенклатуре названия альдегидов образуются путем прибавления суффикса -ал к названию соответствующего углеводорода. Нумерация углеводородной цепи начинается с того углерода, к которому присоединена функциональная группа (метаналь, 2-метилпропаналь).
Изомерия: У альдегидов наблюдается изомерия углеродного скелета.
бутаналь 
2-метил пропаналь 
Электронное строение: В молекуле альдегида имеются  и
и  связи. Атом углерода карбонильной группы находится в состоянии sр2-гибридизации (все атомы карбонильной группы находятся на одной плоскости и углы между ними равны 120°). Углерод карбонильной группы связан с другим с атомом углерода, атомом кислорода и атомом водорода с тремя
связи. Атом углерода карбонильной группы находится в состоянии sр2-гибридизации (все атомы карбонильной группы находятся на одной плоскости и углы между ними равны 120°). Углерод карбонильной группы связан с другим с атомом углерода, атомом кислорода и атомом водорода с тремя  связами и только с атомом кислорода ещё одной
связами и только с атомом кислорода ещё одной  связью.
связью.  связь образуется за счет негибридизированного р-электрона углерода и неспаренного р-электрона кислорода. Она расположена перпендикулярно плоскости
связь образуется за счет негибридизированного р-электрона углерода и неспаренного р-электрона кислорода. Она расположена перпендикулярно плоскости 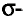 связи. Таким образом, углерод и кислород в карбонильной группе подобно алкенам связаны двойной
связи. Таким образом, углерод и кислород в карбонильной группе подобно алкенам связаны двойной  связью.
связью.
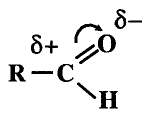
В карбонильной группе связь между атомами углерода и кислорода поляризована сильнее, чем в молекуле спирта. Это объясняется двумя причинами: во-первых,  связь по сравнению с
связь по сравнению с  подвижнее и поэтому она легко поляризуется. Во-вторых, если в карбонильной группе электроны оказываются смещенными только от атома углерода к атому кислорода, то в спиртах они смещаются и от углерода и от водорода.
подвижнее и поэтому она легко поляризуется. Во-вторых, если в карбонильной группе электроны оказываются смещенными только от атома углерода к атому кислорода, то в спиртах они смещаются и от углерода и от водорода.
В карбонильной группе углерод заряжен частично положительно, а кислород - частично отрицательно.
В результате сильной поляризованности карбонильной группы, альдегиды химически активны.
Физические свойства: Насыщенные алифатические альдегиды образуют гомологический ряд, имеющий общую формулу СnН2n+1СНО. Муравьиный альдегид - газ, следующие представители - жидкости, а высшие альдегиды - это твердые вещества. Муравьиный альдегид - ядовитое вещество с острым запахом. 40%-ный водный раствор муравьиного альдегида называется формалином.
Низшие альдегиды хорошо растворимы в воде, с увеличением молекулярной массы растворимость альдегидов уменьшается.
Химические свойства: Альдегиды вступают в следующие химические реакции:
- Реакции присоединения
- Реакции окисления
- Реакции полимеризации
- Реакции поликонденсации
1. Присоединение водорода к альдегидам происходит за счет двойной связи:
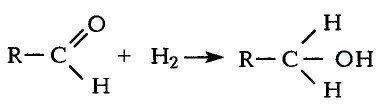
2.1) Водород карбонильной группы альдегида легко окисляется, образуя карбоновую кислоту.
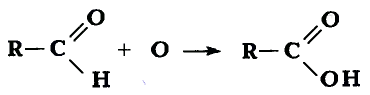
2) При нагревании с аммиачным раствором оксида серебра (I) альдегид превращается в карбоновую кислоту, а выделившееся в свободном виде серебро покрывает стенки сосуда. Эта реакция, называемая реакцией "серебряного зеркала", считается качественной реакцией альдегидов.
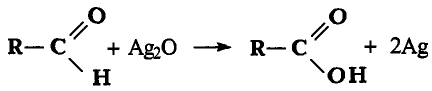
3) В качестве окислителя альдегидов может быть использован также гидроксид меди (II), при нагревании образуется красного цвета оксид меди (I):
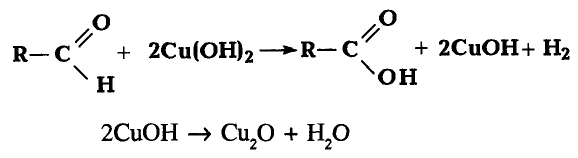
Эта реакция также применяется для определения альдегидов.
3. В реакциях полимеризации формальдегид (муравьиный альдегид, метаналь) образует полимер - полиформальдегид (полиформ), обладающий линейной структурой.
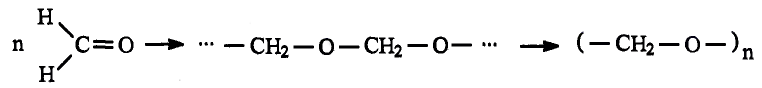
Полиформальдегиды, как металлозаменители, применяются для изготовления различных деталей.
4. При нагревании альдегида с фенолом в присутствии катализатора (кислота или основание) осуществляется реакция поликонденсации - образуется фенолформальдегидная смола и вода.
Реакцией поликонденсации называется реакция образования высокомолекулярного вещества, идущая с выделением низкомолекулярных (вода, аммиак, хлорид водорода) соединений.
Из фенолформальдегидной смолы получают термостойкие реактопласты -фенопласты, которые применяются для изготовления изоляционных, антикоррозионных материалов.
Получение: Альдегиды получаются в основном при окислении спиртов. В промышленности формальдегид образуется при пропускании смеси паров метанола и воздуха через медно-проволочный реактор.
Второй способ - это окисление метана кислородом воздуха при 400-600°С и в присутствии оксидов азота в качестве катализатора:
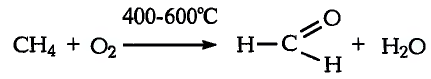
Уксусный альдегид получают в промышленности преимущественно, по реакции, открытой М. Г. Кучеровым - гидратацией ацетилена в присутствии солей ртути (в настоящее время применяются безопасные катализаторы):
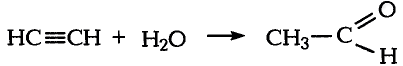
Хорошо известен способ получения уксусного альдегида прямым окислением этилена при температуре 100°С, давлении 1013 мПа, в присутствии катализатора (PdCl2 + Cu2Cl2).
Применение: Формальдегид широко применяется в получении полиформальдегидной; фенолформальдегидной и других смол. Также формальдегид как исходный продукт применяется в производстве красок, фармацевтических препаратов, синтетического каучука, взрывчатых веществ и многих других органических веществ, а в медицине как сильный антисептик.
Уксусный альдегид является важнейшим веществом в производстве уксусной кислоты, пластмасс, фенопластов, лекарственных препаратов.
Карбоновые кислоты
Класс карбоновых кислот занимает особое место среди органических соединений. Такие представители карбоновых кислот, как уксусная, винная, лимонная, яблочная были известны с давних времен.
Карбоновыми кислота называются сложные органические соединения, молекулы которых содержат одну или несколько карбоксильных групп - COOH, соединенных с углеводородным радикалом
Карбоксильная группа состоит из >C=0 карбонильной и -OH гидроксильной групп.
Одноосновные карбоновые кислоты описываются общей формулой R-COOH, Где R - является углеводородным радикалом (в муравьиной кислоте H-COOH, карбоксильная группа соединена с водородом).
Классификация: По количеству карбоксильных групп в своем составе карбоновые кислоты подразделяются на одноосновные - монокарбоновые, двухосновные - дикарбоновые и т.д.
По природе углеводородного радикала они также подразделяются на алифатические (ряд жиров), насыщенные (алканы), ненасыщенные (алкены, алкины) и ароматические (ареновые) карбоновые кислоты.
Номенклатура: По международной номенклатуре названия кислот образуются от названия соответствующих углеводородов с прибавлением слова кислота. В молекуле СН3СООН имеется два углерода, что соответствует этану, а название кислоты - этановая. Многие карбоновые кислоты называются тривиально-историческими наименованиями: муравьиная, уксусная, масляная, щавелевая, молочная, лимонная и т.д.
В таблице 12 приведены сведения о насыщенных алифатических монокарбоновых кислотах (СnН2n+1СООН).
Предельные монокарбоновые кислоты:
Таблица 18
| Формула | Название | |
| Эмпирическая | Тривиальное | Международное |
| HCOOH | Муравьиная кислота | Метановая кислота |
| CH3COOH | Уксусная кислота | Этановая кислота |
| С2Н5СООН | Пропионовая кислота | Пропановая кислота |
| С3Н7СООН | Масляная кислота | Бутановая кислота |
| С3Н7СООН | Изомасляная кислота | 2-метилпропановая кислота |
| С4Н9СООН | Валерьяновая кислота | Пентановая кислота |
| С5Н11СООН | Капроновая кислота | Гексановая кислота |
| С15Н31СООН | Пальмитиновая кислота | Гексадекановая кислота |
| С16Н33СООН | Маргариновая кислота | Гептадекановая кислота |
| C17H35COOH | Стеариновая кислота | Октадекановая кислота |
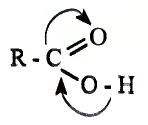
Электронное строение. Выше было сказано, что в состав карбоксильной группы входит карбонильная и гидроксильные группы. В этой группе -ОН группа не проявляет свойства, проявляемые в спиртах, так же, как >С=0 группа не демонстрирует свойства альдегидов. Нам известно, что карбонильная группа сильно поляризована (см. альдегиды), электроны смещены в сторону кислорода, углерод частично положительно заряжен. Электроны кислорода гидроксигруппы находятся в сопряжении с  электронами двойной связи. В результате этого связь между кислородом и водородом ослабевает. Этим и объясняются сильные по сравнению со спиртами кислотные свойства кислот.
электронами двойной связи. В результате этого связь между кислородом и водородом ослабевает. Этим и объясняются сильные по сравнению со спиртами кислотные свойства кислот.
Физические свойства: Среди карбоновых кислот в отличие от альдегидов нет газообразных веществ. Низшие представители карбоновых кислот, до пальмитиновой жидкости, хорошо растворимые в воде и с острым запахом. Высшие представители, включая пальмитиновую кислоту, твердые вещества без запаха и не растворимые в воде.
Температура кипения карбоновых кислот выше температуры кипения соответствующих спиртов. Отсутствие газообразных веществ, хорошая растворимость в воде, высокая температура кипения карбоновых кислот связаны с наличием водородных связей, т. е. водородная связь является причиной ассоциации молекул.
Химические свойства:
Кислотные свойства:
- Водные растворы карбоновых кислот кислые на вкус
- Окрашивают в красный цвет лакмус и метилоранж
- Проводят электрический ток
- Взаимодействуя с металлами, выделяют водород
В общем виде диссоциацию карбоновых кислот можно представить в следующем виде:
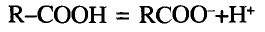
В ряду активности металлов, металлы, стоящие слева от водорода, обладают способностью вытеснять водород из карбоновых кислот:
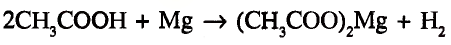 ацетат магния
ацетат магния
Основные оксиды и основания также вступают во взаимодействие с карбоновыми кислотами:
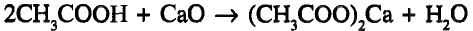 ацетат кальция
ацетат кальция
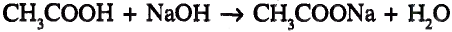 ацетат натрия
ацетат натрия
Карбоновые кислоты способны вытеснять металлы из солей слабых кислот (например, соли угольной кислоты):
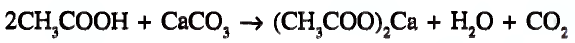
Во всех перечисленных выше случаях карбоновые кислоты образуют соли.
Характерной реакцией карбоновых кислот это реакция этерификации -взаимодействие со спиртами с образованием сложных эфиров:
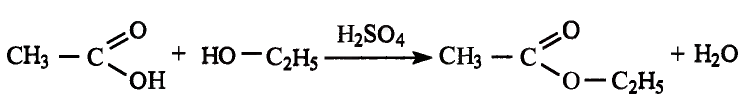
Реакции, идущие с участием углеводородного радикала.
В карбоновых кислотах под воздействием карбоксильной группы активность атомов водорода, соседних к ней, возрастает и они способны замещаться на атомы брома или хлора:
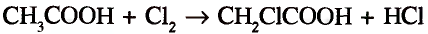
 хлоруксусная кислота
хлоруксусная кислота
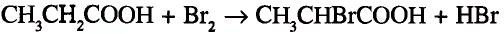
 бромпропановая кислота
бромпропановая кислота
Под воздействием индукционного эффекта заместителей монохлоруксусная и  бромпропановая кислоты сильнее соответствующих кислот.
бромпропановая кислоты сильнее соответствующих кислот.
Применение: Муравьиная кислота применяется как сильный восстановитель при синтезе органических соединений; в пищевой промышленности - дезинфицирующее и консервирующее средство; в текстильной промышленности - при окрашивании тканей; в переработке природного каучука - как коагулянт, так же применяется в медицине.
Уксусная кислота широко используется в производстве красителей, пластмасс, лекарственных препаратов (аспирин, фенацетин), искусственных волокон, несгораемой кинопленки и т. д; соли уксусной кислоты применяются при окрашивании тканей, в медицине, в борьбе с сельскохозяйственными вредителями, в качестве растворителей сложных эфиров и душистых веществ.
Пальмитиновая и стеариновая кислоты используются в производстве свечей, натриевые соли этих кислот - в производстве хозяйственного мыла, а калиевые соли - жидкого мыла, применяемого в медицине.
Сложные эфиры
Сложные эфиры, являясь широко распространенными органическими соединениями, имеют большое практическое значение.
- Сложными эфирами называются сложные органические соединения, в которых два углеводородных радикала соединены посредством -COO- группы
- Общая формула сложных эфиров R-COO-R1
- Сложные эфиры можно считать производными карбоновых кислот, в которых водород гидроксогруппы замещен на радикал
- Сложные эфиры могут образовываться не только из карбоновых, но и их неорганических кислот (этилнитрат C2H5-O-NO2)
Наименование: Наименования сложных эфиров очень часто схожи с наименованиями солей. Например, СН3СООС2Н5- этилацетат, НСООСН3-метилформиат; наименование сложных эфиров образуется также прибавлением слова эфир к наименованию кислоты и спирта, которые образовали этот эфир: СН3СООС2Н5 - уксусно-этиловый эфир; НСООСН3 - муравьино-метиловый эфир.
Физические свойства: Сложные эфиры монокарбоновых кислот обычно жидкости с приятным фруктовым запахом (уксусно-изоамиловый эфир - запах груши, масляно-бутиловый эфир - запах ананаса). Сложные эфиры, образованные из высших спиртов и высших кислот, твердые, не обладающие запахом вещества. Обычно они плохо растворимы в воде, а в спирте и эфире - хорошо.
Распространенность в природе: Многие эфиры входят в состав эфирных масел и составляют основу фруктового и цветочного запаха.
- Эфиры трехатомного спирта глицерина и высших жирных кислот составляют основу масел и жиров
- Эфиры высших одноатомных спиртов и высших монокарбоновых кислот составляют основу воска и спермацетов
Получение: Природные эфиры извлекаются из растений с помощью органических растворителей (экстракция).
В производстве сложные эфиры получают реакцией этерификации (смотри предыдущие темы).
В этой реакции в образовании воды участвует гидроксогруппа кислоты и водород спирта.
Химические свойства: Сложные эфиры под воздействием воды подвергаются омылению.
Гидролиз эфиров является обратным процессу этерификации, т. е. сложный эфир расщепляется при нагревании и при добавлении в воду небольшого количества неорганической кислоты или щелочи. Поэтому, чтобы сместить равновесие этерификации в сторону образования эфира, необходимо отгонять образующийся эфир или брать в большом количестве исходные спирт или кислоту.
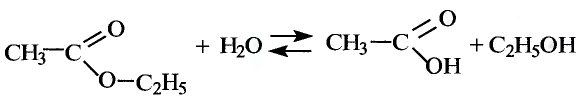
Добавление щелочи приводит к необратимости гидролиза, так как получающаяся кислота образует с щелочью соль.
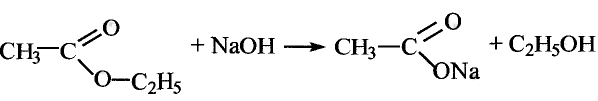
Отдельные представители: Важнейшие представители сложных эфиров - это жиры. Жиры - это сложные эфиры трехатомного спирта глицерина и карбоновых кислот.
В образовании масел и жиров участвуют: из насыщенных кислот - стеариновая - СН3-(СН2)16-СООН, пальмитиновая СН3-(СН2)14-СООН; из ненасыщенных - олеиновая - СН3-(СН2)7-СН=СН-(СН2)7-СООН.
В природе основным источником масел и жиров являются животные (подкожный жир и жир в составе молока) и растения (масла, входящие в состав семян и плодов). Природные масла и жиры это триглицериды с различными радикалами кислот. В составе природных жиров и масел кроме триглицеридов имеются и другие вещества, витамины, флавоноиды, красители, свободные жирные кислоты, моно-и диглицериды, каротиноиды.
Жиры, образованные преимущественно предельными жирными кислотами, твердые (животные жиры - бараний, говяжий), масла, образованные непредельными жирными кислотами - жидкие (растительные масла - хлопковое, подсолнечное, соевое, кукурузное, оливковое, кунжутное).
Масла и жиры легче воды и не растворимы в ней, образуют эмульсии, однако хорошо растворяются в органических растворителях. Жиры и масла обладают свойством сорбировать запахи, поэтому они применяются для получения ароматических веществ из цветов. Они не обладают постоянством состава и поэтому для них не характерна определенная температура плавления.
Так как жидкие жиры образованы ненасыщенными жирными кислотами, в промышленности, в присутствии катализатора, например никеля, они насыщаются водородом, т. е. гидрируются и переходят в твердое состояние, образуя маргарины и саломассы, что очень удобно при транспортировке.
Гидролизом масел и жиров (в качестве катализатора могут быть использованы оксиды магния, кальция, цинка) получают чистый глицерин, карбоновые кислоты и мыла.
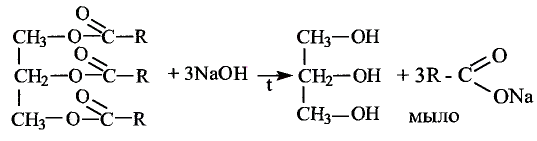
Масла и жиры получают из природных источников, т.е. выделяют из животных и растительных организмов. Получение масел путем этерификации глицерина и жирных кислот (синтез французского учёного М. Бертло, 1854) для промышленности нерентабелен.
С биологической точки зрения масла и жиры для организма являются основным источником энергии. При употреблении в пищу, масла и жиры под воздействием определенных ферментов гидролизуются, восполняя запасы энергии, или из образованных продуктов синтезируются новые молекулы масел, соответствующие этому организму.
Большое количество масел и жиров, кроме пищевых целей, применяется в производстве мыла, глицерина и карбоновых кислот, алифов и лаков, фармацевтических и косметических препаратов.
Синтетические и искусственные моющие средства
В настоящее время нашу жизнь трудно представить без моющих средств. С древних времен человечество пользовалось этими средствами. Первоначально использовали только воду, затем золу, различные растения и выжимки из семян, а также водный раствор, полученный при нагревании золы и масел. Начиная с XVIII века появилось мыло, приготовленное путем обработки масла щелочью. В настоящее время используются различные моющие средства, так как из-за необходимости экономии ценного продукта - масел и жиров возникла потребность поиска путей получения мыла и моющих средств из продуктов непищевого происхождения. Карбоновые кислоты, необходимые для производства мыла, получают путем окисления парафина, на основе же солей сложных эфиров высших спиртов и серной кислоты с общей формулой R-CH2-0-SO2-ONa получают новые алкилсульфатные моющие средства. Из-за способности хорошо растворяться (в отличие от других обычных мыл), кальциевые и магниевые соли вышеназванных эфиров обладают моющими способностями и в жесткой воде. Составную часть всех синтетических моющих порошков, выпускаемых сегодня, составляют алкилсульфаты. Синтетические моющие средства позволяют экономить сотни тысяч тонн пищевого сырья - растительных и животных масел и жиров.
Многие моющие средства при использовании не расщепляются и, попадая в водные бассейны, являются причиной загрязнения окружающей среды. Поэтому создание моющих средств, разлагающихся в результате жизнедеятельности микроорганизмов, является в настоящее время одной из актуальных задач, стоящих перед химией.
Углеводы
Строение углеводов и классификация
Среди органических веществ есть класс соединений, без которых невозможно представить обмен веществ и энергии в живых организмах. Это углеводы. Углеводы являются источником энергии в организме человека. Около 70% пищевых продуктов, употребляемых человеком, состоят из углеводов (хлеб, картошка, рис, сахар). Ткани и бумага изготавливаются из углеводов. Углеводы образуются в процессе фотосинтеза в организмах растений из углекислого газа и воды. В сухих частях растений встречается до 80%, а в организмах человека и животных до 20% углеводов. Хотя название "углеводы" осталось, оно связано с эмпирической формулой молекул, то есть, если рассматривать C2(H2O)m (где n и  формулу, то кажется, что молекула состоит из атома углерода и молекулы воды (например, уксусная кислота соответствует формуле С2(Н2O)2, а формальдегид - СН2O, но они не являются углеводами). На самом деле это сложные вещества. В большинстве случаев их называют сахаридами (сахарами).
формулу, то кажется, что молекула состоит из атома углерода и молекулы воды (например, уксусная кислота соответствует формуле С2(Н2O)2, а формальдегид - СН2O, но они не являются углеводами). На самом деле это сложные вещества. В большинстве случаев их называют сахаридами (сахарами).
- Углеводы - сложные вещества, состоящие из углерода, кислорода и водорода.
- Классификация и номенклатура. Углеводы подразделяются на три группы:
- Моносахариды - глюкоза, фруктоза ...(не гидролизуются).
- Дисахариды - сахароза, мальтоза ... (в результате гидролиза образуются две молекулы моносахарида).
- Полисахариды - крахмал, целлюлоза ... (высокомолекулярные соединения, в результате гидролиза которых образуется n молекул моносахаридов).
Глюкоза
Физические свойства и распространенность в природе: Глюкоза (виноградный сахар) - С6Н12O6 - бесцветное кристаллическое вещество, хорошо растворимое в воде, сладкое на вкус. Она встречается во всех частях растений: плодах,
корнях, листьях, цветах, в стебле. Особенно, в больших количествах она имеется в винограде, сахарном тростнике, сахарной свекле, сладких фруктах. В крови человека имеется около 0,1%глюкозы.
Строение: В молекуле глюкозы определены следующие функциональные группы: Альдегидная -СНО.
Первичная спиртовая -СН2ОН.
Вторичная спиртовая -СНОН.
Немецкий ученый Е. Фишер, изучив химические свойства, предложил формулу глюкозы, которая соответствует формуле альдегидоспирта.
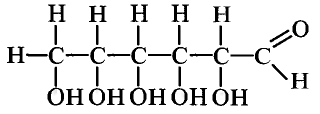
Этот альдегидоспирт имеет линейную структуру, которая состоит из шести атомов углерода, включает альдегидную группу и, соответственно, является альдогексозой. Однако, было установлено, что наряду с молекулами, строение которых соответствует открытой цепи, существуют молекулы циклического строения.
Образование циклического строения можно объяснить следующим образом. Углеродная цепь вследствие вращения атомов относительно s-связи может быть не только вытянутой, но и изогнутой. При этом карбонильная группа -С=O может близко подойти к пятому атому углерода, и, в результате появления внутримолекулярного взаимодействия, между первым и пятым атомами углерода через атом кислорода появляется связь. Таким образом образуется шестичленное кольцо - полуацетальная форма глюкозы (полиацеталем называется продукт, образующийся в результате внутреннего взаимодействия спиртовой группы и альдегида или кетона, имеющиеся в составе соединения).
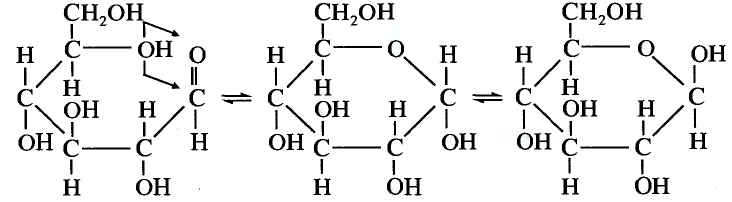
Циклическая молекула не имеет альдегидную группу, вместо нее имеет ОН-группу, прикрепленную к первому атому углерода, которую называют полиацетатной гидроксигруппой. Она по сравнению с гидроксигруппой спирта активна и легко вступает в реакцию. Относительно плоскости кольца эта группа может быть расположена по разному - в вышеуказанной формуле эта группа расположена под плоскостью кольца молекулы и называется  формой. B
формой. B  форме эта группа расположена над плоскостью кольца.
форме эта группа расположена над плоскостью кольца.
В 1811 году русским химиком К. С. Кирхгофом путем гидролиза был получен крахмал.
Химические свойства: Глюкозе присущи химические реакции, характерные альдегидам, спиртам и циклическим соединениям.
Глюкоза так же как альдегид обладает восстановительными свойствами и вступает в реакцию серебряного зеркала:
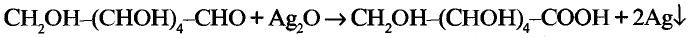
При окислении глюкозы гидроксидом меди (II) образуется глюконовая кислота и осадок красного цвета-оксид меди (I):
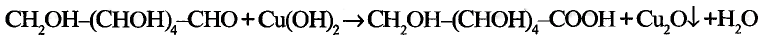
Проявляя окислительные свойства при взаимодействии с водородом, глюкоза восстанавливается, образуя спирт (сорбит - шестиатомный спирт):
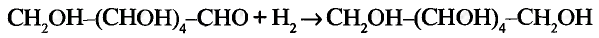
Вышеуказанные реакции подтверждают наличие альдегидной группы в молекуле глюкозы.
Как многоатомный спирт глюкоза также вступает во взаимодействие с гидроксидами металлов:
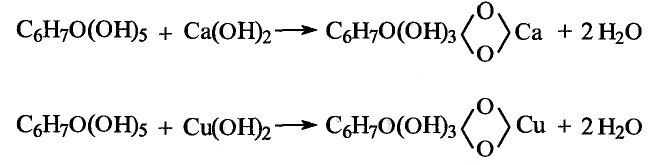
Сахарат меди - вещество синего цвета и на основе этой реакции в медицине делают анализ мочи для определения в ней сахара.
При взаимодействии спиртов с полиацетатной гидроксигруппой глюкозы образуются гликозиды - вещества, сходные эфирам.
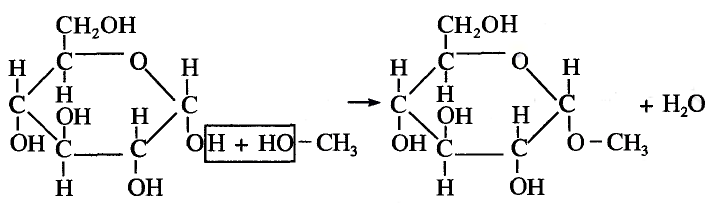
Брожение: Под воздействием биологических катализаторов происходит брожение глюкозы. Известны несколько разновидностей брожения: спиртовое, кислотное и др. Например, под воздействием окислительных ферментов глюкоза подвергается спиртовому брожению, в результате образуется этанол и углекислый газ.
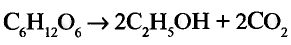
Под воздействием других ферментов могут образоваться уксусная кислота, масляная и молочная кислоты, изопропиловый спирт, ацетон.
Окисление: В организме человека и животных в результате окисления глюкозы выделяется энергия, столь необходимая для жизнедеятельности живых существ.
Получение и применение: В промышленности глюкоза образуется при гидролизе крахмала и клетчатки (соединительная ткань растений, которая состоит из целлюлозы) (смотри тему «Полисахариды»).
Глюкоза применяется в медицине, в производстве кондитерских изделий, зеркал и елочных игрушек (на основе реакции серебряного зеркала), а также она применяется для обработки тканей и кожаных изделий.
Фруктоза
Фруктоза (фруктовый сахар C6H12O6) - бесцветное кристаллическое вещество, хорошо растворимое в воде, слаще глюкозы, входит в состав меда и фруктов.
Фруктоза, являясь кетоноспиртом, входит в группу гексокетоз и является изомером глюкозы.
Также как и глюкоза, она существует в циклических формах.
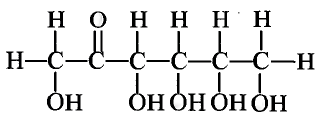
Также как и глюкоза, фруктоза проявляет свойства спиртов - образует сахараты и сложные эфиры, не гидролизуется. Этот ценный пищевой продукт, который в 1,5 раза слаще сахарозы и в 3 раза-глюкозы, легко усваивается организмом (люди, подверженные диабету, легче усваивают фруктозу, чем сахарозу).
Дисахариды
Физические свойства и распространенность в природе: Сахароза (продукт, получаемый из сахарной свеклы или сахарного тростника С12Н22О11) и мальтоза (молочный сахар - С12Н22О11) - белое кристаллическое вещество, хорошо растворимое в воде. Мальтоза, в основном имеется в составе молока животного происхождения.
Строение: Сахароза является дисахаридом циклической глюкозы и фруктозы, а мальтоза - дисахарид глюкозы, две молекулы которой соединены посредством атома кислорода.
В молекулах сахарозы и мальтозы нет ни альдегидной, ни карбонильной, ни полу-ацетальной гидроксильной групп. Они имеют только гидроксильную группу и тем самым по своим химическим свойствам отличаются от моносахаридов.
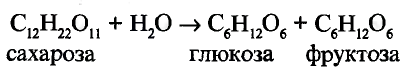
Поэтому их называют дисахаридами.
Дисахариды легко взаимодействуют с гидроксидами металлов, при вливании раствора сахарозы к гидроксиду меди (II) образуется сахарат меди ярко голубого цвета.
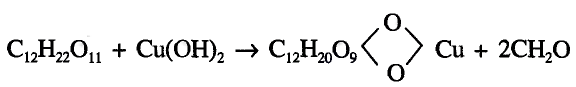
При взаимодействии раствора сахарозы с суспензией гидроксида кальция получается водорастворимый сахарат кальция.
Дисахариды отличаются от моносахаридов отсутствием реакции «серебряного зеркала» и неспособностью восстанавливаться под влиянием других восстановителей.
Получение и применение: В промышленности сахарозу получают из сахарной свеклы или сахарного тростника, а мальтозу - из промежуточных продуктов, образующихся при гидролизе полисахаридов. Они широко применяются в пищевой промышленности.
Полисахариды
Полисахариды, образуя класс веществ, составляющих основу тканей живых организмов, считаются строительным материалом и источником питательных веществ.
Крахмал
Физические свойства и распространенность в природе: Крахмал представляет собой белый порошок, не растворимый в воде, спирте, эфирах. В горячей воде набухает и образует коллоидный раствор - клейстер.
Крахмал - чрезвычайно распространенный растительный углевод он образуется в листьях в результате фотосинтеза и накапливается в корнях, корневых клубнях, семенах, зернах.
- Клубни картофеля содержат около 20% крахмала.
- Зерна пшеницы и кукурузы — около 70%
- Риса — около 80%.
Процесс фотосинтеза можно выразить следующим обобщенным уравнением:
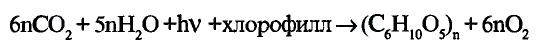
Строение: Крахмал является природным полимером, и его строение выражается (C6H10O5)n общей формулой. Макромолекулы крахмала неодинаковы по своей структуре и числу звеньев: наряду с молекулами линейной структуры, число звеньев C6H10O5 в которых достигает нескольких сотен, а молекулярная масса несколько сотен тысяч, имеются молекулы разветвленной структуры, в которых несколько тысяч звеньев C6H10O5, а молекулярная масса- несколько миллионов.
Определено, что молекула крахмала построена из остатков молекул 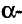 глюкозы, которая представлена ниже:
глюкозы, которая представлена ниже:
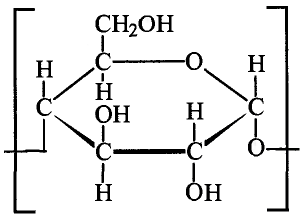
остатки  глюкозы
глюкозы
Химические свойства: Подобно альдегидам крахмал не обладает восстанавливающими свойствами. Гидролиз. При нагревании с водой в присутствии кислот или ферментов крахмал подвергается гидролизу. Сначала образуются промежуточные продукты с меньшей молекулярной массой, чем у крахмала - полисахариды, декстрин, затем изомер сахарозы - мальтоза, конечным продуктом гидролиза является глюкоза:
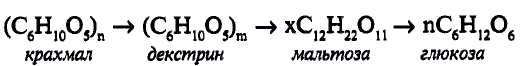
Процесс гидролиза схематично можно изобразить следующим образом:
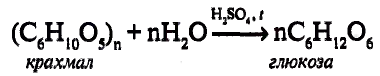
Способность гидролизоваться - важное химическое свойство крахмала. Получение глюкозы в промышленности основано на этом свойстве крахмала.
Взаимодействие с йодом. При взаимодействии с йодом крахмал приобретает синюю окраску и это является качественной реакцией крахмала и йода.
Получение и применение. Крахмал в основном получается из картофеля, риса и кукурузы.
Крахмал, имеющийся в пищевых продуктах (хлебе, картофеле, зерновых продуктах), является основным источником, удовлетворяющим потребности человека в углеводах. В организме крахмал также как и жиры гидролизуется, и организм усваивает конечный продукт- глюкозу.
Крахмал применяется в производстве антибиотиков, витаминов, кондитерских изделий, медицине, для подкрахмаливания белья. Крахмал также используется для производства декстрина, этанола, глюкозы и других веществ.
Целлюлоза
Физические свойства и распространенность в природе: Целлюлоза (клетчатка) -белое твердое волокнистое вещество, не имеющее вкуса и запаха, не растворимое в воде и органических растворителях и не обладающее постоянной температурой плавления. Широко распространена в природе. Она составляет основную часть клеток высших растений.
- В древесине целлюлоза составляет около 50%;
- В волокнах хлопка до 98%;
- До 75% в корнях.
Гигроскопическая фильтровальная бумага состоит из относительно чистой целлюлозы.
Строение: Целлюлоза также как и крахмал является природным полимером и его состав выражается общей формулой (С6Н10О5)n. Некоторые молекулы целлюлозы содержат до 40 тыс. С6Н10О5 звеньев (средняя молекулярная масса достигает нескольких миллионов).
Однако, хотя крахмал и целлюлоза имеют одну и ту же молекулярную формулу, их строение отличается друг от друга. Макромолекулы крахмала образованы молекулами  глюкозы и имеют линейную и разветвленную структуру, макромолекулы целлюлозы состоят из остатков молекул
глюкозы и имеют линейную и разветвленную структуру, макромолекулы целлюлозы состоят из остатков молекул  глюкозы и имеют только линейную структуру. В результате, в отличие от крахмала, целлюлоза образует волокнистые материалы и не является пищевым продуктом. В молекуле целлюлозы нет ни альдегидной, ни карбонильной, ни полуацетальной гидроксильной групп. Она имеет только спиртовую гидроксильную группу и проявляет химические свойства многоатомных спиртов.
глюкозы и имеют только линейную структуру. В результате, в отличие от крахмала, целлюлоза образует волокнистые материалы и не является пищевым продуктом. В молекуле целлюлозы нет ни альдегидной, ни карбонильной, ни полуацетальной гидроксильной групп. Она имеет только спиртовую гидроксильную группу и проявляет химические свойства многоатомных спиртов.
Химические свойства: Целлюлоза не проявляет свойств альдегидов. Не наблюдаются ее восстановительные свойства - реакция «серебряного зеркала», не взаимодействует с гидрокисью меди.
Гидролиз. Целлюлоза, также как крахмал, под действием разбавленных кислот гидролизуется, и конечным продуктом при этом является глюкоза. Процесс гидролиза выражается следующим общим уравнением:
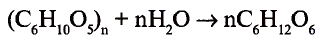
Гидролиз - важное свойство целлюлозы. Из продукта гидролиза - глюкозы производят этанол. Этанол, получаемый из древесины, называют гидролизным спиртом. При получении гидролизного спирта 1 тонна древесины заменяет 1,5 тонны картофеля или 0,7 тонн зерна.
Реакция этерификации. В каждом С6Н10О5 звене целлюлоза имеет три гидроксильные группы и за счет этих групп она образует простые и сложные эфиры. Это считается одним из важных свойств целлюлозы.
Большое значение имеет способность целлюлозы образовывать с концентрированной азотной кислотой в присутствии концентрированной серной кислоты сложные эфиры -моно, -ди, -тринитроцеллюлозу:
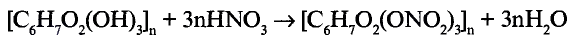
Нитраты целлюлозы - чрезвычайно горючие вещества. Тринитроцеллюлоза (пироксилин) применяется при изготовлении взрывчатого бездымного пороха.
С уксусной кислотой целлюлоза образует ацетатные эфиры (ди- и триацетатцеллюлозы).
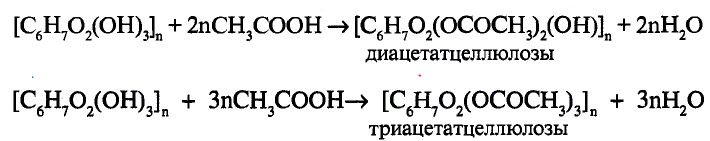
Ди- и триацетатцеллюлозы применяется для получения ацетатного волокна. Человечество для изготовления одежды и предметов народного хозяйства издревле применяло природные волокна (лен, кенаф, хлопок, шерсть, шелк).
В настоящее время широко применяются химические волокна, которые получены химическим путем. Химически переработанные природные волокна называется искусственными, волокна, получаемые из синтетических материалов - синтетическими. Искусственное ацетатное волокно достаточно прочное, мягкое, не пушится, обладает приятным переливом, и другими ценными свойствами. Недостатком этих волокон является их малая гигроскопичность, по сравнению с хлопком, и способность электризоваться.
Горение. Целлюлоза хорошо горит.
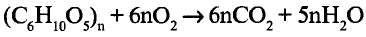
Термическое расщепление. Целлюлоза расщепляется при нагревании ее без доступа воздуха. При этом образуется древесный уголь, вода и летучие органические вещества: метанол, уксусная кислота, ацетон и другие.
Применение: В качестве древесины целлюлоза используется в строительстве, в быту, а как волокнистое вещество (хлопок, кенаф, лен) - для изготовления тканей, нитей, канатов. Большая часть целлюлозы применяется в производстве бумаги, этанола, хлопкового линта, для получения простых и сложных эфиров, являющихся основным сырьем в производстве искусственного волокна (ацетатное, вискозное), а также в производстве искусственной кожи, пластмасс (целлюлоид, целлофан), лаков, электроизоляционных покрытий, ионитов, медицинского коллодия.
Азотосодержащие органические соединения
Амины
Азотосодержащие органические соединения подразделяются на различные классы: нитросоединения, амины, аминокислоты и др. Несравнима биологическая роль азотосодержащих веществ в природе. Белки, являющиеся составной частью всех живых организмов, состоят из аминокислот.
- Аминами называются сложные вещества, образованные в результате замещения в аммиаке NH3 одного, двух или всех атомов водорода на углеводородные радикалы.
- Если в молекуле аммиака замещен один атом водорода, то это первичный амин NH2—R1.
- Если в молекуле аммиака замещены два атома водорода - вторичный амин R1-NH-R2 (или R1=R2).
- Если в молекуле аммиака замещены все атомы водорода, это - третичный амин: R1-NR3-R2 (или R1=R2=R3).
По природе углеводородородных радикалов аминосоединения подразделяются:
- Алифатические амины;
- Алициклические амины;
- Ароматические амины;
- Гетероциклические амины и другие.
Номенклатура: Название первичных аминов образуется путем прибавления слова -амин к названию соответствующих углеводородных радикалов. В названии, впереди, ставится цифра, указывающая тот углерод углеводорода, к которому прикреплена аминогруппа:
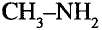 метанамин
метанамин
 2-бутанамин
2-бутанамин
Образование названия симметричных аминов с одинаковыми радикалами происходит путем прибавления префикса ди-, три- к названию вторичного и третичного аминового радикала: NH(C6H5)2 - дифениламин, (CH3)3N - триметиламин.
Изомерия: Изомерия аминов связана с углеводородной цепью и положением аминогруппы.
Амины состава 
Электронное строение: Все амины, так же как и аммиак, обладают свободной электронной парой. За счет этой электронной пары атом азота присоединяет к себе воду и протон кислоты Н+. Поэтому амины подобно аммиаку проявляют основные свойства. Амины - органические основания. Их молекулы полярны.
Взаимодействие атомов в молекуле: Природа индукционного воздействия радикалов алифатических аминов сильнее, чем у аммиака, а ароматические амины, как основания, слабее, чем аммиак.
В ароматических аминах по мере возрастания числа углеводородных радикалов основные свойства уменьшаются, а у алифатических аминов усиливаются.
Основные свойства в ряду аммиака, первичных, вторичных, третичных и ароматических аминов усиливаются в следующем порядке:
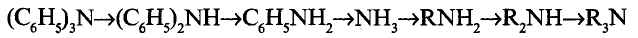
В свою очередь аминогруппа также оказывает воздействие на углеводородный радикал. В ароматических аминах атом водорода обладает большей подвижностью, чем в свободном бензоле. Например, анилин C6H5NH2 по сравнению с бензолом легче вступает в реакции замещения.
Предельные алифатические амины
Физические свойства: Приведенные ниже метиламин, диметиламин, триметиламин - газообразные вещества с аммиачным запахом, хорошо растворимые в воде.
Средние представители гомологического ряда - жидкости, высшие представители -твердые вещества, без запаха и нерастворимые в воде.
Химические свойства: Химические свойства аминов сходны с аммиаком. Им характерны свойства оснований.
Свойства оснований: Взаимодействие с водой. Амины растворяются в воде с образованием ионов алкиламмония [RNH3]+, при этом происходит накопление ОН- ионов в растворе:
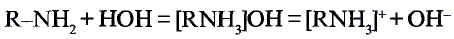
В результате этого водные растворы аминов имеют щелочную среду. Индикатор изменяет цвет: фенолфталеин - на розовый, а лакмус- на синий. Ион алкиламмония по своему строению похож на ион аммония, при этом азот проявляет четырех валентность и степень окисления, равную 3.
Взаимодействие с кислотами. Амины, также как и аммиак, взаимодействуют с минеральными кислотами с образованием солей алкиламмония.
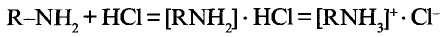
Эта реакция осуществляется и в газообразном и жидком и твердом состоянии. Образующиеся соли - твердые вещества, хорошо растворимые в воде. В водных растворах находятся в диссоциированном состоянии. Под воздействием щелочей (особенно при нагревании) расщепляются до свободных аминов.
Горение. В отличие от аммиака амины на воздухе горят (вспомните при каких условиях горит аммиак):
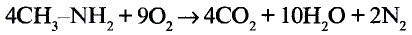
Анилин - представитель ароматических аминов
Среди аминов большое практическое значение имеет анилин (бензоламин, фениламин). C6H5NH2 первичный ароматический амин.
Физические свойства: Бесцветная маслянистая жидкость, со специфическим запахом, малорастворимая в воде. Сильно ядовит. Темнеет вследствие частичного окисления на воздухе.
Химические свойства: Свойства оснований. Анилин - слабое основание. Фенильный радикал С6Н5 обладающий отрицательным индукционным эффектом, притягивая к себе неспаренные электроны азота аминогруппы, уменьшает электронную плотность азота и ослабляет связанность водорода. Поэтому свойства оснований у анилина слабее, чем у алифатических аминов (вспомните, что в результате притяжения фенильного радикала фенола электронами гидроксильной группы ослабевает связанность водорода и усиливаются кислотные свойства). Анилин не взаимодействует с водой и его водные растворы не изменяют цвет индикатора.
Взаимодействие с кислотами. С сильными кислотами анилин образует соли. А при воздействии на них щелочи он выделяется в свободном состоянии.
Реакция с участием бензольного ядра. Атомы водорода бензольного ядра анилина легко замещаются галогенами, нитро- и сульфогруппами. Эта реакция протекает легче, чем у бензола, заместители располагаются в орто- и пара-положении относительно аминогруппы, имеющей заменитель 1-рода. При воздействии на анилин бромной воды образуется осадок белого цвета (бензол не взаимодействует с бромной водой).
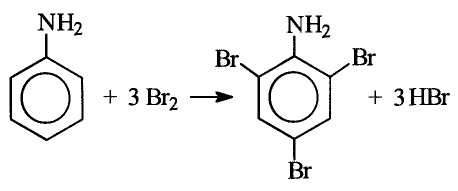
Окисление. Под воздействием кислорода воздуха и других окислителей анилин легко окисляется с образованием цветных продуктов. Одна из чувствительных реакций - реакция с хлорной известью СаОС12, которая применяется как качественная реакция на анилин, образующая характерный фиолетовый цвет. Под влиянием смеси бихромата калия и серной кислоты образуется продукт черного цвета - анилиновый черный. Черный анилин не растворим в воде и устойчив к воздействию мыла и света, поэтому он применяется при окрашивании тканей и стекол.
Получение и применение: Анилин - один из важнейших продуктов химической промышленности. Он является сырьем для получения многочисленных анилиновых красителей, лекарств (сульфаниламидов), взрывчатых веществ, высокомолекулярных веществ и т. д.
Получение анилина основано на восстановлении нитробензола (русский ученый Н. Н. Зинин, 1842 г):
В общем виде эта реакция имеет следующий вид
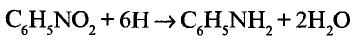
Н. Н. Зинин применял сульфид аммония, в настоящее время в лабораторных условиях анилин получают восстановлением нитробензола в присутствии железа и соляной кислоты, в промышленности же - каталитическим восстановлением водорода:
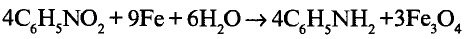
Аминокислоты
Аминокислоты - это органические соединения, где к углеводородному радикалу присоединены аминогруппа (-NH2) и карбоксильная (-СООН) группа.
Общая формула аминокислот - NН2-R-COOH.
По расположению аминогруппы относительно карбоксильной группы аминокислоты подразделяются следующим образом:
-
 (альфа)-аминокислоты;
(альфа)-аминокислоты; -
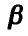 (бетта)-аминокислоты;
(бетта)-аминокислоты; -
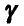 (гамма)-аминокислоты;
(гамма)-аминокислоты; -
 (дельта)-аминокислоты;
(дельта)-аминокислоты; -
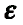 (эпсилон)-аминокислоты.
(эпсилон)-аминокислоты.
Строение: Молекулы аминокислот имеют две функциональные группы с противоположными химическими свойствами. Если аминогруппа обладает основными свойствами, то карбоксогруппа - кислотными. Эти две группы образуют в молекуле внутреннюю соль (биполярный ион):
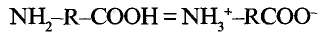
Биполярность аминокислот объясняется растворимость в воде, нейтральность водных растворов, кристаллическое строение твердых солей, относительно высокая температура плавления.
В состав аминокислотного радикала могут быть различные: гидрокси -ОН, тио -S, тиол -SH и другие функциональные группы.
Важнейшие аминокислоты - это 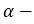 аминокислоты, которые являются основной молекулы белка.
аминокислоты, которые являются основной молекулы белка.
Многие аминокислоты имеют тривиальные названия, а по международной номенклатуре к названию соответствующей карбоновой кислоты прибавляется префикс -амино.
В таблице 19 приведены формулы, названия и классы некоторых аминокислот:
Некоторые аминокислоты которые встречаются в природе
Таблица 19
Изомерия: Аминокислотам свойственна структурная и стереоизомерия. Если структурная изомерия аминокислот связана с положением функциональных групп и со строением углеродного скелета, то стереоизомерия связана с асимметрией атома углерода, который может быть связан с четырьмя различными заместителями. Стереоизомеры проявляют оптическую активность и их называют оптическими изомерами.
Хотя оптические изомеры обладают одинаковыми физическими (температуры плавления и кипения, плотность) и химическими составами, один из них отклоняет поляризованный луч (L или (-)-форма) влево, а другой (Д или (+)-форма) вправо.
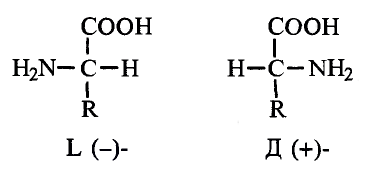
Физические свойства и распространенность в природе: В природе аминокислоты встречаются в свободном состоянии и в составе других соединений. Все растительные и животные белки состоят из аминокислот. Аминокислоты -бесцветные кристаллические вещества, хорошо растворимые в воде, многие из которых обладают сладким вкусом.
Химические свойства: Аминокислоты являются органическими амфотерными веществами и демонстрируют свойства и оснований и кислот. Отличие от неорганических амфотерных веществ состоит в том, что их амфотерностъ определяется наличием различных функциональных групп. Аминокислоты образуют биполярные ионы.
Влияние на цвет индикатора. Моноаминомонокарбоновые и диаминодикарбоновые аминокислоты не изменяют цвет индикатора. Диаминомонокарбоновые аминокислоты проявляют основные, а моноаминодикарбоновые кислоты - кислотные свойства и в зависимости от этого по разному изменяют цвет индикатора.
Кислотные свойства (реакции идут за счет карбоксильной группы). Аминокислоты также как обычные кислоты реагируют с металлами, оксидами металлов и щелочами с образованием солей.
Также как органические и неорганические кислоты образуют со спиртами сложные эфиры.
Свойства оснований (реакции идут за счет аминогруппы). Аминокислоты, подобно аминам, реагируют с сильными минеральными кислотами с образованием солей.
Отличительные реакции. Аминокислотам характерна реакция поликонденсации с образованием полипептидов:
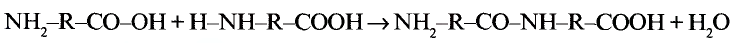
Группа -CO-NH- атомов называется пептидной (амидной) группой, связь между углеродом и азотом называется пептидной (амидной) связью.
Из двух молекул аминокислоты образуется дипептид, из трех - трипептид, из четырех тетрапептид и т. д. В молекулах белка аминокислоты связаны друг с другом посредством пептидной связи. Синтез белка в организме человека и животных можно представить по этой простой схеме.
Поликонденсацией аминокапроновой кислоты образуется капрон:
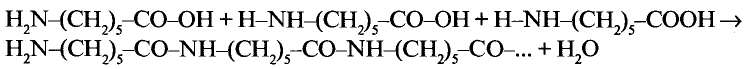
Молекулы капрона имеют линейную структуру и имеют [-NH-(CH2)5-CO-]n общую формулу. Молекулярная масса капрона в пределах 16000-22000. Капрон вытягивается в волокно. Капроновое волокно является примером синтетического химического волокна. Оно не пропускает влагу, не теряет прочность и не гниет, по сравнению с природными волокнами устойчиво к стиранию. Высокая прочность капрона - результат наличия множества водородных связей, которая возникает в результате взаимодействия -NH- и -СО-групп макромолекулы.
Однако капроновое волокно имеет и некоторые недостатки: не устойчиво к воздействию кислот (гидролизуется начиная с амидной связи) и высокой температуры плавится при 215°Q.
Из капронового волокна производится одежда, искусственное стекло, парашют, канат, рыболовные снасти. Из сверхпрочного капронового волокна изготавливаются авто- и авиашины, детали машин и механизмов.
Получение и применение: Аминокислоты получают в качестве конечного продукта гидролиза белков.
Любой синтетический способ получения аминокислот состоит из двух этапов:
а) синтез галогензамещенной карбоновой кислоты:
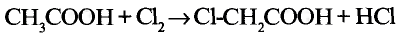
б) получение аминокислоты при воздействии аммиака:
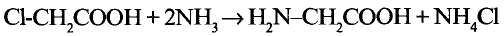
Аминокислоты имеют важное значение в обмене азота в живых организмах. Они являются основным источником для образования белка, пептидов, ферментов, гормонов и других веществ.
Аминокислоты, синтезируемые в организме человека и животных из других аминокислот или из не белковых компонентов, называются заменимыми.
Аминокислоты, не синтезируемые в организме животных и человека, но необходимые для нормальной жизнедеятельности, называются незаменимыми (лизин, изолейцин, фенилаланин ... всего 8 аминокислот).
Незаменимые аминокислоты синтезируются только зелеными растениями.
Аминокислоты применяются в медицине, животноводстве для обогащения пищи животных, в производстве пластмасс и синтетических волокон.
Белки
Белки - высшая форма органических соединений. Они - основа всего живого. Жизнь - это форма существования белков.
Состав и строение: Известны различные типы белков, их молекулярная масса колеблется от 6000 до нескольких миллионов. По результатам анализа различных белков определено, что в их составе 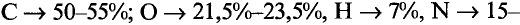
 немного Р, галогенов, металлов. Например формула белка крови - гемоглобина (C738H1166O208S2Fe)4.
немного Р, галогенов, металлов. Например формула белка крови - гемоглобина (C738H1166O208S2Fe)4.
Основные сведения о строении белков, химических свойствах получены путем гидролиза. При гидролизе любого белка образуются аминокислоты. В состав белка чаще всего входит 23 аминокислоты. Аминокислоты в белках связаны посредством пептидной связи.
Полипептидная цепь, в которой аминокислотные остатки расположены в определенной последовательности, называется первичной структурой белка.
Сложная пространственная спиралеобразная конфигурация белка, образующаяся под воздействием водородной связи между пептидными связями полипептидной цепи, называется вторичной структурой белка. Пространственная трехмерная структура, образующаяся в результате закручивания вторичной структуры под влиянием функциональных групп (солевой мостик между карбоксильной группой и аминогруппой, сложноэфирный мостик между карбоксильной группой и гидроксильной группой, дисульфидный мостик между атомами серы) полипептидной цепи, называется третичной структурой белка.
Классификация: В соответствии с химическим составом белки подразделяются на простые и сложные.
Простые белки или протеины - белки, при гидролизе которых образуются только аминокислоты. Среди белков они составляют большую часть.
Сложные белки или протеиды, белки при гидролизе которых кроме белков образуется небелковые вещества (углеводы, фосфорная, нуклеиновая кислота и др.)
Общие свойства белков: Биологическая активность белков связана с пространственным и химическим строением белка. Белки обладают различными физиологическими свойствами: некоторые растворяются в воде, образуя коллоидные растворы (белок яйца), некоторые растворяются в разбавленных растворах соли, третьи же не растворяются ни в одном из растворителях (белки клеточных покровов).
Некоторые белки можно выделить в виде кристаллов (гемоглобин крови, яичный белок).
Химические свойства: Гидролиз. При нагревании белков с щелочами или кислотами или под влиянием ферментов происходит гидролиз. Последним продуктом гидролиза является аминокислота.
Амфотерные свойства. В молекулах белка (в радикалах аминокислотного витка) наличие -СООН и NH2 групп определяют амфотерные свойства. Они взаимодействуют с кислотами и щелочами с образованием солей.
Денатурация белка - это его необратимое разрушение (вторичной и третичной структуры) под воздействием температуры, радиации, солей тяжелых металлов и механического встряхивания. В результате денатурации разрушается пространственная структура белка (разрушаются водородные, солевые, эфирные, полисульфидные мостики)и нарушается его биологическая активность.
При сильном нагревании белков образуются летучие вещества, имеющие запах жженных перьев. Это позволяет распознавать белки.
Цветные реакции белков:
Биуретовая реакция. При приливании к белку щелочи и нескольких капель раствора солей меди (II) образуется красно-фиолетовое окрашивание.
Ксантопротеиновая реакция. При приливании к белку, содержащему бензольное кольцо, концентрированной азотной кислоты, происходит окрашивание в желтый цвет, а при добавлении щелочи - желтый цвет переходит в золотистый.
Биологическое значение белков: Белки, являясь основной составной частью живых организмов, входят в состав ядра и протоплазмы клеток растений и животных. Это форма существования живых организмов. Организмы животных строят свои белковые клетки за счет белковых аминокислот, получаемых с пищей. Нехватка или отсутствие белка в пище приводит к тяжелым заболеваниям. Ценность пищевых продуктов оценивается составом аминокислот и незаменимыми аминокислотами, имеющимися в пище. В организм животных белки поступают с расти тельностью или другой животной пищей. Под влиянием ферментов желудка и кишечника белки гидролизуются. При этом, образующиеся аминокислоты всасываются ворсинками кишечника в кровь, через которую они доставляются в ткани и клетки организма. Здесь происходит биосинтез белков, соответствующих данному организму. Из белков идет построение тканей и клеток организма.
При нехватке незаменимых аминокислот в пище, у животных наблюдается отставание в росте, весе, и может даже наступить смерть.
Белки управляют важными функциями и специфическими функциями живых организмов: памятью, ростом, движениями, активностью органов чувств, природой болезни, иммунитетом и т. д. В организме такой сложный процесс, как биосинтез белков протекает очень быстро: молекула белка образуется за 2-3 сек.
Изучение тонких и сложных процессов, которые происходят в организме, является интересной и актуальной проблемой, решение которого способствует созданию новых биотехнологических процессов, протекающих в живых организмах.
Изучение белковых веществ - это осознание всего живого и его осознанное управление.
В промышленности белки применяются для получения природных волокон (шелка, шерсти), кожи, желатина, казеина, пластмасс.
Белковые препараты, применяемые в медицине- это гормоны, кровезаменители, которые имеют важное значение.
Высокомолекулярные соединения
К синтетическим высокомолекулярным соединениям и полимерным материалам относятся пластмассы (полиэтилен, полипропилен, поливинил хлорид, полистирол, фенолоформальдегидные пластмассы и др.), синтетические каучуки.
Свойства высокомолекулярных соединений (ВМС) зависят от их строения и способа синтеза.
- Реакция полимеризации - это образование более крупной молекулы в результате последовательного соединения одинаковых молекул.
- В результате полимеризации образуются высокомолекулярные соединения - полимеры.
- Молекулы полимера называются макромолекулами.
- Низкомолекулярные соединения, образующие макромолекулы, называются мономерами.
- Число мономеров в цепи полимера, называется степенью полимеризации.
- Молекулярная масса полимеров величина непостоянная, она является средней величиной, зависящей от степени полимеризации.
Строение полимеров: Известно, что строение макромолекулы полимера может быть линейным, разветвленным и пространственным. Нельзя забывать то, что линейное строение наблюдается не только тогда, когда атомы углерода расположены на одной линии, но и тогда, когда они расположены в зигзагообразной цепи.
Важнейшая характеристика полимеров - это их аморфная и кристаллическая структура. Кристаллическая структура полимеров характеризуется упорядоченностью (параллельностью) макромолекулы полимера, аморфная структура же - ее неупорядоченностью. Полимеры не имеют настоящего кристаллического строения. Обычно, если одна часть макромолекулы имеет упорядоченное строение, то другая ее часть не имеет таковую. Степень кристалличности настоящего полимера переменна. Например, при растяжении полимера его молекулы располагаются параллельно и его степень кристалличности возрастает.
Относительная молекулярная масса полимера - средняя величина, так как для настоящего полимера степень полимеризации непостоянная величина.
Характерные свойства полимеров: Полимеры также, как и высокомолекулярные соединения, не имеют постоянной температуры плавления, а плавятся при определенном интервале температур. Они не возгоняются, мало растворимы, растворы очень вязкие. Полимеры отличаются высокой механической прочностью. Все это объясняется своеобразным строением полимеров. Для плавления вещества необходимо нагревание для преодоления силы притяжения между молекулами. В высокомолекулярных соединениях силы межмолекулярного взаимодействия велики, для их преодоления расходуется много энергии. Так как степень полимеризации величина непостоянная, то и молекулярная масса различна, поэтому при нагревании увеличивается подвижность молекул небольшой массы, затем, при длительном нагревании, и большие макромолекулы обретают подвижность. ВМС не имеют определенной температуры плавления. Для возгонки необходимо сильное нагревание и только после этого макромолекулы переходят в летучее состояние, однако, при сильном нагревании молекула полимера может расщепиться и возгонка становится невозможной.
Малая растворимость полимеров объясняется тем, что маленькие молекулы растворителя неспособны разделить макромолекулы.
Механическая прочность ВМС объясняется сильным межмолекулярным притяжением.
Получение: Синтетические ВМС и полимерные материалы получаются в результате реакций полимеризации, сополимеризации и поликонденсации. Для протекания этих реакций необходимо взаимодействие молекулы исходного вещества не менее чем с двумя другими молекулами. В молекулах веществ, вступающих в реакции полимеризации и сополимеризации (этилен, пропилен, стирол, бутадиен и др.), имеющиеся двойные связи разрываются, и за счет этого образуются две валентные связи, которые дают возможность образовывать связи с другими молекулами.
Реакция полимеризации идет по свободнорадикальному механизму. Для образования свободного радикала к первоначальному мономеру добавляется небольшое количество другого вещества, являющегося инициатором реакции. Молекула инициатора образует с молекулой мономера неустойчивое промежуточное соединение, которое расщепляется и образует свободный радикал (R°). Радикал, встретившись с молекулой мономера, оказывает воздействие на  связь и создает электронную пару с одним его электроном. Между радикалом и молекулой мономера возникает ковалентная связь. Второй электрон
связь и создает электронную пару с одним его электроном. Между радикалом и молекулой мономера возникает ковалентная связь. Второй электрон  связи остается свободным и свободная частица превращается в радикал.
связи остается свободным и свободная частица превращается в радикал.
Механизм реакции полимеризации этилена можно представить следующим образом (под давлением 150 МПа)
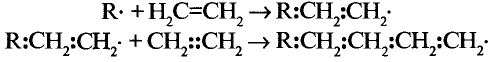
Инициатором реакции является кислород. Молекулы будут связываться друг с другом (пока два радикала не соединятся) до разрыва цепи. В результате образуется полимер (-СН2-СН2-)n.
Реакция поликонденсации протекает между двумя веществами, молекулы которых имеют не менее двух функциональных групп. Эти функциональные группы могут быть различными и одинаковыми (-NH2, -СООН в аминокислотах, -ОН в этиленгликоле, -СООН дикарбоновых кислотах). При осуществлении реакции поликонденсации между взаимодействующими функциональными группами образуется связь и, наряду с макромолекулой, образуются низкомолекулярные вещества.
Пластмассы
Производство пластмасс по объему стоит на первом месте среди полимерных материалов.
Пластические массы (пластмассы, пластики) являются материалами, полученными на основе природных или синтетических полимеров (смол), и при формовке находятся в пластичном состоянии, после же принимают стеклообразное состояние.
В состав пластмасс, кроме полимеров, входят другие добавки, которые придают им особые свойства. К таким добавкам относятся следующие:
Наполнители (древесная мука, ткань, асбест, стекловолокно)-способствуют повышению механической прочности и снижению стоимости пластмасс.
Пластификаторы (сложные эфиры, кипящие при высокой температуре) увеличивают эластичность материала и уменьшают его ломкость.
Стабилизаторы (антиоксиданты, лучевые стабилизаторы) -способствуют переработке пластмасс и сохранению свойств при эксплуатации.
Красители и другие вещества, придающие пластмассам различный цвет.
Полимер (смола), входящий в состав пластмасс, связывает все его компоненты. Свойства пластмасс зависят от составляющих их полимеров. В зависимости от изменений, происходящих в полимере при изготовлении изделий, пластмассы подразделяются на два типа:
Термопластические пластмассы- получают на основе линейных полимеров (полиэтилен, полипропилен, поливинилхлорид, полистирол и др.), при высокой температуре и давлении они обладают пластичностью и текучестью, а при охлаждении затвердевают.
Термореактивные пластмассы- получают из низкомолекулярных веществ -при формовке в результате химической реакции они пространственно сшиваются (сеточная структура). Это неплавящиеся и нерастворимые материалы, (фенолформальдегидные пластмассы).
На примере получения полиэтилена рассмотрим как воздействуют на продукцию способы получения. Полиетилен можно получить двумя способами: при высоком давлении (150-300 МПа, 200-280°С) и низком давлении (0,2-2,5 мПа, 80-100°С). В 20 таблице приведены некоторые свойства полимеров, полученные вышеприведенными двумя способами.
| Свойства | Полимер | |
| при высоком давлении | при низком давлении | |
| Молекулярная масса | 60000-500000 | 80000-800000 |
| Степень кристаллизации. % | 50-65 | 75-90 |
| Плотность, 910-930 кг/м3 | 950-970 | |
| Температура плавления, °С | 105-108 | 120-130 |
Полимер, полученный при высоком давлении не имеет твердой линейной структуры. В молекуле идет процесс разветвления и поэтому его степень кристаллизации ниже, чем у полимера, полученного при низком давлении.
Искусственные и синтетические волокна: На сегодняшний день широко применяются волокна, получаемые химическими способами. Искусственными называются волокна, получаемые путем химической переработки природного волокна, а синтетическими - волокна, получаемые из синтетических материалов.
Ди- и триацетат целлюлозы применяется для получения ацетатного волокна. С давних времен человечество использовало природное волокно (состоящие из целлюлозы - лен, кенаф, хлопок; состоящие из белка - шерсть, шелк) для изготовления одежды и других хозяйственных изделий. Искусственное ацетатное волокно - это волокно, которое обладает такими свойствами, как прочность, мягкость, оно не теряет форму, цвет. Недостатком является то, что оно по сравнению с хлопковым волокном обладает меньшей гигроскопичностью и подвержено электризации.
Этиленгликоль применяется при получении лавсанового синтетического волокна. Расплавленная стекломасса сразу не твердеет, а постепенно начинает сгущаться и увеличивать свою вязкость. Это дает возможность придавать ему различную форму. Из остывающей сгущенной массы можно вытягивать волокно. Из стекловолокна изготавливаются тепло- и электроизоляционные ткани, кислотоустойчивые материалы.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |