
Галогены в химии - формулы и определение с примерами
Содержание:
Понятие "галоген" было введено в науку в 1811 г. немецким химиком И. Швейгером и означало "образующий соль".
Галогенами называют фтор, хлор, бром, йод и астат. Все галогены являются неметаллами и в периодической таблице химических элементов занимают основную подгруппу седьмой группы.
На внешнем энергетическом уровне атомы галогенов имеют семь электронов и для заполнения этого уровня восемью электронами им недостает одного электрона. Поэтому они присоединяют по одному электрону от атомов водорода и металлов и проявляют степень окисления, равную —1:
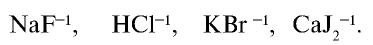
Будучи сильным электроотрицательным элементом, только фтор проявляет степень окисления —1 во всех соединениях. Другие галогены хлор, бром и йод в соединениях с кислородом проявляют также степень окисления от +1 до +7 .
Строение атомов галогенов
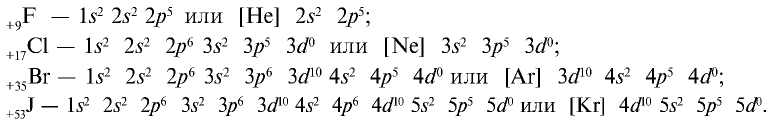
Распространение в природе
Так как галогены являются сильными окислителями, в свободном состоянии в природе они не встречаются и находятся в основном в виде химических соединений (табл. 23).
Таблица 23
Распространение галогенов в природе
| Химический элемент | Количество в земной коре, % | Природные соединения |
| Фтор | 0,027 | Плавиковый шпат  , апатит, фосфориты , апатит, фосфориты |
| Хлор | 0,045 | Хлориды: КС1, NaCl |
| Бром | 0,00016 | Бромиды: NaBr, KBr, MgBr,  |
|
Йод |
0,00003 | Йодиды: NaJ, KJ |
Получение галогенов
В связи с тем, что в природных соединениях галогены имеют в основном отрицательную (—1) степень окисления, выделение их в свободном состоянии проводится путем окисления ионов галогенидов.
- Фтор получают из фторид-ионов только в процессе электролиза.
- Хлор получают из хлоридов путем электролиза растворов, содержащих ионы хлора, или путем воздействия на них сильными окислителями:
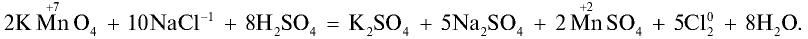
- Бром получают из бромидов путем электролиза растворов, содержащих бромид-ионы, или путем воздействия на них сильными окислителями. Кроме того, бром можно выделить воздействуя на растворы бромидов хлором, так как хлор — более сильный окислитель, чем бром:
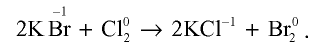
- Йод выделяют из йодидов путем их электролиза или воздействия на них сильными окислителями, в частности, хлором и бромом

Физические свойства галогенов
О некоторых свойствах галогенов вы узнали при изучении природных семейств химических элементов. С возрастанием относительных атомных масс галогенов их физические свойства изменяются по определенной закономерности.
Агрегатные в обычных условиях состояния и цвет постепенно сгущаются.
Фтор — газ светло-зеленого цвета, хлор — тяжелый газ желто-зеленого цвета, бром — жидкость красновато-бурого цвета, йод — кристаллическое вещество темно-серого цвета. Температура кипения и плотность постепенно увеличиваются от фтора к йоду.
Водорастворимость галогенов относительно невелика. Так, в одном объеме воды в обычных условиях растворяется 2,5 объема хлора, водорастворимость йода составляет 0,02 на 100 г воды. Галогены хорошо растворяются в органических растворителях (керосин, бензин, ацетон, различные спирты, бензол и др.).
Йод обладает сублимирующим свойством, то есть при накаливании он превращается в газ фиолетового цвета.
— Явление перехода веществ из твердого состояния в газообразное, а из газообразного в твердое, минуя жидкое, называется сублимацией.
Химические свойства галогенов
Радиусы атомов галогенов увеличиваются от фтора к йоду (в ряду 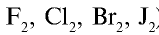 ). Это объясняется тем, что валентные электроны фтора притягиваются к ядру сильнее, чем электроны йода.
). Это объясняется тем, что валентные электроны фтора притягиваются к ядру сильнее, чем электроны йода.
В ряду 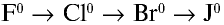 :
:
- — окислительные свойства галогенов ослабевают;
- — химическая активность снижается;
- — восстановительные свойства усиливаются.
В ряду 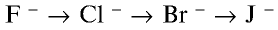 , наоборот, химическая активность галогенов возрастает. Внешний энергетический слой этих ионов заполнен восемью электронами, они не могут присоединять электроны, а наоборот, отдают их и окисляются.
, наоборот, химическая активность галогенов возрастает. Внешний энергетический слой этих ионов заполнен восемью электронами, они не могут присоединять электроны, а наоборот, отдают их и окисляются.
Фтор — самый активный среди галогенов. Под влиянием фтора окисляется даже кислород. При взаимодействии с водой он горит ярким пламенем:
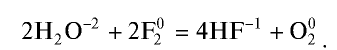
Элементы знаний, умений и навыков: галогены, сублимация.
Хлор
Хлор — ядовитый газ, натрий — щелочной металл.
Галогены и их соединения имеют большое значение в народном хозяйстве. Хлор и его соединения занимают важное место в ряду галогенов. Поэтому рассмотрим свойства хлора подробнее. Из предыдущих глав нам известно, что:
1) в периодической таблице химический элемент хлор расположен в основной подгруппе седьмой группы третьего периода под порядковым номером 17;
2) атом хлора имеет следующее строение: 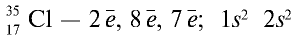
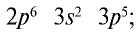
3) молекула хлора имеет следующее строение: 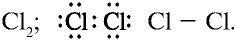 Это молекула с неполярной ковалентной связью. Распространение в природе. В природе хлор встречается только в виде таких соединений, как:
Это молекула с неполярной ковалентной связью. Распространение в природе. В природе хлор встречается только в виде таких соединений, как:
- галит (каменная соль)-------NaCl;
- сильвинит------------------- КС1 • NaCl;
- сильвин--------------------- КС1;
- бишофит--------------------
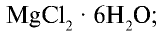
- карналлит-------------------
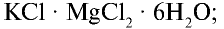
- каинит----------------------
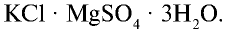
Получение:
В промышленности хлор получают путем электролиза.
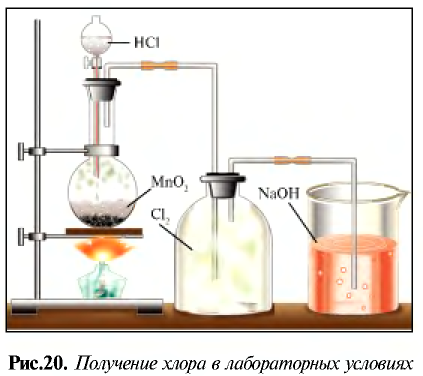
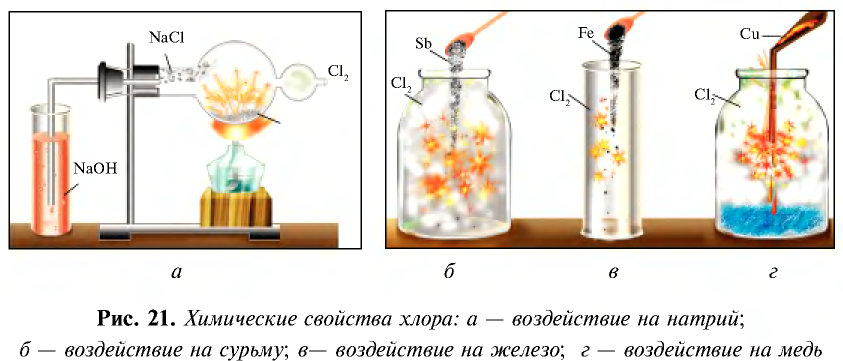
В лабораторных условиях хлор получают при взаимодействии 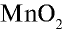 с НС1 на установке, указанной на рис. 20. Вместо
с НС1 на установке, указанной на рис. 20. Вместо 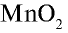 можно использовать
можно использовать 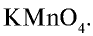 . Запишите уравнение этой реакции и уравняйте ее.
. Запишите уравнение этой реакции и уравняйте ее.
Физические свойства:
Хлор — таз желто-зеленого цвета с острым удушливым запахом, ядовит. Попадая в органы дыхания, хлор вызывает воспаление слизистой оболочки. Поэтому, работая с ним следует соблюдать осторожность. Примерно в 2,5 раза тяжелее воздуха. При температуре 20°С в одном объеме воды растворяется 2,5 объема хлора, в результате образуется раствор, называемый хлорной водой.
Пример №1
Определите массу хлора в хлорной воде.
Решение.
В одном объеме воды растворяется 2,5 объема хлора.
Значит, в 1 л воды растворяется 2,5 л 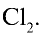
1. Масса 1 л воды: т — 1000 мл • 1 г/мл = 1000 г.
2. Масса 2,5 л 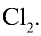 :
:
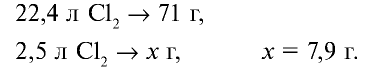
4. Масса раствора: 1000 + 7,9 = 1007,9 г.
5. Массовая доля хлора в растворе:
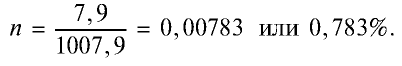
Химические свойства:
При взаимодействии с водородом, металлами, бромидами и йодидами хлор является окислителем. Например, реакция взаимодействия хлора с натрием выражается следующим уравнением (см. рис. 21, а).

Поскольку хлор сильный окислитель, то вступая в реакцию с железом, он окисляет его до степени окисления +3 (см. рис. 21, в).
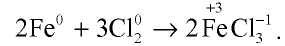
Хлор взаимодействует также с сурьмой, медью и рядом простых веществ (рис. 21, б, г).
При взаимодействии с водой и щелочами один атом молекулы хлора является окислителем, второй—восстановителем:
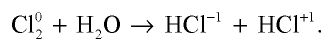
Соединяясь с едким калием, хлор в зависимости от условий образует различные вещества. При взаимодействии хлора с нагретым едким калием образуются хлорид калия и бертолетова соль. Степень окисления хлора в хлориде калия равна —1, в бертолетовой соли +5:
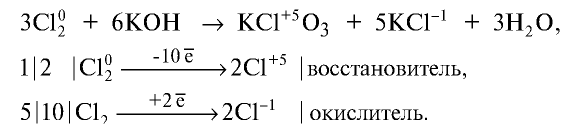
При взаимодействии хлора с холодным едким калием образуются соли КС10 и КС1:
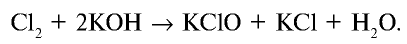
Уравняйте уравнение этой реакции методом электронного баланса.
Элементы знаний, умений и навыков: природные соединения хлора, получение, степени окисления хлора, хлор-окислитель, хлор-восстановитель, соляная кислота.
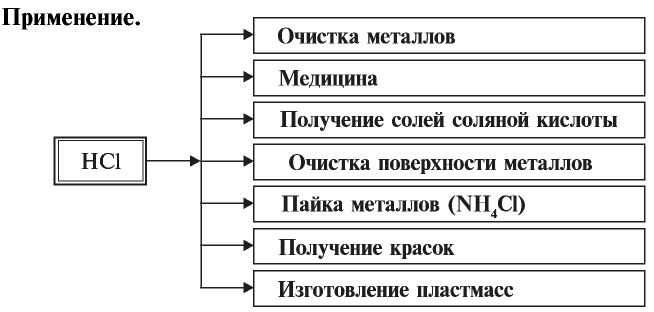
Хлорид водорода
Чем объясняются кислотные свойства водного раствора хлорида водорода?
Хлорид водорода — одно из самых важных соединений хлора. Его химическая формула НС1. Относительная молекулярная масса 36,5. Структурная формула Н—С1, атомы в молекуле связаны полярной ковалентной связью. Электронная формула 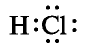 .
.
Получение:
1. В промышленности хлорид водорода получают в реакциях взаимодействия водорода и хлора:
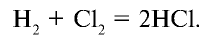
2. В лабораторных условиях хлорид водорода получают путем воздействия на чистый сухой хлорид натрия концентрированной серной кислотой:
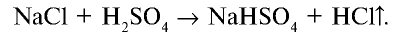
При сильном нагревании реакция заканчивается образованием сульфата натрия:
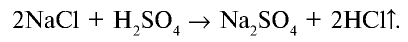
Физические свойства:
Хлорид водорода — бесцветный газ с острым удушливым запахом, немного легче воздуха  Очень хорошо растворяется в воде, то есть в одном объеме воды растворяются 500 объемов НС1 (рис. 22).
Очень хорошо растворяется в воде, то есть в одном объеме воды растворяются 500 объемов НС1 (рис. 22).

Химические свойства:
По химическим свойствам хлорид водорода схож с соляной кислотой, поэтому ее химические свойства рассмотрим подробнее ниже. Однако в отличие от соляной кислоты, сухой хлорид водорода не вступает в реакции с металлами и их оксидами.
Применение:
Хлорид водорода используется в основном в производстве соляной кислоты.
Соляная кислота
Соляная кислота представляет собой водный раствор хлорида водорода.
Получение:
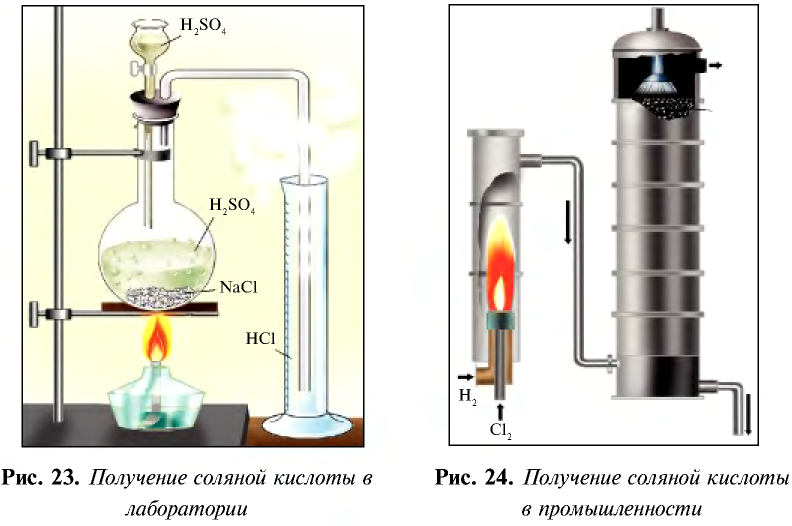
В лабораторных условиях соляную кислоту получают с помощью простой реакции. Выделяющийся в результате реакции газ направляется в воду, в которой он быстро растворяется и образует соляную кислоту (рис. 23).
В промышленности соляную кислоту получают путем сжигания водорода с хлором и растворения в воде полученного хлорида водорода (рис. 24).
Физические свойства:
Концентрированная соляная кислота — бесцветная жидкость с острым запахом (за счет выделения хлорида водорода), дымящаяся при влажном воздухе. Плотность концентрированной соляной кислоты 1,19 г/см3, содержание хлорида водорода в ней 37% (такая кислота называется также "дымящейся").
Химические свойства:
1. Соляная кислота вступает в химические реакции, как и все сильные кислоты:
а) окрашивает фиолетовый цвет лакмуса в красный; обесцвечивает розовый цвет фенолфталеина в щелочной среде; изменяет оранжевый цвет метилоранжа в красный;
б) взаимодействует со всеми металлами, которые в ряду активности расположены перед водородом, с образованием соли и водорода:

в) взаимодействует с основными и амфотерными оксидами с образованием солей и воды:
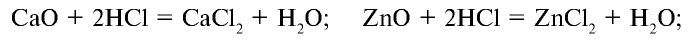
г) взаимодействует с основаниями с образованием солей и воды:
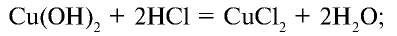
д) взаимодействует с солями слабых кислот с образованием новой
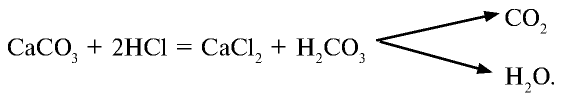
2. Реакции, присущие соляной кислоте.
а) взаимодействует с нитратом серебра и образует белый осадок (AgCl), который не растворяется ни в воде, ни в кислоте:
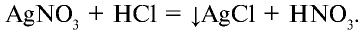
 служит реактивом для определения наличия хлорид-иона в растворах;
служит реактивом для определения наличия хлорид-иона в растворах;
б) взаимодействует с окислителями, в результате чего ион хлора окисляется и образуется свободный хлор:
Соли соляной кислоты называют хлоридами. Хлориды имеют важное значение в народном хозяйстве.
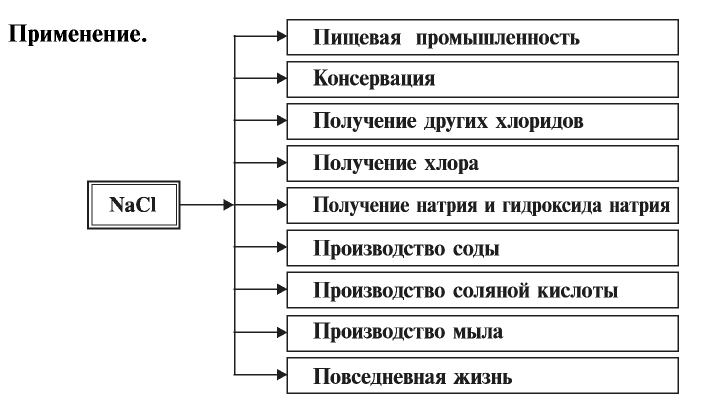
Хлорид натрия (поваренная соль) — NaCl
Поваренная соль в природе встречается в большом количестве. Основная масса ее содержится в растворенном виде в воде морей и океанов. Поваренная соль встречается также в виде твердых кристаллов, называемых каменной солью. На территории Узбекистана каменная соль добывается на месторождениях Ходжаикан, Тубакат, Барса-Кельмес, Байбичакан, Аккала.
Температура кипения поваренной соли 1413°С, температура плавления 800,4°С, плотность 2,16 г/см3. Растворимость при 0°С — 35,6 г.
Поваренная соль имеет важное значение в жизни человека и в народном хозяйстве. Человек потребляет в сутки примерно 10 г, а в год — 3,6 кг поваренной соли. Значит, население Узбекистана в год потребляет примерно 90000 т поваренной соли. Население всего мира потребляет в год 25 млн т этого продукта.
Хлорид калия — КС1
Хлорид калия в природе встречается в виде минералов карналлита — 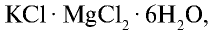 , сильвинита — КС1 • NaCl, сильвина — КС1, каинита —
, сильвинита — КС1 • NaCl, сильвина — КС1, каинита — 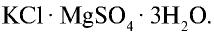 . Природные минералы хлорида калия добываются на месторождениях Тубакат в Кашкадарьинской области и Ходжаикан в Сурхандарьинской области.
. Природные минералы хлорида калия добываются на месторождениях Тубакат в Кашкадарьинской области и Ходжаикан в Сурхандарьинской области.
Хлорид калия имеет важное значение в производстве калийных удобрений для сельского хозяйства, а также для получения едкого кали, хлора и его соединений.
Почти все хлориды, кроме 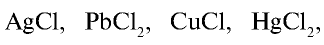 хорошо растворяются в воде.
хорошо растворяются в воде.
Для определения хлоридов и соляной кислоты используется раствор 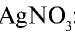
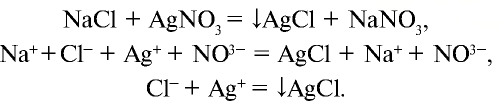
Соль 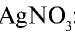 является реактивом для хлорид-иона (Cl¯).
является реактивом для хлорид-иона (Cl¯).
Кислородные соединения хлора
Галогены, в частности хлор, образуют ряд кислородных соединений, однако эти соединения получают косвенным путем, так как хлор непосредственно с кислородом не взаимодействует. В кислородных соединениях хлор проявляет степень окисления +1, +3, +5, +7.
Хлорноватистая кислота НСlO — неустойчивое вещество, которое существует только в разбавленных растворах.
НСlO — сильный окислитель. При медленном расщеплении ее выделяется атомарный кислород:
НСlO = НС1 + О.
Хлорноватистая кислота относится к очень слабым кислотам. Ее соли получают путем пропускания хлора через раствор щелочи:
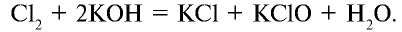
При взаимодействии хлора с гашеной известью получают хлорную известь (отбеливающая известь):
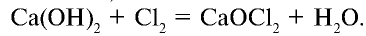
Хлорная известь — 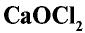 является смешанной солью (кальциевая соль соляной и хлорноватистой кислот) и имеет структурную формулу
является смешанной солью (кальциевая соль соляной и хлорноватистой кислот) и имеет структурную формулу
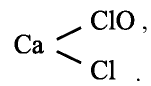
Хлористая кислота — — крайне неустойчива и существует только в разбавленных растворах. Является сильным окислителем. Соли хлористой кислоты неустойчивы и взрываются при ударе.
— крайне неустойчива и существует только в разбавленных растворах. Является сильным окислителем. Соли хлористой кислоты неустойчивы и взрываются при ударе.
Хлорноватая кислота 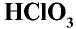 — неустойчивое вещество, существует только в растворе. При концентрации в растворе свыше 40% взрывается и расщепляется.
— неустойчивое вещество, существует только в растворе. При концентрации в растворе свыше 40% взрывается и расщепляется.
Хлорноватая кислота и ее соли — хлораты также являются сильными окислителями. При пропускании хлора через горячий гидроксид калия получается хлорат калия (бертолетова соль):
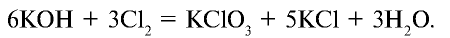
Бертолетова соль 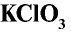 — устойчивое вещество, которое в качестве окислителя используется при производстве спичек, при изготовлении взрывчатых веществ. В лабораторных условиях применяется для получения кислорода.
— устойчивое вещество, которое в качестве окислителя используется при производстве спичек, при изготовлении взрывчатых веществ. В лабораторных условиях применяется для получения кислорода.
Хлорная кислота 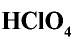 . Самая сильная среди кислородных соединений хлора. В ряду кислородных соединений хлора кислотные свойства и устойчивость повышаются, а окислительные свойства ослабевают в следующем порядке:
. Самая сильная среди кислородных соединений хлора. В ряду кислородных соединений хлора кислотные свойства и устойчивость повышаются, а окислительные свойства ослабевают в следующем порядке:
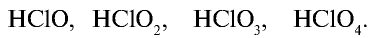
Элементы знаний, умений и навыков: хлорид водорода, соляная кислота, дымящаяся соляная кислота, реакции, присущие иону хлора, окисление хлор-иона, хлорноватистая кислота, хлорная известь, хлористая кислота, хлорноватая кислота, бертолетова соль, хлорная кислота.
Фтор, бром, йод
Какие соединения галогенов вы использовали? С какой целью?
Фтор, бром, йод являются представителями семейства галогенов и широко распространены в природе в виде различных соединений.
Фтор — в природе встречается в виде минералов флюорита (плавиковый шпат) 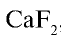 , криолита
, криолита 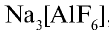 , фторапатита
, фторапатита 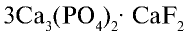 или
или 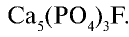
Бром — находится в виде минералов в морских и подземных водах и в качестве примеси во всех природных хлорсодержащих соединениях.
Йод — в природе встречается в составе морских водорослей, губок, морской воды в виде органических соединений и входит в состав чилийской селитры в качестве примеси в виде йодатов 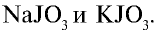
Все галогены имеют острый запах и ядовиты. Молекулы 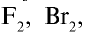
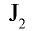 двуатомные, с возрастанием порядкового номера радиусы их атомов увеличиваются, что приводит к повышению поляризованности молекул. В результате усиливается межмолекулярное дисперсионное взаимодействие, что обусловливает жидкое состояние у брома и твердое — у йода. А это в свою очередь является причиной высоких значений их температур кипения и плавления.
двуатомные, с возрастанием порядкового номера радиусы их атомов увеличиваются, что приводит к повышению поляризованности молекул. В результате усиливается межмолекулярное дисперсионное взаимодействие, что обусловливает жидкое состояние у брома и твердое — у йода. А это в свою очередь является причиной высоких значений их температур кипения и плавления.
Фтор обладает очень высокой химической активностью и практически трудно растворим в растворителях. Бром и йод мало растворимы в воде и хорошо растворяются в органических растворителях.
При комнатной температуре фтор вступает во взаимодействие с щелочными металлами, свинцом и железом, а при накаливании реагирует также со всеми металлами, золотом и платиной. При низких температурах фтор взаимодействует с водородом, йодом, бромом, серой, фосфором, мышьяком, сурьмой, углеродом, кремнием и бором, при этом реакция сопровождается взрывом и воспламенением фтора. При накаливании фтор соединяется с хлором, криптоном и ксеноном:
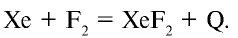
Фтор не вступает непосредственно в реакцию с кислородом, азотом и алмазом, в атмосфере фтора стекло и вода сгорают:
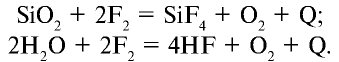
Несмотря на относительно слабую химическую активность брома и йода, они также взаимодействуют со многими металлами и неметаллами.
Бром реагирует с водородом при небольшом нагреве, а с йодом при сильном нагревании, однако с повышением температуры нагрева
HJ начинает расщепляться и происходит обратная реакция, которая не доходит до конца:
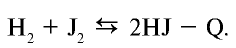
Химические свойства галогенов ослабевают от фтора к астату, окислительные свойства снижаются поэтапно. Этим объясняется окисление легкими галогенами (в качестве простых веществ) ионов тяжелых галогенидов и восстановление оксидов легких галогенов ионами тяжелых галогенидов:
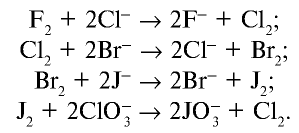
Так как фтор, бром, йод в природе встречаются в виде соединений и их ионы заряжены отрицательно, получение этих галогенов в свободном состоянии осуществляется через окисление их ионов путем воздействия окислителями и пропускания электрического тока через расплавы или водные растворы их солей.
Фтор используется для изготовления устойчивых к высоким температурам смазочных средств, стойких к химическим реагентам пластмасс (тефлон), охлаждающих жидкостей (фреон, хладон) и др.
Бром применяется при производстве различных лечебных средств, некоторых красок, при изготовлении бромида серебра. Недостаток брома в организме человека приводит к возникновению различных заболеваний нервной системы. При лечении этих заболеваний и при бессоннице применяются лекарственные средства на основе брома.
Пятипроцентный спиртовый раствор йода используется в медицине в качестве антисептического и кровоостанавливающего средства, а также при изготовлении ряда фармацевтических средств.
Пример №2
Как можно получить хлорид кальция с помощью поваренной соли и других необходимых веществ? Запишите соответствующие уравнения реакций.
Решение:
1) получение НС1 и 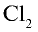 из поваренной соли:
из поваренной соли:
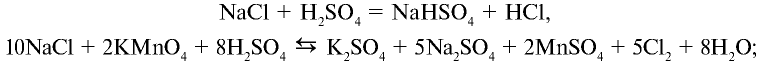
2) получение Са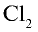 путем воздействия на HC1 оксидом Ca (CaO) или
путем воздействия на HC1 оксидом Ca (CaO) или 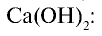
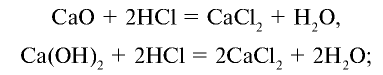
3) получение Ca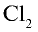 также путем воздействия на хлор кальцием:
также путем воздействия на хлор кальцием:
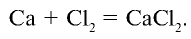
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |