
Электролиты и неэлектролиты в химии - формулы и определения с примерами
Содержание:
Электролиты и неэлектролиты:
Еще в начале XIX в. ученые сделали важное наблюдение: электрический ток могут проводить не только металлы, но и растворы многих веществ, например уксусной кислоты, поваренной соли и др.
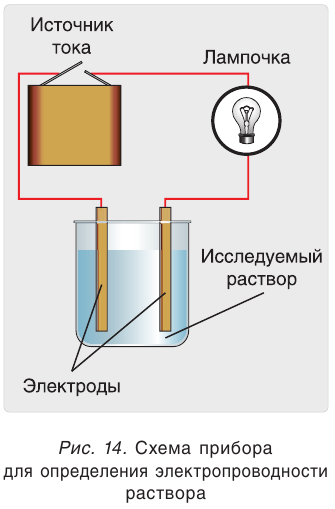
Электропроводность раствора можно установить с помощью прибора, изображенного на рисунке 14. Два электрода помещают в раствор и соединяют с источником тока. Если раствор проводит электрический ток, то цепь замыкается, о чем свидетельствуют показание вольтметра или загоревшаяся лампочка.
При погружении электродов в дистиллированную воду лампочка не загорается. Чистая вода не проводит электрический ток (рис. 15). Не проводит ток и сухая поваренная соль NaCl, если в нее погрузить электроды. Водный раствор этой же соли проводит электрический ток. Можно сделать вывод, что в растворе имеются носители электрического тока — заряженные частицы (ионы). Точно так же ведут себя в растворах и другие соли, а также щёлочи и кислоты. Безводные
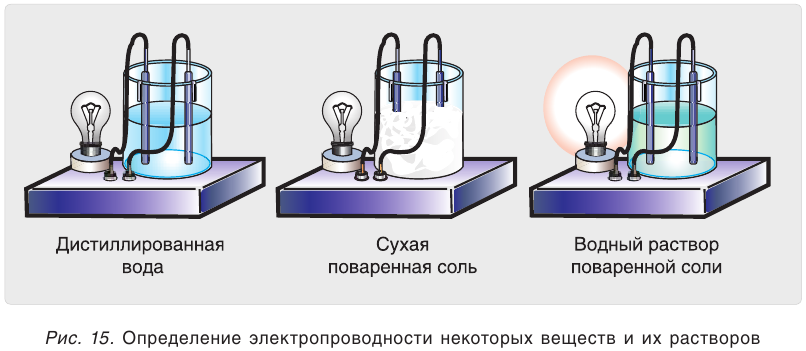
кислоты — очень плохие проводники электрического тока, но водные растворы многих кислот являются хорошими проводниками. Электропроводными являются также расплавы ионных соединений — солей и щелочей.
Исследуем электропроводность растворов и таких веществ, как сахароза, глюкоза, спирт. Мы видим, что лампочка в приборе не загорается. Следовательно, водные растворы этих веществ не проводят электрический ток. Это объясняется тем, что такие вещества состоят из молекул, которые переходят в раствор, не распадаясь на ионы.
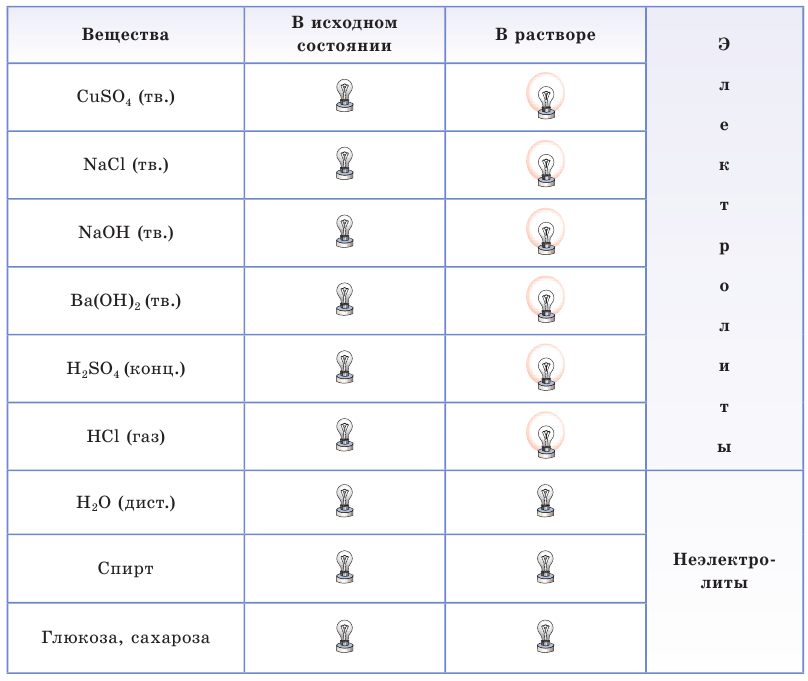
Результаты испытаний электропроводности веществ в исходном (твердом, жидком или газообразном) состоянии и их водных растворов отражены в таблице 10.
Таблица10. Электропроводность некоторых веществ и их растворов
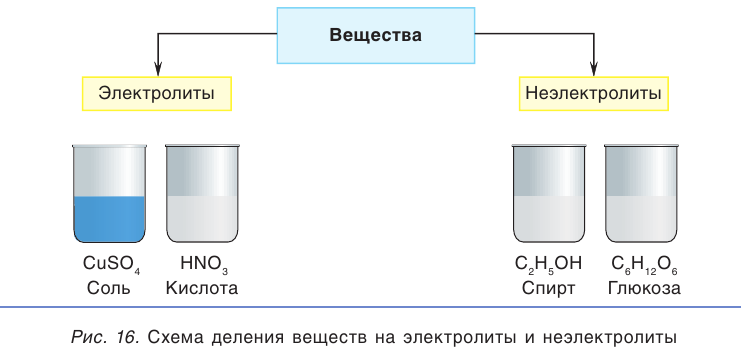
Известный английский физик Майкл Фарадей предложил разделить все вещества в зависимости от их способности проводить ток в растворенном или расплавленном состоянии на электролиты и неэлектролиты (рис. 16). Термин «электролит» происходит от греческого слова литос — растворенный (разложенный).
Вещества, водные растворы или расплавы которых проводят электрический ток, называются электролитами.
К электролитам относятся соединения с ионным типом связи. Это соли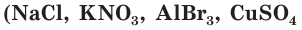 и др.) и основания
и др.) и основания 
 Кристаллы этих веществ построены из ионов, закономерно расположенных в узлах кристаллической решетки и удерживаемых в таком положении электростатическими силами. В процессе растворения этих электролитов в воде образующие их ионы переходят в раствор.
Кристаллы этих веществ построены из ионов, закономерно расположенных в узлах кристаллической решетки и удерживаемых в таком положении электростатическими силами. В процессе растворения этих электролитов в воде образующие их ионы переходят в раствор.
Электролитами являются и многие кислоты — вещества, образованные молекулами с ковалентными полярными связями 
 и др.).
и др.).
Вещества, водные растворы или расплавы которых не проводят электрический ток, называются неэлектролитами.
Неэлектролитами является большинство органических веществ, таких как сахароза, спирт, глицерин, простые вещества неметаллов и др. Они существуют в виде неполярных или малополярных молекул, которые при растворении в воде распределяются между ее молекулами.
По способности проводить электрический ток в растворах и расплавах вещества делятся на электролиты и неэлектролиты.
Электролиты — это вещества, водные растворы или расплавы которых проводят электрический ток.
Электролитами являются ионные соединения (основания, соли) и большинство кислот.
Электролитическая диссоциация веществ
Почему растворы и расплавы электролитов проводят электрический ток? Для ответа на этот вопрос шведский ученый Сванте Аррениус в 1887 г. детально изучил поведение веществ в водных растворах и выдвинул теорию, которая получила название теории электролитической диссоциации. Термин «диссоциация» происходит от латинского слова dissociatio — разъединение, распад.
Теория электролитической диссоциации
Электрический ток — это направленное движение заряженных частиц. Какие же частицы являются носителями электрического тока в растворах? В результате многочисленных экспериментов Аррениус установил, что растворы электролитов содержат больше частиц, чем их было в исходном веществе. Например, если в воде растворить хлороводород химическим количеством 1 моль, в растворе суммарное число частиц будет 2 моль, а 1 моль хлорида алюминия образует 4 моль частиц. Учитывая, что кристаллы хлорида алюминия имеют ионное строение, мы можем утверждать, что ионы алюминия и хлорид-ионы в воде переходят в раствор. Объяснения этих наблюдений явились основой теории электролитической диссоциации. Согласно этой теории, при растворении в воде или при расплавлении электролиты распадаются (диссоциируют) на ионы — положительно и отрицательно заряженные частицы.
Электролитическая диссоциация — это распад электролитов на ионы в водных растворах или расплавах.
При диссоциации электролитов образуются как простые ионы, состоящие из одного атома 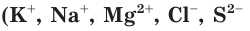 и др.), так и сложные ионы, состоящие из нескольких атомов
и др.), так и сложные ионы, состоящие из нескольких атомов 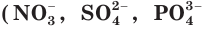 и др.).
и др.).
Обратите внимание:
- заряд иона и степень окисления атома записываются по-разному!
При обозначении заряда иона справа вверху от его формулы сначала записывают цифру, а потом знак + или –. При обозначении же степени окисления атома, как вы уже знаете, над символом элемента сначала записывается знак + или –, а потом — число.
Для обозначения заряженных частиц Аррениус использовал термин «ион», предложенный ранее М. Фарадеем. Слово «ион» в переводе с греческого означает «движущийся, идущий, странствующий». В растворах ионы непрерывно перемещаются («странствуют») в различных направлениях.
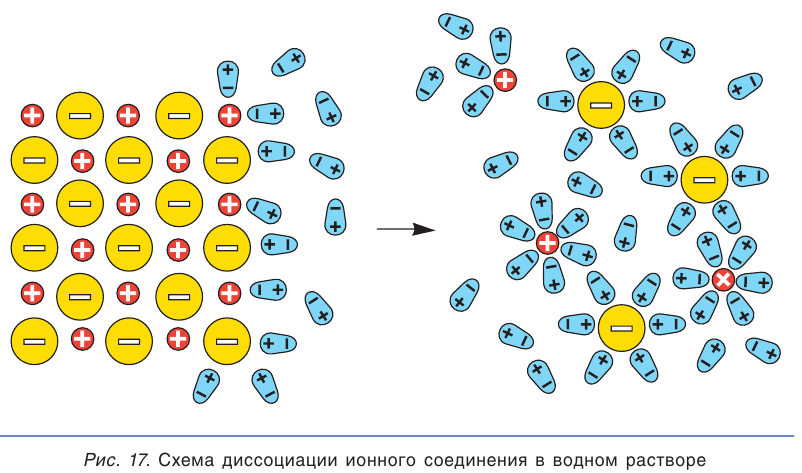
Главной причиной электролитической диссоциации в водных растворах является взаимодействие электролитов с молекулами воды. Такое взаимодействие называется гидратацией.
При погружении кристалла ионного соединения в воду полярные молекулы воды (диполи) притягиваются к ионам, находящимся на поверхности кристалла: отрицательными полюсами — к положительно заряженным ионам, а положительными полюсами — к отрицательно заряженным. Под действием молекул воды ионы отрываются от кристалла и переходят в раствор. При этом каждый отдельный ион оказывается окруженным диполями воды (рис. 17). Такие ионы называются гидратированными ионами.
Процесс электролитической диссоциации изображают химическим уравнением, в котором вместо знака равенства пишут либо одну, либо две противоположно направленные стрелки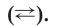 Обычно в уравнениях электролитической диссоциации не указывают формулы молекул воды, связанных с ионами в растворе:
Обычно в уравнениях электролитической диссоциации не указывают формулы молекул воды, связанных с ионами в растворе:
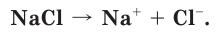
При составлении уравнений электролитической диссоциации руководствуются следующими правилами. В левой части уравнения записывают формулу вещества-электролита, а в правой — формулы ионов, на которые распадается электролит. Их число указывают с помощью коэффициентов:
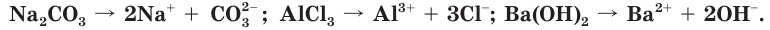
Обратите внимание: сложные ионы, например 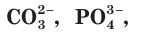 в процессе диссоциации не разрушаются!
в процессе диссоциации не разрушаются!
В молекулах с ковалентной связью ионов нет. Если в веществе ковалентная связь является малополярной, то при его растворении в воде разрываются только слабые связи между молекулами, а сами молекулы вещества остаются целыми, т. е. не распадаются на ионы и равномерно распределяются по всему объему раствора. Но что происходит при растворении в воде веществ с сильно полярной ковалентной связью, например газа хлороводорода HCl?
Когда полярная молекула хлороводорода попадает в воду, к той ее части, где сосредоточен положительный заряд, молекулы воды притягиваются своими отрицательными полюсами. К той части молекулы HCl, которая заряжена отрицательно, молекулы воды притягиваются положительными полюсами. В результате под действием диполей воды ковалентная полярная связь в молекуле хлороводорода разрывается с образованием гидратированных ионов водорода и хлора, которые переходят в раствор (рис. 18):
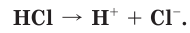
При разрыве химической связи электронная пара остается у отрицательно заряженного иона хлора. В растворе вместо каждой нейтральной молекулы HCl оказываются по два гидратированных иона: положительно заряженный ион водорода (H+ ) и отрицательно заряженный ион хлора (Cl- ). При этом общий заряд положительных ионов равен общему заряду отрицательных ионов.
Диссоциация молекул других кислот (иодоводородной, азотной, серной и др.) протекает в водных растворах сходным образом.
Если атомы в молекулах растворяемых веществ связаны ковалентной малополярной или неполярной связью, то эти вещества в водных растворах не распадаются на ионы. Поэтому такие вещества являются неэлектролитами.
Следовательно, электролитами могут быть только вещества с ионной и ковалентной полярной связью.
- При растворении в воде электролиты диссоциируют на отдельные ионы, которые в растворе окружены молекулами воды (гидратированы).
- Распад электролитов на ионы в водном растворе или расплаве называется электролитической диссоциацией.
- Главной причиной электролитической диссоциации в растворе является взаимодействие электролитов с молекулами воды.
Ионы в растворах электролитов
Ионы, образующиеся в процессе диссоциации электролитов в водных растворах, отличаются по своим свойствам от соответствующих нейтральных атомов и молекул.
Как вы уже знаете, при растворении поваренной соли в воде, содержащиеся в ее кристаллах ионы натрия и хлора переходят в раствор:
Сравним свойства атома и иона натрия. Общим, одинаковым в этих частицах является заряд ядра, равный 11+. Отличаются же они строением электронных оболочек, а следовательно, и свойствами (табл. 11).
Таблица 11. Отличия атомов натрия от ионов

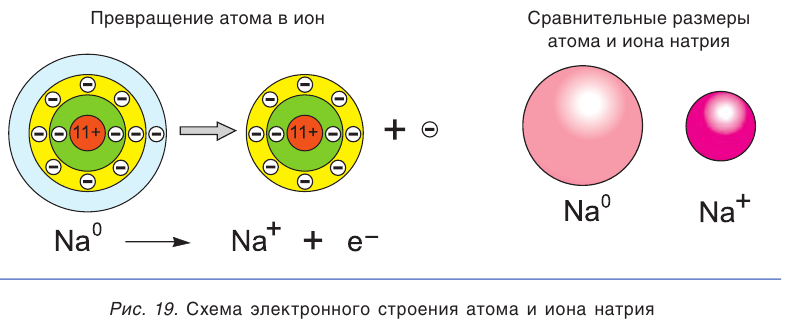
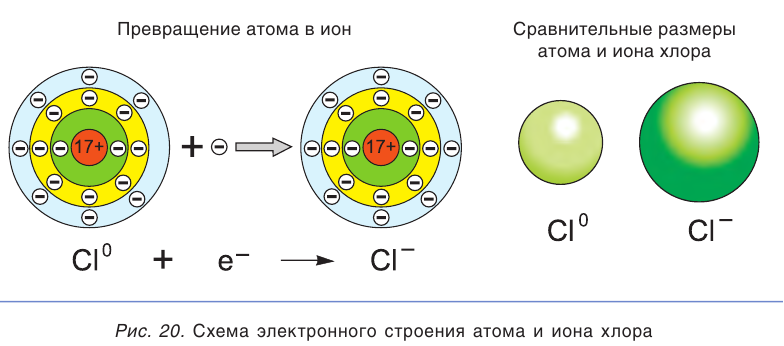
Высокая химическая активность натрия обусловлена тем, что у его атома на внешнем электронном слое находится всего один электрон. При взаимодействии с другими атомами атом натрия отдает этот электрон и превращается в гораздо более устойчивую частицу — ион Na+ (рис. 19). Так, атомы натрия взаимодействуют с водой, вытесняя из нее водород, а при растворении поваренной соли в воде водород не выделяется.
Строение и, следовательно, свойства атомов хлора Cl также будут отличаться от свойств ионов хлора Cl- (табл. 12).
Таблица 12. Отличия атомов хлора от ионов

Химическая активность атома хлора связана с нехваткой одного электрона на внешнем электронном слое для его завершения (рис. 20). Этот электрон атом хлора присоединяет при взаимодействии с атомами металлов, превращаясь при этом в устойчивый ион хлора 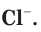
Атомы хлора Cl могут соединяться друг с другом ковалентной неполярной связью, образуя молекулу 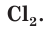 . Свободный хлор
. Свободный хлор 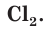 — ядовитый газ с зеленоватой окраской и характерным запахом, а ионы хлора
— ядовитый газ с зеленоватой окраской и характерным запахом, а ионы хлора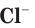 бесцветны и не имеют запаха. Раствор поваренной соли, как и сама соль NaCl, широко используется при приготовлении пищи, не причиняя вреда организму.
бесцветны и не имеют запаха. Раствор поваренной соли, как и сама соль NaCl, широко используется при приготовлении пищи, не причиняя вреда организму.
Аналогичным образом различаются свойства атомов водорода H, молекулярного водорода 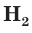 и ионов водорода
и ионов водорода  Молекулярный водород
Молекулярный водород 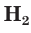 — это газ, который почти не растворяется в воде и горит на воздухе. Ионы водорода
— это газ, который почти не растворяется в воде и горит на воздухе. Ионы водорода 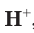 , напротив, в воде могут находиться в очень большом количестве.
, напротив, в воде могут находиться в очень большом количестве.
Таким образом, различия в свойствах атомов и ионов одного и того же элемента объясняются разным электронным строением этих частиц.
В растворе ионы находятся в хаотическом движении. Но если опустить в раствор электролита электроды и подать на них электрическое напряжение, то ионы приобретают направленное движение: положительно заряженные ионы перемещаются к катоду (отрицательно заряженному электроду), а отрицательно заряженные ионы — к аноду (положительно заряженному электроду) (рис. 21). Поэтому положительно заряженные ионы получили название катионы, а отрицательно заряженные — анионы. Следы движения окрашенных ионов (например, 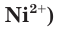 можно наблюдать на влажной фильтровальной бумаге, если на нее поместить крупинки соли
можно наблюдать на влажной фильтровальной бумаге, если на нее поместить крупинки соли 
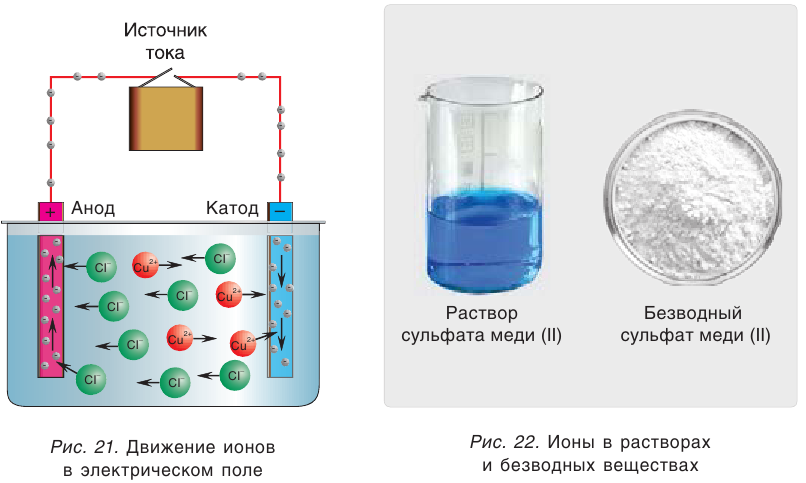
Свойства ионов в растворах во многом отличаются и от свойств этих же ионов в безводных веществах. Так, например, катионы меди 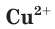 в сульфате меди(II) практически бесцветны, а раствор этой соли имеет голубой цвет (рис. 22). Это обусловлено, прежде всего, гидратацией катионов меди
в сульфате меди(II) практически бесцветны, а раствор этой соли имеет голубой цвет (рис. 22). Это обусловлено, прежде всего, гидратацией катионов меди 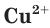 , т. е. их взаимодействием с молекулами воды.
, т. е. их взаимодействием с молекулами воды.
В состав большинства минеральных вод, которые продаются в наших магазинах, входят катионы натрия, кальция, магния, хлорид-анионы, сульфат-анионы, гидрокарбонат-анионы.
- Различия в свойствах атомов и ионов одного и того же элемента объясняются разным электронным строением этих частиц.
- Положительно заряженные ионы называются катионами, а отрицательно заряженные — анионами.
Сильные и слабые электролиты
Все ли электролиты диссоциируют одинаково? Каждое вещество обладает определенными свойствами и, возможно, процесс диссоциации разных веществ протекает в различной степени. Действительно, если сравнить электропроводность растворов хлороводородной и угольной кислот, то оказывается, что при их одинаковой молярной концентрации раствор хлороводорода обладает большей электропроводностью. Следовательно, в растворе хлороводородной кислоты больше заряженных частиц (ионов), т. е. молекулы НСl диссоциируют лучше.
В зависимости от способности к диссоциации все электролиты условно делят на две группы — сильные и слабые. К сильным электролитам относятся вещества, которые при растворении практически полностью диссоциируют на ионы. Это почти все соли, щёлочи  и др.), кислоты
и др.), кислоты 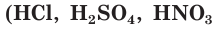 и др.), которые так и называются — сильные кислоты (рис. 23, вверху). Диссоциацию таких электролитов записывают в виде уравнения со стрелкой в одном направлении:
и др.), которые так и называются — сильные кислоты (рис. 23, вверху). Диссоциацию таких электролитов записывают в виде уравнения со стрелкой в одном направлении:
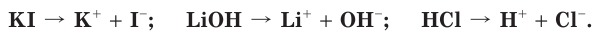
При растворении ионного соединения его кристаллическая структура разрушается под действием молекул воды, в результате чего в растворе образуются гидратированные ионы (см. рис. 17). Поэтому все растворимые ионные соединения в растворах находятся в виде ионов.
Вещества молекулярного строения с ковалентной полярной связью также способны распадаться на ионы в водных растворах (см. рис. 18). Полярные молекулы воды усиливают полярность молекулы электролита, превращая ее практически в ионную структуру с последующим распадом на ионы. Диссоциация полярных молекул может быть полной или частичной в зависимости от степени полярности связей в молекуле.
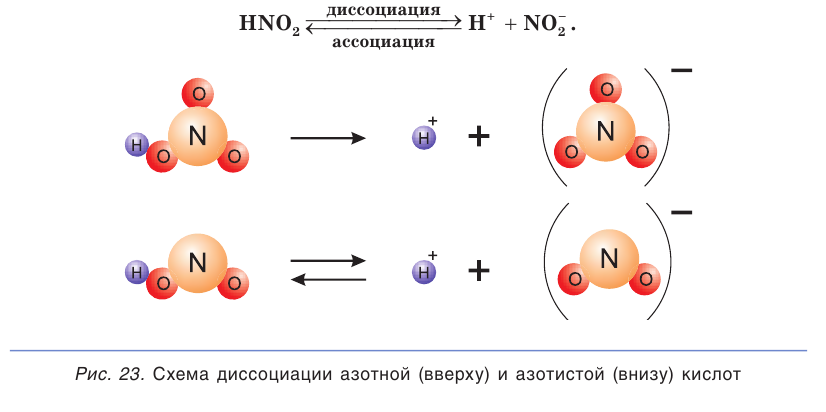
К слабым электролитам относятся вещества, при растворении диссоциирующие на ионы в незначительной степени. Это, например, такие кислоты как 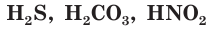 (азотистая кислота),
(азотистая кислота), 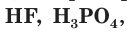 все органические кислоты. В водных растворах они диссоциируют обратимо. Это означает, что одновременно в растворе осуществляются два противоположных процесса — распад молекул на ионы (диссоциация) и объединение ионов в молекулы (ассоциация). Поэтому в растворах слабых электролитов наряду с ионами содержатся недиссоциированные молекулы. Диссоциацию таких электролитов, например азотистой кислоты
все органические кислоты. В водных растворах они диссоциируют обратимо. Это означает, что одновременно в растворе осуществляются два противоположных процесса — распад молекул на ионы (диссоциация) и объединение ионов в молекулы (ассоциация). Поэтому в растворах слабых электролитов наряду с ионами содержатся недиссоциированные молекулы. Диссоциацию таких электролитов, например азотистой кислоты  отображают в виде уравнения с двумя противоположно направленными стрелками (см. рис. 23, внизу):
отображают в виде уравнения с двумя противоположно направленными стрелками (см. рис. 23, внизу):

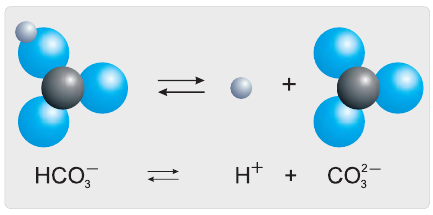
Разберем более подробно процесс диссоциации слабой двухосновной угольной кислоты 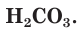 Как и азотистая кислота, она диссоциирует не полностью и обратимо. От молекулы
Как и азотистая кислота, она диссоциирует не полностью и обратимо. От молекулы 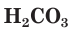 ионы водорода отщепляются не одновременно, как в случае сильных кислот, а последовательно, или ступенчато. На первой ступени диссоциации образуются катионы водорода и анионы
ионы водорода отщепляются не одновременно, как в случае сильных кислот, а последовательно, или ступенчато. На первой ступени диссоциации образуются катионы водорода и анионы 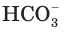 (рис. 24):
(рис. 24):
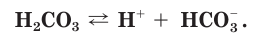
Анионы 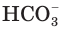 − называются гидрокарбонат-ионами. Соединяясь с ионами
− называются гидрокарбонат-ионами. Соединяясь с ионами  , они превращаются в недиссоциированные молекулы
, они превращаются в недиссоциированные молекулы 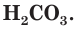 При этом, как и в случае азотистой кислоты, процессы диссоциации и ассоциации протекают одновременно, и в растворе содержатся как ионы, так и недиссоциированные молекулы кислоты.
При этом, как и в случае азотистой кислоты, процессы диссоциации и ассоциации протекают одновременно, и в растворе содержатся как ионы, так и недиссоциированные молекулы кислоты.
На второй ступени гидрокарбонат-ионы обратимо диссоциируют с образованием катионов водорода и карбонат-анионов (рис. 25):

Как правило, на второй ступени диссоциация происходит гораздо слабее.
Кроме слабых кислот, к слабым электролитам относятся также малорастворимые основания, например  раствор аммиака в воде.
раствор аммиака в воде.
Чистая вода является очень слабым электролитом и незначительно диссоциирует на ионы водорода и гидроксид-ионы:
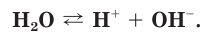
Содержание ионов  и
и  в воде чрезвычайно мало, поэтому диссоциацией воды мы обычно пренебрегаем, а среда дистиллированной воды является нейтральной.
в воде чрезвычайно мало, поэтому диссоциацией воды мы обычно пренебрегаем, а среда дистиллированной воды является нейтральной.
С количественными характеристиками способности веществ к диссоциации вы познакомитесь при дальнейшем изучении химии.

- По способности диссоциировать в водных растворах электролиты делятся на сильные и слабые.
- Растворимые вещества с ионной и ковалентной сильно полярной связью относятся к сильным электролитам.
- Растворимые вещества с ковалентной малополярной связью относятся к слабым электролитам. В их растворах наряду с ионами присутствуют недиссоциированные молекулы.
Электролитическая диссоциация кислот, оснований и солей
Вы уже знаете, что химические вещества делятся на классы — оксиды, кислоты, основания, соли. Как ведут себя в водных растворах вещества этих классов?
Вспомните отношение оксидов к воде. Основные оксиды активных металлов взаимодействуют с водой с образованием щелочей. Кислотные оксиды в результате растворения в воде образуют кислоты. Таким образом, основные и кислотные оксиды не являются электролитами и при контакте с водой не распадаются на ионы, а реагируют с ней. Электролитами являются кислоты, щёлочи и соли.
Водные растворы кислот имеют некоторые общие свойства. Для них характерны кислый вкус, способность окрашивать лакмус в красный цвет, взаимодействовать с некоторыми металлами с выделением водорода, а также с основными оксидами и основаниями. Точно также некоторые общие свойства имеют водные растворы всех щелочей: они мыльные на ощупь, окрашивают лакмус в синий цвет, способны реагировать с кислотными оксидами, кислотами. Водные растворы солей одной и той же кислоты или солей одного и того же металла также имеют общность свойств. Основная причина общности свойств растворов таких электролитов определяется однотипностью процессов их диссоциации.
Диссоциация кислот
Кислоты диссоциируют в водных растворах на ионы водорода H+ и анион кислотного остатка, например:

Как вы уже знаете, молекулы кислот могут содержать разное количество атомов водорода. Число атомов водорода в молекуле кислоты, способное замещаться атомами металла с образованием соли, определяет основность кислоты. Так, например, 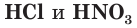 — одноосновные,
— одноосновные, 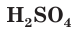 и
и 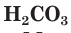 — двухосновные,
— двухосновные, 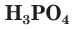 - трехосновная кислоты.
- трехосновная кислоты.
Многоосновные сильные кислоты диссоциируют ступенчато. Однако, поскольку при этом атомы водорода, превращаясь в ионы, уходят в раствор практически одновременно, диссоциацию таких кислот записывают одним уравнением:
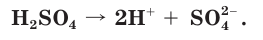
Диссоциация многоосновных слабых кислот протекает сложнее, чем сильных. Например, слабые двухосновные кислоты частично диссоциируют только по первой ступени: 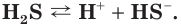 Диссоциация по второй ступени
Диссоциация по второй ступени практически невозможна. Поэтому в водных растворах слабых кислот наряду с ионами водорода и анионами кислотного остатка присутствуют недиссоциированные молекулы. Свойства таких растворов, например специфический запах сероводородной кислоты
практически невозможна. Поэтому в водных растворах слабых кислот наряду с ионами водорода и анионами кислотного остатка присутствуют недиссоциированные молекулы. Свойства таких растворов, например специфический запах сероводородной кислоты 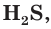 связаны с наличием в растворе молекул, которые могут испаряться из раствора.
связаны с наличием в растворе молекул, которые могут испаряться из раствора.
Таким образом, в растворах всех кислот содержатся ионы водорода 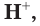 которые и обусловливают общие свойства водных растворов кислот: кислый вкус, способность изменять окраску индикаторов, взаимодействовать с другими веществами. Растворы, которые содержат ионы водорода, принято называть кислыми или говорить, что они имеют кислотный характер (кислую среду). Чем больше ионов водорода находится в растворе, тем выше кислотность среды.
которые и обусловливают общие свойства водных растворов кислот: кислый вкус, способность изменять окраску индикаторов, взаимодействовать с другими веществами. Растворы, которые содержат ионы водорода, принято называть кислыми или говорить, что они имеют кислотный характер (кислую среду). Чем больше ионов водорода находится в растворе, тем выше кислотность среды.
У газа хлороводорода HCl, так же как и у безводной серной кислоты, кислотные свойства отсутствуют. Эти свойства проявляются только в водных растворах указанных веществ, так как в процессе их диссоциации образуются ионы водорода, которые и определяют кислотный характер растворов. Следовательно, можно дать такое определение кислот.
Кислоты — это электролиты, при диссоциации которых в водных растворах в качестве катионов образуются только ионы водорода.
Первое определение кислот в химии было предложено Р. Бойлем (1627—1691). Кислотами он называл вещества, которые реагировали с содой с выделением газа и окрашивали фиолетовые цветки фиалки в красный цвет. Позже он исследовал отвары, спиртовые вытяжки, соки других растений и установил, что щёлочи также меняют их окраску.
Диссоциация оснований
Растворимые в воде основания называются щелочами. В результате диссоциации щелочей образуются катионы металлов и гидроксид-ионы:
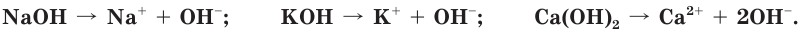
Мыльность растворов, способность окрашивать индикаторы, их едкое действие — результат присутствия в водном растворе гидроксид-ионов  Поэтому можно дать такое определение оснований.
Поэтому можно дать такое определение оснований.
Основания — это электролиты, при диссоциации которых в водных растворах в качестве анионов образуются только гидроксид-ионы.


Вместе с тем и кислоты, и основания обладают индивидуальными свойствами, зависящими от природы аниона или катиона соответственно. Некоторые свойства серной кислоты и ее солей (например, образование осадка с раствором хлорида бария) обусловлены свойствами ее аниона 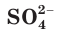 (рис. 26).
(рис. 26).
Диссоциация солей
Соли — это электролиты, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков:
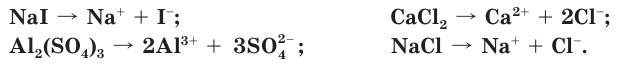
Свойства растворов солей также обусловлены свойствами всех ионов, которые образуются в процессе диссоциации.
Раствор, в котором находятся одинаковые количества ионов 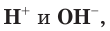 как в чистой воде, называют нейтральным. Если в растворе содержится больше ионов
как в чистой воде, называют нейтральным. Если в растворе содержится больше ионов  такой раствор называют кислым, а раствор, в котором больше ионов
такой раствор называют кислым, а раствор, в котором больше ионов  , — щелочным (табл. 13).
, — щелочным (табл. 13).
Таблица 13. Характеристика среды растворов



Определить среду раствора — это значит обнаружить в нем ионы  и
и 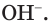 Это можно сделать с помощью уже известных вам веществ — индикаторов (рис. 27). Индикаторы — органические вещества, некоторые из которых встречаются в живой природе. В лаборатории чаще всего применяются уже известные вам лакмус, метилоранж, фенолфталеин, универсальный индикатор.
Это можно сделать с помощью уже известных вам веществ — индикаторов (рис. 27). Индикаторы — органические вещества, некоторые из которых встречаются в живой природе. В лаборатории чаще всего применяются уже известные вам лакмус, метилоранж, фенолфталеин, универсальный индикатор.
Лабораторный опыт 1
Обнаружение катионов водорода и гидроксид-анионов в растворах
Обнаружение ионов, обеспечивающих кислую или щелочную среду в растворах, имеет большое значение в лабораторной практике, медицине, промышленности и в быту.
1. Обратите внимание на окраску лакмуса, метилоранжа и фенолфталеина в нейтральной среде — водном растворе или на полоске универсальной индикаторной бумаги. Занесите результаты ваших наблюдений в таблицу.
2. Налейте в две пробирки раствор серной кислоты (или хлороводородной кислоты) и добавьте в одну пробирку 1—2 капли лакмуса (или метилоранжа), а во вторую 2—3 капли фенолфталеина. Обратите внимание на изменение окраски индикатора.
3. В пробирку с раствором гидроксида натрия добавьте 2—3 капли фенолфталеина. Появление малиновой окраски свидетельствует о наличии в растворе гидроксид-ионов.
Повторите опыт по обнаружению гидроксид-ионов в растворе щёлочи при помощи лакмуса или метилоранжа. Результаты опытов оформите в виде таблицы:
Как вы думаете, в какой цвет окрасится капля лакмуса, если ее поместить на срез лимона?

Растворы кислот, щелочей, ряда солей опасны для человека. Растворы многих кислот, попадая на кожу, в глаза, могут вызвать ожоги. Чем сильнее кислота, тем тяжелее ожог. Также опасны и вызывают химические ожоги щёлочи, содержащие гидроксид-ионы. Это свойство отражено в устаревших названиях щелочей, например «едкий натр» (NaOH), «едкое кали» (KOH) (рис. 28). Ионы, входящие в состав солей, также не безопасны для человека. Например, к сильным ядам относятся соли, содержащие катионы свинца, ртути и др.
- Свойства водных растворов сильных электролитов определяются свойствами ионов, образующихся при их диссоциации.
- Кислоты — это электролиты, в водных растворах которых в качестве катионов содержатся только ионы водорода.
- Основания — электролиты, в водных растворах которых в качестве анионов содержатся только гидроксид-ионы.
- Соли — это электролиты, в водных растворах которых содержатся катионы металлов и анионы кислотных остатков.
- Если содержание ионов H+ в растворе больше, чем содержание ионов OH- , такой раствор называют кислым, а раствор, в котором содержание ионов OH- больше, чем ионов H+ , — щелочным.
Реакции ионного обмена
Познакомившись с диссоциацией солей, кислот и щелочей, мы узнали, что сильные электролиты существуют в растворах только в виде ионов. Следовательно, все реакции, которые происходят между электролитами в растворах, являются реакциями между ионами и называются ионными реакциями.
Ионными реакциями называются реакции, протекающие в водных растворах с участием ионов электролитов.
Многие реакции, протекающие в растворах, относятся к реакциям обмена. Напомним, что к этому типу относятся реакции между сложными веществами, в результате которых эти вещества обмениваются своими составными частями. Такими составными частями веществ в электролитах являются ионы.
Реакции ионного обмена в растворах электролитов протекают только в том случае, если в результате взаимодействия между ионами образуются малодиссоциирующие (вода или другие слабые электролиты), нерастворимые (осадки) и газообразные вещества.
Реакция ионного обмена, сопровождающаяся образованием слабого электролита (воды)
Вы уже знаете, что реакция между кислотой и основанием называется реакцией нейтрализации. В результате такого процесса образуются соль и вода:
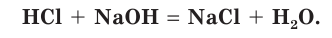
Уравнение реакции, записанное в такой форме, обычно называют молекулярным (или уравнением в молекулярной форме). Молекулярным уравнением может изображаться любая реакция.
За ходом нейтрализации удобно следить с помощью индикатора, изменение окраски которого свидетельствует об окончании реакции между кислотой и щёлочью.
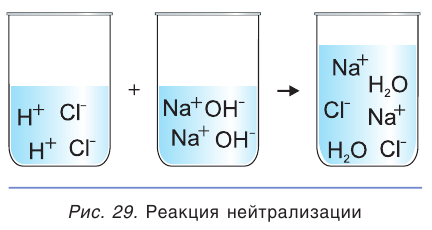
Три из четырех участников рассматриваемой реакции (HCl, NaOH и NaCl) являются сильными электролитами, т. е. находятся в растворе в виде ионов (рис. 29). Вода — слабый электролит, практически не диссоциирующий на ионы. Поэтому ионное уравнение данной реакции можно записать следующим образом:
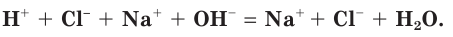
Такая запись процесса называется полным ионным уравнением. В ионном уравнении все сильные электролиты записываются в виде формул их ионов. Твердые, плохо растворимые, газообразные вещества и слабые электролиты (включая воду) записываются в виде их молекулярных формул.
Если в правой и левой частях полного ионного уравнения исключить (сократить) одинаковые по химическому составу и числу ионы 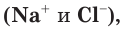 то получим сокращенное (краткое) ионное уравнение:
то получим сокращенное (краткое) ионное уравнение:

В левой части уравнения такого вида обычно сначала записывается катион, а потом — анион. Уравнение показывает, что реакция нейтрализации сводится к взаимодействию ионов водорода с гидроксид-ионами с образованием малодиссоциирующего вещества, каким является вода.
Составьте самостоятельно все три формы уравнений реакции нейтрализации между азотной кислотой и гидроксидом калия. Вы видите, что любая реакция между сильной кислотой и щёлочью сводится к взаимодействию ионов водорода с гидроксид-ионами. Поэтому одно и то же сокращенное ионное уравнение может описывать несколько реакций ионного обмена с участием различных веществ, и ему будут соответствовать несколько уравнений в молекулярном виде.
Реакции ионного обмена, сопровождающиеся образованием осадков
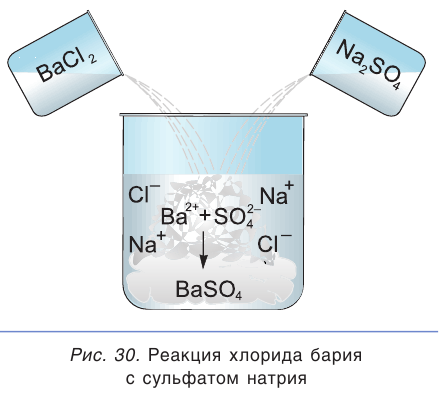
Взаимодействие между водными растворами сульфата натрия 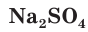 и хлорида бария
и хлорида бария 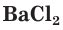 — пример процесса образования нерастворимого вещества:
— пример процесса образования нерастворимого вещества:
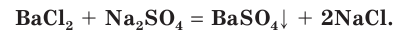
Полное ионное уравнение такой реакции имеет вид:
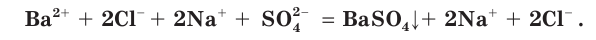
Если в этом уравнении исключить одинаковые ионы в правой и левой частях (это означает, что такие ионы не участвуют в процессе!), то получим уравнение в сокращенном ионном виде:
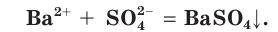
Это уравнение показывает, что при взаимодействии раствора сульфата натрия с раствором хлорида бария происходит связывание ионов бария 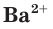 с сульфат-ионами
с сульфат-ионами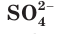 с образованием осадка сульфата бария (рис. 30). Точно такое же сокращенное ионное уравнение будет, если вместо хлорида бария взять, например, нитрат бария
с образованием осадка сульфата бария (рис. 30). Точно такое же сокращенное ионное уравнение будет, если вместо хлорида бария взять, например, нитрат бария 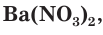 , а вместо сульфата натрия — сульфат калия
, а вместо сульфата натрия — сульфат калия 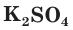 или серную кислоту
или серную кислоту 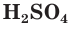 . Таким образом, одному и тому же сокращенному ионному уравнению будут соответствовать несколько уравнений в молекулярном виде.
. Таким образом, одному и тому же сокращенному ионному уравнению будут соответствовать несколько уравнений в молекулярном виде.
При составлении уравнений реакций обмена с образованием осадка необходимо пользоваться таблицей растворимости (см. форзац II), в которой указана растворимость электролитов в воде.
Например, необходимо определить, будет ли выпадать осадок при смешивании растворов нитрата кальция  и карбоната калия
и карбоната калия 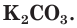 . Записываем уравнение реакции:
. Записываем уравнение реакции:
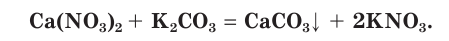
Для определения растворимости карбоната кальция 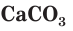 в таблице растворимости находим столбец катиона
в таблице растворимости находим столбец катиона 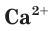 и строку аниона
и строку аниона 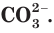 В месте их пересечения стоит буква «Н». Это означает, что карбонат кальция нерастворим в воде и выпадает в осадок при смешивании растворов нитрата кальция и карбоната калия.
В месте их пересечения стоит буква «Н». Это означает, что карбонат кальция нерастворим в воде и выпадает в осадок при смешивании растворов нитрата кальция и карбоната калия.
Аналогичным образом определяем, что нитрат калия  в воде растворим. Значит, уравнение реакции записываем так:
в воде растворим. Значит, уравнение реакции записываем так:
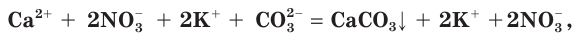
а в сокращенном ионном виде:
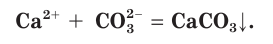
(Прочерк в таблице растворимости означает, что вещество не существует или разлагается водой.)
Реакции ионного обмена, сопровождающиеся выделением газов
Связывание ионов приводит и к образованию газообразного продукта, выделяющегося из раствора.

Например, если к раствору соды 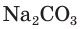 прилить раствор серной кислоты, то наблюдается выделение пузырьков углекислого газа (рис. 31):
прилить раствор серной кислоты, то наблюдается выделение пузырьков углекислого газа (рис. 31):
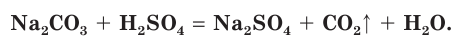
В полной ионной форме это уравнение записывается следующим образом:
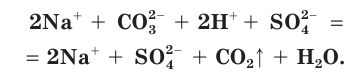
Сокращенное ионное уравнение реакции в этом случае такое:
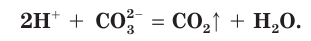
Таким образом, реакции ионного обмена в растворах электролитов протекают полностью («до конца»), если соблюдается одно из следующих условий:
- образуется осадок;
- выделяется газообразное вещество;
- образуется вода или другой слабый электролит.
С точки зрения теории электролитической диссоциации это означает, что в реакции образуются вещества, полученные в результате связывания ионов в осадок, газ или малодиссоциирующее вещество.
Многие реакции между растворами электролитов являются реакциями между ионами, т. е. ионными реакциями.
Реакции ионного обмена происходят только в том случае, если в результате образуются малорастворимые, газообразные или малодиссоциирующие вещества.
Уравнения реакций, отражающие взаимодействие между ионами в растворе, называются ионными уравнениями — полными или сокращенными.
Расчеты по уравнениям химических реакций, протекающих в растворах электролитов
Как вы уже знаете, реакции с участием электролитов осуществляются за счет взаимодействия ионов, содержащихся в их растворах. В таких реакциях могут участвовать также слабодиссоциирующие и малорастворимые вещества и неэлектролиты, например оксиды. При написании ионных уравнений реакций формулы таких веществ записываются в молекулярном виде. Последовательность действий рассмотрим на конкретных примерах.
Пример №1
Взаимодействие гидроксида меди(II) с соляной кислотой.
а) Записываем молекулярное уравнение реакции:
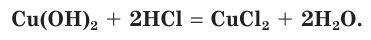
б) Составляем полное ионное уравнение. Для этого определяем, какие вещества являются сильными электролитами 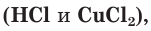 и записываем их формулы в ионном виде. Малорастворимые и слабодиссоциирующие вещества
и записываем их формулы в ионном виде. Малорастворимые и слабодиссоциирующие вещества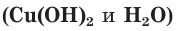 записываем в молекулярном виде:
записываем в молекулярном виде:
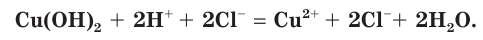
Обратите внимание, что коэффициенты, стоящие перед формулами веществ в молекулярном уравнении, учитываются и в полном ионном уравнении.
в) Записываем сокращенное ионное уравнение. Для этого из левой и правой частей полного ионного уравнения удаляем (вычеркиваем) ионы, не участвующие в химической реакции 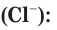
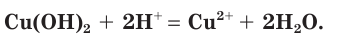
Анализируем сокращенное ионное уравнение и делаем вывод, что данная реакция протекает за счет взаимодействия ионов водорода с осадком гидроксида меди(II) с образованием ионов меди(II) и воды.
На основе уравнений реакций, протекающих в растворах электролитов, можно проводить различные количественные расчеты.
Пример №2
Хватит ли ионов водорода, содержащихся в растворе хлороводородной кислоты массой 152 г с массовой долей НCl, равной 12 %, для полного растворения осадка гидроксида меди(II) массой 19,6 г?
Решение
1. Определим химическое количество гидроксида меди (II):
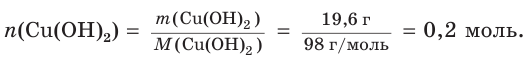
2. Рассчитаем массу хлороводородной кислоты в растворе:
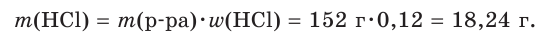
3. Найдем химическое количество HCl и, соответственно, химическое количество ионов водорода в растворе:
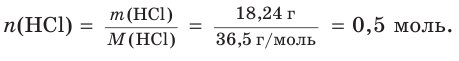
Поскольку из 1 моль НCl в результате диссоциации образуется 1 моль ионов водорода, следовательно, из 0,5 моль НCl образуется 0,5 моль ионов водорода, т. е.
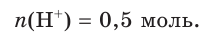
4. По сокращенному ионному уравнению составим пропорцию и определим, какое химическое количество ионов понадобится для реакции с  химическим количеством 0,2 моль:
химическим количеством 0,2 моль:
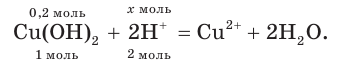
Отсюда получим, что х = 0,4 моль ионов водорода — столько потребуется для реакции. Поскольку в растворе имеется 0,5 моль ионов 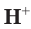 , этого их химического количества будет достаточно для растворения осадка.
, этого их химического количества будет достаточно для растворения осадка.
Пример №3
Взаимодействие раствора гидроксида натрия с газообразным оксидом серы(IV) SO2.
а) Записываем молекулярное уравнение реакции:
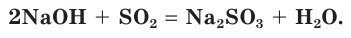
б) Составляем полное ионное уравнение реакции. Для этого определяем, какие вещества являются сильными электролитами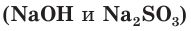 и записываем их формулы в ионном виде. Формулу газообразного
и записываем их формулы в ионном виде. Формулу газообразного 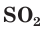 и воды
и воды 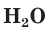 записываем в молекулярном виде:
записываем в молекулярном виде:
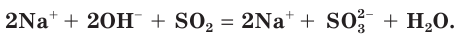
в) Записываем сокращенное ионное уравнение:
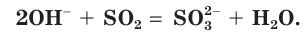
Из анализа сокращенного ионного уравнения делаем вывод, что данная реакция протекает за счет взаимодействия гидроксид-ионов  с молекулами
с молекулами 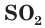 с образованием сульфит-ионов
с образованием сульфит-ионов 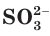 и воды.
и воды.
Пример №4
Какой объем (дм3 , н. у.) оксида серы (IV) понадобится для реакции с гидроксид-ионами, которые содержатся в растворе гидроксида натрия массой 180 г с массовой долей щёлочи, равной 0,1?
Решение
1. Рассчитаем массу гидроксида натрия в растворе:
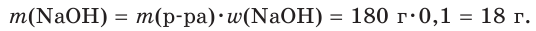
2. Определим химическое количество гидроксида натрия в растворе:
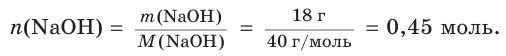
Соответственно, химическое количество гидроксид-ионов в растворе также равно 0,45 моль. Поскольку из 1 моль NaOH в результате диссоциации образуется 1 моль гидроксид-ионов, 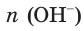 = 0,45 моль.
= 0,45 моль.
3. По молекулярному (или сокращенному ионному) уравнению составим пропорцию и вычислим, какое химическое количество 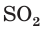 понадобится для реакции с NaOH химическим количеством 0,45 моль:
понадобится для реакции с NaOH химическим количеством 0,45 моль:
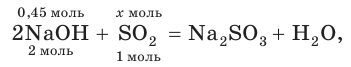
отсюда х = 0,225 моль SO2.
4. Найдем объем оксида серы (IV):
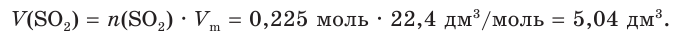
В результате реакций ионного обмена между кислотами и основаниями в растворах образуются соли и вода. При полной нейтрализации кислота и щёлочь расходуются полностью с образованием нейтрального раствора. Если же кислота берется в недостатке по отношению к щёлочи (или наоборот), происходит неполная нейтрализация.
Пример №5
Взаимодействие раствора гидроксида калия с раствором серной кислоты.
а) Составляем молекулярное уравнение реакции:
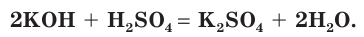
б) Записываем полное ионное уравнение реакции. Поскольку в данной реакции сильными электролитами являются 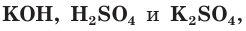 полное ионное уравнение имеет вид:
полное ионное уравнение имеет вид:
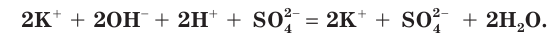
в) Записываем сокращенное ионное уравнение:
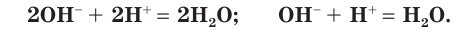
Пример №6
К раствору массой 200 г с массовой долей серной кислоты, равной 4,9 %, прибавили раствор массой 400 г с массовой долей гидроксида калия, равной 0,056. Какова окраска индикатора лакмуса в растворе после реакции?
Решение
1. Рассчитаем массы веществ в исходных растворах:
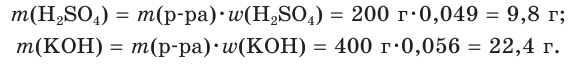
2. Определим химические количества веществ:

3. На основании молекулярного уравнения реакции определим химическое количество гидроксида калия, необходимого для полной нейтрализации серной кислоты в растворе:
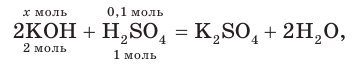
откуда получим: х = 0,2 моль KOH.
4. Поскольку найденное химическое количество KOH (0,2 моль) меньше содержащегося в исходном растворе (0,4 моль), щёлочь была взята в избытке, и среда полученного раствора щелочная. В таком растворе лакмус окрашивается в синий цвет.
В некоторых случаях при смешивании растворов двух сильных электролитов химические реакции не происходят. Смешаем, например, растворы нитрата натрия и хлорида кальция. Составим молекулярное уравнение предполагаемой реакции обмена:
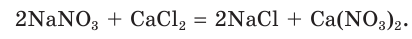
Определим, какие ионы находятся в полученном растворе, записав полное ионное уравнение:
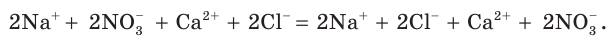
Очевидно, что в данном случае ионы друг с другом не связываются и никаких изменений в растворе не происходит. Следовательно, реакция просто не идет, а в растворе содержатся ионы четырех видов.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |