
Валентность и степень окисления в химии - формулы и определения с примерами
Содержание:
Природа и типы химической связи:
При обычных условиях химические элементы существуют в форме различных атомных частиц (атомов или ионов) в составе простых и сложных веществ. Из них только простые вещества благородных газов (элементов группы VIIIA) являются одноатомными молекулами, а остальные представляют собой самые разнообразные соединения. Число атомов в таких соединениях колеблется от двух до сотен и тысяч. Взаимодействие, т. е. совокупность сил, которые обеспечивают существование таких агрегатов (молекул, радикалов, кристаллов и др.), получило название химическая связь.
Химическая связь — это взаимодействие, которое связывает отдельные атомы в более сложные системы (молекулы, кристаллы и т. д.).
Причина образования химической связи — это стремление атомов путём взаимодействия с другими атомами достичь более устойчивого состояния, т. е. состояния с минимально возможным запасом энергии. Следовательно, основным условием образования химической связи является понижение полной энергии Е многоатомной системы по сравнению с суммарной энергией изолированных атомов. Например, в случае образования вещества АВ из атомов А и В
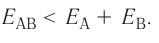
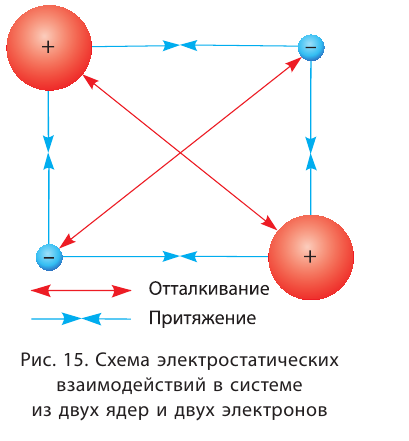
Природа сил химической связи — электростатическая, т. е. обусловлена взаимодействием положительно заряженных ядер и отрицательно заряженных электронов (рис. 15).
Главную роль при образовании химической связи между атомами играют их валентные электроны, т. е. те электроны, которые обычно находятся на внешнем энергетическом уровне и наименее прочно связаны с ядром атома. У атома на внешнем энергетическом уровне может содержаться от одного до восьми электронов. Завершёнными, а поэтому и самыми устойчивыми, являются внешние электронные оболочки атомов благородных газов: у гелия там находятся два электрона
Природа сил химической связи — электростатическая, т. е. обусловлена взаимодействием положительно заряженных ядер и отрицательно заряженных электронов (рис. 15).
Главную роль при образовании химической связи между атомами играют их валентные электроны, т. е. те электроны, которые обычно находятся на внешнем энергетическом уровне и наименее прочно связаны с ядром атома. У атома на внешнем энергетическом уровне может содержаться от одного до восьми электронов. Завершёнными, а поэтому и самыми устойчивыми, являются внешние электронные оболочки атомов благородных газов: у гелия там находятся два электрона 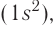
У атомов остальных элементов внешние энергетические уровни являются незавершёнными, поэтому в процессе химического взаимодействия атомы стремятся их завершить, т. е. приобрести электронное строение атома ближайшего благородного газа. Это соответствует нахождению двух электронов на внешнем уровне у атома водорода, который находится в одном периоде с гелием, и восьми электронов (октет) — у всех остальных атомов. Достичь такого электронного состояния атомы могут только за счёт обобществления электронов, т. е. их совместного использования атомами, соединяющимися между собой. При этом образуются общие электронные пары, которые связывают атомы друг с другом и между ними возникает химическая связь.
В зависимости от способа обобществления электронов различают три основных типа химической связи: ковалентную, ионную и металлическую.
Ковалентная связь
Ковалентная связь возникает обычно между двумя атомами неметаллов с одинаковыми или близкими значениями электроотрицательности. Рассмотрим образование ковалентной связи на примере простейшей молекулы — молекулы водорода 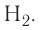 У атома водорода всего один электрон, находящийся на внешнем (первом) энергетическом уровне, до завершения которого не хватает одного электрона.
У атома водорода всего один электрон, находящийся на внешнем (первом) энергетическом уровне, до завершения которого не хватает одного электрона.

При сближении двух атомов водорода за счёт сил притяжения, действующих между их ядрами и электронами, происходит частичное перекрывание электронных облаков неспаренных электронов с антипараллельными спинами (это одно из условий образования общей электронной пары!). В зоне их перекрывания плотность двухэлектронного облака увеличивается. Ядра атомов стягиваются к этой области повышенного отрицательного заряда до тех пор, пока не наступит равновесие между силами межъядерного отталкивания и силами притяжения. Расстояние между ядрами атомов уменьшается, энергия системы, состоящей из двух атомов водорода, также понижается. Область повышенной электронной плотности связывает два атома водорода в молекулу 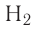 (рис. 16).
(рис. 16).
Образование химической связи между атомами водорода в молекуле можно показать различными способами. Например, с помощью электронных формул, в которых указывают символы элементов и валентные электроны в виде точек:
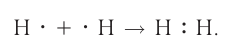
В графических (или структурных) формулах пару электронов обозначают с помощью чёрточки:
Н —Н.
В случае молекулы водорода эта единственная чёрточка символизирует ковалентную связь.
Химическая связь между атомами, осуществляемая за счёт образования общих электронных пар, называется ковалентной связью.
Образование ковалентной связи можно показать и с помощью электронно-графических схем, на которых обычно указываются только орбитали внешнего энергетического уровня:
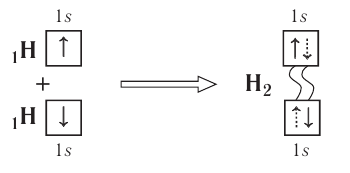
Волнистая линия между двумя орбиталями Is указывает на то, что каждый электрон как бы одновременно находится как на одной, так и на другой орбитали.
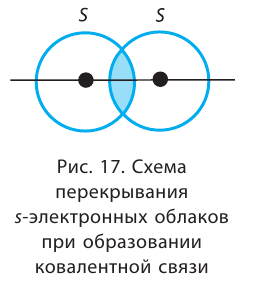
В данном случае ковалентная связь образована в результате перекрывания двух s-орбиталей (или s-облаков)
(рис. 17).
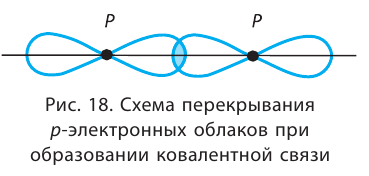
Подобным образом образуется ковалентная связь и между двумя атомами фтора в молекуле 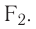 У атома фтора имеется семь электронов на внешнем электронном слое, один из них — неспаренный электрон. При сближении двух атомов фтора происходит перекрывание электронных облаков их неспаренных электронов, образуется общая электронная пара и внешний энергетический уровень каждого атома фтора завершается до октета (8 электронов):
У атома фтора имеется семь электронов на внешнем электронном слое, один из них — неспаренный электрон. При сближении двух атомов фтора происходит перекрывание электронных облаков их неспаренных электронов, образуется общая электронная пара и внешний энергетический уровень каждого атома фтора завершается до октета (8 электронов):
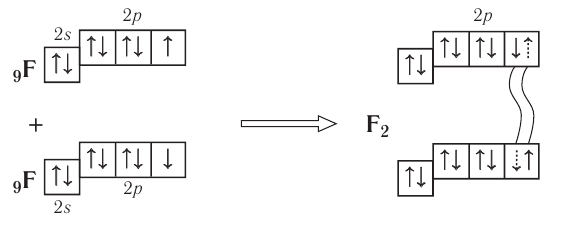
Схема образования молекулы фтора с помощью электронных формул:
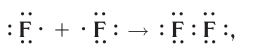
а графическая формула молекулы:
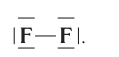
В данном случае образование ковалентной связи произошло за счёт перекрывания р-электронных облаков (рис. 18).
Одинарная связь
И в молекуле водорода, и в молекуле фтора атомы связаны электронной парой, которая символизирует одну химическую связь, называемую одинарной. В обоих случаях перекрывание электронных облаков (как S-, так и р-) происходит вдоль линии, соединяющей центры взаимодействующих атомов.
Эту условную прямую называют линией (или осью) связи.
Ковалентная связь, образованная за счёт перекрывания атомных орбиталей вдоль линии связи, называется с-связью (сигма-связью).
Пару электронов, образующих ковалентную связь, называют связывающей в отличие от электронных пар, которые не участвуют в образовании связей и, следовательно, являются несвязывающими. Такие пары часто также называют неподелёнными, поскольку они принадлежат только одному атому.
У атомов водорода в молекуле 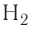 нет несвязывающих пар, а в молекулах фтора
нет несвязывающих пар, а в молекулах фтора 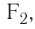 хлора
хлора 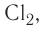 брома
брома 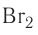 или иода
или иода 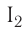 у каждого из атомов галогенов их по три:
у каждого из атомов галогенов их по три:
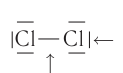 несвязывающая пара электронов.
несвязывающая пара электронов.
- Причиной образования химической связи является стремление атомов достичь более устойчивого состояния, что приводит к выделению энергии при образовании связей.
- Природа сил химической связи — электростатическая, т. е. определяется различными видами взаимодействий электронов и ядер в системе связанных атомов.
- Различают три основных типа химической связи — ковалентную, ионную и металлическую.
- Ковалентная связь, образованная за счёт перекрывания атомных орбиталей вдоль линии связи, называется a-связью (сигма-связью).
Полярная и неполярная ковалентная связь
Два атома могут быть связаны между собой и несколькими ковалентными связями. В таком случае говорят о кратности связи, понимая под этим термином число электронных пар, участвующих в образовании ковалентной связи.
Кратные связи
У атомов азота (элемента группы VA) до завершения внешнего энергетического уровня не хватает трёх электронов:
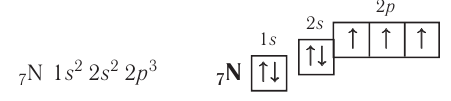
Поэтому при образовании молекулы 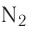 атомы азота обобщают уже не одну, а три пары электронов:
атомы азота обобщают уже не одну, а три пары электронов:
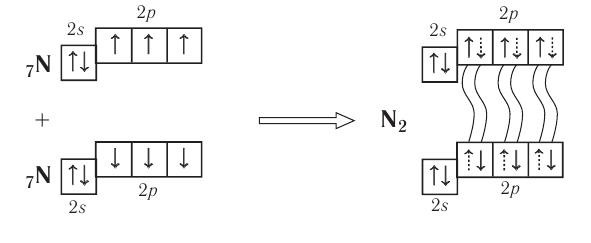
Схема образования молекулы азота: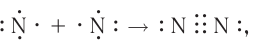
а графическая формула молекулы: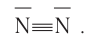
Одна из ковалентных связей, образовавшаяся в результате перекрывания р-электронных облаков вдоль линии связи, представляет собой 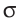 -связь. Две другие образуются за счёт перекрывания также р-орбиталей.
-связь. Две другие образуются за счёт перекрывания также р-орбиталей.
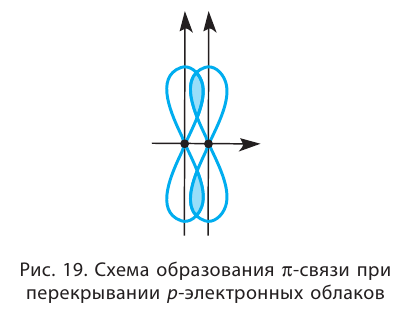
Такое перекрывание происходит уже не вдоль линии, соединяющей центры атомов, а по обе стороны от неё. Образуется не одна, а две области перекрывания (рис. 19).
Такая ковалентная связь получила название 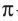 -связь.
-связь.
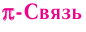 — это ковалентная связь, возникающая при перекрывании электронных облаков по обе стороны от линии, соединяющей ядра атомов.
— это ковалентная связь, возникающая при перекрывании электронных облаков по обе стороны от линии, соединяющей ядра атомов.
Облака s-электронов не могут участвовать в образовании 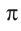 -связи. Такие связи могут быть образованы только за счёт перекрывания р- или ^/-орбиталей. Возникновение
-связи. Такие связи могут быть образованы только за счёт перекрывания р- или ^/-орбиталей. Возникновение 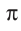 -связей происходит между двумя атомами тогда, когда они уже связаны
-связей происходит между двумя атомами тогда, когда они уже связаны  -связью.
-связью.
Если ковалентная связь между двумя атомами образуется двумя общими электронными парами, то такая ковалентная связь называется двойной связью,
и она обозначается двумя чёрточками. Например, в молекуле этена 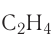 атомы углерода соединены между собой двойной связью:
атомы углерода соединены между собой двойной связью:
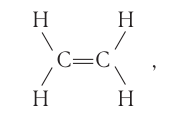
одна из которых —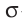 -связь, а вторая —
-связь, а вторая —  -связь.
-связь.
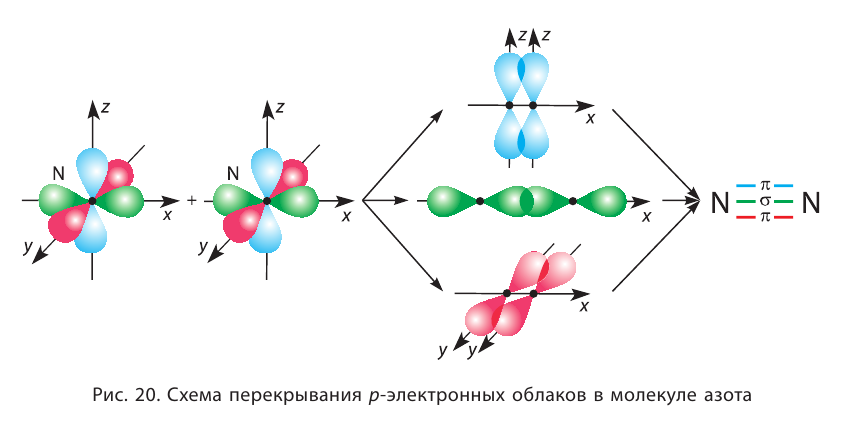
Если в молекуле имеется тройная связь, как, например, в молекуле азота 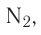 то одна из них —
то одна из них — 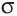 -связь, а две другие —
-связь, а две другие — 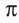 -связи, расположенные во взаимно перпендикулярных плоскостях (рис. 20).
-связи, расположенные во взаимно перпендикулярных плоскостях (рис. 20).
Полярная и неполярная ковалентная связь:
До сих пор мы рассматривали ковалентную связь, образованную атомами одного и того же элемента. В этом случае общая пара электронов располагается симметрично между двумя атомами с одинаковой электроотрицательностью. Такая ковалентная связь называется неполярной.
Если же взаимодействуют атомы с различными электроотрицательностями, т. е. атомы разных элементов, то общая электронная пара смещается к атому с большей электроотрицательностью. В таких случаях возникает полярная ковалентная связь.
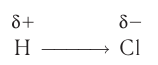
Например, в молекуле хлороводорода HCI общая электронная пара смещена в сторону более электроотрицательного атома, каким является хлор:
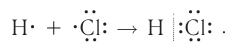
В данном случае перекрываются шарообразное s-электронное облако атома водорода и гантелеобразное p-облако атома хлора (рис. 21).
Схема такого перекрывания приведена ниже:
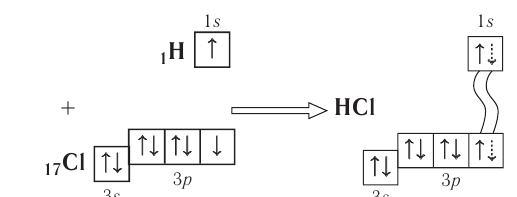
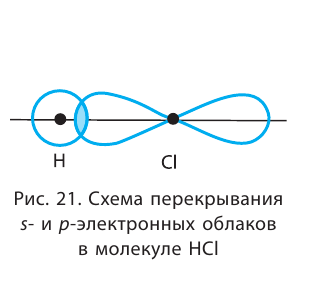
В результате смещения общей электронной пары в молекуле НС1 на атоме хлора возникает частичный отрицательный заряд, а на атоме водорода — такой же по величине, но положительный заряд:
(греческая буква 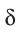 (дельта) обозначает частичный заряд, т. е. заряд меньше единицы).
(дельта) обозначает частичный заряд, т. е. заряд меньше единицы).
Значение заряда 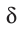 можно рассматривать как меру полярности связи: чем больше частичные заряды на атомах, тем выше полярность связи. Например: связь Н—F более полярна, чем Н—С1, так как частичные заряды на атомах Н и F равны 0,43+ и 0,43— соответственно, а на атомах Н и С1 — 0,18+ и 0,18—. Если молекула состоит из двух атомов, связанных между собой полярной связью, то она также называется полярной и представляет собой диполь:
можно рассматривать как меру полярности связи: чем больше частичные заряды на атомах, тем выше полярность связи. Например: связь Н—F более полярна, чем Н—С1, так как частичные заряды на атомах Н и F равны 0,43+ и 0,43— соответственно, а на атомах Н и С1 — 0,18+ и 0,18—. Если молекула состоит из двух атомов, связанных между собой полярной связью, то она также называется полярной и представляет собой диполь:  условное обозначение диполя (рис. 22).
условное обозначение диполя (рис. 22).
Чем больше разность электроотрицательностей связанных атомов, тем более полярна химическая связь между ними.
С помощью ковалентной связи образуются молекулы и более сложных веществ, состоящих из трёх, четырёх и более атомов. В качестве примера рассмотрим образование молекулы аммиака  . Электронно-графическая схема взаимодействия трёх атомов водорода и одного атома азота следующая:
. Электронно-графическая схема взаимодействия трёх атомов водорода и одного атома азота следующая:
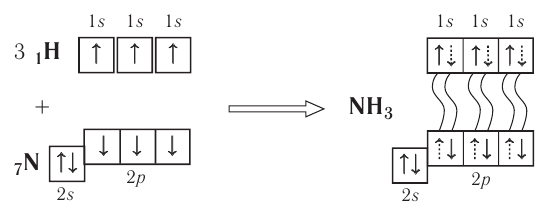
Общая схема образования молекулы аммиака:
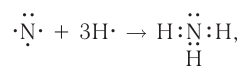
а её графическая формула:
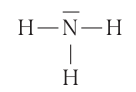
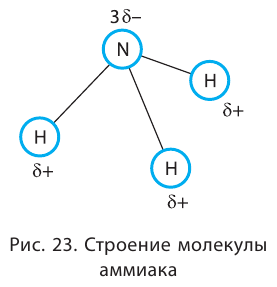
Таким образом, три неспаренных электрона атома азота принимают участие в образовании трёх ковалентных связей с атомами водорода, а на внешнем энергетическом уровне у атома азота остаётся ещё неподелённая пара электронов. Молекула  имеет форму пирамиды с атомом азота в её вершине (рис. 23).
имеет форму пирамиды с атомом азота в её вершине (рис. 23).
Каждая связь N — Н является полярной. В целом вся молекула  представляет собой диполь, так как возникающие на атомах частичные заряды
представляет собой диполь, так как возникающие на атомах частичные заряды  пространственно разделены.
пространственно разделены.
Однако существует много молекул, которые содержат полярные связи, но сами являются неполярными. Это объясняется особенностями их пространственного строения. Об этом мы с вами поговорим в следующих параграфах.
- Кратность связи определяется числом общих электронных пар между двумя связанными атомами.
- Ковалентная связь, при образовании которой область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов, называется
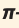 -связью.
-связью. - При соединении двух атомов с разными электроотрицательностями возникает полярная ковалентная связь.
- Система из двух зарядов, одинаковых по величине и противоположных по знаку называется диполем.
Механизмы образования ковалентной связи
Различают два основных механизма образования ковалентной связи — обменный и донорно-акцепторный.
Обменный механизм образования связи
Ковалентная связь образуется двумя атомами с помощью двух электронов с антипараллельными спинами, т. е. химическая связь находится (локализована) между двумя атомами. Так как нахождение двух электронов в поле действия двух ядер энергетически выгоднее, чем пребывание каждого электрона в поле своего ядра, то в образовании ковалентной связи принимают участие все одноэлектронные орбитали внешнего энергетического уровня. Например, атом азота имеет три неспаренных электрона на внешнем уровне:
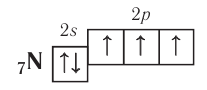
атом кислорода — два: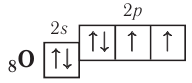
атом фтора — один: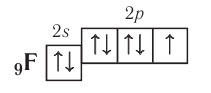
Поэтому эти атомы могут образовывать за счёт таких электронов соответственно три, две и одну ковалентные связи.
Число неспаренных электронов может увеличиваться при переходе атома в возбуждённое состояние. Например, на внешнем энергетическом уровне атома углерода
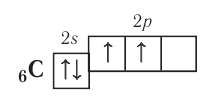
находятся только два неспаренных электрона. Однако в большинстве своих соединений углерод проявляет ковалентность, равную 4 (т. е. образует четыре ковалентные связи), например в 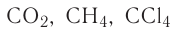 и т. д. Такая ковалентность атома углерода становится возможной благодаря тому, что его атом при образовании химических связей с другими атомами переходит в возбуждённое состояние (т. е. в состояние с большей энергией) за счёт распаривания пары электронов
и т. д. Такая ковалентность атома углерода становится возможной благодаря тому, что его атом при образовании химических связей с другими атомами переходит в возбуждённое состояние (т. е. в состояние с большей энергией) за счёт распаривания пары электронов 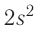 и перехода одного из них на подуровень 2р:
и перехода одного из них на подуровень 2р: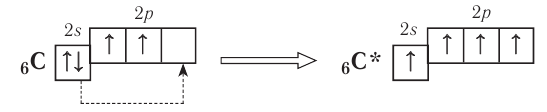
В возбуждённом состоянии атом углерода имеет четыре неспаренных электрона, за счёт которых он может образовывать четыре ковалентные связи с атомами других элементов. Распаривание электронов требует затраты энергии, но эта затрата с избытком компенсируется энергией, выделяющейся при образовании дополнительных связей. Распаривание, как правило, происходит лишь в пределах данного энергетического уровня, поскольку переход электронов на свободные орбитали другого уровня энергетически невыгоден. Поэтому в возбуждённое состояние могут перейти атомы только тех элементов второго периода, у которых имеются свободные орбитали (бериллий, бор, углерод). У атомов азота, кислорода и фтора нет свободных орбиталей на втором энергетическом уровне, а переход электронов на третий уровень потребует слишком больших затрат энергии, которые не компенсируются выделением энергии при образовании дополнительных связей.
В то же время атомы элементов третьего и следующих периодов имеют на внешнем энергетическом уровне d-подуровень, на который при возбуждении могут переходить s- и p-электроны:
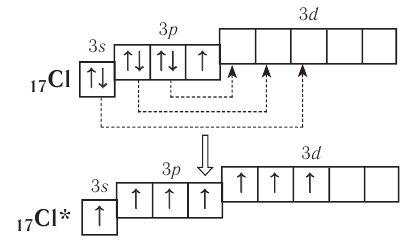
Благодаря этому атом хлора способен образовывать не одну, а несколько ковалентных связей, вплоть до семи, как, например, в оксиде 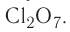 .
.
Таким образом, атомы при образовании ковалентных связей используют все свои неспаренные электроны, как находящиеся в основном состоянии, так и образовавшиеся при распаривании.
Механизм образования ковалентной связи за счёт обобществления неспаренных электронов двух взаимодействующих атомов называется обменным.
Донорно-акцепторный механизм образования ковалентной связи Образование ковалентной связи возможно и при взаимодействии атомов, один из которых имеет пару неподелённых электронов (А:), а другой — свободную орбиталь (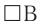 ). В этом случае атом А предоставляет атому В в общее пользование пару электронов, и она становится связывающей парой, образуя между этими атомами ковалентную связь:
). В этом случае атом А предоставляет атому В в общее пользование пару электронов, и она становится связывающей парой, образуя между этими атомами ковалентную связь:
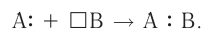
Атом, предоставляющий электронную пару для образования связи, называется донором, а участвующий в обобществлении пары за счёт свободной орбитали — акцептором. Такой механизм образования ковалентной связи получил название донорно-акцепторного.
В Механизм образования ковалентной связи за счёт неподелённой пары электронов одного атома и свободной орбитали другого называется донорно-акцепторным.
Примером такого механизма может служить образование иона аммония 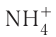 при взаимодействии аммиака
при взаимодействии аммиака  и хлороводородной кислоты НС1 в растворе:
и хлороводородной кислоты НС1 в растворе:
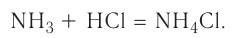
Сокращённое ионное уравнение этой реакции:
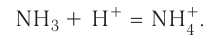
Составим электронную схему такого взаимодействия, обозначив точками электроны, принадлежащие атому азота, а звёздочками — атомам водорода:
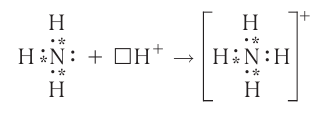
В ионе аммония каждый атом водорода связан с атомом азота общей электронной парой. И хотя одна из этих связей образована по донорноакцепторному механизму, она не отличается по своим характеристикам от остальных ковалентных связей, образованных по обменному механизму.
Донорно-акцепторный механизм позволяет объяснить существование катиона гидроксония 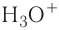 , в виде которого находится в водных растворах ион водорода. Эта частица образуется в результате гидратации иона водорода:
, в виде которого находится в водных растворах ион водорода. Эта частица образуется в результате гидратации иона водорода:
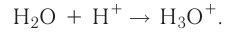
Электронная схема этого процесса:
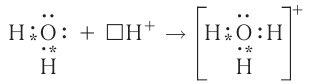
Обменным называется механизм образования ковалентной связи, при котором каждый атом предоставляет для формирования общей электронной пары один неспаренный электрон.
Механизм образования ковалентной связи за счёт электронной пары одного атома и свободной орбитали другого называется донорно-акцепторным.
Атомные кристаллические решётки
Каждая молекула представляет собой систему взаимосвязанных атомов, расположенных определённым образом относительно друг друга. Следовательно, молекула характеризуется определённым пространственным строением, или, говоря иначе, геометрией (формой).
Вопросы строения молекул рассматривает один из разделов химии, который называется стереохимией (в буквальном переводе — пространственная химия).
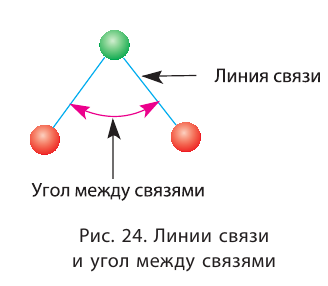
Согласно стереохимическим представлениям, когда один атом образует несколько связей, то они направлены под определёнными углами друг к другу. Угол между связями (или валентный угол) — это угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов. Такие прямые, как вы уже знаете, называются линиями связи (рис. 24).
Например, в молекуле 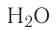 атом кислорода образует две сигма-связи с атомами водорода за счёт р-орбиталей внешнего энергетического уровня, ориентированных в атоме взаимно перпендикулярно (см. § 12). Следовательно, угол между двумя линиями связи О — Н должен быть близок к 90° (рис. 25).
атом кислорода образует две сигма-связи с атомами водорода за счёт р-орбиталей внешнего энергетического уровня, ориентированных в атоме взаимно перпендикулярно (см. § 12). Следовательно, угол между двумя линиями связи О — Н должен быть близок к 90° (рис. 25).
Аналогично, в молекуле  углы между связями N — Н, образованные тремя р-орбиталями атома азота, также должны быть близки к 90° (рис. 26), а вся молекула в целом должна иметь форму треугольной пирамиды с атомом азота в вершине.
углы между связями N — Н, образованные тремя р-орбиталями атома азота, также должны быть близки к 90° (рис. 26), а вся молекула в целом должна иметь форму треугольной пирамиды с атомом азота в вершине.
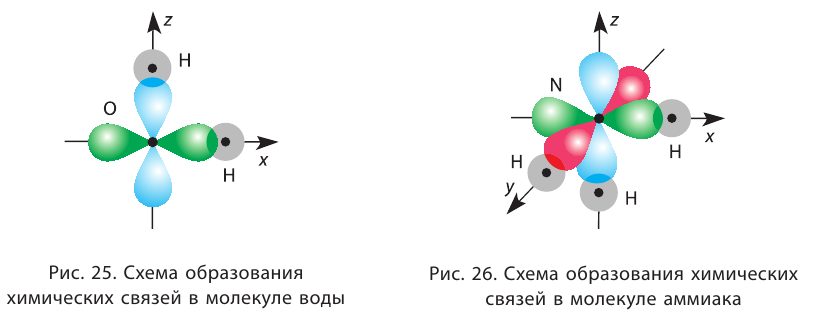
Однако реальные значения углов между связями (105° в молекуле 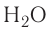 и 107° в молекуле
и 107° в молекуле  ) отличаются от ожидаемых. В первом приближении увеличение углов связи можно объяснить взаимным отталкиванием атомов, которые не связаны друг с другом (в молекулах воды и аммиака — атомов водорода). Например, уже в молекуле H2S такое отталкивание слабее, чем в молекуле
) отличаются от ожидаемых. В первом приближении увеличение углов связи можно объяснить взаимным отталкиванием атомов, которые не связаны друг с другом (в молекулах воды и аммиака — атомов водорода). Например, уже в молекуле H2S такое отталкивание слабее, чем в молекуле 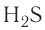 (так как радиус атома серы больше радиуса атома кислорода), и угол Н — S — Н ближе к 90°, чем угол Н — О — Н.
(так как радиус атома серы больше радиуса атома кислорода), и угол Н — S — Н ближе к 90°, чем угол Н — О — Н.
За счёт ковалентной связи образуются не только молекулы. Некоторые простые и сложные вещества построены из атомов, связанных друг с другом ковалентными связями, и образуют громадные кристаллические структуры, моделями которых являются атомные кристаллические решётки.
Примерами таких веществ являются простые вещества — бор, алмаз, кремний.
В кремнии (как и в кристалле алмаза)
(рис. 27) каждый атом связан четырьмя ковалентными связями с другими атомами.
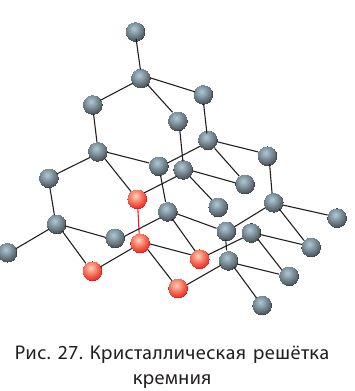
Подобное строение имеют и сложные вещества: карбид кремния — SiC и оксид кремния — 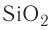 (кварц).
(кварц).
Атомных кристаллов сравнительно немного. Благодаря высокой прочности ковалентных связей они имеют очень высокие температуры плавления, большую твёрдость. Так, самым твёрдым природным веществом является алмаз — его температура плавления более 3 500 °С. Карбид кремния SiC также является одним из самых твёрдых веществ с очень высокой температурой плавления — более 2 700 °С.
- Стереохимия — раздел химии, рассматривающий пространственное строение молекул.
- Модели кристаллических структур, построенных из атомов, связанных друг с другом ковалентными связями, называются атомными кристаллическими решётками.
Валентность и степень окисления
Валентность и валентные возможности атомов
Мы установили, что атомы способны образовывать ковалентные связи различным образом. Количественно эта способность атомов оценивается с помощью характеристики, называемой валентностью.
В Валентность — мера способности атомов данного элемента соединяться с другими атомами.
Такое толкование валентности позволяет обосновать количественные соотношения атомов элементов в любых химических соединениях.
С развитием электронных представлений о строении веществ понятие валентности приобрело определённое физическое обоснование, связанное с часлом ковалентных связей, которыми данный атом связан с другими атомами. Такое число называется ковалентностью атома.
Ковалентные связи могут быть образованы как с помощью одноэлектронной орбитали атома, так и с помощью целой пары электронов (если атом — донор) или свободной орбитали (если атом — акцептор). Следовательно, можно сказать, что ковалентность атомов химического элемента также равна числу электронных орбиталей, которые данный атом использует для образования ковалентных связей.
Таким образом, ковалентность атомов химического элемента определяется как числом ковалентных связей, которыми его атом связан с другими атомами, так и числом орбиталей, используемых этим атомом для образования связей.
Зная электронное строение атома того или иного элемента, можно определить его валентные возможности. Так, атом водорода всегда проявляет ковалентность, равную единице, поскольку у него всего одна орбиталь.
Анализируя строение простых и сложных веществ, образованных атомами элементов второго периода, нетрудно убедиться, что атомы большинства этих элементов могут проявлять переменную ковалентность. Например, в молекулах простых веществ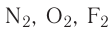 атом азота имеет ковалентность, равную трём, кислород — двум, а фтор — единице согласно графическим формулам этих молекул:
атом азота имеет ковалентность, равную трём, кислород — двум, а фтор — единице согласно графическим формулам этих молекул:
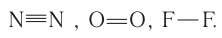
Простые вещества бора и углерода являются немолекулярными соединениями, однако атомы этих элементов связаны в кристаллах ковалентными связями: бор — тремя, а углерод — четырьмя. Поэтому их ковалентности соответственно равны 3 и 4.
В то же время в соединениях с атомами других элементов кислород, азот и фтор способны проявлять и другие значения ковалентности. Например, в молекулярном ионе 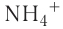 азот связан четырьмя ковалентными связями с атомами водорода, поэтому его ковалентность равна 4. Кислород в ионе гидроксо-ния
азот связан четырьмя ковалентными связями с атомами водорода, поэтому его ковалентность равна 4. Кислород в ионе гидроксо-ния 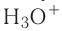 имеет ковалентность 3, фтор также может проявлять ковалентность больше 1.
имеет ковалентность 3, фтор также может проявлять ковалентность больше 1.
В любом случае, у атомов элементов второго периода максимальная ковалентность не может быть больше четырёх, так как на внешнем электронном слое у атомов этих элементов всего четыре орбитали, и, следовательно, атомы максимально могут образовать только четыре ковалентные связи.
У атомов элементов третьего периода в связи с появлением d-подуровня валентные возможности увеличиваются, так как в результате распаривания 3р- и 3s-электронов может образоваться от четырёх до семи (у хлора) неспаренных электронов. Например, сера, помимо ковалентности II в основном состоянии
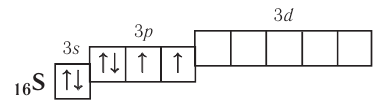
может проявлять также ковалентности IV и VI:
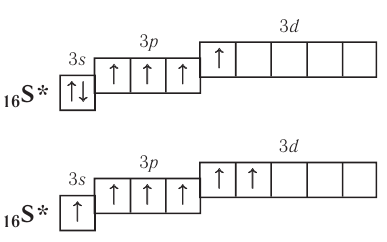
Такое распаривание электронов проявляется обычно под действием атомов более электроотрицательных элементов, например фтора, кислорода, поэтому свои высшие значения ковалентности атомы проявляют обычно в соединениях с кислородом и фтором.
Таким образом, ковалентность является численной характеристикой способности атомов данного элемента образовывать ковалентные связи и поэтому может относиться только к соединениям с таким типом связи.
Степень окисления
Более универсальной характеристикой состояния атома в химическом соединении является степень окисления.
В Степень окисления — это условный относительный заряд атома в химическом соединении, если предположить, что оно состоит из ионов.
При определении степени окисления атомов предполагают, что все связывающие электронные пары перешли к более электроотрицательному атому. На самом деле такого полного смещения не происходит даже при взаимодействии атомов элементов с большой разницей в электроотрицательностях.
Однако условно считают такое смещение электронных пар полным независимо от реальной степени смещения.
Численное значение этой характеристики выражается в единицах заряда электрона и может иметь положительное, отрицательное или нулевое значения.
В Количественно степень окисления определяется числом валентных электронов, смещённых от атома данного элемента в химическом соединении (положительная степень окисления) или к нему (отрицательная степень окисления).
В основу расчёта степени окисления атомов в соединениях положен принцип, согласно которому алгебраическая сумма степеней окисления атомов в соединении равна нулю, а в сложном ионе (типа 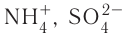 и т. п.) — заряду иона.
и т. п.) — заряду иона.
При проведении расчётов необходимо знать несколько основных положений.
1. Металлы во всех сложных соединениях имеют только положительные степени окисления.
2. Неметаллы могут проявлять как положительные, так и отрицательные степени окисления.
3. Элементы, атомы которых проявляют постоянную степень окисления:
- а) щелочные металлы (Li, Na, К, Rb, Cs) — +1;
- б) металлы второй группы (А и В) — +2;
- в) алюминий — +3;
- г) фтор — — 1.
Кислород практически во всех своих соединениях проявляет степень окисления —2, кроме фторида 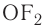 и пероксида
и пероксида 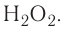 .
.
4. Высшая положительная степень окисления, как правило, равна номеру группы периодической системы.
5. Низшая отрицательная степень окисления обычно равна разности: № группы — 8.
Для большинства элементов характерно проявление их атомами переменных степеней окисления в зависимости от атомов, с которыми он связан, и типа соединения, в котором он находится. Например, атомы азота могут проявлять самые разнообразные степени окисления: от —3 в молекуле аммиака 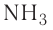 до + 5 в молекуле азотной кислоты
до + 5 в молекуле азотной кислоты  (табл. 9).
(табл. 9).
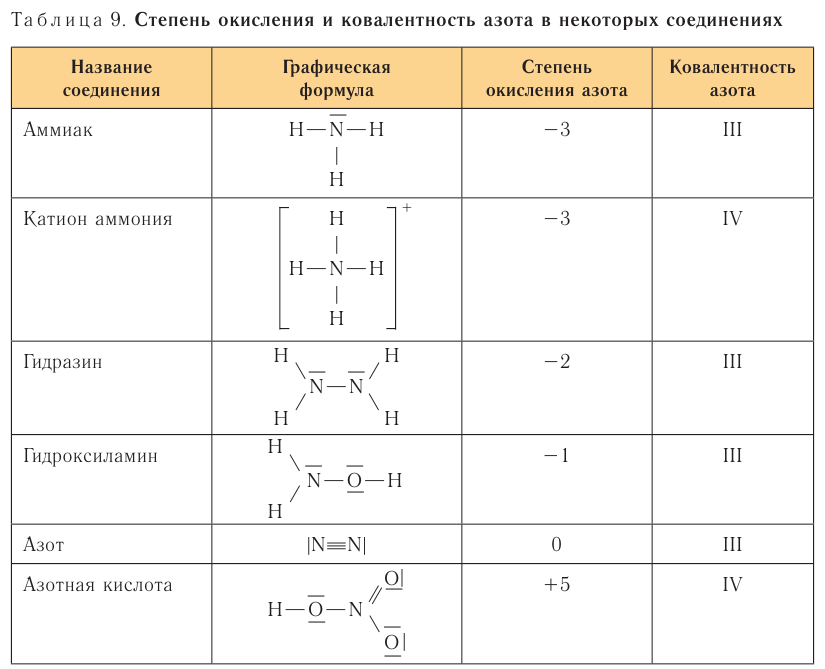
Степень окисления не следует отождествлять с ковалентностью атома элемента, хотя их численные значения часто совпадают:

В пероксиде водорода Н — О — О — Н ковалентность кислорода равна двум, а степень окисления —1, в ионе 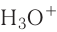 его ковалентность III, а степень окисления —2.
его ковалентность III, а степень окисления —2.
Часто степень окисления атома элемента определяется как алгебраическая сумма степеней окисления по всем связям с атомами других элементов. Например, в молекуле гидроксиламина 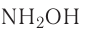 общая степень окисления азота равна —1, так как по двум связям с водородом азот проявляет суммарную степень окисления —2, а по связи с атомом кислорода +1:
общая степень окисления азота равна —1, так как по двум связям с водородом азот проявляет суммарную степень окисления —2, а по связи с атомом кислорода +1:
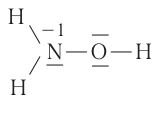
Степень окисления характеризует состояние атомов элемента в сложном веществе независимо от типов связей его атомов. Особенно важна эта характеристика при составлении уравнений окислительно-восстановительных реакций.
Ковалентность атома химического элемента определяется числом ковалентных связей, которыми он связан с другими атомами, или, что то же самое, числом орбиталей, используемых данным атомом для образования связей.
Степень окисления — это условный заряд атома в химическом соединении, вычисленный из предположения, что оно состоит из ионов.
Металлическая и ионная связь
Ковалентная химическая связь обычно возникает между атомами неметаллов с одинаковой или с несильно различающейся электроотрицательностью. Если различие в электроотрицательности атомов (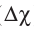 ), между которыми образуется химическая связь, велико и превышает 1,7, то общая электронная пара практически полностью смещается к атому, имеющему большую электроотрицательность. В результате этого образуются частицы, имеющие заряды — положительно и отрицательно заряженные ионы с устойчивой электронной конфигурацией атомов ближайшего благородного газа. Противоположно заряженные ионы прочно удерживаются силами электростатического притяжения — между ними возникает химическая связь, которая называется ионной.
), между которыми образуется химическая связь, велико и превышает 1,7, то общая электронная пара практически полностью смещается к атому, имеющему большую электроотрицательность. В результате этого образуются частицы, имеющие заряды — положительно и отрицательно заряженные ионы с устойчивой электронной конфигурацией атомов ближайшего благородного газа. Противоположно заряженные ионы прочно удерживаются силами электростатического притяжения — между ними возникает химическая связь, которая называется ионной.
Ионная связь
Химическая связь, осуществляемая за счёт электростатического взаимодействия противоположно заряженных ионов, называется ионной связью.
Ионная связь, как правило, возникает между атомами типичных металлов и типичных неметаллов. Характерным свойством атомов металлов является то, что они легко отдают свои валентные электроны, тогда как атомы неметаллов способны легко их присоединять.
Рассмотрим возникновение ионной химической связи, например между атомами натрия и атомами хлора в хлориде натрия NaCl.
Отрыв электрона от атома натрия приводит к образованию положительно заряженного иона — катиона натрия 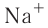 (рис. 28):
(рис. 28):
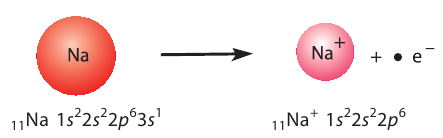
Рис. 28. Образование катиона натрия 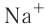
Присоединение электрона к атому хлора приводит к образованию отрицательно заряженного иона — аниона хлора 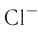 (рис. 29):
(рис. 29):
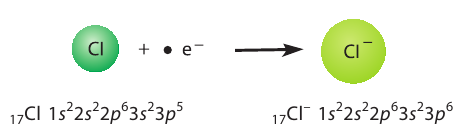
Рис. 29. Образование аниона хлора 
Между образовавшимися ионами 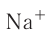 и
и 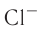 , имеющими противоположный заряд, возникает электростатическое притяжение, в результате которого образуется соединение — хлорид натрия с ионным типом химической связи. Таким образом, процесс образования ионной связи сводится к переходу электронов от атомов натрия к атомам хлора с образованием противоположно заряженных ионов, имеющих завершённые электронные конфигурации внешних слоёв:
, имеющими противоположный заряд, возникает электростатическое притяжение, в результате которого образуется соединение — хлорид натрия с ионным типом химической связи. Таким образом, процесс образования ионной связи сводится к переходу электронов от атомов натрия к атомам хлора с образованием противоположно заряженных ионов, имеющих завершённые электронные конфигурации внешних слоёв:
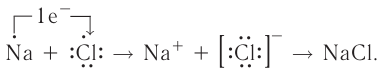
Соединения с ионной связью принято называть ионными. Большинство бинарных соединений, содержащих атомы металлов, являются ионными, т. е. в них химическая связь в значительной степени ионная. К числу таких соединений относятся галогениды, оксиды, сульфиды, нитриды и др.
Ионная связь возникает не только между простыми катионами и простыми анионами типа 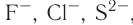 , но и между простыми катионами и сложными анионами типа
, но и между простыми катионами и сложными анионами типа 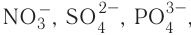 , или гидроксид-ионами
, или гидроксид-ионами  . Подавляющее большинство солей и оснований являются ионными соединениями. Например, сульфат натрия
. Подавляющее большинство солей и оснований являются ионными соединениями. Например, сульфат натрия 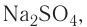 нитрат меди(II)
нитрат меди(II) 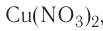 гидроксид магния
гидроксид магния 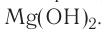 Существуют ионные соединения, в состав которых входят сложные катионы, не содержащие атомы металлов, например ион аммония
Существуют ионные соединения, в состав которых входят сложные катионы, не содержащие атомы металлов, например ион аммония 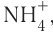 а также соединения, в которых сложными являются и катион, и анион, например сульфат аммония
а также соединения, в которых сложными являются и катион, и анион, например сульфат аммония 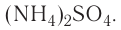
Ионные кристаллы
Ионная связь по своим свойствам отличается от ковалентной. Так как силы электростатического взаимодействия направлены от иона во все стороны, то каждый ион может притягивать ионы противоположного знака в любом направлении. Поэтому ионное соединение представляет собой гигантскую ассоциацию ионов противоположных знаков, расположенных в определённом порядке, в форме ионного кристалла. Кристаллы ионных соединений состоят из катионов и анионов, которые определённым образом располагаются в пространстве благодаря равновесию сил притяжения и отталкивания. На рисунке 30 представлено строение кристалла хлорида натрия NaCl, состоящего из катионов натрия  и анионов хлора
и анионов хлора 
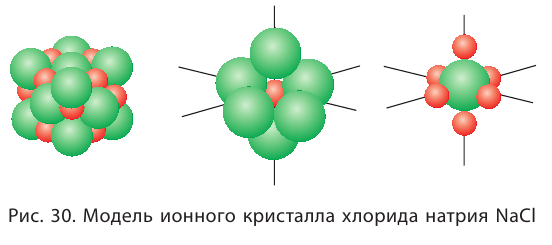
Каждый катион натрия окружён шестью анионами хлора, а каждый анион хлора — шестью катионами натрия.
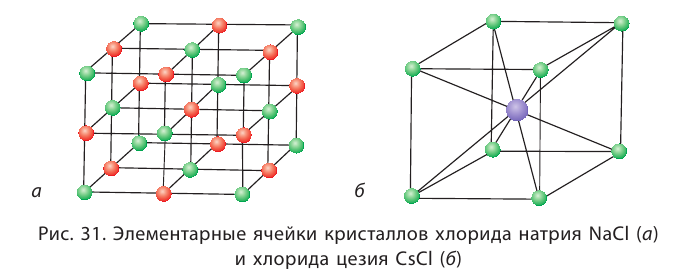
Наименьшей структурной единицей кристалла (т. е. его наименьшей частью), отражающей все особенности структуры его кристаллической решётки, является элементарная ячейка. Её строение зависит от соотношения размеров катиона и аниона, а также их природы. На рисунке 31 приведено строение элементарных ячеек хлорида натрия NaCl и хлорида цезия CsCl. Существуют и другие типы элементарных ячеек.
Если частицы в веществе связаны ионной связью, то оно относится к веществам с немолекулярным строением. В твёрдом агрегатном состоянии такие вещества представляют собой ионные кристаллы. Так как ионная связь является прочной, то ионные кристаллы имеют обычно высокие температуры плавления и кипения, не имеют запаха. Для ионных соединений характерна хрупкость, а отсутствие свободных заряженных частиц объясняет тот факт, что при комнатной температуре они плохо проводят электрический ток.
Металлическая связь. Металлические кристаллы
Атомы большинства металлов достаточно легко отдают свои валентные электроны, в результате чего превращаются в положительно заряженные ионы. Это происходит не только при взаимодействии металлов с другими атомами, но и при образовании металлических кристаллов.
В кристалле металла непрерывно протекают два противоположных процесса — образование ионов металла из нейтральных атомов в результате отдачи валентных электронов:
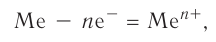
и присоединения электронов к ионам с образованием нейтральных атомов:
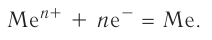
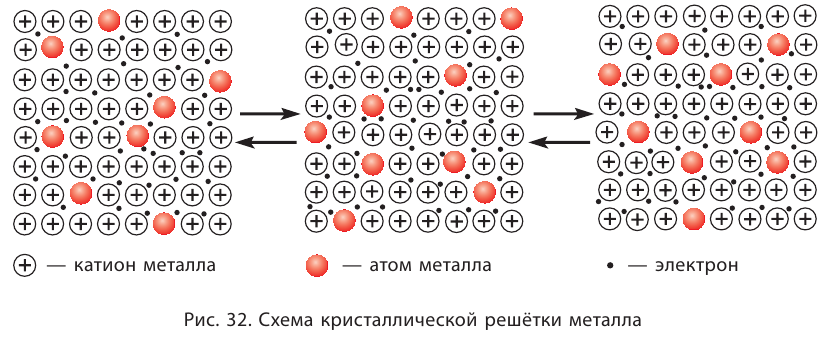
В узлах кристаллической решётки металла попеременно находятся как нейтральные атомы, так и положительно заряженные ионы (рис. 32). Образующиеся при этом электроны свободно перемещаются внутри кристалла и компенсируют взаимное отталкивание между положительно заряженными катионами металла, а также удерживают атомы в составе кристалла. Они становятся общими для всех атомов и ионов металла, связывая их между собой.
В Химическая связь между атомами в металлическом кристалле, возникающая за счёт обобществления их валентных электронов, называется металлической связью.
Металлическая связь не имеет направленности в пространстве. Эта химическая связь является коллективной, как и ионная, в ней принимают участие все атомы кристалла металла.
Металлическая связь сходна с ковалентной связью тем, что при образовании и той и другой связи электроны обобществляются. Однако в случае металлической связи эти электроны связывают все атомы металлического кристалла, тогда как в ковалентном соединении связываются лишь находящиеся рядом атомы.
- Ионная связь осуществляется за счёт электростатического притяжения между противоположно заряженными ионами.
- Химическая связь между атомами в металлическом кристалле, возникающая за счёт обобществления их валентных электронов, называется металлической связью.
Межмолекулярное взаимодействие
Молекулы, несмотря на свою электронейтральность, способны взаимодействовать между собой. Такое взаимодействие называется межмолекулярным. Силы, за счёт которых возникает это взаимодействие, часто называют ван-дер-ваальсовыми в честь голландского учёного В а н-де р-В а а л ьса. Эти силы обусловливают притяжение молекул данного вещества (или разных веществ) друг к другу в жидком и твёрдом агрегатном состоянии.
Природа межмолекулярного взаимодействия
Межмолекулярное взаимодействие, как и химическая связь между атомами, имеет электростатическую природу. Несимметричность распределения электронов и ядер атомов в молекуле приводит к появлению у неё электрических полюсов — положительного с той стороны, где электронная плотность понижена, и отрицательного, где она повышена. Образовавшиеся полярные молекулы притягиваются друг к другу разноимёнными полюсами (рис. 33, а).
Взаимодействие может осуществляться также между полярной и неполярной молекулами. При этом в неполярной молекуле под действием электрического поля полярной молекулы возникает (индуцируется) диполь. Постоянный диполь и индуцированный диполь притягиваются друг к другу (рис. 33, б).
В неполярных молекулах вследствие постоянного изменения положения ядер и электронов непрерывно возникают, перемещаются и исчезают электрические полюса. Поэтому в разные моменты времени возникают мгновенные диполи, между которыми также действуют силы притяжения (рис. 33, в)
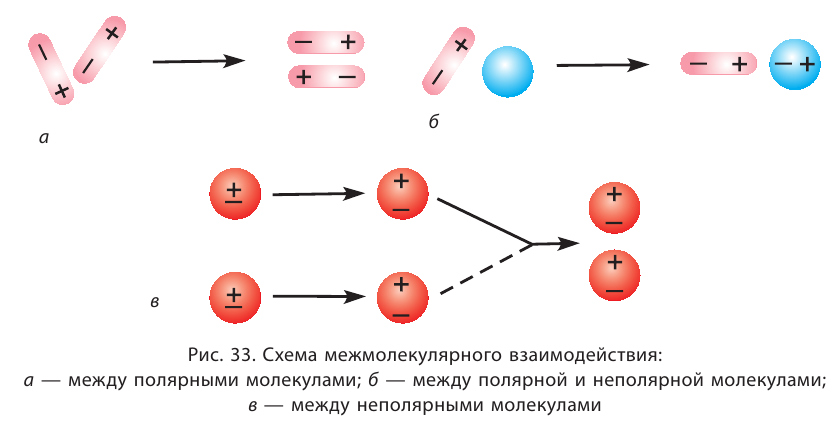
В этом и состоит объяснение существования притяжения между любыми молекулами, как полярными, так и неполярными.
Межмолекулярное взаимодействие и агрегатное состояние вещества
Межмолекулярное взаимодействие обусловливает переход вещества из газообразного в жидкое, а затем и в твёрдое состояние. Но по сравнению с ковалентной связью межмолекулярные взаимодействия слабы, связи между молекулами относительно непрочные и легко разрываются. Именно поэтому молекулярные вещества плавятся и кипят при относительно низких температурах.
Энергия межмолекулярного взаимодействия зависит в основном от двух характеристик молекул — их полярности и размера. Чем сильнее межмолекулярное взаимодействие в веществе, тем выше его температуры плавления и кипения. Например, благодаря более сильному межмолекулярному взаимодействию кислород кипит при более высокой температуре, чем азот, что используется при получении этих газов из воздуха. Углеводороды с большой молекулярной массой кипят при более высокой температуре, чем низкомолекулярные углеводороды. Это свойство углеводородов лежит в основе процесса перегонки нефти.
Молекулярные кристаллы
В узлах молекулярной кристаллической решётки расположены молекулы, связанные между собой слабыми межмолекулярными связями (рис. 34).
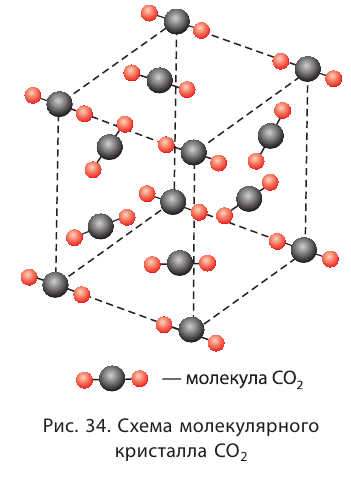
Молекулярные кристаллические решётки присущи водороду, азоту, кислороду, иоду, воде, углекислому газу, многим органическим веществам, находящимся в твёрдом состоянии. Кристаллы благородных газов также молекулярные, они построены из одноатомных молекул.
Для веществ, образующих молекулярные кристаллы, характерны низкие температуры плавления и кипения, небольшая твёрдость. Нагревание некоторых молекулярных кристаллов, например иода, углекислого газа, приводит к переходу вещества из твёрдого состояния сразу в газообразное, минуя жидкую фазу. Этот процесс называется возгонкой, или сублимацией.
В то же время многие органические вещества с молекулами, содержащими десятки тысяч и более атомов, вообще не плавятся, так как прочность связей между молекулами в сумме оказывается выше прочности связей внутри молекулы. Попробуйте расплавить, например, крахмал, целлюлозу (вату). Вы убедитесь в том, что вещество начнёт разрушаться раньше, чем плавиться.
Однако надо иметь в виду, что реакционная способность молекулярных веществ зависит от прочности не межмолекулярных, а внутримолекулярных связей. Ведь при химическом взаимодействии разрываются именно внутримолекулярные связи. Например, парафин — механически непрочное вещество, связи между молекулами в нём слабы. Но это вещество химически достаточно устойчиво, оно не разрушается под действием кислот и щелочей.
Водородная связь
Одной из разновидностей межмолекулярного взаимодействия является водородная связь. Она осуществляется между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом другой молекулы:
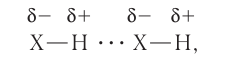
где X — атом одного из наиболее электроотрицательных элементов: F, О или N.
Межмолекулярное взаимодействие 109
Возникновение водородной связи (на схеме она обозначается тремя точками) обусловлено прежде всего тем, что у атома водорода имеется только один электрон, который при образовании полярной ковалентной связи с сильноотрицательным элементом смещается в сторону этого элемента. На атоме водорода возникает частичный положительный заряд, что в сочетании с отсутствием внутренних электронных слоёв позволяет другому атому сближаться до расстояний, близких к длинам атомных связей.
В первом приближении образование водородной связи можно объяснить электростатическим взаимодействием между молекулами. Определённый вклад в образование водородной связи вносит донорно-акцепторное взаимодействие «свободной» ls-орбитали атома водорода и орбитали с неподелённой парой электронов электроотрицательного атома. Поэтому водородная связь обладает свойством направленности, во многом определяя структуру вещества в конденсированном состоянии.
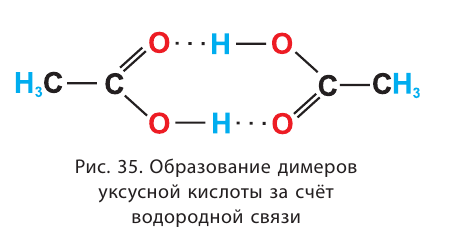
Благодаря водородным связям молекулы объединяются в ассоци-аты, например молекулы уксусной кислоты образуют димеры (рис. 35).
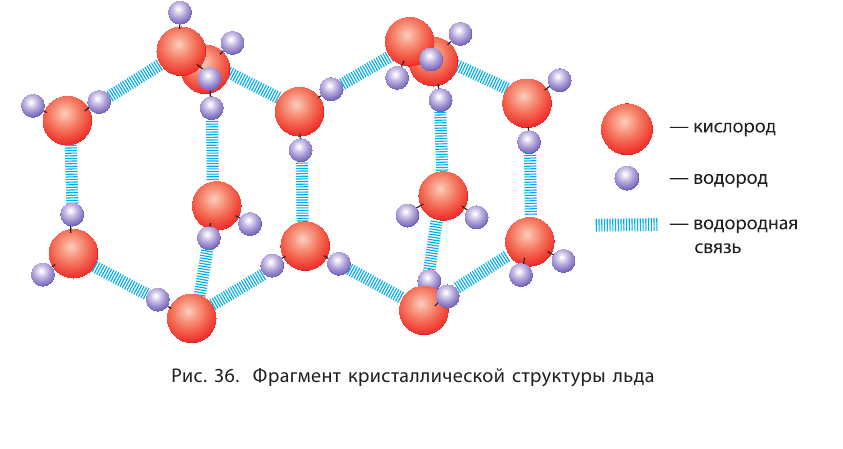
Водородные связи определяют кристаллическую структуру льда, где каждый атом кислорода в молекулах  связан с четырьмя атомами водорода — двумя ковалентными и двумя водородными связями (рис. 36).
связан с четырьмя атомами водорода — двумя ковалентными и двумя водородными связями (рис. 36).
Взаимодействие с образованием водородной связи в несколько раз сильнее, чем обычное межмолекулярное взаимодействие, но слабее ковалентной связи. С повышением температуры водородные связи разрушаются. Это происходит при переходе вещества молекулярного строения из твёрдого состояния в жидкое, а затем в газообразное.
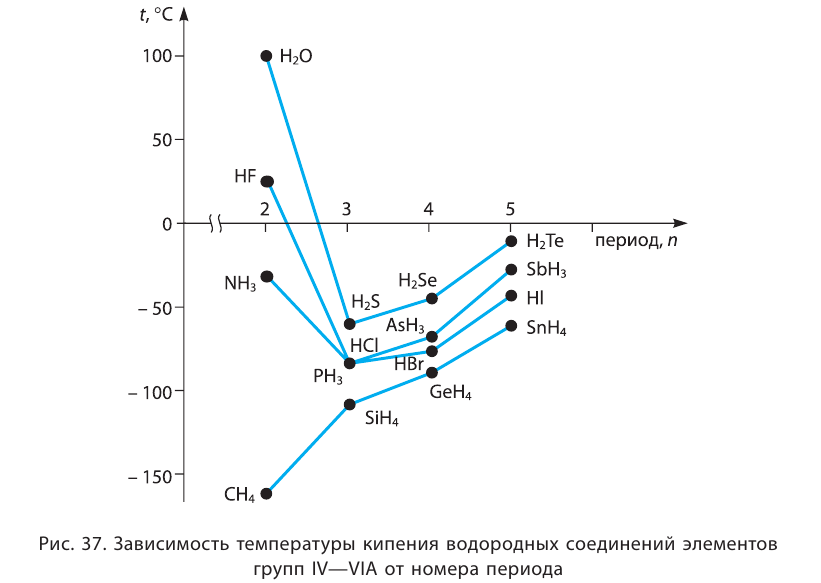
Наличие водородной связи существенно влияет на физические свойства веществ. Так, аномально высокие температуры кипения  по сравнению с аналогичными веществами, образованными элементами этих же групп других периодов (рис. 37), объясняются образованием ассоциатов за счёт водородных связей.
по сравнению с аналогичными веществами, образованными элементами этих же групп других периодов (рис. 37), объясняются образованием ассоциатов за счёт водородных связей.
Водородная связь 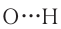 широко распространена в природе. Именно её наличием обусловлены аномальные свойства воды, в том числе высокие температуры кипения и плавления, необычайно высокая теплоёмкость. Благодаря своей ажурной структуре (см. рис. 36) лёд имеет меньшую плотность, чем жидкая вода. Поэтому зимой лёд находится на поверхности воды, а глубокие водоёмы не промерзают до дна.
широко распространена в природе. Именно её наличием обусловлены аномальные свойства воды, в том числе высокие температуры кипения и плавления, необычайно высокая теплоёмкость. Благодаря своей ажурной структуре (см. рис. 36) лёд имеет меньшую плотность, чем жидкая вода. Поэтому зимой лёд находится на поверхности воды, а глубокие водоёмы не промерзают до дна.
Водородная связь может возникать и между атомами одной молекулы. Чаще всего внутримолекулярная водородная связь возникает в молекулах органических веществ, содержащих в своём составе такие группы атомов, как —ОН, =NH, —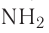 и др.
и др.
Особенно велика роль водородных связей в биохимических процессах с участием высокомолекулярных соединений (белки, ДНК и др.), пространственная структура которых определяется наличием водородных связей.
Межмолекулярное взаимодействие возникает между любыми молекулами, как полярными, так и неполярными, и имеет электростатическую природу.
Межмолекулярное взаимодействие обусловливает переход вещества из газообразного состояния в жидкое, а затем и в твёрдое.
Чем сильнее межмолекулярное взаимодействие в веществе, тем выше его температуры плавления и кипения.
В узлах молекулярной кристаллической решётки расположены молекулы, связанные между собой слабыми межмолекулярными связями.
Водородная связь осуществляется между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом фтора, кислорода, азота (реже хлора и серы), принадлежащим другой молекуле.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |