Периодический закон Д. И. Менделеева в химии - формулы, определение с примерами
Содержание:
Периодическая система химических элементов:
Какие стадии исторического развития прошла таблица периодической системы? Каких ученых, внесших вклад в создание этой системы и периодического закона, вы знаете?

Как образовались названия химических элементов
Периодическая система химических элементов всегда привлекала внимание и вызывала интерес своим многообразием и отличительным строением.
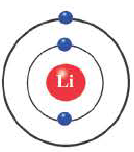
«Химическим элементом» называется вид атомов с одинаковым зарядом ядра и разными массами.
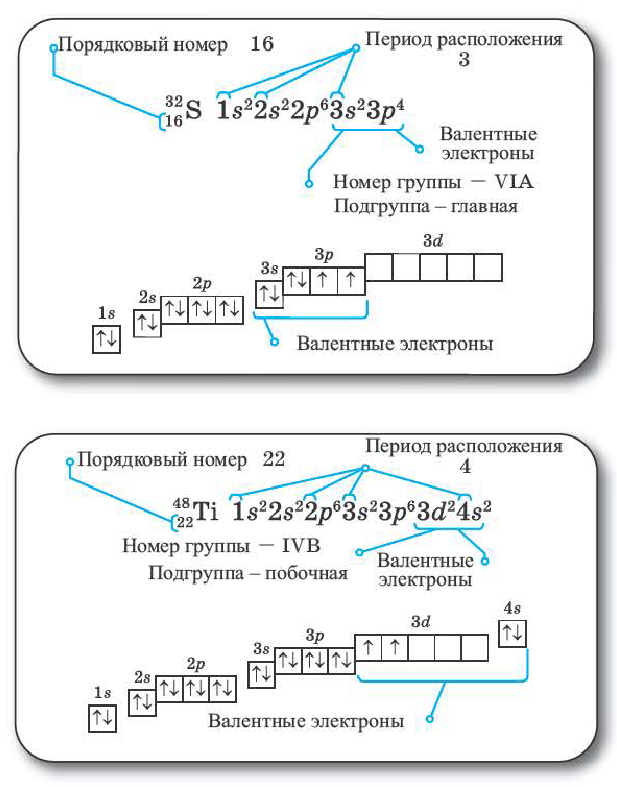
Таблица периодической системы химических элементов отражает в себе множество важной информации, такие как: знак элемента, его порядковый номер, относительная атомная масса, физические и химические свойства и др.
В качестве составителя таблицы периодической системы химических элементов в первую очередь нам приходит на ум имя русского ученого Д.И.Менделеева. Однако ещё до Д.И.Менделеева были ученые, которые систематизировали химические элементы по группам. Ещё в середине XIX века уже было открыто 63 элемента. Кроме того, ученые уже умели с большой точностью вычислять атомные массы элементов. Увеличение числа химических элементов привело к необходимости их систематизации.
 |
Первая научная попытка по систематизации элементов была предпринята в 1828 году немецким ученым Иоганн Вольфганг Дёберейнером. Он выявил существование групп схожих элементов (щелочные металлы: Li, Na, К; щелочноземельные металлы: Ca, Sr, Ba; галогены: Cl, Br, I), паз вав их «триадами» (трио). |
 |
В 1862 году французский ученый Александр Эмиль Шанкургпуа расположена элементы в виде спирали вокруг цилиндра по мере возрастания их атомных масс. При этом схожие элементы оказались расположены друг под другом. Данная спираль известна под названием «Земная спираль». |
 |
В 1864 году английский ученый Джон Александр Ньюлендс обнаружил наличие групп семёрок элементов. Он показал, что в этих группах каждый 8 ой элемент, следующий за седьмым, повторяет свойства предыдущего элемента или проявляет схожие с ним свойства. Ньюлендс назвал это «правилам октавы», |
 |
В 1869 году Дмитрий Иванович Менделеев на основе периодического закона составил периодическую систему химических элементов. В периодической системе каждый элемент занимает определенную клетку, характеризуется своим порядковым номером и атомной массой. On вывел закон о периодичности схожих свойств химических элементов. Согласно этапу закону, схожие химические свойства элементов и их соединений через определенные интервалы периоды повторяются. |
Периодическая система химических элементов это графическое изображение периодического закона.
При составлении периодической системы Д.И.Менделеев уточнил атомные массы многих элементов, оставил в таблице пустые места для неоткрытых 29 элементов, заранее с максимальной точностью описав и сообщив свойства и атомные массы трех из них экаалюминия, экабора и экакремния. Все три элемента экабор (скандий Sc; 45,0), экаалюминий (галлий Ga; 69,7), эка-кремний (германий Ge; 72,6) были открыты еще при жизни Д.И.Менделеева и носят названия стран, где они были открыты. Позже, после изучения строения атома и физического смысла порядковых номеров элементов (равенство числа протонов заряду ядра), прозорливос ть мыслей Менделеева была подтверждена.
| 1 марта 1869 года дата открытия периодического закона и создания первоначального варианта периодической системы. |
В настоящее время современное определение периодического закона имеет следующее звучание: Формы и свойства химических элементов, а также образованных ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра их атомов.
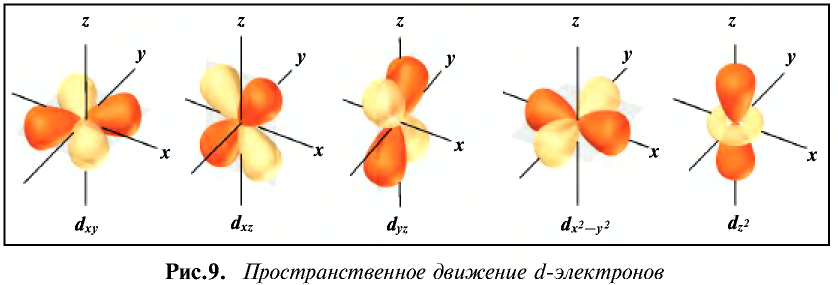
До сих пор были предложены различные таблицы, графики и схемы, выражающие периодический закон. В настоящее время пользуются таблицами классической формы с краткой периодичностью (с 8-ью столбцами) и с длинной периодичностью (с 18-ью столбцами). В современной периодической таблице 118 химических элементов, как встречающихся в природе, так и полученных в результате ядерных реакций, расположены по ряду возрастания порядковых номеров атомов. Ряды элементов, начинающиеся щелочными металлами (в 1-ом периоде водородом) и заканчивающиеся инертными газами, расположенные в порядке возрастания зарядов их ядер (порядковых номеров), называются периодами. В целом существует 7 периодов и 8 групп.
 |
Доктор химических наук, профессор Аббас Чайхорский (1917 2008) в 70 х годах прошлого века создал наиболее совершенную таблицу периодической системы химических элементов. Кроме того, он предложил 5 ое квантовое число. |
Расположенные в вертикальных столбцах периодической таблицы ряды элементов называются группами. В таблице каждая группа по сходству свойств элементов подразделяется на две подгруппы: главную (или подгруппу А) и побочную (или подгруппу В). Главные подгруппы состоят из элементов как малых, так и больших периодов, а побочные подгруппы только из элементов больших периодов.
- Металлы подгруппы А I (щелочные металлы): Li, Na, К, Rb, Cs, Fe.
- Металлы подгруппы А II: Be, Mg, Ca, Sr, Ba, Ra.
Из них Ca, Sr, Ba называются щелочноземельными металлами.
- Элементы подгруппы A VII (галогены): F, Cl, Br, I, At.
- Элементы подгруппы A VIII (инертные газы): Не, Ne, Ar, Кг, Хе, Rn.
1-ый период состоит из 2-х, 2-ой и 3-ий периоды каждый из 8-ми, 4-ый и 5-ый периоды каждый из 18-ти, 6-ой период из 32-х, а 7-ой период из 32-х элементов. 1-ый, 2-ой, 3-ий периоды называют малыми, а 4-ый, 5-ый, 6-ой и 7-ой периоды большими периодами. Вместе с тем открытие новых химических элементов продолжается. По мере продвижения слева направо, заряд ядра каждого последующего элемента возрастает на +1 ив результате на один электрон становится больше.
Элементы, расположенные после лантана с порядковым номером 57, называются лантаноидами, а элементы, следующие после актиния с порядковым номером 89, называются актиноидами. Каждый из этих рядов состоит из 14 элементов с последовательно обозначенными порядковыми номерами.
Периодический закон и периодическая система в начале XX века сыграли важную роль в изучении строения атома. Открытие периодического закона также сыграло исключительную роль в развитии естественных наук, в особенности физики, географии, минералогии, биологии, космохимии и др.
Модели атомов
| Aтом это мельчайшая электронейтральная, химически неделимая частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов и содержащая в себе все свойства химического элемента. |
До конца XIX века атомы рассматривались как неделимые частицы. Ряд открытий (радиоактивность, электропроводимость растворов, катодные лучи), осуществленных начиная с 1896-го года, доказали, что атомы являются сложными частицами. После этого ученые начали предлагать свои модели атома, раскрывающие суть этих частиц.
 Модель Дальтона |
 Модель Томсона |
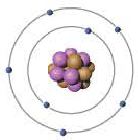 Модель Резерфорда |
Наиболее приемлемая модель атома была предложена в 1911-ом году английским ученым Э.Резерфордом.
 |
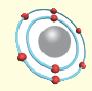
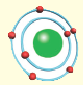
Эрнест Резерфорд после ряда проведённых опытов пришел к выводу, что атом обладает планетарным строением. Атом это шарообразная нейтральная частица, состоящая из положительно заряженного ядра в центре, вокруг которого по определенным орбитам на большой скорости вращаются отрицательно заряженные электроны. |
По этой модели движение электронов было уподоблено вращательному движению планет вокруг Солнца. Исходя из этого, модель Резерфорда получила название планетарной модели.
| Орбитали это участки 90% ной вероятности пребывания электронов при стационарном состоянии атома (при отсутствии подачи энергии со стороны). |
Одной из отличительных особенностей атома является непрерывное, нескончаемое вращение электронов. Электроны с одинаковой скоростью продолжают непрерывно вращаться и никогда не сталкиваются друг с другом. В атоме электроны постоянно движутся вокруг ядра по определенным орбитам. Во время вращения вокруг ядра они образуют электронные облака различной формы. Электронные облака бывают разные. Эти облака также называют орбиталями. Орбитали обозначаются символами s, р, d, f.
| Орбитали, в соответствии с заглавными буквами английских названий, отмечаются символами s, р, d, f. s sharp (острый), р prinsipal (основной, главный), d diffuse (рассеянный),f fundamental (основательный). |
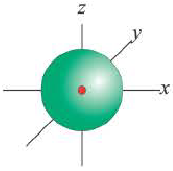
s-орбиталь
Электроны, образующие при вращении облако шарообразной формы, называют s (эс) - электронами, а орбитали сферической формы s (эс) - орбиталями. Сферической формы S- орбиталь симметрична относительно ядра и ни в какую сторону не отклоняется.
Электроны, образующие при движении гантелеобразные облака, называют р (пэ) - электронами, а орбитали гантелеобразной формы р (пэ) - орбиталями. Гантелеобразные электронные облака располагаются перпендикулярно вдоль осей х, у и z в трехмерной системе координат.
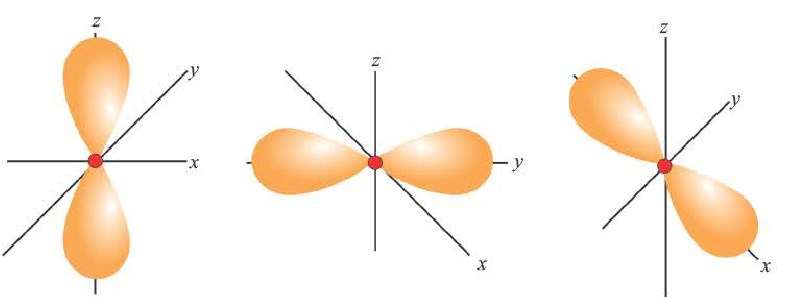
p-орбиталь
Электроны, образующие при вращении более сложные по форме электронные облака, называются d (дэ) - электронами, а орбитали d (дэ) - орбиталями.
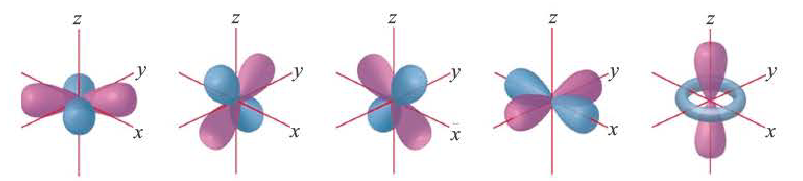
d-орбиталь
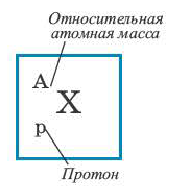
Согласно планетарной модели атома, в нейтральном атоме число протонов равно числу электронов: P(X)=e(X)
Относительная атомная масса или же массовое число атома равно сумме количества протонов и нейтронов (n): (A=p+n).
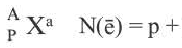 [числовое значение заряда] N(e)(Xa )
[числовое значение заряда] N(e)(Xa ) N(p)(X0)
N(p)(X0)
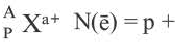 [числовое значение заряда] N(e)(X0)
[числовое значение заряда] N(e)(X0) N(e)(Xa+)
N(e)(Xa+)
В ионе 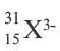 р=15
р=15
n=A р=40 20 = 20
N(e) = р [заряд] =20 2 = 18
Изотопами называются разновидности атомов одного и того же химического элемента с одинаковым положительным зарядом (числом протонов, зарядом ядра), но разными атомными массами.
Изотопы отличаются своими относительной атомной массой, количеством нейтронов и распространением в природе.
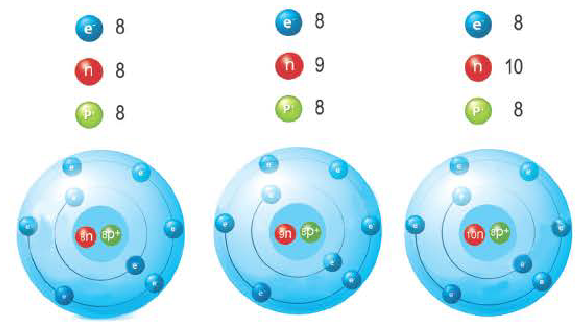
Изотопы элемента кислорода
Так как относительная атомная масса любого химического элемента равна сумме количества нейтронов и протонов, здесь не должно быть дробного числа. Но поскольку у элемента существуют различные изотопы, то берется их среднее числовое значение. Вот почему для вычисления средней относительной атомной массы любого химического элемента используется нижеприведенная формула:
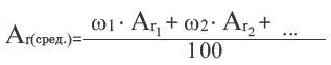
 - массовая доля (в процентах) распространения изотопа в природе.
- массовая доля (в процентах) распространения изотопа в природе.
Строение электронного слоя атомов
Определите по элементам Na, K и P число электронов, энергетических уровней и подуровней.
Что такое энергетический уровень и подуровень? Какие электроны считаются валентными электронами?
В центре каждого атома элемента находится ядро, и электроны, образующие электронный слой, располагаются вокруг ядра по слоям. Некоторые из этих слоёв находятся на близком, а другие на более отдаленном расстоянии от ядра. Электроны, находящиеся на близком расстоянии, сильнее притягиваются к ядру, а расположенные в отдалении слабее. Электронное облако орбиталь, созданное находящимися ближе всех к ядру электронами, образует первый электронный слой вокруг ядра. Так как электроны, расположенные на самом отдаленном от ядра энергетическом уровне (внешнем электронном слое), слабо притягиваются ядром, эти электроны образуют второй, третий и т.д. электронные слои. Число электронов может быть в пределах 1÷8.
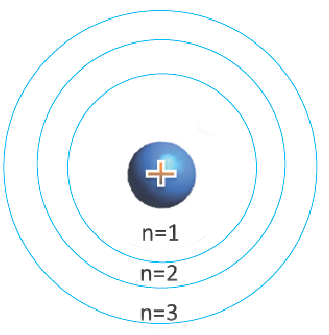
Электронные слои, отличающиеся друг от друга по запасу своей энергии, называются энергетическими уровнями (или электронными слоями).
Энергетические уровни (электронные слои) обозначаются числами. Электронные слои (энергетические уровни) отмечаются буквой «n» (n=1,2, 3,4,5, 6, 7). Электроны, находящиеся на одном энергетическом уровне, отличаются друг от друга по значению своей энергии. Энергетические уровни подразделяются на подуровни, все электроны с одинаковым значением своей энергии располагаются в одних энергетических подуровнях. Энергетические подуровни обозначаются буквами s, р, d, f. На первом энергетическом уровне (электронном слое) имеется 1 (s), на втором 2 (s, р), на третьем 3 (s, р, d), на четвертом 4 (s, р, d, f) подуровня. Электронного слоя, обладающего более 4-х (s, р, d, f) подуровней, не существует, s-подуровень состоит лишь из одной, р-подуровень из трех, d-подуровень из пяти, f-подуровень из семи орбиталей.
| Электронный слой | Энергетический подуровень | Орбиталь | Количество электронов | Максимальное количество электронов |
| n 1 | s | 1 (1s орбиталь) | 2 | 2 |
| n 2 | s | 1 (2s орбиталь) | 2 | 8 |
| p | 3 (2р орбиталь) | 6 | ||
| n 3 | s | 1 (3s орбиталь) | 2 | 18 |
| p | 3 (Зр орбиталь) | 6 | ||
| d | 5 (3d орбиталь) | 10 | ||
| n 4 | s | 1 (4s орбиталь) |
2 | 32 |
| p | 3 (4р орбиталь) | 6 | ||
| d | 5 (4d орбиталь) | 10 | ||
| f | 7 (4fорбиталь) | 14 |
Согласно содержащейся в таблице информации, энергетические уровни можно выразить следующими формулами:
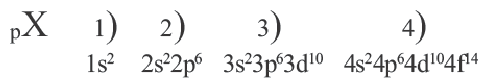
В атомах элементов 1-го периода (Н, Не) имеется один (n=1), 2-го периода (Li, Be, В, С, N, О, F, Ne) два (n=2), 3-его периода (Na, Mg, Al, Si, P, S, Cl, Ar) три (n=3), 4-го периода четыре (n=4) и т.д. электронного слоя.
Схемы, описывающие распределение электронов по орбиталям каждого энергетического уровня, называют электронной конфигурацией атома. Например, на основе электронной формулы ls22s22p63s23р6 составим электронную конфигурацию атома:
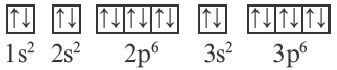
Это также называют графической электронной формулой атома. Графические электронные формулы чаще всего используются при изучении строения наружного энергетического уровня атома.
Отсюда видно, что в атомах ни одного из существующих элементов нет подуровня 1р, 2d, 3f. Ни у одного элемента в последнем электронном слое не бывает больше 8-ми электронов.
| Максимальное число электронов того или иного энергетического уровня (электронного слоя) вычисляется по формуле N (е)max 2n2, а максимальное количество орбиталей по формуле N(орбиталь)мах n2. |
Вследствие участия электронов наружного слоя в химических формулах и создания ими химических связей, их называют валентными электронами (кроме О и F).
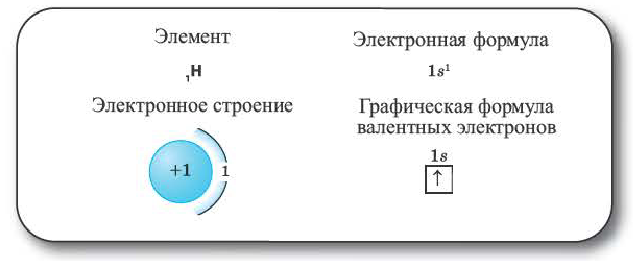
 Водород (1ё) |
|
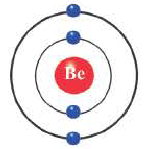 Бериллий (2ё; 2ё) |
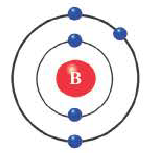 Бор (2ё; 3ё) |
Элементы, обладающие 1,2,3-мя электронами в последнем электронном слое 1÷4 периодов (кроме 1H lsl, 2He ls2, 5B ls22s22pl), являются металлами, а те, у которых 4 и больше 4-х электронов, неметаллами.
Последовательность заполнения орбиталей энергетических уровней электронами
 |
Модель атома | Электронная формула | Графическая электронная формула |
1.  |
 |
 |
|
2.  |
 |
 |
|
3.  |
 |
 |
В какой последовательности происходит заполнение энергетических уровней электронами? Что такое спин? По каким правилам составляется графическая электронная формула?
Строение энергетических уровней (электронных слоев) и последовательность заполнения этих уровней электронами объясняются квантовой теорией. Квантовой теорией было установлено, что заполнение орбиталей электронами идет по принципу минимума энергии. Это означает, что электроны сначала заполняют орбитали первого энергетического уровня, характеризующегося наименьшим (минимум) запасом энергии, далее они заполняют орбитали второго, третьего и т.д. уровней, обладающих сравнительно большими запасами энергии. Заполнение электронами подуровней в пределах определенного энергетического уровня должно происходить в следующей последовательности:
S→p→d→f
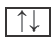
Каждая орбиталь может содержать 1 или 2 электрона. 1 орбиталь обозначается 1 клеткой.
 пустая орбиталь
пустая орбиталь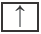 орбиталь с одним электроном
орбиталь с одним электроном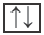 полностью заполненная орбиталь
полностью заполненная орбиталь
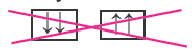
Принцип Паули - в каждой орбитали может находиться только 2 электрона и электронные спины указываются противоположно направленными стрелками.
|
|
|
Правило Хуида - согласно этому правилу, заполнение орбиталей электронами по подуровням происходит электронами с неспаренными паралельными спинами.
| Правильно | 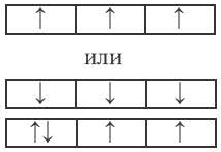 |
Неправильно | 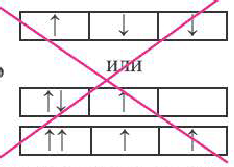 |
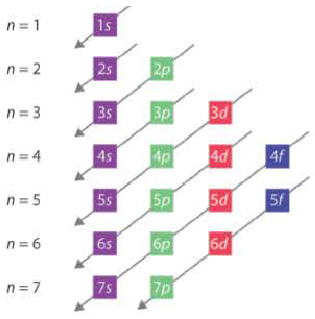
Последовательность заполнения электронами энергетических уровней и подуровней происходит следующим образом:
ls←2s←2p←3s←3p←4s ≈ 3d←4p←5s ≈ 4d←5p←6s←4f ≈ 5d
В этой формуле числа обозначают энергетические уровни, а буквы (s, р, d...) подуровни. Начиная с 4-го энергетического уровня, после s-подуровня электронами заполняются орбитали d-подуровня предыдущего энергетического уровня. Данный порядок распространяется и на 5-й и 6-й энергетические уровни.
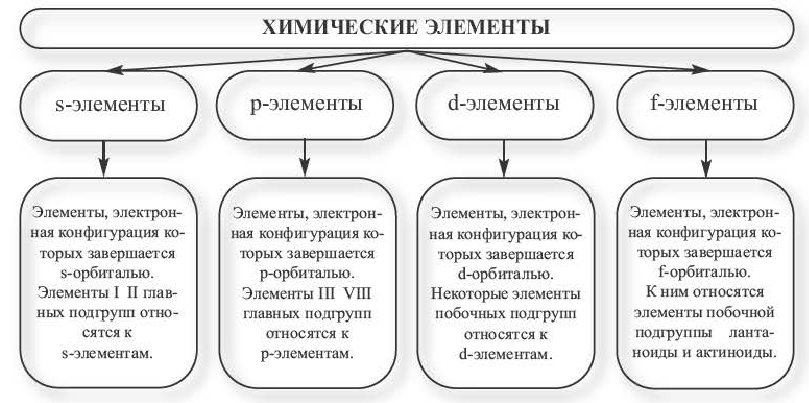
Семейство элементов, куда входит тот или иной элемент, определяется подуровнем, где размещается последний электрон атома этого элемента. Семейство химических элементов делится на четыре части.
Рассмотрим последовательность заполнения орбиталей в атомах некоторых элементов.
Элементы 1-го периода. В первом периоде заполняется 1-ый энергетический уровень элементов и этот уровень занимают максимум 2 электрона.
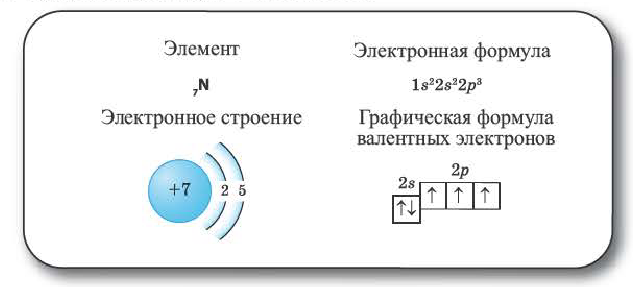
Элементы 2-го периода. Во втором периоде уже начинает заполняться 2-ой энергетический уровень. На этом уровне находятся 4 (ls+3p)орбитали, которые содержат максимум 8 электронов.
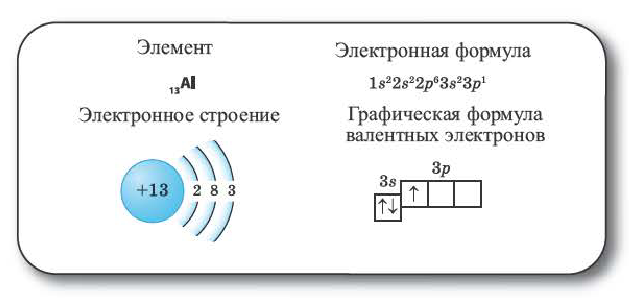
Элементы 3-его периода. Начиная с 3-его периода, заполняется 3-ий энергетический уровень. Этот уровень состоит из 9 (ls+3p+5d) орбиталей. Орбитали содержат максимум 18 электронов.
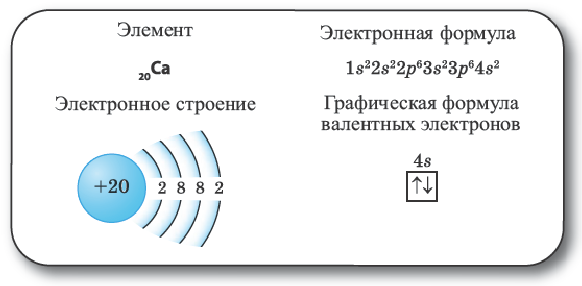
Элементы 4-го периода. Поскольку энергия 4s-подуровня меньше энергии Зd-подуровня, в элементах этого периода вначале заполняется электронами орбиталь 4s-подуровня.
Последовательность заполнения электронами подуровней элементов Cr и Cu различна. Электронная конфигурация хрома должна была быть следующей:
| 24Cr 1 s22s22p63s23p64s23d4 | 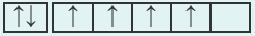 |
Однако, один из электронов в 48-орбитали переходит в 3d-подуровень (т.е. происходит электронный скачок). Вот почему электронная конфигурация этого элемента такая:
| 24Cr 1 s22s22p63s23p64s13d5 | 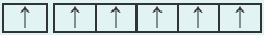 |
Подобный электронный скачок наблюдается и в элементе под номером 29 Си:
| 24Cr 1 s22s22p63s23p64s13d10 | 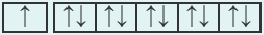 |
На основе электронной формулы можно указать положение любого химического элемента в периодической системе. Самый большой энергетический уровень в краткой электронной формуле элемента показывает период элемента, а число электронов номер группы.
Все элементы побочной подгруппы 4-го периода обладают следующим электронным строением: 1 s22s22p63s23p63da4sb. Если сумма а+b равна 8 или больше 8, то элемент расположен в VIII В группе, а если меньше 8, то полученное число показывает номер побочной подгруппы. Если в Зd-подуровне содержится 10 электронов, то номер побочной подгруппы, где расположен элемент; определяется числом электронов в 48-подуровне. Если в электронном слое того или иного элемента из 4-го периода нарушена последовательность количества электронов (2, 8,18), то 3-ий слой оставляется пустым, а в 4-ый слой вписывается число 2. Из порядкового номера элемента вычитается отмеченное общее число электронов, а полученное число вписывается в 3-ий слой.
Некоторые свойства химических элементов и их периодичность
Расположите представленные элементы в пустые клетки в соответствии с возрастанием их электроотрицательности. Объясните, как меняются свойства элементов, расположенных в одном и том же периоде в таблице периодической системы, и причины этих изменений.
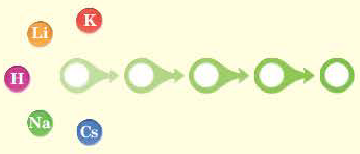
На основе строения атома химических элементов можно определить их место в периодической системе, обладание ими металлическими (способность отдавать электроны, быть восстановителем), неметаллическими (способность принимать электроны, быть окислителем) свойствами, энергией ионизации, их электроотрицательность, радиус атома (размеры). В зависимости от радиуса атома и его электронного строения, по мере возрастания порядковых номеров химических элементов слева направо по периодам, в изменениях их свойств также наблюдается периодичность.
Радиус атома это расстояние от его ядра до самого отдаленного электрона (измеряется в нанометрах). Число протонов, нейтронов в частицах с разными зарядами одного и того же элемента, его относительная атомная масса не меняются, а радиус и количество электронов меняются.
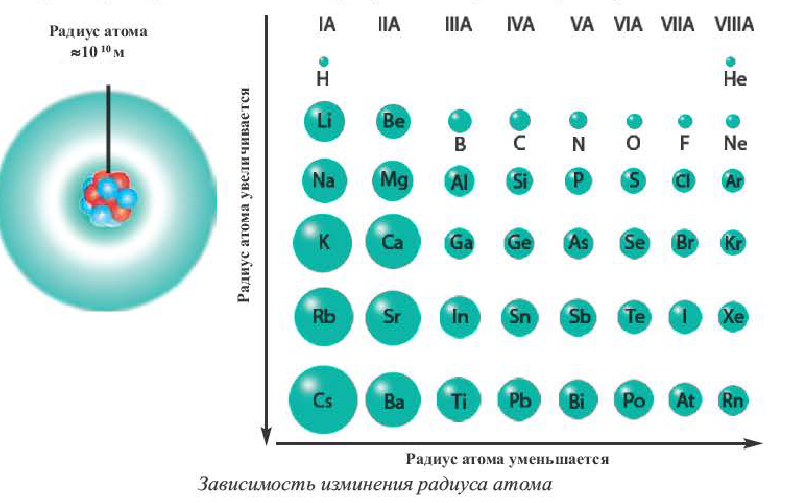
По направлению слева направо по периоду число электронов в наружном слое увеличивается. В результате образуется электронная плотность. За счет образовавшейся в наружном слое электронной плотности увеличивается и сила притяжения электронов наружного слоя к ядру. Вследствие этого, радиус атома уменьшается.
В главных же подгруппах в направлении сверху вниз число электронных слоев увеличивается. В результате последний электрон все больше отдаляется от ядра. Благодаря этому, радиус атома увеличивается.
Радиус нейтрального атома элемента меньше радиуса его отрицательно заряженного иона и больше радиуса его положительно заряженного иона.
r(X) r(X0)
r(X0) r(X+)
r(X+)
Металлические и неметаллические свойства. Элементы, расположенные в первой группе таблицы периодической системы (за исключением водорода) называются щелочными металлами (Li, Na, К., Rb, Cs, Fr). То есть эти элементы проявляют металлические свойства. Металлы всегда отдают электрон, т.е. проявляют восстановительные свойства.
В восьмой группе расположены только инертные газы (Не, Ne, Ar, Kr, Хе, Rn). Из неметаллов (Н, В, С, N, О, F, Si, P, S, Cl, Br, I) лишь один фтор всегда получает электрон, т.е. является окислителем. Кроме фтора, все остальные неметаллы могут проявлять как окислительные, так и восстановительные свойства.
Следовательно, по мере возрастания порядковых номеров элементов в периодах, их металлические свойства постепенно ослабевают и они вначале переходят к амфотерным металлам, а затем к неметаллам. К концу периодов неметаллические свойства усиливаются и, наконец, период завершается благородными газами, не проявляющими в обычных условиях ни металлических, ни неметаллических свойств.
Энергия, которая необходима для отщепления одного электрона от атома, находящегося а нейтральном состоянии, называется энергией ионизации. В направлени сверху вниз в подгруппах в результате удаления наружных электронов от ядра энергия ионизации уменьшается. Химические свойства элементов тесно связаны со значением энергии ионизации элемента. Чем меньше энергия ионизации, тем сильнее будет проявляться металлическое свойство элемента. Химическая инертность благородных газов объясняется их высокой энергией ионизации.
Восстанови тельное свойство это свойство атома отдавать электрон. Процесс отдачи электрона называется окислением 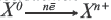 |
Окислительнoe свойство это свойство атома принимать электрон Процесс получения электрона называется восстановлением. 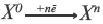 |
Если в наружном электронном слое атома имеется несколько электронов, то для отщепления каждого из них тратится определенная энергия. Эти энергии меняются в последовательности E1 E2
E2 E3 и т.д. Поскольку электроны, находящиеся во внутреннем слое атома, по сравнению с электронами внешнего слоя, более сильно притягиваются ядром, они с трудом отщепляются от ядра. Например, для алюминия будет E1
E3 и т.д. Поскольку электроны, находящиеся во внутреннем слое атома, по сравнению с электронами внешнего слоя, более сильно притягиваются ядром, они с трудом отщепляются от ядра. Например, для алюминия будет E1 E2
E2 E3
E3
 E4 .
E4 .
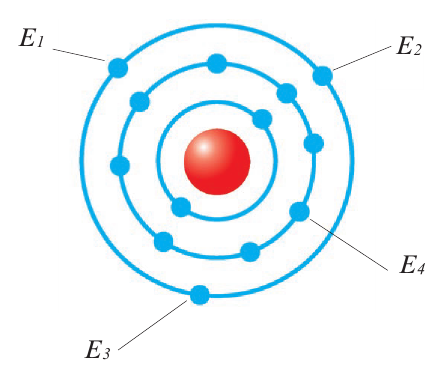
Энергия, выделяемая при присоединении одного электрона к нейтральному атому, называется сродством к электрону. В направлении сверху вниз в подгруппах сродство к электрону уменьшается, а в направлении слева направо по периодам усиливается.
Свойство атомов притягивать к себе электроны от атомов других элементов в соединениях называют электроотрицательностью. Самая высокая электроотрицательность у фтора. Его электроотрицательность равна 4. В направлении слева направо по периодам электроотрицательность элементов увеличивается, а в направлении сверху вниз в главных подгруппах уменьшается. Чем выше относительная электроотрицательность, тем сильнее элемент проявляет свои неметаллические (окислительные) свойства.
Относительная электроотрицательность обозначается знаком ЭО. Относительная электроотрицательность элементов меняется в интервале 0 ЭО
ЭО 4.
4.
Относительная электроотрицательность лития принята за единицу. Электроотрицательности других элементов определяются по литию (см. стр. 194).
Если обобщить вышесказанное, то на основе схемы периодической системы можно представить изменения свойств элементов по периодам и главным подгруппам следующим образом:
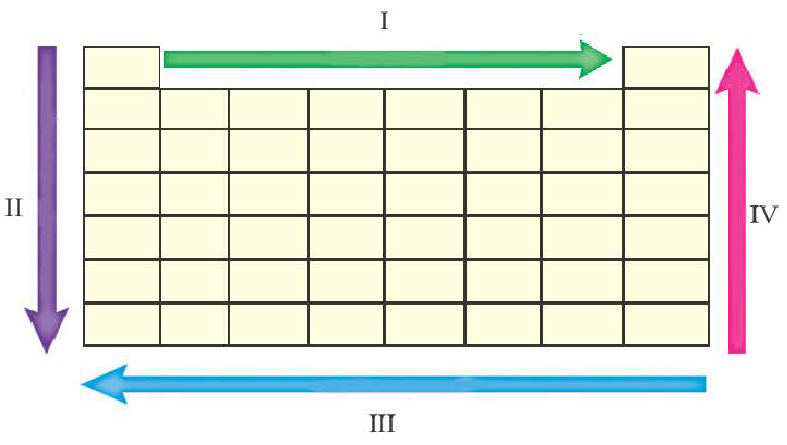
| Свойства, изменяющиеся по I IV направлениям | Свойства, изменяющиеся по II III направлениям | ||
| Возрастающие | Уменьшающиеся | Возрастающие | Уменьшающиеся |
| Неметаллические, окислительные свойства, энергия ионизации, способность принимать электроны, электро отрицательность | Металлические, восстановительные свойства, радиус атома, способность отдавать электроны | Металлические, восстановительные свойства, радиус атома, способность отдавать электроны | Неметаллические, окислительные свойства, энергия ионизации, электро отрицательность |
Возбужденное состояние атома
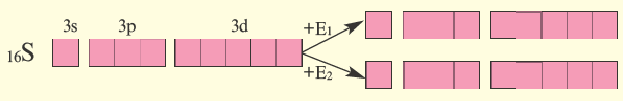
Определите нормальное состояние и состояния возбуждения серы E1 и Е2 и укажите соответствующие этим состояниям валентности.
При поглощении некоторыми атомами энергии их спаренные валентные электроны, став одиночными, переходят внутри энергетического уровня (в одном и том же электронном слое) с подуровня с меньшей энергией на подуровень со сравнительно большей энергией (например, с s-подуровня на р- или d- подуровень, с р- подуровня на d- подуровень). В это время число его неспаренных электронов увеличивается. Это состояние называется возбужденным состоянием атома. Для того, чтобы произошло возбуждение, на энергетическом уровне должны быть спаренный электрон и пустая орбиталь. Если на энергетическом уровне того или иного атома нет пустой орбитали, то он не может возбуждаться.
| Может возбуждаться | 6С ls22s22p2 | Имеет спаренный электрон и пустую орбиталь |
| Не может возбуждаться | 1H Is1 | Не имеет пустую орбиталь и спаренный электрон |
Поскольку у элементов 2-го периода 7N, 80, 9F отсутствует пустая орбиталь, они не могут возбуждаться и вследствие неизменности числа неспаренных (одиночных) электронов, эти элементы не способны проявлять соответствующую номеру их группы валентность.
| Группа | VA | VI А | VII А |
| 7N ...2s22p3 | 8O..,2s22p4 | 9F...2s22p5 | |
| Проявляемая в соединениях валентность | HI, IV | II, HI | I |
Атомы, у которых имеется пустая орбиталь, могут возбуждаться.
| Группа | IA | IIA | IIIA | IVA | VA | VI А | VII А | VIII А |
| Электронная формула | ns1 | ns2 | ns2np1 | ns2np2 | ns2np3 | ns2np4 | ns2np5 | ns2np6 |
| Число неспаренных электронов | 1 | 0 | 1 | 2 | 3 | 2 | 1 | 0 |
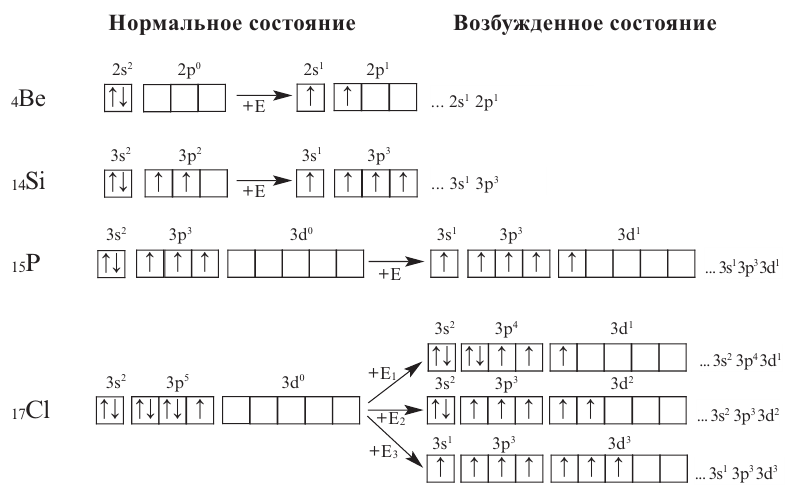
Из вышеприведенных схем видно, что пока электроны р-подуровней не становятся одиночными, электроны s-подуровней тоже не могут стать одиночными. Следовательно, состояние возбуждения
- ns1 np4 nd1
- ns1 np4 nd2
- ns1 np4 nd3
- ns2 np2 nd1
невозможно.
Элементы, имеющие в нормальном (основном) состоянии наибольшее число неспаренных (одиночных) электронов, размещены в группе VA (например, в элементах 7N, 15Р имеется 3 одиночных электрона). В возбужденном состоянии максимальное число неспаренных (одиночных) электронов бывает у элементов, расположенных в группе VIIA (в элементах 17Cl, 35Br, 53I имеется 7 одиночных электронов). У элементов групп IIA и VIIIA в нормальном состоянии одиночных электронов не бывает. В элементах групп IIA VIIA при каждом возбуждении число одиночных электронов увеличивается на 2 единицы.
У элементов групп IIA VA бывает 1, у элементов группы VIA 2, у элементов группы VIIA 3 состояния возбуждения и, соответственно этому, энергии возбуждения. Валентность, проявляемая тем или иным элементом в соединениях (кроме атомов F, О, N), равна числу одиночных электронов в состоянии возбуждения.
Пример №1
Определите электронную формулу элемента с порядковым номером 34.
Решение: Согласно вышеприведенной последовательности, если в 1-ом слое запишем 2е, во 2-ом слое 8е, в 3-ем слое 18е, то в 4-ом слое должны записать 6е. Потому что их сумма должна быть равна числу протонов.
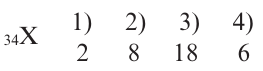
2е из 6е в 4-ом слое расположены в 48-подуровне, а остальные 4е в 4р- подуровне. В таком случае, в краткой форме электронная формула элемента записывается в виде ... 4s2 4p4. Число электронных слоев (4) в атоме эле- мента показывает номер периода, в котором он расположен. Если в предпоследнем электронном слое того или иного элемента имеется 8 или 18ё, то этот элемент является элементом главной подгруппы. Номер группы, в которой расположен элемент главной подгруппы, равен общему числу электронов последнего слоя. Значит, 34-ый элемент, электронное строение которого мы изучали, размещается в группе VI А 4-го периода.
Ни у одного из элементов, изученных по школьному курсу, в последнем электронном слое не бывает больше 8-ми электронов.
Пример №2
Определите в периодической системе место элемента с порядковым номером 26.
Решение: Если в атоме в предпоследнем электронном слое содержится в пределах 8 18 электронов, в таком случае, этот элемент относится к побочной подгруппе (В). Номер периода, в котором размещены эти элементы, также равен числу электронных слоев. А номер группы, в которой расположены элементы побочной подгруппы 4-го периода, определяется суммой электронов подуровней ... 3da4sb. Если эта сумма меньше 8-ми, то полученное число бывает равным номеру группы, если же сумма равна 8-ми или больше 8-ми, то эти элементы размещаются в подгруппе VIII В. Здесь главное условие заключается в том, чтобы в 3d не было 10 электронов. Если в 3d будет 10е, то номер группы определяется числом электронов в 4s.
Действуя как и в задаче 1, записываем в 1-ом слое 2е, во 2-ом слое 8е, но в 3-ем слое записать 26-(2+8)=16 невозможно. В таком случае, оставив 3-й слой пустым, записываем 2е в 4-ый слой, а оставшиеся 26-(2+8+2)= 14е в 3-ий слой. Тогда:
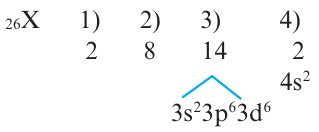
Краткая электронная формула ...3d64s2 ; размещается в 4-ом периоде; группа (6+2=8) VIII В.
Примечание: Из изученных по школьному курсу элементов побочной подгруппы 4-го периода это правило нарушается лишь в элементах 24Cr и 29Cu.
Пример №3
Определите период и группу, в которых расположен элемент с порядковым номером 24.
Решение: Если действовать как и при решении задачи 2, то электронное строение 24-го элемента должно быть следующим:
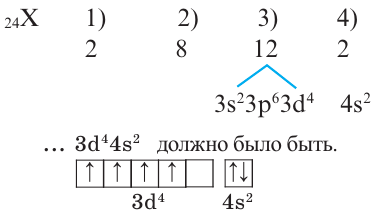
Однако это не так, один из электронов в 4s переходит в 3d (т.е. происходит электронный скачок). В таком случае, электронное строение этого элемента будет таким:
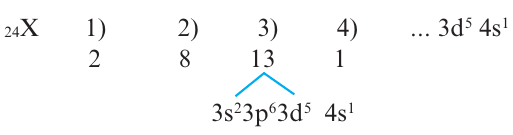
Элемент размещается в 4-ом периоде; группа (1+5=6) VI В.
Такой электронный скачок происходит и в элементе с порядковым номером 29.
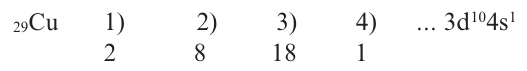
Если в краткой электронной формуле того или иного элемента 3d не указывается, то это элемент главной подгруппы, а если указывается и в нем содержится электрон, тогда этот элемент относится к побочной подгруппе.
Пример №4
Определите а, b и с.

| Ионы | N(C) | Семейство, куда входит элемент |
| X2+ | 18 | a |
| γ3+ | 10 | b |
| Z2+ | 24 | c |
Решение:
Краткая электронная формула элементов главной подгруппы
| IA | IIA | IIIA | IVA | VA | VI А | VII А | VIII А | |
| ns1 | ns2 | ns2np1 | ns2np2 | ns2np3 | ns2np4 | ns2np5 | ns2np6 | |
| N (одинарный электрон) | 1 | 0 | 1 | 2 | 3 | 2 | 1 | 0 |
Семейство элементов, куда входит тот или иной элемент, определяется подуровнем, где размещается последний электрон атома этого элемента. Как видно из таблицы, элементы групп I A (H, Li, Na, К, Rb, Cs), II A (Be, Mg, Ca, Sr, Ba, Ra) и Не это s-элементы, элементы же групп III A -VIII А р- элементы. A Cu, Zn, Cr, Fe, Mn, Ag, Hg и др. d- элементы.
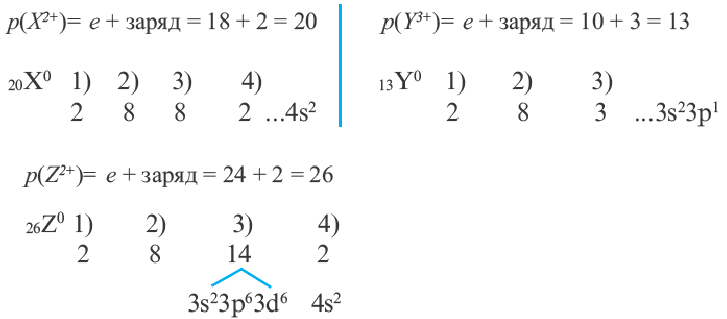
Следовательно, X s- элемент, Y р- элемент, a Z d- элемент. Ответ: C
Пример №5
Определите период и группу расположения X в периодической таблице, если в частице X+6 содержится 10e.
Решение: N(p)= N(e) + [заряд] =10 + 6=16
В таком случае, будем действовать как в задаче 1.
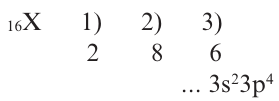
Следовательно, элемент X расположен в 3-ем периоде, группе VIA.
Пример №6
Определите место X в периодической системе (8O), если в ионе ХО3 содержится 40 электронов.
Решение: N(e)общ.=N(p)x+ 3N(e)0+заряд = N(p)x + 3 • 8 + 1 = 40
N(p)x = 15
В таком случае:
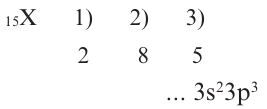
В таком случае, элемент X расположен в 3-ем периоде, группе VA.
Пример №7
Определите соответствие.
| Свойство элемента | Электронная формула элемента | |
| 1) Только восстановитель | a) ...2s22p6 | |
| 2) Только окислитель | b) ...2s22pl | |
| 3) Ни окислитель, ни восстановитель | с) ...3d64s2 | |
| d) ...3s23p3 | ||
| е) ...2s22p5 | ||
| f) ...4sl |
Решение: Поскольку металлы (с, f) отдают электроны, они являются только восстановителями. Из неметаллов фтор (е) бывает только окислителем. Другие неметаллы (b, d) могут быть как окислителями, так и восстановителями. А инертные (благородные) газы (а) не бывают ни окислителями, ни восстановителями.
Периодический закон и периодическая таблица элементов
На какие группы можно подразделить химические элементы по их свойствам?
Химия как наука сформировалась в XVIII -XIX вв., однако основы ее закладывались еще до нашей эры древнегреческими учеными-естествoиспытателями Левкиппом, Демокритом, Эпикуром, а также нашими великими предками — учеными-энциклопедистами, жившими в VIII—XI вв., — Ахмадом Аль-Фергани, Абу Бакром Мухаммедом ибн Закари Ар-Рази, Абу Насром Фараби, Абу Райханом Беруни, Абу Али ибн Сина. В их трудах наряду с научными рассуждениями о строении материального мира приводятся пенные сведения о распределении элементов материального мира по группам, что составляло основу химической науки, а также данные о методах прикладной химии.
Ар-Рази была высказана мысль о существовании атома — самой маленькой единицы материальных элементов, которая в свою очередь делится на еще более мелкие частицы. В трудах Фараби и Беруни приводятся сведения о составных компонентах материального мира, о классификации минералов и драгоценных камней. Великий целитель Востока Абу Али ибн Сина разработал классификацию всех известных в тот период лечебных веществ по их составу и свойствам. Эти первоначальные научные знания, без сомнения, послужили основой для последующих попыток классифицировать химические элементы.
С XVII—XVIII вв. химическая наука начала усиленно развиваться в странах Запада. Развитие науки и техники создавало возможности для получения новых веществ, выделения химических элементов в отдельности. Однако работа с большим объемом неупорядоченных новых фактов вызывала у ученых трудности, связанные с отсутствием группировки вновь создаваемых разнообразных веществ и классификации известных и открываемых химических элементов. Если к концу XVIII в. было известно около 30 химических элементов, к 60-м годам XIX в. — 63, то к настоящему времени открыто 118 химических элементов, которые входят в состав всех существующих веществ и обладают различными свойствами.
Изучение свойств веществ и открытия, сделанные в этой области, расширение возможностей использования веществ для удовлетворения потребностей человека вызвали необходимость разработки классификации веществ и их составных компонентов — химических элементов.
Ученые неоднократно предпринимали попытки классифицировать химические элементы и вещества, однако первые попытки обычно оказывались несовершенными.
Изучение окружающих объектов, происходящих событий и явлений, приводя их в систему, например, группируя жизненно необходимые предметы или классифицируя растения и животных по сортам и видам, приводит к формированию у человека единой системы понятий и представлений о них.
Точно так же систематизация по классам химических элементов, составляющих основу всех веществ, выделение их в группы способствуют формированию единой системы понятий и представлений, расширению знаний об окружающем мире.
В основу первой классификации химических элементов были положены их общие характерные свойства, и они были разделены на металлы и неметаллы. Почти все металлы обладают характерным металлическим блеском, хорошо проводят электрический ток и теплоту, поддаются ковке. Неметаллы же не обладают этими свойствами. Все металлы (кроме ртути) являются твердыми, а неметаллы находятся в твердом (сера, углерод, кремний, йод), жидком (бром), газообразном (кислород, водород, хлор) состояниях.
Металлы и неметаллы различаются между собой и химическими свойствами.
- Гидроксиды типичных металлов являются основаниями, а гидроксиды неметаллов — кислотами.
- Гидриды металлов представляют собой твердые вещества, а гидриды неметаллов являются летучими соединениями.
Однако нельзя провести четкой границы между металлами и неметаллами, так как отдельные элементы по внешним признакам, хотя и схожи с металлами, но не являются таковыми. Например, йод.
Элементы, проявляющие свойства, характерные и для металлов, и для неметаллов, называются амфотерными. Например, цинк и алюминий. По физическим свойствам это — металлы, а по химическим свойствам они схожи как с металлами, так и с неметаллами (табл. 4).
Таблица 4
Подразделение элементов на группы и их генетическая взаимосвязь
| Металлы | Амфотерные элементы | Неметаллы |
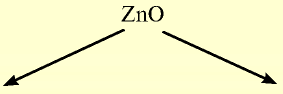
| Na | Zn | S |
| Основный оксид | Амфотерный оксид | Кислотный оксид |
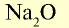 |
 |
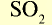 |
| Основание | Кислота | |
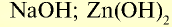 |
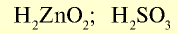 |
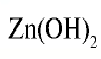 — гидроксид цинка — проявляет свойства и основания, и кислоты.
— гидроксид цинка — проявляет свойства и основания, и кислоты.
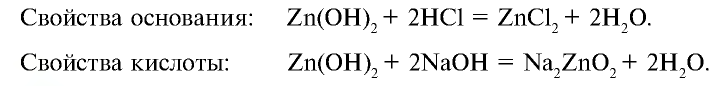
- — Гидроксиды, проявляющие свойства и основания, и кислоты, называются амфотерными гидроксидами.
- — Оксид, образующий амфотерный гидроксид, также обладает амфотерными свойствами,
- — Элементы, образующие амфотерный оксид и амфотерный гидроксид, являются амфотерными элементами.
Низковалентные оксиды отдельных элементов обладают основными, высоковалентные оксиды — кислотными, а оксиды с переменной валентностью — амфотерными свойствами. Например, оксид хрома (И) СrО — является основным, оксид хрома (III) 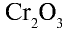 — амфотерным, а оксид хрома (VI)
— амфотерным, а оксид хрома (VI) 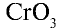 — кислотным.
— кислотным.
Следовательно, такое разделение химических элементов на металлы и неметаллы является неполным и неточным.
Элементы знаний, умений и навыков: металлы, неметаллы, амфотерные элементы, амфотерные оксиды, амфотерные гидроксиды.
Природные семейства химических элементов
При изучении свойств водорода, кислорода и воды вы познакомились с элементами, которые проявляют одинаковые свойства. Например, металлы калий и натрий мягкие, легче воды, в обычных условиях интенсивно реагируют с кислородом и водой, в результате чего образуют одновалентные соединения:
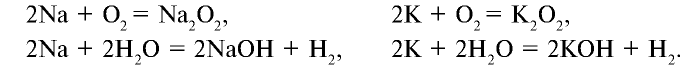
Металлы Li, Rb, Cs и Fr по своим свойствам также похожи на Na и К. Все они составляют одно семейство — семейство щелочных металлов (табл. 5).
Таблица 5
Свойства щелочных металлов
| Элемент | Химический символ | Относительная атомная масса  |
Валентность | Оксид | Гидроксид | Соль |
| Литий | Li | 6,9 | I |  |
LiOH | 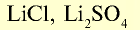 |
| Натрий | Na | 23 | I | NaOH | 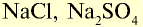 |
|
| Калий | К | 39,1 | I | КОН | 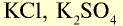 |
|
| Рубидий | Rb | 85,5 | I | RbOH | 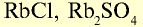 |
|
| Цезий | Cs | 132,9 | I | CsOH | 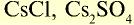 |
Щелочные металлы имеют следующие общие свойства:
- Щелочные металлы во всех соединениях одновалентны.
- Гидроксиды щелочных металлов являются щелочами и хорошо растворяются в воде.
- С увеличением атомных масс щелочных металлов их физические и химические свойства изменяются периодически (табл. 6).
Таблица 6
Физические и химические свойства щелочных металлов
| Физические и химические свойства | Li | Na | К | Rb | Cs |
Относительная атомная масса 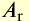 |
6,9 | 23 | 39,1 | 85,5 | 132,9 |
| Температура плавления, °С | 179 | 97,8 | 63,6 | 39 | 28,6 |
| Температура кипения, °С | 1370 | 883 | 760 | 696 | 685 |
| Плотность, г/см3 | 0,53 | 0,92 | 0,85 | 1,52 | 1,87 |
| Окисление на воздухе | Усиливается | ||||
| Растворимость гидроксидов | Увеличивается | ||||
Хлор С1, фтор F, бром Вr и йод J являются похожими элементами и составляют семейство галогенов (табл. 7).
Хлор вступает в реакцию с водородом и металлами и образует одновалентные соединения:

Фтор, бром и йод обладают такими же свойствами, что и хлор.
Таблица 7
Соединения галогенов
| Галогены | F | С1 | Br | J |
| Соединения с водородом (I) | HF | НС1 | НВr | HJ |
| Соединения с металлами | NaF | NaCl | NaBr | NaJ |
| Высший оксид | — | 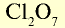 |
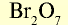 |
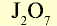 |
Водородные соединения галогенов представляют собой летучие газообразные соединения, хорошо растворимые в воде. Водные растворы галогенов — это кислоты: HF — фтороводородная, НС1 — соляная (хлороводородная), НВr — бромоводородная, HJ — йодоводородная.
С увеличением атомных масс свойства галогенов изменяются периодически. Пользуясь данными табл. 8, попробуйте объяснить зависимость физических свойств галогенов от их атомных масс.
Таблица 8
Физические свойства элементов семейства галогенов
| Элемент | Относительная атомная масса 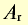 |
Формула простого вещества | Агрегатное состояние в нормальных условиях | Температура кипения, °С | Плотность, г/см3 | Тепловой эффект реакции соединения с 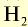 , кДж , кДж |
| Фтор | 19 | 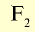 |
Светло-зеленый газ | -182 | 1,1 (в жидком состоянии) | 552 |
| Хлор | 35,5 | 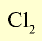 |
Желтовато-зеленый газ | -34 | 1,57 (в жидком состоянии) | 184 |
| Бром | 79,9 | 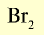 |
Красновато-бурая жидкость | 59 | 3,14 | 72 |
| Йод | 126 | 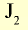 |
Темно-серый твердый кристалл | 185 | 4,94 | -53 |
Галогены имеют следующие общие свойства:
- Галогены образуют с водородом летучие гидриды.
- Водные растворы гидридов галогенов являются кислотами.
- В гидридах и солях, образованных с металлом, галогены одновалентны.
- В высших оксидах, образованных с кислородом (кроме фтора), галогены семивалентны.
- С увеличением атомных масс галогенов их физические и химические свойства изменяются периодически.
Схожие свойства наблюдаются и у следующих групп элементов. Например, магний Mg по свойствам близок к кальцию Са, алюминий А1 — к бору В, углерод С — к кремнию Si, азот N — к фосфору Р.
Инертные газы (гелий Не, неон Ne, аргон Аr, криптон Кr, ксенон Хе) составляют отдельное семейство и обладают одинаковыми свойствами.
Инертные газы имеют следующие общие свойства:
- Молекулы их одноатомные.
- Не образуют соединений с водородом и металлами.
- Отдельные инертные газы образуют соединения с кислородом и фтором.
- Не вступают в реакцию ни с каким элементом, поэтому их называют инертными.
Элементы знаний, умений и навыков: группы схожих элементов, щелочные металлы, галогены, инертные газы.
Периодический закон химических элементов
В природе все события и явления, все сущее подчиняется определенным законам. А химические элементы?

В 1869 г. русский ученый Д.И.Менделеев так сформулировал периодический закон химических элементов:
"Свойства простых веществ, а также формы и свойства соединений химических элементов находятся в периодической зависимости от величины атомных весов элементов".
Великий русский ученый. Открыл периодический закон. Предложил первоначальный удобный образец использования периодической таблицы химических элементов.
Открытию периодического закона предшествовал целый ряд законов и открытий, сделанных в предыдущие периоды в области естественных наук — химии, физики, биологии.
- Древнегреческий ученый Демокрит, живший в 460—370 гг. до нашей эры, высказал мысль о том, что все предметы в природе состоят из очень маленьких частиц — атомов.
- Центральноазиатский ученый-энциклопедист Ар-Рази (865—925 гг.) утверждал, что атомы делимы и включают пустоты и мельчайшие частицы, которые находятся в постоянном движении.
- Абу Райхан Беруни, живший и творивший в 979—1048 гг., выступая против ученых, которые считали атомы неделимыми частицами, признавал, что атомы — это мелкие делимые (но не бесконечно) частицы.
- Великий целитель из Бухары Лбу Али иби Сипа разработал классификацию всех известных в то время лечебных природных химических соединений по их составу и свойствам.
- Английский химик и физик Р. Бойль (1627—1691 гг.) объяснил сущность химических элементов как простейших химически неделимых веществ, которые входят в состав сложных соединений.
- В 1756 г. М.В.Ломоносов открыл закон сохранения массы.
- В 1801—1808гг. Ж.Л.Пруст открыл закон постоянства состава.
- В 1803—1804 гг. Дж.Дальтон развил атомно-молекулярное учение и ввел в науку понятие об атомной массе.
- В 1814 г. Й.Я.Берцелиус составил таблицу химических элементов на основе атомных масс 46 элементов.
- В 1817—1829 гг. И.В.Деберейнер выделил природные семейства химических элементов, расположив их в триады по схожести свойств.
- В 1852 г. Франкланд ввел в науку понятие валентности.
- В 1861 г. А.М.Бутлеров открыл теорию строения органических соединений.
- В 1817—1829 гг. И.В.Деберейнер предложил теорию триад на основе атомных масс элементов.
- В 1862 г. А. де Шанкуртуа создал таблицу химических элементов в форме цилиндра.
- В 1864 г. Ю.Л.Мейер (1830—1895 гг.) предложил таблицу, основанную на возрастании атомных масс элементов.
- В 1865 г. Дж.Ньюлэндс (1837—1898 гг.) предложил закон октав, основанный на эквивалентности элементов.
Периодический закон химических элементов — это закон природы и отражает связи, существующие в природе. Открытие этого закона позволило глубже изучить взаимосвязь между атомными массами и свойствами элементов. Были составлены таблицы ряда элементов на основе изменения валентности их оксидов, оснований и кислот (см. табл. 9).
Таблица 9
Зависимость свойств элементов от их атомных масс
| Символ элемента | Na | Mg | A1 | Si | P | S | Cl | Ar |
| Относительная атомная масса Ar | 23 | 24 | 27 | 28 | 31 | 32 | 35,5 | 40 |
|
Оксид с высшей валентностью Валентность элемента |
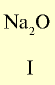 |
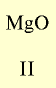 |
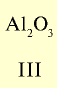 |
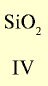 |
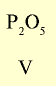 |
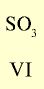 |
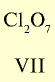 |
— — |
|
Летучее водородное соединение Валентность элемента |
— — |
— — |
— — |
 |
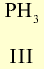 |
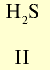 |
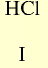 |
— — |
| Основания | NaOH | 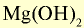 |
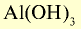 |
— | — | — | — | — |
| Кислоты | — | — | 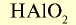 |
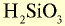 |
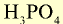 |
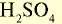 |
HC1 | — |
| Металлические свойства | уменьшаются→ | |||||||
| Неметаллические свойства | увеличиваются→ | |||||||
На основе теоретических и практических исследований Д.И.Менделеева было установлено, что с увеличением атомных масс элементов их свойства изменяются периодически. Анализ данных табл. 9 показывает следующие закономерности.
- — Металлические свойства элементов ослабевают.
- — Неметаллические свойства элементов усиливаются.
- — Металлические свойства элементов ослабевают и передаются амфотерным элементам и от них к слабым неметаллам.
- — Неметаллические свойства элементов постепенно усиливаются и обрываются на инертных газах.
- — Валентность элементов по кислороду начинается с единицы и возрастает периодически.
- — Валентность летучих водородных соединений уменьшается.
- — У гидроксидов элементов, начиная с щелочей, основные свойства ослабевают и передаются гидроксидам с амфотерными свойствами и от них сменяются кислотными свойствами, которые постепенно усиливаются.
Располагая элементы в ряд, начиная с водорода, по мере увеличения их атомных масс, можно увидеть, что начиная с лития каждый девятый элемент повторяет свойства первого.
Обратите внимание на данные табл. 10. Литий — элемент с самыми сильными металлическими свойствами. У бериллия эти свойства ослабевают и сменяются неметаллическими у бора. У следующих за бором элементов неметаллические свойства постепенно усиливаются, достигая наивысшей степени у фтора. Последнее место в этом ряду занимает инертный газ неон, который не проявляет ни металлических, ни неметаллических свойств.
Таблица 10
Периодичность, наблюдаемая у первых 18 элементов
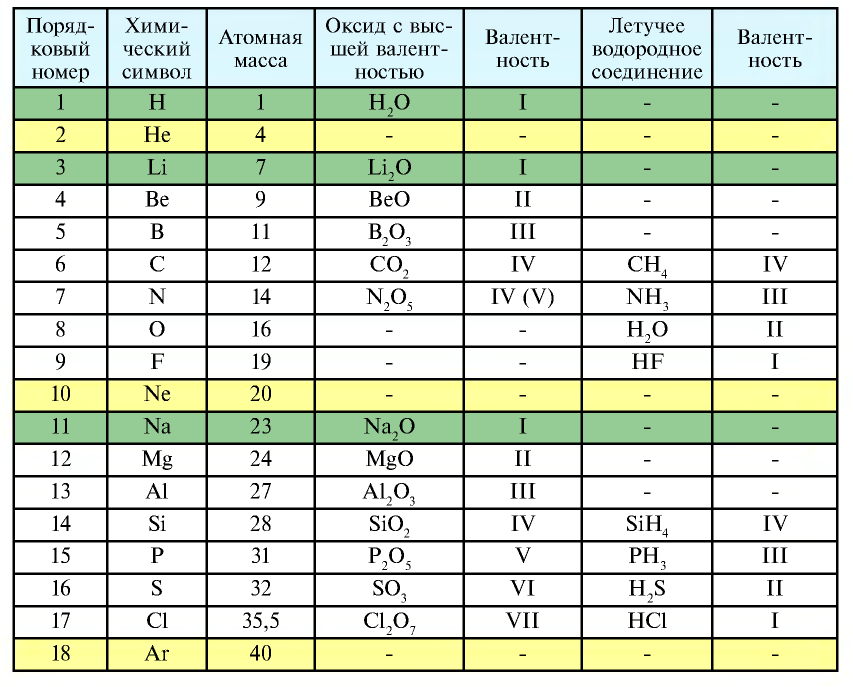
Следующий за неоном элемент натрий повторяет свойства лития. Он, как и литий, является щелочным металлом и проявляет сильные металлические свойства. Валентность его 1.
В ряду, начинающемся с одиннадцатого элемента — натрия, металлические свойства начинают ослабевать при переходе к магнию, валентность которого увеличивается на единицу (2) и который повторяет свойства бериллия. Металлические свойства еще более ослабевают у следующего элемента алюминия (валентность 3) и переходят в неметаллические свойства у слабого неметалла кремния, которые усиливаются у сильного неметалла хлора. Хлор повторяет свойства фтора. Аргон — инертный газ. Следующий за аргоном элемент калий — щелочной металл, который снова повторяет свойства лития и натрия. Следовательно, свойства элементов повторяются периодически.
Когда Д.И.Менделеев работал над обоснованием периодического закона, атомные массы многих элементов были определены неправильно, многие элементы еще не были открыты, что создавало определенные трудности. Так, атомная масса аргона Аг — 40. За аргоном поставлен калий К, имеющий атомную массу 39. Как щелочный металл он должен был бы находиться под щелочными металлами. Если эти элементы поменять местами в порядке возрастания атомных масс, то щелочной металл калий попал бы в группу инертных газов, а инертный газ аргон — в группу щелочных металлов. А это привело бы к нарушению периодического закона.
В соответствии с периодическим законом аргону (хотя его атомная масса больше, чем у калия) был присвоен порядковый номер 18, а калию — 19. Периодический закон не нарушился. Однако из таких перестановок стало ясно, что свойства химических элементов зависят от более важного, чем атомная масса, показателя. Что это за показатель? Д.И.Менделеев считал, что это — порядковый номер элемента. Из курса физики 7 класса мы знаем, что порядковые номера элементов численно равны количеству протонов в атомном ядре (зарядам ядер).
Действительно, впоследствии было установлено, что в атомном ядре аргона имеется 18, а в атомном ядре калия — 19 протонов.
В настоящее время периодический закон формулируется следующим образом.
- — Свойства химических элементов, а также образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда атомного ядра этих элементов.
Основываясь на зависимости свойств элементов от их атомных масс, были исправлены атомные массы ряда элементов. Так, атомная масса бериллия принималась равной 13,5, а его валентность — 3. Тогда бериллий пришлось бы поместить между углеродом и азотом под порядковым номером 6. Периодический закон нарушился бы. Поэтому Д.И.Менделеев предположил, что валентность бериллия должна быть равна 2 и он должен располагаться между литием (атомная масса 7) и бором (атомная масса 11), а атомная масса его должна быть равна примерно 9. Последующие исследования показали, что истинная атомная масса бериллия 9 и он действительно двухвалентный элемент.
Элементы знаний, умений и навыков: изменение металлических и неметаллических свойств элементов в зависимости от их атомных масс, первоначальная формулировка периодического закона, современная формулировка, переменная валентность.
Состав атомного ядра
Знаете ли вы элементы, у которых в атомном ядре нет нейтронов?
В курсах химии и физики 7 класса вы усвоили первоначальные понятия о строении ядра.

Английский ученый-физик. Исследовал строение атома, радиоактивность и радиоактивный распад. Предложил планетарную модель строения атома. Лауреат Нобелевской премии.
В 1911 г. английский физик Э. Резерфорд опроверг существующее мнение об атомах как о неделимых шарообразных частицах и предложил планетарную модель строения атома. Он пропустил а-лучи, испускаемые природными радиоактивными элементами, через очень тонкую металлическую пластинку. Большая часть а-частиц проскакивала через пластинку и, не изменяя своего направления, продолжала движение. Небольшая часть их изменяла направление движения под определенным углом. И лишь очень небольшая часть а-частиц полностью изменила направление движения (см. рис. 1).
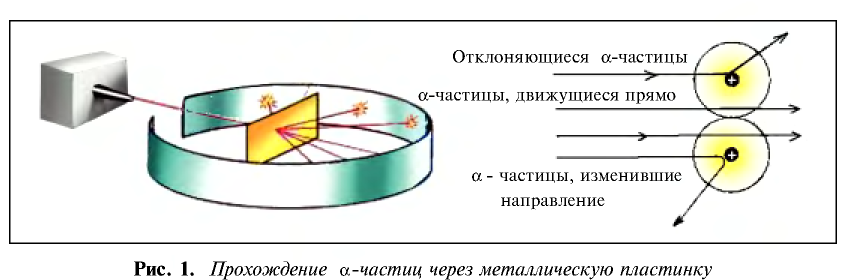
Исходя из результатов своих экспериментов, Э. Резерфорд пришел к следующим выводам.
- В центре каждого атома имеется положительно заряженное ядро.
- Вокруг ядра двигаются отрицательно заряженные частицы — электроны.
- Заряд атомного ядра численно равен порядковому номеру элемента.
- Число положительно заряженных протонов в ядре равно числу электронов.
При столкновении а-частиц, испускаемых радиоактивными элементами, с ядрами атомов, то есть при их бомбардировке а-частицами, из ядер выбрасываются протоны и нейтроны.
Протоны — это частицы с зарядом +1 и с массой, равной массе водородного атома, то есть 1. Они обозначаются символом 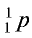 .
.
Нейтроны — это частицы с массой, равной 1, но лишенные заряда. Они обозначаются символом 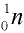 .
.
Вокруг атомного ядра двигаются отрицательно заряженные электроны, масса которых в 1840 раз меньше массы протонов и, следовательно, вычислить ее практически невозможно. Поэтому масса электронов принята равной 0, а заряд —1. Электроны обозначаются символом 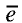 .
.
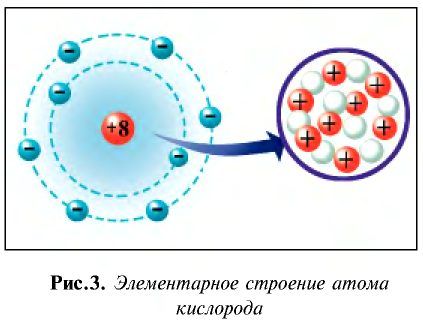
Мы знаем, что атомы — электронейтральные частицы, следовательно, можно считать, что количество протонов и электронов в них равно. Так, порядковый номер алюминия 13, значит, в его атомном ядре 13 протонов. Заряд ядра +13. Вокруг ядра двигаются 13 электронов, то есть сумма отрицательных зарядов также равна —13.
- Атом — мельчайшая химически неделимая частица вещества.
- Атом состоит из положительно заряженного ядра и ядерной оболочки с отрицательно заряженными электронами.
- Порядковый номер химического элемента численно равен заряду его атомного ядра.
- В ядре атома водорода имеется один протон с зарядом, равным +1, и массой 1 а.е.м. Вокруг ядра вращается один электрон.
- Масса атома равна сумме протонов и нейтронов в его ядре:
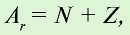
где N — число нейтронов, Z — порядковый номер элемента (число протонов).
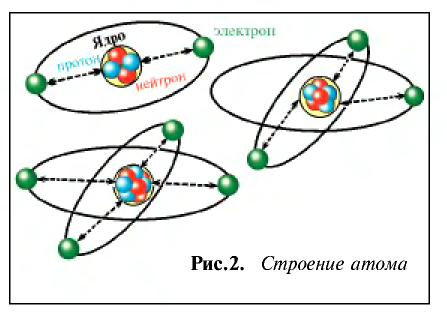
Таким образом, атом — электронейтральная частица, которая состоит из ядра, содержащего положительно заряженные протоны и нейтроны, лишенные заряда, а также из вращающихся вокруг ядра электронов, число которых равно числу протонов (рис. 2, 3).
Элементы знаний, умений и навыков: атом, ядро атома, протон, нейтрон, электрон, заряд ядра, порядковый номер.
Изотопы и изобары
Могут ли атомы водорода и гелия быть одинаковыми по атомным массам?
Вы уже ознакомились с сущностью таких понятий, как протон, нейтрон, атомная масса. У вас, естественно, может возникнуть вопрос: почему атомные массы элементов, определяемые суммой масс протонов и нейтронов, выражаются дробными числами, тогда как массы протонов и нейтронов близки к целым числам? Например, атомная масса хлора — 35,453, кислорода — 15,9994, водорода — 1,00787 и т.д. В действительности в природе нет ни одного атома хлора с такой массой. Согласно утверждению А.М.Бутлерова, если атомные массы элементов выражаются дробными числами, то и массы атомов, составляющих элементы, должны иметь среднее значение.
Атомы одного и того же элемента, отличающиеся друг от друга по массе, но имеющие одинаковые химические свойства, называются изотопами. Хотя массы таких атомов различны, они занимают одно и то же место в периодической таблице.
Почти все существующие в природе элементы представляют собой смесь изотопов, поэтому атомная масса элемента равна среднеарифметическому значению масс его изотопов (рис. 4).
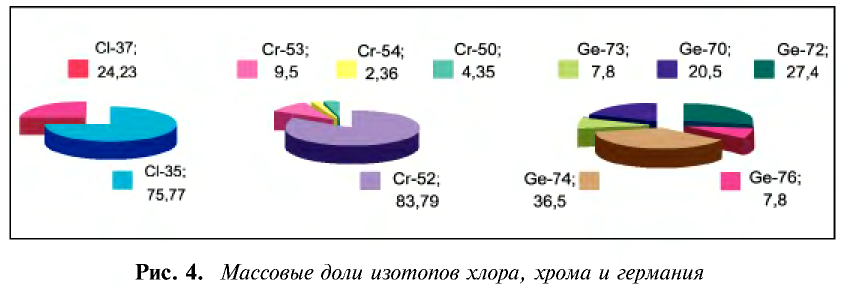
В природе существуют две разновидности атомов хлора, имеющих атомные массы, равные 35 и 37. Природный хлор является смесью этих атомов.
Химический элемент — это вид атомов, имеющих один и тот же заряд ядра, в котором число нейтронов может быть различным. Именно поэтому при одном и том же заряде ядра масса атома бывает различной.
- — Поскольку число протонов в ядре атома химического элемента одинаковое, а число нейтронов различное, разновидности атомов, различающиеся атомными массами, называются изотопами.
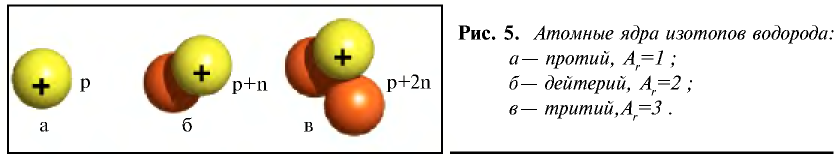
Так, у водорода имеется два естественных изотопа и еще один изотоп, образующийся в результате ядерных реакций (рис. 5).
Пример №8
Определите число протонов и нейтронов в ядрах изотопов аргона 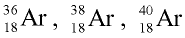 используемых в осветительных лампах.
используемых в осветительных лампах.
Решение:
1) заряд ядра изотопов аргона равен 18, значит, число протонов во всех изотопах будет по 18;
2) число нейтронов в ядре изотопа 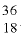 Аr найдем по формуле
Аr найдем по формуле
N = Ar- Z: N= 36 - 18 = 18;
отсюда 18 протонов и 18 нейтронов;
3) число нейтронов в ядре изотопа 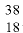 Ar:
Ar:
N = 38 — 18 = 20,
отсюда 18 протонов и 20 нейтронов;
4) число нейтронов в ядре изотопа 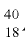 Ar:
Ar:
N = 40 - 18 = 22,
отсюда 18 протонов и 22 нейтрона.
Пример №9
Атомная масса природного бора равна 10,81, и он является смесью изотопов 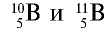 . Определите количество изотопов (%) в природном боре.
. Определите количество изотопов (%) в природном боре.
Решение.
Количество изотопа 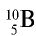 - х, а изотопа
- х, а изотопа 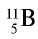 — (100 — х). Умножим 10 на х, 11 на (100 — х), сложим произведения и полученную сумму разделим на 100. Результат: 10,81.
— (100 — х). Умножим 10 на х, 11 на (100 — х), сложим произведения и полученную сумму разделим на 100. Результат: 10,81.
Решим задачу с помощью данного уравнения.
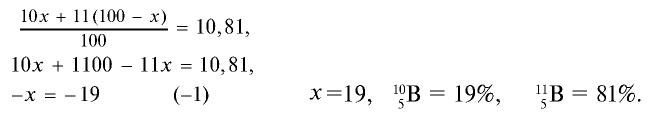
Эту задачу можно решить и диагональным способом:
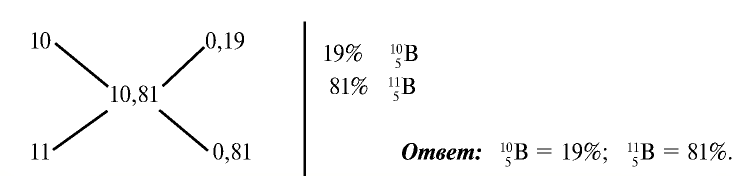
— Разновидности атомов, имеющих разные заряды ядер и одинаковые массы, называются изобарами. Например: 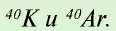
- — Элементы, в ядрах атомов которых число нейтронов одинаковое, а число протонов различное, называются изотопами.
В качестве примера изотонов можно привести:
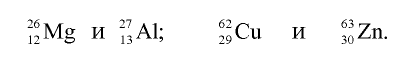
Элементы знаний, умений и навыков: изотопы, изобары, изотоны, протий, дейтерий, тритий, среднеарифметическое значение.
Строение электронных слоев атомов
По каким свойствам электроны располагаются на одном энергетическом уровне?
Вы познакомились со строением атомного ядра химических элементов и движением отрицательно заряженных электронов вокруг ядра. Каким образом электроны вращаются вокруг ядра? Не притягиваются ли отрицательно заряженные электроны к положительно заряженному ядру? Или они удаляются от ядра и расходятся?
Каждый электрон вращается вокруг ядра атома химического элемента на очень большой скорости и за счет возникновения центробежных сил не притягивается ядром.
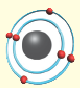
Электроны не просто вращаются вокруг ядра по определенной траектории, линии их вращения образуют вокруг ядра как бы электронное облако. Например, в атоме водорода электрон, вращаясь вокруг ядра, образует облако в виде шара, самая плотная часть которого находится на расстоянии 0,53 • 1010 м от ядра (рис. 6).
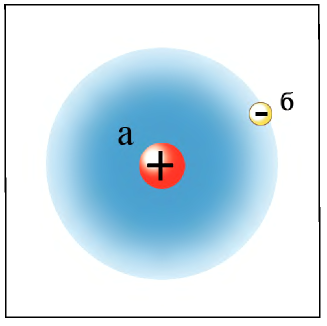
Рис. 6. Строение атома водорода, а — ядро, б — электронное облако
Количество энергии каждого электрона, вращающегося вокруг ядра, бывает различным. Чем ближе электрон к ядру, тем меньше его энергетический запас. Чем дальше электрон от ядра, тем больше его энергия. В зависимости от количества энергии электроны могут размещаться вокруг ядра, образуя электронные слои, или энергетические уровни.
Электроны с близкими значениями энергии составляют один энергетический уровень. Число энергетических уровней определяется номером периода или главным квантовым числом, которое обозначается буквой n. Первый период — один уровень, второй период — два уровня и т.д.
Главное квантовое число выражается либо целыми числами: 1, 2, 3, 4, 5, в..., либо прописными латинскими буквами: К, L, М, N, О, Р, Q.
Число электронов на энергетических уровнях определяется по формуле N=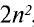 , где n — главное квантовое число.
, где n — главное квантовое число.
| Главное квантовое число: в цифровом обозначении | 1 | 2 | 3 | 4 | 5 | 6 |
| в буквенном обозначении | K | L | M | N | O | P |
Число электронов (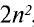 ) ) |
2 | 8 | 18 | 32 | 50 | 72 |
Отсюда видно, что в первом электронном слое находится не более двух, во втором — не более восьми электронов.
В электронных слоях элементов с порядковыми номерами 1—10 электроны распределяются в следующем виде.
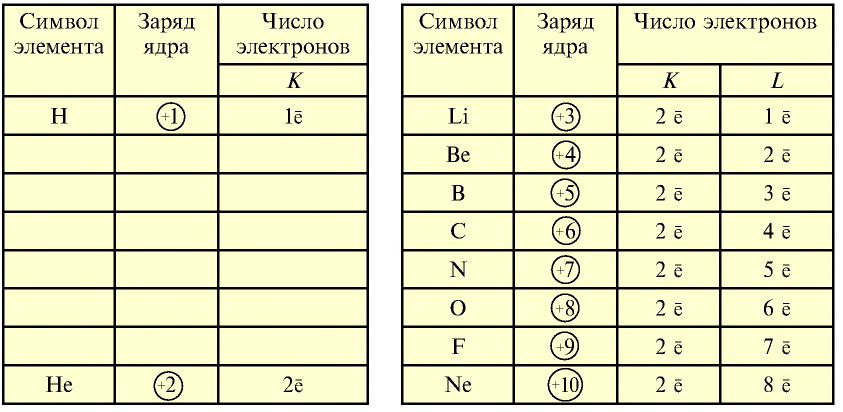
Распределение электронов по электронным слоям у элементов с порядковыми номерами 11—18 приводится ниже:
| Символ элемента | Порядковый номер | Заряд ядра | Число электронов | ||
| K | L | M | |||
| Na | 11 | +11 | 2 | 8 | 1 |
| Mg | 12 | +12 | 2 | 8 | 2 |
| А1 | 13 | +13 | 2 | 8 | 3 |
| Si | 14 | +14 | 2 | 8 | 4 |
| P | 15 | +15 | 2 | 8 | 5 |
| S | 16 | +16 | 2 | 8 | 6 |
| С1 | 17 | +17 | 2 | 8 | 7 |
| АR | 18 | +18 | 2 | 8 | 8 |
Вокруг ядра атома водорода вращается только один электрон, образуя облако в виде шара. Вокруг ядра атома гелия вращается два электрона, однако каждый из них вращается не только вокруг ядра, но и вокруг своей оси в противоположном друг к другу направлении. Такое вращение называется спином. По одной орбитали могут вращаться только два электрона с противоположными спинами. Третьего электрона быть не может.
Элементы знаний, умений и навыков: движение электрона вокруг ядра, строение электронного облака атома водорода, размещение электронов по слоям в зависимости от количества их энергии.
Энергетические подуровни
Какие формы вращения электронов наблюдаются на энергетических подуровнях?
Хотя электроны вращаются вокруг ядра атома размещаясь по определенным слоям, электроны каждого слоя отличаются от электронов других слоев по количеству энергии. В связи с этим неодинаковы по форме и образуемые электронами облака. По форме образуемых облаков электроны можно разделить на четыре группы: s-, р-, d-, f - электроны.
Порядок распределения электронов на энергетических подуровнях определяется формой образуемых электронами облаков.
Электроны, образующие облака шарообразной формы, являются s-электронами, и в каждом слое их насчитывается до двух (рис. 7).

Вокруг ядра атома бора вращается пять электронов, два из них находятся на первом энергетическом уровне, а три — на втором. Два электрона второго энергетического уровня вращаются по шарообразной орбитали, а третий электрон — по другой орбитали, то есть образует гантелеобразное облако вокруг ядра. Такие электроны называются p-электронами. Они образуют вокруг ядра три орбитали по осям х, у и z- На каждой орбитали располагается по два вращающихся противоположно друг к другу электрона, общее число которых равно шести (рис. 8).
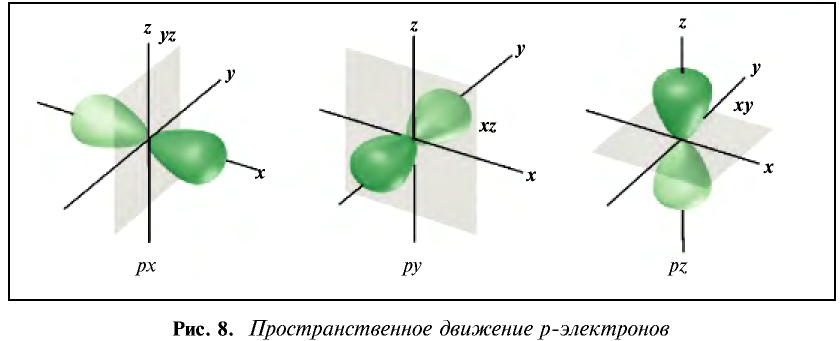
Пространственное движение электронов на каждом энергетическом уровне, то есть квантовое число, определяющее форму электронных облаков, называется орбитальным квантовым числом и обозначается буквой l.
Значения орбитального квантового числа составляют от 0 до n—I (табл. 11):
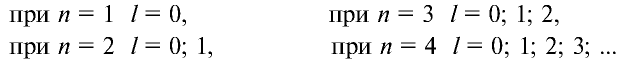
Таблица 11
Главные и орбитальные квантовые числа
| Главное квантовое число, n | 1 | 2 | 3 | 4 | ||||||
| Орбитальное квантовое число, l | 0 | 0 | 1 | 0 | 1 | 2 | 0 | 1 | 2 | 3 |
| Буквенное обозначение, l | s | s | p | s | p | d | s | p | d | f |
| Совместное написание n и l | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f |
Число электронов 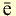 на орбитали 2(2l+1) на орбитали 2(2l+1) |
2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 14 |
Если главное квантовое число равно 1, то орбитальное квантовое число будет равно 0. Электроны на этом уровне называются s- электронами. Они вращаются на одной орбитали, которая имеет сферическую форму и называется s-орбиталью. s-орбитали изображают также в виде клеточки □.
Если главное квантовое число равно 2, электроны в нем характеризуются s- и р-орбитальными квантовыми числами. Как видно из рис. 8, по p-орбитали вращается группа электронов, совершающих перпендикулярные движения в трех направлениях, р-орбитали обозначают также в виде трех клеточек □□□.
Если главное квантовое число равно 3, то на этом энергетическом уровне электроны характеризуются s-, р- и d-орбитальными квантовыми числами. На с!-орбиталях вращается до 10 электронов, совершающих движения достаточно сложной формы (рис. 9). d-орбитали обозначают в виде пяти клеточек: □□□□□.
Точно так же на энергетическом уровне с главным квантовым числом, равным четырем, находятся s-, р-, d- и f-орбитали.
Клетки — графическое изображение магнитных квантовых чисел — называют орбиталями, на каждой из которых может совершать движения пара электронов с противоположными спинами. По мере увеличения порядкового номера элементы разделяются на s-, р-, d-, и f-элементы в зависимости от того, на какую орбиталь попадают притягиваемые электроны.
К s-элементам относятся водород, гелий, а также первые и вторые элементы(щелочные металлы), с которых начинаются периоды в периодической системе. Шесть элементов, расположенных в конце периодов (включая инертные газы), являются p-элементами. Десять элементов, находящихся в промежутке между начинающими период первыми и вторыми элементами и последними шестью, являются d -элементами. Лантаноиды и актиноиды — f элементы.
Таким образом, в периодической системе в настоящее время существует 14 .s-, 30 р-, 37 d- и 28 f-элементов.
Элементы знаний, умений и навыков: главное квантовое число, орбитальное квантовое число, s-электроны, p-электроны, d-электроны, f-электроны, энергетические уровни, численные и буквенные обозначения энергетических уровней, энергетические подуровни, s-элементы, p-элементы, d-элементы, f-элементы, графическое изображение магнитного квантового числа.
Распределение электронов по энергетическим уровням
На основе чего электроны распределяются по энергетическим уровням?
Электроны распределяются по подуровням, образуя вокруг ядра облака определенной формы, это распределение зависит от количества их энергий, то есть чем ближе электрон к ядру атома, тем меньше его количество энергии.
Электроны стремятся занять положение, соответствующее минимальному значению энергии, и располагаются вокруг ядра согласно принципу Паули. Как известно из предыдущих тем, наибольшее число электронов, которые могут расположиться в каждом электронном слое, определяется по формуле N= . Первый электронный слой, или слой К, находится на самом близком расстоянии от ядра атома и имеет n — 1. В соответствии с этим на данном слое совершают движение
. Первый электронный слой, или слой К, находится на самом близком расстоянии от ядра атома и имеет n — 1. В соответствии с этим на данном слое совершают движение 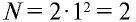 электрона. На втором электронном слое могут разместиться 8, на третьем — 18, а на четвертом — 32 электрона.
электрона. На втором электронном слое могут разместиться 8, на третьем — 18, а на четвертом — 32 электрона.
Во внешних электронных слоях всех элементов (кроме элементов I периода) находится не более восьми электронов. Внешние электронные слои инертных газов (за исключением гелия) заполнены восемью электронами, поэтому эти газы химически устойчивы.
На внешнем энергетическом уровне элементов основной подгруппы периодической таблицы число электронов равно номеру группы. Число электронов во внешнем слое элементов побочной подгруппы не превышает двух, при переходе от одного элемента ко второму притягиваемые электроны переходят из внешнего слоя во внутренний, так как внешний пополняется 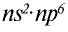 электронами, а присоединяющиеся электроны занимают подуровень nd.
электронами, а присоединяющиеся электроны занимают подуровень nd.
Так, атом марганца имеет следующее строение: Мn(+25) 2, 8, 13, 2, а его электронная формула: 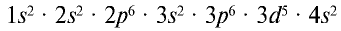 (табл. 12).
(табл. 12).
Согласно принципу Паули, в любом атоме не может быть двух электронов с одинаковыми квантовыми числами.
Следовательно, на каждой орбитали атома значение трех квантовых чисел — n, l, m (главного, орбитального и магнитного) может быть одинаковым, однако спиновые квантовые числа (s) различаются, то есть имеются электроны с противоположными спинами  .
.
Пополнение подуровней электронами было выяснено с помощью правила В.М.Клечковского (1900—1972 гг.), согласно которому, электроны заполняют энергетические подуровни в следующем порядке:
Порядок заполнения ячеек (клеточек) энергетических уровней электронами подчиняется правилу Хунда. Сначала происходит заполнение ячеек нечетными электронами. Например, после заполнения одной из ячеек 2р нечетными электронами к ним присоединяются электроны, которые составляют пару нечетным. Энергетические подуровни 2р заняты шестью электронами. Следующий электрон, согласно правилу Клечковского, переходит в энергетический подуровень 3s:
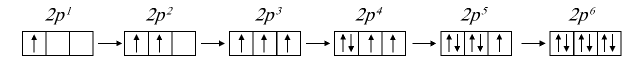
Таблица 12
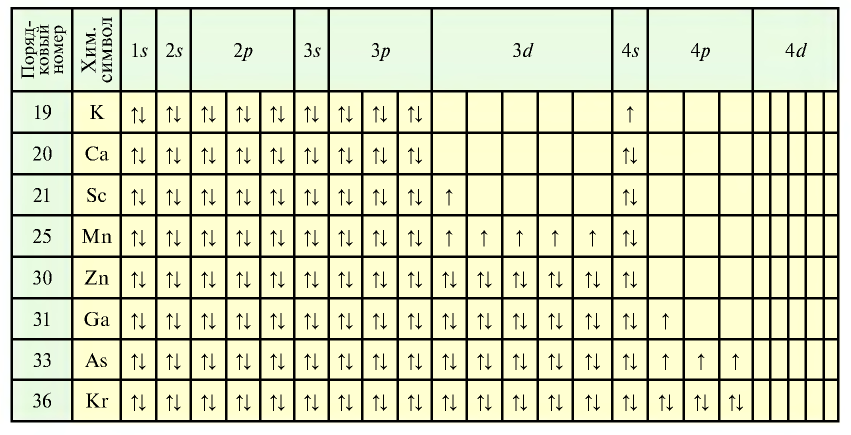
Порядок заполнения энергетических подуровней электронами (на примере элементов с порядковыми номерами 19—36)
Элементы знаний, умений и навыков: энергетическая ячейка, принцип Паули, правило Клечковского, правило Хунда, электронная формула.
Чем отличаются друг от друга большой и малый периоды
Все химические элементы в периодической таблице химических элементов распределены по периодам, рядам и группам. Горизонтальные ряды в периодической таблице образуют периоды, которые делятся на большие и малые. Каждый малый период включает один ряд, а каждый большой — два ряда. Период состоит из ряда химических элементов, начинающегося щелочным металлом и оканчивающегося инертным газом.
Запишем все существующие химические элементы в порядке возрастания их атомных масс. При этом наблюдается постепенное убывание металлических свойств, которые переходят к типичным неметаллам. Девятый после лития элемент натрий — типичный металл, который повторяет свойства лития (рис. 10).
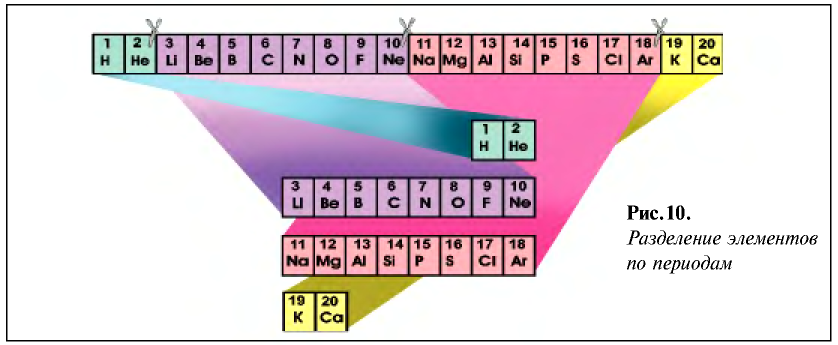
Девятый после натрия элемент калий — типичный металл, который повторяет свойства лития и натрия.
- — Горизонтальный ряд элементов, начинающийся щелочным металлом и оканчивающийся инертными газами, называется периодом.
В периодической системе химических элементов Д.И. Менделеева имеется семь периодов.
В первом периоде расположены только два элемента — водород и гелий. Второй и третий периоды содержат по восемь элементов.
- — Первый, второй, третий периоды называют малыми периодами.
- — Четвертый, пятый, шестой, седьмой периоды — большими.
Четвертый, пятый периоды содержат 18 элементов, шестой период — 32 элемента, седьмой период считается незавершенным. Каждый большой период состоит из двух рядов: четного и нечетного.
Схожие элементы, расположенные в одном вертикальном столбце, составляют группу элементов. В периодической системе имеется восемь групп, каждая из которых пронумерована вверху таблицы римскими цифрами.
- — Каждая группа разбита на две подгруппы. Подгруппы, в которые входят элементы и малых, и больших периодов, называются основными. Подгруппы, включающие только элементы больших периодов, называются побочными.
Элементы основных и побочных подгрупп записываются в клетки групп со смещением влево и вправо. Например, элементы вертикального столбца, состоящего из щелочных металлов первой группы, входят в основную подгруппу, а медь, серебро и золото — в побочную подгруппу.
Водород входит в первую группу периодической таблицы, так как валентность его в оксиде (воде) равна 1. Его можно расположить и в седьмую группу, то есть в вертикальном столбце, поскольку для заполнения внешнего энергетического уровня его атома недостаточно одного электрона.
Числа электронов во внешнем электронном слое атомов элементов основных подгрупп равны номерам их групп. Валентность этих элементов в высших кислородных соединениях также численно равна номерам их групп (за исключением кислорода и фтора).
Валентность элементов, образующих нелетучие водородные соединения, также периодически уменьшается с 4 до 1 (только у неметаллов).
В каждой основной подгруппе с возрастанием относительных атомных масс элементов их металлические свойства усиливаются, а неметаллические ослабевают. Например, в основной подгруппе первой группы металлические свойства, начиная с лития, усиливаются у элементов, стоящих под ним, и достигают наивысшего проявления у франция. У галогенов металлические свойства начинают ослабевать от фтора к йоду. Самый сильный неметалл — это фтор.
Элементы знаний, умений и навыков: период, малый период, большой период, группа, основная подгруппа, побочная подгруппа, изменение металлических и неметаллических свойств.
Строение атомов элементов малых периодов
Какие периоды считаются малыми?
Периоды, состоящие из одного ряда элементов, называются малыми. В первом периоде периодической таблицы химических элементов расположены водород и гелий. Атомы этих элементов имеют один энергетический уровень, в котором согласно формуле N=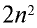 , содержится
, содержится 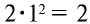 электрона.
электрона.
В ядре атома водорода имеется один протон, вокруг ядра вращается один электрон, совершая шарообразные движения.
У элементов второго периода атомы имеют два энергетических уровня. В первом электронном слое содержится два электрона, во втором 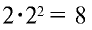 (обратите внимание на табл. 13).
(обратите внимание на табл. 13).
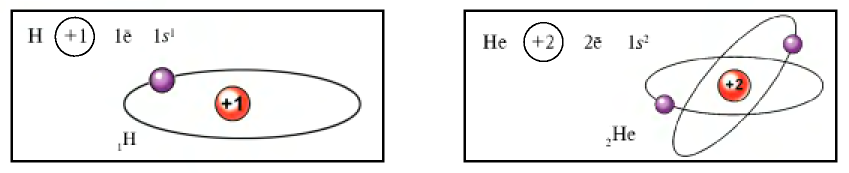
Таблица 13
Строение атомов элементов второго периода
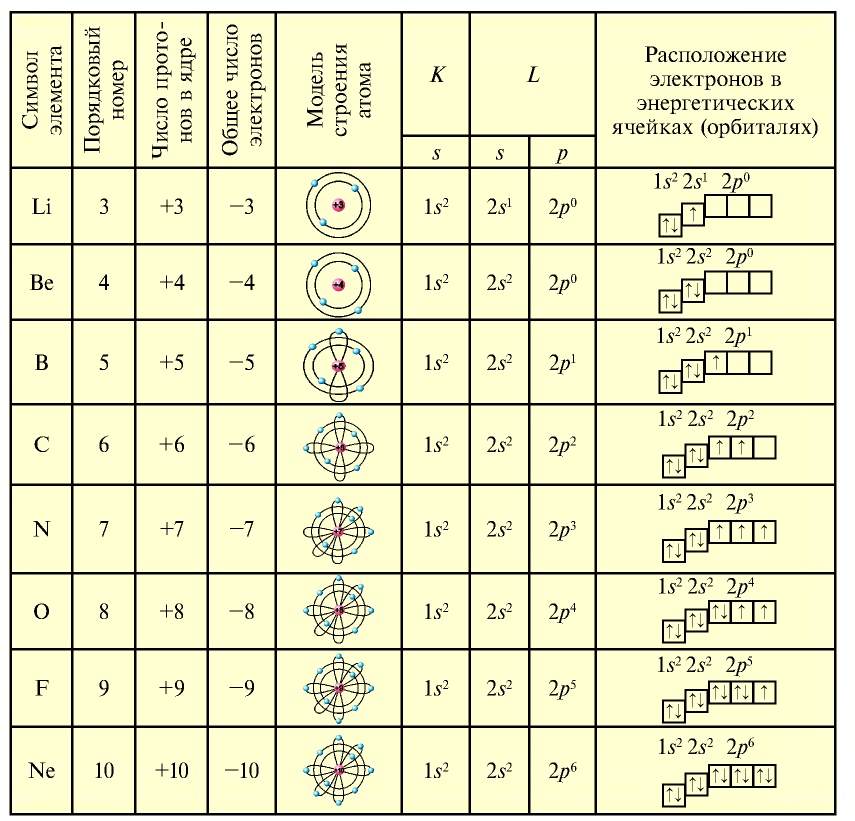
У элементов третьего периода атомы имеют три энергетических уровня. В первом имеется два электрона, во втором — до восьми и в третьем (внешнем) — до восьми электронов. Поскольку третий уровень внешний, 3d- энергетический подуровень не принимает электроны.
Обратите внимание на табл. 14.
Таблица 14
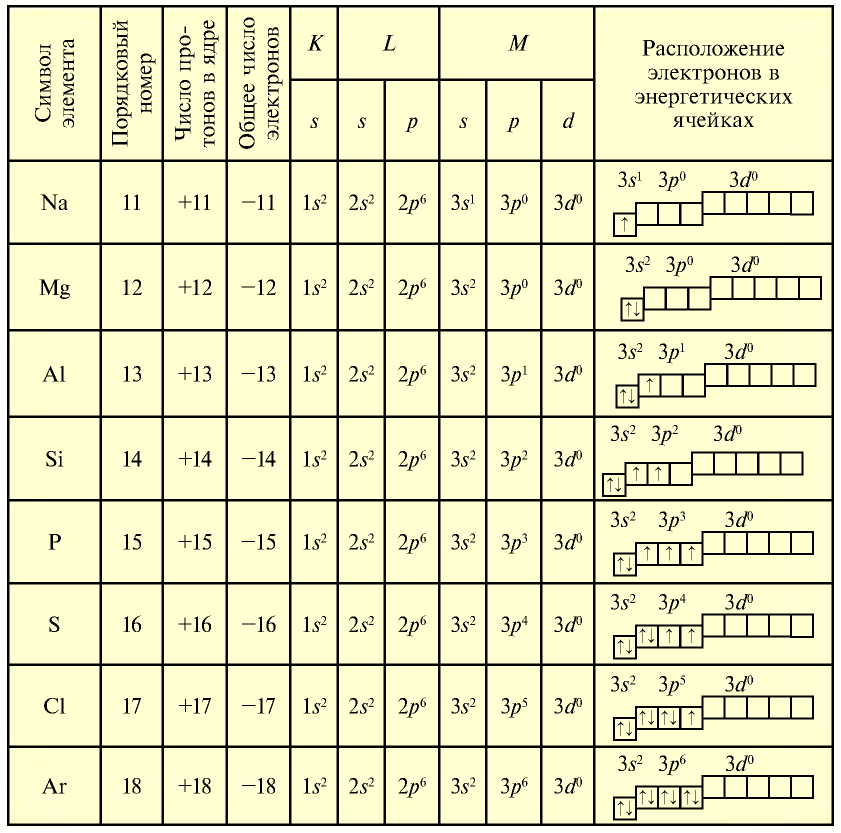
Строение атомов элементов третьего периода
Какие элементы являются элементами большого периода
Большие периоды характеризуются тем, что включают два ряда. Четвертый, пятый, шестой и седьмой периоды периодической таблицы являются большими. Четвертый и пятый периоды содержат по 18 элементов, и каждый период начинается щелочным металлом и оканчивается инертными газами. Атомы элементов четвертого периода имеют четыре энергетических уровня, четвертый из которых внешний: на первом энергетическом уровне находятся 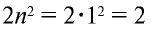 электрона, на втором
электрона, на втором 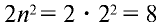 , на третьем
, на третьем  , на четвертом
, на четвертом 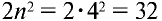 электрона.
электрона.
Первым в четвертом периоде стоит калий К с порядковым номером 19. В ядре его атома 19 протонов, а вокруг ядра вращаются 19 электронов, которые располагаются в следующем порядке:

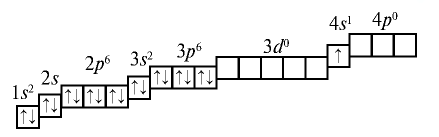
У кальция электроны заполняют s-энергетический подуровень внешнего энергетического уровня.

Начиная со скандия электроны заполняют не внешний энергетический уровень, а d-энергетический подуровень (орбиталь) третьего энергетического уровня:
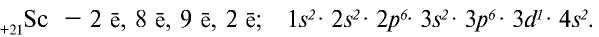
У цинка d-энергетический подуровень третьего энергетического уровня заполняется 10 электронами:
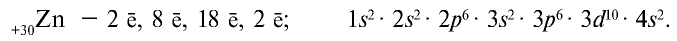
У цинка первый, второй, третий энергетические уровни заполнены. Внешний уровень может принять до восьми электронов.
Начиная с галлия присоединяемые электроны попадают на р-орбиталь внешнего энергетического уровня:
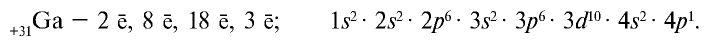
А у инертного газа криптона внешний энергетический уровень заполнен восемью электронами, и на этом четвертый период завершается:
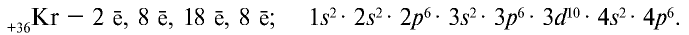
Первые два элемента четвертого периода являютсяs-элементами, следующие десять — d-элементами, последние шесть — p-элементами.
У элементов пятого периода электронные слои атомов заполняются элекронами так же, как и в четвертом периоде.
У элемента шестого периода — лантана (La) электроны заполняют f-орбиталь четвертого энергетического уровня. На f-орбитали находится 14 электронов. У церия —
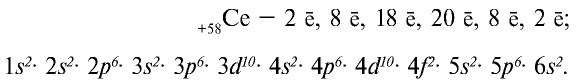
Указанное выше повторяется и у элементов седьмого периода.
Электронные формулы химических элементов можно записать и в сокращенном виде. Например, 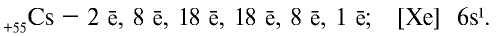
Элементы знаний, умений и навыков: умение записывать электронные формулы атомов элементов большого периода.
Описание элементов по их местоположению в периодической таблице и строению атомов
Можно ли определить место элемента в таблице по его свойствам?
Какие свойства элемента нужно знать для этого?
Периодическая таблица элементов имеет важное значение для получения подробных данных о каждом химическом элементе. Очень многие свойства элементов можно предсказать по их местоположению в периодической таблице. Например, элемент с порядковым номером 38 — стронций Sr. Он находится в четном ряду, в основной подгруппе второй группы пятого большого периода. В четном ряду большого периода находятся только металлы. Стронций — металл. Он расположен в начале большого периода после щелочного элемента рубидия Rb. Следовательно, его металлические свойства слабее, чем у рубидия. Поскольку стронций стоит в главной подгруппе второй группы под кальцием, его металлические свойства сильнее, чем у кальция.
Стронций образует двухвалентный оксид SrO, не образует летучие водородные соединения.
В ядре атома стронция имеется 38 протонов, а также 50 (88 — 38 = 50) нейтронов. В электронейтральном атоме вокруг ядра двигаются 38 электронов. Электронная формула атома стронция следующая:
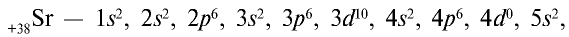 или сокращенно:
или сокращенно: 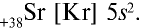
Во внешнем электронном слое атома стронция находятся два электрона. Это свидетельствует о том, что стронций — металл. По числу электронов во внешнем электронном слое можно определить, какой это элемент: металл или неметалл, его высшую валентность относительно кислорода, летучее водородное соединение и валентность элемента в этом соединении.
По мере возрастания порядковых номеров элементов в основной подгруппе, то есть в направлении сверху вниз, внешний электронный слой удаляется от ядра, а радиус атома увеличивается, хотя ионный заряд атомов остается без изменений. У элементов основной подгруппы первой группы (Li, Na, К, Rb, Cs) с возрастанием радиуса атомов электроны легче удаляются из внешнего электронного слоя. Способность внешнего слоя присоединять электроны ослабевает. Поэтому металлические свойства элементов усиливаются, а неметаллические свойства уменьшаются.
Открытие периодического закона оказало огромное влияние на дальнейшее развитие химической науки:
- появилась возможность осуществлять планомерный поиск новых химических элементов, существующих в природе;
- был открыт путь к познанию внутреннего строения атомов элементов и овладению атомной энергией;
- открытие периодического закона послужило главным фактором открытий XX в., сделанных в области физики и химии;
- явление радиоактивности, радиоактивные изотопы широко используются в технике, медицине, сельском хозяйстве.
На основе периодического закона Д.И. Менделеев исправил атомные массы очень многих элементов. Он оставил незаполненным значительное число клеток в периодической таблице для не открытых еще элементов, сумел предсказать свойства и атомные массы отдельных элементов и указал, где следует их искать. Так, среди других элементов Д.И. Менделеев особенно подробно описал свойства трех. Он назвал их экабором (скандий), экаалюминием (галлий) и экасилицием (германий). В течение последующих лет эти элементы были открыты: в 1875 г. французский ученый Лекок де Буабодран открыл галлий, скандинавский ученый Л. Нильсон в 1879 г. открыл скандий и немецкий ученый К. Винклер в 1886 г. открыл германий. Открытие этих элементов стало самым важным подтверждением периодического закона и точности предсказаний Д.И. Менделеева, сделанных на основе открытого им закона. В качестве примера сравним свойства открытого К. Винклером германия со свойствами экасилиция, предсказанного Д.И. Менделеевым (см.табл.15).
Таблица 15
Сравнение свойств германия и экасилиция
| Свойство | Экасилиций (предсказанный) | Германий (открытый) |
| Относительная атомная масса | 72 | 72,32 |
| Плотность, г/см3 | 5,5 | 5,47 |
| Сравнительная теплоемкость, Дж/кг-К | 4 | 4 |
Плотность  г/см3 г/см3 |
4,7 | 4,703 |
Точка кипения  °С °С |
100 | 86 |
Плотность ЕС14,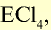 г/см3 г/см3 |
1,9 | 1,887 |
Периодический закон сыграл большую роль и при открытии ряда других элементов. При составлении периодической таблицы Д.И. Менделеев оставил незаполненными две клетки под марганцем. Неизвестные элементы Д.И. Менделеев назвал экамарганцем и двимарганцем. Это послужило толчком для открытия супругами В. и И. Ноддаками элемента рения.
Элементы знаний, умений и навыков: умение описать элементы по их местоположению в периодической таблице, значение периодического закона и периодической таблицы в открытии новых химических элементов.
Ядерные реакции
Каковы отличительные особенности ядерных и химических реакций?
В 1896 г. французский ученый А. Беккерель установил, что соли урана испускают лучи, схожие с рентгеновскими лучами. В 1898 г. нобелевские лауреаты, французские ученые Мария Склодовская-Кюри и Пьер Кюри с помощью радиометрического метода открыли элементы радий Ra и полоний Ро. Эти элементы испускали лучи, как и уран, причем их излучение было более интенсивным, чем у урана.
- Явление испускания ядрами неустойчивых изотопов химических элементов различных частиц и лучей и превращения этих ядер в другие называется радиоактивностью.
- Слово "радиоактивность" в переводе с латинского означает "активно испускающий лучи " ("радио "-испускаю лучи, "актавус " -активно).
- Элементы, все изотопы которых радиоактивны, называются радиоактивными элементами.
В 1899 г. Э. Резерфорд во время изучения радиоактивных лучей выделил их в три группы: 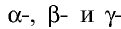 лучи. Он доказал, что а-лучи являются ядрами атомов гелия. В том же году А.Беккерель доказал, что
лучи. Он доказал, что а-лучи являются ядрами атомов гелия. В том же году А.Беккерель доказал, что  -лучи представляют собой поток электронов. В 1900 г. французский ученый Р. Уилард выявил
-лучи представляют собой поток электронов. В 1900 г. французский ученый Р. Уилард выявил  лучи и доказал, что
лучи и доказал, что  лучи — это электромагнитные волны.
лучи — это электромагнитные волны.
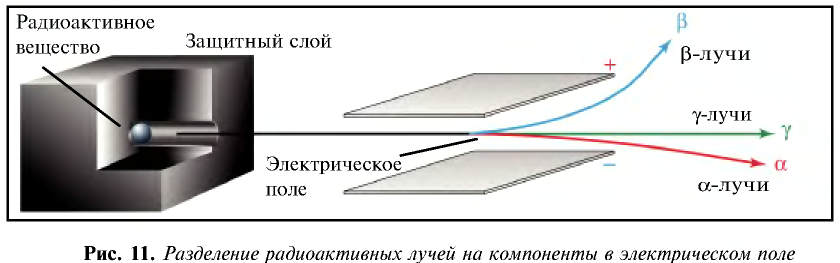
Деление радиоактивных лучей на  лучи было признано всеми учеными. В магнитном поле эти лучи двигаются в направлениях, которые указаны на рис. 11.
лучи было признано всеми учеными. В магнитном поле эти лучи двигаются в направлениях, которые указаны на рис. 11.
Испуская радиоактивное излучение, радиоактивные элементы превращаются в изотопы других элементов или в изотоп самого элемента. Такие явления называются ядерными реакциями, и в результате этих реакций выделяется огромное количество энергии.
Распад радиоактивных элементов в ядерных реакциях происходит следующими четырьмя путями:
а-распад. Зная, что а-частицы — это ядра атомов гелия, можно понять, что в результате этого распада масса атома радиоактивного элемента уменьшается на четыре, а заряд— на две единицы:
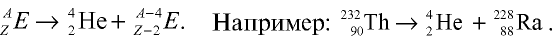
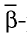 распад. При
распад. При 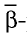 распаде радиоактивного элемента нейтрон в ядре атома элемента превращается в протон, и из ядра выделяется электрон. В результате масса ядра атома остается неизменной, а заряд увеличивается на одну единицу:
распаде радиоактивного элемента нейтрон в ядре атома элемента превращается в протон, и из ядра выделяется электрон. В результате масса ядра атома остается неизменной, а заряд увеличивается на одну единицу:
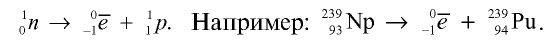
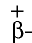 распад.
распад. 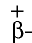 част и па называется позитроном, и ее масса равна массе электрона, а заряд численно равен заряду электрона, но имеет противоположный знак
част и па называется позитроном, и ее масса равна массе электрона, а заряд численно равен заряду электрона, но имеет противоположный знак 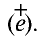 При
При 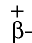 распаде протон в ядре атома радиоактивного элемента превращается в нейтрон, и из ядра выделяется позитрон.
распаде протон в ядре атома радиоактивного элемента превращается в нейтрон, и из ядра выделяется позитрон.
В результате масса ядра атома элемента не изменяется, а заряд уменьшается на одну единицу:
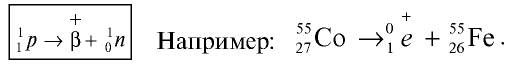
Распад в результате падения электрона на ядро
Ядро радиоактивного элемента захватывает электрон с близкого к ядру электронного слоя (падение электрона на ядро), в результате чего электрон присоединяется к протону и превращается в нейтрон:
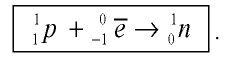
В результате этого масса ядра элемента не изменяется, а заряд уменьшается на одну единицу:
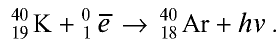
Следовательно, в результате падения электрона на ядро образуется изобар этого элемента.
Искусственная радиоактивность
В связи с неустойчивостью атомных ядер радиоактивных элементов постоянно происходит их самопроизвольный распад и образуются ядра других элементов.
Ядра атомов нерадиоактивных элементов устойчивы, и превращение их в другие элементы осуществляется специальными методами. В средние века вплоть до XVII в. алхимики не раз предпринимали попытки превратить металл в золото. Однако они не знали, что превращение одного элемента в другой с помощью химических процессов осуществить невозможно.
Открытие периодического закона, познание строения атома, радиоактивности и ядерных реакций обусловили появление возможностей превращения одних элементов в другие.

Польский ученый химик и физик. Одна из основателей радиоактивного учения. Открыла элементы полоний и радий. Дважды лауреат Нобелевской премии в области химии и физики.
В 1934 г. Фредерик Жолио-Кюри и Ирен Кюри открыли искусственную радиоактивность. Сущность этого открытия состояла в том, что при бомбардировке ядер атомов нерадиоактивных элементов различными частицами получаются радиоактивные изотопы другого элемента.
Например, бомбардировкой атома алюминия а-частицами получают радиоактивный изотоп фосфора:
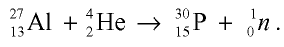
При бомбардировке атома бора а-частицами получен радиоактивный изотоп азота 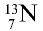 :
:
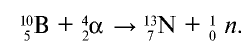
Изотоп 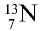 , распадаясь, образует изотоп
, распадаясь, образует изотоп 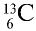 :
:
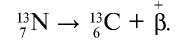
Ученые нашей страны У.А. Арипов и М. Муминов своими научными исследованиями внесли заметный вклад в область изучения ядерных реакций. В настоящее время при Академии наук Республики Узбекистан работает Институт ядерной физики.
Элементы знаний, умений и навыков: радиоактивность, радиоактивный элемент, искусственная радиоактивность, 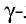 лучи,
лучи, 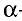 -лучи,
-лучи, 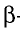 -лучи, ядерные реакции, формулы ядерных реакций,
-лучи, ядерные реакции, формулы ядерных реакций, 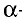 -распад,
-распад,  -распад,
-распад,  -распад, падение электрона на ядро.
-распад, падение электрона на ядро.
Пример №10
Определите электронное строение элемента с порядковым номером 23 и семейство, к которому он относится, по его местоположению в периодической таблице.
Решение.
Элемент с порядковым номером 23 — это ванадий, расположенный в побочной подгруппе пятой группы в четвертом периоде периодической таблицы. Электронное строение ванадия следующее:
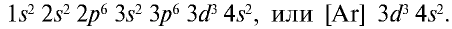
Следовательно, ванадий относится к семейству d-элементов.
Пример №11
Один из элементов образует высший оксид состава 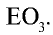 В летучем водородном соединении этого элемента содержится 5,88 % водорода. Определите относительную атомную массу элемента.
В летучем водородном соединении этого элемента содержится 5,88 % водорода. Определите относительную атомную массу элемента.
Решение:
1) если 5,88 % содержания элемента составляет водород, то остальные (100—5,88 = 94,12) 94,12 % приходятся на массовую долю элемента;
2) зная составной компонент водородного соединения, можно найти эквивалентность элемента:
если 94,12 г элемента соединяются с 5,88 г водорода, то Е г элемента соединятся с 1 г водорода.
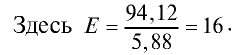
Итак, эквивалентность элемента равна 16. Формуле высшего оксида соответствует формула летучего водородного соединения Н2Е. Следовательно, валентность элемента в водородном соединении равна двум.
Умножив эквивалентность на валентность, найдем значение относительной атомной массы: 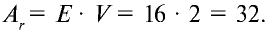 Этот элемент — сера, ее высший оксид
Этот элемент — сера, ее высший оксид  и летучее водородное соединение
и летучее водородное соединение  .
.
Периодическая система химических элементов Д. И. Менделеева
Химию невозможно представить без периодического закона и периодической системы химических элементов. Периодический закон помогает объяснить многие химические факты, прогнозировать и обосновывать различные закономерности в мире веществ. Этот закон иллюстрирует периодическая система элементов. Она содержит важнейшие сведения о них, служит незаменимым путеводителем по неорганической химии не только для ученика или студента, но и для опытного химика. Ваше первое знакомство с периодической системой состоялось в 7 классе. Вы умеете предсказывать химический характер элемента, максимальное значение его валентности по положению элемента в периодической системе. Отныне сфера ее использования для вас расширится.
Благодаря открытиям в области строения атома периодический закон получил мощную теоретическую поддержку. Выяснилось, что химический характер элементов и свойства веществ обусловлены составом электронных оболочек атомов. Вы научились определять количество электронов в атомах и простых ионах, а скоро сможете давать полную характеристику строения атомов и ионов важнейших элементов.
Развитие представлений о химическом элементе
Древнегреческие философы считали, что все вещества состоят из четырех элементов-первоначал: огня, воздуха, воды и земли. По их мнению, эти «стихии» являются носителями определенных качеств, присущих веществам, — теплоты, холода, влажности и сухости. Таких взглядов придерживались и алхимики.
Термин «элемент», приближающийся по смыслу к современному, появился в XVII ст. Английский химик Р. Бойль назвал элементом то, что является пределом разложения вещества. Если бы мы жили тогда, то сказали бы, что элемент — это атом. Такой смысл вкладывал в слово «элемент» и М. В. Ломоносов.
Французский ученый A.-Л. Лавуазье считал элементом простое вещество, так как его нельзя разложить на другие вещества. Однако ныне известно, что не разлагаются и немало сложных веществ, например оксиды 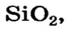
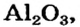 а простое вещество озон легко превращается в другое простое — кислород:
а простое вещество озон легко превращается в другое простое — кислород: 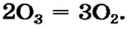 Не различал элемент и простое вещество также английский ученый Дж. Дальтон. Позже Д. И. Менделеев высказал такую мысль: «Простое тело является веществом... , а под элементом следует понимать составные части простых и сложных тел».
Не различал элемент и простое вещество также английский ученый Дж. Дальтон. Позже Д. И. Менделеев высказал такую мысль: «Простое тело является веществом... , а под элементом следует понимать составные части простых и сложных тел».
В начале XX ст. ученые установили, что атом состоит из положительно заряженного ядра и отрицательно заряженных электронов. С тех пор элемент стали определять как вид атомов с определенным зарядом ядра. В наше время, характеризуя качественный состав воды, любой из вас скажет, что это вещество образовано двумя видами атомов (с зарядами ядер +1 и +8), или же двумя элементами — Гидрогеном и Оксигеном.
Первые попытки классификации химических элементов
В период становления науки химии ученые пытались «навести порядок» среди нескольких десятков известных в то время химических элементов, осуществить их классификацию.
Классификация — это распределение объектов (предметов, организмов, явлений и т. п.) по группам или классам в зависимости от их общих признаков.
В химии существуют классификации элементов, веществ, химических реакций.
Классификацию простых веществ, на основании которой позже возникла первая классификация химических элементов, предложил в конце XVIII ст. A.-Л. Лавуазье. Он разделил простые вещества на металлы и неметаллы (ныне химические элементы делят на металлические и неметаллические). Такая классификация была слишком общей и несовершенной. Некоторые простые вещества (например, графит, теллур) по одним свойствам напоминали металлы, а по другим — неметаллы. Однако разделение простых веществ, а также химических элементов на две большие группы сыграло важную роль в развитии химии.
Среди металлов и среди неметаллов были очень похожие вещества. Ученые объединили их в отдельные группы. Простые вещества каждой группы получили такие общие названия: щелочные металлы, щелочноземельные металлы, галогены, инертные газы.
Щелочные металлы
Это — литий, натрий, калий, рубидий, цезий, франций. Они легкие, мягкие (рис. 45), легкоплавкие. В химических реакциях щелочные металлы проявляют высокую активность (рис. 46). На воздухе в обычных условиях они быстро взаимодействуют с кислородом, водяным паром, другими веществами. Поэтому их хранят в керосине в герметически закрытых сосудах (рис. 47) или в ампулах, из которых удален воздух. Указанные металлы назвали щелочными, так как они реагируют с водой с образованием щелочей — растворимых оснований с общей формулой 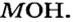

Щелочноземельные металлы. К этим веществам относят магний, кальций, стронций, барий, радий. Они напоминают щелочные металлы, реагируют со многими веществами, но не так энергично. Продуктами их реакций с водой являются щелочи* 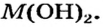
* - Магний гидроксид к щелочам не относят.
Галогены
Так называют наиболее активные неметаллы — фтор, хлор, бром, иод. Эти простые вещества состоят из двухатомных молекул: 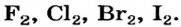 В обычных условиях фтор и хлор — газы, бром — жидкость, а иод — твердое вещество. Наиболее активным среди галогенов и других неметаллов является фтор. Галогены реагируют с водородом с образованием соединений, имеющих формулы
В обычных условиях фтор и хлор — газы, бром — жидкость, а иод — твердое вещество. Наиболее активным среди галогенов и других неметаллов является фтор. Галогены реагируют с водородом с образованием соединений, имеющих формулы 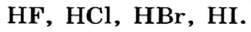 Эти соединения хорошо растворяются в воде; их водные растворы являются кислотами. Галогены взаимодействуют со многими металлами. Продукты таких реакций — соли. Поэтому название «галогены» происходит от греческого слова halas — соль.
Эти соединения хорошо растворяются в воде; их водные растворы являются кислотами. Галогены взаимодействуют со многими металлами. Продукты таких реакций — соли. Поэтому название «галогены» происходит от греческого слова halas — соль.
Инертные газы
Эти простые вещества были открыты во второй половине XIX ст. Они получили такое название, поскольку не вступали в химические реакции. К инертным газам относятся гелий, неон, аргон, криптон, ксенон, радон. Они состоят не из молекул, как другие газы, а из атомов.
Элементы, от которых происходят рассмотренные простые вещества, имеют аналогичные общие названия: щелочные элементы, щелочноземельные элементы, галогены, инертные элементы.
В конце 20-х годов XIX ст. немецкий ученый В. Деберейнер рассортировал часть подобных элементов на тройки, или триады:
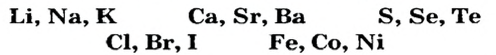
В первой триаде оказались щелочные элементы, во второй — щелочноземельные, в четвертой — галогены. Разместив элементы в триадах по увеличению относительных атомных масс, Деберейнер обнаружил интересную закономерность: полусумма относительных атомных масс двух крайних в триаде элементов приблизительно или точно равнялась относительной атомной массе «центрального» элемента. Покажем это для первой триады: 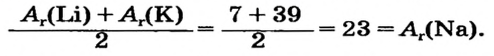
Кроме того, свойства простого вещества и соединений этого элемента оказались «промежуточными» по сравнению со свойствами простых веществ и соединений двух соседних элементов.
Сформировать триады из остальных элементов Деберейнеру не удалось.
В 1865 г. английский ученый Дж. Ньюлендс разместил известные в то время элементы в ряд по возрастанию относительных атомных масс:
Он заметил, что во многих случаях каждый восьмой элемент подобен элементу, от которого производился отсчет. Похожими были и соответствующие простые вещества. (Попробуйте в этом убедиться.) Такая особенность свойственна звуковому ряду в музыке: каждые первая и восьмая ноты имеют одинаковые названия и сходное звучание.

Закономерность, обнаруженную Нью-лендсом, назвали правилом октав. Она соблюдалась в начале ряда элементов, но далее нарушалась (рис. 48). Например, , Хром в значительной мере отличался от Алюминия, а Манган и Феррум были совсем не похожи на Фосфор и Сульфур соответственно. Число 8, как свидетельствует история химии, считалось в то время магическим, но после выяснения строения атома получило научное обоснование.
Более удачную попытку классификации химических элементов осуществил в 1864 г. немецкий химик Л. Мейер. Он предложил таблицу, в которой разместил элементы по возрастанию относительных атомных масс и в соответствии с их валентностью. Однако из-за того что значения атомных масс и валентности были для некоторых элементов ошибочными или вообще неизвестными, не все элементы вошли в созданную Мейером таблицу.
Описанные попытки ученых объединить химические элементы послужили основой для их общей классификации. Вскоре Д. И. Менделеев сообщил о созданной им периодической системе химических элементов.
выводы:
Представления о химическом элементе изменялись с развитием науки. Ранее не различали химический элемент и простое вещество. Были известны несколько групп подобных простых веществ: щелочные металлы, щелочноземельные металлы, галогены. Позже были открыты инертные газы.
Первые попытки классификации химических элементов охватывали лишь их часть и не имели серьезного научного обоснования.
Создание периодической системы химических элементов
Проблема классификации химических элементов увлекла в 60-е годы XIX ст. Д. И. Менделеева. Он искал закономерности и взаимосвязи, которые бы охватывали все элементы, а не только их часть.
В то время было известно 63 химических элемента. На каждый из них ученый завел «досье» — карточку, в которую записал относительную атомную массу элемента, значение его валентности, сведения о простом веществе и соединениях.
Менделеев считал важнейшей характеристикой элемента массу его атома. Разместив элементы в ряд по увеличению относительных атомных масс (рис. 49), ученый (как и раньше Ньюлендс) заметил, что через определенные интервалы в нем встречаются элементы, которые образуют сходные простые вещества и соединения.
1 - Инертные газы были открыты позже.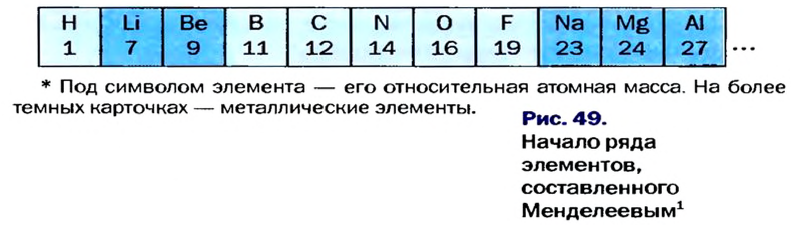
Ряд начинается с неметаллического элемента Гидрогена. За ним следуют металлические элементы Литий и Бериллий, затем — неметаллические элементы от Бора до Флуора, далее — снова металлические элементы и т. д. Таким образом, характер элементов в ряду периодически повторяется. Аналогичные выводы можно сделать относительно максимальных значений валентности элементов, состава и химических свойств высших оксидов и т. п.
Менделеев разделил составленный ряд на несколько фрагментов (рис. 50), каждый из которых начинался с типичного металлического элемента (щелочного) и заканчивался типичным неметаллическим элементом (галогеном). При этом ученый обнаружил новую закономерность: в каждом фрагменте характер элемента соседних тов. свойства их простых веществ, а также фрагмента состав и свойства соединений изменяются постепенно.
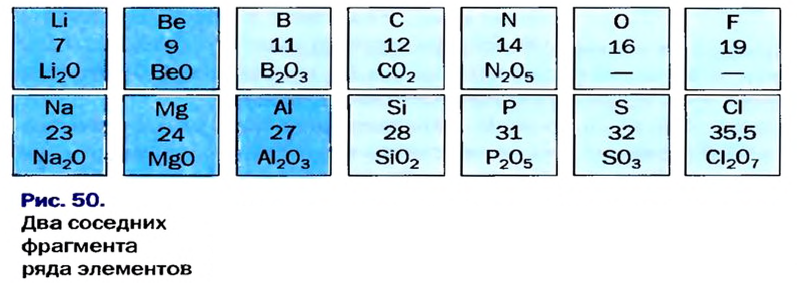
Рассмотрим один из фрагментов ряда элементов (рис. 51). На первом месте в нем находится щелочной элемент Натрий. Он одновалентен, образует основный оксид 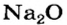 и щелочь
и щелочь 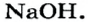 За Натрием следует двухвалентный Магний, от которого происходят основный оксид
За Натрием следует двухвалентный Магний, от которого происходят основный оксид 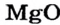 и малорастворимое основание
и малорастворимое основание 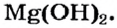 Третье место занимает трехвалентный Алюминий, оксид и гидроксид которого амфотерны. Следующие элементы — неметаллические: Силиций, Фосфор, Сульфур и Хлор. Максимальные значения валентности этих элементов возрастают от 4 до 7, а кислотные свойства оксидов и соответствующих кислот усиливаются.
Третье место занимает трехвалентный Алюминий, оксид и гидроксид которого амфотерны. Следующие элементы — неметаллические: Силиций, Фосфор, Сульфур и Хлор. Максимальные значения валентности этих элементов возрастают от 4 до 7, а кислотные свойства оксидов и соответствующих кислот усиливаются.
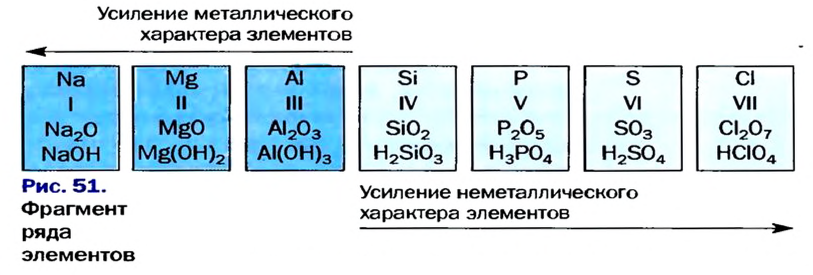
Е каждом фрагменте металлический характер элементов усиливается справа налево, а неметаллический характер — слева направо.
После того как ряд элементов был разделен на фрагменты, Менделеев разместил второй фрагмент под первым, третий — под вторым и т. д. Получилась таблица, а в ее столбцах оказались подобные элементы: щелочные, щелочноземельные, галогены и др. Так в 1869 г. была создана периодическая система химических элементов. Подробно о ней будет идти речь в следующем параграфе.
Д. И. Менделеев назвал ряд элементов, составленный по возрастанию атомных масс, естественным рядом, т. е. таким, который существует независимо от человека в самой природе.
Периодический закон:
Создав периодическую систему химических элементов, Д. И. Менделеев в 1871 г. сформулировал закон периодичности, или периодический закон:
- свойства химических элементов, простых веществ, а также состав и свойства соединений находятся в периодической зависимости от значений атомных масс.
Периодичность в химии — это повторение (но не копирование) химического характера элементов, особенностей строения атомов, состава, строения и свойств веществ через определенное количество элементов в их естественном ряду.
Во времена Менделеева уровень развития науки не был достаточно высоким. Поэтому ученому не удалось раскрыть причину периодичности. Но он верил, что это обязательно произойдет. Ныне общеизвестно, что периодичность в мире химических элементов обусловлена электронным строением атомов.
Менделеев не ограничился фактическим материалом, которым располагала химическая наука. В случае нарушения элементом общей закономерности в естественном ряду он советовал химикам проверить значение его атомной массы. Ученый предсказал не только открытие новых элементов, но и значения их атомных масс, свойства простых веществ, существование соединений в природе и т. п.
Следует заметить, что положение нескольких элементов в естественном ряду не соответствует возрастанию относительных атомных масс. Менделеев разместил, например. Теллур перед Иодом, хотя масса атома Теллура немного больше. Ученый принял во внимание, что простое вещество иод является более активным неметаллом, чем простое вещество теллур, тоже неметалл. Значит, неметаллический характер сильнее выражен у элемента Иода, и его место — после Теллура.
В своей периодической системе Д. И. Менделеев оставил пустые клетки и считал, что они должны принадлежать еще не открытым, но существующим в природе элементам. Вскоре был открыт первый элемент, предсказанный Менделеевым (его назвали Галлием), затем — второй (Скандий), третий (Германий). Это было триумфом периодического закона, который проявил не только обобщающую, но и предсказательную силу.
Это интересно. Периодическую систему еще называют "великим обобщением" элементов.
Периодический закон — один из основных законов природы. Он раскрывает единство химических элементов и взаимосвязь между ними. Изучая химию, вы будете часто обращаться к этому закону, находить новые факты, которые подтверждают его, и, пользуясь им, предсказывать химические свойства простых и сложных веществ, возможности их химических превращений.
Выводы:
Расположив химические элементы в ряд по возрастанию относительных атомных масс, Д. И. Менделеев открыл периодический закон. Ученый сформулировал его так: свойства химических элементов, простых веществ, а также состав и свойства соединений находятся в периодической зависимости от значений атомных масс.
Периодический закон — один из основных законов природы, который раскрывает единство химических элементов и взаимосвязь между ними.
О чём расскажет периодическая система
Периодическая система — источник сведений о химических элементах. Периодическая система химических элементов является неотъемлемым атрибутом школьного химического кабинета. Ее можно найти в любом учебнике по химии. Периодическую систему используют ученики, студенты, преподаватели, научные работники, ведь она содержит важнейшие сведения о химических элементах. Зная положение в ней элемента, можно охарактеризовать строение его атома, предсказать свойства простого вещества, различных соединений.
Периодическая система имеет форму таблицы. Поэтому ее называют табличным выражением периодического закона. Существует два основных варианта системы — короткий (форзац I) и длинный (приложение). Короткий вариант используют чаще; он более удобный и компактный.
Каждый элемент находится в определенной клетке периодической системы (исключение — Гидроген). Вам известно, что в ней записана такая информация:
- символ элемента;
- его порядковый номер;
- название элемента;
- значение относительной атомной массы;
- название простого вещества, если оно отличается от названия элемента.
Это интересно. Известны несколько сотен вариантов и разновидностей периодической системы химических элементов.
Добавим, что в клетках короткого варианта периодической системы содержатся данные об электронном строении атомов (оно будет рассмотрено позже).
В клетках длинного варианта системы приведены только порядковые номера, символы и названия элементов, а также названия некоторых простых веществ.
Строение периодической системы
Составными частями периодической системы являются периоды и группы.
Период — это фрагмент естественного ряда элементов от щелочного элемента* до инертного.
Каждый вариант периодической системы имеет семь периодов. В длинном варианте периодом является одна строка системы, а в коротком — одна или две соседние строки. Последний период содержит пустые клетки (соответствующие элементы еще не открыты).
Первый период (в нем имеется 2 элемента), второй и третий (содержат по 8 элементов) называют малыми периодами, а четвертый, пятый (по 18 элементов), шестой (32 элемента) и седьмой (в нем пока 29 элементов) — большими.
Периоды нумеруют арабскими цифрами.
* - Первый период начинается с Гидрогена.
Группа — столбик элементов в коротком варианте периодической системы или два столбика в длинном варианте.
Периодическая система содержит восемь групп элементов. Их принято нумеровать римскими цифрами. Каждая группа состоит из двух подгрупп — главной и побочной. Главные подгруппы обозначены в периодической системе буквой а, а побочные — буквой b. В коротком варианте системы символы элементов главных подгрупп смещены влево от центра клеток, а символы элементов побочных подгрупп — вправо. Главная подгруппа содержит больше элементов, чем побочная. Распознать подгруппы можно по цвету клеток: клетки элементов главных подгрупп окрашены в розовый или желтый цвет, а элементов побочных подгрупп — в синий или зеленый.
Фрагменты двух вариантов периодической системы с указанием периодов, групп и подгрупп представлены на рис. 52.
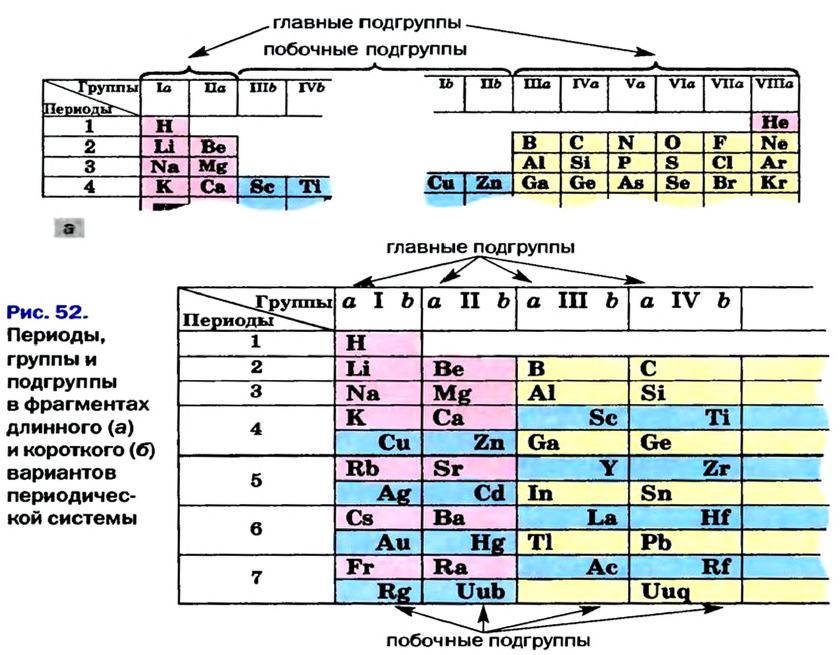
В нижней части короткого и длинного вариантов периодической системы имеются два отдельных ряда, в каждом из которых находится 14 элементов. В верхнем ряду размещены элементы с общим названием «лантаноиды» (т. е. похожие на Лантан), а в нижнем — «актиноиды» (похожие на Актиний). Большинство этих элементов были открыты в XX ст. Они входят в естественный ряд элементов и принадлежат побочной подгруппе III группы. Лантаноиды — элементы 6-го периода, актиноиды — 7-го. Для удобства (чтобы не делить клетки Лантана и Актиния на 15 частей для размещения в них Лантана и лантаноидов. Актиния и актиноидов) эти элементы вынесены за пределы основного поля периодической системы.
Зная положение элемента в периодической системе, можно делать различные прогнозы. Один из них касается химического характера элемента. В 7 классе вы узнали, что в длинном варианте системы проведена ломаная линия, слева и ниже которой находятся металлические элементы, а справа и выше — неметаллические. Некоторые элементы, размещенные около этой линии  образуют простые вещества, которые по одним свойствам напоминают металлы, а по другим — неметаллы. Добавим, что в главных подгруппах содержатся как металлические, так и неметаллические элементы, а в побочных подгруппах — только металлические элементы*.
образуют простые вещества, которые по одним свойствам напоминают металлы, а по другим — неметаллы. Добавим, что в главных подгруппах содержатся как металлические, так и неметаллические элементы, а в побочных подгруппах — только металлические элементы*.
* — Элементы побочных подгрупп называют переходными.
Наиболее сходны друг с другом элементы одной подгруппы, а между элементами главной и побочной подгрупп каждой группы нередко существуют заметные различия.
Выводы:
Периодическая система химических элементов является табличным выражением периодического закона.
Существуют два варианта периодической системы — короткий и длинный. Каждый вариант системы состоит из периодов и групп, а каждая группа имеет главную и побочную подгруппы.
Период — это фрагмент естественного ряда элементов. Он начинается со щелочного элемента, а завершается инертным. Группа — столбик элементов в коротком варианте периодической системы или два столбика в длинном варианте. В группах (подгруппах) находятся подобные элементы.
Ломаная линия в длинном варианте периодической системы делит ее на две части. Слева и ниже этой линии размещены металлические элементы, а справа и выше — неметаллические элементы.
Строение атома
Состав атома. Представления древних философов об атоме как о мельчайшей однородной и неделимой частице не менялись в течение многих столетий. Однако во второй половине XIX ст. ученые обнаружили, что в атоме имеются еще более мелкие частицы.
- атом — это наименьшая электронейтральная частица вещества, которая состоит из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов (рис. 53);
- величина заряда ядра и количество электронов в атоме совпадают с порядковым номером элемента;
- ядро в десятки тысяч раз меньше атома.

Дальнейшие исследования строения атома в начале XX ст. показали, что в ядре содержатся частицы двух типов — протоны и нейтроны. Их общее название — нуклоны.
Протон имеет такой же заряд по величине, что и электрон, но положительный: +1. Количество протонов определяет заряд ядра атома; оно равно количеству электронов. Нейтрон — незаряженная частица. Протон обозначают 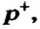 а нейтрон —
а нейтрон — 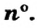
Для характеристики частиц, которые входят в состав атомов, как и для самих атомов, используют не абсолютные, а относительные массы. Массы протона и нейтрона приблизительно одинаковы и почти в 2000 раз превышают массу электрона. Значения относительных масс протона и нейтрона равны единице.
Итак, в атоме находятся частицы трех типов — с положительным, отрицательным зарядами, а также такие, которые заряда не имеют (схема 15).
Электроны притягиваются к ядру атома так называемыми электростатическими силами, однако не падают на него, поскольку движутся с большой скоростью. Протоны и нейтроны удерживаются вместе в ядре благодаря действию особых, «ядерных», сил. Природу этих сил полностью выяснить пока не удалось.
Протонное и нуклонное числа
Количество протонов в атоме называют протонным числом. Его указывают нижним индексом слева от символа элемента: 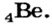
Учитывая строение атома, можно дать такое определение химического элемента: химический элемент — вид атомов с определенным протонным числом.
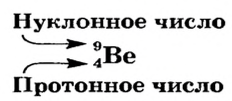
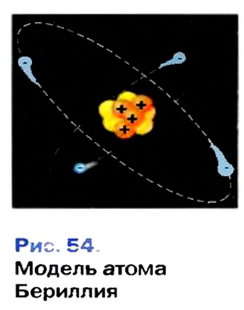
Суммарное количество протонов и нейтронов в атоме называют нуклонным числом. Его обозначают буквой А, а значение записывают верхним индексом слева от символа элемента: 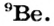
Обозначение атома с нуклонным и протонным числами: 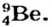
Количество нейтронов равно разности между нуклонным и протонным числами. Этих частиц в атоме Бериллия насчитывается 9 — 4 = 5 (рис. 54).
Существует двадцать элементов, у каждого из которых все атомы имеют одинаковые нуклонные числа (они почти совпадают с относительными атомными массами, приведенными в таблице Д. И. Менделеева):
Остальные элементы имеют атомы с разными нуклонными числами. Причину этого рассмотрим в следующем параграфе.
Изложенное выше можно записать с помощью формул.
Поскольку атом в целом электронейтрален, то в нем содержится одинаковое количество протонов и электронов, равное порядковому номеру элемента:
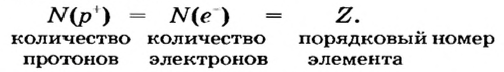
Количество нейтронов в любом атоме равно разности между нуклонным числом и количеством протонов (электронов) или порядковым номером элемента:
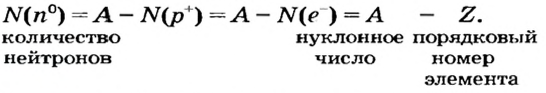
Количество нейтронов в атомах двадцати указанных элементов можно вычислять, используя значение относительных атомных масс:
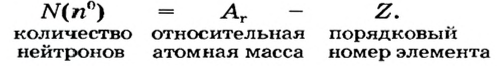
Простые ионы элементов содержат столько протонов и нейтронов, сколько и атомы, но отличаются от них количеством электронов. Так, в анионе F содержится на 1 электрон больше, чем в атоме F, а в катионе  — на 2 электрона меньше, чем в атоме Be.
— на 2 электрона меньше, чем в атоме Be.
Ядра с большим количеством протонов (свыше 83) неустойчивы. Они распадаются на меньшие ядра, отдельные частицы. Этот процесс называют радиоактивным распадом. Его изучают на уроках физики. Неустойчивость больших ядер — причина того, что в природе нет элементов с порядковыми номерами, превышающими 92. Их атомы получены в лабораториях с использованием уникального оборудования, которое дает возможность фиксировать частицы, существующие долю секунды.
Это интересно. Неустойчивые ядра также имеются в атомах Технеция (элемент 5-го периода) и Прометия (элемент 6-го периода).
Выводы:
- Атом состоит из ядра и электронов. Ядро имеет положительный заряд; в нем содержатся протоны, нейтроны и сосредоточена почти вся масса атома. Количество протонов и электронов в атоме одинаково. Оно совпадает с порядковым номером элемента. Количество нейтронов в атоме (для 20 элементов) равно разности между относительной атомной массой и количеством протонов.
- Простые катионы содержат меньше электронов, чем соответствующие атомы, а простые анионы — больше.
- Ядра атомов, в которых количество протонов превышает 83, неустойчивы. Они претерпевают радиоактивный распад.
Изотопы
Вы знаете, что атомы состоят из частиц трех типов — протонов, нейтронов и электронов. Атомы одного элемента содержат одинаковое количество протонов и электронов, но не всегда — одинаковое количество нейтронов.
Виды атомов одного элемента с разным количеством нейтронов называют изотопами*.
* — Термин происходит от греческих слов isos — одинаковый и topos —
место. Изотопы «принадлежат» одной клетке периодической системы.
Для элемента Гидрогена известны три изотопа. Каждый из них имеет свое название и обозначение (рис. 55). В природе больше всего атомов Гидрогена, ядра которых состоят только из протона. Среди нескольких тысяч таких атомов встречается атом, в ядре которого, кроме протона, есть еще и нейтрон. Эти два вида атомов — Протий и Дейтерий — являются природными изотопами Гидрогена. Физикам удалось получить в лаборатории атомы этого элемента с двумя нейтронами в ядре. Такой, искусственный, вид атомов Гидрогена назвали Тритием.
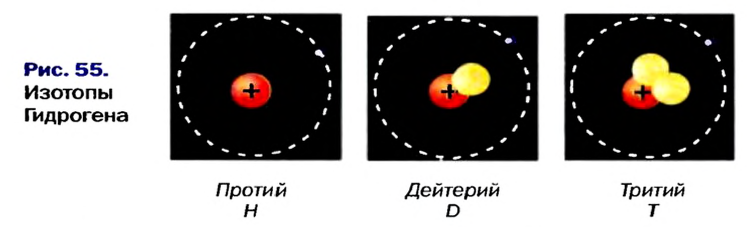
Нуклонные числа (суммарные количества протонов и нейтронов) для изотопов Гидрогена составляют 1, 2 и 3. Таким образом, изотопы — это виды атомов одного элемента с разными нуклонными числами.
Вещества, образованные изотопами элемента, немного различаются по физическим свойствам. Плотность «тяжелой» воды  составляет
составляет  а температура кипения (при нормальном давлении) — +101,43 °С. Для обычной воды
а температура кипения (при нормальном давлении) — +101,43 °С. Для обычной воды  эти физические характеристики вам хорошо известны —
эти физические характеристики вам хорошо известны — 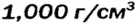 и +100 °С. Химические свойства обоих веществ одинаковы. «Тяжелая» вода, как и обычная, взаимодействует с натрием, кальций оксидом, фосфор(V) оксидом, другими соединениями.
и +100 °С. Химические свойства обоих веществ одинаковы. «Тяжелая» вода, как и обычная, взаимодействует с натрием, кальций оксидом, фосфор(V) оксидом, другими соединениями.
В природе многие элементы представлены несколькими видами атомов, т. е. изотопами, а для двадцати элементов, упомянутых в предыдущем параграфе, существует лишь по одному виду атомов (атомы каждого из этих элементов абсолютно одинаковы).
Изотопы обозначают с помощью символов или названий элементов с обязательным указанием нуклонного числа. Его записывают верхним индексом слева от символа элемента 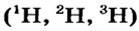 или после названия элемента через дефис (Хлор-35, Хлор-37). Часто используют полные обозначения изотопов —
или после названия элемента через дефис (Хлор-35, Хлор-37). Часто используют полные обозначения изотопов — 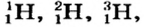
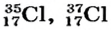 (нижний индекс — заряд ядра, или протонное число).
(нижний индекс — заряд ядра, или протонное число).
Нуклидами являются виды атомов различных элементов: 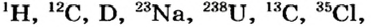
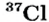 и др. Общее число известных в настоящее время нуклидов составляет почти 2300.
и др. Общее число известных в настоящее время нуклидов составляет почти 2300.
Изотопы — это нуклиды (виды атомов) одного элемента:
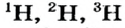 — изотопы Гидрогена;
— изотопы Гидрогена;
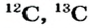 — изотопы Карбона.
— изотопы Карбона.
Вычисление относительных атомных масс элементов, имеющих изотопы
В природе существует два нуклида Хлора. Для одного вида атомов нуклонное число (относительная атомная масса) равно 35, для другого — 37. Ученые обнаружили, что легкие атомы Хлора составляют три четверти от общего количества атомов этого элемента, а тяжелые атомы — одну четверть (рис. 56). По этим данным можно рассчитать относительную атомную массу Хлора:
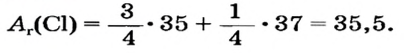
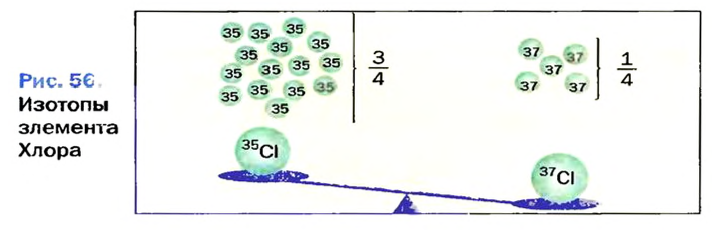
Числа  называют атомными долями изотопов. Они представляют собой отношения количеств атомов каждого нуклида к общему количеству атомов элемента. Приведенные атомные доли для изотопов Хлора можно выразить и в процентах: 75% , 25%.
называют атомными долями изотопов. Они представляют собой отношения количеств атомов каждого нуклида к общему количеству атомов элемента. Приведенные атомные доли для изотопов Хлора можно выразить и в процентах: 75% , 25%.
Атомную долю обозначают греческой буквой  (читается «хи»). Зная атомные доли изотопов элемента (
(читается «хи»). Зная атомные доли изотопов элемента (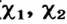 и т.д) в природной смеси и соответствующие нуклонные числа (
и т.д) в природной смеси и соответствующие нуклонные числа (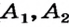 и т. д.), можно вычислить относительную атомную массу элемента:
и т. д.), можно вычислить относительную атомную массу элемента:
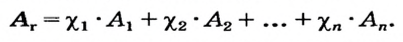
Заметное отклонение значения относительной атомной массы элемента от целого числа указывает на существование изотопов. Так, Купрум 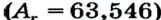 имеет два изотопа
имеет два изотопа 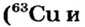
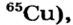 Цинк
Цинк 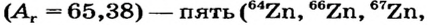
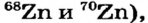 Станнум
Станнум 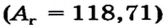 — десять.
— десять.
Уточнение важных химических понятий
Из курса химии вам известно, что относительные атомная, молекулярная, формульная массы являются отношениями масс атома, молекулы, формульной единицы к 1/12 массы атома Карбона. Однако существующие в природе атомы этого элемента неодинаковы. Карбон имеет два нуклида — 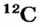 (атомов этого вида — 98,89 % от общего количества атомов Карбона) и 13С. В качестве атомной единицы массы выбрана 1/12 массы атома Карбона-12. Приводим уточненные определения упомянутых физических величин:
(атомов этого вида — 98,89 % от общего количества атомов Карбона) и 13С. В качестве атомной единицы массы выбрана 1/12 массы атома Карбона-12. Приводим уточненные определения упомянутых физических величин:
- относительные атомная, молекулярная, формульная массы являются отношениями массы атома, молекулы, формульной единицы к 1/12 массы атома
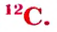
Это интересно. Бром, как и Хлор, имеет два природных нуклида — 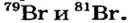 Их атомные доли почти одинаковы (50,5 и 49,5%).
Их атомные доли почти одинаковы (50,5 и 49,5%).
Одна из соответствующих расчетных формул имеет такой вид:
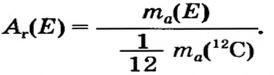
Уточняем также определение единицы измерения количества вещества:
моль — это порция вещества, которая содержит столько формульных единиц (т. е. атомов, молекул, сочетаний атомов или ионов), сколько атомов содержится в 12 г нуклида 
Радионуклиды
Многие нуклиды являются неустойчивыми; ядра соответствующих атомов самопроизвольно распадаются на меньшие ядра, отдельные частицы (рис. 57). Такое явление называют радиоактивным распадом (о нем упоминалось в предыдущем параграфе). В связи с этим нуклиды делят на стабильные и радиоактивные. Последние называют радионуклидами.
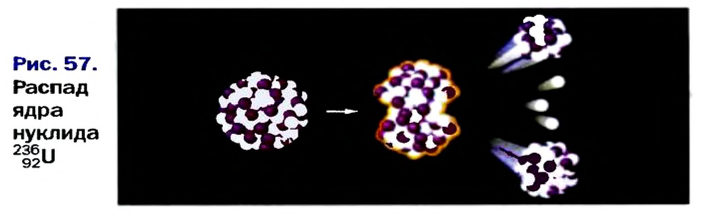
Для большинства элементов известны изотопы обоих типов. Например, нуклиды Лития 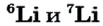 являются стабильными, a
являются стабильными, a 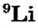 — радиоактивный. Элементы с порядковыми номерами 43, 61, а также 84 и выше имеют только радиоактивные изотопы. В клетках периодической системы указаны (в квадратных скобках) нуклонные числа тех нуклидов, которые распадаются наиболее медленно.
— радиоактивный. Элементы с порядковыми номерами 43, 61, а также 84 и выше имеют только радиоактивные изотопы. В клетках периодической системы указаны (в квадратных скобках) нуклонные числа тех нуклидов, которые распадаются наиболее медленно.
Применение радионуклидов
Радионуклиды используют в биологии, химии, медицине, археологии, современной технике, а также в физических экспериментах, связанных с получением новых элементов.
Важной сферой применения радиоактивных изотопов является атомная энергетика. На атомных электростанциях вырабатывают почти половину всей электроэнергии в Украине.
Это интересно. По содержанию радионуклида 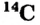 в ископаемых останках растений, животных, первобытного человека определяют их возраст.
в ископаемых останках растений, животных, первобытного человека определяют их возраст.
Во время распада неустойчивых ядер атомов возникает излучение, небольшие дозы которого приводят к серьезным заболеваниям, а высокие — к гибели всего живого. Поэтому работа с радиоактивными веществами требует особого внимания, осторожности и должна предусматривать защиту людей и окружающей среды от этого излучения.
Некоторые радиоактивные изотопы, например Карбон-14, Калий-40, встречаются в природе, но, к счастью, в очень незначительном количестве. Они медленно распадаются и не приносят вреда живым организмам.
Атомные катастрофы
Атом бывает не только мирным. Явление радиоактивного распада атомов Урана, Плутония было использовано для создания атомного (ядерного) оружия. Такое оружие применили Соединенные Штаты Америки в 1945 г. против мирного населения. Были сброшены две атомные бомбы на японские города Хиросима и Нагасаки. В одно мгновение погибли тысячи людей, на значительных территориях оказались разрушенными все здания. Человечество узнало о лучевой болезни, из-за которой умерло в течение нескольких десятилетий много жителей этих городов.
В мире предпринимаются меры по ограничению производства ядерного оружия. Действуют международные соглашения о запрете его испытаний в воздухе, на земной поверхности, под водой. Человечество должно приложить максимум усилий, чтобы не допустить возникновения атомного конфликта. Иначе жизнь на нашей планете может исчезнуть навсегда (рис. 58).
Это интересно. При взрыве атомной бомбы выделяется в миллион раз больше энергии, чем при взрыве обычной бомбы.

В 1986 г. в Украине произошла авария на Чернобыльской атомной электростанции (ЧАЭС). Она привела к разрушению 4-го блока станции (рис. 59) и выброса в окружающую среду значительных масс радиоактивных веществ. Погибли люди — те, кто тушил возникший пожар, кто работал вблизи атомного реактора. Позже потеряли здоровье или умерли тысячи людей, участвовавших в ликвидации последствий аварии.

Значительная часть территории Украины, загрязненная радионуклидами, постепенно восстанавливается естественным путем. Однако в зоне, примыкающей к ЧАЭС, до сих пор запрещено проживать людям. Осуществляется постоянный контроль за состоянием защитного сооружения, которое возведено над разрушенным реактором.
Необходимыми условиями для развития атомной энергетики являются максимальная безопасность людей и надежность оборудования.
Выводы:
- Виды атомов одного элемента с различным количеством нейтронов называют изотопами, а любой вид атомов — нуклидом. Изотопы — это нуклиды одного элемента.
- Относительные атомная, молекулярная, формульная массы являются отношениями массы атома, молекулы или формульной единицы к 1/12 массы атома
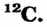
- Моль — порция вещества, которая содержит столько формульных единиц, сколько атомов содержится в 12 г нуклида
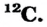
- Нуклиды бывают стабильными и радиоактивными. Радионуклиды используют в различных областях науки, техники, в энергетике, медицине, военном деле.
- Радиоактивные вещества опасны для людей, всей живой природы.
Ядерные реакции
Элементы, не существующие в природе (их свыше 20). называют искусственными. Они «родились» в научных лабораториях в результате ядерных реакций — превращений, при которых изменяются ядра атомов.
Ученые пытаются соединить атомные ядра с протонами, нейтронами, другими (легкими) ядрами. Эти частицы разгоняют до высокой скорости в специальных установках (ускорителях) и бомбардируют ими ядра-мишени. Во время таких экспериментов иногда образуются атомы новых элементов. Заметим, что при химических реакциях элементы остаются неизменными.
Впервые ядерную реакцию осуществил английский физик Э. Резерфорд в 1919 г. Он «облучал» атомы Нитрогена  -частицами (это — ядра атомов Гелия) и обнаружил образование ядер одного из нуклидов Оксигена, а также протонов (рис. 60):
-частицами (это — ядра атомов Гелия) и обнаружил образование ядер одного из нуклидов Оксигена, а также протонов (рис. 60):
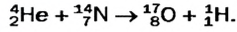
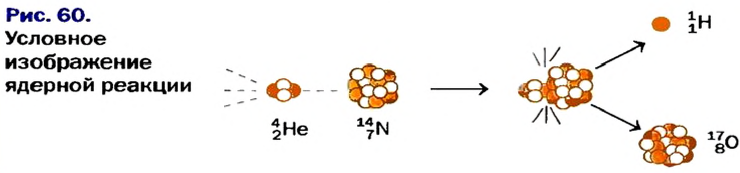
Уравнение ядерной реакции отличается от химического уравнения наличием индексов слева от символа каждого элемента. Верхний индекс, как вам известно, является нуклонным числом, а нижний — протонным числом. Суммы одноименных индексов в левой и правой частях уравнения ядерной реакции одинаковы. Например, для приведенного выше уравнения они таковы:

Открытие Резерфорда инициировало проведение многих экспериментов с целью получения новых, неизвестных науке элементов.
Во второй половине прошлого столетия и в начале нынешнего американские, российские и немецкие физики с помощью ядерных реакций получили ряд элементов, которые «заняли» пустые клетки в периодической системе после Урана. Их назвали трансурановыми элементами. Они принадлежат к III группе, побочной подгруппе.
Современная модель атома
Результаты исследований электронов свидетельствуют о том, что эти частицы отличаются от обычных физических тел. Электрон имеет свойства и частицы, и волны. Точно определить его размер, траекторию движения и координаты в пространстве невозможно.

Электронные орбитали. Электрон может находиться в любой точке атома (рис. 61).
Часть пространства в атоме, где пребывание электрона наиболее вероятно, называют орбиталъю.
Орбиталь с электроном похожа на микроскопическое облако (существует термин «электронное облако»). В нем распределены и масса, и заряд электрона.

Орбитали могут иметь несколько форм. Простейшая среди них — сферическая (рис. 62), т. е. форма шара (в его центре находится ядро атома). Такую орбиталь обозначают буквой s, а электрон в ней называют s-электроном. Вторая разновидность формы — гантелеобразная (рис. 63). Ее имеет р-орбиталь. Такие орбитали размещены в пространстве вдоль осей 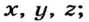 поэтому их еще называют
поэтому их еще называют 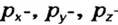 орбиталями. В них находятся р-электроны. Существуют еще
орбиталями. В них находятся р-электроны. Существуют еще 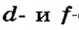 орбитали, которые имеют более сложные формы.
орбитали, которые имеют более сложные формы.
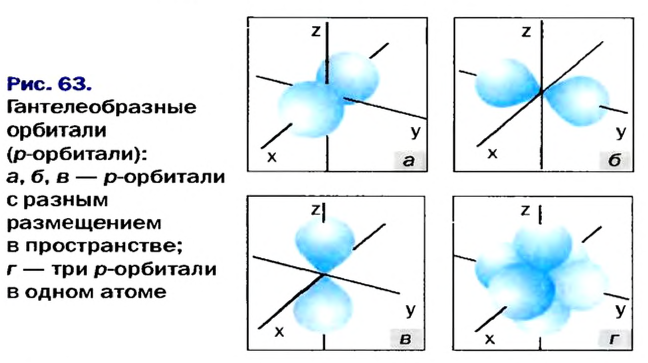
Любую орбиталь упрощенно изображают маленьким квадратом  а электрон в ней — стрелкой:
а электрон в ней — стрелкой: 
В каждой орбитали может находиться один или два электрона. Эти два электрона отличаются друг от друга свойством, которое называют спином. Его упрощенно представляют как вращение электрона вокруг собственной оси (так вращается наша планета, вследствие чего происходит смена дня и ночи).
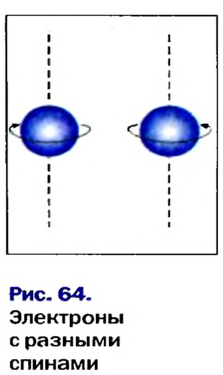
Один из электронов вращается вокруг этой оси по часовой стрелке, другой — против часовой стрелки, т. е. имеет противоположный спин (рис. 64). Эти электроны обозначают в орбитали противоположно направленными стрелками:
Орбиталь, в которой находятся два электрона, является заполненной. Если в орбитали — один электрон, его называют неспаренным, а если два — спаренными.
Энергетические уровни
Важнейшей характеристикой электрона, которую можно определить довольно точно, является его энергия. Электроны, которые занимают в атоме одну или несколько орбиталей одинаковой формы и размера, имеют одинаковую энергию.
Чем компактнее орбиталь и чем ближе к ядру находится электрон, тем его энергия меньше.
Современная модель атома учитывает энергию электронов. В ней эти частицы распределяют по так называемым энергетическим уровням (схема 16). Каждый энергетический уровень заполняют электронами с одинаковой или очень близкой энергией. Электроны первого уровня имеют наименьшую энергию; они находятся на наименьшем расстоянии от ядра атома. Второй уровень занимают электроны с большей энергией, третий — с еще большей и т. д.
Вместо термина «энергетический уровень» нередко используют другой — «электронная оболочка».
Энергетические уровни состоят из подуровней, причем номер уровня указывает на количество подуровней. Так, у первого уровня имеется один подуровень, у второго — два, у третьего — три (схема 16) и т. д.
Распределение электронов по энергетическим уровням
Каждый энергетический уровень вмещает ограниченное количество электронов. Их максимальное число определяют по формуле:
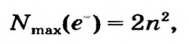
где n — номер уровня.
На первом энергетическом уровне может находиться не более чем 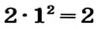 электрона. Они размещаются в одной орбитали (сферической), являются s-электронами, имеют одну и ту же энергию, но различаются своими спинами.
электрона. Они размещаются в одной орбитали (сферической), являются s-электронами, имеют одну и ту же энергию, но различаются своими спинами.
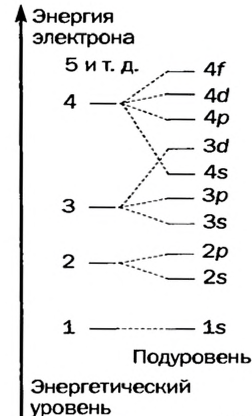
Схема 16. Энергетические уровни
Заполнение электронами первого энергетического уровня проиллюстрируем так называемыми электронными формулами (рис. 65) и их графическими вариантами:
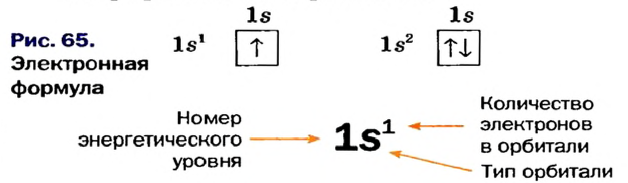
Второй энергетический уровень может вместить максимум 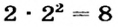 электронов. Два из них занимают одну s-орбиталь, но большего объема, чем та, которая принадлежит первому уровню. Они также имеют противоположные спины. Остальные шесть электронов второго уровня являются р-электронами. Поскольку в каждой орбитали может находиться не более двух электронов, то р-орбиталей должно быть
электронов. Два из них занимают одну s-орбиталь, но большего объема, чем та, которая принадлежит первому уровню. Они также имеют противоположные спины. Остальные шесть электронов второго уровня являются р-электронами. Поскольку в каждой орбитали может находиться не более двух электронов, то р-орбиталей должно быть 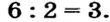 Это орбитали одного энергетического уровня; они имеют одинаковый объем и расположены вдоль осей координат (рис. 63).
Это орбитали одного энергетического уровня; они имеют одинаковый объем и расположены вдоль осей координат (рис. 63).
Электронная формула заполненного второго энергетического уровня —
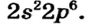
Сферическая орбиталь для электрона более выгодна, чем гантелеобразная. Поэтому энергия s-электронов второго энергетического уровня немного ниже, чем р-электронов:
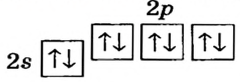
Итак, второй энергетический уровень состоит из двух подуровней. Их обозначают так же, как и соответствующие электроны: s-подуровень, р-подуровень (схема 16).
Третий энергетический уровень вмещает не более 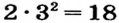 электронов. Он состоит из трех подуровней —
электронов. Он состоит из трех подуровней —  . Если на s-подуровне может быть не более 2-х электронов, на р-подуровне — не более 6-ти, то максимальное количество электронов на d-подуровне составляет
. Если на s-подуровне может быть не более 2-х электронов, на р-подуровне — не более 6-ти, то максимальное количество электронов на d-подуровне составляет 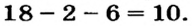 Это — d-электроны; они занимают пять орбиталей.
Это — d-электроны; они занимают пять орбиталей.
Современная модель атома позволяет воспроизвести его электронное строение, определить возможности соединения атома с другими атомами, а также потери атомом или присоединения им электронов. Все это предопределяет химические свойства простых и сложных веществ.
Выводы:
Часть пространства в атоме, где пребывание электрона наиболее вероятно, называют орбита лью. Орбитали имеют несколько форм — сферическую (в такой орбитали находятся s-электроны), гантелеобразную (в ней находятся р-электроны) и некоторые другие. В орбитали могут находиться один или два электрона.
Свойство электрона, напоминающее вращение вокруг собственной оси, называют спином.
В современной модели атома электроны распределяют по энергетическим уровням и подуровням. Каждый уровень и подуровень вмещает ограниченное количество электронов.
Строение электронных оболочек атомов
Размещение электронов в атомах: Все в окружающем мире стремится перейти в состояние с наименьшей энергией. Такое состояние является самым устойчивым и потому самым выгодным. Принципом наименьшей энергии определяется и электронное строение атома.
Электроны в атоме размещаются так, чтобы их энергия была минимальной.
Рассмотрим, как заполняют электроны энергетические уровни и подуровни в атомах различных элементов.
Атом элемента № 1 Гидрогена содержит только один электрон. Согласно принципу наименьшей энергии этот электрон должен находиться как можно ближе к ядру, т. е. принадлежать первому энергетическому уровню и занимать s-орбиталь.
Электронная формула атома Гидрогена и ее графический вариант таковы:
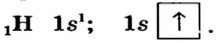
Атом элемента № 2 Гелия имеет два электрона. Может ли второй электрон разместиться на первом энергетическом уровне? Да, так как максимальная «емкость» первого уровня — 2 электрона. Эти частицы будут различаться только своими спинами.
Запишем электронную формулу атома Гелия и ее графический вариант:
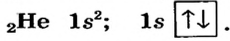
В атоме элемента № 3 Лития — три электрона. Два электрона занимают 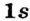 -орбиталь (схема 16). Первый энергетический уровень заполнен, и третий электрон размещается на втором уровне. Из орбиталей
-орбиталь (схема 16). Первый энергетический уровень заполнен, и третий электрон размещается на втором уровне. Из орбиталей  он «выбирает» ту, которая имеет более низкую энергию, т. е.
он «выбирает» ту, которая имеет более низкую энергию, т. е.  -орбиталь.
-орбиталь.
Электронная формула атома Лития и ее графический вариант таковы:
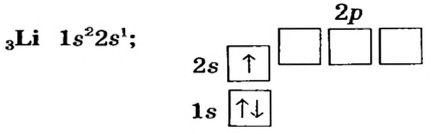
Электроны на последнем энергетическом уровне атома называют внешними. В атоме металлического элемента Лития — один внешний электрон; он находится в 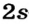 -орбитали.
-орбитали.
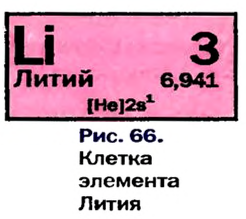
Чтобы выделить в атоме внешние электроны, используют сокращенную запись электронной формулы. Для атома Лития она такова: 
Сокращенные записи электронных формул атомов имеются в коротком варианте периодической системы Менделеева (форзац I, рис. 66). Иногда электронные формулы атомов записывают, указывая только внешние электроны. Такая формула для атома Лития — 
В атоме элемента № 4 Бериллия — 4 электрона. Четвертый электрон «составляет пару» третьему и размещается в 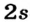 -орбитали:
-орбитали:

Атом элемента № 5 Бора имеет 5 электронов. Пятый электрон принадлежит второму энергетическому уровню и размещается в одной из р-орбиталей:
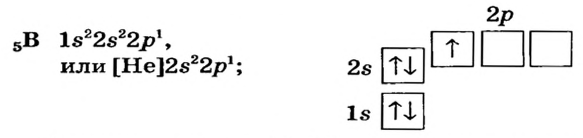
В атоме элемента № 6 Карбона появляется шестой электрон. Он может либо «подселиться » к пятому электрону в одну р-орбиталь, либо занять другую р-орбиталь. Реализуется вторая возможность: электроны, имея одноименные заряды, отталкиваются друг от друга; им выгоднее разместиться в разных орбиталях.
Электронная формула атома Карбона и ее графический вариант:
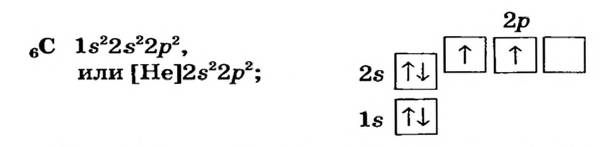
Учитывая то, что каждый электрон старается занять вакантную орбиталь последнего подуровня, а в случае ее отсутствия «подселяется» к другому электрону (с противоположным спином), запишем электронные формулы атомов остальных элементов 2-го периода:
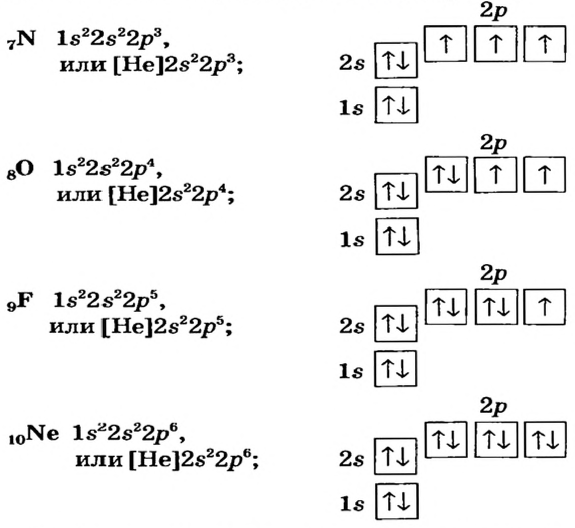
Заполнение электронами орбиталей внешнего энергетического уровня в атомах элементов 2-го периода показано на рисунке 67.
В атоме элемента № 11 Натрия начинается заполнение третьего энергетического уровня. На нем появляется один электрон: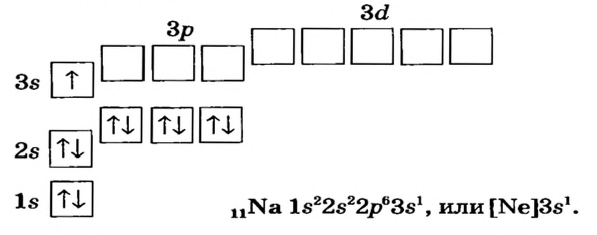
Советуем запомнить: количество энергетических уровней атома, на которых находятся электроны, совпадает с номером периода, в котором находится элемент.
При составлении электронных формул атомов элементов 4-го периода нужно учитывать, что энергия подуровней возрастает в таком порядке (схема 16):
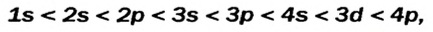
а на последнем энергетическом уровне в атоме не бывает больше 8 электронов.
Состояние атома, в котором орбитали заполнены электронами в соответствии с принципом наименьшей энергии, называют основным.
Внешние электроны атома и валентность элемента
Существует связь между размещением электронов на последнем энергетическом уровне атома и значениями валентности элемента.
Это интересно. Электронное строение атомов элементов, открытых в последнее время, не установлено.
Сопоставим некоторые факты. Атом Гидрогена имеет один электрон; значение валентности элемента равно 1. На внешнем энергетическом уровне атома Лития — тоже один электрон, а атома Флуора — семь электронов, среди которых один — неспаренный. Литий и Флуор — одновалентные элементы. В атоме Оксигена на внешнем уровне — два неспаренных электрона; этот элемент двухвалентен.
Количество неспаренных электронов в атоме указывает на возможное значение валентности элемента.
Атом Карбона содержит два неспаренных электрона (с. 166). Однако этот элемент в своих соединениях (кроме угарного газа СО) проявляет валентность 4. Значит, в атоме Карбона должно быть не два, а четыре неспаренных электрона. Они появляются в результате разъединения пары  -электронов: один из электронов, получив порцию энергии, переходит в вакантную р-орбиталь.
-электронов: один из электронов, получив порцию энергии, переходит в вакантную р-орбиталь.
Процесс перехода электрона с одной орбита-ли в другую (в пределах одного энергетического уровня) называют возбуждением атома. Возбужденное состояние атома обозначают звездочкой вверху после символа элемента:
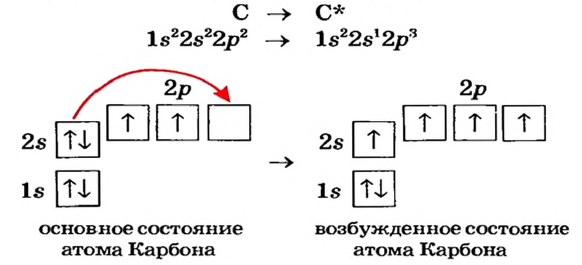
Это интересно. Отдельный атом, находящийся в возбужденном состоянии, быстро возвращается в основное состояние, теряя при этом часть своей энергии.
В атомах Оксигена и Флуора нет вакантных орбиталей. Поэтому разъединение пар 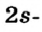 и
и 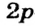 -электронов невозможно. Значение валентности этих элементов совпадает с количеством неспаренных электронов в атомах: 2 — для Оксигена и 1 — для Флуора.
-электронов невозможно. Значение валентности этих элементов совпадает с количеством неспаренных электронов в атомах: 2 — для Оксигена и 1 — для Флуора.
В атомах Гелия и Неона во всех орбиталях находятся лишь пары электронов, а свободных орбиталей нет. Эти элементы не проявляют такого свойства как валентность; их атомы неспособны соединяться друг с другом и с другими атомами.
Выводы:
Электроны в атоме размещаются так, чтобы их энергия была минимальной. На каждом энергетическом уровне электроны сначала заполняют s-орбитали, а затем — р-орбитали.
Количество неспаренных электронов в атоме указывает на возможное значение валентности элемента.
Атом при наличии свободных орбиталей на последнем энергетическом уровне может переходить в возбужденное состояние. При этом за счет разъединения электронных пар количество неспаренных электронов в атоме возрастает и возникает предпосылка для проявления элементом более высокой валентности.
Современная формулировка периодического закона Д. И. Менделеев
Д. И. Менделеев, как и его современники, еще не знал, какое строение имеет атом. Однако он был уверен в том, что причину периодичности в изменениях химического характера элементов и свойств веществ нужно искать в самих атомах. Ученый понимал, что периодический закон требует более глубокого познания.
Открытие сложного строения атома помогло установить, что фундаментальной характеристикой каждого элемента является заряд ядра атома, а не масса, поскольку у большинства элементов есть изотопы. Поэтому ныне периодический закон формулируют так:
- свойства химических элементов, простых веществ, а также состав и свойства соединений находятся в периодической зависимости от значений зарядов ядер атомов.
Известно, что Менделеев разместил в периодической системе Иод после Теллура, хотя масса атома Иода немного меньше. Основными критериями для ученого были, кроме атомной массы, химический характер элементов и свойства образованных ими веществ. Теперь мы знаем, что ядро атома Иода содержит на один протон больше, чем ядро атома Теллура, и поэтому порядковый номер Иода должен быть на единицу большим.
В периодической системе имеется еще несколько пар элементов, которые следовало бы поменять местами, учитывая значения атомных масс. Среди них — Аргон и Калий. Атом Калия содержит на один протон больше. Но почему его относительная атомная масса меньше, чем Аргона? Оба элемента имеют по три природных нуклида. Аргон почти целиком состоит из «тяжелого» нуклида 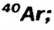 таких атомов — 99,6 % от их общего количества (существуют еще нуклиды
таких атомов — 99,6 % от их общего количества (существуют еще нуклиды 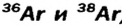 ). У Калия преобладает «легкий» нуклид
). У Калия преобладает «легкий» нуклид 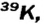 на который приходится 93,2 % всех атомов (существуют еще нуклиды
на который приходится 93,2 % всех атомов (существуют еще нуклиды  ).
).
Физическая суть периодического закона. Обратим внимание на внешние электронные оболочки атомов первых 18 элементов (рис. 68).
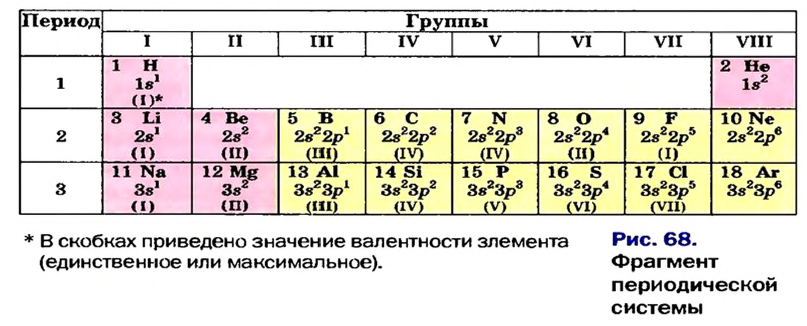
Вы видите, что в естественном ряду химических элементов количество внешних электронов в атомах и их размещение в орбиталях системы периодически повторяются. Например, в атомах Гидрогена (элемент № 1), Лития (№ 3), Натрия (№ 11) на последнем энергетическом уровне находится один s-электрон, в атомах Гелия (№ 2), Бериллия (№ 4), Магния (№ 12) — два s-электрона.
Зная количество внешних электронов, можно предсказать химический характер элемента. В атомах элементов 2-го и 3-го периодов Лития, Бериллия, Натрия, Магния, Алюминия на последнем энергетическом уровне находится небольшое количество электронов — от 1 до 3. Это металлические элементы. В атомах неметаллических элементов внешних электронов больше — от 4 до 8.
Поскольку состав внешней электронной оболочки атома влияет на химический характер элемента, то периодичность изменения электронного строения атомов элементов обусловливает периодичность изменения состава и свойств веществ. В этом заключается физическая суть периодического закона.
Классификация элементов по электронному строению атомов
В основе одной из классификаций химических элементов лежит электронное строение атомов. В зависимости от типа орбитали, в которой размещаются электроны с наибольшей энергией (внешние электроны), элементы делят на четыре типа: s-элементы, р-элементы, d-элементы и f-элементы. Клетки элементов каждого типа в периодической системе имеют определенный цвет — розовый (s-элементы), желтый (р-элементы), синий (d-элементы) или зеленый (f-элементы).
s-Элементы (кроме Гелия) принадлежат к главным подгруппам I и II групп, а р-элементы — главным подгруппам III—VIII групп. Во всех побочных подгруппах содержатся d-элементы, а f-элементы принадлежат к побочной подгруппе III группы. Это — лантаноиды и актиноиды; они вынесены за пределы основного поля периодической системы.
Периодическая система, электронное строение атомов и валентность элементов. С электронным строением атомов согласуются номера периодов и групп:
- номер периода, в котором находится элемент, указывает на количество энергетических уровней (электронных оболочек) в его атоме;
- номер группы, к которой принадлежит s- или р-элемент, совпадает с количеством электронов на внешней оболочке атома и указывает на максимальное значение валентности элемента (рис. 68). Поэтому внешние электроны еще называют валентными.
Существует несколько элементов, максимальные значения валентности которых отличаются от номеров соответствующих групп периодической системы. Нитроген — элемент V группы, но значение его валентности не превышает 4. Постоянные значения валентности Оксигена (2) и Флуора (1) также не отвечают номерам групп (VI и VII). Причину этого мы рассмотрели в предыдущем параграфе.
Радиусы атомов элементов в периодах и группах
Атом в нашем представлении является микроскопическим шариком, имеющим определенный радиус.
Радиус атома — это расстояние от центра ядра до сферической поверхности, которой касаются орбитали с электронами последнего энергетического уровня.
Радиусы атомов зависят от зарядов ядер и количества энергетических уровней, на которых размещены электроны.
Атомы элементов одного периода имеют одинаковое количество энергетических уровней, но разные радиусы (рис. 67, 69). Заряды ядер атомов элементов в периоде возрастают. Чем больше заряд ядра, тем ближе к нему находятся электроны и тем радиус атома меньше. Такую зависимость объясняет закон физики, согласно которому частица с большим зарядом сильнее притягивает (или отталкивает) другую.
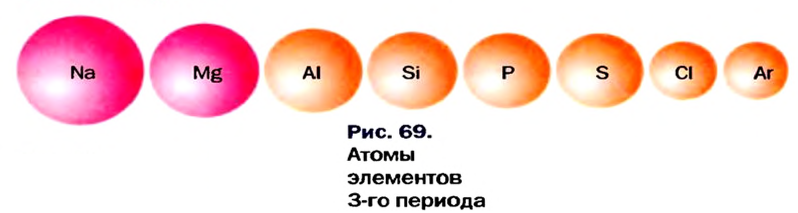
Теперь сравним атомы элементов одной группы (подгруппы). В них с увеличением порядкового номера возрастает количество энергетических уровней, на которых размещены электроны. Это приводит к увеличению размеров атомов (рис. 70). Чем больше энергетических уровней имеет атом, тем его радиус больше.
Радиусы атомов элементов в группе (подгруппе) возрастают сверху вниз.

Обратите внимание на заряды ядер атомов Лития, Натрия и Калия. Они резко возрастают: 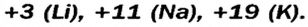 Это должно усилить притяжение электронов к ядру и вызвать уменьшение радиусов атомов. Однако возрастающие заряды ядер в значительной мере экранируются зарядами электронов внутренних оболочек, как бы нейтрализуются ими. А количество этих электронов от Лития к Калию увеличивается почти так же, как и заряды ядер. Поэтому определяющим фактором, который влияет на радиусы атомов элементов одной группы (подгруппы), является количество энергетических уровней.
Это должно усилить притяжение электронов к ядру и вызвать уменьшение радиусов атомов. Однако возрастающие заряды ядер в значительной мере экранируются зарядами электронов внутренних оболочек, как бы нейтрализуются ими. А количество этих электронов от Лития к Калию увеличивается почти так же, как и заряды ядер. Поэтому определяющим фактором, который влияет на радиусы атомов элементов одной группы (подгруппы), является количество энергетических уровней.
Выводы:
Периодический закон ныне формулируют так: свойства химических элементов, простых веществ, а также состав и свойства соединений находятся в периодической зависимости от значений зарядов ядер атомов.
Физическая суть периодического закона заключается в том, что с возрастанием зарядов ядер периодически изменяется электронное строение атомов, что обусловливает периодическое изменение химического характера элементов, их валентности, свойств простых веществ и соединений.
Исходя из электронного строения атомов, различают 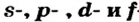 -элементы.
-элементы.
Номер периода, в котором находится элемент, указывает на количество энергетических уровней в его атоме, а номер группы — на количество электронов на внешнем уровне и максимальное значение валентности.
Радиусы атомов элементов в периоде уменьшаются слева направо, а в группе (подгруппе) возрастают сверху вниз.
Характеристика элемента по его положению в периодической системе и строению атома
Разобравшись в сути периодического закона, зная, какая информация об элементах имеется в периодической системе, и опираясь на электронное строение атома, вы можете составить характеристику элемента, определить тип его простого вещества.
План характеристики элемента
- Место элемента в периодической системе (номер периода, номер группы, главная или побочная подгруппа).
- Относительная атомная масса.
- Состав атома, т. е. количество протонов, нейтронов (если элемент входит в число двадцати элементов, имеющих по одному природному нуклиду) и электронов. Вероятность существования природных изотопов (по отклонению значения относительной атомной массы от ближайшего целого числа).
- Электронное строение атома, т. е. размещение электронов на энергетических уровнях и подуровнях.
- Тип элемента
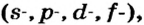 его химический характер (металлическим или неметаллическим является элемент).
его химический характер (металлическим или неметаллическим является элемент). - Максимальное и минимальное значения валентности (по номеру группы периодической системы, к которой принадлежит элемент, и количеству неспаренных электронов в атоме). Возможность нахождения атома в возбужденном состоянии.
- Тип простого вещества, образованного элементом (металл или неметалл).
Пример №12
Составить характеристику Фосфора по положению элемента в периодической системе и строению атома.
Решение
1. Элемент Фосфор находится в 3-м периоде, пятой группе, главной подгруппе. В соответствующей клетке периодической системы (рис. 71) находим символ элемента — Р. Поскольку в клетке приведено лишь одно название — фосфор, то оно является названием как элемента, так и его простого вещества.

2. Относительная атомная масса элемента — 30,974.
3. Порядковый номер элемента (протонное число) — 15. В состав атома Фосфора входят 15 протонов и 15 электронов.
Фосфор находится среди тех двадцати элементов (§ 23), которые имеют по одному природному нуклиду. Нуклонное число для нуклида Фосфора получаем, округляя значение относительной атомной массы элемента до целого числа: 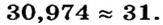 Обозначение нуклида —
Обозначение нуклида — 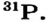 Количество нейтронов в ядре нуклида равно разности между нуклонным и протонным числами:
Количество нейтронов в ядре нуклида равно разности между нуклонным и протонным числами: 
4. Поскольку Фосфор находится в 3-м периоде, то электроны в его атоме размещены на 3-х энергетических уровнях. Первый и второй уровни заполнены; они содержат соответственно 2 и 8 электронов (таково электронное строение атома элемента № 10 Неона). На третьем, внешнем, уровне находятся 5 электронов (их количество для элемента главной подгруппы совпадает с номером группы): 2 электрона — на Зs-подуровне и 3 — на Зр-подуровне.
Электронная формула атома Фосфора —
Ее графический вариант с изображением не только заполненных, но и вакантных орбиталей последнего энергетического уровня (Зd-орбиталей) имеет такой вид:
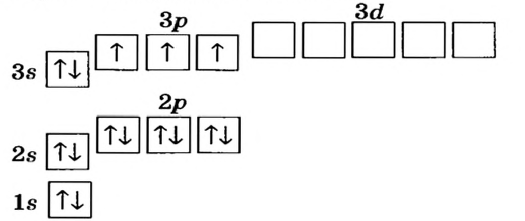
5. Фосфор — р-элемент, поскольку при заполнении энергетических уровней атома последний электрон занимает р-орбиталь. Фосфор является неметаллическим элементом; он находится в длинном варианте периодической системы справа и выше ломаной линии.
6. Минимальное значение валентности Фосфора равно 3 (таким является количество неспаренных электронов в атоме). Существует возможность перехода одного электрона из Зs-орбитали в Зd-орбиталь:
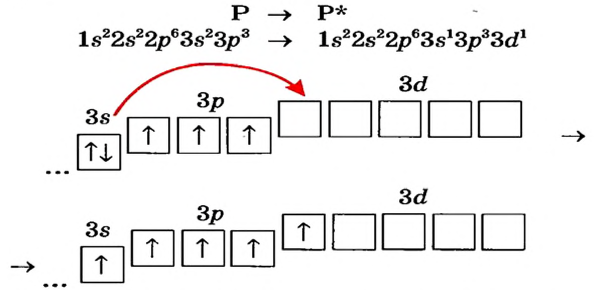
Количество неспаренных электронов в возбужденном атоме увеличивается до пяти. Поэтому максимальное значение валентности Фосфора равно 5.
7. Поскольку Фосфор — неметаллический элемент, то его простое вещество является неметаллом.
Характеристика Гидрогена
Элемент № 1 — единственный, который размещают в двух клетках периодической системы Д. И. Менделеева. Его можно найти в главных подгруппах I и VII групп.
Каждый вариант размещения Гидрогена имеет свое обоснование.
1. Гидроген похож на элементы главной подгруппы I группы — щелочные элементы. Он одновалентен; в его атоме на последнем (единственном) энергетическом уровне находится один электрон.
2. Гидроген сходен и с элементами главной подгруппы VII группы — галогенами. Это — неметаллический элемент. Постоянное значение его валентности совпадает с минимальным значением валентности галогенов. Простое вещество Гидрогена — газ водород  — по своим свойствам имеет много общего с фтором
— по своим свойствам имеет много общего с фтором  и хлором
и хлором 
Какому же варианту размещения Гидрогена в периодической системе следует отдать предпочтение? Единого мнения нет. Поэтому этот элемент можно обнаружить и в I, и в VII группе.
При составлении характеристики элемента Гидрогена необходимо учитывать оба варианта его размещения в периодической системе.
Выводы:
Химический элемент характеризуют, указывая его положение в периодической системе, относительную атомную массу, состав и электронное строение атома, химический характер, тип (исходя из электронного строения), максимальное и минимальное значения валентности (с учетом возможности нахождения атома в возбужденном состоянии), а также тип простого вещества.
Периодическая система, химический характер элементов и свойства простых веществ
Вы знаете, что существуют металлические и неметаллические элементы. Первые находятся в периодической системе в начале каждого периода и в середине больших периодов. Их атомы имеют на внешнем энергетическом уровне, как правило, от одного до трех электронов. Неметаллические элементы завершают периоды. Внешних электронов в их атомах больше — от четырех до восьми:
Металлические элементы образуют простые вещества металлы, а неметаллические — простые вещества неметаллы. Химический характер элемента определяют прежде всего по химическим свойствам его простого вещества» т. е. учитывают, вступает ли оно в реакции, характерные для металлов или неметаллов, а если вступает, то насколько активно.
Химическая активность металлов — простых веществ элементов одного периода. Выясним, как изменяется активность простых веществ металлических элементов 3-го периода в реакциях с водой и хлоридной кислотой.
Вам хорошо известно, что натрий бурно взаимодействует с водой в обычных условиях. Магний вступает в аналогичную реакцию только при нагревании (рис. 72), а алюминий даже в кипящей воде остается неизменным. Таким образом, химическая активность металлов по отношению к воде возрастает в ряду алюминий — магний — натрий.

Химическая активность металлов — простых веществ элементов главной подгруппы. Обратим внимание на отношение к воде простых веществ элементов главной подгруппы II группы.
Убедиться в различной активности магния и кальция можно, осуществив такой эксперимент. В две пробирки наливают немного воды и добавляют по 1—2 капли раствора фенолфталеина. В одну пробирку вносят небольшой кусочек кальция, а в другую — магниевую стружку. С водой будет реагировать только кальций. Если пробирку с магнием и водой нагреть, то и в ней начнется реакция.
Изучив другие реакции металлов (например, с неметаллами, солями), можно обнаружить такую закономерность: металлический характер элементов и химическая активность металлов усиливаются в периодах справа налево, а в главных подгруппах — сверху вниз.
Анализируя эту закономерность, приходим к выводу: типичные металлические элементы находятся в левом нижнем углу длинного варианта периодической системы. Это — Франций, Цезий, Радий.
Химическая активность неметаллов — простых веществ элементов одного периода. Сравним особенности протекания реакций простых веществ неметаллических элементов 3-го периода с водородом.
Силиций не реагирует с водородом, а фосфор вступает с ним в реакцию при температуре более 300°С и повышенном давлении:
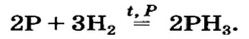
Сера начинает взаимодействовать с водородом при температуре 200°С:
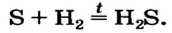
Смесь хлора с водородом на свету взрывается (в темноте реакция не происходит):
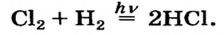
Эти и другие факты свидетельствуют о том, что активность неметаллов в ряду силиций — фосфор — сера — хлор возрастает.
Аналогичное изменение химической активности наблюдаем для неметаллов, образованных элементами 2-го периода. Азот реагирует с водородом при нагревании и наличии катализатора (продукт реакции — аммиак  ). Смеси кислорода и водорода, фтора и водорода взрываются; первая — при поджигании, а вторая — в обычных условиях и даже в темноте.
). Смеси кислорода и водорода, фтора и водорода взрываются; первая — при поджигании, а вторая — в обычных условиях и даже в темноте.
Химическая активность неметаллов — простых веществ элементов главной подгруппы. Сопоставим протекание реакций с водородом галогенов — простых веществ элементов главной подгруппы VII группы.
О реакциях фтора и хлора с водородом говорилось выше; фтор проявляет большую активность, чем хлор. Бром взаимодействует с водородом лишь при нагревании и наличии катализатора
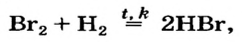
а реакция иода с водородом не происходит полностью ни при каких условиях
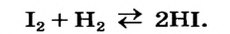
Таким образом, химическая активность простых веществ возрастает в ряду иод — бром — хлор — фтор.
Неметаллический характер элементов и химическая активность неметаллов усиливаются в периодах слева направо, а в главных подгруппах — снизу вверх.
Типичные неметаллические элементы находятся в правом верхнем углу длинного варианта периодической системы. Это — Флуор, Хлор, Оксиген.
Материал параграфа обобщен в схеме 17.

Выводы:
- Химический характер элемента обусловлен химическими свойствами его простого вещества.
- Металлический характер элементов и активность металлов усиливаются в периодах справа налево, а в главных подгруппах — сверху вниз.
- Неметаллический характер элементов и активность неметаллов усиливаются в периодах слева направо, а в главных подгруппах — снизу вверх.
- Типичные металлические элементы находятся в левом нижнем углу длинного варианта периодической системы, а типичные неметаллические элементы — в правом верхнем углу.
Периодическая система и химические свойства соединений
Оксиды
Наиболее характерными для элементов являются высшие оксиды. В таком оксиде элемент проявляет максимально возможное для него значение валентности. Оно совпадает с номером группы периодической системы, где находится элемент.
Проследим, как изменяются свойства высших оксидов в зависимости от положения элементов в периодической системе.
Рассмотрим высшие оксиды элементов 2-го периода (табл. 5). Первый элемент этого периода — металлический Литий. Он образует основный оксид 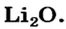 За Литием следует Бериллий, тоже металлический элемент. Его оксид
За Литием следует Бериллий, тоже металлический элемент. Его оксид  — амфотерный. Другие элементы этого периода принадлежат к неметаллическим элементам. Бор, Карбон и Нитроген образуют кислотные оксиды —
— амфотерный. Другие элементы этого периода принадлежат к неметаллическим элементам. Бор, Карбон и Нитроген образуют кислотные оксиды — 
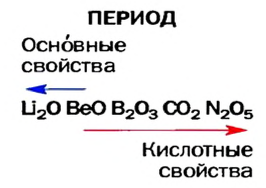
У первых двух соединений кислотные свойства выражены слабо, а у третьего — в полной мере. Оксида Оксигена, разумеется, не существует.

В периодах кислотные свойства высших оксидов усиливаются слева направо, а основные свойства — в противоположном направлении.
Свойства высших оксидов в главных подгруппах каждой группы элементов также изменяются постепенно. В качестве примера приводим оксиды элементов III группы (табл. 6).
В главных подгруппах основные свойства высших оксидов усиливаются сверху вниз, а кислотные свойства — в противоположном направлении.

Гидроксиды
Гидроксид, или гидрат оксида, — это соединение оксида с водой. О соответствии свойств оксидов и гидроксидов упоминалось ранее (с. 37, 43, 87). Если гидроксид происходит от основного оксида, то он является основанием, если от амфотерного оксида — амфотерным гидроксидом, а если от кислотного — оксигенсодержащей кислотой:
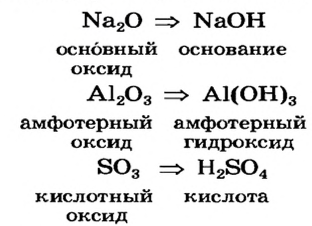
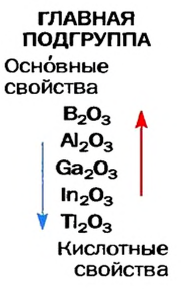
Отсюда следует такой вывод: изменения основных и кислотных свойств гидратов оксидов в периодах и группах (главных подгруппах) должны быть такими же, как и для оксидов.
В периодах кислотные свойства гидроксидов усиливаются слева направо, а основные свойства — в противоположном направлении.
В главных подгруппах основные свойства гидроксидов усиливаются сверху вниз, а кислотные свойства — в противоположном направлении.
Проиллюстрируем эти выводы данными о химическом характере гидратов высших оксидов элементов 2-го и 3-го периодов (табл. 7).

Соединения элементов с Гидрогеном
Вам известны лишь несколько таких соединений, в частности хлороводород 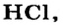 сероводород
сероводород 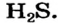 . Однако они существуют для большинства элементов. Их строение и свойства неодинаковы, они изменяются в периодах и группах, но не так просто и наглядно, как свойства оксидов или гидроксидов.
. Однако они существуют для большинства элементов. Их строение и свойства неодинаковы, они изменяются в периодах и группах, но не так просто и наглядно, как свойства оксидов или гидроксидов.
Рассмотрим соединения элементов 3-го периода с Гидрогеном (табл. 8).
Первый элемент в этом периоде — Натрий. Он образует соединение 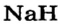 (натрий гидрид), которое состоит из ионов
(натрий гидрид), которое состоит из ионов 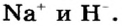 По строению, некоторым свойствам и даже внешнему виду (белое кристаллическое вещество) натрий гидрид напоминает соли, в частности натрий хлорид
По строению, некоторым свойствам и даже внешнему виду (белое кристаллическое вещество) натрий гидрид напоминает соли, в частности натрий хлорид 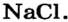 Соединение Магния, следующего элемента в периоде, имеет формулу
Соединение Магния, следующего элемента в периоде, имеет формулу  Это также ионное вещество, которое сходно с солями. Соединение Алюминия с Гидрогеном
Это также ионное вещество, которое сходно с солями. Соединение Алюминия с Гидрогеном 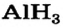 имеет атомное строение и от солей отличается.
имеет атомное строение и от солей отличается.
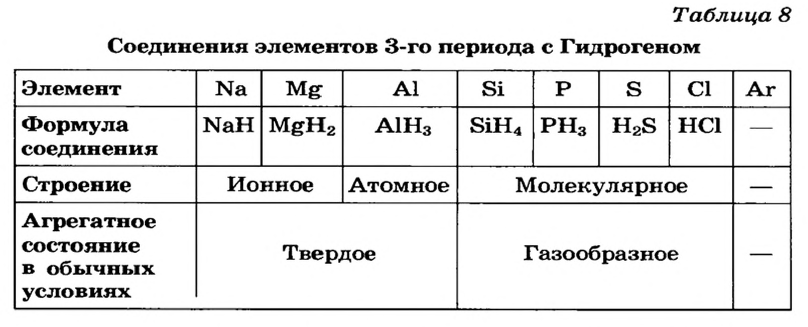
Силиций и Фосфор находятся в середине периода. Силан 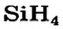 и фосфин
и фосфин 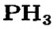 — газы, которые почти не растворяются в воде и не реагируют с ней. Эти вещества состоят из молекул.
— газы, которые почти не растворяются в воде и не реагируют с ней. Эти вещества состоят из молекул.
Далее в периоде размещены Сульфур и Хлор. Их соединения с Гидрогеном — сероводород 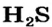 и хлороводород
и хлороводород 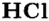 — являются молекулярными веществами. Это — газы, которые растворяются в воде; их растворы ведут себя как кислоты.
— являются молекулярными веществами. Это — газы, которые растворяются в воде; их растворы ведут себя как кислоты.
Строение и свойства большинства соединений элементов 2-го периода с Гидрогеном такие ясе, как и соединений элементов 3-го периода. Приведем несколько примеров. Литий гидрид 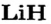 — ионное кристаллическое вещество, напоминающее соль (как и
— ионное кристаллическое вещество, напоминающее соль (как и 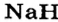 ). Метан
). Метан 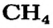 — газообразное молекулярное соединение, нерастворимое в воде (как и
— газообразное молекулярное соединение, нерастворимое в воде (как и 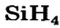 ). Фтороводород
). Фтороводород 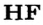 — газ, который состоит из молекул. Его водный раствор проявляет кислотные свойства; это — фторидная кислота. Словом, фтороводород похож на хлороводород
— газ, который состоит из молекул. Его водный раствор проявляет кислотные свойства; это — фторидная кислота. Словом, фтороводород похож на хлороводород 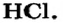
Это интересно. Жидкий аммиак 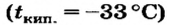 реагирует со щелочными металлами как кислота (с выделением водорода).
реагирует со щелочными металлами как кислота (с выделением водорода).
Однако два соединения элементов 2-го периода с Гидрогеном — аммиак  и вода
и вода  — отличаются соответственно от фосфина
— отличаются соответственно от фосфина  и сероводорода
и сероводорода  Аммиак хоть и является газом, но его раствор напоминает очень разбавленный раствор щелочи. А вода — соединение нейтрального характера.
Аммиак хоть и является газом, но его раствор напоминает очень разбавленный раствор щелочи. А вода — соединение нейтрального характера.
Выводы:
- Существует связь между химическими свойствами высших оксидов, соответствующих гидроксидов и положением элементов в периодической системе.
- Основные свойства высших оксидов и гидроксидов усиливаются в периодах справа налево, в главных подгруппах — сверху вниз, а кислотные свойства — в противоположном направлении.
- Соединения типичных металлических элементов с Гидрогеном имеют ионное строение и напоминают соли. Соединения типичных неметаллических элементов с Гидрогеном состоят из молекул. Их водные растворы являются кислотами.
Значение периодического закона
Современную химию невозможно представить без периодического закона и периодической системы элементов. Периодический закон, или закон периодичности, аккумулирует важнейшие знания о химических элементах, простых веществах и соединениях. Он позволяет объяснить многие химические факты, помогает осознать и обосновать различные закономерности в мире химических элементов, веществ и их превращений, предсказать возможности получения неизвестных соединений.
Открытие Д. И. Менделеевым периодического закона побудило к поискам причин периодичности среди элементов, простых веществ и однотипных соединений. Ученые сконцентрировали свои усилия на исследовании атомов, их природы. Обнаружение на рубеже XIX—XX вв. сложного строения атома, а позже — и атомного ядра привело к выяснению физической сути периодического закона. Менделеев писал, что «периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает».
Значение периодического закона для химической науки огромно. Его успешно используют и в других науках; этот закон помогает постичь научную картину материального мира. Ученые-биологи доказали, что подобные элементы и их соединения могут выполнять сходные функции в организме, иногда — заменять друг друга. На основании химического анализа горных пород, минералов, руд геологи обнаружили, что подобные элементы часто встречаются в природе вместе. Исследуя соединения аналогичного состава, физики установили сходство их строения и физических свойств.
Периодический закон и периодическая система являются основой неорганической химии. Ученикам и студентам не стоит запоминать состав и химические свойства большого количества веществ. Это и невозможно сделать. Нужно научиться выделять, понимать и прогнозировать главное об элементах и веществах, используя периодический закон и периодическую систему.

Жизнь и деятельность Д. И. Менделеева
Дмитрий Иванович Менделеев родился в сибирском городе Тобольск в 1834 г. Его отец был учителем, затем — директором местной гимназии. Дмитрий, обучаясь в этой гимназии, больше всего интересовался математикой и физикой.
В 1850 г. Д. И. Менделеев поступил на физико-математический факультет Санкт-Петербургского главного педагогического института (рис. 73). Здесь он увлекся химией. В 1855 г. Менделеев закончил институт с золотой медалью и был направлен на работу учителем гимназии в г. Симферополь. Из-за Крымской войны он переехал в Одессу, учительствовал в Ришельевской гимназии, а затем возвратился в Петербург, где защитил магистерскую диссертацию. В 1857 г. Менделееву присудили звание доцента; он читал лекции в Петербургском университете.
В 1859—1861 гг. Менделеев работал в Гей-дельбергском университете (Германия), где исследовал физические свойства газов и жидкостей. Он установил, что существует температура (так называемая критическая температура кипения), выше которой вещество не может находиться в жидком состоянии даже при высоком давлении. Ученый вывел уравнение состояния идеального газа, которое ныне называют уравнением Менделеева — Клапейрона. В 1860 г. Менделеев принял участие в I Международном съезде химиков в Карлсруэ.
Возвратившись в 1861 г. в Петербург, ученый продолжает работать в университете, пишет учебник «Органическая химия», разрабатывает химическую теорию растворов. В 1865 г. Менделеев защищает докторскую диссертацию, а в 1868 г. становится профессором Санкт-Петербургского университета. Ученый инициирует создание Русского физико-химического общества (оно существует и по Сей день и носит имя Менделеева). У него было много учеников — молодых химиков.

В 1869 г. в возрасте 35 лет Д. И. Менделеев открыл периодический закон. Периодическую систему он включил в свой знаменитый учебник «Основы химии» (рис. 74), в котором изложил важнейшие химические знания на основе периодического закона. Менделеев преобразовал совокупность химических элементов в стройную систему. С того времени наука химия приобрела целостность и логическое совершенство. «Основы химии» были изданы в России при жизни ученого 8 раз, а также во многих других странах. Автор постоянно дополнял и совершенствовал свой учебник.
Это интересно. Русский поэт А. Блок писал о Менделееве: «...Он давно все знает... Его знание наиболее полно. Оно происходит от гениальности... »
Менделеев имел широкий круг научных интересов в различных областях естествознания и промышленности. Он выдвинул теорию минерального (неорганического) происхождения нефти, предложил промышленный способ ее переработки, транспортировку нефти трубопроводом, изобрел способ изготовления бездымного пороха. Выдающийся ученый также исследовал изменение давления в атмосфере с высотой, совершенствовал технику разнообразных измерений, повышал точность взвешиваний, изменяя конструкции весов. Он организовал Главную палату мер и весов. Д. И. Менделеев постоянно давал полезные рекомендации относительно добычи нефти, выращивания зерновых культур, создал программу развития промышленности России, разрабатывал идеи развития различных областей хозяйства, настаивал на тщательном изучении природных ресурсов.

Ученый поддерживал тесные связи с Украиной, химиками Киевского и Харьковского университетов, был избран почетным членом советов Киевского, Харьковского и Одесского университетов. В 1898 г. Менделеев принял участие в создании Киевского политехнического института. Он изучал работу угледобывающей промышленности в Донбассе, предложил идею подземного превращения угля в газообразное топливо. Среди его друзей были известные украинские художники. Менделеев немного знал украинский язык.
Д. И. Менделеев был очень образованным, высококультурным человеком. Его избрали своим почетным членом свыше 70 академий наук и научных обществ разных стран. Ученому присвоили звание профессора Оксфордский, Кембриджский, другие престижные университеты мира (рис. 75). Полное собрание научных работ Менделеева насчитывает 25 томов.

В конце жизни Менделеев писал: «...периодический закон, исследование упругости газов, понимание растворов как ассоциаций, «Основы химии». Здесь все мое богатство. Оно не отнято у кого-то, а создано мной, это мои дети...» (рис. 76).
Умер Менделеев в 1907 г.
В честь выдающегося ученого, признавая его заслуги перед мировой наукой, было решено дать открытому американскими учеными в 1955 г. химическому элементу № 101 название Менделевий.
Выводы:
- Периодический закон — основной закон химии. Он устанавливает связь между всеми химическими элементами, позволяет предсказать их характер, свойства простых веществ и соединений.
- Периодический закон используют физики, биологи, геологи, ученые других специальностей.
- Изучать химию, не опираясь на периодический закон и периодическую систему элементов, невозможно.
- Дмитрий Иванович Менделеев, открыв периодический закон и создав периодическую систему элементов, стал одним из выдающихся химиков. Он много сделал для развития химической науки, промышленности, образования.
Периодический закон в периодической системе химических элементов Д. И. Менделеева
Вы учились пользоваться периодической системой как справочной. При изучении этой темы, вы узнаете: чем обусловлено размещение того или иного элемента в определенной клетке таблицы; как с ее помощью можно прогнозировать свойства веществ; о связи между строением атома и свойствами веществ.
Исторические сведения о попытках классификации химических элементов
Химия, как и любая другая наука, использует определенные формы научных знаний — факты, понятия, законы, теории. Фактами о некоторых химических элементах и образованных ими простых веществ, например о железе, серебре, олове, золоте и др., люди оперировали давно. Даже придумали обозначение символов элементов, из атомов которых эти вещества образованы.
С накопления фактов начинается развитие каждой науки, а со временем возникает потребность в их классификации — разделении по определенным признакам. До 1750 года было известно 15 химических элементов. Это не так уже и много, чтобы чувствовалась острая необходимость в их классификации. Но следующие 50 лет ознаменовались открытием еще 20 химических элементов, то есть их стало вдвое больше. На первую половину XIX ст. (1801—1850 гг.) пришлось открытие еще 24 химических элементов. К 1869 г. количество известных химических элементов достигло 63, а различных веществ — сотен тысяч. Согласитесь, такое количество элементов и соединений требовало определенной классификации, т. к. работать с информацией, изучать химию только путем запоминания формул невозможно.
Первые классификации обычно несовершенны. Вам хорошо известно, что киты, хотя и проживают в водной среде, принадлежат к классу млекопитающих. Но в биологии виды животных сначала классифицировали по месту их обитания. Поэтому киты попали в одну группу с рыбами.
Совершим экскурс в историю химии
Одна из первых классификаций (1786—1787 гг.) принадлежит Антуану Лавуазье. Он разделил известные в то время элементы на металлы и неметаллы, или металлоиды. (Вспомните общие характерные свойства простых веществ, образованных атомами этих элементов, а также свойства их оксидов и гидроксидов, и сделайте вывод о том, что было положено в основу этого разделения.) Однако это разделение оказалось несовершенным, т. к. существуют элементы, которые в зависимости от условий могут проявлять химические свойства как металлических, так и неметаллических элементов. Примером могут служить опыты с гидроксидом цинка, проведенные вами во время изучения классов неорганических соединений. Вы тогда убедились, что гидроксид цинка образует соли, реагируя и с кислотой, и с основанием (щелочью). Подобные свойства проявляют гидроксиды алюминия, свинца, бериллия и некоторых других элементов. То есть, как простые вещества они по своим физическим свойствам относятся к металлам; в то же время, как их соединения по химическим свойствам амфотерны.
Амфотерный характер некоторых гидроксидов свидетельствует о несовершенстве первой попытки классификации элементов.
Следующая классификация заключалась в объединении элементов на основе сходных свойств образованных ими веществ в природные группы — семейства — щелочных металлов, галогенов, инертных газов и др. Несовершенство этой классификации заключается в том, что в ней не прослеживаются связи между отдельными группами элементов.
В 1829 г. немецкий химик Йоганн Деберейнер заявил, что все известные элементы можно разделить на группы, в каждую из которых будут входить по три химически похожих элемента. Он назвал их триадами. Рассмотрим примеры триад:
а) литий, натрий, калий; б) сера, селен, теллур; в) хлор, бром, иод.
Однако попытки ученого сгруппировать все известные на то время элементы в триады потерпели неудачу. Он обнаружил лишь 5 триад и вывел для них такую зависимость: атомная масса среднего в триаде элемента является средней арифметической атомных масс крайних элементов.
В 1863 г. английский химик Джон Ньюлендс заметил, что если разместить элементы в порядке увеличения их атомных масс (тогда масса называлась «атомный вес»), то каждый восьмой элемент подобен первому (отсчет вели от любого, избранного в качестве начального, элемента). Ученый образно сравнил это с музыкальной октавой. В виде октав ему удалось разместить (не нарушая правило) первые 17 химических элементов, имеющихся в современной периодической системе. А так как далее закономерность нарушалась, об этой классификации быстро забыли.
Ближе всех к открытию закона, который объяснял бы свойства всех химических элементов, а также их соединений, подошел немецкий химик Лотар Мейер, который в 1864 г. разместил элементы в порядке возрастания их атомных масс и распределил на 6 групп, согласно валентности. Однако сделать теоретические выводы и установить периодическую закономерность ученому не удалось.
Нетрудно заметить, что в рассмотренных выше классификациях ученые принимали за основу сходство состава и свойств веществ. То есть, они искали закон объединения групп подобных элементов, и этот путь оказался тупиковым.
Русский химик Дмитрий Иванович Менделеев, в отличие от своих предшественников, занялся поиском закономерностей в изменении свойств элементов. Это было верное решение, и в 1869 г. ученый открыл общий закон природы — периодический закон.
Итоги:
- Любая наука начинается с накопления фактов, которые со временем ученые классифицируют — разделяют на группы по определенным признакам.
- В основу классификации химических элементов на металлические и неметаллические вначале было положено сходство физических свойств простых веществ.
- На основании схожести свойств элементов и их соединений были выделены природные семейства — щелочных металлов, галогенов, инертных газов.
- В XIX ст. ученые И. Деберейнер, Дж. Ньюлендс, Л. Мейер попытались ввести новые классификации химических элементов, однако в них не отображались связи между отдельными группами элементов.
- До открытия периодического закона знания о химических элементах существовали в виде фактов, не связанных в единое целое.
- В 1869 г. Д. И. Менделеев открыл периодический закон — общий закон природы.
Понятие о щелочных металлах
Щелочные металлы — литий 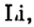 натрий
натрий 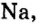 калий
калий 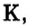 рубидий
рубидий 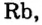 цезий
цезий 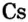 были открыты в XIX веке. Щелочной металлический элемент франций добыт искусственно в XX веке. Название щелочные металлы эти вещества получили потому, что их гидроксиды — щелочи — мыльные на ощупь. Щелочные металлы в природе встречаются лишь в составе соединений, поскольку их простые вещества вследствие высокой химической активности не существуют в свободном состоянии.
были открыты в XIX веке. Щелочной металлический элемент франций добыт искусственно в XX веке. Название щелочные металлы эти вещества получили потому, что их гидроксиды — щелочи — мыльные на ощупь. Щелочные металлы в природе встречаются лишь в составе соединений, поскольку их простые вещества вследствие высокой химической активности не существуют в свободном состоянии.
Физические свойства щелочных металлов
Простые вещества литий, натрий, калий, рубидий, цезий — металлы серебристо-белого цвета с ярко выраженным металлическим блеском, настолько мягкие, что легко режутся ножом. Они относятся к легким и легкоплавким веществам, имеют высокие теплопроводность и электропроводность. То есть, это типичные металлы, физические свойства которых во многом подобны.
Однако «подобный» не означает «одинаковый». В подтверждение этого поработайте с таблицей 2 и выясните:
1) подтверждается ли приведенная в тексте информация о невысоких температурах плавления и кипения щелочных металлов;
2) какой из щелочных металлов имеет самую низкую температуру плавления (сравните ее с температурой тела человека);
3) к легким или тяжелым металлам относятся щелочные металлы (металлы с плотностью до 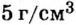 называют легкими);
называют легкими);
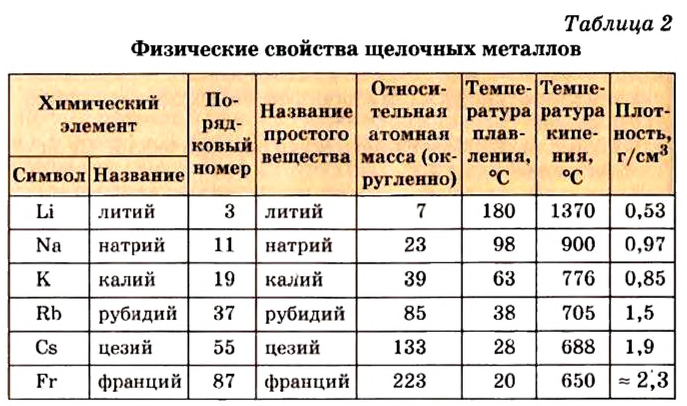
4) как изменяются относительная атомная масса элементов, температура плавления и кипения, плотность щелочных металлов с увеличением порядкового номера (протонного числа).
Итак, вы убедились в том, что элементы не случайно объединены в одно семейство.
Место щелочных металлов в периодической системе
Найдем в периодической системе клетки с символами щелочных металлических элементов. Литий находится в клетке под номером 3, натрий — 11, калий — 19, рубидий — 37, цезий — 55, франций — 87. Нетрудно заметить, что в периодической системе они расположены друг под другом, в столбец. Существенно отличаются порядковые номера (протонные числа) этих элементов. Отличаются щелочные металлы и относительной атомной массой, причем каждый следующий элемент имеет большую относительную атомную массу, чем предыдущий. С увеличением относительных атомных масс элементов изменяются физические свойства щелочных металлов.
Рассмотрим внимательнее периодическую систему и попробуем найти общие признаки в размещении щелочных металлических элементов. Оказывается, что ими начинаются все (кроме первого) горизонтальные ряды элементов, которые называются периодами. У щелочных металлических элементов одинаковая общая формула оксидов, в которых они одновалентны.
Химические свойства щелочных металлов
Щелочные металлы — чрезвычайно активные простые вещества.
1. Взаимодействие с кислородом. На воздухе при комнатной температуре щелочные металлы окисляются кислородом и образуют оксиды:
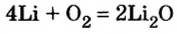
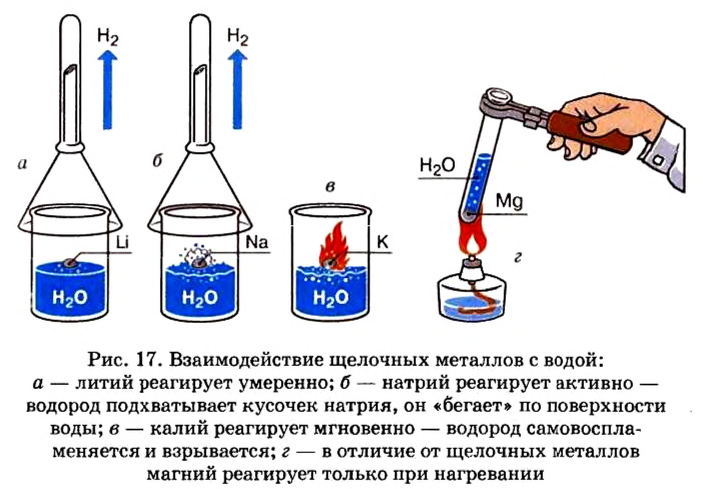
Другие щелочные металлы образуют еще и пероксиды. Если литий, натрий или калий нагреть, то окисление сопровождается горением, т. е. выделением света и тепла. Активность же рубидия и цезия настолько высока, что эти металлы горят без предварительного нагревания.
2.Взаимодействие с водой. Все щелочные металлы взаимодействуют с водой и образуют гидроксиды — щелочи. Реакция сопровождается выделением водорода и тепла (рис, 17).
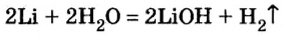
(Проанализируйте состав и количество реагентов и продуктов реакции, сделайте вывод, к какому типу реакций относится взаимодействие щелочных металлов с водой.)
Литий реагирует с водой медленно, натрий — намного быстрее, калий очень быстро, с выделением такого количества тепла, что водород загорается. Активность рубидия и цезия в реакции с водой еще выше, чем активность калия.
3. Взаимодействие с неметаллами. Щелочные металлы взаимодействуют со многими неметаллами, в частности с теми, которые образуют с металлами соли бескислородных кислот:
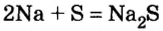
Изучая химические свойства кислот и солей, вы рассматривали их взаимодействие с металлами. Однако уравнений реакций со щелочными металлами не записывали. Поскольку эти реакции происходят в растворе, то металл взаимодействует с водой, а образовавшаяся щелочь продолжает реагировать с кислотой или солью. Это свидетельствует о высокой активности щелочных металлов и их соединений.
Общность физических и химических свойств рассмотренных металлов дала возможность выделить их как семейство щелочных металлов.
Итоги:
- К семейству щелочных металлов относятся металлы литий
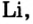 натрий
натрий 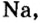 калий
калий 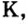 рубидий
рубидий 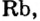 цезий
цезий 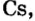 франций
франций  поскольку они имеют сходные свойства в свободном состоянии и образуют сходные по составу и свойствам оксиды и гидроксиды.
поскольку они имеют сходные свойства в свободном состоянии и образуют сходные по составу и свойствам оксиды и гидроксиды. - Щелочные металлы имеют ярко выраженные физические свойства металлов — блеск, теплопроводность, электропроводность и др.
- В периодической системе щелочные металлические элементы размещены в начале периодов (кроме первого).
- Химическая активность щелочных металлов высока, что подтверждается взаимодействием с кислородом, водой, неметаллами и другими веществами.
- С увеличением порядкового номера (протонного числа) химическая активность щелочных металлов возрастает.
О железе, золоте, серебре, меди и некоторых других металлах человек знал давно, чего нельзя сказать о щелочных металлах. Причина заключается в их чрезвычайно высокой активности. Длительное время попытки получить традиционными методами натрий или калий в свободном состоянии из солей этих металлов, например из хлорида натрия, хлорида калия, карбоната калия, были безуспешными. И только в 1808 г. английский ученый Гемфри Дэви сообщил об открытии новых элементов — натрия и калия.
Как ему это удалось? С помощью постоянного электрического тока ученый провел электролиз щелочи. При этом около отрицательно заряженного электрода в расплаве щелочи Г. Деви наблюдал появление шариков с ярким металлическим блеском, которые по внешнему виду напоминали ртуть. Часть из них сгорала ярким пламенем, и горение сопровождалось взрывом, а часть достаточно быстро тускнела. Причина такого явления — химическая активность щелочных металлов. Не случайно эти металлы хранят в запаянных ампулах или под слоем керосина, который делает невозможным их взаимодействие с другими веществами. Проведя много опытов, ученый убедился, что получил металлы калий и натрий в свободном состоянии. После изучения их свойств он сообщил о своем открытии. Через 10 лет был открыт литий, а через полвека — рубидий и цезий. Представитель семейства щелочных металлов — элемент франций был открыт французской исследовательницей Маргаритой Перей через 132 года после открытия натрия и калия. Она назвала его в честь своей родины.
Понятие о галогенах и инертных газах
Существуют семейства и среди неметаллов, например семейство галогенов или инертных газов.
Типичные неметаллы, входящие в состав семейства галогенов, — фтор, хлор, бром, иод — были открыты приблизительно в то же время, что и щелочные металлы, то есть в первой половине XIX века. Астат, которого слишком мало в природе, был получен уже в XX веке. В переводе с гр. галогены означает солероды. Свое название галогены получили благодаря способности легко вступать в реакцию с металлами и образовывать соли бескислородных кислот. Подобно щелочным металлам, галогены в природе встречаются лишь в виде соединений, т. к. их простые вещества проявляют высокую химическую активность. Молекулы всех галогенов двухатомны независимо от их агрегатного состояния — 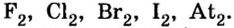 Валентность атомов галогенов в этих соединениях равна 1.
Валентность атомов галогенов в этих соединениях равна 1.
Физические свойства галогенов
Все галогены — вещества, имеющие запах и цвет. Запах у них резкий, раздражает органы дыхания, а при длительном воздействии вызывает удушье.
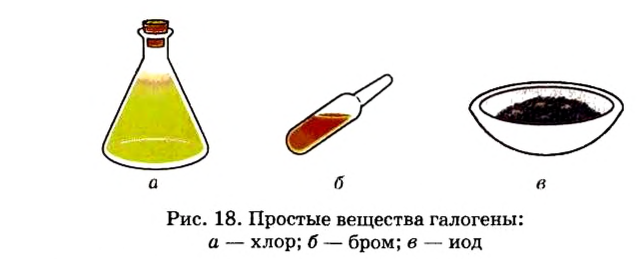
При обычных условиях фтор и хлор — газообразные вещества, бром — жидкость, йод — твердое вещество (рис. 18). Данные о физических и других свойствах галогенов представлены в таблице 3.
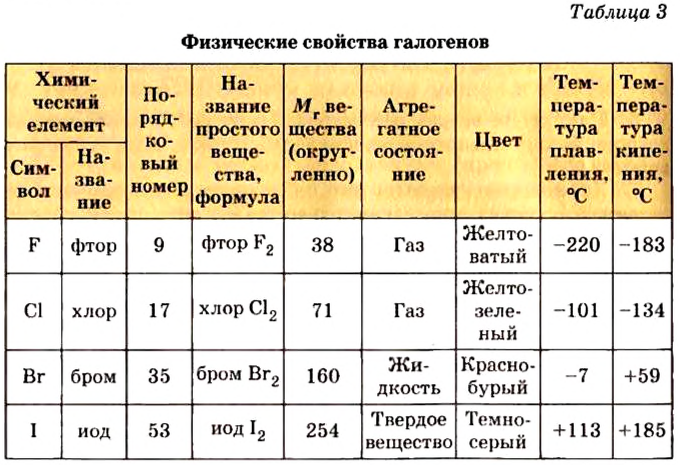
Место галогенов в периодической системе
Отыщем в периодической системе клетки с символами химических элементов семейства галогенов. Как видим, они размещены в столбец, через определенное количество других элементов. В отличие щелочных элементов, которыми начинаются периоды, галогены размещены в конце периодов. После них в периоде находится лишь один химический элемент — представитель семейства инертных газов, информация о котором приведена в этом параграфе. У галогенов преобладает общая формула высшего оксида — 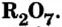 Запомните, что она не распространяется на оксид фтора
Запомните, что она не распространяется на оксид фтора 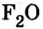 и оксид брома
и оксид брома 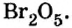
Все без исключения галогены образуют летучие соединения с водородом, которые имеют общую формулу 
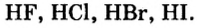
Химические свойства галогенов
Галогены относятся к активным неметаллам. Они реагируют со многими неорганическими и органическими веществами (их вы будете изучать в старших классах). Рассмотрим взаимодействие галогенов с водородом и металлами.
1. Взаимодействие галогенов с водородом. При взаимодействии с водородом галогены образуют галогеноводороды:

(Определите валентность фтора и брома в образовавшихся веществах.)
Смесь водорода и фтора взрывается даже в темноте. Для того чтобы прореагировали хлор и водород, смесь нужно поместить на яркий свет или нагреть. Бром и парообразный йод реагируют с водородом только при нагревании, причем более, чем это нужно в случае реакции хлора с водородом.
Водные растворы бинарных соединений галогенов с водородом (галогеноводороды) проявляют кислотный характер, т. е. являются бескислородными кислотами. Активность этих кислот возрастает от фтороводородной 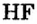 к йодоводородной
к йодоводородной 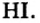
Используя приведенную выше информацию, сделайте вывод, как изменяются:
а) химическая активность галогенов в реакции с водородом от фтора к иоду;
б) активность бескислородных кислот, полученных растворением галогеноводородов в воде.
2.Взаимодействие галогенов с металлами. Галогены активно реагируют с металлами.
Так, натрий без нагревания соединяется с хлором:
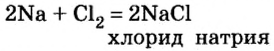
Раскаленное железо сгорает в хлоре ослепительным пламенем:
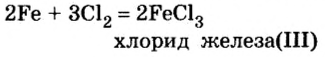
Смесь порошков алюминия и йода при комнатной температуре может продолжительное время находиться в неизменном виде. Но стоит добавить к ней несколько капель воды, как начинается бурное взаимодействие:
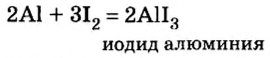
Следовательно, это реакция каталитическая. Катализатором является вода (в небольших количествах).
В рассмотренных уравнениях продуктами реакций являются соли — хлориды и иодиды. Существуют также и такие соли, как фториды и бромиды, например 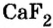 или
или 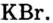
(Определите валентность галогенов в приведенных примерах солей и убедитесь, что, как и в соединениях с водородом, она равна 1.)
Как видим, галогены активно взаимодействуют с металлами и образуют соли бескислородных кислот, содержащих одновалентный кислотный остаток, название которого заканчивается суффиксом -ид (фторид, хлорид, иодид,бромид). Общим для всего семейства галогенов является взаимодействие хлоридов, бромидов, иодидов с раствором нитрата серебра, которое сопровождается образованием осадков, нерастворимых не только в воде, но и в кислотах:
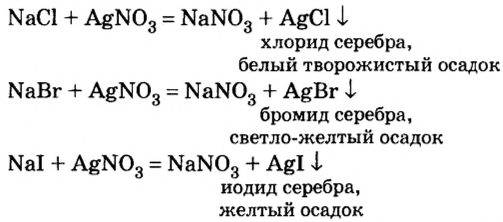
Итак, элементы, отнесенные к семейству галогенов, а также их соединения имеют много общего, а физические и химические свойства галогеносодержащих веществ изменяются с изменением порядкового номера (протонного числа) химических элементов в периодической системе.
Понятие об инертных элементах
В конце XIX ст. экспериментальные методы исследований в химии достигли такого уровня, что на протяжении шести лет было открыто 6 новых химических элементов и определено их место в периодической системе. Это гелий 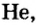 неон
неон  аргон
аргон 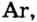 криптон
криптон 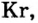 ксенон
ксенон 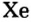 и радон
и радон 
Внимание английского физика Джона Релея привлек тот факт, что у азота, полученного из воздуха, и азота, полученного из его соединений, различная плотность. За объяснением он обратился к другому ученому — Уильяму Рамзаю. После серии экспериментов по сжижению воздуха и разделению полученной смеси на отдельные компоненты, в составе воздуха было обнаружено простое газообразное вещество аргон с одноатомными молекулами. (Раньше, благодаря спектральному анализу, физики установили наличие большого количества неона на Солнце.) Вслед за аргоном в составе воздуха были открыты еще три газообразных простых вещества — криптон, неон и ксенон. Последним был открыт радон, присутствующий среди продуктов радиоактивного распада радия (детальнее о радиоактивном распаде вы узнаете из §31). Открытые элементы были отнесены к одному семейству инертных, или благородных элементов. Все инертные химические элементы относятся к малораспространенным на Земле элементам. Так, У. Рамзай отмечал, что ксенона в воздухе меньше, чем золота в морской воде. И это еще одно доказательство того, насколько важны экспериментальные методы исследований и для открытия химических элементов и для создания новых веществ.
Все инертные элементы в свободном состоянии при обычных условиях — газообразные вещества. От других газообразных простых веществ они отличаются одноатомным составом молекул. До 1962 г. ученым не удавалось получить соединения инертных элементов. В настоящее время известно свыше 200 соединений ксенона, криптона и радона, полученных в специальных условиях.
С открытием инертных элементов возникла проблема размещения их в периодической системе. То, что они наделены подобными свойствами, из которых основное — инертность (бездеятельность, пассивность) относительно других веществ, свидетельствовало в пользу выделения их в отдельную группу периодической системы. В 1900 г. было принято решение создать нулевую группу и разместить там инертные элементы. Но в современной периодической системе, после получения соединений инертных элементов с другими элементами (в основном со фтором, кислородом и хлором), инертные элементы включены в VIII группу и размещены в ней друг под другом. Поработайте с периодической системой и найдите в ней элементы с порядковыми номерами (протонными числами) 2, 10, 18, 36, 54, 86. Вы убедитесь, что инертным газом заканчивается каждый период, кроме последнего, который еще не завершен.
Итоги:
- Среди химических элементов встречаются элементы с подобными свойствами простых и сложных веществ, образованных ими. Их объединяют в семейства.
- Примером семейства металлических элементов является семейство щелочных химических элементов — литий, натрий, калий, цезий и франций.
- Щелочные металлы — это типичные металлы как по физическим, так и по химическим свойствам. Они проявляют высокую химическую активность, возрастающую с увеличением относительной атомной массы элементов.
- Примером семейства неметаллических элементов является семейство галогенов — фтор, хлор, бром, иод, астат.
- Галогены — это типичные неметаллы. Они также проявляют высокую химическую активность, убывающую с увеличением относительной атомной массы элементов.
- Инертные, или благородные элементы — гелий, неон, аргон, криптон, ксенон и радон — особенное семейство. Простые вещества, образованные атомами этих элементов, имеют одноатомные молекулы, газообразны по агрегатному состоянию и проявляют стойкую инертность (пассивность) к взаимодействию с другими веществами.
Несмотря на то, что простые вещества галогены ядовиты и представляют опасность для здоровья человека в случае попадания в организм с воздухом, водой или пищей, ионы  для человека жизненно необходимы. (Вспомните, что отрицательно заряженные ионы называют анионами.)
для человека жизненно необходимы. (Вспомните, что отрицательно заряженные ионы называют анионами.)
Так, организм человека нуждается в анионах фтора для прочности зубной эмали. Поэтому зубные пасты часто содержат соединения этого элемента в виде добавки. Анион хлора входит в состав желудочного сока. Наш организм получает его с поваренной солью. Некоторые лекарственные препараты, которые действуют успокаивающе на нервную систему человека, содержат в своем составе анионы брома. Нужны организму и анионы иода, чтобы правильно функционировала щитовидная железа. Если в ее работе возникают сбои, это сказывается на общем самочувствии человека, развивается тяжелое заболевание — зоб. Вам, очевидно, приходилось видеть на упаковках с поваренной солью надпись «йодированная». Что это означает? К поваренной соли добавлено небольшое количество йодида натрия или йодида калия — так человек может пополнить запасы ионов йода в своем организме.
Д. И. Менделеева
Если вы внимательно изучили предыдущие три параграфа, то вы готовы к восприятию и пониманию одного из важнейших общих законов природы — периодического закона, открытого Дмитрием Ивановичем Менделеевым.
Вспомните, что закон — это утверждение, которое при определенных условиях выполняется относительно всей совокупности исследуемых свойств или явлений. Закон не имеет исключений. Что касается периодического закона, то совокупностью исследуемых свойств являются свойства химических элементов и их соединений.
Ко времени открытия периодического закона были известны 63 химических элемента. Попытки предшественников Д. И. Менделеева классифицировать их по сходным признакам и свойствам не увенчались успехом. Меж тем, химическая наука продолжала чувствовать острую необходимость в классификации химических элементов. Молодой профессор Санкт-Петербургского университета Дмитрий Иванович Менделеев взялся за это дело по собственной инициативе, т. к., обучая студентов и работая над созданием учебника «Основы химии», понимал, насколько важно четко классифицировать элементы.
Перед ученым встал вопрос выбора признака, который следовало бы положить в основу классификации. Конечно, этот признак должен был проявляться во всех без исключения элементах. На то время таких признаков было известно два — валентность и атомная масса химических элементов (тогда она называлась «атомный вес»). Дмитрий Иванович избрал атомную массу, руководствуясь тем, что она является неизменной характеристикой атомов и остается такой, какие бы химические явления не происходили. Валентность же бывает как постоянной, так и переменной, к тому же одинаковую валентность могут проявлять атомы элементов с резко отличающимися химическими свойствами веществ, например, одновалентные щелочные металлы и одновалентные в соединениях с водородом и металлами галогены. Но это не означало, что ученый отказался от использования валентности. Более того, он тщательно анализировал и сравнивал валентности атомов в различных соединениях, и это помогало ему в работе над классификацией химических элементов.
Чтобы выяснить, существует ли общая зависимость свойств химических элементов и их соединений от атомной массы, Менделеев разместил карточки с записями символов химических элементов по возрастанию атомной массы элементов, начиная с водорода. Кроме символа химического элемента на каждой карточке были записаны округленная атомная масса, формула оксида, высшая валентность по кислороду, формула летучего
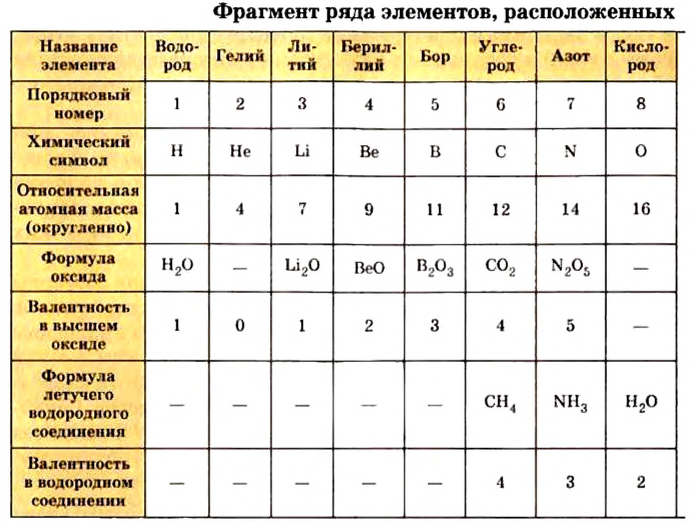
водородного соединения (для неметаллов), валентность элемента в нем. Расположенные в один ряд элементы были пронумерованы, а предоставленный им номер был назван порядковым номером.
Для лучшего восприятия данной информации поработаем с таблицей 4.
Из таблицы следует, что с увеличением атомной массы происходит периодическое повторение свойств элементов. Так, одиннадцатый элемент ряда — натрий — имеет общие свойства с третьим элементом — литием. В пределах ряда от лития к фтору металлические свойства соединений постепенно убывают и при этом нарастают неметаллические свойства. И действительно, после активного щелочного металлического элемента лития четвертым размещен также металлический элемент бериллий, но уже с амфотерными свойствами соединений. Пятый, шестой, седьмой, восьмой, девятый и десятый элементы — неметаллические. Активность простых веществ и соединений этих элементов с увеличением порядкового номера возрастает и достигает максимума у фтора.
Десятым является инертный химический элемент неон. При переходе от галогена к этому элементу наблюдается резкий спад активности. В отличие от галогенов неон не взаимодействует ни с водородом, ни с металлами и по своим свойствам подобен элементу с порядковым номером 2, то есть гелию.
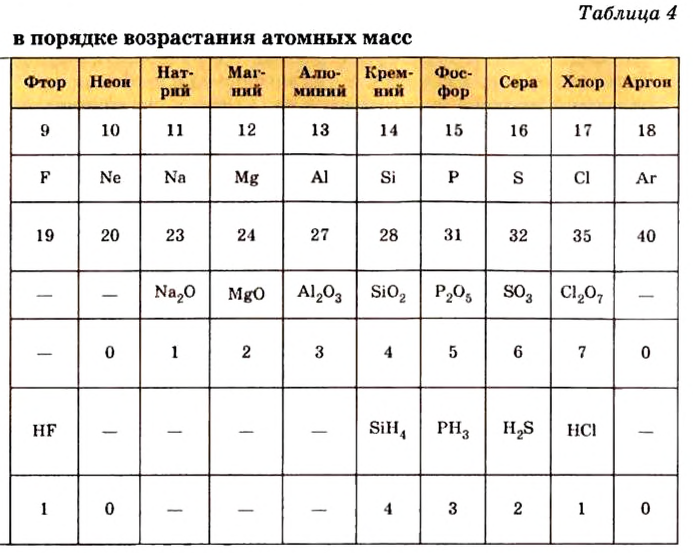
За натрием следует типичный металлический элемент магний, после него под порядковым номером 13 стоит амфотерный металлический элемент алюминий. Дальше, как и в интервале бор — неон, под номерами 14, 15, 16, 17, 18 размещены неметаллические элементы. У них также постепенно нарастают неметаллические свойства, которые достигают максимума у размещенного семнадцатым хлора. После хлора опять появляется неактивный инертный элемент аргон. То есть, через восемь химических элементов свойства повторяются.
Проанализируем остальные записи на карточках и сделаем вывод, что с увеличением атомной массы от лития и до неона, от натрия и до аргона наблюдается одинаковое изменение таких характеристик: металлические свойства элементов ослабляются, неметаллические нарастают; валентность по кислороду увеличивается; валентность неметаллов в бинарных соединениях с водородом уменьшается.
Продолжив анализировать дальше, увидим, что девятнадцатый элемент калий — представитель щелочных элементов — повторяет свойства элементов с порядковыми номерами 3 и 11.
Выяснив, что при постоянном увеличении атомной массы свойства элементов и их соединений периодически повторяются, Д. И. Менделеев сообщил о своем открытии. Вскоре оно получило название периодического закона Д. И. Менделеева.
Случилось это 1 марта (по новому стилю) 1869 года. В формулировке своего первооткрывателя закон звучит так.
Свойства простых веществ, а также формы и свойства соединений химических элементов находятся в периодической зависимости от величины атомного веса элементов.
Сделав вывод о периодической повторяемости свойств элементов и их соединений при постоянном увеличении атомной массы, Д. И. Менделеев разбил единый ряд элементов на более короткие ряды и разместил их так, чтобы элементы семейств были друг под другом. Так появилось графическое отображение периодического закона — периодическая таблица, которую со временем назвали периодической системой.
Следует отметить, что было несколько случаев нарушения периодичности. Это навело ученого на мысль, во-первых, проверить достоверность атомных масс некоторых элементов, а во-вторых, предусмотреть существование еще не открытых элементов.
Приведем примеры:
Пример 1. До начала работы Д. И. Менделеева над созданием классификации элементов считали, что относительная атомная масса бериллия — 13,5. В таком случае он должен был бы разместиться между углеродом и азотом. Но тогда похожие элементы не попали бы в одну группу. Дмитрий Иванович обратил внимание на то, что в соответствии с формой и свойствами соединений этот элемент должен занять место между литием и бором, и высказал предположение об ошибке в определении относительной атомной массы бериллия. Экспериментальные исследования подтвердили правильность предположения Д. И. Менделеева.
Пример 2. При построении периодической таблицы Д. И. Менделеев оставил немало свободных клеток, считая, что среди известных 63 химических элементов нет таких, которые бы в соответствии со свойствами их веществ можно было там разместить. Например, такими были клетки с порядковыми номерами 21, 31, 32. Но Д. И. Менделеев не только предусмотрел под этими номерами еще не открытые элементы, но и правильно описал их свойства. Все три элемента были открыты при жизни Д. И. Менделеева и получили названия скандий, галлий, германий. Их свойства совпали со свойствами, предусмотренными великим ученым. После этих открытий периодический закон был всемирно признан, а периодическая система как графическое отображение данного закона стала таблицей номер один для всех химиков и тех, кто изучает химию.
Тот факт, что инертные и некоторые другие элементы, открытые после 1869 года, нашли свое место в периодической системе, свидетельствует об универсальном характере данного закона.
Итоги:
- Предшественники Д. И. Менделеева подготовили почву для открытия периодического закона, но, избрав за основу классификации признак подобности свойств отдельных групп элементов, не смогли вывести закономерность, которая бы касалась всех без исключения элементов.
- Д. И. Менделеев избрал за основу классификации атомную массу — постоянную и неизменную характеристику, которая касается всех элементов и для каждого из них имеет определенное значение, т. е. никогда не повторяется.
- Обнаруженная Д. И. Менделеевым периодическая повторяемость свойств веществ дала ему возможность сформулировать периодический закон.
- Периодический закон — это закон природы, который объясняет формы и свойства веществ, позволяет предсказывать и открывать новые элементы, создавать новые вещества.
Научный работник Бонифатий Михайлович Кедров детально изучил наследство первооткрывателя периодического закона Д. И. Менделеева и опубликовал материалы исследования, в которых присутствуют приведенные ниже цитаты самого Менделеева:
«Я был с самого начала глубоко убежден в том, что главное свойство атомов — атомный вес, или масса атома — должно определять основные свойства каждого элемента... Сопоставив все, я вполне ясно увидел периодический закон и получил полное подтверждение, что он отвечает глубинной природе вещей. В его свете передо мной раскрылись целые новые области науки. Я в него внутренне поверил той верой, которую считаю необходимой для каждого плодотворного дела».
А еще Дмитрий Иванович предусмотрел, что новые открытия ученых не угрожают закону разрушением, а только «надстройку и развитие обещают». И это действительно так!
Д. И. Менделеева и периодическая система
С записями в каждой клетке периодической системы вы ознакомились в 7 классе. Вспомним их. В клетке под номером 29 записано: символ химического элемента — 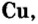 его название — медь, название простого вещества — медь, относительная атомная масса элемента — 64. Такие данные есть о каждом элементе.
его название — медь, название простого вещества — медь, относительная атомная масса элемента — 64. Такие данные есть о каждом элементе.
В прошлом учебном году вы использовали периодическую систему лишь как справочную, когда нужно было узнать, сколько протонов, нейтронов и электронов входит в состав атома, какова его относительная атомная масса. Теперь вы будете детально изучать структуру периодической системы, выясните, что означают записи в ней, как характеризовать свойства элемента и его соединений по месту в периодической системе.
Периодическая система, ее форма и структура
Графическим выражением периодического закона является периодическая система, предложенная Д. И. Менделеевым.
Периодической системой называется упорядоченное множество химических элементов и их классификация.
Прообразом современной периодической системы была таблица «Опыт системы элементов, основанной на их атомном весе и химическом сходстве», опубликованная Д. И. Менделеевым 1 марта 1869 г. (рис. 19). В течение двух с половиной лет ученый совершенствовал систему, распределяя элементы по группам, периодам, рядам, после чего она приобрела современные очертания.
За годы существования периодической системы предлагались различные варианты ее графического изображения — преимущественно таблицы, хотя встречались и геометрические фигуры, спирали и др. Наибольшее одобрение получили две табличные формы — короткая (первый форзац учебника) и длинная (второй форзац учебника). Более распространена короткая форма периодической системы.

В структуре таблицы различают горизонтальные ряды элементов — периоды и вертикальные столбцы элементов — группы.
Характеристика периодов
Рассмотрим более подробно периоды периодической системы.
Период — это горизонтальный ряд химических элементов, расположенных в порядке возрастания их атомных масс, который начинается щелочным металлическим элементом, а закапчивается инертным элементом.
Исключения составляют первый период, который начинается водородом и содержит только 2 элемента, и последний, еще не завершенный, а потому инертный элемент в нем отсутствует. В периодической системе 7 периодов. Они обозначены арабскими цифрами, от 1 до 7. Номера рядов также обозначены арабскими цифрами, от 1 до 10. Обратите внимание, что рядов больше, чем периодов.
Первый, второй, третий и седьмой периоды образованы из одного ряда, а четвертый, пятый и шестой периоды состоят из двух рядов — четного и нечетного.
Первые шесть периодов являются завершенными, т. е. в них нет мест для размещения новых химических элементов. Седьмой период незавершен, и новые химические элементы могут пополнять его.
Периоды, состоящие из одного ряда, называются малыми, а периоды, состоящие из двух рядов,— большими.
(Рассмотрите периодическую систему и найдите в ней малые и большие периоды.)
Как вам известно, повторяемость свойств химических элементов и их соединений происходит периодически, то есть через определенный промежуток элементов. В периодической системе такими промежутками являются периоды. Поработайте с таблицей и выясните, сколькими элементами разделены между собой щелочные металлические элементы натрий и калий, а сколькими — калий и рубидий. Это позволит вам понять, что в малых периодах периодическая повторяемость свойств и форм соединений чаще, чем в больших периодах.
Группы химических элементов
Периодическая система имеет 8 групп. Каждая из них образована элементами, размещенными в одном вертикальном столбце.
Группа — это вертикальный столбец химических элементов, сходных по свойствам и форме их соединений.
Группы пронумерованы римскими цифрами от I до VIII. Найдем в периодической системе химические элементы VII группы. Начинается она фтором. Под ним размещены все другие галогены. В 4 периоде в VII группе появляется еще один столбец элементов — марганец, технеций, рений, борий. Отметим, что, начиная с 4 периода, группы поделены на две подгруппы — главную и побочную.
Перечисленные выше марганец, технеций, рений, борий составляют побочную подгруппу VII группы, а главную подгруппу этой группы составляют галогены.
Главными подгруппами называются подгруппы, в состав которых входят элементы и малых, и больших периодов. Побочными подгруппами называются подгруппы, в состав которых входят элементы только больших периодов.
Вы знаете, что с увеличением относительной атомной массы элементов неметаллические свойства галогенов ослабевают, а металлические свойства щелочных элементов усиливаются. Эта закономерность присуща элементам главных подгрупп.
В пределах подгруппы с увеличением относительной атомной массы элементов их неметаллические свойства ослабевают, а металлические — усиливаются.
Другие структурные составляющие периодической системы
В нижней части периодической системы есть еще четыре горизонтальных ряда, которые называются Высшие оксиды, Летучие водородные соединения, Лантаноиды, Актиноиды.
В ряду Высшие оксиды для каждой группы приведена общая формула оксида с максимальной валентностью элемента, хотя из этого правила есть исключения. Например, медь размещена в I группе, но ее высший оксид имеет формулу 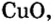 фтор — в VII группе, а формула его соединения с кислородом —
фтор — в VII группе, а формула его соединения с кислородом — 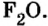 (Определите валентность элемента, обозначенного в общих формулах высших оксидов буквой
(Определите валентность элемента, обозначенного в общих формулах высших оксидов буквой  и вы убедитесь, что она равна номеру группы.)
и вы убедитесь, что она равна номеру группы.)
Общие формулы Летучих водородных соединений (так называются газообразные соединения неметаллов с водородом) записаны только в IV, V, VI и VII группах. А поскольку неметаллические элементы в периодической системе размещены лишь в главных подгруппах, то общие формулы летучих водородных соединений относятся к неметаллическим элементам главных подгрупп. Так, в главной подгруппе IV группы размещены два неметаллических элемента — углерод и кремний. По общей формуле 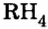 составляем формулы
составляем формулы 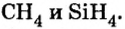
Лантаноиды:
Отыщем в периодической системе элемент с порядковым номером 57. Это лантан. Он находится в 6 периоде, III группе, побочной подгруппе. Обратите внимание, что порядковый номер следующего элемента — гафния — не 58, а 72. И это не ошибка. Элементы с порядковыми номерами 58—71 вынесены в ряд под названием Лантаноиды. Аналогично проделали с элементами, порядковые номера которых 90—103. Их мы найдем в ряду Актиноиды.
Лантаноиды и актиноиды появились в периодической системе в начале XX ст., когда на протяжении короткого времени были открыты около 40 новых элементов. Тогда в периодической системе свободными оставались лишь семь клеток в 6 и 7 периодах, тогда как разместить нужно было 28 химических элементов. Поскольку 14 элементов (порядковые номера 58— 71) имеют общие свойства со свойствами лантана, их назвали лантаноидами и вынесли в отдельный ряд периодической системы. Аналогично разместили и элементы с порядковыми номерами 90—103, их назвали актиноидами.
Длинная форма периодической системы
До сих пор вы рассматривали короткую форму периодической системы. Рассмотрим, какие отличия присущи длинной форме периодической системы. В короткой форме периоды разделяются на ряды, группы — на главные и побочные подгруппы. Последние есть лишь в больших периодах, т. е., начиная с 4-го периода. В длинной форме периодической системы такого разделения нет. Все элементы каждого из семи периодов записаны в один ряд. Номер группы совпадает с номером группы короткой формы системы, только в главных подгруппах к номеру добавлена еще буква  а в побочных — буква
а в побочных — буква  Начиная с 4-го периода, во всех периодах между группой
Начиная с 4-го периода, во всех периодах между группой  «вклиниваются» 8 групп Б в такой последовательности:
«вклиниваются» 8 групп Б в такой последовательности: 
 (см. форзац 2).
(см. форзац 2).
Элементы легко отыскать в любом из вариантов таблицы, если помнить, что они расположены согласно их порядковым номерам.
Итоги:
- Периодическая система — это совокупность химических элементов, расположенных в порядке возрастания их атомных масс и упорядоченных в форме таблицы, которая является графическим отображением периодического закона.
- Периодическая система состоит из семи периодов и восьми групп химических элементов, которые в короткой форме таблицы разделяют на подгруппы.
- В периоде с ростом атомной массы химических элементов происходит постепенный переход свойств от металлических к неметаллическим.
- В группах размещены химические элементы со сходными свойствами и формами соединений.
- Периодичность свойств химических элементов подтверждается тем, что в каждом периоде есть элементы со сходными свойствами и формой оксидов, гидроксидов, летучих водородных соединений.
Свидетельством того, что периодический закон предусматривает дозаполнение периодической системы, являются оставленные Д. И. Менделеевым свободные клетки для еще не открытых элементов, описание свойств некоторых из них. Так, между кремнием и оловом в 1886 г. оставалась незаполненной клетка № 32, в которой, согласно предсказанию Д. И. Менделеева, должен был разместиться элемент под условным названием экасилиций.
В 1886 г. немецкий ученый Клеменс-Александр Винклер, анализируя один из найденных минералов, обнаружил в нем новый элемент. Ученый выделил элемент в виде простого вещества, получил его соли, изучил свойства и назвал в честь своей страны германием.
Ниже приведено сравнение свойств химического элемента с порядковым номером 32, предсказанного Д. И. Менделеевым, со свойствами открытого К. Винклером Германия.
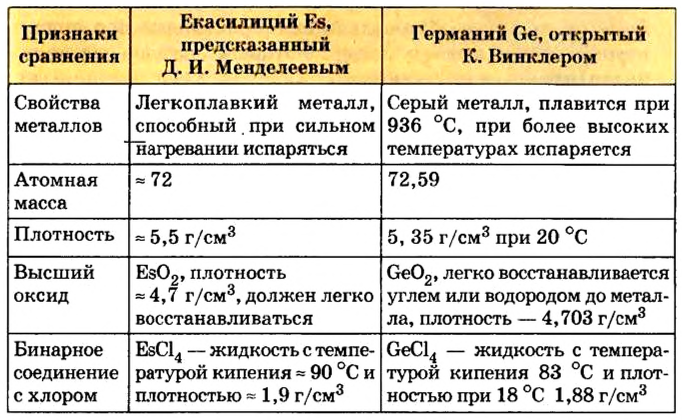
Строение атома
Исследование строения атома. Термин атом возник еще в античном мире и в переводе с греческого означает «неделимый». Довольно долго ученые считали, что атом неделим.
При химических явлениях новые атомы действительно не образуются, а переходят из состава одних веществ в состав других. Однако это не распространяется на такое явление, как радиоактивность.
Радиоактивностью называют самопроизвольный распад неустойчивых атомных ядер, который сопровождается радиоактивным излучением.
Луч на латыни означает «радиус». Поэтому физик и химик Мария Склодовская-Кюри предложила называть вещества, которые излучают невидимые лучи, радиоактивными, а само излучение — радиоактивным. В 1896 г. впервые это явление обнаружил, работая с урановыми рудами, французский физик Анри Беккерель. (Тогда уран был последним, 92 элементом периодической системы.) Ученый заметил, что кусочек урановой руды излучал невидимые глазу лучи, от которых фотопленку не защищала даже черная бумага. Завернутая в такую бумагу фотопленка была надежно изолирована от солнечных лучей, но засвечивалась, если на бумагу клали кусочек урановой руды. Так были обнаружены радиоактивные свойства урана.

Эрнест Реэерфорд (1871—1937) — английский физик, основоположник ядерной физики.
Работал в Кембриджском университете (Англия) вместе с Джозефом Джоном Томсоном, который открыл частицу электрон. Э. Резерфорду принадлежит открытие атомного ядра. Он был первым, кому удалось расщепить ядро и доказать, что радиоактивность является результатом распада атомного ядра. В 1908 г. за исследование разных видов радиоактивности ученый награжден Нобелевской премией.
Эрнестом Резерфордом установлено, что Эрнест Резерфорд в магнитном или электрическом поле пучок радиоактивного излучения разделяется на три луча (рис. 20). Эти лучи были обозначены первыми буквами греческого алфавита 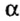 - (альфа),
- (альфа), 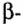 (бета),
(бета), 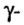 (гамма),
(гамма), 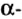 лучи оказались потоком положительно заряженных частиц с массой атома гелия,
лучи оказались потоком положительно заряженных частиц с массой атома гелия, 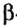 -лучи— потоком отрицательно заряженных электронов (в то время уже было экспериментально доказано существование электронов),
-лучи— потоком отрицательно заряженных электронов (в то время уже было экспериментально доказано существование электронов), 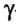 -лучи — потоком настолько коротких волн, что, в отличие от световых, они невидимы.
-лучи — потоком настолько коротких волн, что, в отличие от световых, они невидимы.
Последующие исследования ученого были направлены на определение строения атома. Пропуская 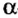 -частицы сквозь тоненькие металлические пластины, он зафиксировал, что большинство из них проникает сквозь пластину, часть отклоняется под определенными углами от заданного им прямолинейного движения, а часть (приблизительно
-частицы сквозь тоненькие металлические пластины, он зафиксировал, что большинство из них проникает сквозь пластину, часть отклоняется под определенными углами от заданного им прямолинейного движения, а часть (приблизительно  отскакивает обратно. Поскольку
отскакивает обратно. Поскольку 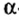 -частицы заряжены положительно, то их поведение ученый объяснял тем, что им мешают другие положительно заряженные частицы. Результаты опыта доказывали, что большая часть атомного пространства не несет положительного заряда. На этом основании был сделан вывод, что атомы состоят из положительно заряженной сердцевины — ядра — и отрицательно заряженных электронов, размещенных за пределами ядра.
-частицы заряжены положительно, то их поведение ученый объяснял тем, что им мешают другие положительно заряженные частицы. Результаты опыта доказывали, что большая часть атомного пространства не несет положительного заряда. На этом основании был сделан вывод, что атомы состоят из положительно заряженной сердцевины — ядра — и отрицательно заряженных электронов, размещенных за пределами ядра.
Планетарная модель строения атома
С открытием частиц, входящих в состав атома, встал вопрос о том, как эти частицы размещены и связаны между собой в атоме. Э. Резерфорд предложил модель атома, согласно которой в центре атома расположено плотное ядро небольших (по сравнению с атомом) размеров, вокруг которого беспрерывно движутся электроны. Предложенная Резерфордом (1909—1911 гг.) модель атома получила название ядерной, или планетарной.
В соответствии с планетарной моделью атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, которые движутся вокруг ядра по круговым или эллиптическим орбитам, как планеты вокруг Солнца.
Заряд электрона — наименьший из всех известных зарядов (подробнее об этом вы узнаете на уроках физики), он условно принят равным -1.
Отрицательные заряды электронов уравновешиваются положительным зарядом ядра, и атом в целом остается электронейтральным.
Дальнейшие достижения в изучении строения атома
В 1920 г. Э. Резерфорд ввел понятие о положительно заряженной
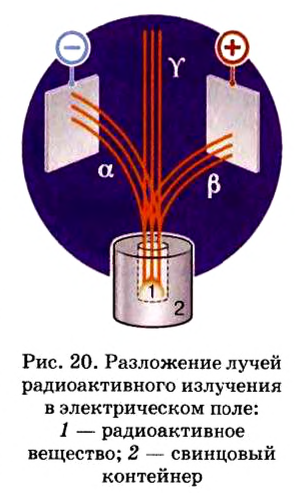
частице в составе ядра — протоне. Заряд протона по абсолютной величине равен заряду электрона, но имеет противоположный знак. Его условно принимают равным +1. В 1932 г. английский ученый Джеймс Чедвик экспериментально обнаружил в ядре атома нейтральную частицу — нейтрон, масса которой равна массе протона. Советский ученый Дмитрий Иваненко и итальянец Етторе Майоран обосновали, что нейтроны и протоны формируют атомное ядро и определяют массу атома.
Итак, в состав атома входят: положительно заряженные протоны, отрицательно заряженные электроны и незаряженные (нейтральные) нейтроны. Протоны принято обозначать 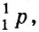 нейтроны —
нейтроны — 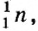 электроны —
электроны — 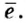 Все они имеют чрезвычайно малые абсолютные массы, к тому же масса протона приблизительно равна массе нейтрона, тогда как масса электрона в 1836 раз меньше массы протона. Данные о строении атома и его составляющих представлены в таблице 5.
Все они имеют чрезвычайно малые абсолютные массы, к тому же масса протона приблизительно равна массе нейтрона, тогда как масса электрона в 1836 раз меньше массы протона. Данные о строении атома и его составляющих представлены в таблице 5.
Несмотря на то, что размеры ядра в десятки тысяч раз меньше, чем электронная оболочка, основная масса атома сосредоточена именно в нем. При вычислении относительной атомной массы элемента массой электронов пренебрегают.
Порядковый номер элемента в периодической системе и число протонов в ядре его атома совпадают. Например, порядковый номер кальция равен 20 — и ядро атома кальция содержит 20 протонов, порядковый номер брома 35 — ив ядре атома брома — 35 протонов.
Число протонов в ядре совпадает с порядковым номером элемента и периодической системе и называется протонным числом.
А общее число протонов и нейтронов в атоме получило название нуклонного числа. Название протонного числа происходит от названия положительно заряженных частиц протонов, название нуклонного числа — от латинского названия ядра нуклеус.
Итоги:
- До открытия радиоактивности атом считали неделимым. С открытием этого явления было установлено сложное строение атома.
- Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов и в целом является электронейтральной (незаряженной) частицей.
- В состав ядра, кроме протонов, входят нейтроны. Нейтрон — это незаряженная частица с массой, приблизительно равной массе протона.
- Абсолютные массы составляющих частиц атома очень малы, поэтому пользуются их относительными массами: у протона и нейтрона они приблизительно одинаковы и приняты за 1, масса электрона в 1836 раз меньше.
- Ядро по сравнению с атомом имеет очень малые размеры, но в нем сосредоточена основная масса атома.
- Открытие на грани XIX и XX ст. строения атома и радиоактивности — выдающееся достижение науки.
Шведский инженер Альфред Нобель (1833—1896) — изобретатель взрывчатых веществ и владелец заводов по их производству. Не имея собственной семьи, весь свой капитал, который был на то время эквивапентен 9 миллионам долларов, он завещал человечеству. В составленном им завещании сказано, что проценты с его капитала ежегодно должны идти на премирование людей, которые на протяжении прошедшего года принесли наибольшую пользу человечеству. Указанные проценты он распорядился разделить на 5 равных частей: одна — на премии авторам выдающихся открытий в области физики, вторая — химии, третья — медицины, четвертая — в области искусства, пятая — за выдающийся вклад в сплочение и процветание наций. Особенность завещания А. Нобеля заключалось в признании достижений, независимо от национальной принадлежности кандидатов на премии.
С 1901 г. и до наших дней Нобелевские премии по химии получили свыше 100 ученых. Одними из первых были исследователь строения атома Э. Резерфорд (1908 год) и Мария Склодовская-Кюри (1911 год). Премию ей присудили за уникальные исследования радия. Вместе со своим мужем Пьером Кюри она была удостоена Нобелевской премии также по физике (1903 год) — за открытие радиоактивности элементов полония  и радия
и радия  Мария Склодовская-Кюри — первый ученый, удостоенный такой высокой научной награды дважды. Она была также первой женщиной-профессором.
Мария Склодовская-Кюри — первый ученый, удостоенный такой высокой научной награды дважды. Она была также первой женщиной-профессором.
Формулировка периодического закона
До создания Д. И. Менделеевым периодической системы порядковые номера химических элементов были не связанными величинами. В таблице они лишь подтверждали последовательность размещения химических элементов в соответствии с возрастанием их атомной массы. Но для всех ли химических элементов порядок их размещения в периодической системе отвечает увеличению их атомной массы?
Перестановки в периодической системе
Обратившись к периодической системе, увидим, что в ней есть особенности, которые касаются элементов с порядковыми номерами: 18 и 19 (калий и аргон); 27 и 28 (кобальт и никель); 52 и 53 (теллур и иод); 90 и 91 (торий и протактиний). (Найдите эти элементы и убедитесь. что в данных случаях элемент с меньшей атомной массой уступил место элементу с большей атомной массой.)
Вторую и третью перестановки Д. И. Менделеев сделал для того, чтобы установленная им периодичность не была нарушена. Первая перестановка была сделана с согласия ученого несколько позже (вспомните, что инертные элементы были открыты через 30 лет после создания периодической таблицы). Четвертая перестановка появилась значительно позже. И если бы эти перестановки не были сделаны, то указанные элементы попали бы в состав подгрупп с другими свойствами. В частности, инертный элемент аргон оказался бы в подгруппе активнейших металлических химических элементов.
Научных объяснений все эти перестановки на то время не имели. Некоторые ученые склонны были считать, что причина кроется в неточном определении атомных масс элементов.
Физическая сущность порядкового номера и современная формулировка периодического закона.
Научное объяснение перестановки в периодической системе получили после того, как в 1913—1914 гг. английский физик Генри Мозли экспериментально подтвердил периодический закон. Было установлено, что все химические элементы (без исключения!) размещены в периодической системе в порядке возрастания зарядов ядер их атомов. То есть, порядковый номер элемента в периодической системе указывает на такую его важную характеристику, как величина заряда ядра атома. А поскольку положительный заряд ядра уравновешивается отрицательным зарядом электронов, входящих в состав электронной оболочки атома, то порядковый номер элемента указывает также на число электронов в атоме.
Благодаря исследованиям физиков было сформулировано современное определение периодического закона.
Свойства элементов, а также образованных ими соединении, находятся в периодической зависимости от величины зарядов ядер их атомов.
В этом заключается физическая суть периодического закона, подтверждающая гениальность открытия Д. И. Менделеева, сделанного задолго до установления физиками строения атома.
Понятие об изотопах
Наличие в периодической системе перестановок в случаях, когда элемент с большей атомной массой имеет меньший заряд ядра, оставалось необъясненным до установления существования изотопов. Выяснилось, что для многих химических элементов существуют разновидности атомов с одинаковым зарядом ядра, но с разным нуклонным числом. То есть, число протонов в ядре таких атомов одинаково, а число нейтронов разное. Так, в природе распространены атомы хлора с нуклонными числами 35 и 37. Заряд ядра в обеих разновидностях равен +17, поэтому и в периодической системе они занимают одну и ту же клетку, порядковый номер которой 17.
Разновидности атомов одного и того же химического элемента, которые имеют одинаковый заряд ядра, но разные нуклонные числа, называются изотопами.
В переводе с греческого изо — одинаковый, топос — место.
Следовательно, скольких бы не было изотопов у химического элемента, в периодической системе всем им отведена одна клетка (химические свойства изотопов одного элемента одинаковы). Поэтому современное определение химического элемента таково:
- химический элемент — это вид атомов с одинаковым зарядом ядра.
Каждый изотоп характеризуется двумя величинами: протонным числом (проставляется внизу слева от химического символа) и нуклонным числом (проставляется вверху слева от химического символа), например: 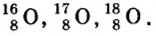
Иногда протонное число не пишут.
Большинство элементов имеют изотопы. Названия изотопов обычно совпадают с названием элемента. Хотя есть и исключения, например, три изотопа водорода называются: протий 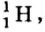 дейтерий
дейтерий 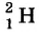 и тритий
и тритий 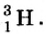
Углерод имеет два изотопа — с нуклонным числом 12 и нуклонным числом 13: 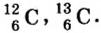 Вспомните, что за эталон сравнения массы атомов принята 1/12 массы более легкой разновидности атомов углерода. Речь шла именно об изотопе
Вспомните, что за эталон сравнения массы атомов принята 1/12 массы более легкой разновидности атомов углерода. Речь шла именно об изотопе  который в 1961 г. физиками и химиками был принят за основу единственной шкалы относительных атомных масс элементов. Это сделано потому, что значение относительной атомной массы изотопа углерода
который в 1961 г. физиками и химиками был принят за основу единственной шкалы относительных атомных масс элементов. Это сделано потому, что значение относительной атомной массы изотопа углерода  — целое число и составляет 12,0000. Поэтому формулу, по которой вычисляется относительная атомная масса элементов, записывают так:
— целое число и составляет 12,0000. Поэтому формулу, по которой вычисляется относительная атомная масса элементов, записывают так:
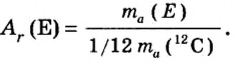
Среди существующих в природе элементов больше всего изотопов — десять — имеет олово 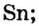 у кислорода и водорода их по три. К каждому из них применяется общее название нуклид, например, нуклид углерода с нуклонным числом
у кислорода и водорода их по три. К каждому из них применяется общее название нуклид, например, нуклид углерода с нуклонным числом 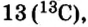 нуклид алюминия с нуклонным числом
нуклид алюминия с нуклонным числом 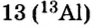 и т. п.
и т. п.
Виды изотопов. По происхождению изотопы разделяют на природные и искусственные.
Природные изотопы — это изотопы, которые существуют в природе. Искусственные — это такие, которые образуются при ядерных реакциях.
Ядерные реакции — единственные реакции, при которых происходят изменения в ядре атома, приводящие к образованию атомов других элементов и сопровождающееся радиоактивным излучением.
С открытием в 30-е годы XX ст. этих реакций наступила новая эпоха в развитии науки и техники. При ядерных реакциях выделяется большое количество тепла.
По способности к излучению изотопы классифицируют на стабильные и радиоактивные.
Стабильные — это изотопы, способные к излучению. Известно 280 стабильных изотопов. Они есть у большинства химических элементов.
Радиоактивные — это неустойчивые изотопы, самопроизвольно превращающиеся в изотопы других элементов. Длительность этих превращений может быть от нескольких секунд до десятков тысяч лет.
Все искусственные и часть природных изотопов радиоактивны, то есть они излучают альфа-, бета- или гамма-лучи. Их в природе не так уж и много. Это — полоний, радон, радий, актиний, торий, протактиний, уран.
Изотопы и относительная атомная масса элементов в периодической системе. Из § 31 мы знаем, что нуклонное число определяет общее число протонов и нейтронов в атоме, а протонное — количество протонов в ядре атома. Поскольку относительная атомная масса протонов и нейтронов выражается целым числом, то целым числом выражается и относительная атомная масса каждого изотопа химического элемента (вспомните, что при ее вычислении массой электронов пренебрегают). Чем же тогда объяснить, что атомные массы элементов в периодической системе в большинстве своем дробные числа?
Выясним это на таком примере. В периодической системе относительная атомная масса хлора указана как 35,5. В действительности же в природе не существует его атомов с таким значением относительной атомной массы, но есть два природных изотопа — с нуклонными числами 35 и 37. По распространенности в природе на первый изотоп приходится 75,4 % всех атомов хлора, на второй — 24,6 %. Проведем подсчет и узнаем среднее значение относительной атомной массы хлора. Для этого часть атомов каждого изотопа умножим на его нуклонное число и найдем сумму:
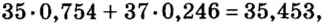 или округленно 35,5.
или округленно 35,5.
Таким образом, в периодической системе указано среднее значение относительной атомной массы существующих в природе изотопов хлора.
Теперь понятно, что перестановки в периодической системе, в частности аргона и калия, предопределены распространенностью изотопов этих элементов в природе. Например, у аргона с меньшим зарядом ядра атома, чем у калия, больше тяжелых изотопов, в результате чего среднее значение его относительной атомной массы больше, чем у калия.
В отличие от элементов, которые встречаются в природе, атомные массы искусственно полученных элементов выражены целыми числами. В периодической системе они взяты в квадратные скобки.
Обозначив нуклонное число 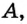 число протонов
число протонов 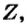 число нейтронов
число нейтронов 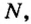 получим выражение:
получим выражение: 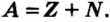 Зная нуклонное число изотопа, всегда можно вычислить число нейтронов в его ядре.
Зная нуклонное число изотопа, всегда можно вычислить число нейтронов в его ядре.
Итоги:
- Изотопы — это разновидности атомов одного элемента, которые отличаются числом нейтронов в ядре. Изотопы одного элемента занимают в периодической системе одну клетку.
- Изотопы бывают природные и искусственные, стабильные и радиоактивные.
- Для того, чтобы получить искусственный изотоп, необходимо провести не химическую, а ядерную реакцию — сложные превращения атомных ядер одного элемента в атомные ядра другого, т. к. химические реакции — это превращения веществ, а ядерные — химических элементов.
- Заряд ядра атома равен порядковому номеру элемента в периодической системе и указывает на принадлежность атома конкретному химическому элементу.
- С открытием изотопов стало понятно, что все без исключения химические элементы размещены в периодической системе по мере возрастания зарядов ядер их атомов.
- Указанная в периодической системе атомная масса элемента является средней величиной атомных масс его изотопов с учетом распространения их в природе.
Открытие искусственной радиоактивности (1935 г.) дало возможность получать радиоактивные элементы и вырабатывать энергию с помощью ядерных реакций, проводимых в специальных реакторах.
Радиоактивные изотопы применяют в научных исследованиях (как меченые атомы, которые дают возможность следить за ходом химических и биологических преобразований), в промышленности, сельском хозяйстве, медицине, археологии и т. п.
Сложные ядерные реакции, протекающие в недрах Солнца, обеспечивают нашу планету светом и теплом. На ядерном топливе работают атомные электростанции — в настоящее время они удовлетворяют около 10 % потребности человечества в электроэнергии, работая на таком «горючем», как уран или плутоний. Это высокоэффективное топливо. Так, 1 кг урана при ядерной реакции выделяет столько же тепла, сколько его выделяется при сжигании 2000 т угля.
Атомные станции являются экологически чистыми, но аварии на них могут иметь катастрофические последствия, как это случилось на Чернобыльской атомной электростанции в 1986 г., когда в атмосферу попало огромное количество радиоактивных изотопов цезия, стронция, иода, плутония. Большие дозы излучения (бытовое название «радиация») опасны для жизни тем, что вызывают онкологические заболевания, заболевания крови и другие.
Состояние электронов в атоме
Вспомним, что размеры атомного ядра в десятки тысяч раз меньше размеров всего атома. Существует немало образных сравнений размеров ядра и атома. Вот одно из них: если представить ядро размером с горошину, то расстояние от ядра до крайней электронной оболочки будет равно приблизительно 1 км. Значит, основную часть атома составляет его электронная оболочка. Ученые заинтересовались ее строением и поиском ответа на вопрос о причине периодического изменения свойств элементов и их соединений.
Несовершенство планетарной модели строения атома
Вы уже знаете, что после открытия сложного строения атома Э. Резерфорд предложил планетарную модель атома. Она сыграла важную роль в развитии природоведения, помогала при решении неотложных задач, однако оказалась неточной. Во-первых, она не объясняла характера распределения электронов в околоядерном пространстве, которое получило название электронной оболочки атома. Во-вторых, в соответствии с этой моделью электроны при вращении вокруг ядра должны были бы терять энергию и со временем падать на ядро, чего в действительности не происходит. Это побудило Нильса Бора и других ученых к дальнейшей работе над моделью атома, исходя из результатов новых исследований природы электрона. А они свидетельствовали о том, что электрон проявляет свойства не только микрочастицы, но и волны. Следовательно, законы физики, которым подчиняются большие тела, на электроны не распространяются.
Современная модель атома (ее еще называют орбитальной, или квантово-механической). Эта модель, сохранив представление о том, что в центре атома находится положительно заряженное ядро, не только математически описывает движение электрона в атоме, но и дает наглядное представление о строении электронной оболочки атома.
Она основывается на том, что движение электрона в атоме нельзя описать определенной траекторией, а можно лишь рассматривать некоторый объем пространства, в котором находится электрон. С учетом его двойственной природы (микрочастицы и волны) невозможно одновременно и абсолютно точно указать местонахождение электрона.
Вероятность пребывания электрона в ядре равна нулю. По мере отдаления от ядра вероятность быстро возрастает и на некотором расстоянии от ядра достигает максимума, после чего постепенно уменьшается. Точно определить участок околоядерного пространства и зафиксировать в нем пребывание электрона невозможно. Электрон может быть в любой точке атомного пространства, однако вероятность нахождения в ней будет невелика. Поэтому было введено понятие атомная орбиталь.
Атомная орбиталь — это геометрический образ, соответствующий объему пространства вокруг ядра, вероятность пребывания электрона в котором равна 90—95 %.
Неправильно утверждать, что электрон в определенный момент времени находится в данной точке атомного пространства, но абсолютно правильно говорить о вероятном нахождении электрона на атомной орбитали.
Ознакомление с атомными орбиталями начнем с атома водорода — химического элемента, который имеет самое простое строение. Порядковый номер элемента указывает на то, что в состав ядра входит один протон, а в электронной оболочке содержится один электрон. Относительная атомная масса элемента приблизительно равна также единице. Следовательно, в атоме самого распространенного изотопа 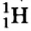 нейтронов нет. Орбиталь единственного его электрона геометрически ограничена сферой, радиус которой равен 0,053 нм. Более наглядное представление об этой орбитали можно получить с помощью такого воображаемого эксперимента. Предположим, что в какой-то промежуток времени удалось сфотографировать положение электрона в атоме и получить его изображение в виде точки. Продолжив многократное непрерывное фотографирование, получим новые изображения (точки) в разных частях околоядерного пространства. Объединив все полученные изображения на одной фотографии, получим рисунок, который напоминает шар (рис. 21). На рисунке видно, что в одних местах точки расположены гуще, что свидетельствует о большей вероятности пребывания там электрона. В других местах
нейтронов нет. Орбиталь единственного его электрона геометрически ограничена сферой, радиус которой равен 0,053 нм. Более наглядное представление об этой орбитали можно получить с помощью такого воображаемого эксперимента. Предположим, что в какой-то промежуток времени удалось сфотографировать положение электрона в атоме и получить его изображение в виде точки. Продолжив многократное непрерывное фотографирование, получим новые изображения (точки) в разных частях околоядерного пространства. Объединив все полученные изображения на одной фотографии, получим рисунок, который напоминает шар (рис. 21). На рисунке видно, что в одних местах точки расположены гуще, что свидетельствует о большей вероятности пребывания там электрона. В других местах
точек меньше, следовательно, и вероятность пребывания там электрона ниже.
Понятие электронного облака
Полученное при воображаемом эксперименте наглядное изображение вероятности пребывания электрона в атомном пространстве, называется электронным облаком.
Электронное облако — это наглядное изображение атомной орбитали.
Мы рассмотрели электронное облако сферической формы (рис. 22). Электроны с такой формой электронного облака получили название 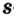 -электронов (произносится: эс-электрон). (Наличие в названии буквы
-электронов (произносится: эс-электрон). (Наличие в названии буквы 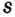 — это заимствова ние первой буквы английского слова сфера.) Имеющиеся в атоме
— это заимствова ние первой буквы английского слова сфера.) Имеющиеся в атоме 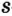 -орбитали налагаются одна на другую.
-орбитали налагаются одна на другую.

В результате экспериментальных исследований и математических расчетов доказано существование атомных орбиталей с другими формами электронных облаков, в частности похожих на гантель или объемную восьмерку (рис. 22). Электроны с такой формой электронного облака получили название 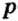 -электронов (произносится: пэ-электроны). (Наличие в названии буквы
-электронов (произносится: пэ-электроны). (Наличие в названии буквы 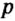 — это заимствование первой буквы английского слова перпендикуляр.) Преимущественно
— это заимствование первой буквы английского слова перпендикуляр.) Преимущественно 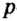 -электроны располагаются по обе стороны от ядра (иногда в месте сужения гантели есть обозначение ядра в виде точки). Пространственное расположение трех
-электроны располагаются по обе стороны от ядра (иногда в месте сужения гантели есть обозначение ядра в виде точки). Пространственное расположение трех 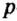 -орбиталей представлено на рисунке 23.
-орбиталей представлено на рисунке 23.
Как видим, три 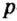 -электронных облака расположены во взаимно перпендикулярных плоскостях.
-электронных облака расположены во взаимно перпендикулярных плоскостях.
Существуют также 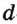 -электронные облака и
-электронные облака и 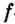 -электронные облака. Их конфигурации более сложные.
-электронные облака. Их конфигурации более сложные.
Согласно последним данным исследований электронной оболочки атома установлено: электрон имеет еще одно свойство — вращаться вокруг своей воображаемой оси. (Вспомните из курса природоведения, что смена дня и ночи является результатом вращения Земли вокруг своей оси.)
Одним электронам приписывают вращение по часовой стрелке, а другим — против. Условно это помечают стрелками с противоположными направлениями 
Физики утверждают, что в атоме не существует двух абсолютно одинаковых электронов. И если по различным характеристикам два электрона абсолютно одинаковы, они будут отличаться направлением вращения вокруг своей оси.
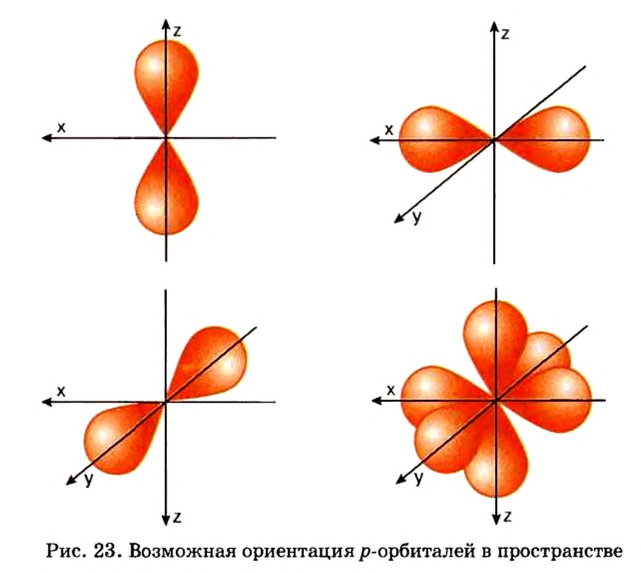
Энергетические уровни
Электроны имеют определенный запас энергии. Описывая строение электронной оболочки, электроны с одинаковым или приблизительно одинаковым запасом энергии объединяют в один энергетический уровень, или электронный слой. Выделяют 7 таких уровней, помечая их арабскими цифрами от 1 до 7 или большими буквами латинского алфавита  Обратите внимание на совпадение количества периодов и энергетических уровней. Это не случайно:
Обратите внимание на совпадение количества периодов и энергетических уровней. Это не случайно:
- количество уровней электронной оболочки атома каждого элемента равно номеру периода, в котором размещен химический элемент.
Чем ближе к ядру размещен энергетический уровень, тем меньший запас энергии имеют его электроны. То есть, электроны второго уровня характеризуются более высокой энергией, чем третьего, третьего — выше, чем четвертого, и так далее. Получив дополнительный запас энергии, электроны способны перейти на высший уровень. И наоборот, отдав энергию, электроны переходят с высшего уровня на более низкий. Находясь в пределах энергетического уровня, электрон не выделяет и не поглощает энергию.
Переход электронов на более отдаленные орбитали получил название возбужденного состояния атома. Для наступления такого состояния часто бывает достаточно нагревания или освещения вещества.
Итоги:
- Электрон имеет двойственную природу — микрочастицы и волны. Это отражается на его состоянии в атоме.
- Невозможно проследить все этапы движения электрона в атоме, потому говорят лишь о вероятности пребывания электрона в той или другой точке.
- Орбиталь — это атомное пространство, в котором вероятность пребывания электрона составляет более 90 процентов. На одной орбитали может находиться не больше двух электронов.
- Наглядным изображением атомных орбиталей являются электронные облака; различают
 -облака.
-облака. - Электроны с одинаковым или приблизительно одинаковым запасом энергии образуют один энергетический уровень, или электронный слой. Максимальное количество энергетических уровней — семь.
- Электрон, который движется на более отдаленном от ядра энергетическом уровне, имеет больший запас энергии, чем электрон, который движется на более близком к ядру уровне.
- Согласно современной орбитальной модели атома состояние электрона в атоме характеризуется: формой орбитали, пространственной ориентацией орбитали, энергией, вращением электрона вокруг ядра и вокруг собственной оси.
Кроме относительной атомной массы атом характеризуется величиной атомного объема. Он равен частному от деления атомной массы элемента на плотность простого вещества в твердом состоянии. Атомный объем дает возможность представить пространство, которое занимает один атом того или иного элемента, поскольку в одном моле любого элемента содержится число Авогадро, то есть 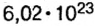 атомов. Характерно, что величина атомного объема также находится в периодической зависимости от величины заряда ядра атома.
атомов. Характерно, что величина атомного объема также находится в периодической зависимости от величины заряда ядра атома.
Строение электронных оболочек атомов
Электроны с одинаковым или приблизительно одинаковым запасом энергии образуют один энергетический уровень, или электронный слой. Ознакомимся с основными положениями современной теории строения атома.
- Минимально возможное количество энергетических уровней в атоме — один, максимально — семь.
- Количество энергетических уровней в электронной оболочке атома всегда равно номеру периода, в котором размещен элемент.
- Самый отдаленный от ядра энергетический уровень называется внешним, его электроны имеют больший запас энергии, чем электроны, расположенные ближе к ядру.
- Максимальное количество электронов на одном энергетическом уровне четко определено. Так, на первом энергетическом уровне может быть не более 2 электронов, на втором — не более 8, на третьем — не более 18, на четвертом — не более 32.
- Энергетические уровни, заполненные максимально возможным для них числом электронов, называются завершенными; энергетические уровни с меньшим количеством электронов — незавершенными.
- В зависимости от формы атомных орбиталей электроны одного уровня могут находиться на подуровнях.
Распределение электронов одного уровня на подуровнях
Каждый энергетический уровень состоит из подуровней. В пределах одного уровня количество подуровней определяется числом имеющихся на них видов атомных орбиталей.
На первом энергетическом уровне находятся электроны лишь со сферической формой орбиталей, то есть  -электроны, они образуют
-электроны, они образуют  -подуровень. Следовательно, на первом энергетическом уровне существует один подуровень.
-подуровень. Следовательно, на первом энергетическом уровне существует один подуровень.
На втором энергетическом уровне размещены электроны со сферической и гантелеподобной формами орбиталей, то есть  и
и 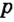 -электроны. В соответствии с этим второй уровень включает 2 подуровня —
-электроны. В соответствии с этим второй уровень включает 2 подуровня — 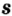 -подуровень и
-подуровень и 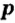 -подуровень. Как вы уже поняли, названия подуровней повторяют названия орбиталей.
-подуровень. Как вы уже поняли, названия подуровней повторяют названия орбиталей.
На третьем энергетическом уровне есть три подуровня, т. к. там имеются 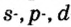 -орбитали. Поэтому третий подуровень получил название
-орбитали. Поэтому третий подуровень получил название 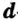 -подуровень. Соответственно четвертый подуровень называется
-подуровень. Соответственно четвертый подуровень называется 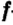 -подуровнем и появляется он на четвертом энергетическом уровне.
-подуровнем и появляется он на четвертом энергетическом уровне.
Согласно современной теории строения атома, на одной орбитали не может быть больше двух электронов. Поскольку 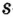 -подуровень содержит лишь одну
-подуровень содержит лишь одну 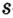 -орбиталь, то на нем возможно пребывание двух
-орбиталь, то на нем возможно пребывание двух 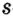 -электронов. А
-электронов. А 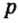 -подуровень содержит 3
-подуровень содержит 3 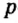 -орбитали, потому на нем максимально может находиться 6
-орбитали, потому на нем максимально может находиться 6 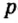 -электронов. На
-электронов. На 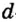 -подуровне насчитывается 5 орбиталей, поэтому максимальное число
-подуровне насчитывается 5 орбиталей, поэтому максимальное число 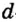 -электронов на нем — 10. Чтобы заполнить 7 орбиталей
-электронов на нем — 10. Чтобы заполнить 7 орбиталей 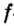 -подуровня, понадобится 14
-подуровня, понадобится 14 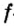 -электронов.
-электронов.
Обратите внимание, что количество электронов на подуровне вдвое больше, чем количество орбиталей. Это объясняется наличием в атоме спаренных электронов. Описывая строение атома, спаренные электроны одной орбитали принято записывать в квадратике  (он получил название энергетической ячейки) в виде противоположно направленных стрелок
(он получил название энергетической ячейки) в виде противоположно направленных стрелок  Неспаренные электроны в энергетической ячейке помечают одной стрелкой
Неспаренные электроны в энергетической ячейке помечают одной стрелкой  Позже вы узнаете, что именно наличие неспаренных электронов и незаполненных свободных ячеек имеет важное значение для соединения одних атомов с другими.
Позже вы узнаете, что именно наличие неспаренных электронов и незаполненных свободных ячеек имеет важное значение для соединения одних атомов с другими.
Обобщенная информация о максимальном числе электронов на энергетических подуровнях и об энергетических ячейках приведена в таблице 6.
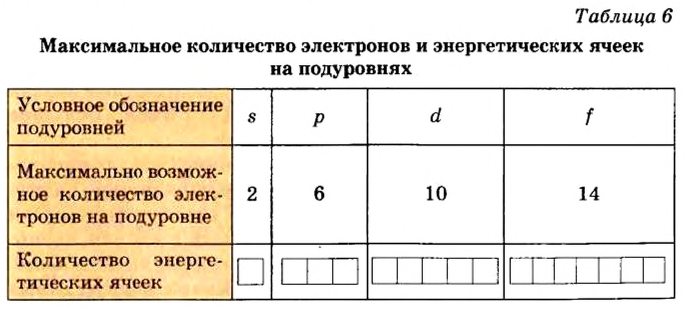
Итак, максимальная наполняемость энергетических уровней электронами зависит от количества подуровней и числа электронов, размещенных на них.
Сведения о строении электронной оболочки атомов элементов первых четырех периодов представлены в таблице 7.

Понятие о радиусе атома
Поскольку электрон одновременно проявляет свойства и микрочастицы и волны, атом не имеет четких граней. Поэтому измерить абсолютные размеры атомов невозможно. А так как современная теория строения атома трактует его форму в виде шара, то радиусы атомов различных химических элементов были рассчитаны теоретически.
Радиусом атома называется расстояние от центра ядра до сферической поверхности электронной оболочки, на которой вероятность пребывания электронов внешнего уровня наибольшая.
Чем большее число энергетических уровней в электронной оболочке, тем больший радиус атома. Однако это не означает, что при наличии у элементов одного периода одинакового числа энергетических уровней их радиусы одинаковы. Расчеты показали, что в пределах одного периода с увеличением заряда ядра радиусы атомов уменьшаются. Самое большое уменьшение происходит в малых периодах.
В пределах одной подгруппы прослеживается противоположная закономерность — с увеличением заряда ядра радиусы атомов увеличиваются. Так, радиус атома лития равен 0,159 нм, а радиус фтора— элемента одного с литием периода — 0,040 нм. Сравнение с рубидием, который является элементом одной с литием подгруппы и имеет радиус атома 0,2248 нм, подтверждает, что размеры радиусов элементов одной подгруппы увеличиваются по мере увеличения заряда ядра.
Итоги:
- В электронной оболочке атома различают: энергетические уровни, энергетические подуровни, энергетические ячейки.
- Количество энергетических уровней в электронной оболочке атома равно номеру периода. Энергетических уровней может быть от одного до семи.
- По форме атомных орбиталей уровни разделяются на подуровни. Выделяют 4 вида подуровней:
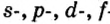 -подуровни.
-подуровни. - Максимальное количество электронов на
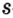 -подуровне — 2, на
-подуровне — 2, на 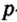 -подуровне — 6, на
-подуровне — 6, на 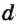 -подуровне — 10, на
-подуровне — 10, на 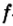 -подуровне — 14.
-подуровне — 14. - Для обозначения спаренных электронов введены энергетические ячейки. В одной ячейке может находиться не более двух электронов. Их помечают разнонаправленными стрелками.
- Каждый подуровень имеет вдвое меньше ячеек, чем максимальное количество электронов на нем.
- Радиус атома, как и его относительная атомная масса, является одной из количественных характеристик атома. Изменения его в пределах одного периода и одной подгруппы имеют определенные закономерности.
При наличии в электронной оболочке атома свободных энергетических ячеек электроны могут из низших энергетических уровней или подуровней перемещаться на более высокие, т. е. из невозбужденного состояния атом переходит в возбужденное. При этом энергия всегда поглощается, а спаренные электроны становятся неспаренными. Возможен обратный переход электронов, и тогда энергия выделяется.
Оба процесса происходят при специально созданных условиях (температура, освещение, наличие других веществ и т. п.). При химических реакциях этот процесс обеспечивается благодаря образованию двумя атомами общей электронной пары.
Последовательность заполнения электронами энергетических уровней и подуровней
Как известно, в периодической системе при постоянном увеличении зарядов ядер атомов свойства элементов и образованных ими соединений периодически повторяются. Что же является причиной периодичности? Ответ на этот вопрос связан со строением электронных оболочек атомов.
Для того чтобы понять взаимосвязь строения электронной оболочки атома и периодической повторяемости свойств веществ, выясним последовательность заполнения электронами энергетических уровней и подуровней.
Заполнение электронами энергетических уровней и подуровней
В современной теории строения атома распределение электронов на электронной оболочке подчиняется таким правилам.
- В пределах одного энергетического уровня первым заполняется
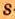 -подуровень, вторым —
-подуровень, вторым — 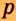 -подуровень.
-подуровень. - Сначала электронами заполняется первый энергетический уровень, затем второй, и только после окончательного заполнения второго энергетического уровня начинается заполнение третьего уровня.
- На одной орбитали не бывает больше двух электронов.
Следует также помнить, что число электронов в атоме равно порядковому номеру химического элемента.
Электронные формулы атомов
Заполнение электронами энергетических уровней и подуровней отображают с помощью электронных формул атомов.
Электронная формула атома — это запись распределения электронов в атоме с помощью коэффициентов, которыми обозначаются энергетические уровни (1, 2, 3...7), символов подуровней 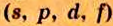 и верхних индексов, равных числу электронов на подуровне.
и верхних индексов, равных числу электронов на подуровне.
Например, записью 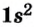 (читается один-эс-два) обозначен первый энергетический уровень с имеющимся одним
(читается один-эс-два) обозначен первый энергетический уровень с имеющимся одним  -подуровнем, заполненным двумя электронами, то есть завершенный.
-подуровнем, заполненным двумя электронами, то есть завершенный.
Записью 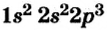 (читается один-эс-два два-эс-два два-пэ-три) обозначены первые два энергетических уровня: на первом находится два
(читается один-эс-два два-эс-два два-пэ-три) обозначены первые два энергетических уровня: на первом находится два  -электрона, на втором — тоже два
-электрона, на втором — тоже два  -электрона и три
-электрона и три 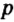 -электрона. То есть первый энергетический уровень завершен. Второй энергетический уровень содержит электроны на подуровне
-электрона. То есть первый энергетический уровень завершен. Второй энергетический уровень содержит электроны на подуровне 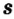 и подуровне
и подуровне 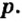 Запись показывает, что подуровень
Запись показывает, что подуровень 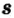 заполнен полностью, тогда как подуровень
заполнен полностью, тогда как подуровень 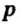 — наполовину.
— наполовину.
Заполнение электронами внешнего энергетического уровня у элементов первых двух периодов рассмотрите на рисунке 24.
Первый период состоит лишь из двух элементов — водорода и гелия. В атоме водорода заполнение первого энергетического уровня начинается, а в атоме гелия — завершается.
Электронные формулы этих атомов таковы:
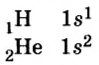
Графические электронные формулы атомов
Один  -электрон атома водорода является неспаренным и его можно обозначить в энергетической ячейке таким образом
-электрон атома водорода является неспаренным и его можно обозначить в энергетической ячейке таким образом 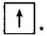 Два
Два 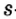 -электрона атома гелия спарены — образуют электронную пару. Их помечают тоже в одной энергетической ячейке, но уже двумя противоположно направленными стрелками
-электрона атома гелия спарены — образуют электронную пару. Их помечают тоже в одной энергетической ячейке, но уже двумя противоположно направленными стрелками 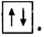
Отображение распределения электронов но энергетическим ячейкам называется графической электронной формулой.
Графические электронные формулы водорода и гелия имеют такой вид:
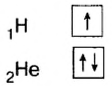
Третьим в периодической системе размещен химический элемент литий. Номер периода указывает на наличие двух энергетических уровней как у лития, так и у остальных элементов этого периода. Согласно приведенным выше правилам и рассмотренным примерам напишем электронные и графические электронные формулы атомов химических элементов второго периода:
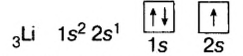
Иногда, чтобы подчеркнуть, что чем дальше от ядра размещен энергетический уровень, тем большим запасом энергии наделены его электроны, ячейки располагают не линейно, а наподобие ступенек. Покажем это на примере бериллия  и бора
и бора 
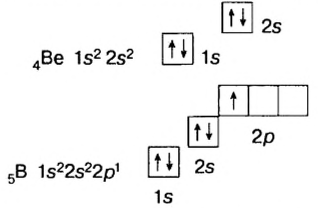
Как видим, у бора появился первый  -электрон и началось заполнение подуровня
-электрон и началось заполнение подуровня  У следующих пяти элементов — углерода, азота, кислорода, фтора и неона в электронной оболочке становится на 1 электрон больше и все они заполняют
У следующих пяти элементов — углерода, азота, кислорода, фтора и неона в электронной оболочке становится на 1 электрон больше и все они заполняют  -подуровень второго энергетического уровня:
-подуровень второго энергетического уровня:
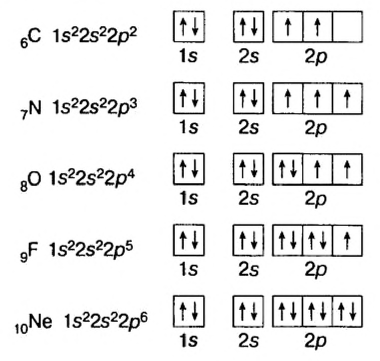
Обратите внимание, неоном заканчивается второй период, и на нем завершается заполнение электронами второго энергетического уровня. Для одиннадцатого электрона следующего элемента натрия, которым начинается третий период, свободных ячеек не осталось. Поэтому этот электрон начнет заполнение третьего энергетического уровня из подуровня 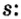
На третьем энергетическом уровне кроме  -подуровней существует подуровень
-подуровней существует подуровень  (максимально возможное число электронов — 10, энергетических ячеек — 5). Но пока полностью не заполнятся электронами
(максимально возможное число электронов — 10, энергетических ячеек — 5). Но пока полностью не заполнятся электронами  -подуровни этого уровня, ячейки
-подуровни этого уровня, ячейки  -подуровня будут оставаться пустыми:
-подуровня будут оставаться пустыми:
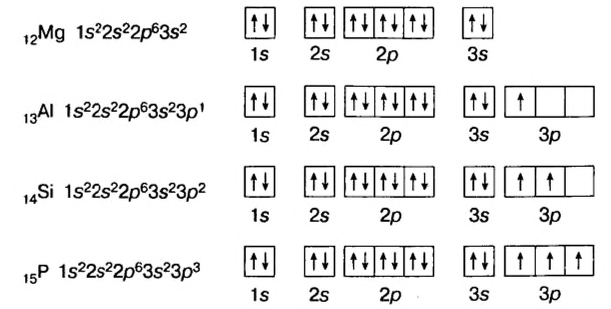
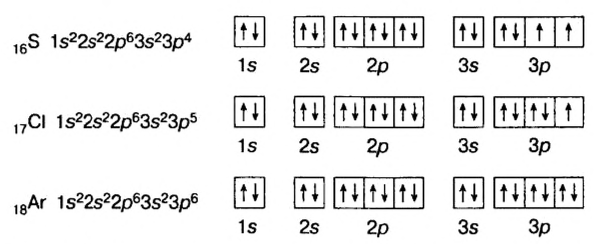
Таким образом, ни один элемент третьего периода не содержит электронов на подуровне 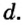
Следующий после аргона элемент калий размещен в четвертом периоде. В электронной оболочке его атома появляется девятнадцатый электрон, которым начинается заполнение четвертого энергетического уровня:
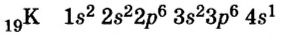
Причина периодичности
Выпишем в столбик рассмотренные электронные формулы щелочных элементов:
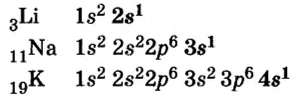
Изучая семейство щелочных элементов, вы узнали о сходстве свойств простых веществ и соединений этих элементов. Как видно из записей электронных формул атомов лития, натрия, калия, эти элементы имеют одинаковое строение внешнего энергетического уровня — он содержит лишь один 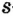 -электрон.
-электрон.
Причиной периодической повторяемости свойств химических элементов и образованных ими соединений является появление элементов с одинаковым строением внешнего энергетического уровня (для элементов главных подгрупп) и предпоследнего энергетического уровня (для элементов побочных подгрупп).
Вам известно, что большие периоды состоят из двух рядов и содержат больше элементов — появляются элементы побочных подгрупп, лантаноиды и актиноиды. Короткие сведения о том, как происходит заполнение электронных оболочек их атомов приведено ниже в рубрике «Страница эрудита».
Итоги:
- Электронная формула атома — это условная запись размещения электронов электронной оболочки атома с помощью цифр и букв английского алфавита
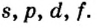
- При заполнении одного энергетического подуровня, до тех пор пока есть свободные энергетические ячейки, электроны размещаются в них по одному, а затем — по два.
- Для того чтобы безошибочно написать электронную формулу атома, необходимо: а) узнать, сколько всех электронов имеет атом; б) выяснить, в каком периоде периодической системы размещен элемент; в) придерживаться последовательности заполнения электронами энергетических уровней и подуровней, описанной в параграфе.
- Периодическая повторяемость свойств элементов является следствием периодической повторяемости строения их электронных оболочек.
Поработайте с периодической системой и убедитесь, что в четвертом периоде после калия и кальция — элементов главных подгрупп — размещено 10 элементов побочных подгрупп с порядковыми номерами 21—30. Особенность заполнения электронами электронных оболочек этих атомов заключается в том, что у внешнего четвертого энергетического уровня 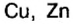 заполнен лишь подуровень
заполнен лишь подуровень  (2 электрона), а каждый из 10 электронов, которые последовательно появляются у элементов
(2 электрона), а каждый из 10 электронов, которые последовательно появляются у элементов  заполняет подуровень
заполняет подуровень  предпоследнего уровня:
предпоследнего уровня:

У некоторых элементов побочных подгрупп один из двух 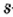 -электронов внешнего энергетического уровня может переместиться на
-электронов внешнего энергетического уровня может переместиться на 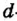 -подуровень, как например у меди:
-подуровень, как например у меди:
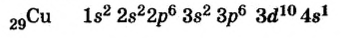
Но в любом случае число электронов равно порядковому номеру элемента в периодической системе.
Взаимосвязь между размещением элементов в периодической системе и их свойствами
Вы знаете, что каждый элемент в периодической системе занимает постоянное, четко определенное место, по которому можно безошибочно узнать : а) заряд ядра атома; б) число электронов; в) число энергетических уровней. Существует ли связь между размещением элемента в периодической системе и свойствами образованных им веществ? Ответ на этот вопрос вы получите после выполнения лабораторного опыта 10 со «Страницы естествоиспытателя».
Проведенный опыт убедил вас в том, что свойства гидрокси-дов разные: гидроксид натрия — типичное основание с сильно выраженными щелочными свойствами, гидроксид алюминия — амфотерный гидроксид, а серная кислота имеет кислотные свойства.
То, что исследованные гидроксиды проявили разный химический характер, не является случайностью, а основано на зависимости между свойствами химических элементов и их положением в периодической системе. Рассмотрим эту зависимость на примере элементов третьего периода (табл. 8).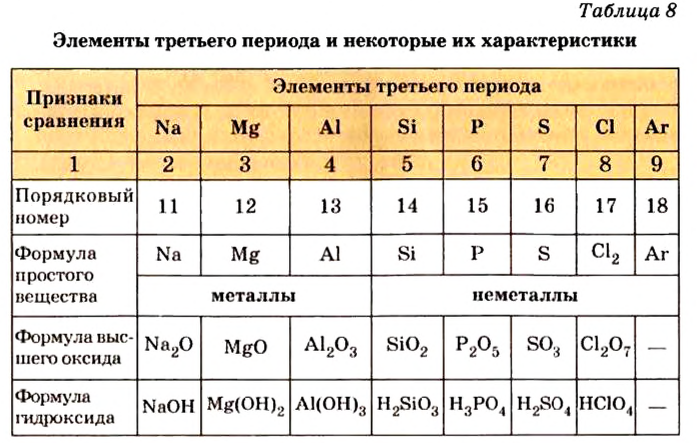
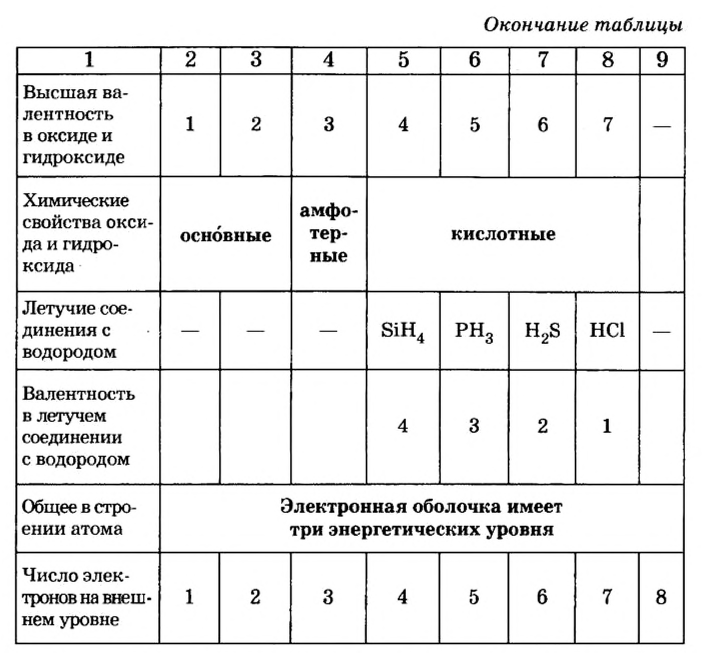
Если продолжим таблицу за счет элементов четвертого периода, то увидим, что у следующего после аргона элемента калия формы соединений и химические свойства резко отличаются от свойств галогенов. Итак, можно сделать вывод, что в периодах с возрастанием порядковых номеров элементов прослеживаются такие изменения:
- металлические свойства простых веществ ослабевают, а неметаллические — усиливаются;
- основные свойства оксидов и гидроксидов ослабляются, а кислотные — усиливаются;
- валентность элементов в оксидах и гидроксидах возрастает от 1 до 7;'
- валентность неметаллов в летучих водородных соединениях уменьшается от 4 до 1;
- период завершается инертным химическим элементом, на который установленные закономерности не распространяются;
- при переходе от одного периода к другому наблюдается резкий переход от неметаллических свойств элементов к металлическим, размежеванных неактивными инертными элементами.
Такая зависимость между размещением элемента в периоде и свойствами образованных им веществ является общей для всех периодов с той лишь разницей, что в малых периодах эти изменения наступают быстрее, чем в больших.
Кроме размещения в горизонтальных рядах—периодах, элементы входят в состав вертикальных столбцов — групп. Рассмотренные ранее свойства природных семейств щелочных элементов, галогенов и инертных элементов дают вам возможность самостоятельно сделать вывод, что самые активные металлы размещены в группе I, то есть в начале периодов, а самые активные неметаллы — в группе VII, то есть в конце периодов. Каждый период заканчивается инертным элементом VIII группы.
Если провести воображаемую черту через элементы: бериллий, алюминий, германий, олово, сурьма, свинец, полоний, которая разделит периодическую систему на 2 части, то верхняя правая часть будет содержать неметаллы, нижняя левая — металлы, а элементы, которые образуют линию раздела,— это металлические элементы с амфотерными свойствами оксидов и гидроксидов. Итак, в зависимости от того, в какой части периодической системы размещен элемент, его соединения обнаруживают основные, кислотные или амфотерные химические свойства.
На основе современной теории строения атома ученые объясняют, что характер химических свойств и его изменение в периодах находится в зависимости от изменения строения электронных оболочек атомов. Чтобы понять, какие отличия в строении электронных оболочек предопределяют ослабление металлических и усиление неметаллических свойств, сравним электронные формулы атомов элементов, с гидроксидами которых был проведен лабораторный опыт.
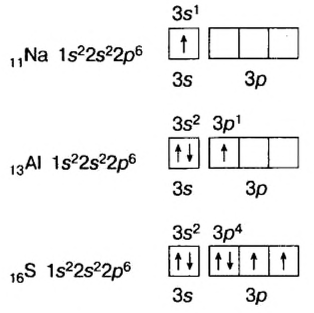
Как видим, по количеству энергетических уровней атомы натрия, алюминия и серы отличий не имеют. Однако у каждого из них различное число электронов на внешнем энергетическом уровне, которое с увеличением порядкового номера элемента возрастает. Делаем вывод, что причиной ослабления металлических и усиления неметаллических свойств элементов одного периода является возрастание числа электронов на внешнем энергетическом уровне.
Итак, элементы одной подгруппы (щелочные, галогены или других семейств) имеют общие свойства благодаря одинаковому строению внешнего энергетического уровня.
Рассмотренные зависимости еще раз подтверждают универсальный характер периодического закона и доказывают, что он является фундаментальным законом природы.
Итоги:
- Периодическая повторяемость свойств элементов в периодах является следствием периодического повторения похожего строения электронных оболочек атомов.
- Химическая схожесть элементов одной подгруппы — результат одинакового строения внешних энергетических уровней их атомов.
- В периодах металлические свойства элементов и их соединений ослабляются, а неметаллические — усиливаются. Поэтому, чем ближе к началу периода размещен элемент, тем сильнее у него выражены металлические свойства.
До появления современной теории строения атома не существовало доказательств, которые бы объясняли инертный характер химических свойств неметаллов VIII группы главной подгруппы — гелия, неона, аргона и других. Отныне он объясняется тем, что энергетические ячейки внешнего энергетического уровня их атомов полностью заполнены спаренными электронами. Такой уровень считается стойким, или завершенным:
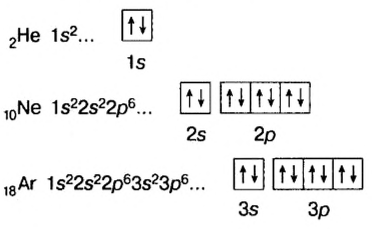
У всех инертных газов, кроме гелия, внешний энергетический уровень содержит 8 электронов.Поэтому вместо нулевой группы, которая сначала была прибавлена к периодической системе для размещения в ней инертных химических элементов, их поместили в главную подгруппу восьмой группы. Отныне подтвердилась еще одна зависимость — элементы главных подгрупп на внешнем энергетическом уровне имеют столько электронов, каков номер группы (исключение составляет гелий).
Характеристика химических элементов по их положению в периодической системе и строению атома
Вы уже знаете, что не существует ни одного элемента, который бы занимал случайное место в периодической системе. (Место водорода и в I, и в VII группах обосновано сходством строения электронной оболочки атома водорода с атомами элементов главных подгрупп этих групп.) Закономерным является то, что каждому элементу отвечает только одно четко определенное место в периодической системе и на каждое место в ней может претендовать лишь один химический элемент.
Что означает для элемента его место в периодической системе
После изучения строения атома вы поняли, что место элемента в периодической системе — не просто пронумерованная клетка, закрепленная за химическим элементом на основании значений его относительной атомной массы и заряда ядра атома.
Место каждого химического элемента в периодической системе отображает совокупность основных его свойств, находящихся в тесной закономерной связи со свойствами соответственно размещенных других элементов.
Поэтому и название таблицы не случайно содержит слово «система». Как вам известно из природоведения и физики, система — это единое целое, которое состоит из взаимосвязанных частей. В случае изъятия одной из частей целостность системы теряется. (Вспомните, чтобы целостность периодической системы не нарушилась, в размещении элементов 4 раза отошли от принципа ее построения по возрастанию атомных масс.)
Место элемента в периодической системе, знание строения его атома дают возможность разносторонне и безошибочно характеризовать химический элемент и его соединения.
План характеристики химического элемента по его положению в периодической системе и строению атома. Чтобы получить как можно более полную информацию о химическом элементе, необходимо придерживаться плана характеристики (табл. 9).
1) Место элемента в периодической системе
- а) порядковый номер (протонное число)
- б) относительная атомная масса
- в) период, ряд
- г) группа, подгруппа
2) Строение атома
- а) число протонов, нейтронов, заряд ядра
- б) число электронов, заряд электронной оболочки атома
- в) число энергетических уровней
- г) электронная, графическая электронная формулы атома
- д) число электронов на внешнем энергетическом уровне, в том числе и неспаренных
- е) завершенный или незавершенный внешний энергетический уровень, сколько электронов не хватает до завершения
3) Химический характер элемента и образованных им веществ
- а) к металлическим или неметаллическим елементам принадлежит
- б) формула оксида и соответствующего ему гидроксида
- в) химический характер оксида и гидроксида, примеры уравнений реакций
- г) формула летучего соединения с водородом (для неметаллов), валентность элемента в нем
4) Сравнение химического характера элемента со свойствами соседних элементов
- а)сравнение в периоде
- б)сравнение в подгруппе
Пример характеристики:
По приведенному в таблице плану охарактеризуем химический элемент фосфор.
1. Место в периодической системе. Порядковый номер фосфора 15, 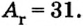 Элемент размещен в третьем периоде, третьем ряду, V группе, главной подгруппе.
Элемент размещен в третьем периоде, третьем ряду, V группе, главной подгруппе.
2. Строение атома. Ядро атома содержит 15 протонов и имеет заряд 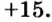 Изотоп
Изотоп 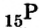 содержит
содержит 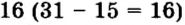 нейтронов. В составе электронной оболочки есть 15 электронов с суммарным зарядом -15, размещенных на трех энергетических уровнях. Электронная формула атома —
нейтронов. В составе электронной оболочки есть 15 электронов с суммарным зарядом -15, размещенных на трех энергетических уровнях. Электронная формула атома — 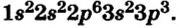 Графическая электронная формула:
Графическая электронная формула:
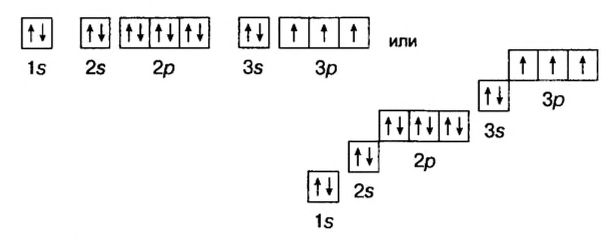
На внешнем энергетическом уровне находится 5 электронов, из них 3 — неспаренных. Внешний энергетический уровень незавершен, к завершению не хватает трех электронов, что составляет менее половины электронов завершенного внешнего энергетического уровня.
3. Химический характер элемента и образованных им веществ. Имея на внешнем энергетическом уровне 5 электронов, фосфор принадлежит к неметаллам. Формула высшего оксида 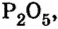 гидроксида —
гидроксида — 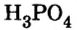 (ортофосфорная кислота). В химических реакциях оба вещества проявляют кислотные химические свойства:
(ортофосфорная кислота). В химических реакциях оба вещества проявляют кислотные химические свойства:
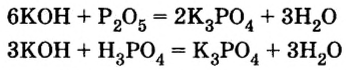
Формула летучего водородного соединения 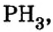 валентность фосфора в ней 3.
валентность фосфора в ней 3.
4.Сравнение химического характера элемента со свойствами соседних элементов. У фосфора соседями по периоду являются кремний и сера, по подгруппе — азот и мышьяк. Неметаллические свойства у фосфора выражены сильнее, чем у кремния, но слабее, чем у серы и азота, и сильнее, чем у мышьяка.
Итоги:
Четко определенное место химического элемента в периодической системе, знания физической сути порядкового номера элемента, номера периода, группы и подгруппы дают возможность исчерпывающе характеризовать строение атома, соединения элемента и их свойства.
Умение характеризовать химический элемент по его месту в периодической системе и строению атома дает возможность выполнять задания по нахождению элемента и составлению формул его соединений.
Пример №13
Относительная молекулярная масса оксида элемента  группы равна 102. Установите, какой это элемент, напишите формулу его гидроксида.
группы равна 102. Установите, какой это элемент, напишите формулу его гидроксида.
Решение
Поскольку неизвестный элемент относится к III группе, то его оксид отвечает общей формуле 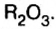 По этой формуле вычислим относительную молекулярную массу соединения:
По этой формуле вычислим относительную молекулярную массу соединения:
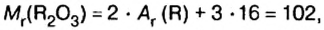
отсюда 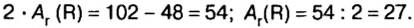
Ответ: находим в периодической системе элемент с относительной атомной массой 27. Это — алюминий, формула его гидроксида — 
Пример №14
Назовите элемент по таким данным: находится в VII группе, образует летучее соединение с водородом, относительная молекулярная масса которого 81.
Решение
Общая формула летучего соединения с водородом для неметаллов VII группы  По этой формуле вычислим относительную молекулярную массу соединения:
По этой формуле вычислим относительную молекулярную массу соединения:
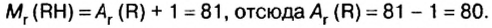
Ответ: элемент с относительной атомной массой 80 — бром.
Значение периодического закона Д. И. Менделеева для химии
Открытие Д. И. Менделеевым в 1869 г. периодического закона имело важное значение не только для химии, но и для других естественных наук, а также философии. Благодаря закону получили научное объяснение известные факты относительно сходства свойств и форм веществ, была установлена взаимосвязь понятий химический элемент и простое вещество. Стало реальным научное прогнозирование существования неизвестных элементов и их открытия.
Дмитрий Иванович сам предусмотрел существование 11 элементов и на основе взаимосвязи между размещением элементов в периодической системе и их свойствами ориентировочно установил их атомную массу, спрогнозировал основные свойства. Некоторые элементы были открыты при жизни ученого, например скандий, галий, германий, а некоторые — значительно позже. Так, почти за 80 лет до открытия элемента с порядковым номером 84 Менделеев предусмотрел для него атомную массу 212, способность образовывать оксид с общей формулой  плотность 9,3, легкоплавкость, серый цвет. У открытого в 1946 г. полония лишь атомная масса имела несколько меньшее значение, остальные же свойства подтвердились.
плотность 9,3, легкоплавкость, серый цвет. У открытого в 1946 г. полония лишь атомная масса имела несколько меньшее значение, остальные же свойства подтвердились.
За основу классификации всех элементов, а не только сходных по свойствам и формам их соединений, Менделеев принял атомную массу. Однако тогда практически каждый шестой элемент имел неточно, а то и неправильно определенное значение атомной массы. И если бы не открытие периодического закона, то неизвестно, как долго это несоответствие существовало бы в науке. Так считалось, что относительная атомная масса бериллия равна 13,5. С таким ее значением элемент должен был бы занять в периодической таблице не четвертую, а шестую клетку, что привело бы к нарушению периодичности. Действительно, тогда двухвалентный металлический элемент бериллий разместился бы между неметаллами — углеродом и азотом. Такое несоответствие навело ученого на мысль, что атомная масса бериллия должна быть больше, чем у лития, но меньше, чем у бора. И бериллий был размещен в клетке под номером 4. Последующие исследования ученых дали возможность уточнить относительную атомную массу бериллия и подтвердили истинность предположения ученого.
Подтверждение предсказаний Д. И. Менделеева свидетельствует о прогностической роли периодического закона. В настоящее время закон распространен на всю Вселенную. Как показали исследования Космоса, на других небесных телах есть такие же химические элементы, как и на планете Земля. В 40-е годы прошлого века были заполнены все свободные клетки периодической системы, оставленные Менделеевым. Но после открытия радиоактивности и изобретения способов получения изотопов начался новый этап проверки предсказаний на основе периодического закона. На сегодня открыто уже 115 химических элементов и синтез новых элементов продолжается. Отображая естественную взаимосвязь между элементами, периодический закон положил начало современному природоведению, выяснению физиками причины периодичности. Закон стал ведущим в химии и физике, опираясь на него, ученые открыли химические элементы, для каких Д. И. Менделеев оставил пустые клетки в таблице. Так появилось новое направление исследований — открытие элементов, которые не существуют в природе. И что особенно важно — для всех нашлись места в периодической системе.
Периодический закон способствует развитию методов познания природы. Такие общие законы развития природы, как единство и борьба противоположностей (на примере существования в атоме положительно заряженного ядра и отрицательно заряженных электронов), переход количественных изменений в качественные (число электронов на внешнем энергетическом уровне у каждого следующего элемента периодической системы увеличивается, что предопределяет появление нового элемента), находят подтверждение благодаря периодическому закону.
Существенной особенностью периодического закона является то, что в отличие от других фундаментальных законов природы у него не существует количественного выражения, то есть он не может быть записан в виде математической формулы или какого-то уравнения. Но это единственный закон, который имеет графическое отображение в виде таблицы периодической системы химических элементов. Периодическая система химических элементов помогает планировать научные исследования и осуществлять их, является незаменимым наглядным пособием для всех, кто изучает химию.
Итак, в настоящее время периодический закон и периодическая система благодаря своим приложениям в науке и практике вышли за пределы химии. И где бы вам в будущем не пришлось работать, какие бы отрасли природоведения вы не исследовали, периодический закон станет ориентиром в познании и преобразовании природы.
Итоги:
- Периодический закон — это один из основных законов природы, он имеет научное и практическое значение для многих областей знаний.
- Периодический закон отображает связь всех химических элементов, предопределенную внутренним строением их атомов.
- Периодический закон — непревзойденный образец проверки правильности теории путем выведения из нее закономерностей и подтверждения их практикой.
-
Достижение физиков в установлении сложного строения атома, синтез новых элементов, создание новых веществ,— все это стало возможным благодаря открытию периодического закона.
Жизнь и научная деятельность Д. И. Менделеева
Дмитрий Иванович Менделеев (1834 — 1907) — русский ученый, член-корреспондент Петербургской Академии наук (с 1876 г.), родился в городе Тобольске в многодетной семье директора Тобольской гимназии Ивана Павловича и Марии Дмитриевны Менделеевых. Семья рано осталась без отца, и все заботы о воспитании и учебе детей легли на плечи матери.

Годы учебы Д. И. Менделеева
В гимназии Менделеев проявлял особый интерес к естественным наукам, поэтому после ее окончания в 1850 г. поступил на естественно-математический факультет Петербургского педагогического института. Его учителями были известные ученые — химик Александр Воскресенский, физик Емилий Ленц, математик Михаил Остроградский, биолог Федор Брандт, которым Менделеев был благодарен за подготовку по естественным наукам. Институт Дмитрий Иванович окончил в 1855 г. с золотой медалью и получил диплом старшего учителя.
Педагогическая деятельность Д. И. Менделеева
Педагогическую деятельность Менделеев начал на должности учителя природоведения, но уже в 23 года стал преподавателем Петербургского университета.
Молодой ученый продолжал научные исследования о состоянии и свойствах веществ. В 1859 г. он поехал в Германию в двухлетнюю научную командировку, где много времени уделял химическому эксперименту. В частности, Дмитрий Иванович исследовал свойства газов и доказал, что при определенной температуре все газы можно превратить в жидкости.
Вернувшись в Петербург, Менделеев продолжил научную и педагогическую деятельность в университете. Его исследования растворов касались образования неустойчивых соединений растворенного вещества с растворителем. Обобщенные результаты многочисленных экспериментов по изучению свойств растворов он изложил в докторской диссертации. Сразу после ее защиты Дмитрия Ивановича избрали профессором Петербургского технологического университета. Там он читал лекции почти по всем разделам химии — теоретической, органической, технической, аналитической. Он был первым русским ученым, который написал учебник по органической химии. А его учебник «Основы химии» признан фундаментальным учебником для высших учебных заведений, в котором впервые неорганическая химия трактовалась с точки зрения периодического закона. Учебник на протяжении почти 80 лет неоднократно переиздавался, в том числе и на иностранных языках.
Открытие периодического закона — научный результат деятельности Д. И. Менделеева
Стремление объединить разрозненные химические знания в определенную систему натолкнуло Д. И. Менделеева в 60-е годы XIX ст. на поиск родства всех химических элементов. Поскольку о строении атома на то время не было известно, ученый значительное внимание уделял сопоставлению атомных масс, сравнению элементов и их соединений, а результаты этой теоретической и экспериментальной работы обнародовал на научных собраниях в разных странах. Так Дмитрий Иванович приближался к открытию в 1869 г. периодического закона и созданию периодической системы химических элементов.
Свое гениальное открытие — периодический закон и периодическую систему элементов — Менделеев сделал в возрасте 35 лет, намного опередив свое время. Периодическая система стала необходимым инструментом в химических исследованиях, она заняла почетное место на стене каждой химической лаборатории, на рабочем месте всех, кто причастен к изучению химии.
Многогранная деятельность ученого
Д. И. Менделеев посвятил науке более 50 лет жизни. Все, что он сделал, чего достиг, указывает на широту и значимость его труда.
Ученый исследовал растворы и разработал теорию растворов, изобрел один из видов бездымного пороха, разработал способы использования удобрений в сельском хозяйстве и орошения засушливых земель. Изучив состав нефти, Д. И. Менделеев изобрел новые способы ее переработки и выделения из нее веществ, которые можно использовать для производства промышленных товаров. Он выступал против использования нефти лишь как топлива.
В августе в 1887 г. Менделеев осуществил полет на воздушном шаре с целью наблюдения солнечной короны во время солнечного затмения. Он преодолел путь около 100 км на максимальной высоте полета приблизительно 4 км и успешно приземлился.
Д. И. Менделеев проникался проблемами развития государства, улучшения благосостояния его народа. Как патриот и высокообразованный человек он понимал, что в улучшении уровня жизни народа важная роль принадлежит образованию. Поэтому Дмитрий Иванович был активным участником мероприятий, посвященных обсуждению вопросов образования, подготовки учителей, создания учебных заведений, написания учебников. Во все времена он отстаивал интересы студенчества, защищал новые идеи и помогал молодым ученным воплощать их в жизнь.
Профессор Д. И. Менделеев был любимым преподавателем студентов-химиков. Послушать его лекции приходили студенты и преподаватели из разных факультетов, даже те, которые не изучали химию, находя для себя много поучительного и интересного.
Д. И. Менделеев работал и в отрасли точных измерений. В 1893 г. он стал организатором и первым директором Главной палаты мер и весов.
Благодаря активной научной и общественной деятельности Дмитрий Иванович много путешествовал, побывал в разных уголках планеты. Но его не оставляла мысль, которая волновала многих естествоиспытателей того времени,— освоение пространств Северного Ледовитого океана. Талантливый ученый разработал план освоения Арктики и предложил проект ледокола.
Дмитрий Иванович помогал художникам устраивать выставки картин, принимал участие в обсуждении произведений искусства. В его библиотеке хранились ценные коллекции репродукций картин, признанных мировыми шедеврами.
Признание заслуг ученого Д. И. Менделеева
Заслуги Д. И. Менделеева снискали общее признание еще при его жизни. Он был избран почетным членом почти всех академий Европы и Америки, многих ученых сообществ, научных учреждений и учебных заведений разных стран мира. Его научный титул насчитывает почти 130 названий. В знак признания заслуг выдающегося русского ученого полученный в 1955 г. американскими исследователями радиоактивный элемент с протонным числом 101 назвали менделевий.

Итоги:
- Дмитрий Иванович Менделеев — выдающийся ученый, талантливый педагог, патриот своей Отчизны.
- Жизнь и деятельность Д. И. Менделеева является примером настойчивости, целеустремленности в решении научных проблем.
- Во всем мире высоко ценят научное наследие Д. И. Менделеева.
Справочный материал по периодической системе элементов и периодическому закону
В процессе изучения неорганической химии вы ознакомились с историей открытия периодической системы и периодического закона.
В конце IX и начале X века Абу-ар-Рози классифицировал материалы, основываясь на их растительном, животном и минеральном происхождении;
В XVIII веке стало известно около 30 элементов;
XIX веке определено более 60 элементов;
Немецкие ученые И. Деберейнер (1829) и Ю. Мейер (1864), английские ученые У. Одлинг и Дж. Ньюлендс (1863), французские ученые Дж. Дюма и А. Шанкуртуа (1862) и др. делали попытку систематизировать химические элементы;
В1620 году А. Сала разделил растворители на водные, кислотные и масляные;
Проблемы систематизации удачно решены русским ученым Д. И. Менделеевым в 1869 г.;
В 1718 году Е. Жоффруа создал таблицу сходных веществ.
Периодический закон Д. И. Менделеев первоначально сформулировал так: «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов». Затем, как нам известно, по мере углубления, расширения знаний и представлений о строении атома была дана современная формулировка, гласящая, что:
«Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра атомов этих элементов».
Периодический закон - отражает закон природы и все живое в природе.
Периодическая система элементов появилась на основе периодического закона.
Если в первоначальном варианте (1 марта 1869 г.) периодическая система включала в себя 63 элемента, то в современной системе - 109 элементов.
Расположение элементов в периодической системе объясняется периодичностью изменения их физических и химических свойств. Под периодичностью понимается повторяемость свойств через определенный интервал. Например, в таблице щелочные металлы, галогены и инертные газы расположены через интервал (период), где расположены элементы с 8 или 18 элементами. Такой порядок изменения свойств связан с заполнением электронного уровня.
Периодическая система и периодический закон химических элементов с точки зрения строения атома
Открыт периодический закон и составлена периодическая система, однако Д. И. Менделеев не объяснил сходство и отличие свойств элементов, суть причины периодичности изменений.
В XIX веке атом в химической реакции считался неизменяемой частицей. Эти представления изменились после новых открытий, сделанных в конце XIX и в начале XX веков:
- Открытие Х-(рентгеновских) лучей (немецкий ученый В. Рентген, 1895).
- Открытие радиоактивности (французский ученый А. Беккерель, 1896).
- Открытие электрона (английский ученый Дж. Томсон, 1897).
- Заряд ядра данного элемента равен его порядковому номеру в периодической системе (английский ученый Д. Мозли, 1913).
- Создание проточно-нейтронной теории атомного ядра (русские ученые Д. Д. Иваненко и Е. Н. Гапон, а также немецкий ученый В. Гейзенберг, 1932).
Положение химического элемента в периодической системе зависит от свойств и строения его атома.
Изучение радиоактивности (М. Складовская-Кюри, П. Кюри, Э. Резерфорд) показало, что атом химического элемента является сложной системой. Атом состоит из положительно заряженного ядра и вращающихся вокруг него электронов (электрон  имеет массу равную
имеет массу равную 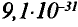 кг и отрицательный заряд равный
кг и отрицательный заряд равный 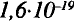 Кл). Скопление электронов вокруг атома называется электронной оболочкой. Атом - электронейтральная частица, следовательно число электронов на электронном уровне равно заряду ядра или порядковому номеру
Кл). Скопление электронов вокруг атома называется электронной оболочкой. Атом - электронейтральная частица, следовательно число электронов на электронном уровне равно заряду ядра или порядковому номеру 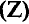 элемента в периодической системе.
элемента в периодической системе.
Согласно протонно-нейтронной теории, ядро атома состоит из протонов и нейтронов (протон 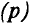 - это частица, имеющая 1 а.е.м. массы, и частица с зарядом +1; нейтрон
- это частица, имеющая 1 а.е.м. массы, и частица с зарядом +1; нейтрон 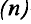 - электронейтральная частица с весом, близким к массе протона).
- электронейтральная частица с весом, близким к массе протона).
Заряд ядра определяется числом протонов, входящих в его состав. Следовательно, число протонов атомного ядра также равно порядковому номеру в периодической системе элементов.
Масса атома (А) равна сумме массы всех частиц, входящих в состав атома:

Масса электронов очень мала, и поэтому можно считать, что масса атома состоит только из массы протонов и нейтронов. Общая масса протонов и нейтронов называется массовым числом (А). Она округленная до целого числа, равна относительной атомной массе элемента (Аr):

Число нейтронов в атомном ядре равно разности между относительной атомной массой элемента и его порядковым номером: 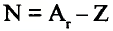
Таким образом, по местоположению элементов в периодической системе можно определить состав его атома (таблица 1).
Таблица 1
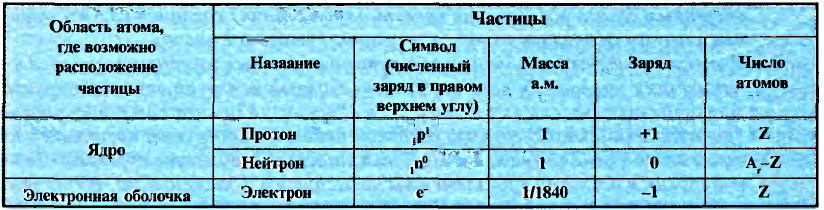
Как мы видим, в состав атома вошли положительно и отрицательно заряженные частицы - электроны и протоны т.е. он состоит из частиц с противоположными свойствами.
Протоны, нейтроны, электроны являются элементарными частицами, наряду с ними на сегодняшний день известно много частиц с различными свойствами (масса, заряд и др.). И хотя мы их не видим, существование их доказано экспериментальными данными ученых.
Также как атом и молекула, элементарная частица является разновидностью материи.
Изучение строения атома показало, что периодическая таблица составлена таким образом, что элементы в ней расположены в соответствии со строением электронных оболочек атомов.
В невозбужденном состоянии электронное строение атома определяется количеством электронов в нем. При этом электроны занимают орбиты с минимальной энергией. Количество электронов численно равно заряду ядра. Таким образом, именно заряд ядра определяет электронное строение атома и связанные с этим свойства элементов. Из этого вытекает современная формулировка периодического закона.
Свойства химических элементов и образующихся из них простых и I сложных веществ находятся в периодической зависимости от заряда атомного ядра.
Количество электронных уровней любого элемента численно равно номеру периода, где расположен этот элемент. Н и Не имеют один электронный уровень и они расположены в первом периоде; атомы таких элементов как Li, Be, В, С, N, О, F, Ne имеют два электронных уровня, и они расположены во втором периоде и т.д. Атомы элементов на внешнем электронном слое не могут иметь больше восьми электронов, и в периодической системе имеется восемь групп. Каждая группа подразделяется на главную и побочную подгруппы. Количество электронов на внешнем электронном уровне атома элементов главной подгруппы численно равно (кроме Не) номеру группы.
1. Период начинается, соответственно, с организации нового энергетического уровня. Каждый период начинается с щелочного металла и завершается инертным газом. Их внешний уровень (кроме гелия) состоит из 8 электронов и имеет символику 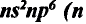 - главное квантовое число).
- главное квантовое число).
2. Элементы главных и побочных подгрупп различаются завершаемостью энергетических уровней. У всех элементов главных подгрупп заполняется или внешний s-подуровень (s элементы I и II групп), или внешний р-подуровень (р-элементы III и IV групп). В первой побочной подгруппе, состоящей из трех декад (Sc-Zn, Y-Cd, La-Hg), завершается заполнение внутреннего d-подуровня и поэтому эти элементы называются d-элементами. Во второй побочной подгруппе лантаноидов и актиноидов происходит заполнение f-подуровня, расположенного еще глубже, и поэтому эти элементы называются f-элементами.
Таким образом, строение периодической системы объясняет электронное строение атома, количество групп, количество главных и побочных подгрупп, количество элементов в группах и периодах. Она разъясняет размещение таких элементов, как калий и аргон, кобальт и никель, теллур и йод (согласно их атомного строения).
Изменение свойств элементов в периодах и группах
Электронная теория атомного строения объясняет изменчивость свойств элементов с точки зрения взаимосвязи их атомного строения и положения в периодической системе.
Согласно этой теории химическая реакция основывается на электронном взаимоотношении, т.е. на процессе перестройки электронных уровней атома. В этом процессе в основном участвуют электроны внешних электронных уровней (валентные электроны). Обычно это одиночные (неспаренные) электроны.
Например, внешний электронный уровень атома углерода имеет следующее строение 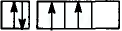 . В возбужденном состоянии он переходит в следующее
. В возбужденном состоянии он переходит в следующее  .
.
Максимально заполненные уровни бывают самыми устойчивыми. Такие электронные уровни называются завершенными и имеют 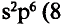 электронов) конфигурацию (кроме Не).
электронов) конфигурацию (кроме Не).
Поэтому инертные газы с трудом вступают в химическое взаимодействие.
Атомы металлов на внешнем электронном уровне, обычно, имеют 4 электрона, которые слабо притягиваются атомом. И вступая в реакцию, они легко теряют валентные электроны. По сравнению с другими металлами щелочные металлы обладают сильно выраженными металлическими свойствами. Для сравнения металлических свойств элементов используется специальная величина - энергия ионизации (I).
Энергия ионизации - это количество энергии, необходимое для отделения электрона от атома.
Единица измерения энергии ионизации выражается в отношении электрон-вольт к атому (eV/атом). Энергия ионизации атома считается функцией строения электрона. Энергия ионизации атома находится в периодической зависимости от порядкового номера элемента.
Атомы неметаллов имеют на внешнем электронном уровне 4 и более электронов, которые сильно связаны с атомом. Поэтому при вступлении в химическое взаимодействие атом неметалла присоединяет электрон. Для сравнения неметаллических свойств вводится специальная величина - сродство к электрону (Е).
Сродство к электрону - это количество энергии, которая выделяется или поглощается в результате присоединения одного электрона и нейтральному атому.
Единица измерения сродства к электрону выражается в отношении электрон-вольт (eV/атом) к атому.
Элементы главной подгруппы седьмой группы (F, CI, Br, I) - типичные неметаллы, обладают самой большой величиной сходства к электрону.
На примере элементов, одного периода, например элементов третьего периода рассмотрим изменение химических свойств в зависимости от строения атома.
Каждый элемент этого периода имеет три К, L и М электронных уровня, а для всех элементов этого же периода строение К, L электронного уровня одинаково, отличаются они только строением внешнего М уровня. Радиусы атомов также отличаются друг от друга (Таблица 2).
Таблица 2
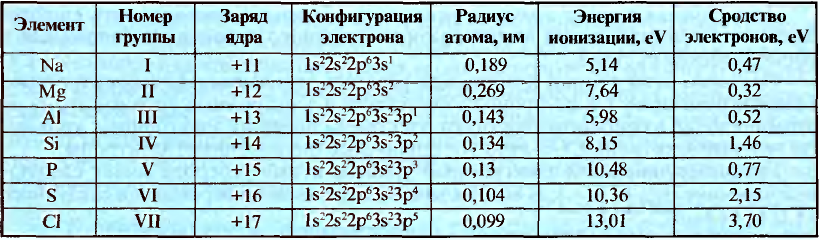
По мере увеличения заряда ядра атома элемента одного и того же периода радиус атома уменьшается, а количество электронов на внешнем энергетическом уровне увеличивается. В результате усиливается притяжение к ядру электронов внешнего энергетического уровня, увеличивается энергия ионизации и сродство к электрону. Поэтому к концу периода ослабевают металлические свойства элементов и усиливаются неметаллические.
Действительно, третий период начинается с типичного щелочного металла - натрия. Магний, расположенный за натрием, также является типичным металлом, однако по сравнению с натрием он обладает меньшими металлическими свойствами. Следующий металл алюминий, который в некоторых соединениях проявляет неметаллические свойства. У элементов Si, Р, S, С1 неметаллические свойства от Si к С1 усиливаются. Хлор типичный неметалл. Период завершается инертным газом - аргоном. Такое изменение химических свойств элементов наблюдается во всех периодах.
В больших периодах, как и в малых, металлические свойства ослабевают, но гораздо медленнее, а неметаллические постепенно усиливаются.
Таким образом, можно сделать заключение, что с изменением порядкового номера химические свойства элементов изменяются периодично.
На примере элементов I А группы рассмотрим химические свойства элементов главной подгруппы и изменение их атомного строения (Таблица 3).
Таблица 3

Элементы одной подгруппы имеют одинаковое электронное строение внешнего энергетического уровня. Элементы I А группы имеют на внешнем энергетическом уровне по одному s-электрону. Однако, с возрастанием порядкового номера (заряда ядра) элемента увеличивается радиус атома и количество электронов. Это приводит к ослаблению притяжения между ядром и внешним электроном и уменьшению энергии ионизации. По этой причине в главной подгруппе по мере возрастания порядкового номера элемента сверху вниз происходит усиление металлических свойств и ослабление неметаллических.
Обобщая, изменение свойств элементов в периоде и группах можно выразить следующим образом:
1. По мере возрастания порядкового номера (заряда ядра) элементов в группах:
- Усиливаются металлические свойства;
- Неметаллические свойства ослабевают.
2. По мере возрастания порядкового номера (заряда ядра) в периодах:
- Ослабевают металлические свойства;
- Увеличиваются неметаллические свойства.
Следовательно, самые сильные металлические свойства проявляются у цезия и самые сильные неметаллические свойства - у фтора.
Видно, что с возрастанием заряда атомного ядра количество электронов на внешнем энергетическом уровне изменяется периодически.
Заряд атома
Ядро атома нейтрально и состоит из протонов.
Нейтрон - нейтральная частица, и его относительная масса равна 1 а.е.м. Обозначается буквой "n".
Протон заряжен отрицательно. Его относительная масса равна 1 а.е.м Обозначается буквой "р".
Заряд ядра атома равен порядковому номеру элемента в периодической системе элементов.
В ядре атома водорода имеется один протон, нейтронов же нет.
Масса атома равна сумме масс протонов и нейтронов в ядре. 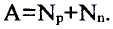 Например, ядро атома алюминия имеет 13 протонов и 14 нейтронов.
Например, ядро атома алюминия имеет 13 протонов и 14 нейтронов. 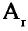
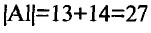 а.е.м.
а.е.м.
Группа химических элементов, имеющих одинаковый заряд ядра, но отличающихся массой атома, называются изотопами. Например, в природе встречается три изотопа аргона - 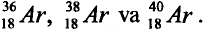 Свинец имеет 4 изотопа:
Свинец имеет 4 изотопа: 
Элементы, имеющие одинаковую массу, но отличающиеся зарядом ядра, называются изобарами. Например, калий и аргон. 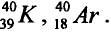
Элементы имеющие одинакового количество нейтронов в атомном ядре называются изотонами. Например, ксенон 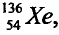 барий
барий 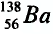 и лантан
и лантан 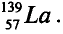
В результате самоизлучения радиоактивных элементов появление новых химических элементов называется радиоактивным расщеплением. При 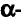 излучении заряд ядра уменьшается на 2, а масса ядра - на 4 единицы. Следовательно, порядковый номер нового элемента уменьшается на 2 порядка, и в периодической системе он смещается на две клетки влево. При
излучении заряд ядра уменьшается на 2, а масса ядра - на 4 единицы. Следовательно, порядковый номер нового элемента уменьшается на 2 порядка, и в периодической системе он смещается на две клетки влево. При 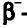 излучении масса ядра не изменяется, а его заряд на единицу увеличивается
излучении масса ядра не изменяется, а его заряд на единицу увеличивается 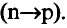
При излучении позитронов масса ядра не изменяется, а его заряд на единицу уменьшается 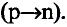
Строение электронных слоев атома
Атом, являясь электронейтральной системой, состоит из положительно заряженного ядра и отрицательно заряженных электронов, вращающихся вокруг ядра. Число протонов в электронейтральном атоме равно числу электронов. Электроны вращаются вокруг ядра на энергетических уровнях. Энергетические уровни подразделяются на подуровни, подуровни, в свою очередь, на энергетические ячейки.
Движение электронов характеризуется 4 квантовыми числами.
1. Главное квантовое число - 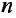
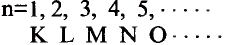 .
.
Чем меньше главное квантовое число, тем больше энергия связывания ядра и подуровневых электронов.
Число электронов с любого энергетического подуровня определяйся  формулой.
формулой.
- когда
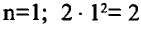 электрона;
электрона; - когда
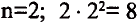 электрона;
электрона; - когда
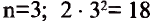 электрона;
электрона; - когда
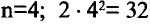 электрона.
электрона.
2. Орбитальное квантовое число - 
Орбитальное квантовое число определяет энергию подуровневых электронов или форму электронного "облака". Орбитальное квантовое число равно от 0 до n-1.
- когда
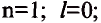
- когда
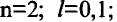
- когда
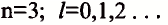
Связь между n и l
Таблица 4
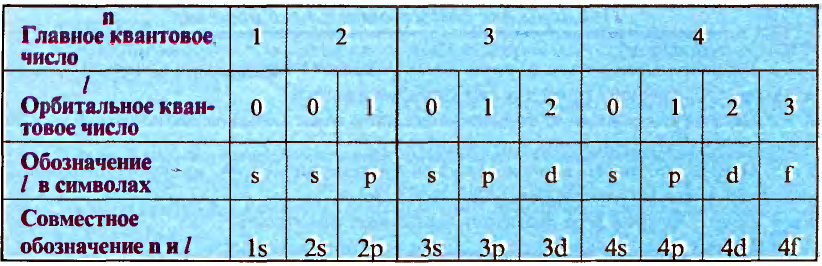
Число электронов на подуровнях определяется следующий формулой:
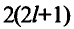
3. Магнитное квантовое число - m
Магнитное квантовое число определяет состояние электронов в атоме или состояние электронных "облаков" по отношению к магнитному полю.
Численное значение магнитного квантового числа определяется в интервале от +1 до -1.
- когда
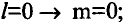
- когда
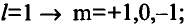
- когда
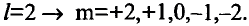
Количество ячеек на энергетических уровнях определяется 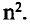 Например,
Например, 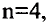 то количество ячеек равно
то количество ячеек равно 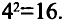
4. Спиновое квантовое число - s
Спиновое квантовое число определяет вращение электрона вокруг собственной оси. Его численное значение равно для одного электрона 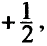 для двух электронов
для двух электронов 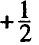 и
и 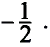
В одном атоме не может быть 4 квантовых чисел с одинаковыми численными значениями. Даже если имеется два электрона с одинаковыми n, l, m квантовыми числами, то их спины будут противоположными  (Принцип Паули).
(Принцип Паули).
Главные ячейки подуровней сначала по одному максимально заполняются электронами, затем по порядку будут спариваться.
Порядок заполнения энергетических уровней и подуровней электронами можно представить в общем порядке следующим образом:
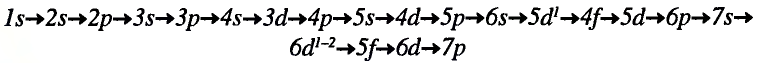
Типы химических связей: ковалентная (полярная и неполярная), ионная и металлическая
Теория электронного строения атома объясняет способность атомов соединяться в молекулы, т.е. природу и механизм химической связи.
Химическая связь - это взаимодействие двух или более атомов, в результате которого образуются химически устойчивые двух или многоатомные системы (например: молекула или кристалл);
- Направленность связи определяет пространственную структуру и формулу молекулы;
- Полярность связи определяется асимметричным размещением общей электронной пары;
- Кратность связи определяется числом электронных пар, связывающих атомы;
- Длина связи - это равновесное состояние расстояния между ядрами атомов (измеряется в нм);
- Энергия связи равна работе, совершаемой для разрыва связи (измеряется в кДж /моль).
Образование химической связи являясь экзотермическим процессом, протекает с выделением энергии, а разрыв связи - эндотермическим процессом и протекает с поглощением энергии.
Ковалентная, ионная, металлическая, водородная связи считаются основными типами химической связи.
Связь, образованную посредством общей электронной пары атомов, называют ковалентной.
Способность атома химического элемента притягивать электронную пару называется электроотрицательностью.
- а) связь между атомами с одинаковой величиной электроотрицательности называется неполярной ковалентной связью (общая электронная пара расположена симметрично между ядрами);
- б) связь между атомами с различной величиной электроотрицательности называется полярной ковалентной связью (общая электронная пара смещена в сторону более электроотрицательного элемента).
Ковалентная связь характерна в основном для неметаллов. Возникновение ковалентной связи обусловлено образованием общей электронной пары атомов с противоположными спинами. Простые вещества (такие как  обладают неполярной ковалентной, а многие сложные вещества (такие как
обладают неполярной ковалентной, а многие сложные вещества (такие как 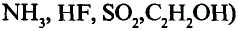 - полярной ковалентной связью.
- полярной ковалентной связью.
При нормальных условиях вещества с ковалентной связью могут быть твердыми (парафин, лед), жидкими (вода, спирт), и газообразными (кислород, азот, аммиак).
При образовании соединения из атомов элементов с резко выраженной электроотрицательностью (типичные металлы и типичные неметаллы) электронная пара будет смещена в сторону атома с большей электроотрицательностью. В результате образуются ионы (положительно заряженные катионы и отрицательно заряженные анионы).
Например, при горении натрия в хлоре образуется молекула NaCl в которой электронная пара, состоящая из 3s-электрона натрия и 3p-электрона хлора, полностью смещена в сторону атома хлора, в результате чего образуется катион 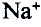 и анион
и анион 
Частицы, образующиеся в результате присоединения электронов к атомам или в результате потерь электронов атомами, называются ионами;
- Соединения, образованные из ионов, называются ионными соединениями;
- Связь между ионами называется ионной.
Между ионной и ковалентной связями не существует четкой границы. Ионную связь можно считать предельным состоянием полярной ковалентной связи. Однако, в отличие от ковалентной связи, ионная связь не имеет направления.
- Процесс отдачи электронов называется окислением;
- Процесс присоединения электронов называется восстановлением.
Например, при взаимодействии натрия и хлора атом натрия отдает электрон и окисляется, образуя катион: 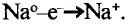 Атом хлора принимает электрон и образует анион:
Атом хлора принимает электрон и образует анион: 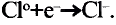 Металлы главной подгруппы I и II группы образуют типичные ионные соединения с неметаллами главной подгруппы VII группы.
Металлы главной подгруппы I и II группы образуют типичные ионные соединения с неметаллами главной подгруппы VII группы.
При нормальных условиях ионные соединения - это твердые вещества.
Атом водорода, связанный с атомом сильноэлектроотрицательного элемента (фтор, кислород, азот), обладает способностью образовывать еще одну связь с атомом другого сильноэлектроотрицательного элемента. Например, в молекуле воды водород связан с сильно электроотрицательным элементом кислородом с помощью полярной ковалентной связи. Общая электронная пара сдвинута в сторону кислорода и при этом водород имеет частичный положительный заряд, а кислород - частичный отрицательный заряд. Положительно заряженный водород одной молекулы воды притягивается отрицательно заряженным кислородом другой молекулы воды, что приводит к образованию водородной связи.
Связь между двумя электроотрицательными атомами через атом водорода называется водородной.
Водородная связь характерна для таких соединений, как вода, жидкий аммиак, фторид водорода и многих органических соединений.
Металлам свойственна самая низкая энергия ионизации и наличие большого количества активных электронов. Электроны в структуре кристаллической решетки металла легко отрываются из атомов, и в результате образуется электронный газ и положительно заряженные ионы металлов. Электроны по всему кристаллу считаются общими.
Валентность элементов и степень их окисления
Атом одного элемента может присоединить только определенное число атомов другого элемента.
Валентность - это способность атома элемента присоединять определенное количество атомов другого элемента;
Валентность элементов определяется количеством электронных пар, которые связывают атом одного элемента с атомом другого элемента.
Валентность не равняется нулю и отрицательному числу. Понятие "валентность" целесообразно применять только по отношению к соединениям с ковалентной связью.
В настоящее время, для характеристики состояния атома введено такое понятие, как степень окисления.
Степень окисления - это условный заряд, приобретаемый атомом при превращении его в ион (т.е. когда происходит полное смещение общей электронной пары в сторону более электроотрицательного атома).
Степень окисления не всегда равна валентности.
При определении степени окисления элемента в соединениях необходимо помнить следующее:
Степень окисления молекулы, состоящей из одинаковых атомов равна нулю;
Степень окисления водорода в гидроксидах металлов равна -1, а во всех других соединениях +7;
Степень окисления кислорода во многих соединениях равна -2, в соединениях фтором +2, в пероксидах (Э-О-О-Э) -1;
Степень окисления фтора во всех соединениях равна -1;
Степень окисления щелочных металлов во всех соединениях равна +1;
Степень окисления элементов главной подгруппы II группы во всех соединениях равна +2;
Атомы простых веществ имеют степень окисления, равную нулю;
Алгебраическая сумма степеней окисления всех атомов молекул равна нулю. Используя это правило можно определить неизвестную степень окисления атома, входящего в молекулу, если степени окисления других атомов известны;
Степень окисления может быть не только целым, но и дробным числом;
Многие элементы имеют переменную степень окисления;
Самая высокая степень окисления равна номеру группы периодической системы, где расположен этот элемент;
В соединениях с водородом степень окисления неметаллов изменяется от -4 (элементы IV группы) до -1 (элементы VII группы). Это определяется количеством электронов, отданных атомами водорода атому неметалла.
Теория электролитической диссоциации
Вещества, растворы или расплавы которых способны проводить электрический ток, называются электролитами;
Вещества, растворы или расплавы которых неспособны проводить электрический ток, называются неэлектролитами.
Разработанные в XIX веке теории растворов (теория гидратов Д. И. Менделеева и ионизации С. Аррениуса), на первый взгляд, давали противоречивые объяснения. Если теория гидратов Д. И. Менделеева не могла объяснить способность растворов кислот, щелочей и солей проводить электрический ток, то теория ионизации С. Аррениуса не могла объяснить появление ионов в растворах электролитов.
Впервые русский ученый И. А.Каблуков предложил рассматривать эти две теории как теорию электролитической диссоциации.
Согласно электролитической диссоциации при растворении электролита в поляризованном растворителе происходит взаимодействие электролита с полярными молекулами растворителя.
Электролиты - это вещества с ионной или полярной ковалентной связью.
В процессе диссоциации ионы переходят в гидратированное состояние.
К каждому иону присоединяется несколько молекул растворителя (воды). Обычно молекулы растворителя не участвуют в химической реакции электролитов; в этом случае они не учитываются при составлении уравнений химической реакции.
Неэлектролиты, являясь соединениями с неполярной или со слабой полярной ковалентной связью, под воздействием растворителя не ионизируются, и поэтому их растворы не способны проводить электрический ток.
Распад электролитов при растворении в воде или в другом полярном растворителе, а также при расплавлении под воздействием высокой температуры на ионы, называется электролитической диссоциацией.
Каждый электролит образует положительно и отрицательно заряженные ионы, и эти ионы отличаются от нейтрального атома или молекулы зарядом или другими свойствами.
В растворе ионы совершают беспорядочное движение, однако при пропускании электрического тока отрицательно заряженные ионы перемещаются к аноду, а положительно заряженные ионы - к катоду.
Электролитическая диссоциация - обратимый процесс, притяжение катионов и анионов в растворе приводит к образованию молекулы. В растворе ионы и молекулы находятся в динамичном (подвижном) равновесии. Поэтому в уравнениях электролитической диссоциации ставится знак обратимости 
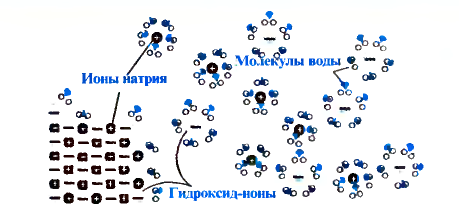
Рис. 1. Распад в водном растворе молекулы гидроксида натрия на ионы.
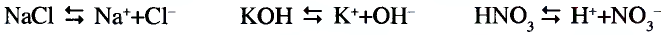
Отношение числа молекул, диссоциированных при определенной температуре к исходному числу молекул растворенного вещества, называется степенью электролитической диссоциации 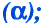
Степень электролитической диссоциации зависит от природы электролита, концентрации раствора и температуры;
Диссоциированная и межмолекулярная константа равновесия называется константой диссоциации;
Константа диссоциации зависит от природы электролита и температуры, но не зависит от концентрации.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |