
Растворы в химии - виды, получение, формулы и определения с примерами
Содержание:
Растворы:
Что вы наблюдаете после того, как, добавив в чай сахар, начинаете размешивать его? Какой процесс происходит, почему сахар становится невидимым? Поясните своё мнение.

Распределение частиц одного или нескольких веществ между частицами другого вещества называют процессом растворения. Из курса физики вы знаете, что растворение - это не только физический процесс, но и химический. То есть, во время растворения веществ друг в друге совершается не простое измельчение и распределение (диффузия) одного вещества в другом, а здесь, наряду с физическим процессом, между частицами растворенного вещества и растворителя происходит химическое взаимодействие. Выделение теплоты при растворении в воде некоторых веществ (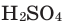
Однородные системы, состоящие из растворенного вещества и растворителя, называют растворами.

р (растворенное вещество) + р (растворитель) = р (раствор)
Растворы бывают в жидком, газообразном и твердом состояниях. Например, реки, озера, моря - это жидкие, состоящий из азота, кислорода и других газов воздух - газообразный, а чугун и сталь, полученные в результате растворения металлов друг в друге - твердые растворы.
По степени своей растворимости в 1000 мл (1 л) воды вещества делятся на 3 группы (схема 1).
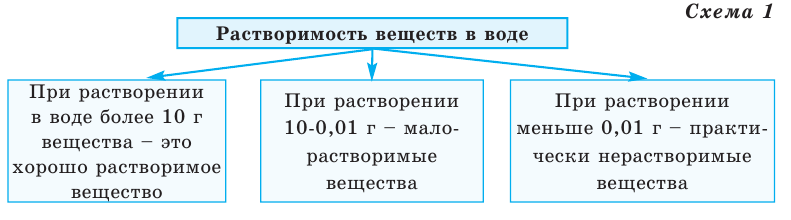
Как видно из схемы 1, способность веществ растворяться в воде неодинакова. При одинаковых количествах воды и условиях некоторые вещества растворяются хорошо, до конца, другие - мало, а третьи -ничтожно мало. Например, сравним способности растворяться в 1000 г (или 1000 мл) воды (г/л) при комнатной температуре  сахара, поваренной соли, извести, гипса, хлорида серебра
сахара, поваренной соли, извести, гипса, хлорида серебра  и сульфата бария
и сульфата бария 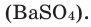
Здесь поваренная соль и сахар являются хорошо растворимыми, известь и гипс - малорастворимыми, а хлорид серебра (I) и сульфат бария - практически нерастворимыми веществами.
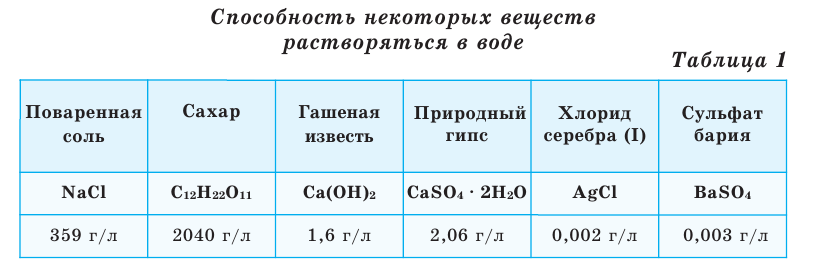
Растворение большинства солей в воде представляет собой эндотермический процесс, и поэтому с повышением температуры растворимость солей возрастает (рис. 1, а). Поскольку растворение в воде газов (и щелочей) обычно является экзотермическим процессом, с повышением температуры их растворимость уменьшается (рис. 1,6). На растворимость солей и веществ в жидком состоянии давление не влияет. Зависимость растворимости от температуры показывается посредством кривых растворимости.
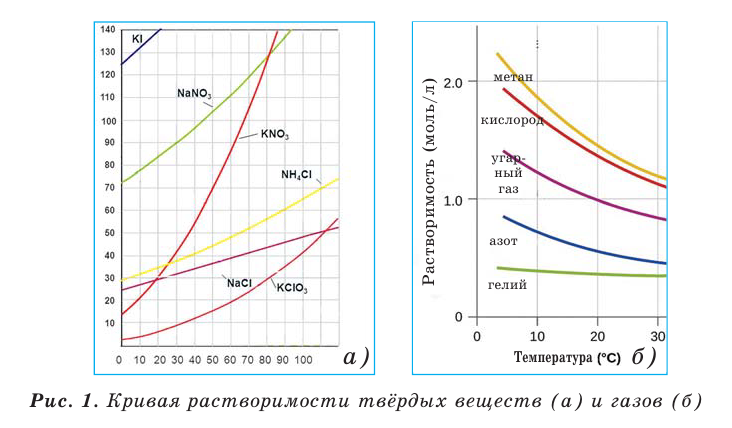
С помощью кривых растворимости можно определить коэффициенты растворимости веществ при различных температурах. При растворении в воде твердых и жидких веществ объем системы в заметной степени не меняется. Однако растворение в воде газов происходит с уменьшением объема системы. Вследствие этого повышение давления увеличивает растворимость газов. Растворение солей - эндотермический, а растворение газов - экзотермический процесс.
Качественные особенности состава раствора. Коэффициент растворимости

Обратите внимание на картинки. Сгруппируйте густые и жидкие продукты питания.
В зависимости от количества вещества, растворённого в определенном объеме растворителя, растворы классифицируются следующим образом (схема 1):
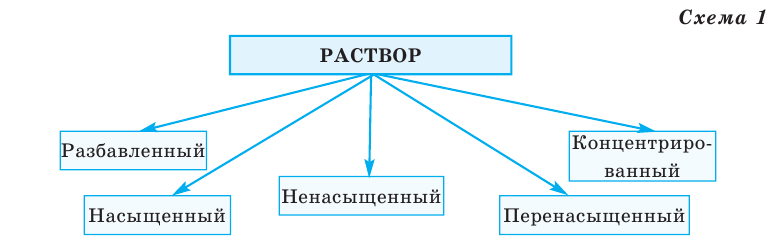
Если в определенном объеме раствора при комнатной температуре растворенное вещество содержится в малом количестве, то такой раствор называют разбавленным, а при большом количестве - концентрированным. Например, полученный при растворении в 1 стакане (170 г) воды 1-2 кусков сахара (10-20 г) раствор называют разбавленным, а при растворении 4-5 кусков сахара (40-50 г) и более - концентрированным.
Для выражения количества растворимого вещества также пользуются понятиями насыщенного и ненасыщенного растворов. Раствор, в котором при определенной температуре растворяемое вещество более не способно растворяться, называют насыщенным раствором. Раствор же, в котором при определенной температуре еще какая-то часть растворяемого вещества способна растворяться, называют ненасыщенным раствором. Например, если в стакане воды при комнатной температуре (20 С) растворяются 1, 2, 3 куска сахара и есть возможность растворить в ней еще какое-то количество сахара, значит - это ненасыщенный раствор. Увеличивая число кусков сахара и перемешивая их, мы продолжаем растворять их. Если, наконец, на дне стакана даже при перемешивании остается нерастворенный сахар, то полученный раствор называют насыщенным. Если путём нагревания насыщенного раствора постепенно добавить растворимое вещество и после этого довести полученный раствор до температуры исходного раствора, то получится перенасыщенный раствор.
Нельзя смешивать понятия «насыщенный раствор» и «концентрированный раствор». Насыщенным раствором также называют разбавленный раствор, в котором содержится чрезмерно малое количество малорастворимых веществ.
Коэффициент растворимости
Способность веществ растворяться выражают коэффициентом растворимости. Максимальное количество вещества в граммах, растворенного в 1000 мл (1л) растворителя при определенной температуре, называют коэффициентом растворимости. Коэффициент растворимости обозначается знаком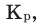 единица его измерения г/л. Если в 1 л воды при комнатной температуре (20
единица его измерения г/л. Если в 1 л воды при комнатной температуре (20  С) растворяется 359 г поваренной соли, 1,6 г гашеной извести, то можно записать:
С) растворяется 359 г поваренной соли, 1,6 г гашеной извести, то можно записать:
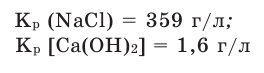
Коэффициент растворимости можно вычислить по следующей формуле: поскольку 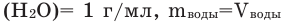
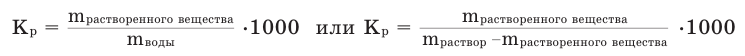
Например, при 20  С в 1000 мл воды максимально может раствориться 2040 г сахара. Это означает, что при 20
С в 1000 мл воды максимально может раствориться 2040 г сахара. Это означает, что при 20 С коэффициент растворимости сахара равен 2040 г/л.
С коэффициент растворимости сахара равен 2040 г/л.
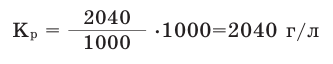
Коэффициент растворимости веществ меняется в зависимости от температуры. По мере повышения температуры у большинства твердых веществ возрастает и коэффициент растворимости в воде, а растворимость газов, наоборот, уменьшается. Растворимость газов в воде прямо пропорциональна давлению. При высоком давлении газы растворяются в воде лучше. Это можно обнаружить и при откупорке бутылок с минеральной водой с растворенным в ней под давлением углекислым газом. В этот момент углекислый газ, в большом количестве растворенный в воде под высоким давлением, мгновенно отделяется от раствора и улетучивается.
Методы выражения концентрации растворов
Масса или количество вещества, растворенного в определенном объеме (или массе) раствора, называется его концентрацией. Концентрация определяется различными методами.
Массовая доля растворенного вещества. Отношение массы растворенного вещества к массе раствора называют массовой долей растворенного вещества. Ее обозначают буквой 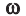 (омега). Если обозначить массу растворенного вещества
(омега). Если обозначить массу растворенного вещества 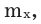 а массу раствора —
а массу раствора — 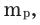 то массовую долю растворенного вещества можно вычислить по следующей формуле:
то массовую долю растворенного вещества можно вычислить по следующей формуле:
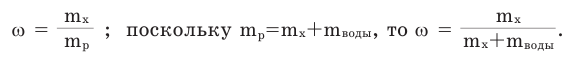
Массовая доля растворенного вещества получает значение в пределах 0-1. Если полученное частное от деления умножить на 100, то массовая доля будет выражена в процентах:
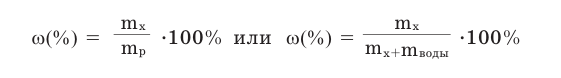
Поскольку 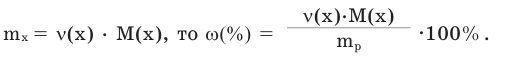
Так как 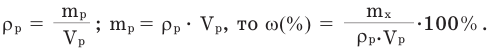
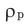 — плотность раствора,
— плотность раствора, 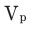 — объем раствора, который всегда измеряется в мл. С увеличением концентрации увеличивается и плотность растворов.
— объем раствора, который всегда измеряется в мл. С увеличением концентрации увеличивается и плотность растворов.
Количество вещества (в граммах), растворенного в 100 граммах раствора, называется процентной концентрацией раствора. Например, 20%-ный раствор означает, что в 100 г раствора содержится 20 г растворенного вещества, 100-20=80 г растворителя. Поскольку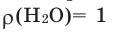 г/мл, то
г/мл, то 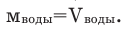
Процентная концентрация раствора выражается величиной от 0-100%.
При добавлении воды в раствор любого вещества концентрация раствора уменьшается. Концентрация полученного раствора вычисляется по следующей формуле:
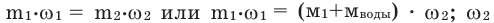 - концентрация полученного раствора.
- концентрация полученного раствора.
Массовое соотношение между тем или иным раствором и добавленной к нему водой составляет 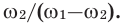
При выпаривании воды из любого раствора концентрация полученного раствора увеличивается. Концентрация конечного раствора вычисляется по формуле: 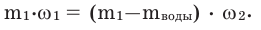
При нагревании раствора газов растворенный газ выделяется, и концентрация раствора уменьшается. Такая же картина уменьшения концентрации раствора наблюдается при нагревании водного раствора этилового спирта. Это связано с тем, что этиловый спирт имеет меньшую температуру кипения, чем вода, и при нагревании такого раствора, в первую очередь выпаривается спирт. А при нагревании растворов солей, щелочей, 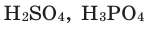 из раствора выделяется вода и концентрация раствора увеличивается.
из раствора выделяется вода и концентрация раствора увеличивается.
Процентная концентрация раствора в насыщенном растворе по коэффициенту растворимости вычисляется по следующей формуле:
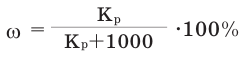
На основе процентной концентрации раствора коэффициент растворимости вычисляется следующим образом:
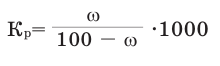
Концентрация конечного раствора при смешивании растворов разной концентрации и разной массы одного и того же вещества вычисляется по следующей формуле: 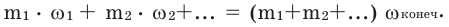 Концентрация конечного раствора при добавлении к любому раствору веществ того же раствора вычисляется по следующей формуле:
Концентрация конечного раствора при добавлении к любому раствору веществ того же раствора вычисляется по следующей формуле: 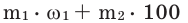
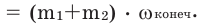
Массовое соотношение смешанных растворов можно определить и методом пакета (перекрещивания).


Если при смешивании какого-либо раствора с водой их массовое соотношение известно, то можно вычислить процентную концентрацию полученного раствора следующим методом. Для этого следует число, относящееся к массовому соотношению начального раствора, умножить на его концентрацию и поделить на сумму чисел в соотношении.
Концентрация конечного раствора при смешивании растворов одного и того же вещества с одинаковой массой и разной концентрацией вычисляется по формуле: 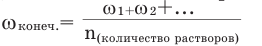
Молярная концентрация
Одной из форм выражения концентрации раствора является также молярная концентрация раствора.
Как известно, в химических реакциях взаимодействуют между собой не массы веществ, а их частицы. К тому же, на практике измеряют не массу растворов, а их объем. При знании количества вещества, растворенного в растворах с одинаковым объемом, легче удается сравнить их концентрацию. Вследствие этого, более удобным считается выражать концентрацию вещества, растворенного в определенном объеме раствора, числом молей в единице объема.
Отношение количества растворенного вещества к объему раствора в литрах называют молярной концентрацией.
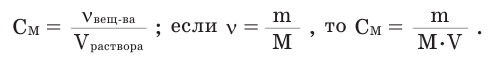
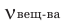 - мольное количество или количество моль растворенного вещества; V - объем раствора, в литрах; М - молярная масса,
- мольное количество или количество моль растворенного вещества; V - объем раствора, в литрах; М - молярная масса,
в г/моль; С - молярная концентрация в моль/л.
Молярная концентрация показывает, сколько молей вещества растворено в 1 л (или 1000 мл) раствора.
Молярная концентрация вместо моль/л часто обозначается буквой М.
Если концентрация раствора равна 1 моль/л, то его называют просто молярным раствором (выражается в виде 1М), а при 0,1 моль/л - децимолярным раствором (0,1 М).
При добавлении в раствор воды молярная концентрация полученного раствора вычисляется следующим образом. Здесь нет необходимости брать объем раствора в литрах:
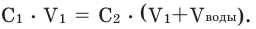
При выпаривании воды из раствора молярная концентрация полученного раствора вычисляется по следующей формуле:
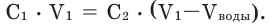
При смешивании растворов одного и того же вещества с одинаковыми объемами и разными концентрациями для вычисления молярной концентрации полученного раствора следует сумму концентраций смешиваемых растворов поделить на количество смешиваемых растворов.
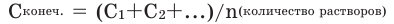
При смешивании растворов одного и того же вещества с разными объемами и разными концентрациями концентрация полученного раствора вычисляется по следующей формуле:
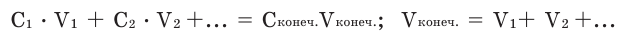
Если плотность раствора известна, то можно молярную концентрацию перевести в процентную концентрацию и наоборот:
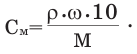
Пакетный метод, относящийся к процентной концентрации, можно применить и к молярной концентрации.
Основные классы неорганических соединений
Ты уже знаешь, что всё, что нас окружает, и мы сами состоим из веществ. Именно вещества являются предметом изучения химии. А их сегодня известно почти 20 млн, и все они имеют определённые свойства. Разумеется, запомнить все их свойства невозможно, да и нет необходимости. Для того чтобы облегчить усвоение сведений о веществах, их классифицируют, устанавливают связи между классами, выявляют общие свойства, характерные для целого класса веществ.
Рассмотри схему «Классификация веществ» (табл. 1, с. 9) и вспомни определение каждого класса и подкласса. Обрати внимание, что в схеме имеются такие подклассы веществ, которые тебе, возможно, пока не встречались, а если отдельные и попадались, то вспомни, по какому поводу, и попытайся составить уравнение реакции, в которой принимает участие или образуется вещество данного подкласса. После этого выполни тренировочные упражнения, их условия приведены далее в тексте.
Классификация — распределение каких-либо объектов по общим признакам с формированием определённой системы классов
Таблица 1. Классификация веществ
Неорганические вещества:
1.Оксиды:
а).Солеобразующие:
- -основные
- -амфотерные
- -кислотные
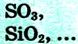
б).Несолеобразующие 
2.Гидроксиды:
а).основания:
- -растворимые
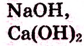
- -нерастворимые
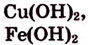
б).амфотерные 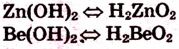
в).кислоты:
- -кислородсодержащие
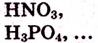
- -бескислородные
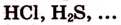
3.Соли:
а).средние 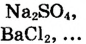
б).кислые 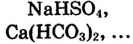
в).основные 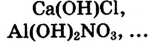
г).двойные 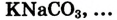
д).комплексные 
4.Вещества:
а).простые:
- -металлы
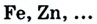
- -неметаллы
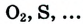
б).сложные:
- -органические вещества
 Менделеев Дмитрий Иванович (1834—1907)
Менделеев Дмитрий Иванович (1834—1907)
Русский химик, разносторонний учёный, педагог, общественный деятель. Работал преподавателем гимназии в Одессе. Профессор Петербургского университета (с 1865). Возглавлял Главную палату мер и весов (с 1893). Сыграл значительную роль в развитии химии и других областей естествознания. Открыл (1869) периодический закон химических элементов — один из основных законов природы.
Периодический закон и периодическая система химических элементов
Периодический закон был открыт Д. И. Менделеевым в 1869 году. А знаешь ли ты, почему именно Д. И. Менделееву удалось открыть периодический закон, а не его предшественникам, например JIo-тару Мейеру? Ведь JI. Мейер был на правильном пути. Из известных в то время 63 элементов он сумел расположить 27 по возрастанию их атомных масс, сгруппировать подобные по валентности элементы и опубликовать таблицу. А Д. И. Менделеев сравнивал между собой не только подобные по свойствам элементы, но и непохожие, при выборе места для элемента обращал внимание на его химические свойства. В итоге, Д. И. Менделеев расположил все известные тогда 63 элемента, оставив свободные клеточки для ещё неизвестных элементов и достаточно точно спрогнозировав их свойства. Почему открытие периодического закона считают гениальным? В то время представления о молекулах и атомах только формировались в науке. Атом считали неделимой частицей, о его внутреннем строении не могло быть и речи. Созданная Д. И. Менделеевым периодическая система сама была основой для изучения строения атома и в настоящее время служит для открытия новых трансурановых элементов, то есть расположенных в периодической системе после урана. Если это открытие — гениально, то почему формулировка периодического закона Менделеевым изменилась? Д. И. Менделеев
Свойства элементов, а также образованных ими простых и сложных веществ находятся в периодической зависимости от заряда ядра их атомов
открыв периодическии закон и создав на его основе периодическую систему химических элементов, показал, что свойства элементов и их соединений изменяются периодически. Но уровень тогдашних знаний не давал возможности выяснить причины периодичности. Уже после смерти Д. И. Менделеева учёные узнали, что атом, который считали своеобразным «кирпичиком» Вселенной, оказался сложной микрочастицей, состоящей из ядра и электронов.
Свойства элементов и их соединений изменяются периодически.
Атом состоит из ядра и электронов
Атомный номер (протонное число) показывает число протонов в ядре и число электронов в атоме
Итак, существует связь периодического закона и периодической системы химических элементов с современными представлениями о строении атома:
1. Порядковый номер элемента соответствует заряду ядра, показывает число протонов в ядре, поэтому называется теперь протонным числом, или атомным номером. Поскольку атом — электронейтральная частица, то протонное число показывает также количество электронов в атоме.
2. Номер периода в периодической системе соответствует числу электронных оболочек в атоме (или энергетических уровней).
3. Номер группы для элементов главных подгрупп означает: а) число электронов, находящихся на внешней электрон-
Причина периодического изменения свойств химических элементов заключается в периодическом изменении и повторяемости внешних электронных оболочек атомов ной оболочке, то есть число валентных электронов, участвующих в химическом взаимодействии; б) высшую положительную степень окисления элемента в высшем оксиде и гидрате оксида (в кислоте или основании).
4. У элементов побочных подгрупп III — VII групп число валентных электронов также соответствует номеру группы, но размещаются они не только на внешнем, но и на предпоследнем электронном слое.
Связь между строением атомов химических элементов и свойствами образованных ими простых и сложных веществ показана в таблице 2 (с. 15). Существует множество вариантов изображения периодической системы химических элементов и не только в виде таблицы. Из табличных вариантов наиболее распространены короткая и длинная формы.
Итак, периодическая повторяемость строения внешних электронных оболочек (энергетических уровней) атомов является причиной периодического изменения свойств химических элементов. В этом заключается физическая сущность периодического закона, и она не зависит от формы представления периодической системы химических элементов.
Таблица 2. Связь между строением атомов элементов и свойствами веществ
| Характеристика элементов и образованных ими веществ | Группы элементов | |||||||
 |
 |
 |
 |
 |
 |
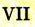 |
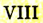 |
|
| Символ элемента | 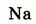 |
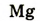 |
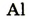 |
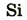 |
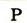 |
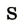 |
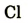 |
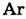 |
|
Протонное число(заряд ядра атома) |
+11 | +12 | +13 | +14 | +15 | +16 | +17 | +18 |
| Размещение электронов в атоме | 2,8,1 | 2,8,2 | 2,8,3 | 2,8,4 | 2,8,5 | 2,8,6 | 2,8,7 | 2,8,8 |
| Валентные электроны | 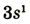 |
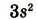 |
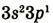 |
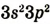 |
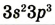 |
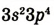 |
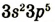 |
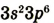 |
| Схема строения внешнего электронного слоя | 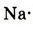 |
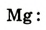 |
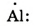 |
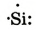 |
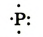 |
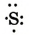 |
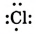 |
 |
| Свойства простого вещества |
Ме- талл |
Металл | Металл |
Неме- талл |
Неме- талл |
Неме- талл |
Неметалл |
Iнертный газ |
| Высшая степень окисления | +1 | +2 | +3 | +4 | +5 | +6 | +7 | - |
| Формулы высшего оксида и высшего гидрата оксида | 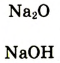 |
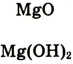 |
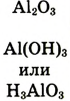 |
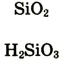 |
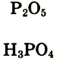 |
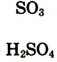 |
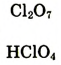 |
- - |
| Свойства оксида и гидрата оксида | Осн. | Осн. | Амф. | Кисл. | Кисл. | Кисл. | Кисл. | - |
| Низшая степень окисления элемента | - | - | - | -4 | -3 | -2 | -1 | - |
| Формула летучего соединения с водородом | - | - | - | 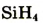 |
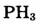 |
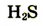 |
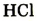 |
- |
Химическая связь
Электронная теория строения атомов объясняет, как атомы удерживаются в молекуле либо кристалле. И ты уже знаешь, что атомы химических элементов, входящие в состав простых или сложных веществ, удерживаются относительно друг друга благодаря химическим связям.
Химическая связь — это взаимодействие атомов, обусловливающее устойчивость молекулы или кристалла как единого целого.
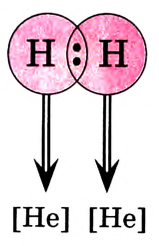
Химическая связь возникает при взаимодействии положительно заряженных ядер атомов и отрицательно заряженных электронов. Вспомни два способа образования химической связи. Первый — при переходе одного или нескольких электронов от одного атома к другому, в результате у обоих атомов возникает устойчивая октетная оболочка (из 8 электронов) и положительно и отрицательно заряженные ионы, взаимодействующие между собой. Например, натрий взаимо- действует с хлором:
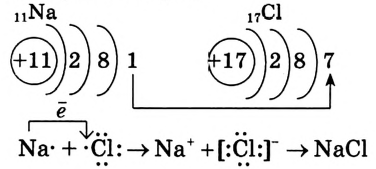

e -'
1-q,..
Na- + -Cl:-> Na+ +[:C1:]" NaCl
Что же произошло?
1. Атом натрия потерял 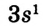 электрон и превратился в положительно заряженный ион со стабильной конфигурацией ближайшего инертного газа неона.
электрон и превратился в положительно заряженный ион со стабильной конфигурацией ближайшего инертного газа неона.
2. Атом хлора присоединил этот электрон на свою Зр-орбиталь и превратился в отрицательно заряженный ион со стабильной конфигурацией ближайшего инертного газа аргона.
3. Разноименно заряженные ионы натрия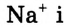 хлора
хлора  взаимно притягиваются и образуют формульную единицу NaCl. Но обрати внимание, молекулы хлорида натрия существуют только в парообразном состоянии.
взаимно притягиваются и образуют формульную единицу NaCl. Но обрати внимание, молекулы хлорида натрия существуют только в парообразном состоянии.
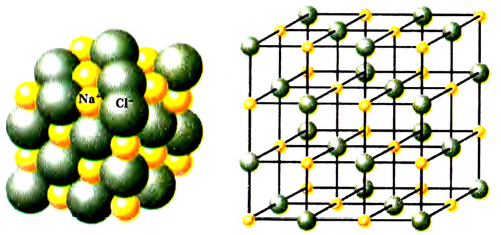
Рис. 1. Схема изображения кристаллических решёток хлорида натрия
В твёрдом состоянии (кристаллическом) все ионные соединения состоят из упорядоченно расположенных положительно и отрицательно заряженных ионов. Молекулы при этом отсутствуют. Формулы, которые обычно относят к ионным соединениям (NaCl, отображают только соотношение положительно и отрицательно заряженных ионов в кристалле.
отображают только соотношение положительно и отрицательно заряженных ионов в кристалле.
Второй способ — посредством обобществления электронов. От каждого атома, который участвует в образовании химической связи, по одному электрону идёт на образование общей электронной пары. Например:
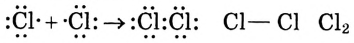
При использовании первого способа образуется ионная связь, а второго — ковалентная. Если возникает химическая связь между атомами неметаллов одного вида, то это — неполярная ковалентная связь, а если между атомами неметаллов разных видов — полярная ковалентная связь. Это объясняется тем, что атомы разных элементов имеют разную электроотрицательность, а общая электронная пара смещается к атому с большей электроотрицательностью. Например: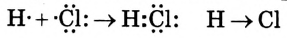
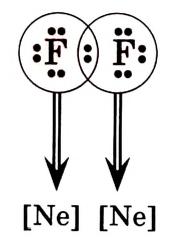
При образовании молекул может возникнуть несколько общих электронных пар. Рассмотри, например, электронную схему образования молекулы азота 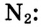
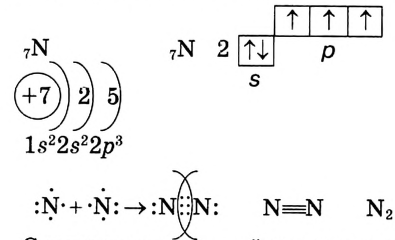
Следовательно, тройная связь между атомами азота в молекуле азота 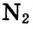 образовалась в результате обобществления трёх неспаренных электронов каждого атома.
образовалась в результате обобществления трёх неспаренных электронов каждого атома.
Возможно ли, что число химических связей, образованных атомом в соединении, больше числа неспаренных электронов? Да, возможно. Например, в атоме углерода только два неспаренных электрона на внешней электронной оболочке атома, а в молекуле метана 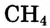 углерод образует четыре химических связи с атомами водорода.
углерод образует четыре химических связи с атомами водорода.
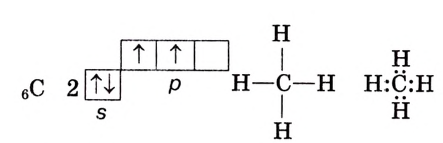
 Углерод Метан
Углерод Метан
Это объясняется тем, что при взаимодействии происходит распаривание  электронной пары.
электронной пары.
Понятие о дисперсных системах и их значение

Рис. 2. Дым — пример дисперсной системы (аэрозоля)
Дисперсные системы: воздух, пища, бумага, кровь, лимфа и др.
Если одно вещество сильно измельчить (раздробить) и равномерно распределить в другом веществе, то образуется дисперсная система. Дисперсные системы окружают нас повсеместно (воздух и пища, бумага, наше тело, кровь, лимфа) и отличаются большим разнообразием. Это объясняется тем, что диспергированные (дроблённые, размельчённые) вещества, их образующие, могут находиться в любом из трёх агрегатных состояний. Дисперсная среда также может быть газообразной, жидкой и твёрдой.
Например, если дисперсная среда газообразная, то дисперсные системы называют аэрозолями. Они состоят из частиц твёрдого вещества либо капелек жидкости, которые во взвешенном состоянии находятся в газообразной среде. К аэрозолям относятся туман, дым, пыль и т. д. (рис. 2). В виде аэрозолей сжигают жидкое и порошкообразное топливо, наносят лакокрасочные покрытия, используют пестициды, лекарственные препараты, продукты бытовой химии, парфюмерию (рис. 3).

Рис. 3. Парфюмерная продукция в аэрозольной упаковке
Наибольшее практическое значение имеют дисперсные системы, средой которых является вода. В зависимости от размеров частиц разделяют на три группы:
- — истинные растворы (просто растворы);
- — коллоидные растворы (золи);
- — грубодисперсные системы, или взвеси (суспензии, эмульсии).
Суспензии образуются, если диспергированное вещество находится в твёрдом состоянии, а эмульсии — если в жидком (рис. 4). Например, если добавить в воду сильно размельчённый мел, то образуется мутная смесь, которая очень медленно отстаивается. Это суспензия.

Рис. 4. Молоко — пример эмульсии
Примером эмульсии может быть молоко, где размельчённым веществом являются капельки жира. Образование эмульсии имеет определённое физиологическое значение, поскольку жир в виде эмульсии легче усваивается организмом. Этим объясняется эмульгирующая функция жёлчи, которую выделяет печень.
Суспензии и эмульсии при хранении быстро расслаиваются. В отличие от них коллоидные растворы более стойкие. Наиболее устойчивы среди дисперсных систем истинные растворы, в которых диспергированное вещество размельчено до молекул или ионов.
Таблица 3. Дисперсные системы
| Характерный признак | Истинные растворы | Коллоидные растворы | Суспензии, эмульсии |
| Вид дисперсной системы | Молекулярно или ионно-дисперсная | Коллоидно-дисперсная | Грубодисперсная |
| Размер частиц | До 1 нм | От 1 до 500 нм | Более 500 нм |
| Пример дисперсной системы | Раствор соли или сахара в воде | Раствор белка куриного яйца в воде | Смесь мела или растительного масла с водой |
| Внешний вид системы | Прозрачная | Прозрачная | Мутная |
| Видимость частиц | Частицы нельзя обнаружить оптическим способом | Частицы можно обнаружить, используя ультрамикроскоп | Частицы можно обнаружить визуально (невооружённым глазом) |
| Способность задерживаться бумажным фильтром | Частицы проникают через фильтр | Частицы задерживает фильтр | |
Дисперсные системы широко распространены в природе. Это горные породы, почвы, атмосферные и гидросферные осадки, растительные и животные ткани.
Среди разных типов дисперсных систем в химии наибольшее значение имеют коллоидные и истинные растворы.
Рис. 5. Горная порода
Выводы:
- Дисперсными называют такие физико-химические системы, в которых диспергированное (размельчённое, раздроблённое) вещество находится в виде мельчайших частиц в другом веществе (дисперсной среде).
- По размерам частиц диспергированного вещества дисперсные системы разделяют на истинные (до 1 им) и коллоидные (от 1 до 500 им) растворы, взвеси-суспензии и эмульсии (более 500 им). Дисперсные системы широко распространены в природе.
Понятие о коллоидных растворах
Коллоидные растворы (коллоиды ) — это высокодисперсные системы, состоящие из очень мелких (от 1 до 500 нм) частиц вещества (дисперсная фаза), зависших в другом веществе (дисперсной среде). По размерам частиц коллоидные растворы занимают промежуточное

Рис. 6. Пенопласт, кухонные губки — примеры коллоидных систем
место между суспензиями, эмульсиями и истинными растворами. Коллоидное состояние вещества — универсально, поскольку при определённых условиях в него могут переходить любая жидкость или твёрдое вещество. Многие минералы, природные воды, вирусы, мышечные и нервные клетки, головной мозг, кровь — это коллоидные системы. Их изучает коллоидная химия (рис. 6).
Коллоидные системы, дисперсионная среда которых — жидкость, называют коллоидными растворами.
Приготовим коллоидный раствор гид-роксида железа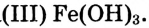
Опыт 1. В колбе на 250 мл нагреем до кипения дистиллированную воду объёмом 100 мл. Когда вода закипит, отставим горелку и добавим в воду каплями 10 мл раствора хлорида железа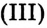 (раствор
(раствор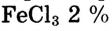 -ный). Постепенно раствор окрашивается, и уже после добавления 10—12 капель приобретает цвет крепкого чая. Цвет обусловлен образованием коллоидного раствора гидроксида железа
-ный). Постепенно раствор окрашивается, и уже после добавления 10—12 капель приобретает цвет крепкого чая. Цвет обусловлен образованием коллоидного раствора гидроксида железа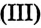
 Что же происходит?
Что же происходит?
При данных условиях соль  взаимодействует с водой по уравнению:
взаимодействует с водой по уравнению:
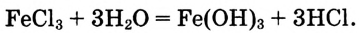
Микрокристаллики малорастворимого гидроксида железа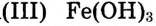 поглощают из раствора отрицательно заряженные ионы хлора и сами становятся отрицательно заряженными. Образовавшиеся отрицательно заряженные частицы отталкиваются от себе подобных, но притягивают положительно заряженные ионы из раствора, образуя слой вокруг этой частицы.
поглощают из раствора отрицательно заряженные ионы хлора и сами становятся отрицательно заряженными. Образовавшиеся отрицательно заряженные частицы отталкиваются от себе подобных, но притягивают положительно заряженные ионы из раствора, образуя слой вокруг этой частицы.
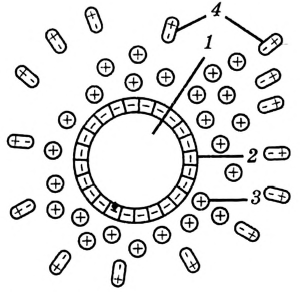
Рис. 7. Схема строения коллоидной частицы: 1 — нерастворимое ядро; 2 — поглощённые отрицательно заряженные ионы; 3 — положительно заряженные ионы; 4 — гидратная оболочка
Появляется ещё одна оболочка, уже из молекул воды. Вся эта сложная система называется коллоидной частицей (рис. 7).
Распознавание коллоидов
Коллоидный раствор легко отличить от истинного. Если в тёмном помещении пропускать через коллоидный раствор узкий пучок света, то наблюдается свечение.
Опыт 2. Собираем прибор (рис. 8). Полученный ранее коллоидный раствор гидроксида железа помещаем в один стакан, а в другой — истинный раствор. Включаем свет и наблюдаем рассеяние света коллоидными частицами и свечение вдоль всего пути прохождения светового луча.
помещаем в один стакан, а в другой — истинный раствор. Включаем свет и наблюдаем рассеяние света коллоидными частицами и свечение вдоль всего пути прохождения светового луча.
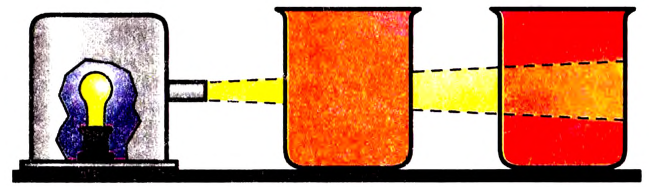
Источник света Истинный раствор Коллоидный раствор
Рис. 8. Конус Тиндаля в коллоидном растворе
В стакане с истинным раствором путь света мы не увидим. Частицы истинных растворов (молекулы, ионы) очень малы, чтобы рассеивать свет, а коллоидные частицы достаточно крупные, именно они рассеивают свет. Это явление открыл ученик М. Фарадея — английский химик Джон Тиндаль (1868). В его честь явление назвали эффектом Тиндаля (рис. 8).
Коагуляция коллоидов
Коллоидные частицы могут поглощать на свою поверхность как положительно, так и отрицательно заряженные ионы, но сами они всегда заряжены одноимённо. Собственно, это и мешает им слипаться и увеличиваться, что определяет прочность коллоидных растворов. Некоторые из них могут сохраняться годами, но постепенно «стареют» и разрушаются. Этим они отличаются от истинных растворов, которые могут сохраняться бесконечно долго. Разрушению коллоидных растворов способствует осаждение частиц под действием силы гравитации. В мелкодисперсных системах разрушению коллоидов препятствует броуновское движение (рис. 9). С повышением температуры оно усиливается, и устойчивость коллоидной системы увеличивается.
Рис. 9. Броуновское движение коллоидных частиц
Коагуляция — слипание частиц коллоида и выпадение в осадок
Одновременно при увеличении скорости движения частиц при нагревании они сталкиваются чаще, их заряд уменьшается, поскольку происходит удаление поглощённых молекул и ионов с поверхности коллоидных частиц. Это сопровождается потерей зарядов, слипанием частиц, скоплением их в крупные агрегаты и выпадением в осадок. Такой процесс называется коагуляцией. Её можно ускорить добавлением растворов кислот, солей и некоторых органических соединений.
Вещества, вызывающие коагуляцию коллоидов, называются коагулянтами.
Коагулянтом может быть другой коллоидный раствор, если заряды его частиц противоположные. Это используют для очистки питьевой, воды. В природной воде всегда содержится много коллоидов, в особенности частиц глины, от которых трудно избавиться, поскольку они легко проходят сквозь фильтр. В воду добавляют сульфат алюминия 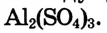 Положительно заряженные ионы алюминия осаждают отрицательно заряженные коллоидные частицы в природной воде.
Положительно заряженные ионы алюминия осаждают отрицательно заряженные коллоидные частицы в природной воде.
 коагулянт
коагулянт
Значение коллоидных растворов
Коллоиды играют очень большую роль в биологии и медицине, в почвоведении и технике. Цитоплазма клеток растительных и животных организмов — сложный коллоид. Большинство физиологических процессов тесно связано с коллоидными растворами. Перевариванию пищи, например, предшествует её переход в коллоидное состояние. Многие продукты питания являются коллоидами — молоко, какао, яйца, майонез, желе, мармелад, пастила, студень.
Такие физиологические жидкости, как кровь, лимфа, спинномозговая жидкость, — также коллоидные растворы, вещества (белки, гликоген, холестерин) в их составе находятся в коллоидном состоянии. Все эти вещества в крови стабилизируются белками (коллоидная защита). Если уровень подобной защиты снижается, то человек начинает болеть: откладываются холестерин и соли кальция на стенках сосудов (атеросклероз), в суставах — соли мочевой кислоты (подагра), образуются камни в почках и жёлчном пузыре и т. д.
Коллоидные системы распространены и в быту (моющие средства, клеи, зубные пасты и пр). Широко используются аэрозольные баллончики с разными средствами бытовой химии и автокосметики — для чистки одежды и ковров, выведения пятен, борьбы с бытовыми насекомыми и грызунами, различные антистатики, полироли, краски (рис. 10, 11).

Рис. 10. Жидкий крем, зубная паста — коллоидные системы

Рис. 11. Антистатики — коллоидные системы
Всевозможные коллоидные системы, преимущественно аэрозоли, нашли применение и в промышленности. В таких отраслях, как мыловаренная, маргариновая, фармацевтическая, парфюмерная, производство пластмасс, искусственного волокна, каучука и многих других, коллоиды изготовляют специально, поскольку часто это сырьё, например, для резиновой, бумажной, кондитерской, текстильной промышленности. В аэрозольной форме сжигают топливо. Аэрозольное состояние используют для получения пигментов, наполнителей, катализаторов и т. д. Аэрозоли используют в медицине, ветеринарии и сельском хозяйстве. Они играют большую роль и в атмосферных процессах. Если заряженные частицы аэрозолей перемещаются в воздухе, который является изолятором, то их движение сопровождается исчезновением заряда частиц аэрозолей, что также вызывает молнию и гром (рис. 12).

Рис. 12. Молния
В технике образование аэрозолей процесс нежелательный, поскольку загрязняется атмосфера. Над промышленными центрами возникают сложные аэрозоли, когда огромные массы дыма смешиваются с атмосферным туманом и пылью. При этом образуется смог, борьба с которым — актуальная экологическая проблема.
Большую опасность представляют собой аэрозоли из муки, сахарной или угольной пыли, порошковых металлов (в частности, магния), поскольку очень взрывоопасны.
Выводы:
- Коллоидные растворы — это физико-химические системы, содержащие нерастворимое измельчённое вещество, размеры частиц которого составляют от 1 до 500 нм.
- Коллоид — это состояние, в котором может находиться большая часть веществ.
- Коллоидный раствор можно определить с помощью эффекта Тин-даля.
- Разрушение коллоидных растворов связано с потерей зарядов коллоидными частицами, в результате они слипаются и выпадают в осадок. Происходит коагуляция коллоида. Коагулянтами могут быть растворы кислот, солей и т. д.
- Коллоиды окружают нас повсеместно. Однако они могут иметь как положительное, так и отрицательное значение.
Понятие об истинных растворах
Химические соединения в индивидуальном состоянии практически не существуют в природе. Они образуют смеси. Да и в быту нас преимущественно окружают смеси веществ, в частности в виде водных растворов.
Процессы растворения и сами растворы имеют огромное значение в органической и неорганической (минеральной) жизни Земли, в науке и технике. Вода, так широко распространённая в природе, — моря, океаны, реки, озёра, грунтовые воды, — всегда содержит растворённые вещества.

Рис. 13. Напиток «Живчик» — это смесь воды, фруктового сока и других веществ (водный раствор)
В первобытном океане (в период возникновения жизни на Земле) массовая доля растворённых солей составляла около 1 %. «Именно в таком растворе впервые появились живые организмы, из этого раствора они получили ионы и молекулы, необходимые для их развития и жизни. С течением времени живые организмы эволюционировали, что дало им возможность покинуть водную среду и перейти на сушу или подняться в воздух. Они приобрели эту способность благодаря сохранению в своих организмах водного раствора в виде жидкой составляющей тканей, плазмы крови и межклеточной жидкости, содержащих необходимый запас ионов и молекул», — так оценивает значение растворов американский химик Лайнус Полинг.

Рис. 14. Кофе (водный раствор) — смесь воды, кофеина и других веществ
Рис. 15. Материал, из которого изготовлена монета(твёрдый раствор), — это смесь меди, никеля и алюминия
Действительно, внутри нас, в каждой клеточке воспоминание о первобытном океане, в котором зарождалась жизнь,— раствор, в котором массовая доля солей достигает 0,9 %. Это наша кровь, лимфа и другие жизненно важные физиологические жидкости организма.
Растворы сопровождают нас всюду, и не только водные. Воздух — это взаимное растворение газов; чугун и сталь — твёрдые растворы железа и углерода. Но наиболее распространёнными являются водные растворы. Усвоение пищи связано с растворением питательных веществ. И растения усваивают необходимые для их роста и развития вещества только в виде растворов. Сок растений — это также раствор. Обычная питьевая вода представляет собой раствор и твёрдых солей, и газов (рис. 16).
Рис. 16. Питьевая вода — смесь воды, солей и газов
Растворы играют большую роль во многих отраслях промышленности: в текстильной промышленности применяют растворы солей, кислот, красителей, металлообрабатывающей — растворы кислот (для удаления с поверхности металлов окалины и ржавчины), а в фармацевтической — растворами являются многие лекарства. Использование неводных растворов связано с полимерами, красителями, лаками и др. Вся промышленность синтетических волокон и пластмасс использует растворы. Химические, биологические и физические исследования часто проводят с применением растворов. Что же такое раствор?
2 "Химия", 9кл
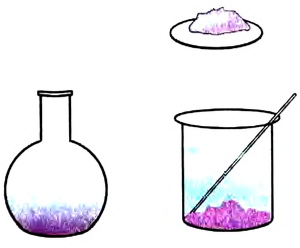
Рис. 17. Растворение медного купороса
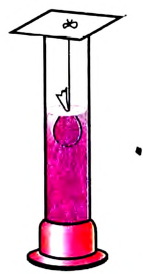
Рис. 18. Растворение перманганата калия
Раствор. Начинаем с демонстрации опытов.
Опыт 1. На дно химического стакана с водой кладём кристаллы медного купороса 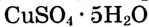 синего цвета (рис. 17). Очень быстро возле горки кристаллов жидкость приобретает голубой цвет — образуется раствор медного купороса в воде. Благодаря диффузии постепенно окрашивается вся жидкость. Этот процесс протекает медленно, поскольку скорость диффузии небольшая.
синего цвета (рис. 17). Очень быстро возле горки кристаллов жидкость приобретает голубой цвет — образуется раствор медного купороса в воде. Благодаря диффузии постепенно окрашивается вся жидкость. Этот процесс протекает медленно, поскольку скорость диффузии небольшая.
Процесс образования однородного раствора можно ускорить.
Опыт 2. В цилиндр наливаем воду (3/4 его ёмкости). В мешочек из марли насыпаем кристаллы перманганата калия 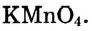 Привязываем его к нитке и опускаем в цилиндр так, чтобы мешочек оставался у поверхности жидкости (рис. 18).
Привязываем его к нитке и опускаем в цилиндр так, чтобы мешочек оставался у поверхности жидкости (рис. 18).
Почему, по твоему мнению, струйки раствора, образующиеся вокруг кристаллов, опускаются вниз? Потому что плотность полученного раствора больше, чем плотность воды. Струйки раствора опускаются, жидкость перемешивается, и раствор становится однородным. Понятно, что обычное перемешивание также ускоряет образование однородного раствора. Вспомни, как ты перемешиваешь в стакане чай, положив в него сахар.
Следовательно, если частицы одного вещества малых размеров распределяются между частицами другого вещества, то получаем однородную систему — раствор. Минеральные воды: Миргородская, Трускавецкая, Нафтуся, Свалява и др.— это растворы солей в воде (рис. 19). Характерная особенность растворов — их однородность.

Рис. 19. Минеральные воды
Растворы бывают бесцветные и окрашенные, но отдельные частицы растворённого вещества в них не видны, так как они микроскопические (менее 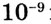 м). Это означает, что вещества в растворе сильно измельчённые — до молекул, атомов или ионов.
м). Это означает, что вещества в растворе сильно измельчённые — до молекул, атомов или ионов.
Раствор содержит не менее двух компонентов, один из них — растворённое вещество, а другой — растворитель (рис. 20).
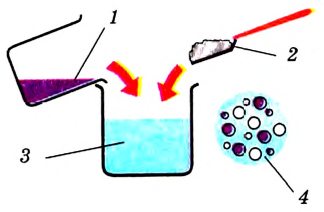
Рис. 20. Компоненты (составляющие) раствора: 1 — растворитель;2 — растворяемое вещество; 3 — раствор; 4 — частицы растворяемого вещества и растворителя равномерно распределены
Растворитель — это компонент раствора, находящийся в том же агрегатном состоянии, что и раствор.
Например, при смешивании сахара (твёрдое вещество) и воды (жидкость) получаем жидкий раствор, где вода — растворитель, а сахар — растворённое вещество. Если вещества находятся в одинаковых агрегатных состояниях, как, скажем, спирт (жидкость) и вода (жидкость), то растворителем является тот компонент, которого в системе больше.
Растворяемое вещество может находиться в любом агрегатном состоянии. В воде можно растворить соль, а молено — и углекислый газ. В обоих случаях образуются однородные системы — растворы. Кроме того, раствор может содержать не одно, а несколько веществ. Типичным примером такого раствора является морская вода. Следовательно,
Раствор — это однородная система переменного состава, содержащая два или несколько компонентов.
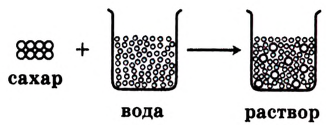
Рис. 21. Схема растворения сахара в воде
Сущность процесса растворения
Ты уже знаешь, если поваренную соль или сахар поместить в воду, то масса твёрдого вещества постепенно уменьшается, — происходит его растворение, то есть молекулы воды разрушают кристаллы растворяемого вещества. Разрушение происходит на поверхности взаимодействия кристалла с водой. Чем больше площадь этой поверхности, тем быстрее разрушается кристалл. Происходит самопроизвольное распределение частиц одного вещества между частицами другого вещества в результате диффузии (рис. 21), что приводит к образованию раствора (физическая теория растворов). Для улучшения контакта вещества с растворителем увеличивают площадь поверхности их взаимодействия. Для этого вещества измельчают и перемешивают.
Впрочем, раствор нельзя рассматривать только с точки зрения физической теории. Ещё Д. И. Менделеев доказал, что при растворении вещества происходят также химические процессы (химическая теория растворов). Это подтверждает тот факт, что объём раствора обычно не равен сумме объёмов растворителя и растворяемого вещества. Есть и другие факты, подтверждающие это. Проведём следующие опыты.
Опыт 3. В стакан с холодной водой помещаем кристаллы аммиачной селитры 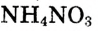 и ставим стакан на влажную дощечку (или картон). Она примерзает к стакану, поскольку температура раствора падает ниже О °С (рис. 22). Следовательно, растворение селитры сопровождается поглощением теплоты. Происходит эндотермический процесс, то есть поглощающий теплоту.
и ставим стакан на влажную дощечку (или картон). Она примерзает к стакану, поскольку температура раствора падает ниже О °С (рис. 22). Следовательно, растворение селитры сопровождается поглощением теплоты. Происходит эндотермический процесс, то есть поглощающий теплоту.
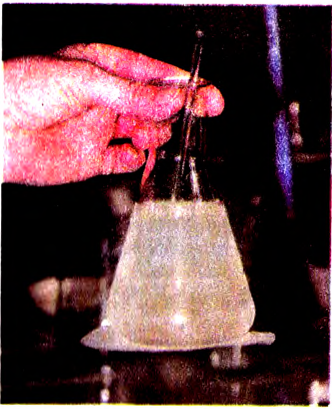
Рис. 22. Поглощение теплоты при растворении 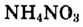 в воде
в воде
Опыт 4. В стакан с водой наливаем концентрированную серную кислоту 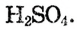 Раствор разогревается настолько, что может даже закипеть (рис. 23). Следовательно, растворение в воде серной кислоты сопровождается выделением теплоты (экзотермический процесс).
Раствор разогревается настолько, что может даже закипеть (рис. 23). Следовательно, растворение в воде серной кислоты сопровождается выделением теплоты (экзотермический процесс).
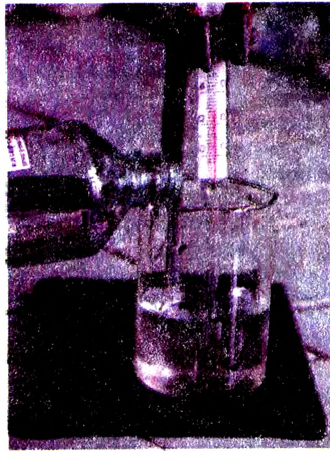
Рис. 23. Выделение теплоты при растворении 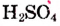 в воде
в воде
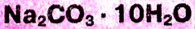 -Кристаллическая сода
-Кристаллическая сода
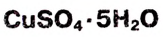

Рис. 24. Раствор медного купороса
Тепловые явления, наблюдавшиеся в ходе этих опытов, также подтверждают, что в процессе растворения веществ происходят не только физические, но и химические процессы. Рассмотрим их.
Понятие о кристаллогидратах
Растворение большинства кристаллических веществ сопровождается поглощением теплоты. Это объясняется затратой значительного количества энергии на разрушение кристаллических решёток вещества. Но одновременно идёт другой процесс — химическое взаимодействие растворяемого вещества с водой, — гидратация, в результате образуются новые соединения — гидраты. При этом теплота высвобождается. Какой из этих процессов доминирует, таким и будет тепловой эффект растворения.
Гидраты — очень нестойкие соединения, они существуют только в растворе. Если из раствора удалить воду, то гидраты легко разрушаются. Но некоторые удерживают воду даже в твёрдом состоянии. Они называются кристаллогидратами, а вода, содержащаяся в кристаллах, — кристаллизационной. Итак, растворение — это сложный физико-химический процесс, при котором происходит взаимодействие между частицами растворённого вещества и растворителя.
Теперь уточним определение раствора.
Раствор — это однородная (гомогенная) система переменного состава, содержащая растворённое вещество, растворитель и продукты их взаимодействия.
Например,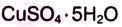 — медный купорос,
— медный купорос, 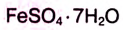 — железный купорос,
— железный купорос, 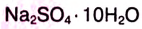 — глауберова соль.
— глауберова соль.
Выводы:
- Растворы имеют большое значение в жизни человека и природы, в науке и технике.
- Процесс растворения имеет сложную природу. Причина перехода твёрдого вещества в раствор — физико-химическое взаимодействие растворителя и растворяемого вещества (одного или нескольких). При растворении разрушаются некоторые существующие и возникают новые химические связи.
- Теплота, поглощаемая при растворении, затрачивается как на химический процесс (разрушение кристалла), так и на физический (диффузию частиц вещества по всему объёму раствора). Теплота, высвобождающаяся в процессе растворения, расходуется на образование новых связей (гидратация).
- Раствор — это однородная система переменного состава, состоит из двух или нескольких компонентов.
Растворимость веществ в воде
Ты уже знаешь, что в воде растворяются разные вещества — твёрдые, жидкие и газообразные.
Способность веществ переходить в раствор называется растворимостью.
По растворимости в воде и других растворителях все вещества разделяют на три группы:
- а) хорошо растворимые;
- б) малорастворимые;
- в) практически нерастворимые.
Последние часто называют просто нерастворимыми (см. таблицу растворимости на форзаце). Но в природе не существует абсолютно нерастворимых веществ. Если погрузить в воду стеклянную палочку или кусочек серебра, то они в ничтожно малых количествах растворяются в воде. Поэтому вода после контакта с серебром почти не содержит микробов.
Хорошо растворимые вещества:

Малорастворимые вещества:

Практически нерастворимые вещества:

Стекло, серебро, золото, растительное масло, керосин, угарный газ — это практически нерастворимые в воде вещества, а малорастворимые — гипс, кислород, азот. Многие вещества растворяются в воде очень хорошо, например сахар, спирт, едкий натр, серная и азотная кислоты. Следовательно, растворимость прежде всего зависит от природы вещества.
Хорошо растворяются подобные по свойствам вещества (эмпирическое правило «подобное растворяется в подобном»). В частности, вещества, состоящие из полярных молекул, и с ионным типом химической связи хорошо растворяются в полярных растворителях (воде, спирте, жидком аммиаке), а неполярные вещества — в неполярных растворителях (бензоле, сероуглероде).
Опыт 1. В химический стакан наливаем 100 мл воды и вносим туда хлорид натрия порциями по 5 г. После каждой порции перемешиваем стеклянной палочкой содержимое стакана до полного растворения соли. Первые 7 порций, то есть 35 г 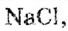 растворяются полностью. Из следующей порции растворяется только 1 г, а 4 г остаются нерастворимыми. Это означает, что при комнатной температуре
растворяются полностью. Из следующей порции растворяется только 1 г, а 4 г остаются нерастворимыми. Это означает, что при комнатной температуре 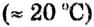 в 100 мл воды могут раствориться 36 г хлорида натрия.
в 100 мл воды могут раствориться 36 г хлорида натрия.
Рис. 25. Насыщенный раствор хромата натрия 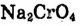
Раствор, в котором данное вещество при определённой температуре больше не растворяется, называется насыщенным. Раствор, в котором данное вещество ещё может растворяться, называется ненасыщенным.
Следовательно, для растворимости веществ имеет значение температура. Но как она влияет? Чтобы ответить на этот вопрос, выполним следующие опыты.
ЛАБОРАТОРНЫЕ ОПЫТЫ:
Опыт 1. В пробирку налей воды на 1/4 объёма. Небольшими порциями вноси нитрат калия и осторожно встряхивай содержимое, чтобы соль полностью растворилась. Внеси следующую порцию соли и т. д. Если растворение соли прекратится, то осторожно нагрей пробирку с раствором и нерастворённым остатком соли. Пробирку регулярно встряхивай. Что наблюдается? Внеси в раствор ещё немного соли. Что происходит?
Опыт 2. Теперь пробирку с горячим раствором соли погрузи в стакан с холодной водой. Что наблюдается? Почему это происходит? Сделай вывод.
Растворимость твёрдых веществ зависит от температуры: с повышением температуры она обычно увеличивается. А растворимость газов, напротив, возрастает с понижением температуры и повышением давления.
Количественной характеристикой растворимости является содержание вещества в насыщенном растворе. Обычно растворимость выражают в граммах на литр (г/л). Рассмотри данный пример.
Пример №1
Какова растворимость йодистого калия в воде при 15 °С, если из насыщенного раствора массой 48 г после его выпаривания выкристаллизовался иодид калия массой 28 г?
Решение. Из условия задачи следует, что в 48 г насыщенного раствора содержится 28 г KI, а остаток составляет вода: 48 - 28 г = 20 г 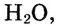 или 0,02 л.
или 0,02 л.
Тогда растворимость KI в воде равна
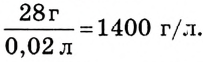
Ответ: растворимость иодида калия при t = 15 °С составляет 1400 г/л.
Зависимость растворимости твёрдых веществ от температуры обычно представляют в виде графика кривых растворимости (рис. 26).
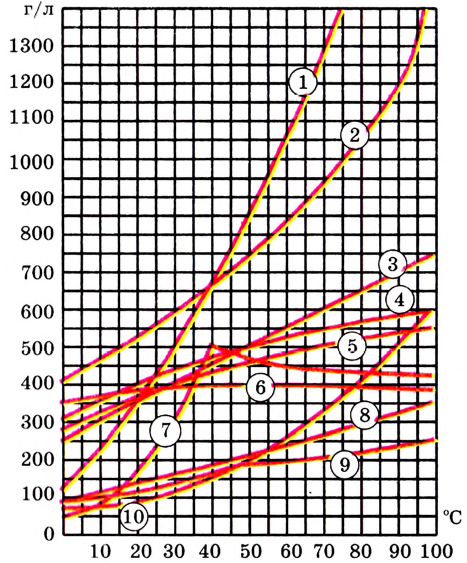
Рис. 26. Кривые растворимости:

Для построения таких кривых на оси абсцисс откладывают температуру, а на оси ординат — растворимость вещества при заданной температуре. График показывает, что с повышением температуры растворимость большинства кристаллических ,с веществ увеличивается, но неодинаково. По рис. 26, при из-90 100 температуры от 0 до 100 °С растворимость нитрата калия возрастает во много раз, а растворимость хлорида натрия — незначительно. У некоторых веществ, например сульфата натрия 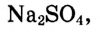 растворимость с повышением температуры до 40 °С возрастает, а затем уменьшается.
растворимость с повышением температуры до 40 °С возрастает, а затем уменьшается.
Как мы убедились, разные вещества растворяются по-разному. У одних растворимость очень большая (при температуре 20 °С в 1 л воды может раствориться сахар массой 2000 г), у других — незначительная (при этих же условиях сульфат кальция 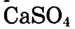 растворяется мало — 2 г/л).
растворяется мало — 2 г/л).

Рис. 27 . Соль добывают из морской воды. Вода испаряется, раствор становится насыщенным, соль кристаллизуется, и её собирают
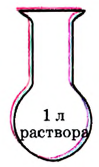
Если в определённом объёме раствора содержится мало растворённого вещества, то такой раствор называют разбавленным, если много — концентрированным. При этом не обязательно, чтобы концентрированный раствор был насыщенным, а разбавленный — ненасыщенным. Если, например, в 1 л раствора содержится 1 кг сахара, то, понятно, что такой раствор — очень концентрированный. Но он ненасыщенный, так как растворимость сахара настолько высока, что он ещё может растворяться. А если в 1 л раствора содержится всего 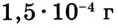 хлорида серебра
хлорида серебра 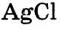 и он больше растворяться не может, то такой раствор из-за плохой растворимости
и он больше растворяться не может, то такой раствор из-за плохой растворимости 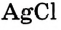 будет уже насыщенным, но сильно разбавленным (рис. 28).
будет уже насыщенным, но сильно разбавленным (рис. 28).
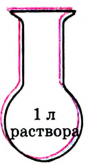
В 1 л раствора 1 кг сахара. Раствор концентрированный, но ненасыщенный.
В 1 л раствора 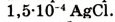 Раствор разбавленный, но насыщенный.
Раствор разбавленный, но насыщенный.
Рис. 28. Концентрированный и разбавленный растворы
Выводы:
- Способность вещества растворяться в определённом растворителе, например в воде, называется растворимостью вещества в этом растворителе.По растворимости вещества разделяют на хорошо растворимые, малорастворимые и практически нерастворимые.
- Растворимость зависит от природы вещества. Вещества с полярным ковалентным и ионным типами химической связи растворяются в полярных растворителях (воде). Неполярные вещества лучше растворяются в неполярных растворителях.
- Растворимость зависит также от температуры. Для подавляющего большинства кристаллических веществ с повышением температуры растворимость увеличивается, а для газов — уменьшается.
- Растворимость вещества вычисляют из соотношения массы вещества, образующей насыщенный раствор при определённой температуре, к объёму растворителя. Выражается растворимость в граммах на литр (г/л).
Вода - полярный растворитель
Тебе необходима иметь представление о: распространении воды в природе; роли воды в живой и неживой природе; техногенном значении воды;
Уметь объяснить: круговорот воды в природе; строение молекулы воды; сущность водородной связи;
Обосновывать: высокую способность воды растворять вещества.
Вода в природе
Вода — наиболее распространённое в природе сложное вещество. Молекулы воды обнаружены в межзвёздном пространстве. Вода входит в состав большинства планет Солнечной системы и их спутников. На Земле вода — одно из наиболее распространённых соединений. Почти 3/4 поверхности Земли покрыто водой — это океаны, моря, реки и озёра (рис. 29). Ты уже знаешь, что в виде снега и льда вода покрывает полярные зоны земного шара. В недрах Земли её, возможно, ещё больше, чем на поверхности, Она насыщает почву и горные породы, входит в состав многих минералов (глины, гипса и др.). Вода — обязательный компонент всех живых организмов. В виде водяного пара значительные массы воды сосредоточены в атмосфере.


Рис. 29. Днепр возле Киева
Из курса природоведения ты уже знаешь, что при изменении атмосферных условий водяной пар в воздухе образует мельчайшие капли воды или кристаллики льда, в результате их скопления формируются облака. Если размеры капель или кристалликов увеличиваются, то они уже не могут оставаться во взвешенном состоянии и выпадают на землю в виде дождя, снега, града. При таянии снега или льда образуются водные потоки. Они сливаются в реки. С поверхности рек, морей, океанов вода испаряется, и опять формируются облака. Итак, вода находится в постоянном движении, непрерывно видоизменяется, в результате осуществляется круговорот воды в природе (рис. 30).
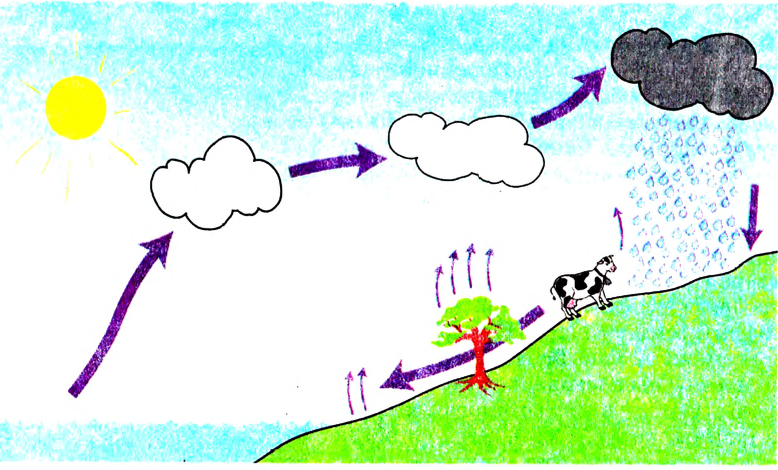
Рис. 30. Круговорот воды в природе
Для выплавки 1 т стали необходимо 300 воды
воды
Вода имеет огромное значение в жизни растений, животных и человека. Согласно современным представлениям колыбелью жизни на Земле был океан.
Для производства 1 т бумаги необходимо 400  воды
воды
Для выращивания 1 т зерна необходимо 1000  воды
воды
Общий объём потребления воды в России 30  в год, что составляет 60 % стока её рек
в год, что составляет 60 % стока её рек
В любом организме вода является средой, где происходят химические процессы, обеспечивающие жизнедеятельность организма. Кроме того, вода принимает непосредственное участие во многих биохимических реакциях.
Вода является очень важным технологическим веществом. Ни одно производство не обходится без использования значительных объёмов воды.
Велика роль воды и в формировании неживой природы на Земле. Вода разрушает горные породы, переносит большие массы вещества по всей планете, формирует осадочные породы. Процессы испарения и конденсации воды регулируют климат на Земле.
Строение молекулы
Вода — вещество молекулярного строения. Молекулу воды можно представить в виде равностороннего треугольника, в вершине которого расположен атом кислорода, а в основе — два протона (рис. 31). Две пары электронов обобществлены между протонами и атомом кислорода, а две пары неразделённых электронов сориентированы на другую сторону кислорода. В молекуле воды имеются две полярные ковалентные связи Н—О.
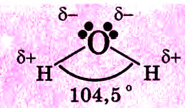
Рис. 31. Схема структуры молекулы воды
Почему они полярные? В результате перекрывания каких орбиталей они образовались? Вспомни расположение электронов в атоме кислорода и атоме водорода, покажи их расположение по энергетическим ячейкам.Следовательно, в молекуле воды атом кислорода имеет четыре электронные пары. Две из них участвуют в образовании ковалентных связей с атомами водорода, то есть являются связующими.
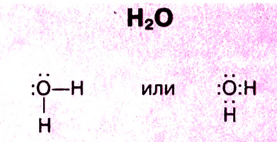
Две другие электронные пары — несвязующими. В молекуле возникают четыре полюса зарядов: два — положительных и два — отрицательных. Положительные заряды сосредоточены возле атомов водорода, поскольку у кислорода электроотрицательность больше, чем у водорода. Два отрицательных полюса приходятся на две несвязующие электронные пары кислорода.

Рис. 32. Огромная плавающая глыба льда — айсберг
Следовательно, молекулы воды полярные, они представляют собой диполь. Молекулы воды имеют угловое строение. Угол между двумя связями Н—О равен 104,5°.
Такое представление о строении молекулы воды даёт возможность объяснить структуру льда. В кристаллических решётках льда каждая молекула  окружена четырьмя такими же молекулами. В плоскостном изображении это можно представить следующим образом:
окружена четырьмя такими же молекулами. В плоскостном изображении это можно представить следующим образом:
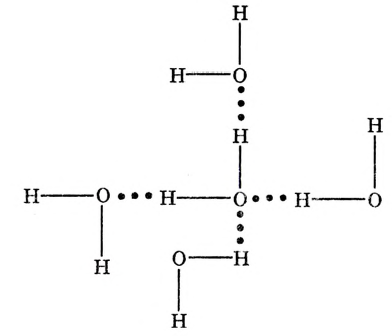
По схеме видим, что связь между молекулами осуществляется посредством атома водорода:
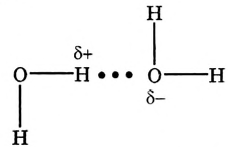
Положительно заряженный атом водорода одной молекулы воды притягивается к отрицательно заряженному атому кислорода другой молекулы воды. Образуется водородная связь (обозначается точками) (рис. 33).
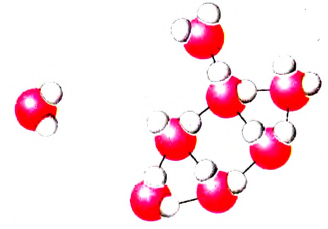
Рис.33.Водородная связь
Химическая связь, возникающая через атом водорода, который оказался между двумя электроотрицательными атомами (преимущественно атомами фтора F, кислорода О, азота N), называется водородной связью. По прочности она слабее, чем ковалентная. Вот почему водородная связь легко разрывается, что наблюдается при испарении воды.
Структура жидкой воды напоминает структуру льда. В жидкой воде молекулы также связаны посредством водородных связей. Именно они обусловили сравнительно высокие температуры плавления и кипения воды. Но структура воды не столь «жёсткая», как у льда. В результате теплового движения молекул в воде одни водородные связи разрываются, другие — образуются.
Вода является прекрасным растворителем многих неорганических и органических веществ. Процессы растворения также обусловливают водородные связи.
Выводы:
- Вода имеет исключительное значение в природе. Без воды невозможна жизнь.
- Вода — вещество молекулярного строения, её молекулы имеют угловую форму, они полярные, представляют собой диполи. Между молекулами воды существует водородная связь.
- Благодаря высокой способности растворять вещества, вода осуществляет на Земле грандиозную работу. В одном месте она разрушает горные породы, растворяет минералы либо вымывает из них растворимые вещества и переносит в растворённом виде на значительные расстояния, а в другом — вода испаряется, и растворённые в ней вещества осаждаются. Так со временем образуются новые минералы и горные породы. Вода определяет климат и погоду в различных регионах земного шара. Пресной воды на Земле мало. Воду надо беречь, охранять природные водоёмы от загрязнения.
Количественный состав раствора
Итак, раствор — это система переменного состава.
От количества растворённого вещества зависят свойства раствора. Поэтому всегда важно знать количественный состав раствора, который выражается в виде концентрации растворённого вещества.
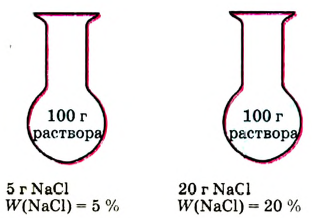
Рис. 34. Растворы с массовой долей растворенного вещества
Концентрация вещества-это физическая величина(размерная или безразмерная),определяющая количественный состав раствора.
Концентрацию вещества можно выразить разными способами.Мы рассмотрим два из них-массовую долю растворенного вещества (безразмерная величина)и молярную концентрацию растворённого вещества(размерная величина).
Массовая доля растворённого вещества — это физическая величина, которая равна отношению массы растворённого вещества к массе раствора.
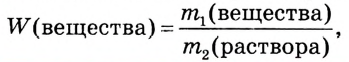
где 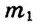 — масса растворённого вещества,
— масса растворённого вещества,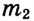 — масса раствора, W (дубль вэ) — массовая доля растворённого вещества.
— масса раствора, W (дубль вэ) — массовая доля растворённого вещества.
Поскольку эта величина — массовая доля — отношение однотипных величин (массы к массе), то формально она не имеет своей единицы, а является безразмерной величиной. Массовую долю растворённого вещества выражают в долях единицы или в процентах (1/100 = 0,01 = 1 %). Например, имеем два раствора хлорида натрия NaCl массой по 100 г каждый. В первом содержится NaCl массой 5 г, во втором — NaCl массой 20 г. Это означает, что в первом растворе массовая доля соли равна 5 г : 100 г = 0,05 (5 %), во втором — 20 г : 100 г = 0,2 (20 %) (рис. 34).
Если массовую долю вычислять не надо, поскольку она известна, тогда что это означает? Например, имеем столовый уксус 9 %-ный. Это значит, что массовая доля уксусной кислоты в растворе составляет 9 %, то есть в каждых 100 г раствора содержатся 9 г уксусной кислоты и 100 г - 9 г = 91 г воды (рис. 35).
Рис. 35. Бутылка столового уксуса (9%)
Массовая доля — удобная характеристика раствора, поскольку легко можно определить массу вещества, растворённого в растворе, и массу растворителя. Именно такие данные необходимы тебе для приготовления растворов.
Рассмотрим конкретные примеры.
Пример №2
Приготовить раствор массой 1 кг с массовой долей растворённого вещества 5 %. Какую массу соответственно соли и воды следует взять?
Дано:
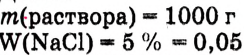
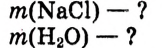
Решение:
Алгоритм приготовления раствора следующий.
1.Вычисли, какую массу соли необходимо взять:
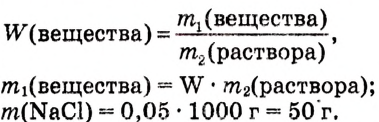
2.Вычисли, какую массу воды необходимо взять: 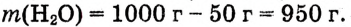
3.Взвесь полученную порцию соли (50 г) и всыпь её в колбу.
4.Отмеряй мерным цилиндром необходимый объём дистиллированной воды (950 мл). Поскольку плотность воды равна 1,0 г/мл, то объём воды 950 мл по массе составляет 950 г. Влей воду в колбу с солью  раствора) и перемешай стеклянной палочкой (или встряхиванием колбы) её содержимое до полного растворения соли (рис. 36).
раствора) и перемешай стеклянной палочкой (или встряхиванием колбы) её содержимое до полного растворения соли (рис. 36).
Рис. 36. Приготовление раствора
Пример №3
В воде массой 100 г при 20 °С растворили нитрат калия 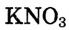 массой 15,6 г. Определи массовую долю нитрата калия в растворе.
массой 15,6 г. Определи массовую долю нитрата калия в растворе.
Дано:
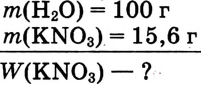
Решение:
Масса раствора состоит из массы растворителя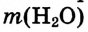 и массы растворённого вещества
и массы растворённого вещества 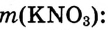 m(раствора) =
m(раствора) = 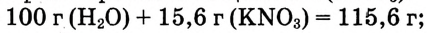
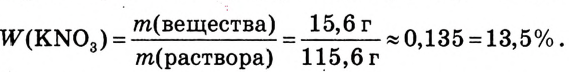
Ответ. Массовая доля нитрата калия 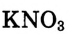 в растворе равна 13,5 %.
в растворе равна 13,5 %.
Пример №4
Определи, какую массу хлорида натрия нужно растворить в воде, чтобы получить раствор объёмом 100  с массовой долей NaCl 20 %. Плотность раствора равна 1,15 г/
с массовой долей NaCl 20 %. Плотность раствора равна 1,15 г/ .
.
Дано:
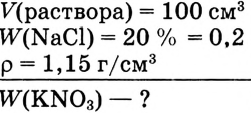
Решение:
Вспомни из курса физики, что плотность раствора (символ 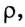 читается «ро») — величина, равная отношению массы раствора к его объёму (см. таблицу в приложении):
читается «ро») — величина, равная отношению массы раствора к его объёму (см. таблицу в приложении):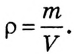
Единица плотности — килограмм на кубический метр  или грамм на кубический сантиметр
или грамм на кубический сантиметр 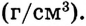 В химии чаще используют грамм на миллилитр (г/мл). Название единицы объёма миллилитр — это специальное название кубического сантиметра
В химии чаще используют грамм на миллилитр (г/мл). Название единицы объёма миллилитр — это специальное название кубического сантиметра 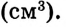
1.Вычисли массу раствора, который необходимо приготовить:
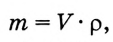 m(раствора) =
m(раствора) = 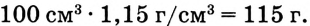
2. Вычисли массу NaCl в растворе:
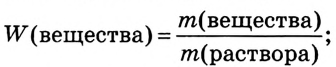
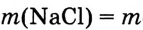 (раствора) • W( вещества);
(раствора) • W( вещества);
m(NaCl) = 115 г • 0,2 = 23 г.
Ответ. Чтобы приготовить раствор объёмом 100  с массовой долей NaCl 20 %, необходимо взять хлорид натрия массой 23 г.
с массовой долей NaCl 20 %, необходимо взять хлорид натрия массой 23 г.
Пример №5
Определи массу глауберовой соли 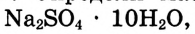 необходимую для приготовления раствора массой 300 г с массовой долей сульфата натрия 8%.
необходимую для приготовления раствора массой 300 г с массовой долей сульфата натрия 8%.
Дано:
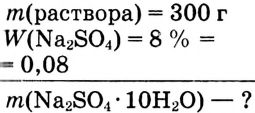
Решение:
1. Вычисли массу безводного сульфата натрия 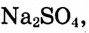 необходимого для приготовления раствора массой 300 г:
необходимого для приготовления раствора массой 300 г:
m(вещества) = m(раствора) • W(вещества); 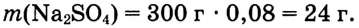 Вариант 1
Вариант 1
2. Вычисли количество вещества 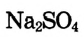 массой 24 г;
массой 24 г;
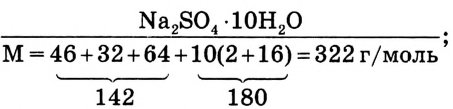
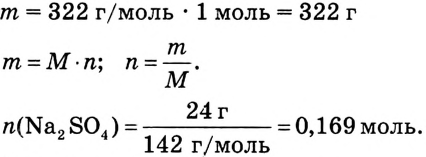
3. Найди массу кристаллогидрата, в котором содержится сульфат натрия количеством вещества 0,169 моль:
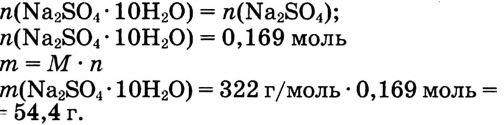
Вариант 2
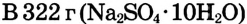 содержится
содержится 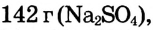
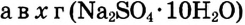 содержится
содержится 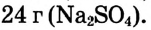
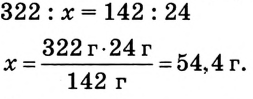
Ответ. Для приготовления раствора массой 300 г с массовой долей сульфата натрия 8 % необходимо взять глауберову соль 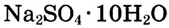 массой 54,4 г.
массой 54,4 г.

Рис. 37. Мерные колбы
Другой способ выражения количественного состава раствора — молярная концентрация.
Молярная концентрация растворённого вещества — физическая величина, равная отношению количества растворённого вещества к объёму раствора
(символ -с, единица — моль/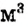 или моль/л).
или моль/л).
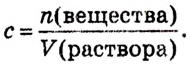
Распространена сокращённая форма записи единицы молярной концентрации М = моль/л. Например, запись 0,1М 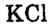 означает, что в каждом литре раствора содержится 0,1 моль
означает, что в каждом литре раствора содержится 0,1 моль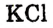 . Такой раствор называют децимолярным.
. Такой раствор называют децимолярным.
Пример №6
При растворении гидрокси-да натрия массой 120 г получаем раствор объёмом 2 л. Определи молярную концентрацию гидроксида натрия.
Дано:
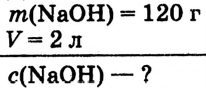
Решение:
1.Вычисли молярную массу NaOH:
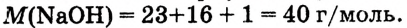
2.Вычисли количество вещества NaOH в растворе:
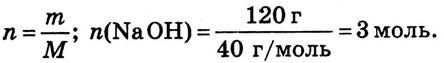
3. Вычисли молярную концентрацию растворённого вещества:
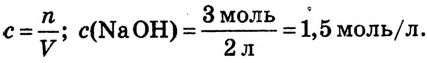
Ответ. Молярная концентрация гидроксида натрия в растворе равна 1,5 моль/л.
Пример №7
Какую массу хлорида цинка необходимо взять, чтобы получить его децимолярный раствор объёмом 250 мл?
Дано:
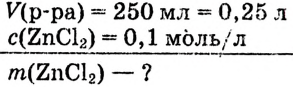
Решение:
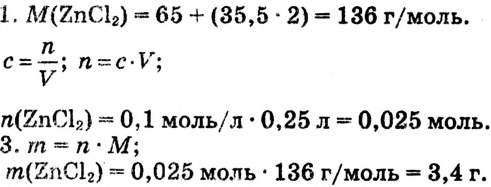
Ответ. Масса  равна 3,4 г.
равна 3,4 г.
Пример №8
Имеем раствор серной кислоты с массовой долей 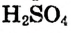 . 96 % и плотностью 1,84 г/мл. Как из него приготовить 500 мл 0,05М раствора серной кислоты?
. 96 % и плотностью 1,84 г/мл. Как из него приготовить 500 мл 0,05М раствора серной кислоты?
Дано:
Решение:
1. Вычисляем молярную массу 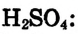
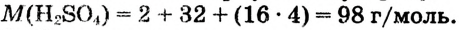
2.Находим количество вещества 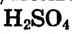 в 500 мл раствора:
в 500 мл раствора:
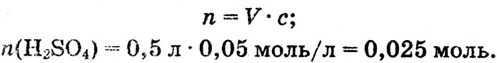
3.Находим массу 0,025 моль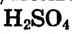 :
:
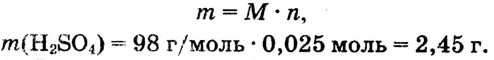
4.Вычисляем массу раствора, в котором содержится 2,45 г 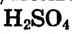 и где эта масса кислоты составляет 96 % массы раствора:
и где эта масса кислоты составляет 96 % массы раствора:
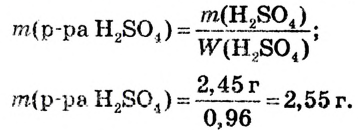
5. Вычисляем объём раствора, масса которого 2,55 г и плотность 1,84 г/мл:
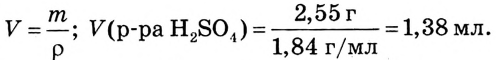
Ответ. Необходимо взять 1,38 мл раствора серной кислоты с массовой долей 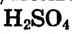 96 %, растворить в небольшом количестве воды в мерной колбе, а полученный раствор разбавить водой до отметки 500 мл; получим 0,05М раствор.
96 %, растворить в небольшом количестве воды в мерной колбе, а полученный раствор разбавить водой до отметки 500 мл; получим 0,05М раствор.
Выводы:
- Количественный состав раствора выражается массовой долей ра створённого вещества в растворе или молярной концентрацией. Массовая доля растворённого вещества — это физическая величина которая равна отношению массы растворённого вещества к массе ра створа. Обозначается W («дубль вэ») и выражается в долях единицы или в процентах.
- Молярная концентрация растворённого вещества — это физическая величина, которая равна отношению количества растворённого вещества к объёму раствора. Обозначают буквой с (це). Единица измерения моль/
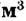 или моль/л.
или моль/л.
Электролитическая диссоциация
Электролиты и неэлектролиты:
На рубеже XVIII— XIX вв., когда для исследования свойств веществ начали использовать электрический ток, выяснилось, что одни вещества, находясь в водном растворе, проводят электрический ток, а другие — не проводят. Убедитесь в этом на опытах (рис. 38).
38. Прибор для исследования электрической проводимости веществ и их растворов
Опыт 1. В стакан с дистиллированной водой опустим электроды (угольные стержни) и включим штепсельную вилку в электросеть. Лампочка прибора не загорается. Почему? О чём это свидетельствует? Делаем вывод: дистиллированная вода не проводит электрический ток, цепь остаётся разомкнутой.
Электролиты: соли, кислоты, щёлочи
Опыт 2. Погружаем электроды в стакан с сухой поваренной солью. Результат тот же, лампочка не загорается. Следовательно, кристаллическая соль также не проводит электрический ток.
Опыт 3. К соли в стакане добавим воду, опустим электроды в водный раствор соли — лампочка ярко загорается. Почему? Это означает, что водный раствор соли, в отличие от сухой соли и дистиллированной воды, хорошо проводит электрический ток.
Так же, как поваренная соль, ведут себя и другие соли, а также щёлочи и кислоты. По отдельности они не проводят электрический ток, а их водные растворы (или расплавы) обладают электрической проводимостью.
Вещества, водные растворы или расплавы которых проводят электрический ток, называются электролитами.
К электролитам относятся соли, кислоты, щёлочи. Электролиты распадаются на ионы не только при растворении в воде, но и в расплаве, когда под влиянием теплового движения силы связи между частицами ослабевают.
Вещества, водные растворы или расплавы которых не проводят электрический ток, называются неэлектролитами.
Примерами неэлектролитов могут быть сахар, спирт, ацетон, глицерин, глюкоза.
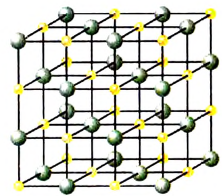
Рис. 39. Структура хлорида натрия
Впервые деление веществ на электролиты и неэлектролиты предложил английский учёный Майкл Фарадей.
В чём же причина различного поведения веществ в водных растворах или расплавах?
Процесс диссоциации
Электрическая проводимость водных растворов электролитов обусловлена наличием положительно и отрицательно заряженных ионов.
В водных растворах под влиянием воды из кристаллов вещества высвобождаются ионы.
Каков же механизм такого высвобождения?
Рассмотрим конкретный пример. Если в воде растворить кристаллы поваренной соли NaCl (рис. 39), то есть вещества с ионным типом химической связи, то вода ослабляет химические связи между ионами натрия 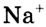 и хлора
и хлора 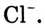 Ионы переходят в раствор и хаотично распределяются по всему объёму (рис. 40).
Ионы переходят в раствор и хаотично распределяются по всему объёму (рис. 40).
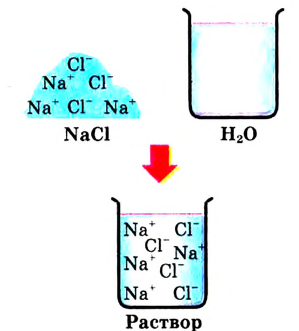
Рис. 40. Растворение NaCl в воде
Каким образом вода ослабляет ионную связь? Ты уже знаешь, что молекулы воды полярные, представляют собой диполи. Своими отрицательными полюсами они ориентированы к положительно заряженным ионам натрия 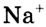 , а положительными полюсами — к отрицательно заряженным ионам хлора
, а положительными полюсами — к отрицательно заряженным ионам хлора 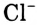 (рис. 41). Между разноимённо заряженными ионами соли, которая имеется в кристалле, и диполями воды возникают силы притяжения и образуются своеобразные связи — происходит гидратация ионов.
(рис. 41). Между разноимённо заряженными ионами соли, которая имеется в кристалле, и диполями воды возникают силы притяжения и образуются своеобразные связи — происходит гидратация ионов.
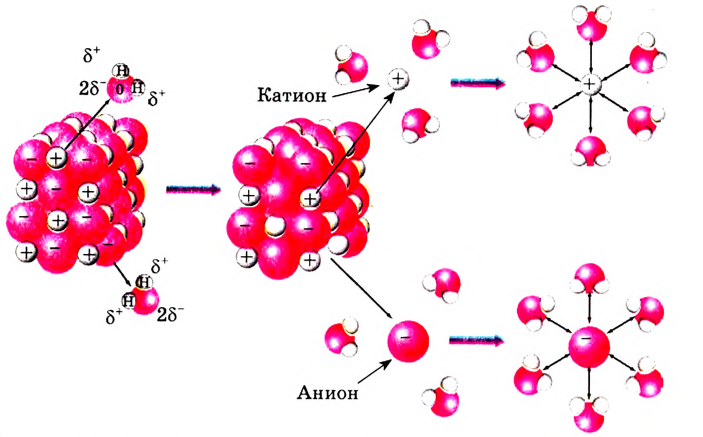
Рис. 41. Схема диссоциации веществ с ионным типом химической связи
В итоге ионные кристаллические решётки разрушаются, высвобождаются отдельные ионы, окружённые диполями воды. Их называют гидратированными ионами. В уравнениях реакций гидратацию ионов часто опускают, поэтому диссоциацию электролитов на ионы сокращённо показывают следующим образом:
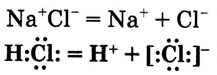
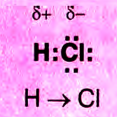
В отличие от металлов и сплавов в водных растворах электролитов носителями электрического заряда являются ионы. Электролиты называют проводниками 2-го рода.
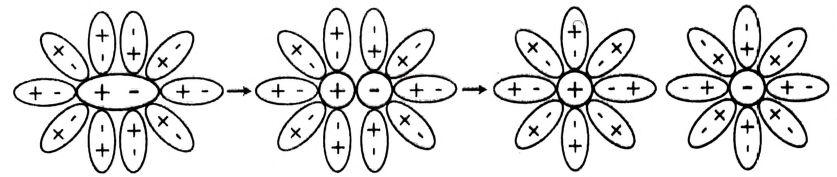
Рис. 42. Схема диссоциации веществ с полярным ковалентным типом химической связи
Почему же тогда электролитами считаются кислоты, ведь они — ковалент-ные соединения и ионов не имеют?
Действительно, кислоты не являются ионными соединениями. Но при растворении в воде, например, хлороводорода НС1 его молекулы также гидратируются, при этом происходит поляризация кова-лентной связи. Общая электронная пара полностью переходит к болеё электроотрицательному атому хлора, который взаимодействует с диполями воды. Образуются гидратированные ионы  и ионы
и ионы  (рис. 42):
(рис. 42):
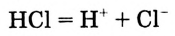
А происходит ли процесс диссоциации на ионы веществ с неполярной ковалентной связью?
Если в молекуле растворяемого вещества имеются ковалентные неполярные связи, то ионов в растворе не будет, поскольку неполярные молекулы не притягивают диполи воды, и поляризация связи не происходит. Ковалентными неполярными (или малополярными) связями преимущественно соединены атомы в молекулах многих органических соединений, поэтому обычно они являются неэлектролитами. Следовательно,
электролитами могут быть только вещества с ионной и сильно полярной ко? валентной химической связью.
Кроме того, молекулы растворителя также должны быть полярными. Лишь при таких условиях возможно расщепление молекул или кристаллов веществ с формированием свободных ионов.
Процесс расщепления электролитов на ионы в водном растворе (или в расплаве) называется электролитической диссоциацией.
- Электролитическая диссоциация — это процесс распада электролита на ионы. В водном растворе она обусловлена взаимодействием вещества с диполями воды, а в расплаве — нагреванием. По способности веществ в водных растворах проводить либо не проводить электрический ток их разделяют на электролиты и неэлектролиты.
- Для электролитов характерна ионная или ковалентная полярная химическая связь, для неэлектролитов — ковалентная неполярная химическая связь.
- Диссоциация электролитов с ионной связью характеризуется двумя процессами — разрушением кристаллических решёток под воздействием диполей воды и гидратацией ионов.
- Диссоциация электролитов с ковалентной полярной связью также включает два процесса — поляризацию ковалентной связи под влиянием диполей воды и опять-таки гидратацию образовавшихся ионов.
Аррениус Сванте-Август (1859—1927)
Шведский физико-химик. Член Стокгольмской академии наук, директор Нобелевского института (с 1905). Автор теории электролитической диссоциации. Работал в области химической кинетики, астрономии, астрофизики, биологии. Лауреат Нобелевской премии (1903)
Диссоциация электролитов в водных растворах
Диссоциацию электролитов в водных растворах впервые объяснил шведский учёный С.-А. Аррениус в 1887 г.
Диссоциация кислот
В процессе диссоциации кислот всегда образуются ионы водорода. Они обусловливают важнейшие свойства кислот (кислый вкус, изменение цвета индикаторов, взаимодействие с основаниями и др.) (рис. 43):
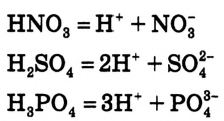
B водном растворе ионы водорода 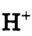 взаимодействуют с диполями воды, образуя ионы гидроксония
взаимодействуют с диполями воды, образуя ионы гидроксония 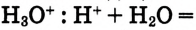
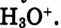 Но в уравнениях реакций для краткости пишут ион
Но в уравнениях реакций для краткости пишут ион 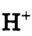 , помня при этом, что он гидратированный и является ионом гидроксония
, помня при этом, что он гидратированный и является ионом гидроксония 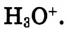
При диссоциации кислот среди положительно заряженных ионов (катионов) образуются только катионы водорода 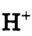 , а других положительно заряженных ионов нет. Отрицательно заряженные ионы кислотных остатков (анионы) могут быть разными, в зависимости от кислоты. Итак, с точки зрения электролитической диссоциации:
, а других положительно заряженных ионов нет. Отрицательно заряженные ионы кислотных остатков (анионы) могут быть разными, в зависимости от кислоты. Итак, с точки зрения электролитической диссоциации:
Кислоты — это электролиты, образующие при диссоциации только катионы водорода, других положительно заряженных ионов не дают.
Обрати внимание, как обозначают заряд ионов: знак заряда «+» или «-» ставят по правую сторону от иона после цифры, например 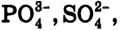 Сравни запись степени окисления элемента, где «+» или *-» ставят сверху над знаком элемента и перед цифрой, например
Сравни запись степени окисления элемента, где «+» или *-» ставят сверху над знаком элемента и перед цифрой, например 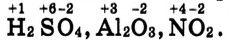
А как диссоциируют многоосновные кислоты? Двух- и многоосновные кислоты диссоциируют ступенчато, то есть постепенно отщепляют катионы водорода 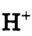 . Например, процесс диссоциации серной кислоты происходит таким образом:
. Например, процесс диссоциации серной кислоты происходит таким образом:

Рис. 43. Выявление ионов водорода в растворе
1-я ступень: 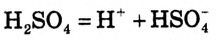
2-я ступень: 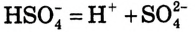
На первой ступени диссоциация происходит активнее.
ЛАБОРАТОРНЫЙ ОПЫТ:
Выявление ионов водорода в водном растворе
В три пробирки налей по 2 мл разбавленной соляной кислоты. В первую добавь 1—2 капли растворов лакмуса, во вторую — фенолфталеина, в третью — метилового оранжевого. Что происходит? Почему? Какой индикатор нельзя использовать для выявления ионов водорода в растворе? Почему?
Диссоциация оснований
 Вспомни, какие вещества называются основаниями. Приведи два-три примера оснований (формулу и название).
Вспомни, какие вещества называются основаниями. Приведи два-три примера оснований (формулу и название).
При диссоциации растворимых оснований — щелочей — обязательно образуются гидроксид-ионы 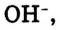 или ионы гидроксогрупп, их наличие обусловливает основные свойства (изменение цвета индикатора, взаимодействие с кислотами и т. д.) (рис. 44):
или ионы гидроксогрупп, их наличие обусловливает основные свойства (изменение цвета индикатора, взаимодействие с кислотами и т. д.) (рис. 44):
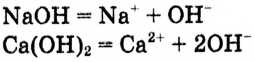
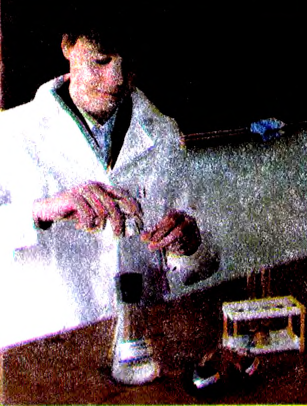
Рис. 44. Выявление гидроксид-ионов в растворе
Другие отрицательно заряженные ионы (анионы), кроме гидроксид-ионов, при диссоциации оснований не образуются. Следовательно, основания — это электролиты, образующие при диссоциации анионы только гидроксогрупп, и никаких других отрицательно заряженных ионов не дают.
ЛАБОРАТОРНЫЙ ОПЫТ:
Выявление гидроксид-ионов в растворе
В три пробирки налей по 2 мл раствора гидроксида натрия. В первую добавь 1— 2 капли раствора лакмуса, во вторую — фенолфталеина, в третью — метилового оранжевого. Что происходит? Почему? Какой индикатор лучше использовать для выявления гидроксид-ионов в растворе?
Диссоциация солей
Под влиянием воды кристаллы солей распадаются на положительно заряженные ионы (катионы) и отрицательно заряженные ионы кислотных остатков (анионы). Например:
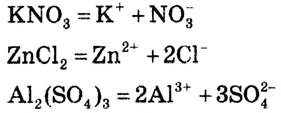
Соли — это электролиты, диссоциирующие с образованием катионов ме таллов и анионов кислотных остатков.
Различают средние, кислые и основные соли.
Средние соли — продукты полного замещения атомов водорода кислоты на атомы металла, например сульфат натрия  нитрат железа
нитрат железа Они диссоциируют полностью:
Они диссоциируют полностью:
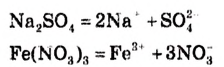
Кислые соли — продукты неполного замещения атомов водорода кислоты на атомы:
Средние соли

Кислые соли

мы металла, например гидросульфат калия  Они диссоциируют ступенчато:
Они диссоциируют ступенчато:
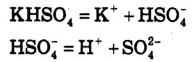
В результате, кроме катионов металла и анионов кислотного остатка, имеются ещё катионы водорода.
Основные соли — продукты неполного замещения гидроксильных групп ОН основания на кислотный остаток, например гидроксихлорид кальция 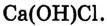 Они диссоциируют также ступенчато:
Они диссоциируют также ступенчато:
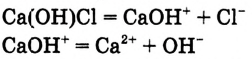
В результате, кроме катионов металла и анионов кислотного остатка, образуются анионы гидроксогрупп (гидроксид-ионы).
Степень диссоциации
Часто вещества взаимодействуют с водой, образуя ионы, не полностью, и в растворе остаются не-диссоциированные молекулы электролита. Поэтому растворы электролитов характеризуются определённой степенью диссоциации (обозначается а, читается альфа).
Степень диссоциации — это отношение числа частиц  распавшихся на ионы, к общему числу частиц N растворённого вещества.
распавшихся на ионы, к общему числу частиц N растворённого вещества.
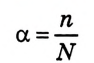
Степень диссоциации выражается в долях единицы или в процентах. Если  то диссоциации нет, если
то диссоциации нет, если или
или 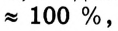 то электролит полностью распался на ионы.
то электролит полностью распался на ионы.
Основные соли

Число частиц, распавшихся на ионы

Общее число частиц
Сильные и слабые электролиты. В зависимости от степени диссоциации электролиты условно разделяют на сильные и слабые.
Сильные электролиты практически полностью диссоциированы на ионы в разбавленных растворах  приближается к 1 или 100 %). Этот процесс — необратимый, и в уравнениях диссоциации ставят знак «равенства». Сила электролита зависит главным образом от полярности химической связи: чем полярнее связь, тем легче она разрушается с образованием ионов, тем электролит сильнее.
приближается к 1 или 100 %). Этот процесс — необратимый, и в уравнениях диссоциации ставят знак «равенства». Сила электролита зависит главным образом от полярности химической связи: чем полярнее связь, тем легче она разрушается с образованием ионов, тем электролит сильнее.
Сила электролита зависит также от природы электролита и растворителя, концентрации раствора, температуры и других факторов.
Слабые электролиты лишь частично диссоциированы на ионы в разбавленных растворах 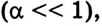 их ионы находятся в динамическом равновесии с недиссоциированными молекулами. Поэтому диссоциация слабых электролитов — оборотный процесс, и в уравнениях реакций вместо знака «равенства» следует ставить знак обратимости
их ионы находятся в динамическом равновесии с недиссоциированными молекулами. Поэтому диссоциация слабых электролитов — оборотный процесс, и в уравнениях реакций вместо знака «равенства» следует ставить знак обратимости 
Чем больше степень диссоциации, тем сильнее электролит.
Слабыми сейчас считаются все электролиты, растворы которых имеют хотя бы частично недиссоциированные молекулы (табл. 4).
Таблица 4. Сильные и слабые электролиты (Л. А. Слета)
| Электролиты | Сильные | Слабые |
| Вода | - |  |
|
Соли |
Подавляющее большинство |
|
|
Гидроксиды: (основания) растворимые (щёлочи) нерастворимые амфотерные |
Гидроксиды щелочных и щёлочноземельных металлов - |
Водный раствор аммиака Все Все |
| Кислоты: бескислородные кислородсодержащие | 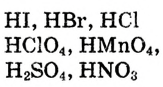 |
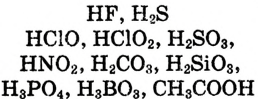 и другие органические кислоты и другие органические кислоты |
Силу кислородсодержащих минеральных кислот можно определить по такому эмпирическому правилу: сила кислоты тем больше, чем больше разность между количеством атомов кислорода и водорода в её молекуле. Если формулу кислоты записать в виде 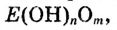 то
то 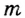 определяет силу кислоты: если
определяет силу кислоты: если 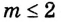 — кислота слабая, если
— кислота слабая, если 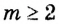 — сильная. Например:
— сильная. Например:
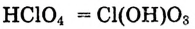 —очень сильная;
—очень сильная;
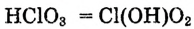 -сильная;
-сильная;
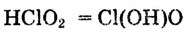 — слабая;
— слабая;
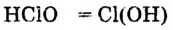 — очень слабая.
— очень слабая.
Связь силы кислоты с числом атомов кислорода, которые не входят в состав групп ОН, объясняется тем, что атом кислорода как более электроотрицательный притягивает общие электронные пары. В результате электронная плотность в группе ОН смещается от атома кислорода к атому кислотообразующего элемента, и связь становится ещё полярнее:
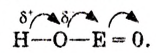
С увеличением числа атомов кислорода эффект оттягивания электронной плотности возрастает.
Выводы:
- Для растворов кислот, оснований, солей характерна ионная электрическая проводимость.
- Вещества, которые относятся к классу кислот, диссоциируют в воде на катионы водорода (ионы гидроксония) и анионы кислотных остатков.
- Вещества, которые относятся к классу оснований (щёлочи), диссоциируют в воде на катионы металлических элементов и анионы гидроксогрупп ОН. Вещества, которые относятся к классу солей, диссоциируют в воде на катионы металлических элементов и анионы кислотных остатков. Диссоциация электролита протекает полностью или частично. Степень диссоциации показывает, какая часть электролита распалась на ионы.
- Сильные электролиты диссоциируют практически полностью. Их диссоциация необратимая, протекает в одном направлении. Слабые электролиты образуют мало ионов. Их растворы или расплавы содержат недиссоциированные молекулы. Диссоциация слабых электролитов обратимая, протекает в противоположных направлениях при одних и тех же условиях.
Реакции обмена между растворами электролитов. Ионные уравнения
Ты уже знаешь, что электролиты при взаимодействии с водой расщепляются на ионы, следовательно, реакции между электролитами в растворе происходят при участии ионов. Взаимодействие ионов в растворе называют ионной реакцией.
Выясним в ходе демонстрационных опытов, при каких условиях электролиты взаимодействуют между собой.
Рис.45. Образование осадка
Опыт 1. В демонстрационную колбу наливаем раствор нитрата меди и добавляем раствор гидроксида натрия. Выпадает синий осадок нерастворимого основания — гидроксид меди
и добавляем раствор гидроксида натрия. Выпадает синий осадок нерастворимого основания — гидроксид меди (рис. 45):
(рис. 45):
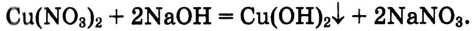
Данное химическое уравнение можно представить в ионной форме. Для этого формулы растворимых сильных электролитов записываем в виде ионов, на которые они диссоциируют в водном растворе, а формулы слабых электролитов, в данном случае нерастворимого вещества 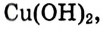 оставляем неизменными:
оставляем неизменными:
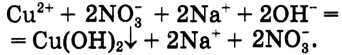
Такую запись называют полным ионным уравнением. Если сократить одинаковые ионы в обеих частях уравнения (подобные члены), то получим сокращённое ионное уравнение:
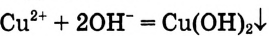
Согласно уравнению реакция между нитратом меди и гидроксидом натрия сводится к взаимодействию ионов меди
и гидроксидом натрия сводится к взаимодействию ионов меди и гидроксид-ионов, сопровождается образованием нерастворимого вещества гидроксида меди, выпадающего в осадок. Очевидно, что ионы
и гидроксид-ионов, сопровождается образованием нерастворимого вещества гидроксида меди, выпадающего в осадок. Очевидно, что ионы  в реакции не участвуют.
в реакции не участвуют.
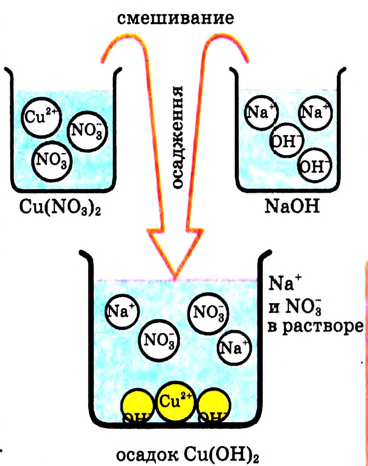

Рис. 46. Образование осадка
ЛАБОРАТОРНЫЙ ОПЫТ:
Реакция обмена между электролитами, протекающая с образованием осадка
Опыт 1. Налей в пробирку до 2 мл раствора сульфата натрия и добавь столько же раствора хлорида бария. Что происходит? Почему? Пользуясь таблицей растворимости (см. форзац), составь уравнение реакции и запиши его в полной и сокращённой ионных формах. Сравни результат с приведённым примером.
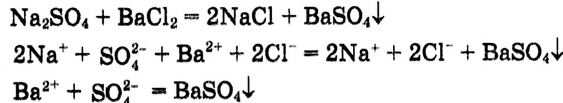
Сделай вывод, какое условие обеспечивает необратимость этой реакции. Разумеется, это образование осадка.
ЛАБОРАТОРНЫЙ ОПЫТ:
Реакция обмена между электролитами, протекающая с выделением газа
Помести в пробирку небольшие кусочки мрамора или мела (осторожно, чтобы не разбить дно) и долей немного соляной кислоты. Что происходит? Почему? Составь уравнение реакции и запиши его в полной и сокращённой ионных формах. Проверь правильность записи.
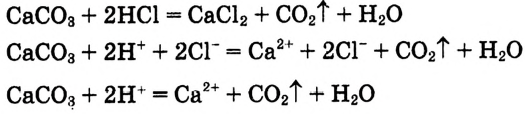
Сделай вывод, какое условие в данном случае способствует необратимости реакции. Понятно, что это выделение газа 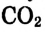 и образование слабого электролита
и образование слабого электролита 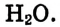
ЛАБОРАТОРНЫЙ ОПЫТ:
Реакция обмена между электролитами, протекающая с формированием слабого электролита
Налей в пробирку 2—3 мл раствора гидроксида натрия и добавь 1—2 капли раствора фенолфталеина. Что наблюдается? Почему? Чем объясняется окрашивание раствора в малиновый цвет? Добавляй каплями соляную кислоту до исчезновения цвета. Составь уравнение реакции и запиши его в полной и сокращённой ионных формах. Проверь правильность записей.
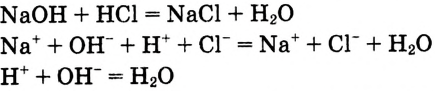
Сделай вывод, при каком условии эта реакция протекает до конца, становится необратимой. Понятно, что при условии образования воды — слабого электролита.
Обрати внимание, в ионных уравнениях принято записывать в недиссоциированной форме формулы малорастворимых веществ, и также газов или слабых электролитов. Поэтому ионное уравнения иногда называют ионно-молекулярными. Так ли это? Ведь в осадок выпадают нерастворимые соли и основания, не содержащие молекул, поскольку это — ионные соединения.
Выводы:
- Реакции в растворах электролитов протекают до конца, то есть становятся практически необратимыми, если ионы, участвующие в реакции, полностью или частично удаляются из сферы взаимодействия. Это происходит, если среди образовавшихся веществ имеются малорастворимые соединения, выпадающие в осадок, газы, вода или другие слабые электролиты.
Что такое растворы
Вы уже знакомы с растворами — однородными системами переменного состава. Любой раствор содержит не менее двух компонентов, один из которых растворитель, а другой — растворённое вещество. Растворы могут быть жидкие (водные и неводные), газообразные (газовые смеси), твёрдые. В газообразных растворах (смесях газов) наблюдается неограниченная взаимная растворимость газов. Примером таких растворов является воздух — смесь азота, кислорода, благородных и углекислого газов. Из твёрдых растворов наиболее важны сплавы металлов. В природе чаще всего встречаются жидкие водные растворы: природная вода, солевые растворы в клетках живых организмов.
В водных растворах растворителем является вода, в которой растворяются различные вещества — твёрдые, жидкие, газообразные. Как вам уже известно, главной причиной проявления водой свойств растворителя является строение её молекул — диполей.
Растворение веществ
Раствор — это не просто смесь частиц растворителя и растворённого вещества. Процесс растворения — сложный физико-химический процесс, при котором происходит взаимодействие частиц растворяемого вещества и растворителя. В результате контакта между частицами растворителя и растворяемого вещества последние отрываются от поверхности растворяемого вещества и, благодаря диффузии, распределяются в объёме растворителя. Это физическая сторона процесса. Одновременно происходит взаимодействие молекул растворителя
с частицами растворяемого вещества — это химическая составляющая процесса растворения. Такое взаимодействие бывает настолько сильным, что приводит к образованию устойчивых соединений.
Тепловые явления при растворении
Растворение веществ сопровождается тепловыми эффектами. В процессе растворения разрушаются химические связи между частицами вещества (атомами, молекулами, ионами), что требует затрат энергии. Одновременно происходит образование связей между частицами растворённого вещества и растворителя, которое сопровождается выделением энергии. При растворении газов и жидкостей теплота обычно выделяется, а при растворении твёрдых веществ она может и выделяться, и поглощаться. Тепловой эффект растворения веществ определяется разницей между количеством теплоты, затраченной на разрыв химических связей между частицами растворяемого вещества (эндотермический процесс), и количеством теплоты, выделившейся при взаимодействии частиц растворённого вещества и растворителя (экзотермический процесс):
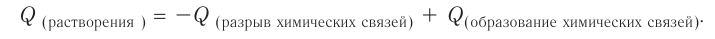
Например, при растворении в воде серной кислоты наблюдается сильное разогревание раствора. Причина этого в том, что количество теплоты, выделяющейся при химическом взаимодействии кислоты с водой, больше количества теплоты, затраченной на разрыв связей в молекулах кислоты.
Гидраты и кристаллогидраты
Химическое взаимодействие растворённого вещества с водой приводит к образованию соединений, которые называются гидратами. Их состав выражают с помощью формул растворённого вещества и воды, соединённых знаком « • », например: 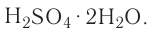
Гидратную теорию растворов предложил русский учёный Д. И. Менделеев. Он писал: «Растворы суть химические соединения, определяемые силами, действующими между растворителем и растворённым веществом». Этот процесс взаимодействия растворяемого вещества с водой называется гидратацией. При увеличении содержания растворённого вещества из раствора выпадают кристаллы, которые содержат в своём составе воду и поэтому называются кристаллогидратами.
Кристаллы, в состав которых входят молекулы воды, называются кристаллогидратами, а содержащаяся в них вода — кристаллизационной.
Так, с 1 моль соли в кристаллогидрате медного купороса 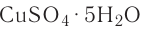 связаны 5 моль воды, а в кристаллогидрате железного купороса —
связаны 5 моль воды, а в кристаллогидрате железного купороса — 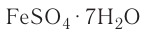 — 7 моль воды (табл. 10).
— 7 моль воды (табл. 10).
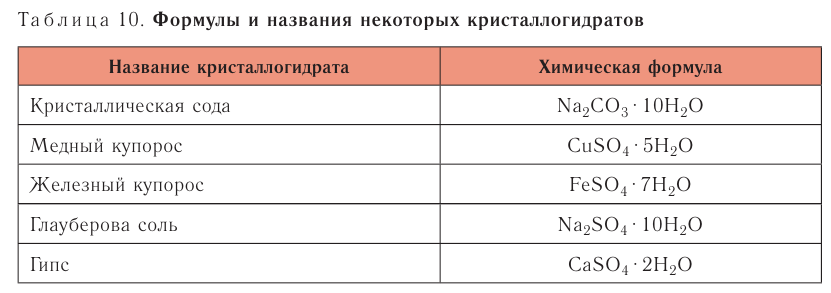

Широко распространённым и используемым кристаллогидратом является природный гипс 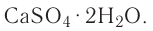 При нагревании его до 180 °С образуется алебастр
При нагревании его до 180 °С образуется алебастр 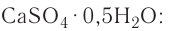
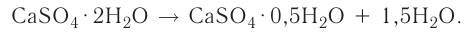
Если в насыщенный раствор вещества поместить его маленький кристаллик, то по мере испарения растворителя на поверхности кристаллика будет осаждаться растворённое вещество и образуется большой однородный кристалл (рис. 44).
Растворимость веществ в воде
Способность веществ растворяться в воде или другом растворителе называется растворимостью. По растворимости все вещества в зависимости от их природы делятся на три группы — нерастворимые, малорастворимые и растворимые. В таблице растворимости это отображается в помощью соответствующих букв — «Н», «М» и «Р». Нерастворимыми являются, например, 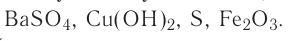
К малорастворимым веществам относятся хлорид свинца(II), сульфид кальция, фторид бария, бензол, кислород и др.
Растворимые в воде вещества могут быть твёрдыми (сахар, сульфат меди(II), гидроксид натрия), жидкими (спирт, уксусная кислота, серная кислота) и газообразными (хлороводород, аммиак).
Второй фактор, влияющий на растворимость веществ, — это температура. Как правило, растворимость твёрдых веществ с увеличением температуры заметно возрастает. Растворение газов сопровождается выделением теплоты, поэтому понижение температуры повышает их растворимость. Она увеличивается также при повышении давления. Эти факты учитываются при изготовлении газированных напитков — углекислый газ растворяют в воде при пониженной температуре и повышенном давлении.
Растворимость веществ при различных температурах количественно характеризуется величиной коэффициента растворимости.
Коэффициент растворимости (s) — это максимальная масса вещества, которое при данной температуре можно растворить в воде массой 100 г.
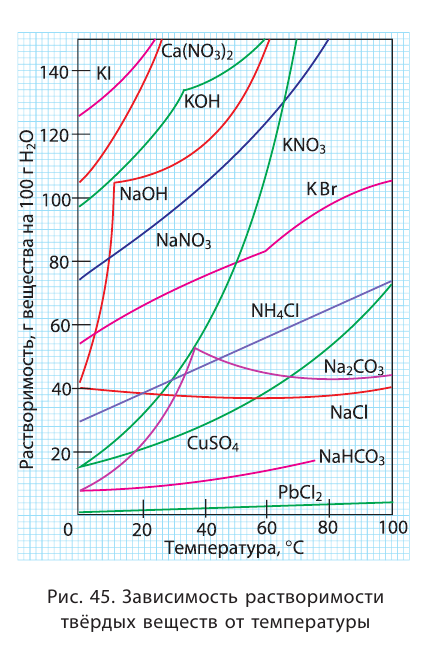
Зависимость растворимости веществ от температуры выражается графически с помощью кривых растворимости (рис. 45).
По кривым растворимости производят различные расчёты. Например, можно определить массу вещества, которое выпадает в осадок из насыщенного раствора при его охлаждении. Если приготовить насыщенный при 60 °С раствор нитрата натрия в воде массой 100 г, а затем охладить его до 20 °С, то по кривой растворимости видно, что из раствора выпадет соль массой 34 г (122 - 88 = 34 г).
Процесс выделения твёрдого вещества из насыщенного раствора при понижении температуры называется кристаллизацией. Кристаллизация играет огромную роль в природе — она приводит к образованию некоторых минералов, участвует в процессах, протекающих в горных породах.
Кристаллизация лежит в основе метода очистки твёрдых веществ, который называется перекристаллизацией.
- Растворение — физико-химический процесс, включающий в себя как разрушение структуры растворяемого вещества, так и взаимодействие его частиц с молекулами растворителя. При растворении веществ в воде может происходить выделение или поглощение теплоты. Растворимость веществ в воде зависит от их природы, температуры, давления. Кристаллогидраты — кристаллические вещества, содержащие молекулы воды.
Способы выражения составов растворов
В промышленности, медицине, быту часто необходимы растворы с определённым и точным содержанием вещества. Поэтому основной характеристикой любого раствора является его количественный состав. Количественный состав растворов выражают различными способами.
Массовая доля растворённого вещества (w — «дубль-вэ») — величина, равная отношению массы этого вещества к массе раствора. С этим способом выражения состава растворов вы познакомились в 8-м классе. Вспомним, что если в растворе массой 200 г масса растворённого вещества равна 40 г, то его массовая доля равна:
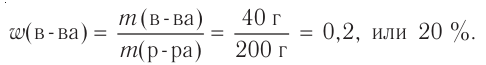
Массовая доля — величина безразмерная, выражается в долях единицы или в процентах.
Пример №9
К раствору массой 400 г с массовой долей хлорида кальция, равной 12 %, добавили раствор массой 120 г, в котором массовая доля той же соли составляла 0,05. Рассчитайте массовую долю хлорида кальция в полученном новом растворе.
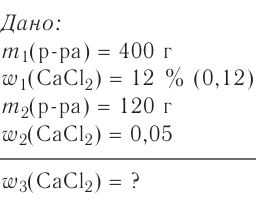
Решение:
1. Определим массу хлорида кальция в первом растворе:
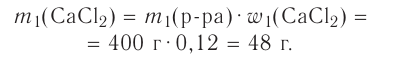
2. Найдём массу хлорида кальция во втором растворе:
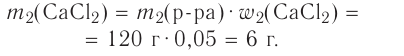
3. Определим общую массу хлорида кальция в новом растворе:
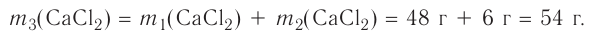
4. Вычислим общую массу нового раствора: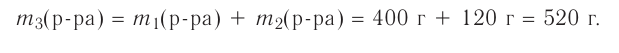
5. Определим массовую долю хлорида кальция в новом растворе: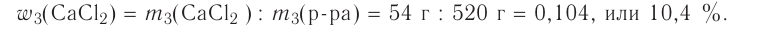
Ответ: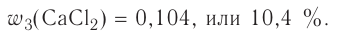
Пример №10
Кристаллогидрат 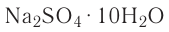 массой 128,8 г растворили в воде массой 691,2 г. Вычислите массовую долю (%) сульфата натрия в полученном растворе.
массой 128,8 г растворили в воде массой 691,2 г. Вычислите массовую долю (%) сульфата натрия в полученном растворе.
Дано:
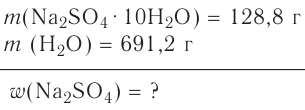
Решение:
1. Определим молярную массу кристаллогидрата:
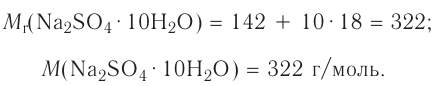
2. Вычислим массу сульфата натрия в указанной порции кристаллогидрата, составив пропорцию:
в порции 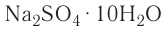 массой 322 г содержится
массой 322 г содержится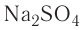 массой 142 г; в порции
массой 142 г; в порции 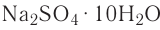 массой 128,8 г содержится
массой 128,8 г содержится 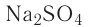 массой х г, откуда
массой х г, откуда 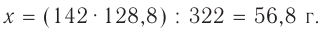
3. Вычислим массу приготовленного раствора:
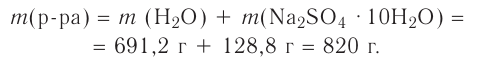
4. Найдём массовую долю сульфата натрия в растворе:
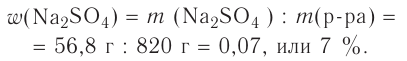
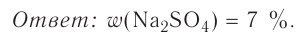
В химии широко пользуются таким способом выражения состава растворов, как молярная концентрация вещества в растворе.
Молярная концентрация вещества — с(Х) — величина, равная отношению его химического количества к объёму раствора:
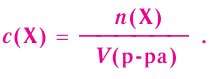
Молярная концентрация выражается в моль/
Пример №11
В растворе объёмом  содержится гидроксид натрия массой 0,8 г. Рассчитайте молярную концентрацию этого вещества в растворе.
содержится гидроксид натрия массой 0,8 г. Рассчитайте молярную концентрацию этого вещества в растворе.
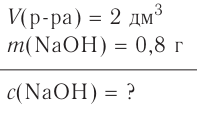
Решение:
1. Вычислим химическое количество гидроксида натрия:
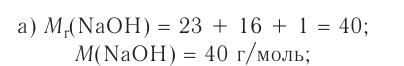
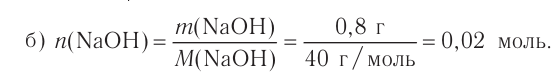
2. Найдём молярную концентрацию гидроксида натрия в растворе: «(NaOH) 0,02 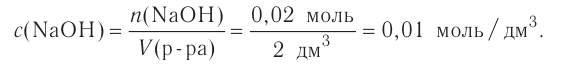
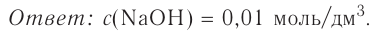
Зная молярную концентрацию, можно легко найти химическое количество растворённого вещества, содержащегося в определённом объёме раствора:
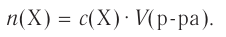
Важной количественной характеристикой любого раствора является плотность р — величина, равная отношению массы данного раствора к его объёму:
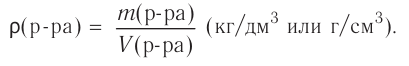
Используя эту характеристику, легко перейти от одного способа выражения состава раствора к другому.
Пример №12
Массовая доля серной кислоты в растворе равна 20 %, а его плотность составляет 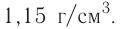 . Вычислите молярную концентрацию серной кислоты в этом растворе.
. Вычислите молярную концентрацию серной кислоты в этом растворе.
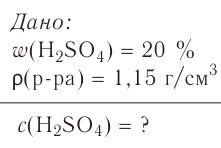
Решение:
1. Поскольку молярная концентрация показывает химическое количество вещества в растворе объёмом 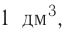 допустим, что объём раствора серной кислоты равен
допустим, что объём раствора серной кислоты равен 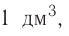 или 1000
или 1000 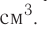
2. Найдём массу этого раствора:
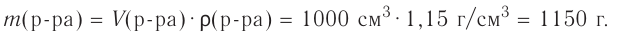
3. Вычислим массу кислоты в растворе:
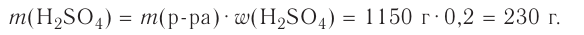
4. Найдём химическое количество серной кислоты в растворе: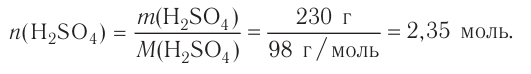
5. Рассчитаем молярную концентрацию 
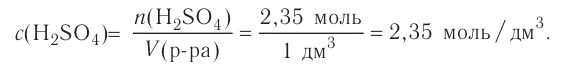
Ответ: 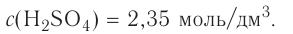
- Количественный состав растворов можно выражать с помощью физических величин — массовой доли или молярной концентрации растворённого вещества.
Электролитическая диссоциация веществ в растворах
Вам уже известно, что растворы и расплавы некоторых веществ проводят электрический ток. Такие вещества называют электролитами. К электролитам относятся соли, щёлочи, кислоты — соединения с ионным и ковалентным полярным типом химической связи.
Причина электропроводности растворов заключается в том, что при растворении под влиянием полярных молекул воды электролиты распадаются, т. е. диссоциируют на положительно и отрицательно заряженные частицы — ионы. Эти ионы являются носителями электрических зарядов в растворах.
Теория, объясняющая электропроводность растворов, первоначально была предложена шведским учёным С. Аррениусом в 1887 году. Русские учёные И. А. Каблуков и В. А. Ки стя ко веки й дополнили эту теорию положением о взаимодействии ионов с молекулами воды и образованием неустойчивых гидратов, чем связали её с утверждением Д. И. Менделеева о взаимодействии растворённого вещества и растворителя.
Сущность теории электролитической диссоциации можно выразить следующим положением.
Электролиты в растворах и расплавах распадаются (диссоциируют) на противоположно заряженные частицы — ионы.
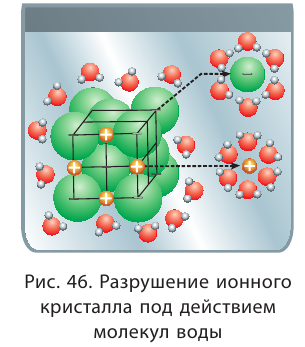
Диссоциация электролитов с ионным и ковалентным типами химической связи протекает по-разному.
Диссоциация соединений с ионным типом связи
В основе строения ионных соединений находится ионная кристаллическая решётка. Разрушение кристаллов происходит под воздействием полярных молекул воды (рис. 46).
Особенностью диссоциации ионных соединений является то, что в этих веществах имеются уже готовые ионы и диполям воды остаётся только разрушить ионный кристалл.
К электролитам с ионным типом связи относятся основания и соли.
Основания диссоциируют в водных растворах на гидроксид-ионы и ионы металла. Например, растворимые в воде основания, которые, как вы знаете, называются щелочами, диссоциируют следующим образом:
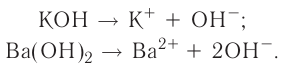
В результате разрушения водой ионных кристаллов солей они диссоциируют на ионы металлов и кислотных остатков:
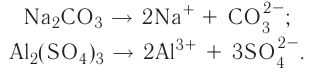
Диссоциация соединений с ковалентным полярным типом связи
Кислоты относятся к веществам, в молекулах которых атомы связаны ковалентными полярными связями. Говоря об электролитах с таким типом связи, мы будем иметь в виду только растворимые органические и неорганические кислоты.
Кислоты имеют молекулярное строение, и готовых ионов в их полярных молекулах нет. Особенность диссоциации кислот в том, что диполи воды притягиваются к разноимённо заряженным концам полярной молекулы кислоты, а затем разрывают её с образованием ионов (рис. 47).
Образующиеся при диссоциации кислот ионы водорода соединяются с молекулами воды. В результате получаются более сложные ионы 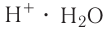 или
или 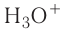 — катионы гидроксония. При этом новая ковалентная связь возникает по донорно-акцепторному механизму:
— катионы гидроксония. При этом новая ковалентная связь возникает по донорно-акцепторному механизму:
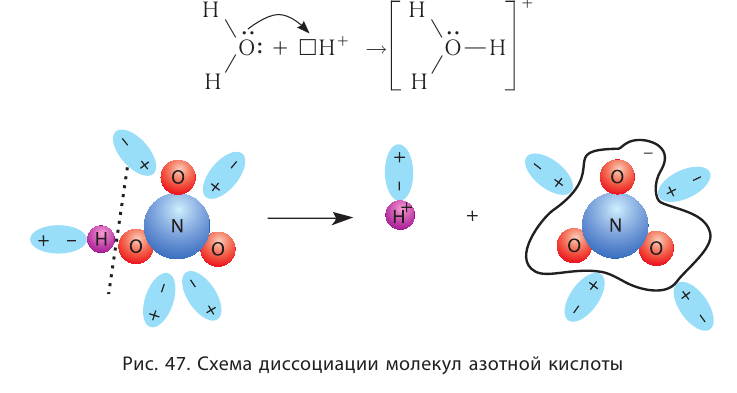
Молекула воды — донор электронной пары, а ион водорода — её акцептор. Однако в дальнейшем, для упрощения в уравнениях ионных реакций, мы будем записывать гидратированный ион водорода в виде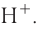
Кислоты диссоциируют в водных растворах на ионы водорода и кислотных остатков:
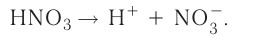
По числу атомов водорода кислоты делятся на одно-, двух- и трёхосновные. Многооснбвные кислоты диссоциируют ступенчато, например:
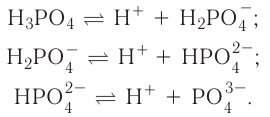
При этом, как правило, на каждой последующей ступени диссоциация ослабевает.
Отличие свойств ионов от свойств атомов и молекул
Атомы и молекулы в целом электронейтральны. Ионы, как известно, образуются в результате отдачи или присоединения электронов атомами, что и является причиной возникновения зарядов у ионов. Так же как ионы водорода, все ионы в водных растворах гидратируются, т. е. взаимодействуют с молекулами воды.
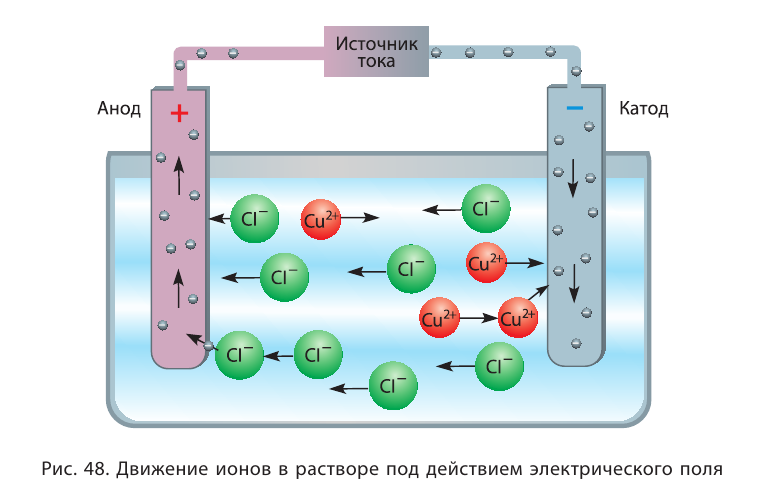
Гидратация отчасти затрудняет обратное соединение ионов (ассоциацию).
Свойства заряженных ионов отличаются от свойств соответствующих элек-тронейтральных атомов. Ионы натрия  не разлагают воду, а нейтральные атомы натрия
не разлагают воду, а нейтральные атомы натрия 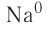 взаимодействуют с ней с выделением водорода.
взаимодействуют с ней с выделением водорода.
Ионы хлора 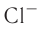 не имеют ни цвета, ни запаха, не токсичны, т. е. не проявляют свойств газообразного хлора. В электрическом поле ионы перемещаются к противоположно заряженным электродам. Положительно заряженные ионы направляются к катоду — их называют катионами. Отрицательно заряженные ионы называют анионами, так как они перемещаются к аноду (рис. 48). В растворе любого электролита общий положительный заряд всех катионов равен общему отрицательному заряду всех анионов.
не имеют ни цвета, ни запаха, не токсичны, т. е. не проявляют свойств газообразного хлора. В электрическом поле ионы перемещаются к противоположно заряженным электродам. Положительно заряженные ионы направляются к катоду — их называют катионами. Отрицательно заряженные ионы называют анионами, так как они перемещаются к аноду (рис. 48). В растворе любого электролита общий положительный заряд всех катионов равен общему отрицательному заряду всех анионов.
Свойства ионов отличаются от свойств атомов и молекул, потому что они обладают различным электронным строением.
Сильные и слабые электролиты
Электролиты диссоциируют на ионы в различной степени. Полнота распада зависит от природы электролита и растворителя, температуры, концентрации электролита.
Количественно диссоциация характеризуется степенью диссоциации а.
Степень диссоциации а — это величина, равная отношению числа молекул или формульных единиц электролита, распавшихся на ионы, к общему числу его растворённых молекул или формульных единиц:
Так как число частиц и их количество связаны между собой соотношением
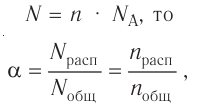
где n — химическое количество соответствующих молекул или формульных единиц.
Таким образом, степень диссоциации — это величина, равная отношению химического количества распавшихся на ионы структурных единиц данного вещества к общему химическому количеству растворённых структурных единиц. Она показывает, какая часть (доля) электролита распадается на ионы.
Степень диссоциации выражается в долях единицы или процентах. Например, если степень диссоциации уксусной кислоты в растворе с молярной концентрацией 0,1 моль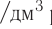 равна 0,015 (1,5 %), то это означает, что из 1000 молекул только 15 распались на ионы. Степень диссоциации обычно определяют экспериментальным путём.
равна 0,015 (1,5 %), то это означает, что из 1000 молекул только 15 распались на ионы. Степень диссоциации обычно определяют экспериментальным путём.
К сильным электролитам  относятся соединения с ионным и ковалентным полярным типом связи. Ионные соединения диссоциируют на катионы металлов и анионы кислотных остатков (соли) или гидроксид-ионы (щёлочи). Сильными электролитами с ковалентным типом связи являются кислоты: серная, соляная, азотная, которые поэтому так и называют — сильные кислоты. В растворах сильных электролитов практически отсутствует процесс обратного объединения ионов, поэтому диссоциацию таких электролитов записывают в виде уравнения распада со стрелкой в одном направлении:
относятся соединения с ионным и ковалентным полярным типом связи. Ионные соединения диссоциируют на катионы металлов и анионы кислотных остатков (соли) или гидроксид-ионы (щёлочи). Сильными электролитами с ковалентным типом связи являются кислоты: серная, соляная, азотная, которые поэтому так и называют — сильные кислоты. В растворах сильных электролитов практически отсутствует процесс обратного объединения ионов, поэтому диссоциацию таких электролитов записывают в виде уравнения распада со стрелкой в одном направлении:
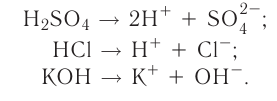
К слабым электролитам относятся соединения с ковалентной менее полярной связью. При растворении в воде они лишь частично диссоциируют на ионы. Степень диссоциации слабых электролитов очень мала К ним относится большинство органических кислот, например уксусная кислота
К ним относится большинство органических кислот, например уксусная кислота 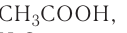 многие неорганические кислоты, такие как сероводородная кислота
многие неорганические кислоты, такие как сероводородная кислота 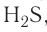 сернистая кислота
сернистая кислота 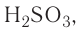 плавиковая кислота HF.
плавиковая кислота HF.
Двухосновные слабые кислоты диссоциируют практически только по первой ступени:
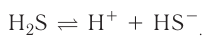
В растворах слабых электролитов непрерывно протекает процесс диссоциации молекул на ионы и обратный процесс объединения ионов в молекулы. Между этими двумя процессами устанавливается динамическое равновесие. Диссоциацию таких электролитов отображают уравнением распада со стрелками в двух направлениях.
Таким образом, можно сказать, что диссоциация слабых электролитов — процесс обратимый. Степень диссоциации таких электролитов растёт с уменьшением их концентраций, так как при этом уменьшается вероятность столкно-ваний ионов в растворе. Слабым электролитом является вода:
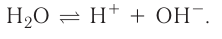
При 25 °С степень её диссоциации равна примерно 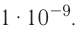 Это означает, что из каждого миллиарда молекул воды только одна молекула распадается на ионы.
Это означает, что из каждого миллиарда молекул воды только одна молекула распадается на ионы.
Выводы:
- Электролиты — это вещества, водные растворы или расплавы которых проводят электрический ток.
- Электропроводность растворов и расплавов электролитов объясняется электролитической диссоциацией веществ на ионы.
- Ионы отличаются от атомов и молекул по строению и свойствам.
- Электролиты делятся на сильные и слабые.
- Количественной характеристикой электролитической диссоциации является степень диссоциации.
Реакции ионного обмена в водных растворах
Поскольку электролиты в растворах распадаются на ионы, то согласно теории электролитической диссоциации реакции в водных растворах электролитов — это реакции с участием ионов. Так как растворы сильных электролитов практически не содержат недиссоциированных молекул, а только анионы и катионы,

то логично предположить, что они и взаимодействуют между собой. Химические реакции между ионами в растворах электролитов называются ионными реакциями. С участием ионов могут протекать как реакции обмена, так и окислительновосстановительные реакции.
Реакции обмена в растворах называют реакциями ионного обмена.
Реакции ионного обмена в растворах электролитов протекают только в том случае, если образуются осадки — труднорастворимые вещества (рис. 49), газообразные или малодиссоциирующие вещества. К последним обычно относят воду  и другие слабые электролиты, например
и другие слабые электролиты, например  и др.
и др.
Уравнения таких процессов составляют либо в обычном (молекулярном) виде, либо в полном ионном или сокращённом ионном виде.
Составление уравнений ионных реакций
Составление уравнений в ионном виде требует соблюдения определённого порядка действий. Для этого:
1. Составляем уравнение реакции в молекулярном виде, расставляем коэффициенты:
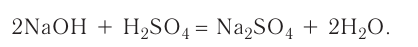
2. Переписываем это уравнение в ионном виде, изображая сильные электролиты в виде ионов, а образующееся малодиссоциирующее вещество — воду — в молекулярном виде:
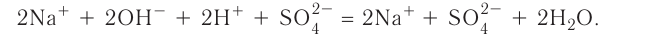
3. Исключаем из обеих частей уравнения не участвующие в реакции ионы и записываем сокращённое ионное уравнение, которое и отображает суть химической реакции:
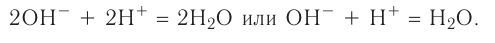
4. Делаем вывод о том, что суть данной реакции заключается в связывании катионов водорода с гидроксид-ионами, которое приводит к образованию малодиссоциирующего вещества — воды.
Если в результате реакции получается осадок, обозначаем это стрелкой, направленной вниз  а если газ — стрелкой, направленной вверх
а если газ — стрелкой, направленной вверх
Пример №13
Составьте молекулярное и ионные уравнения химической реакции, протекающей в растворе между хлоридом железа(III) и гидроксидом натрия.
Составим молекулярное уравнение реакции:
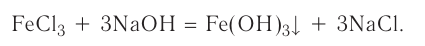
Составим ионное уравнение реакции:
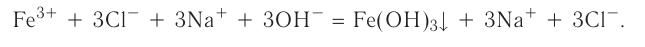
Запишем сокращённое ионное уравнение реакции:
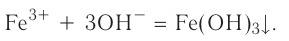
В результате связывания ионов 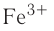 и гидроксид-ионов
и гидроксид-ионов 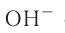 образовался осадок нерастворимого основания гидроксида железа(III) (см. рис. 49).
образовался осадок нерастворимого основания гидроксида железа(III) (см. рис. 49).
Пример №14
Составьте молекулярное и ионные уравнения реакции между сульфидом натрия и соляной кислотой.
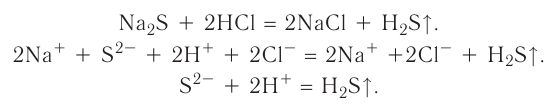
Образование газообразного продукта реакции сероводорода — это результат взаимодействия катионов водорода и сульфид-анионов.
Пример №15
Составьте молекулярное и ионные уравнения химической реакции между гидроксидом алюминия и серной кислотой.
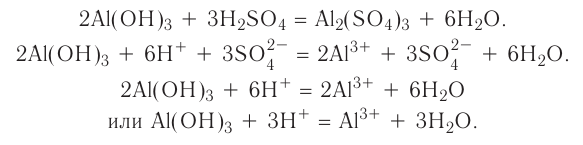
Растворение осадка гидроксида алюминия является признаком химической реакции, которая протекает в результате действия ионов водорода серной кислоты на  с образованием малодиссоциирующего вещества — воды и растворимой соли.
с образованием малодиссоциирующего вещества — воды и растворимой соли.
Пример №16
Установите, взаимодействуют ли в растворе хлорид натрия и нитрат калия.
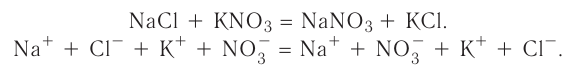
Сокращённое ионное уравнение в данном случае составить невозможно, так как не происходит связывание ионов, и, следовательно, реакция не протекает.
Ионными уравнениями можно выражать любые химические реакции, протекающие в растворах электролитов. Знание условий протекания реакций очень важно для характеристики свойств веществ, получения газов, нерастворимых веществ, нейтрализации кислот и оснований, прогнозирования возможности протекания химических реакций.
При взаимодействии двух разных электролитов химическая реакция возможна только в результате связывания ионов с образованием газа, осадка или слабого электролита.
Кислоты, основания, соли с точки зрения теории электролитической диссоциации
Если учитывать, что в растворах электролитов преобладают ионы, на которые диссоциируют электролиты, то логично, что свойства растворов — это свойства данных ионов. Некоторые ионы в растворах очень легко обнаружить. Например, катионы серебра 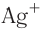 хорошо связываются с анионами хлора
хорошо связываются с анионами хлора 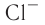 с образованием белого творожистого осадка хлорида серебра AgCl .
с образованием белого творожистого осадка хлорида серебра AgCl .
Взаимодействуют между собой с образованием осадков такие пары ионов, как 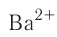 и
и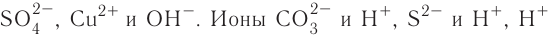 " взаимодействуют с образованием газообразных и малодиссоциирующих веществ.
" взаимодействуют с образованием газообразных и малодиссоциирующих веществ.
Однако ионы в растворах можно обнаружить не только по их связыванию другими ионами. Катионы водорода и гидроксид-ионы обнаруживают с помощью индикаторов. Как вы уже хорошо знаете, в присутствии кислот, образующих при диссоциации катионы водорода, окраска лакмуса и метилоранжа изменяется, соответственно, с фиолетовой и оранжевой на красную.
Щёлочи при диссоциации образуют гидроксид-ионы и изменяют окраску фенолфталеина на малиновую, метилоранжа — на жёлтую, лакмуса — на синюю.
В чистой воде индикаторы не изменяют свою окраску. Это объясняется тем, что концентрации ионов водорода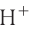 и гидроксид-ионов
и гидроксид-ионов 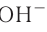 в воде одинаковы и при 25 °С равны по
в воде одинаковы и при 25 °С равны по 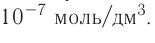
Водородный показатель:
Концентрации ионов 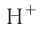 и
и 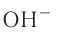 в воде и любом водном растворе взаимосвязаны. Увеличение концентрации ионов
в воде и любом водном растворе взаимосвязаны. Увеличение концентрации ионов 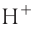 (например, при добавлении кислоты) вызывает уменьшение концентрации ионов
(например, при добавлении кислоты) вызывает уменьшение концентрации ионов 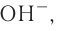 и наоборот.
и наоборот.
Растворы, в которых концентрация ионов водорода равна концентрации гидроксид-ионов, называют нейтральными. Если в растворе концентрация ионов водорода больше концентрации гидроксид-ионов, т. е. 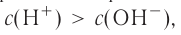 то среда раствора кислая. Если же в растворе
то среда раствора кислая. Если же в растворе 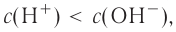 т. е. преобладает концентрация гидроксид-ионов, то его среда является щелочной.
т. е. преобладает концентрация гидроксид-ионов, то его среда является щелочной.
Количественно среду растворов выражают с помощью так называемого водородного показателя pH (пэ-аш), который представляет собой десятичный логарифм концентрации ионов водорода, взятый со знаком «минус»:
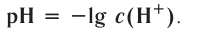
Например, при молярной концентрации ионов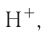 равной
равной 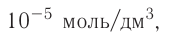 , pH равен 5, а при
, pH равен 5, а при 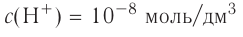 pH равен 8.
pH равен 8.
Водородный показатель характеризует кислотность или щёлочность раствора. Поскольку в чистой воде при 25 °С концентрации ионов одинаковы и равны
одинаковы и равны  , то
, то 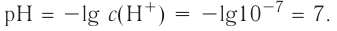 Такое значение pH соответствует нейтральной среде. Чем меньше семи значение pH, тем больше кислотность раствора. Чем больше семи значение pH, тем больше щёлочность раствора (рис. 50).
Такое значение pH соответствует нейтральной среде. Чем меньше семи значение pH, тем больше кислотность раствора. Чем больше семи значение pH, тем больше щёлочность раствора (рис. 50).
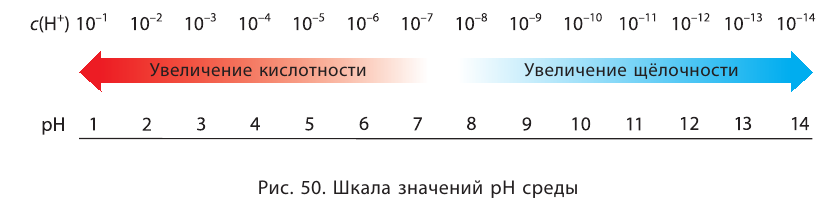
Понятие «водородный показатель» было введено датским химиком Серенсеном в 1909 году. Буква р — первая буква слова «потенц» — сила, а буква Н— символ водорода.
Величина pH имеет большое значение во многих химических и биологических процессах. Большинство из них может протекать с достаточными скоростями и в нужных направлениях только при определённой кислотности среды. Следовательно, измерение pH необходимо в медицине, науке, технике, сельском хозяйстве. Так, например, для нормального развития растений необходимо уменьшать повышенную кислотность почв их известкованием. На молочных комбинатах величиной pH определяется свежесть молока.
В человеческом организме разные жидкости имеют различную величину pH: желудочный сок pH 1,7 (сильнокислотная среда), кровь — pH 7,4 (слабощелочная среда), слюна — pH 6,9 и слёзы pH 7,0 (нейтральная). Величина pH является показателем состояния здоровья человека.
Величину pH можно измерять с помощью индикаторов, окраска которых в растворе сравнивается со специальной pH-шкалой (рис. 51). Более точно в лабораториях, научных исследованиях, в производственной практике величину pH определяют с помощью специальных приборов, которые так и называют — pH-метры (рис. 52).
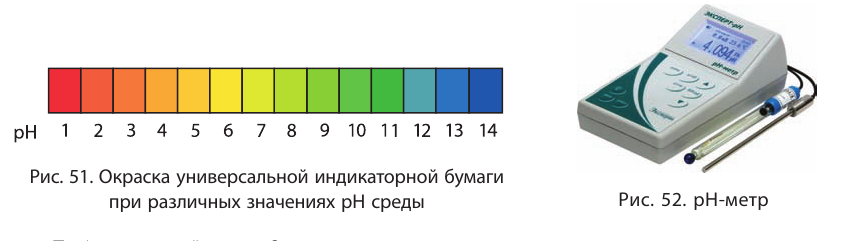
Большинство химических реакций между кислотами, основаниями и солями протекает в растворах. Это реакции между ионами. Рассмотрим, какие ионы определяют свойства веществ основных классов неорганических соединений.
Кислоты:
В Кислоты — это электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода.
Общие свойства кислот обусловлены реакциями, в которые вступают катионы водорода. Обнаружить ионы водорода в растворе кислоты можно с помощью индикаторов. Лакмус и метилоранж меняют цвет, соответственно, с фиолетового и оранжевого на красный. Кислоты вступают в химические реакции с металлами, стоящими в ряду активности до водорода, основными оксидами, основаниями и солями, образованными более слабыми кислотами.
Рассмотрим эти свойства на примере серной и соляной кислот (табл. 11). Таблица 1 1. Химические свойства кислот
Вывод: свойства кислот с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах катионов водорода Н+.
Основания:
В Основания — это электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Основания, растворимые в воде, как известно, называют щёлочами. При электролитической диссоциации они образуют отрицательно заряженные гидроксид-ионы 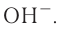 .
.
Присутствие щелочей в растворах обнаруживается с помощью индикаторов. Фенолфталеин в растворах щелочей — малиновый, лакмус — синий, метилоранж — жёлтый. Изменение окраски лакмуса с фиолетовой на синюю происходит в интервале pH от 8 до 14.
Щёлочи — активные вещества, они вступают в химические реакции с простыми и сложными веществами. Рассмотрим некоторые из этих реакций (табл. 12). Таблица 12. Химические свойства щелочей

Вывод: с точки зрения теории электролитической диссоциации свойства щелочей обусловлены наличием в их растворах гидроксид-ионов 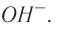
Соли:
В Соли — это электролиты, при диссоциации которых образуются катионы металлов и анионы кислотных остатков.
Химические свойства солей обусловлены свойствами ионов, содержащихся в их растворах. В результате взаимодействия солей с другими солями, щелочами или кислотами образуются, соответственно, новые соли, основания или кислоты. Эти реакции относятся к реакциям обмена. Соли вступают также в окислительновосстановительные реакции с более активными металлами (табл. 13).
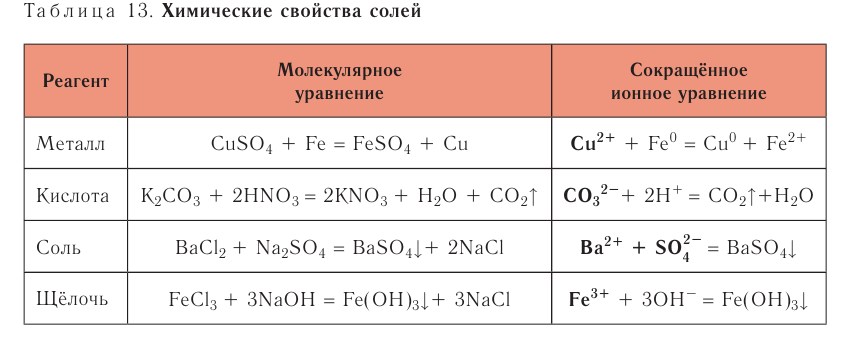
Вывод: свойства солей с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах катионов металлов и анионов кислотных остатков.
- Свойства растворов электролитов обусловлены свойствами ионов, образующихся при диссоциации этих электролитов.
- Среда растворов характеризуется водородным показателем pH.
- Свойства кислот в водных растворах обусловлены свойствами катионов водорода, образующихся в результате диссоциации кислот.
- Свойства оснований в водных растворах обусловлены свойствами гидроксид-ионов.
- Свойства солей обусловлены свойствами ионов, образующихся в результате их диссоциации.
Растворение как физико-химический процесс
Вы уже знакомы с растворами — однородными системами переменного состава. Любой раствор содержит не менее двух компонентов, один из которых растворитель, а другой — растворенное вещество.
Растворение веществ
Растворы — это не просто смеси частиц растворителя и растворенного вещества. Растворение является сложным физико-химическим процессом, при котором происходит взаимодействие частиц растворяемого вещества и растворителя. В результате контакта между частицами растворителя и растворяемого вещества последние отрываются от поверхности растворяемого вещества и благодаря диффузии распределяются в объеме растворителя. Это физическая сторона процесса. Одновременно происходит взаимодействие молекул растворителя с частицами растворяемого вещества — это химическая часть общего процесса растворения. Взаимодействие бывает настолько сильным, что приводит к образованию устойчивых продуктов.
Мы будем рассматривать в основном водные растворы. В воде могут растворяться самые разнообразные вещества. Как вам уже известно, главной причиной этого является строение молекул воды, которые представляют собой диполи благодаря наличию ковалентной полярной связи.
Тепловые явления при растворении
Растворение веществ сопровождается тепловыми эффектами. При растворении разрушаются химические связи между частицами вещества (атомами, молекулами, ионами), что требует затрат энергии. Одновременно происходит образование связей между частицами растворенного вещества и растворителя, которое сопровождается выделением энергии. При растворении газов и жидкостей теплота обычно выделяется, а при растворении некоторых твердых веществ — поглощается. Тепловой эффект растворения веществ является разницей между количеством теплоты, потраченной на разрыв химических связей между частицами растворяемого вещества (эндотермический процесс), и количеством выделившейся теплоты при взаимодействии частиц растворенного вещества и растворителя (экзотермический процесс):
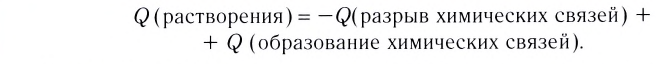
Например, при растворении в воде серной кислоты или гидроксида калия наблюдается сильное разогревание раствора. В этом случае количество теплоты, которое выделилось при химическом взаимодействии растворителя с растворяемым веществом, значительно больше количества теплоты, которое ушло на разрыв связей в молекуле серной кислоты или разрушение кристаллической решетки гидроксида калия.
Гидраты и кристаллогидраты
Химическое взаимодействие растворенного вещества с растворителем (водой) приводит к образованию соединений, которые называются гидратами. Химические формулы гидратов записываются следующим образом: 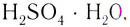
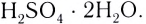
Гидратную теорию растворов предложил русский ученый Д. И. Менделеев. Он писал: «Растворы суть химические соединения, определяемые силами, действующими между растворителем и растворенным веществом. Этот процесс взаимодействия растворяемого вещества с водой называется гидратацией.
Обычно образовавшиеся гидраты непрочны и легко разрушаются.
Иногда гидратные соединения настолько устойчивы, что выделяются в виде кристаллов.
Кристаллы, в состав которых входят молекулы воды, называются кристаллогидратами, а содержащаяся в них вода — кристаллизационной.
Так, в кристаллогидрате медного купороса 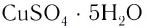 (рис. 56) с 1 моль сульфата меди(II) связано 5 моль воды, а в кристаллогидрате железного купороса —
(рис. 56) с 1 моль сульфата меди(II) связано 5 моль воды, а в кристаллогидрате железного купороса —  — 7 моль воды (табл. 12).
— 7 моль воды (табл. 12).

Лабораторный опыт:
Получение сульфата меди(II) из медного купороса
В фарфоровую чашку (или пробирку) поместите немного, на кончике шпателя, кристаллов медного купороса. Отметьте цвет кристаллов. Поставьте чашку на кольцо штатива и осторожно нагрейте ее содержимое на пламени спиртовки. Как изменился цвет кристаллов? Почему? Дайте объяснение этому явлению. Составьте уравнение химической реакции получения сульфата меди(II) из медного купороса.
После охлаждения кристаллов добавьте к ним 2—3 капли воды. Как изменился цвет кристаллов? Дайте объяснение этому изменению.
Очень важным и интересным кристаллогидратом является природный гипс. Это так называемый двухводный гипс 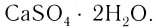 . При нагревании его до I80 °С получают алебастр, или полуводный гипс,
. При нагревании его до I80 °С получают алебастр, или полуводный гипс, 
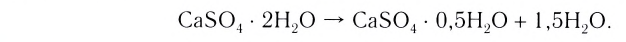
Процессы гидратации лежат в основе твердения пластично-вязких масс, образующихся в результате смешивания с водой вяжущих строительных материалов: цемента, алебастра и др. Чем большее количество кристаллизационной воды свяжется с 1 моль вещества, тем тверже и прочнее образующийся кристаллогидрат. В строительстве для получения строительного раствора нормальной вязкости массовую долю воды в смеси доводят до 30—40 %. Например, если в качестве вяжущего материала берут алебастр, то процесс образования кристаллогидрата идет по уравнению:
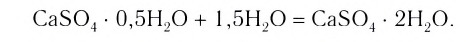
Из уравнения следует, что на 145 г полуводного гипса требуется 27 г воды, однако строители добавляют более 40 г. В процессе твердения поглощается 27 г, а остальная вода испаряется, образуя в твердом гипсе поры.
Способность веществ кристаллизоваться применяется как один из способов получения искусственных кристаллов. Если в насыщенный раствор поместить маленький кристаллик этого же вещества, то по мере испарения растворителя на поверхности кристаллика будет осаждаться растворенное вещество и образовываться большой однородный кристалл, например медного купороса (рис. 57).

Растворимость веществ в воде
Способность веществ растворяться в воде или другом растворителе называется растворимостью. По растворимости все вещества, в зависимости от своей природы, делятся на три группы: хорошо растворимые, малорастворимые, практически нерастворимые. Абсолютно нерастворимых веществ нет. Если опустить в воду стеклянную палочку, кусочек золота или серебра, то они в ничтожно малых количествах все же растворяются в воде. Поэтому их называют практически нерастворимыми.
К малорастворимым веществам относят, например, сульфат кальция, диэтиловый эфир, бензол, кислород.
Растворимые, или, как мы их назвали, хорошо растворимые, в воде вещества могут быть как твердыми (сахар, сульфат меди(II), гидроксид натрия), так и жидкими (спирт, уксусная кислота, серная кислота), и газообразными (хлороводород, аммиак).
Таким образом, растворимость зависит прежде всего от природы самого вещества.
Второй фактор, влияющий на растворимость веществ, — это температура. Как правило, растворимость твердых веществ с увеличением температуры заметно возрастает.
Растворимость газов с повышением температуры уменьшается, так как при их растворении выделяется теплота:

При повышении давления растворимость газов возрастает. Эти свойства газов учитываются при получении газированных напитков: углекислый газ растворяют в воде при пониженной температуре и повышенном давлении.
Растворимость веществ при различных температурах количественно характеризуется с помощью величины коэффициента растворимости.
Коэффициент растворимости (S) — это максимальная масса вещества (г), которое можно растворить при данной температуре в воде массой 100 г. Зависимость растворимости веществ от температуры можно показать при помощи графиков, которые называют кривыми растворимости (рис. 58).
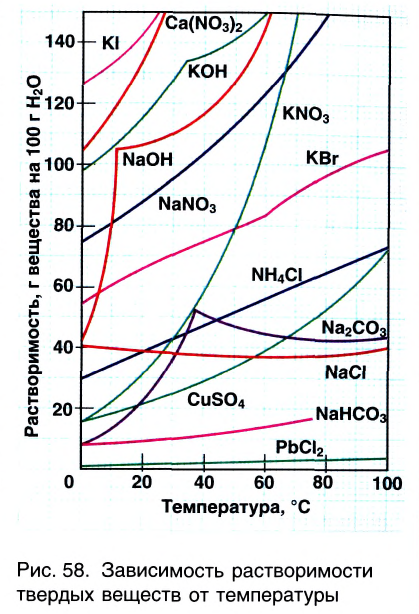
По кривым растворимости производят различные расчеты. Например, можно определить массу вещества, которое выпадает из раствора при его охлаждении. Если приготовить насыщенный при 50 °С раствор нитрата калия в 100 г воды, а затем охладить его до 20 °С, то по кривой растворимости видно, что из раствора выпадет 80 г - 30 г = 50 г соли.
Процесс выделения твердого вещества из раствора при понижении температуры называется кристаллизацией. Кристаллизация играет огромную роль в природе: приводит к образованию некоторых минералов, имеет большое значение в процессах, протекающих в почвах.
На основе кристаллизации в химии распространен метод очистки веществ, называемый перекристаллизацией.
Способы выражения состава растворов
Одной из главных характеристик любого раствора является его состав. Состав растворов выражают различными способами.
Массовая доля растворенного вещества — величина, равная отношению массы вещества к массе раствора. Например, если в растворе массой 200 г содержится растворенное вещество массой 40 г, то его массовая доля равна:
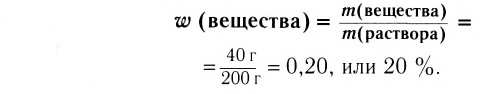
Массовая доля — величина безразмерная, выражается или в долях единицы, или в процентах.
В химии широко пользуются таким способом выражения состава растворов, как молярная концентрация вещества в растворе.
Молярная концентрация — это величина, равная отношению химического количества n ( моль) растворенного вещества к объему V ( дм3) раствора:
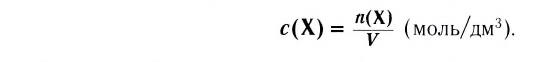
Пример №17
В растворе объемом 2 дм3 содержится гидроксид натрия массой 0,8 г. Рассчитайте молярную концентрацию гидроксида натрия в растворе.
1. Вычисляем химическое количество гидроксида натрия:
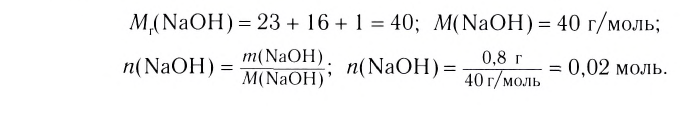
2. Находим молярную концентрацию гидроксида натрия в растворе:
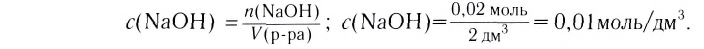
Ответ: 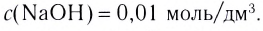
Пользоваться молярной концентрацией удобно, так как с ее помощью легко найти химическое количество вещества в определенном объеме раствора.
Важной количественной характеристикой раствора является также его плотность  — величина, равная отношению массы данного раствора к его объему:
— величина, равная отношению массы данного раствора к его объему:
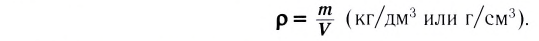
Зная эту характеристику, легко перейти от одного способа выражения состава раствора к другому.
Пример №18
Плотность раствора серной кислоты с массовой долей H2S04 20% равна 1,15 г/см3. Вычислите молярную концентрацию серной кислоты в растворе.
1. Находим массу раствора объемом 1 дм3 (1000 см3):
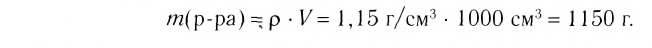
2. Вычисляем массу и химическое количество растворенного вещества (H2S04) в этом объеме раствора:
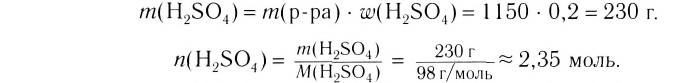
3. Определяем молярную концентрацию H2S04:
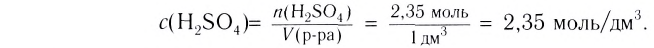
Ответ: 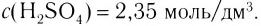
Еще одним способом выражения состава растворов является массовая концентрация вещества в растворе (Т).
Массовая концентрация вещества в растворе (Т) (г/см3) — величина, численно равная отношению массы растворенного вещества (X) к объему раствора (V) и выражается в кг/дм3 или г/см3:
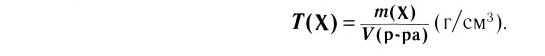
Пример №19
Определите массовую концентрацию азотной кислоты в растворе, в котором массовая доля HNO3) равна 15 %, а плотность раствора составляет 1,012 г/см3.
1. Предположим, объем раствора равен 1 дм3 (1000 см3). Находим его массу:
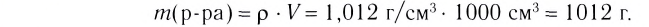
2. Вычисляем массу растворенного вещества (HN03) в этом объеме раствора:
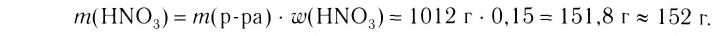
3. Определяем массовую концентрацию азотной кислоты в растворе:
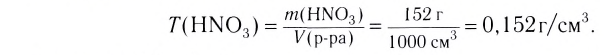
Ответ: 0,152 г/см3.
- Растворение — физико-химический процесс, включающий в себя как разрушение структуры растворяемого вещества, так и взаимодействие его частиц с растворителем.
- Растворимость веществ в воде зависит от их природы, температуры, давления.
- Количественный состав растворов можно выражать различными способами. Наиболее известные: массовая доля, молярная и массовая концентрации растворенного вещества.
Электролитическая диссоциация веществ в растворах
Вам уже хорошо известно, что существуют вещества, растворы или расплавы которых проводят электрический ток. Такие вещества называют электролитами. К электролитам относятся соли, щелочи, кислоты, т. е. соединения с ионным и ковалентным полярным типами химической связи.
Причина электропроводности растворов заключается в том, что при растворении под влиянием полярных молекул воды электролиты распадаются, т. е. диссоциируют на положительно и отрицательно заряженные частицы — ионы. Эти ионы являются переносчиками электрического тока в растворах.
Теория, объясняющая электропроводность растворов, была первоначально предложена шведским ученым С. Аррениусом в 1887 г. Однако эта теория не могла объяснить наличие тепловых эффектов при растворении, роль молекул растворителя и другие явления. В дальнейшем она была развита на основе учения о строении атомов и химической связи другими учеными. Русский ученый И. А. Каблуков дополнил теорию электролитической диссоциации положением о взаимодействии ионов с молекулами воды с образованием неустойчивых гидратов, чем увязал ее с гидратной теорией Д. И. Менделеева о взаимодействии растворенного вещества и растворителя.
Сущность теории электролитической диссоциации с современной точки зрения можно свести к следующему основному положению.
Электролиты в растворах и расплавах распадаются (диссоциируют) на разноименно заряженные частицы — ионы.
Диссоциация электролитов с ионным и ковалентным типами химической связи протекает по-разному.
Диссоциация соединений с ионным типом связи
В основе строения ионных соединений находится ионная кристаллическая решетка. Разрушение кристаллов происходит под воздействием полярных молекул воды (рис. 59).
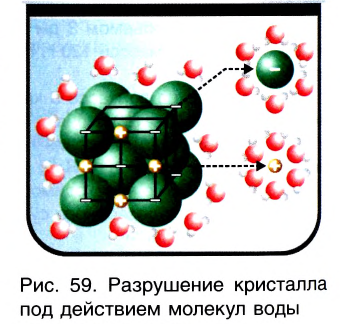
Особенностью диссоциации ионных соединений является то, что в этих веществах имеются уже готовые ионы и диполям воды остается только разрушить ионный кристалл.
К электролитам с ионным типом связи относятся основания и соли.
Основания диссоциируют в водных растворах на гидроксид-ионы и ионы металла. Например, растворимые в воде основания, которые, как вы знаете, называются щелочами, диссоциируют следующим образом:
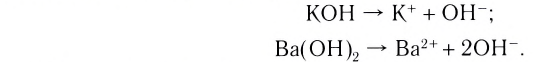
Соли диссоциируют в водных растворах на ионы металлов и кислотных остатков в результате разрушения водой их ионных кристаллов:
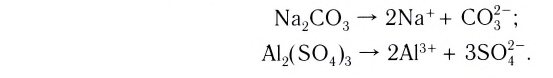
Диссоциация соединений с ковалентным полярным типом связи
Кислоты относятся к веществам, в молекулах которых атомы связаны ко-валентными полярными связями. Говоря об электролитах с таким типом связи, мы будем иметь в виду только растворимые органические и неорганические кислоты.
Кислоты имеют молекулярное строение, и готовых ионов в них нет, но, как правило, все молекулы кислот полярные. Особенностью диссоциации кислот является то, что диполи воды притягиваются к разноименно заряженным концам полярной молекулы кислоты, а затем как бы растягивают ее до образования ионов (рис. 60).
Образовавшийся при диссоциации кислот ион водорода гидратируется молекулой воды и при этом образуется сложный ион Н+(Н20), или Н30+ — ион гидроксония. Установлено, что механизм возникновения ковалентной связи в ионе гидроксония донорно-акцепторный:
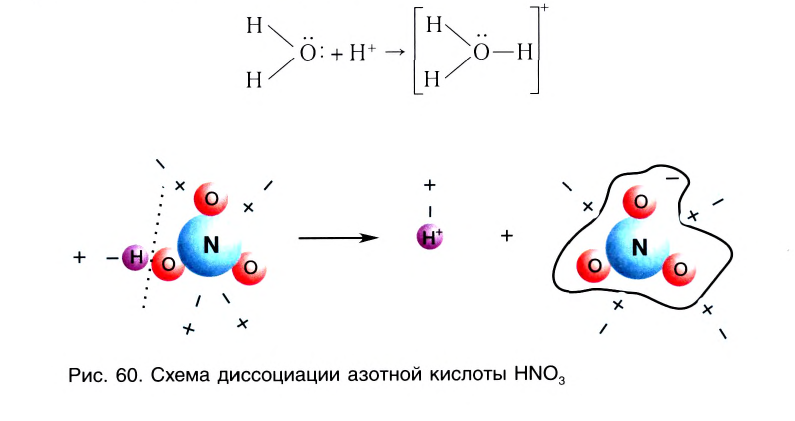
Молекула воды — донор электронной пары, ион водорода — ее акцептор.
Однако в дальнейшем для упрощения записей в уравнениях ионных реакций мы будем записывать гидратированный ион водорода просто как Н+.
Кислоты диссоциируют в водных растворах на ионы водорода и кислотyых остатков:

По числу атомов водорода кислоты делятся на одно-, двух-, трехосновные. Многоосновные кислоты диссоциируют ступенчато. По первой ступени диссоциация протекает обычно легко, последующие ионы водорода отщепляются менее активно:
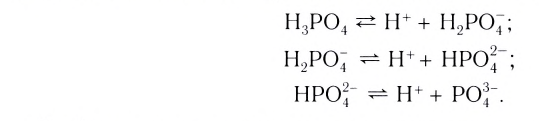
Свойства ионов отличаются от свойств атомов и молекул, потому что они обладают различным электронным строением.
Ионы, как известно, образуются в результате отдачи или присоединения электронов атомами, что и является причиной наличия заряда у ионов. Так же, как ионы водорода, все ионы в водных растворах гидратируются, т. е. взаимодействуют с молекулами воды. Гидратация отчасти затрудняет обратное соединение ионов (ассоциацию). Гидратированные ионы имеют как постоянное, так и переменное число молекул воды. При написании формул гидратированных ионов их можно обозначать:
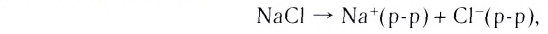
однако для простоты написания указания в скобках опускают.
Свойства заряженных ионов отличаются от свойств электронейтральных атомов. Ионы натрия Na+ не разлагают воду, а нейтральные атомы натрия Naо взаимодействуют с ней с выделением водорода.
Ионы хлора Cl— не имеют ни цвета, ни запаха, не являются токсичными, т.е. не проявляют свойств газообразного хлора. В электрическом поле ионы перемещаются к разноименно заряженным электродам. Положительно заряженные иены направляются к катоду, и их называют катионами. Отрицательно заряженные ионы называют анионами, так как они перемещаются к аноду (рис. 61).
Сильные и слабые электролиты
Электролиты диссоциируют на ионы в различной степени. Полнота распада ia-висит от природы электролита и растворителя, температуры, концентрации растворенного вещества.
Количественно диссоциация характеризуется степенью диссоциации 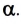
Степень диссоциации — величина, равная отношению числа распавшихся на ионы молекул (или формульных единиц (ФЕ)) к общему числу растворенных молекул (или ФЕ):
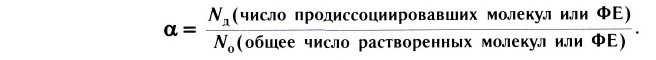
Так как число частиц и их химическое количество связаны между собой соотношением  то
то

где n — химическое количество соответствующих молекул или формульных единиц.
Степень диссоциации выражается в долях единицы или процентах. Например, если степень диссоциации уксусной кислоты в растворе с молярной концентрацией 0,1 моль/дм3 равна 0,015 (1,5 %), то это означает, что из 1000 молекул только 15 распалось на ионы.
Степень диссоциации обычно определяют экспериментальным путем.
По своей природе электролиты можно разделить на сильные ( ) и слабые
) и слабые 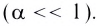
К сильным электролитам относятся соединения с ионным и ковалентным полярным типами связи. Ионные соединения диссоциируют на катионы металлов и анионы кислотных остатков (соли) или гидроксид-ионы (щелочи). Сильными электролитами с ковалентным типом связи являются кислоты: серная, соляная, азотная, которые поэтому так и называют — сильные кислоты. В растворах сильных электролитов практически отсутствует процесс обратного объединения ионов, поэтому диссоциацию таких электролитов записывают в виде уравнения распада со стрелкой в одном направлении:
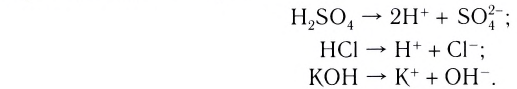
К слабым электролитам относятся соединения с ковалентной малополярной связью. При растворении в воде они лишь частично диссоциируют на ионы. Степень диссоциации слабых электролитов очень мала 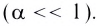 К ним относятся большинство органических кислот, например уксусная кислота СН3СООН, многие неорганические кислоты, такие, как сероводородная кислота H2S, сернистая кислота H2S03, плавиковая кислота HF. Двухосновные слабые кислоты диссоциируют практически только по первой ступени:
К ним относятся большинство органических кислот, например уксусная кислота СН3СООН, многие неорганические кислоты, такие, как сероводородная кислота H2S, сернистая кислота H2S03, плавиковая кислота HF. Двухосновные слабые кислоты диссоциируют практически только по первой ступени:

В растворах слабых электролитов непрерывно протекает процесс диссоциации молекул на ионы и обратный процесс объединения ионов в молекулы. Между этими двумя процессами устанавливается динамическое равновесие.
Таким образом, можно сказать, что диссоциация слабых электролитов — процесс обратимый. Степень диссоциации таких электролитов растет с уменьшением концентрации раствора, так как уменьшается вероятность встречи ионов в растворе. Слабым электролитом является вода:

Степень диссоциации воды при 25 °С равна примерно 1 • 10-7. Это означает, что только одна ее молекула из десяти миллионов распадается на ионы.
- Ионы имеют свойства, отличные от свойств атомов и молекул.
- Электролиты — это вещества, водные растворы или расплавы которых проводят электрический ток. Они делятся на сильные и слабые.
- Количественной характеристикой электролитической диссоциации является степень диссоциации.
Реакции ионного обмена в водных растворах
Поскольку электролиты в растворах распадаются на ионы, то согласно теории электролитической диссоциации реакции в водных растворах электролитов — это, как правило, реакции между ионами. Так как растворы сильных электролитов практически не содержат недиссоциированных молекул, а только анионы и катионы, то логично предположить, что они и будут взаимодействовать между собой. Химические реакции между ионами в растворах электролитов называются ионными реакциями.
Такие реакции обычно относятся к обменному типу, поэтому их часто еще называют реакциями ионного обмена.
Реакции ионного обмена в растворах электролитов протекают только в том случае, если образуются труднорастворимые вещества (осадки), газообразные или малодиссоциированные вещества. К последним обычно относят воду Н20 и другие слабые электролиты, например H2S, H2C03, H2S03, HN02 и др.
Уравнения таких процессов составляют либо в обычном (молекулярном) виде, либо в полном ионном или сокращенном ионном виде. При этом сумма электрических зарядов ионов левой и правой частей уравнения химической реакции должны быть равны.
Составление уравнений ионных реакций
Составление уравнений в ионном виде требует соблюдения определенного порядка действий.
1. Составляем уравнение реакции в молекулярном виде, расставляем коэффициенты:
2. Переписываем это уравнение в ионном виде, изображая сильные электролиты в виде ионов, а малодиссоциированное полученное вещество — воду — в молекулярном:
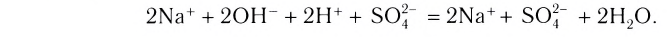
3. Исключаем из обеих частей уравнения не участвующие в реакции ионы и записываем сокращенное ионное уравнение, которое и отображает сущность химической реакции:
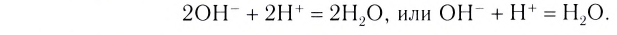
4. Делаем вывод, что сущность данной реакции заключается в связывании катионов водорода гидроксид - ионами, приводящем к образованию малодиссоциированного вещества — воды.
Если в результате реакции получается осадок, обозначаем это стрелкой, направленной вниз ( ), если газ — стрелкой, направленой вверх (
), если газ — стрелкой, направленой вверх ( ).
).
Пример №20
Составьте молекулярное и ионное уравнения химической реакции растворов хлорида железа (III) и гидроксида натрия.
Составляем молекулярное уравнение реакции:
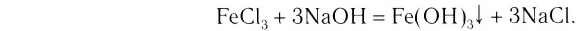
Составляем ионное уравнение реакции:
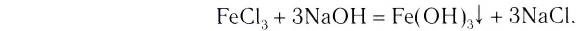
Записываем сокращенное ионное уравнение реакции:
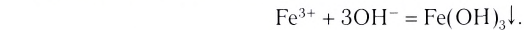
В результате связывания ионов Fe3+ и трех гидроксид-ионов ОН образовался осадок нерастворимого основания гидроксида железа(III) (рис. 62).
Пример №21
Составьте молекулярное и ионное уравнения реакции между раствором сульфида натрия и соляной кислотой.
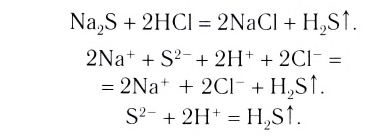
Образование газообразного продукта реакции сероводорода — это результат взаимодействия катионов водорода и сульфид-аниона.
Пример №22
Установите, взаимодействуют ли между собой растворы хлорида натрия и нитрата калия.
Сокращенное ионное уравнение составить невозможно, так как соединения ионов не происходит и реакция не протекает.
Ионными уравнениями можно выражать любые химические реакции, протекающие в растворах электролитов. Знание условий протекания реакций очень важно для характеристики свойств веществ, получения газов, нерастворимых веществ, нейтрализации кислот и оснований, прогнозирования возможности протекания реакций.
При взаимодействии растворов двух разных электролитов химическая реакция возможна только при связывании ионов с образованием газа, осадка или слабого электролита.
Кислоты, основания, соли в свете теории электролитической диссоциации
Раствор каждого вещества обладает определенными свойствами. Если учитывать, что в растворах электролитов преобладают ионы, на которые диссоциирует электролит, то логично, что свойства растворов — это свойства данных ионов. Некоторые ионы в растворах очень легко обнаружить. Например, катионы серебра(I) Ag+ хорошо связываются с анионами хлора Cl— с образованием белого творожистого осадка хлорида серебра(1) AgCl .
Взаимодействуют между собой с образованием новых веществ такие пары ионов, как 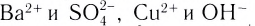
Однако ионы в растворах можно обнаружить не только по их связыванию другими ионами. Катионы водорода и гидроксид-ионы определяют при помощи индикаторов. Как вы уже хорошо знаете, в присутствии кислот (катионов водорода) лакмус изменяет окраску на красную, метилоранж — на малиновую.
Щелочи (гидроксид-ионы) изменяют окраску фенолфталеина на малиновую, метилоранжа — на желтую, лакмуса — на синюю.
Дистиллированная вода окраску индикаторов не изменяет, хотя ее молекулу можно представить как продукт связывания ионов Н+ и ОН— . Измерения электропроводности воды показали, что она относится к очень слабым электролитам, в 1 дм3 ее при 25 °С концентрации ионов водорода и гидроксид-ионов одинаковы и составляют по 10-7 моль/дм3.
Водородный показатель:
Концентрации ионов Н+ и ОН— в воде и любом водном растворе взаимосвязаны. Увеличение концентрации ионов Н+ (например, при добавлении кислоты) вызывает уменьшение концентрации ионов ОН— и наоборот.
Растворы, в которых концентрация ионов водорода равна концентрации гидрок-сид-ионов, называют нейтральными. Если концентрация ионов водорода больше: 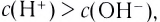 то среда в растворе кислотная, если меньше:
то среда в растворе кислотная, если меньше: 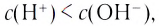 — раствор щелочной, так как концентрация гидроксид-ионов будет больше.
— раствор щелочной, так как концентрация гидроксид-ионов будет больше.
Кислотность растворов обычно выражают через концентрацию ионов водорода Н+. Однако выражать такими цифрами, как 10—8 моль/дм3 или 10—4 моль/дм3, концентрацию ионов водорода неудобно, и в химии применяют водородный показатель рН, который численно равен показателю степени молярной концентрации (десятичному логарифму), взятому с противоположным знаком:

Например, при молярной концентрации ионов Н+, равной 10—5 моль/дм3, рН равен 5, а при 10—8 моль/дм3 рН равен 8. Водородный показатель характеризует кислотность или щелочность раствора. Для воды при 25 °С 
Чем рН меньше 7, тем больше кислотность раствора. Чем рН больше 7, тем больше щелочность раствора. При рН = 7 среда нейтральная. Это означает, что молярные концентрации ионов водорода Н+ и гидроксид-ионов ОН— равны (рис. 63).
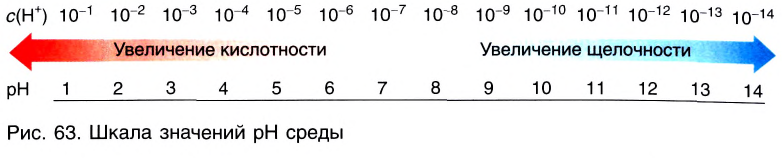
► Понятие «водородный показатель» было введено датским химиком Се ре нее ном в 1909 г. Буква р — начальная буква датского слова «потенц» — сила, а буква I I — символ водорода.
Величина рН играет большую роль в промышленности, химических и биологических процессах. Большинство из них может протекать только при определенной кислотности среды. Например, для нормального развития растений необходимо уменьшать повышенную кислотность почв их известкованием. На молочных комбинатах свежесть молока определяется также величиной рН.
В человеческом организме различные жидкости имеют разную величину рН: желудочный сок — 1,7 (сильнокислотная среда), кровь — 7,4 (слабощелочная среда), слюна — 6,9 и слезы — 7,0 (нейтральная). Величина рН является показателем состояния здоровья человека.
Величина рН измеряется в лаборатории при помощи индикаторов, их окраска потом сравнивается со специальной рН-шкалой (рис. 64). В научных исследованиях, в производственной практике величину рН определяют с помощью специальных приборов, которые так и называют — рH-метры (рис. 65).


Кислоты:
Кислоты — это электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода.
Таким образом, мы можем сказать, что свойства кислот обусловлены реакциями, в которые вступают катионы водорода. Обнаружить ионы водорода в растворе кислоты можно при помощи индикаторов. Лакмус в растворах кислот меняет фиолетовый цвет па красный, метилоранж — также на красный, в чем вы убедились, проведя лабораторный опыт. Кислоты также вступают в химические реакции с металлами, стоящими в ряду активноcти до водорода, основными оксидами, основаниями и солями, образованными более слабыми кислотами.
Рассмотрим эти свойства на примере серной и соляной кислот (табл. 13).

Вывод: свойства кислот с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах катионов водорода Н+.
Основания:
Основания — это электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Основания, растворимые в воде, как известно, называют щелочами. При электролитической диссоциации они образуют отрицательно заряженные гидроксид-ионы ОН—.
Присутствие щелочей в растворах обнаруживается при помощи индикаторов. Фенолфталеин в растворах щелочей — малиновый, лакмус — синий, метилоранж — желтый.
Изменение окраски лакмуса из фиолетовой в синюю происходит в интервале рН от 8 до 14.
Щелочи — очень активные вещества, они вступают в химические реакции со многими простыми и сложными веществами. Рассмотрим некоторые из этих реакций (табл. 14).

Вывод: свойства щелочей с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах гидроксид-ионов ОН .
Соли:
Соли — это электролиты, при диссоциации которых образуются катионы металлов и анионы кислотных остатков.
Свойства солей обусловлены способностью катионов металлов и анионов кислотных остатков связываться с ионами, противоположными по заряду, с образованием осадков, т. е. нерастворимых солей и оснований или более слабых кислот, которые могут разлагаться (например, угольная кислота) или выделяться в виде газа (например, сероводород).
Это реакции растворимых солей между собой, со щелочами, кислотами, металлами, более активными, чем металлы, образующие соль (табл. 15). Реакция с металлами протекает в растворах и расплавах и относится к окислительно-восстановительным.

Вывод: свойства солей с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах катионов металлов и анионов кислотных остатков, их образующих.
- Свойства растворов электролитов обусловлены ионами, образующимися при их диссоциации.
- Свойства кислот в водных растворах обусловлены ионами водорода, образующимися при диссоциации кислот.
- Свойства оснований в водных растворах обусловлены гидроксид-ионами.
- Кислотный и основный характер растворов характеризуется водородным показателем рН.
Гидролиз солей
Вода является не только универсальным растворителем, но и активным реагентом, способным разлагать растворяемые вещества, действуя на них как кислота:
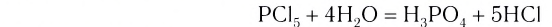
или как основание:
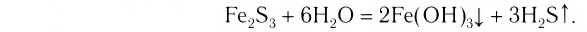
Обменные реакции взаимодействия растворенных веществ с водой называются гидролизом.
Слово «гидролиз» происходит от греческих слов: «гидро» — вода и «лизис» — разложение.
Опыт показывает, что растворы средних солей (т. е. не содержащих ионов Н+ или ОН—) могут иметь не только нейтральную, но и кислую или щелочную среду, хотя в их составе нет ионов, обусловливающих такую среду. Эти факты объясняются взаимодействием солей с водой. Такие процессы, как и обычные реакции солей с кислотами или основаниями, происходят по обменному механизму.
Поскольку соли в растворе находятся в виде ионов, то очевидно, что с водой взаимодействуют именно ионы.
Любую соль можно представить как продукт процесса нейтрализации кислоты 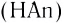 основанием
основанием 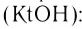
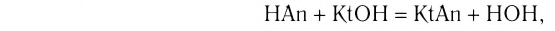
где Kt — катион, a An — анион. Следовательно, гидролиз солей — это процесс, обратный реакции нейтрализации. Необходимым условием его протекания является образование слабого электролита — слабой кислоты или слабого основания:
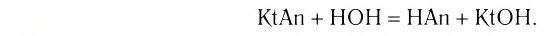
Гидролиз соли — это обменное взаимодействие соли с водой, приводящее к образованию слабодиссоциирующих частиц.
Условно разделив кислоты и основания на сильные и слабые, нетрудно убедиться в том, что при образовании солей возможны четыре варианта сочетания взаимодействующих кислот и оснований:
- соль сильного основания и сильной кислоты;
- соль сильного основания и слабой кислоты;
- соль слабого основания и сильной кислоты;
- соль слабого основания и слабой кислоты.
Рассмотрим, как эти соли могут взаимодействовать с водой.
Соли сильного основания и сильной кислоты  гидролизу не подвергаются, так как их ионы не могут при взаимодействии с водой образовать слабые электролиты. Ионы Н+ и ОН— из воды не высвобождаются, и среда раствора будет нейтральной (рН = 7).
гидролизу не подвергаются, так как их ионы не могут при взаимодействии с водой образовать слабые электролиты. Ионы Н+ и ОН— из воды не высвобождаются, и среда раствора будет нейтральной (рН = 7).
Соли сильного основания и слабой кислоты (KCN, Na2C03, Na2S, CH3COONa и др.) подвергаются гидролизу по аниону.
При растворении в воде соль, например ацетат натрия CH3COONa, диссоциирует на ионы:
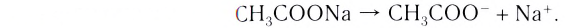
Из двух видов образовавшихся ионов ионы натрия взаимодействовать с водой не будут, так как продуктом такого взаимодействия был бы гидроксид натрия NaOH, являющийся сильным электролитом:
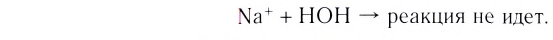
Ацетат-анионы СН3СОО при взаимодействии с водой образуют слабый электролит, каким является уксусная кислота:
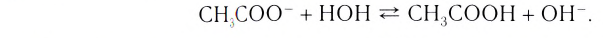
Освободившиеся гидроксид-ионы и обусловливают щелочную среду раствора (рН > 7). Уравнение гидролиза этой соли в молекулярной форме:
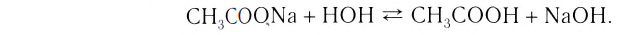
Для большинства солей гидролиз — процесс обратимый, поэтому в уравнениях реакций гидролиза ставится знак обратимости 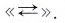
Соли слабого основания и сильной кислоты (NH4C1, A1Cl3, Cu(N03)2 и др.) подвергаются гидролизу по катиону.
При растворении в воде соль, например хлорид аммония NH4С1, диссоциирует на ионы:

Из двух видов образовавшихся ионов ионы хлора взаимодействовать с водой не будут, так как продуктом такого взаимодействия был бы сильный электролит — соляная кислота:
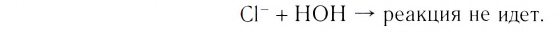
Ионы аммония NH4 при взаимодействии с водой образуют слабый электролит 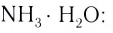
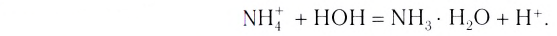
При этом высвобождаются ионы водорода H+, которые и обусловливают кислую среду раствора (рН < 7). Уравнение реакции гидролиза этой соли в молекулярной форме:
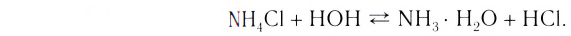
К солям слабого основания и слабой кислоты относятся соли типа NH4CN, Al2S3, AgF и др. Рассмотрим, как протекает их гидролиз на примере цианида аммония. Уравнение диссоциации соли:

С водой взаимодействуют и катионы, и анионы:
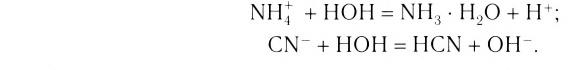
Суммируя эти два процесса и учитывая, что образующиеся ионы Н+ и ОН— нейтрализуют друг друга с образованием молекулы воды, можно записать уравнение гидролиза соли в молекулярной форме:
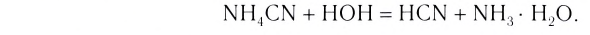
Характер среды растворов таких солей определяется не образующимися ионами Н+ или ОН—, а тем, какой из двух слабых электролитов является более сильным. И гидрат аммиака, и циановодородная кислота являются слабыми электролитами, однако гидрат аммиака диссоциирует несколько сильнее, чем HCN, поэтому в растворе образуется больше гидроксид-ионов, которые обусловливают щелочную среду, рН > 7.
Гидролиз солей — частный случай распространенного в природе явления гидролиза как неорганических, так и органических соединений. Гидролиз белков, жиров и углеводов — одна из важнейших составных частей усвоения продуктов питания организмами. В неживой природе гидролиз — один из процессов, в результате которого происходит разрушение одних горных пород и образование других, в том числе и почвообразующих.
- Гидролиз соли — это обменное взаимодействие соли с водой, приводящее к образованию слабодиссоциирующих частиц.
- Соли, образованные сильными основаниями и сильными кислотами, в реакции гидролиза не вступают.
- Соли, образованные сильными основаниями и слабыми кислотами, подвергаются гидролизу по аниону. Среда растворов — щелочная.
- Соли, образованные слабыми основаниями и сильными кислотами, подвергаются гидролизу по катиону. Среда в их растворах — кислая.
Гидролиз солей, содержащих многозарядные катионы и анионы
Как уже было сказано, гидролиз солей качественно можно рассматривать как результат ион-дипольного взаимодействия ионов соли с их гидратной оболочкой (диполями воды) и упрощенно представить следующими схемами:
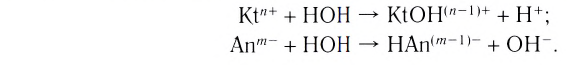
Гидролиз обусловлен образованием малодиссоциирующих частиц 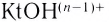 и
и 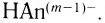 Чем больше заряд и меньше радиус ионов соли, тем сильнее их электростатическое взаимодействие с водой, слабее диссоциация образующихся частиц
Чем больше заряд и меньше радиус ионов соли, тем сильнее их электростатическое взаимодействие с водой, слабее диссоциация образующихся частиц 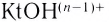 и
и 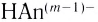 и в большей степени происходит гидролиз.
и в большей степени происходит гидролиз.
Влияние на молекулы воды невелико у катионов щелочных и щелочноземельных металлов, однозарядных анионов 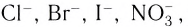 у некоторых двухзарядных анионов, например
у некоторых двухзарядных анионов, например 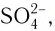 поэтому соли, образованные такими частицами, гидролизу не подвергаются. Большинство остальных многозарядных ионов (анионы слабых кислот и катионы слабых оснований) подвержены сильному гидролизу, который протекает в несколько стадий, ступенчато.
поэтому соли, образованные такими частицами, гидролизу не подвергаются. Большинство остальных многозарядных ионов (анионы слабых кислот и катионы слабых оснований) подвержены сильному гидролизу, который протекает в несколько стадий, ступенчато.
Рассмотрим в качестве примеров гидролиз солей, содержащих многозарядный катион (А1С13) и многозарядный анион (Na2CO3).
Гидролиз по катиону соли слабого основания и сильной кислоты (А1С13)
Между малым по размеру, но имеющим большой заряд катионом алюминия А13+ и молекулами воды происходит интенсивное ион-дипольное взаимодействие, приводящее к деформации молекул воды и последующей диссоциации:
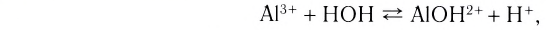
или в молекулярной форме:
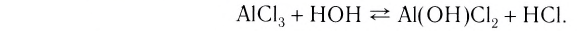
Гидролиз по второй и последующим ступеням практически не происходит из-за накопления в растворе ионов Н+, которые подавляют этот процесс. Поэтому при растворении соли А1С13 в воде не происходит образование осадка А1(ОН)3.
Гидролиз по аниону соли сильного основания и слабой кислоты (Na2CO3)
Подобным образом может происходить и гидролиз многозарядного аниона. Только в этом случае в растворе накапливаются не ионы Н+, а ионы ОН—:
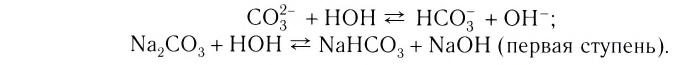
Как и в предыдущем случае, гидролиз по второй ступени практически не происходит из-за накопления в растворе ионов ОН—, которые подавляют этот процесс. Поэтому при растворении в воде соды Na2C03 углекислый газ не выделяется.
Гидролиз по катиону и по аниону соли слабого основания и слабой кислоты (Al2S3)
Гидролиз в данном случае протекает довольно интенсивно. Образующиеся при гидролизе ионы Н+ и ОН— связываются в молекулы воды, что усиливает гидролиз по аниону и катиону.
Если же продукты гидролиза уходят из сферы реакции (образуется осадок или выделяется газ), то гидролиз может протекать практически необратимо, приводя к полному разложению соли:
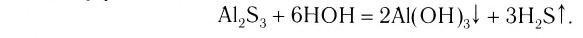
Поэтому такие соли просто не могут существовать в водном растворе. В таблице растворимости об этом свидетельствует прочерк в соответствующей клетке, например для 
По этой же причине, смешивая водные растворы хлорида алюминия и сульфида калия, нельзя получить осадок сульфида алюминия:
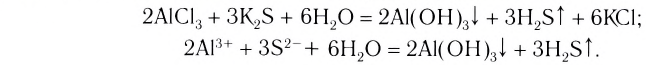
Соли такого типа из-за полного гидролиза нельзя получить в растворах, часто их получают при непосредственном взаимодействии металла и неметалла:

Факторы, влияющие на процесс гидролиза:
Концентрация соли. Поскольку гидролиз — процесс обратимый, то добавление воды в раствор будет способствовать смешению этой равновесной реакции вправо, т. е. разбавление соли усиливает ее гидролиз.
Температура. Все реакции нейтрализации идут с выделением теплоты. Следовательно, гидролиз — процесс эндотермический:
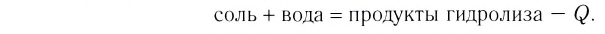
Согласно принципу Ле-Шателье повышение температуры для таких процессов способствует смешению равновесия вправо, т. е. усиливает гидролиз соли.
Влияние кислот и оснований. Процессы гидролиза солей сопровождаются выделением ионов Н+ или ОН—. Поэтому добавление кислоты к раствору соли, гидролиз которой проходит по катиону, т. е. с образованием ионов Н+, смещает равновесие обратимого процесса влево, процесс гидролиза подавляется. Добавление к этому же раствору щелочи, наоборот, приводит к смещению равновесия вправо, так как ионы ОН— будут связывать ионы Н+ в молекулы воды, т. е. гидролиз усилится.
В случае раствора соли, подвергающейся гидролизу по аниону, добавление кислоты или щелочи производит противоположный эффект.
Свойство солей подвергаться гидролизу важно учитывать при работе с ними в лабораториях и на производстве. Желательно готовить растворы непосредственно перед их использованием или некоторые соли лучше использовать в сухом виде. Если необходимо долго хранить раствор, можно добавить в него несколько капель кислоты (или щелочи), которые ослабят гидролиз. Например, при необходимости длительного хранения раствора сульфата меди(II), гидролиз которого протекает по катиону, в раствор добавляют несколько капель серной кислоты. Все соли хранят в посуде с плотно прилегающими крышками, чтобы воспрепятствовать попаданию влаги из воздуха.
- Гидролиз солей многозарядных катионов и анионов протекает ступенчато, в основном по первой ступени.
- Если продукты гидролиза уходят из сферы реакции (образуется осадок или выделяется газ), то гидролиз протекает практически необратимо, приводя к полному разложению соли.
- Разбавление и нагревание раствора соли, добавление кислот или оснований усиливает ее гидролиз.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |