Теория электролитической диссоциации в химии - формулы и определение с примерами
Содержание:
Электролитическая диссоциация:
По электрической проводимости вещества делятся на две группы.
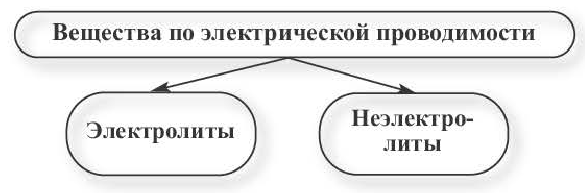
Вещества, водные растворы и расплавы которых проводят электрический ток, называются электролитами.
Na2SO4, KNO3, CuCl2, Al2(SO4)3, HCl, HBr, HI, HNO3, H3PO4, H2SO4 и др.
Вещества, водные растворы и расплавы которых не проводят электрический ток, называются неэлектролитами. Нерастворимые в воде неорганические вещества (H2SiO3, SiO2, AgCl, CaSO4 и др.), чистая вода, большинство органических веществ неэлектролиты.
Процесс распада электролитов на ионы при растворении их в воде или расплавлении называется электролитической диссоциацией.
Основные теоретические положения электролитической диссоциации дал в 1887 году шведский ученый Сванте Аррениус. Современная теория электролитической диссоциации состоит из трех основных положений:
1) Электролиты в растворе и в расплаве распадаются (диссоциируют) на ионы, обладающие положительным или отрицательным зарядом
HNO3  H+ + NO3 Na2SO4
H+ + NO3 Na2SO4  2Na+ + SO
2Na+ + SO
Ионы в растворе находятся в беспорядочном движении в разных направлениях.
2) Под воздействием электрического тока ионы движутся направленно: положительно заряженные ионы направляются к катоду, а отрицательно заряженные ионы - к аноду. Поэтому положительно заряженные ионы называются катионами, а отрицательно заряженные ионы анионами.
3) Диссоциация - обратимый процесс: наряду с распадом молекул происходит также и соединение — ассоциация ионов.
KA  K+ +А
K+ +А
Ионы и нейтральные атомы отличаются друг от друга как по строению, так и по свойствам. Например:
| 11Na0l s2∕2s22p6∕3s1 Электронная формула атома натрия |
11Na+ls2∕2s22p6/ Электронная формула иона натрия |
| 11Na0l)2e 2)8e 3)1е Схема строения атома натрия |
11Na+l)2e 2)8е Схема строения иона натрия |
| Восстановитель | Окислитель |
Несмотря на все это, С.Аррениус не смог полностью раскрыть сущность процесса электролитической диссоциации. Он не учитывал роль молекул растворителя и полагал, что в водном растворе находятся свободные ионы. При диссоциации электролитов в растворе образуются положительно и отрицательно заряженные частицы, состоящие из одного или нескольких атомов.
| Катионы | Анионы |
| LI+, Na+, K+, Be2+, Ca2+, Mg2+, Fe2+, Fe3+, Cu2+,Hg2+, Ag+ | CO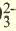 , Cl, S2-, SO , Cl, S2-, SO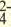 , NO3 , SiO , NO3 , SiO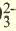 , ClO , ClO2 , ClO , ClO2 |
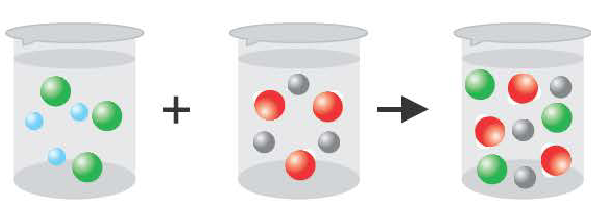
Причиной разложения электролита на ионы является его взаимодействие с полярными молекулами воды. При растворении в воде любой соли, например, кристаллов хлорида натрия, отрицательные полюсы полярных молекул воды притягиваются к положительно заряженным ионам натрия Na+, а положительные полюсы к отрицательно заряженным хлорид-ионам Cl . В результате растворения в воде ионы отщепляются от кристалла и, перейдя в раствор, гидратируются.
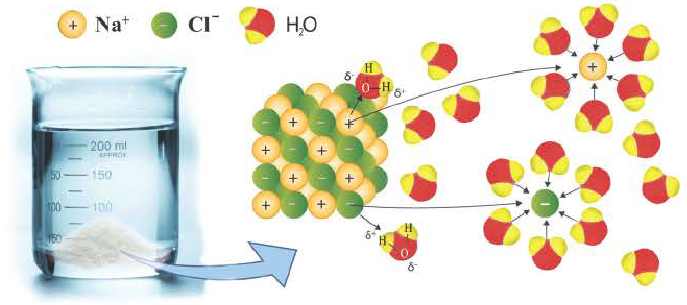
Диссоциация водного раствора хлорида натрия
Наряду с веществами, кристаллическая решетка которых имеет ионное строение, молекулы с полярной ковалентной связью также в воде распадаются на ионы. При растворении в воде хлорида водорода (хлороводорода) с полярно-ковалентной связью под действием полярных молекул воды связь между атомами разрывается. Молекула хлорида водорода распадается на два гидратированных иона. Электронная пара переходит к атому хлора, в результате полярная ковалентная связь превращается в ионную связь.
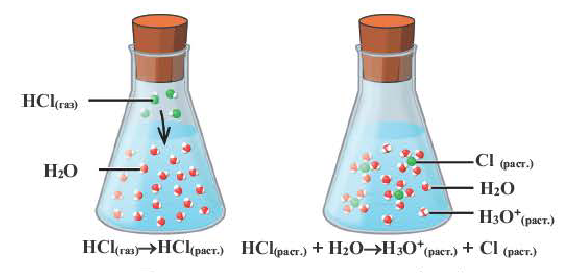
Диссоциация молекулы хлороводорода
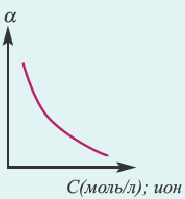
Процесс диссоциации характеризуется степенью диссоциации.
Отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе, называется степенью диссоциации и обозначается знаком а (альфа).
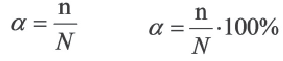
Здесь а показывает степень диссоциации,n число диссоциированных молекул, N- общее число растворенных молекул.
Величина а принимает значения между 0÷1, при выражении в процентах между 0÷100%.
Если α=0, значит, диссоциация не произошла.
Если α=1 или а= 100%, значит, электролит полностью диссоциировал на ионы.
Величина n может принимать разные значения от 0 до N.
Если количество электролита дается в молях:
α= vдис./vобщ. или α=vобщ . 100%
vобщ. — общее растворенное молярное количество вещества.
vдис. — диссоциированное молярное количество вещества.
По значению степени диссоциации электролиты делят на три группы.
| Сильные Электролиты | Электролиты средней силы | Слабые электролиты |
| a ≥ 30% | a=3 ÷ 30% (или 0,03 ÷ 0,3) |
a 3% 3%(или a  0,03) 0,03) |
| Щелочи: LiOH, NaOH, КОН, RbOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 Растворимые в воде соли, сильные кислоты | Mg(OH)2, H3PO4, H2C2O4 (щавелевая кислота) |
NH4OH, H2CO3, H2S, HCN, H2O, CH3COOH и другие органические кислоты |
Электролиты, которые при растворении в воде или расплаве полностью диссоциируются на ионы, называются сильными электролитами.
Электролиты, которые при растворении в воде или расплавлении частично диссоциируются на ионы, называются слабыми электролитами.
Факторы, влияющие на степень диссоциации
Значение степени диссоциации зависит от ряда факторов.
Природа электролита (характер связи в молекуле электролита). Слабые и средней силы электролиты диссоциируют в растворе частично, а сильные электролиты полностью.
Природа растворителя
Диэлектрическая постоянная показывает, во сколько раз сила взаимодействия между двумя электрическими зарядами, находящимися в определенной среде, меньше по отношению к вакууму. Поскольку диэлектрическая постоянная воды (проникающая способность) при 20oC высокая, способность ионизации также сравнительно высокая. Численное значение ее диэлектрической постоянной (81) показывает, что сила взаимодействия между ионами в растворе с водной средой в 81 раз слабее по сравнению с их силой взаимодействия в кристалле. Если в растворе, приготовленном с одинаковой концентрацией, в качестве среды берется вода, то степень диссоциации бывает сравнительно больше по отношению к растворителям.
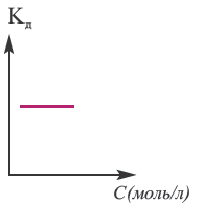
Концентрация раствора электролита. При уменьшении концентрации раствора (т.е. разбавлении раствора), вероятность встречи ионов уменьшается и равновесие смещается в сторону ионизации (степень диссоциации повышается). При уменьшении числа столкновений между ионами в разбавленных растворах в заметной степени снижается и скорость образования молекул. Это, в свою очередь, способствует смещению равновесия в сторону диссоциации и повышению степени диссоциации. Значит, степень диссоциации находится в обратной зависимости от концентрации электролита.
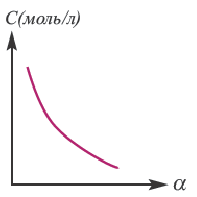
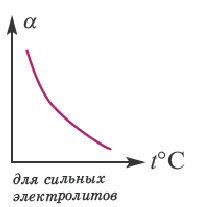
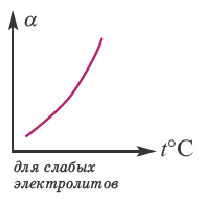
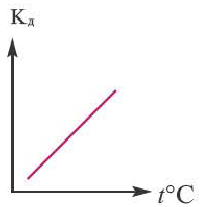
Влияние температуры
В процессе диссоциации электролитов в небольшом количестве поглощается или выделяется тепло. Обычно нагревание раствора на IoC усиливает процесс диссоциации большинства электролитов на 0,05%. При повышении температуры усиливается и электрическая проводимость электролита. Однако это связано как с понижением степени гидратации ионов и вязкости среды, так и с повышением скорости движения ионов. В этом отношении вода занимает особое место. Диссоциация воды эндотермический процесс, который протекает с затратой 57,3 кДж теплоты. Вот почему с повышением температуры повышается и степень диссоциации воды. При нагревании раствора сильных электролитов степень диссоциации понижается, а при нагревании слабых электролитов степень диссоциации повышается.
Влияние концентрации ионов. Повышением или понижением концентрации ионов, образованных в результате диссоциации, можно сместить равновесие. Например, NH4OH диссоциирует на ионы в воде по следующему
уравнению:
NH4OH NН
NН + ОН
+ ОН
При добавлении в раствор немного NH4CI концентрация иона NH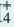 повышается и равновесие смещается влево (в сторону исходных веществ). Такое смещение равновесия подчинено принципу Ле-Шагелье. При устранении из системы равновесия одного из ионов, образовавшихся в растворе, степень диссоциации повышается. Следовательно, при добавлении в раствор слабого электролита, содержащего в составе одноименные ионы, степень диссоциации должна понижаться.
повышается и равновесие смещается влево (в сторону исходных веществ). Такое смещение равновесия подчинено принципу Ле-Шагелье. При устранении из системы равновесия одного из ионов, образовавшихся в растворе, степень диссоциации повышается. Следовательно, при добавлении в раствор слабого электролита, содержащего в составе одноименные ионы, степень диссоциации должна понижаться.
Постоянная диссоциации (Кд). Поскольку значение степени диссоциации зависит от концентрации электролита использование  для характеристики диссоциации электролита не подходит. В этих целях используется постоянная диссоциации (Кд). Значение постоянной диссоциации, в отличие от
для характеристики диссоциации электролита не подходит. В этих целях используется постоянная диссоциации (Кд). Значение постоянной диссоциации, в отличие от  , не зависит от концентрации раствора.
, не зависит от концентрации раствора.
Постоянная диссоциации равна отношению произведения концентраций ионов на концентрацию молекул, не разложившихся на ионы.
Например, формула вычисления постоянной диссоциации для уксусной кислоты следующая:
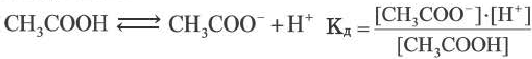
Поскольку Кд не зависит от концентрации, это постоянная величина. Значение Кд зависит от природы /электролита и растворителя и температуры. Чем больше значение Ka, тем больше диссоциирует электролит.
Электрическая проводимость бывает более высокой в том из растворов с одинаковым мольным количеством растворенных в них различных электролитов, в котором образуется наибольшее количество ионов. В ряду NaCl, FeCl2, AlCl3 в
водном растворе каждого из них электрическая проводимость повышается.
Диссоциация кислот, оснований и солей
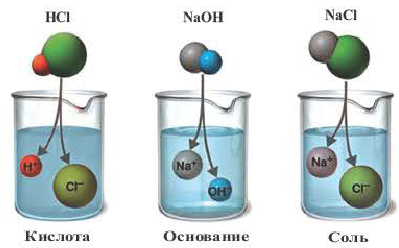
Все растворимые кислоты в водных растворах диссоциируют на ионы водорода и кислотных остатков. C точки зрения теории электролитической диссоциации кислотам можно дать такое определение:
Кислоты это сложные вещества, при диссоциации которых в водных растворах в качестве катионов образуются только ионы водорода.
Диссоциация кислот
Свойства кислот (кислый вкус, воздействие на индикаторы и т.д.) связаны с наличием в растворе гидратированных ионов водорода (Н3О+). Следовательно, общим для кислот является ион водорода H+ (или Н3О+). Отсюда становится ясно, что цвет индикатора меняет ион H+ (или Н3О+).
Одноосновные кислоты диссоциируют одноступенчато, двухосновные кислоты двуступенчато, а трехосновные кислоты (Н3РО4) грехступенчаго. Диссоциация двух- и трехосновных кислот в основном происходит в первой стадии (ступени). При ступенчатой диссоциации каждая последующая ступень протекает более слабо (т.е. при ступенчатой диссоциации процесс диссоциации протекает все медленнее). Основность кислот определяется количеством катионов водорода, образованных в процессе полной диссоциации.
| Диссоциация одноосновных кислот | Диссоциация двухосновных кислот | Диссоциация трехосновных кислот |
|
HCl |
I. H2SO4  H++ H HSO H++ H HSO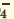 II. HSO4  H+ + SO H+ + SO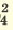 |
I. H3PO4 H++H2PO H++H2PO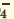 II. H2PO4  H++HPO H++HPO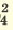 III.HPO 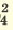  H+HPO H+HPO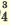 |
I. H3PO3  H+ + H2PO H+ + H2PO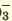 II. H2PO 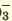  H+ + HPО H+ + HPО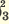 |
Знак обратимости  в процессе диссоциации указывает, что образовавшиеся ионы могут соединяться и образовывать исходные вещества и одновременно исходные ионы второй (или третьей) ступени. в процессе диссоциации указывает, что образовавшиеся ионы могут соединяться и образовывать исходные вещества и одновременно исходные ионы второй (или третьей) ступени.Если скорость распада на ионы больше, чем скорость образования исходных ионов, процесс диссоциации смещается вправо, если меньше то влево. |
Диссоциация оснований
Электролиты, при диссоциации которых в качестве анионов образуются только гидроксоионы, называются основаниями.
Растворимые в воде основания называют щелочами. Как известно, кислотность оснований определяется количеством гидроксильных ионов (ОН ) в их молекуле. Количество гидроксильных групп показывает кислотность основания. Однокислотные щелочи диссоциируют одноступенчато, двукислотные щелочи двуступенчаго. Цвет индикагора также меняется под действием гидроксильного иона (ОН ).
| Диссоциация однокислотных щелочей | Диссоциация двукислотных щелочей |
NaOH  Na+ + ОН Na+ + ОНKOH  K+ + ОН K+ + ОНNH4OH  NH NH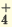 + ОН + ОН |
I. Ca(OH)2 CaOH+ + ОН CaOH+ + ОНII. CaOH+  Ca2+ + ОН Ca2+ + ОН |
Основания, которые в процессе диссоциации образуют как ион H+ так и ионы ОН , называют амфотерными гидроксидами. Амфотерные гидроксиды, взаимодействуя и с кислотами, и с основаниями, образуют соль и воду.
2OH + Zn2+  Zn(OH)2
Zn(OH)2 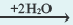 Zn(OH)
Zn(OH)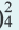 + 2H+
+ 2H+
Диссоциация солей
Вещества, образующие в процессе диссоциации катион металла (или аммония) и анион кислотного остатка, называются солями.
В зависимости от вида, соли диссоциируют по-разному. Нормальные, двойные и смешанные соли диссоциируют одноступенчато.
| Диссоциация нормальных солей | Диссоциация двойных солей | Диссоциация смешанных солей |
(NH4)2SO4  2NH4 + SO4 2NH4 + SO4FeCl3  Fe3+ + ЗСI- Fe3+ + ЗСI-Na3PO4  3Na+ + PO 3Na+ + PO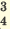 Na2SO4  Na+ + SO Na+ + SO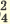 Na2ZnO2  2Na+ + ZnO 2Na+ + ZnO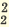 |
NaKSO4  Na+ + K+ + SO 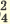 Na2KPO4  2Na++ K+ +PO 2Na++ K+ +PO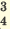 |
CaClNO3  Ca2+ + Cl + NO Ca2+ + Cl + NO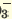 AICISo4  Al3++ Cl +SO Al3++ Cl +SO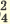 FeNO3Cl2  Fe3+ + N0 Fe3+ + N0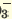 + 2СI- + 2СI- |
| Нерастворимые в воде соли (осадки) не диссоциируют. Они могут диссоциировать только в виде расплавов. |
Кислые соли диссоциируют ступенчато. Гидросоли диссоциируют двуступенчато, а дигидросоли трехступенчаго. Процесс диссоциации постепенно, поступенчато, слабеет.
| Диссоциация гидросолей | Диссоциация дигидросолей |
I. NaHSO4  Na+ + HSO Na+ + HSO II. HSO   H+ + SO H+ + SO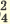 |
I. KH2PO4  K+ + H2PO K+ + H2PO II. H2PO   H+ + PO H+ + PO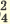 III. HPO 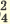  H+ + PO H+ + PO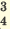 |
Основные соли также диссоциируют ступенчато: гидроксосоли диссоциируют двуступенчато, дигидроксосоли трехступенчато.
| Диссоциация гидросолей | Диссоциация дигидросолей |
I. CaOHNO3  CaOH+ + NO CaOH+ + NO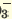 II. CaOH+  Ca2+ + 0H- Ca2+ + 0H- |
I. Al(OH)2Cl  Al(OH) Al(OH)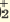 +Cl +ClII. Al(OH) 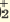  AlOH2+ + ОН AlOH2+ + ОНIII. AlOH2+  Al3+ + ОН Al3+ + ОН |
I. AlOH(NO3)2  AlOH2+ +2NO AlOH2+ +2NO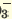 II. AlOH2+  Al3+ + 0H- Al3+ + 0H- |
Реакции ионного обмена
Реакции обмена, протекающие между водными растворами электролитов, в прошлых разделах мы показывали молекулярными уравнениями. В действительности же, в этих реакциях участвуют не молекулы электролитов, а их диссоциированные ионы.
Взаимодействие водных растворов электролитов называют ионными реакциями, а уравнения таких реакций ионными уравнениями. Уравнение, полученное при сокращении ионов, не участвующих в реакции, называется сокращенным ионным уравнением.
Чтобы понять условия протекания реакций ионного обмена, нужно знать их важнейшие свойства.
Свойства ионов
Вам уже известно, что ионы отличаются от атомов строением и свойствами. Некоторые ионы бесцветны, а другие имеют определенный цвет. Для каждого из них характерны специфические химические свойства.
При составлении ионных уравнений соблюдаются следующие правила:
- Полное уравнение реакции записывается в молекулярном виде. Т.е. химические формулы участвующих в реакции исходных веществ и конечных продуктов записываются вместе с их коэффициентами.
- Малодиссоциирующие (вода и в основном органические вещества), малорастворимые (осадок) и газообразные вещества записываются в молекулярной форме.
- Сильные электролиты, как полностью диссоциирующие вещества, записываются в ионном виде (такие уравнения называют полным ионным уравнением).
- Не участвующие в реакции ионы сокращаются. Уравнение, в котором указаны лишь участвующие в реакции ионы, называется сокращенным ионным уравнением.
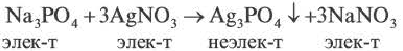 молекулярное уравнение
молекулярное уравнение
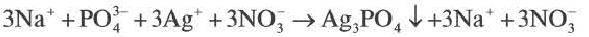 полное ионное уравнение
полное ионное уравнение
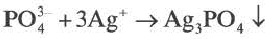 сокращенное ионное уравнение
сокращенное ионное уравнение
Если при реакциях заряды ионов не меняются, такие реакции называются реакциями ионного обмена.
Реакции ионного обмена протекают до конца в трех случаях:
Если образуется осадок.
BaCI2 + Na2SO4 = BaSO4↓ + 2NaCI
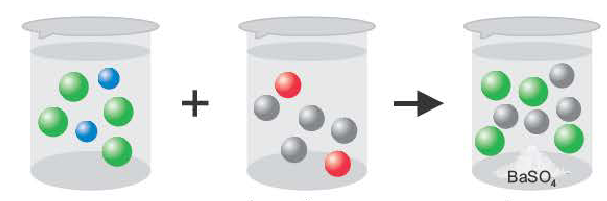
Ba2++2CI + 2Na++SO = BaSO4↓ + 2Na+ + 2CI
= BaSO4↓ + 2Na+ + 2CI
Ba2++SO =BaSO
=BaSO ↓
↓
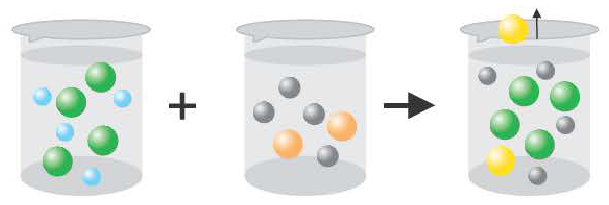
Если получается слабодиссоциирующее вещество (например: вода)
H++CI +Na++OH = Na+ + Cl + H2O
H++ОН =H2O
Если получается газообразное вещество.

2H++2CI + 2Na++S2 = H2S↑ + 2Na+ + 2CI
2H++S2 =H2S↑
Полное ионное уравнение и сокращенное ионное уравнение реакций, протекающих с участием или с образованием двух и более неэлектролитов, бывают одинаковыми.
- 1) Ba(OH)2 + H2SO4 → BaSO4↓+ 2Н2О молекулярное уравнение
- Ba2+ + 2ОН- + 2H+ + SO
 → BaSO4↓+ 2 H2O полное или сокращенное ионное уравнение
→ BaSO4↓+ 2 H2O полное или сокращенное ионное уравнение - 2) FeSO4 + Ba(OH)2 → BaSO4↓+ Fe(OH)2↓
- Fe2+ + SO
 + Ba2++ 2ОН → BaSO4↓ + Fe(OH)2 2↓ полное или сокращенное ионное уравнение
+ Ba2++ 2ОН → BaSO4↓ + Fe(OH)2 2↓ полное или сокращенное ионное уравнение
Реакции ионного обмена используются для определения того или иного вещества или иона.
| Определяемый ион | Реактив, coσι ветствующнй иону (определитель) | Признаки реакции |
| H+(кислота) | индикатор | Изменение цвета |
| Cu2+ | OH- (щелочь) | Синий осадок |
| Fe2+ | Зеленоватый осадок, принимающий со временем бурый цвет | |
| Fe3+ | Осадок бурого цвета | |
| Zn2+ | Белый осадок, при избытке ОН растворяется | |
| Al3+ | Студенистый белый осадок | |
| Mg2+ | Белый осадок | |
| NT4+ | C запахом аммиака | |
| Cr3+ | Темно-зеленый осадок | |
| Cl- | Ag+ (AgNO3) |
Белый осадок |
| Br- | Желтоватый осадок | |
| l- | Газ без запаха, вызывающий помутнение известковой воды | |
CO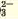 |
H+ (сильная кислота) | Белый осадок |
SO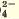 |
Ba2+ | Желтый осадок |
РО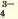 |
Ag+ | Черный осадок |
| S2- | Cu2+ | Черный осадок |
| Pb2+ | Черный осадок | |
| Zn2+ | Белый осадок | |
| Cd2+ | Желтый осадок | |
| Ca2+ | SO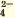 |
Белый осадок |
CO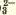 |
Белый осадок | |
| F- | Mg2+ | Желтый осадок |
| ОН- | индикатор | Изменение цвета |
| СН3СОО- | H+ (сильная кислота) | Уксусный запах |
Обменные реакции в растворах электролитов протекают только тогда, когда хотя бы одно из образованных в результате этих реакций веществ является малодиссоциирующим, или нерастворимым (осадком), или же находится в газообразном состоянии.
Сумма коэффициентов сокращенного ионного уравнения реакций, протекающих с образованием лишь одного неэлектролита (осадка или мало диссоциирующего вещества) всегда на 1 единицу бывает больше суммы ионов, образующих этот неэлектролит.
| Слабые электролиты и неэлектролиты | Сумма коэффиниентов сокращенного ионного уравнения его образования |
| СаСО3, MgCO3, ВаСО3, CaSO4, BaSO4, PbSO4, SrSO4, ZnCO3, CuS, PbS, ZnS, CdS, AgCl, Н2О, HCOOH, CH3COOH и др. | 3 |
| Be(OH)2, Mg(OH)2, Zn(OH)2, Fe(OH)2, Cr(OH)2, Cu(OH)2, PbCl2, Mn(OH)2, MgF2 и др. | 4 |
| Al(OH)3, Fe(OH)3, Cr(OH)3, Ag3PO4 и др. | 5 |
| Ca3(PO4)2, Ba3(PO4)2 и др. | 6 |
|
Растворы ионов, вступающих друг с другом в реакцию с выпадением осадка, вы делением газообразного вещества, образованием воды и мало диссоциирующего вещества, невозможно держать в одном сосуде. Если ионы в растворе не образуют вещества, которые мало диссоциируют между собой, трудно растворяются и выделяются в виде газа, то между их растворами реакция не протекает до конца и растворы таких ионов можно держать в одном сосуде. |
Следовательно, если при взаимодействии электролитов между собой не выпадает осадок, не выделяется газ и не образуются вода и органическое вещество, то такие реакции не протекают до конца. Примеры не протекающих в растворе реакций:
Na2SO4+Cu(NO3)2 → NaNO3 + BaCl2→ NaNO3 + KOH→
| Соли, находящиеся в виде осадка, не вступают в реакцию с щелочами, основания в виде осадка не вступают в реакцию с солями, соли в виде осадка не вступают в реакцию с другими солями. |
Электролиз
Электролиз это окислительно-восстановительные реакции, протекающие на электродах, если через раствор или расплав электролита пропускают постоянный электрический ток. В результате электролиза электрическая энергия превращается в химическую энергию. При пропускании через электролитический раствор или расплав постоянного электрического тока хаотическое движение ионов урегулируется, катионы (положительно заряженные ионы) движутся в сторону катода, а анионы (отрицательно заряженные ионы) в сторону анода и, теряя заряды, превращаются в нейтральные атомы или молекулы. В результате на катоде протекает процесс восстановления, а на аноде процесс окисления. В процессе электролиза между участками катода и анода существуют перегородки.
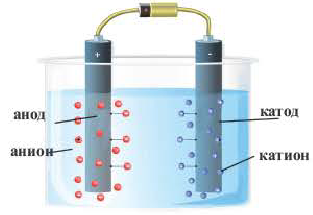
Электролизная ванна
Электролиз расплавов электролитов. Если через расплавы электролитов пропустить постоянный электрический ток, то происходит электролиз. При электролизе расплавов на катоде всегда восстанавливается катион, а на аноде окисляется анион. При электролизе расплавов любых солей, кроме солей аммония, на катоде всегда образуется металл. Рассмотрим процесс электролиза расплавленного хлорида натрия NaCl и гидроксида натрия (NaOH).

Электролиз расплава хлорида натрия
На катоде: Na+ + е → Na° восстановление
На аноде: Cl е → Cl° окисление
2Na++2Cl  2Na+Cl2
2Na+Cl2
2NaCl 2Na + Cl2
2Na + Cl2
На катоде: Na+ + e- → Na0 восстановление
На аноде: OH--e-→OH0 окисление
4OH0→2H2O+O2↑
4NaOH  4Na + 2H2O + O2
4Na + 2H2O + O2

Электролиз расплава гидроксида натрия
Электролиз расплавов солей кислородсодержащих кислот в школьном курсе не изучается.
Г. Дэви, не зная химических свойств выделенного при электролизе металла, наполнил изготовленный из калия тигель водой. Как только вода соприкоснулась с металлом, произошел взрыв. Осколки тигеля и капли расплавленного металла попали в лицо Дэви. Он потерял правый глаз и получил глубокую рану. Рубцы, образовавшиеся на его лице во время взрыва, оставались до конца его жизни.

Электролиз водных растворов электролитов
При электролизе растворов электролитов характер происходящих на электродах электрохимических процессов зависит от природы иона, растворителя, концентрации электролита, материала, из которого изготовлен электрод, температуры, напряжения тока и других факторов. Для того, чтобы заранее определить на основе формулы солей, какие вещества будут образованы на электродах при электролизе водных растворов солей, следует знать следующие правила.
1. При электролизе растворов солей металлов, расположенных в электрохимическом ряду напряжения металлов начиная слития, включая алюминий (Li, К., Ca, Na, Mg, Al), на катоде молекулы воды восстанавливаются с выделением водорода.
На катоде: 2H2O + 2e → H2↑ +2ОН
2. При электролизе же растворов солей бескислородных кислот (НО, HBr, HI, H2S) этих металлов кислотный остаток на аноде окисляется с получением многоатомного простого вещества, и в растворе образуется основание, т.е. масса соли уменьшается.
При электролизе растворов солей кислородсодержащих кислот этих металлов (Li, Na, К, Ca, Ba, Mg, Al) вода на аноде окисляется с выделением кислорода (О2), на катоде вода восстанавливается с выделением водорода. Масса соли не изменяется. Поскольку при электролизе растворов этих солей соль не разлагается, концентрация раствора повышается.
Na2SO4 +2H2O 2H2↑ + O2↑ + Na2SO4
2H2↑ + O2↑ + Na2SO4
При электролизе водных растворов щелочей LiOH, NaOH, KOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 происходит такой же процесс. Т.е. на катоде вода восстанавливается а на аноде вода окисляется.
NaOH + 2H2O 2H2↑ + O2↑+ NaOH
2H2↑ + O2↑+ NaOH
3. При электролизе растворов солей металлов, расположенных в ряду напряжения металлов между алюминием и водородом (Mn, Zn1 Cr, Fe, Ni,Sn, Pb), на катоде ионы металла вместе с молекулами воды восстанавливаются с выделением металла и водорода. На аноде вода окисляется, выделяется кислород. (Электролиз растворов бескислородных солей этих металлов в школьном курсе не изучается).
| На катоде: | 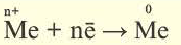 2H2O + 2ё → H2 ↑ +2OН |
| На аноде: | 2H2O 4ё → О2 ↑ + 4Н+ |
| Общее уравнение | NiSO4 + 2H2O 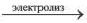 Ni + H2 ↑ + O2 ↑ + H2SO4 Ni + H2 ↑ + O2 ↑ + H2SO4 |
4. При электролизе растворов солей металлов, расположенных в электрохимическом ряду напряжения металлов после водорода (Cu, Hg1 Ag, Pt, Au), на катоде восстанавливаются только ионы металла с получением металла. Из этих металлов при электролизе растворов солей бескислородных кислот меди Cu на аноде кислотный остаток окисляется, получается соответствующее простое вещество. Масса воды не меняется. Следовательно, при электролизе как расплавов, так и растворов CuCh, CuBr2, CuI2, на электродах всегда получается один и тот же продукт (на катоде металл, на аноде галоген).
5. При электролизе растворов солей кислородсодержащих кислот этих металлов (например, Cu(NO2)2, CuSO4, AgNО3, Hg(NO3)2) вода на аноде окисляется с выделением кислорода (O2), в растворе образуется кислота. Значит, при элекгролизе растворов солей этих металлов соль всегда подвергается разложению, концентрация соли уменьшается.
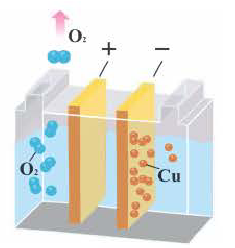
Электролиз водного раствора CuSO4
2CuSO4 + 2H2O 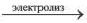 2Cu + O2 ↑+2H2SO4
2Cu + O2 ↑+2H2SO4
4AgNO3 + 2H2O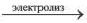 4Ag + O2 ↑ + 4HNO3
4Ag + O2 ↑ + 4HNO3
При электролизе как расплавов, так и растворов солей бескислородных кислот (НС1, HBr, HI, H2S) на аноде кислотные остатки, окисляясь, превращаются в соответствующие простые вещества. Последовательность окисления кислогных остатков на аноде представлена в следующем виде:
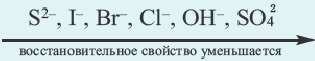
При проведении электролиза раствора смеси нескольких солей, в первую очередь, на аноде выделится S, при отсутствии этого элемента l2, при его отсутствии Вr2, при его отсутствии С12, при его отсутствии О2.
При электролизе растворов солей HF (MeFa) на аноде ионы F не окисляются, окислению подвергаются молекулы воды. Значит, процесс окисления 2F 2e → F2 в водном растворе не происходит. Процесс окисления возможен лишь при электролизе расплава.
При электролизе водных растворов солей кислородсодержащих кислот (HNO3, H2SO4, H3PO4, Н2СО3 и др.) на аноде окисляется не кислотный остаток, а вода с выделением кислорода (O2).
При электролизе растворов смеси солей различных металлов первоочередная последовательность восстановления металлов на катоде следующая:
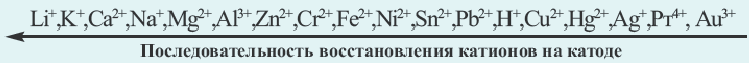
Факторы, влияющие на процесс электролиза. Процесс электролиза связан с электропроводной способностью растворов. Способность растворов к электрической проводимости зависит, в первую очередь, от концентрации ионов. Чем больше концентрация ионов, тем сильнее электропроводность раствора. Например, среди растворов солей KCl, Ba(NO3)2, А1С13 с концентрацией в 1 моль/л (т.е. 1 М) каждой из них (при одинаковой а) наибольшая электрическая проводимость будет у А1С13. Это обусловлено тем, что раствор этой соли обладает как наибольшим количеством ионов, так и более высокой концентрацией.
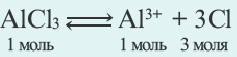
Применение электролиза. Электролиз применяется при получении активных металлов (Na, К, Ca, Mg, Al), меди (Сu), некоторых неметаллов (Cl2, F2) и щелочей (NaOH, КОН). Электролизом также пользуются для покрытия поверхности металлических предметов никелем, хромом, цинком, оловом, золотом и другими стойкими против коррозии металлами.
Гидролиз
Несмотря на отсутствие ионов H+ и ОН в составе нормальных солей, их водные растворы показывают щелочную, кислую или нейтральную реакцию. Эта особенность водных растворов солей объясняется гидролизом hidro вода, Iizis разложение).
Реакции, протекающие с образованием слабых электролитов в результате взаимодействия ионов соли и молекул воды, называются гидролизом солей. Другими словами, гидролизом называют разложение солей под воздействием воды.
В зависимости от природы солей, они подвергаются или не подвергаются гидролизу. Если хотя бы одна из кислот или оснований, образующих соль, будет слабой, то такая соль подвергается гидролизу. Нерастворимые в воде соли гидролизу не подвергаются.
Так как гидролиз является обратимым процессом, в системе образуется динамическое равновесие. Гидролиз солей, образованных из многоосновных кислот или многокислотных оснований, протекает ступенчато. Гидролизные реакции записываются как в виде молекулярного, так и в виде ионного уравнений.
Для составления краткого ионного уравнения гидролиза следует:
- а) написать уравнение диссоциации соли;
- Ь) определить природу аниона и катиона (установить катион слабого основания или анион слабой кислоты);
- с) написать полное ионное уравнение реакции (так как вода является неэлектролитом, ее формулу оставить как есть);
- d) путем сокращения ионов, не участвующих в реакции, определить краткое ионное уравнение.
По наличию или отсутствию процесса гидролиза соли подразделяются на четыре группы:
- Соли, образованные сильными кислотами (HNO3, H2SO4, HCl, HBr, HI) и сильными основаниями (LiOH, NaOH, КОН, RbOH, CsOH, Ca(OH)2, Sr(OH)2).
- Соли, образованные сильными кислотами и слабыми основаниями (Me(OH)n Me
 Be, Mg, Zn, Al, Cr, Fe, Cu,Hg, Ag, Mn, NH4 и др.).
Be, Mg, Zn, Al, Cr, Fe, Cu,Hg, Ag, Mn, NH4 и др.). - Соли, образованные слабыми кислотами (H3PO4, H2SO3, H2CO3, H2S, H2SiO3, HCOOH, CH3COOH и др.) и сильными основаниями.
- Соли, образованные слабыми кислотами и слабыми основаниями.
|
При гидролизе реакция среды определяется природой соответствующих кислоты и основания, образующих соль, иными словами, соотношением концентраций ионов H+ и ОН. |
Рассмотрим отдельно гидролиз группы солей, указанных выше.
1. Соли, образованные сильными кислотами и сильными основаниями (Na2SO4, K2SO4, Me(NO3)n, MeXn,Me = Li, Na, К, Rb, Cs, Ca, Sr, Ba, X
Li, Na, К, Rb, Cs, Ca, Sr, Ba, X  Cl, Br, I) , гидролизу не подвергаются, среда протекания реакции бывает нейтральной, цвет лакмуса (фиолетовый) не меняется.
Cl, Br, I) , гидролизу не подвергаются, среда протекания реакции бывает нейтральной, цвет лакмуса (фиолетовый) не меняется.
2. Соли, образованные сильными кислотами и слабыми основаниями (Mex(SO4)y; MeXn);
X  Cl, Br, I, Me
Cl, Br, I, Me  Be, Mg, Al, Zn, Cr, Fe, Mn, NH4, Cu
Be, Mg, Al, Zn, Cr, Fe, Mn, NH4, Cu
Me(NO3)n Me  Be, Mg, Al, Zn, Cr, Fe, Mn, NH4, Cu, Hg, Ag подвергаются гидролизу. При гидролизе таких солей катион подвергается гидролизу (гидролиз по катиону), среда реакции бывает кислой, лакмус окрашивается в красный цвет. Если валентность катиона больше валентности аниона, на 1-ой ступени гидролиза всегда образуется основная соль. При полном гидролизе таких солей число ступеней гидролиза бывает равным числу кислотных остатков. Гидролиз солей в основном протекает на 1-ой ступени, очередные ступени бывают слабее.
Be, Mg, Al, Zn, Cr, Fe, Mn, NH4, Cu, Hg, Ag подвергаются гидролизу. При гидролизе таких солей катион подвергается гидролизу (гидролиз по катиону), среда реакции бывает кислой, лакмус окрашивается в красный цвет. Если валентность катиона больше валентности аниона, на 1-ой ступени гидролиза всегда образуется основная соль. При полном гидролизе таких солей число ступеней гидролиза бывает равным числу кислотных остатков. Гидролиз солей в основном протекает на 1-ой ступени, очередные ступени бывают слабее.
Определим ступени гидролиза Al(NO3)3.
I. Al(NO3)3 + H2O Al(OH)(NC)3 )2 + HNO3 молекулярное уравнение
Al(OH)(NC)3 )2 + HNO3 молекулярное уравнение
Al3++ 3NO + H2O
+ H2O (AlOH)2+ + 2NO3+ H++NO3 полное ионное уравнение
(AlOH)2+ + 2NO3+ H++NO3 полное ионное уравнение
AP++ H2O (AlOH)2+ + H+ краткое ионное уравнение
(AlOH)2+ + H+ краткое ионное уравнение
II. Al(OH)(NO3)2 + H2O  Al(OH)2NO3 + HNO3
Al(OH)2NO3 + HNO3
(AlOH)2+ + 2NO + H2O
+ H2O  (A1(OH )2)+ + N0
(A1(OH )2)+ + N0 + H+ + NO3
+ H+ + NO3
(AlOH)2+ + H2O (A1(OH )2)+ + H+
III. Al(OH)2NO3 + H2O  A1(OH )3 ↓ + HNO3
A1(OH )3 ↓ + HNO3
(Al(OH)2)+ + NO3 + H2O  A1(OH )3↓ + H+ + NO
A1(OH )3↓ + H+ + NO
A1(OH)2)++ H2O  A1(OH )3↓ + H+
A1(OH )3↓ + H+
Таким образом, гидролиз солей, образованных много кислотными основаниями, протекает ступенчато. Так как в результате скопления ионов H+ равновесие смещается влево, II и III ступени протекают очень слабо.
Из этого примера можно сделать такой вывод, что при гидролизе солей, образованных слабыми основаниями и сильными кислотами, гидролиз обуславливается каnионом (вот почему гидролиз таких солей называют гидролизом по катиону), среда реакции бывает кислой, лакмус окрашивается в красный цвет.
Если валентность металла и кислотного остатка равна двум, то на первой ступени гидролиза таких солей получается основная соль, число ступеней гидролиза равно валентности кислотного остатка.
I ступень. 2CuSO4 + 2H2O  (CuOH)2SO4 + H2SO4
(CuOH)2SO4 + H2SO4
II ступень. (CuOH)2SO4 + 2H2O  2Cu(OH)2 + H2SO4
2Cu(OH)2 + H2SO4
3. Соли, образованные сильными основаниями и слабыми кислотами (Na3PO3, K3PO4, HCOONa, HCOOK, CH3COOK, Na2CO3, K2CO3, Na2S, K2S, Na2SiO3, K2SiO3 и др.), подвергаются гидролизу, при этом среда показывает щелочную реакцию, лакмус окрашивается в синий цвет. Если валентность катиона меньше валентности аниона, то гидролиз соли протекает ступенчато (гидролиз в основном протекает на 1-ой ступени). Если валентность металла меньше валентности кислотного остатка, на 1-ой ступени гидролиза всегда получается кислая соль, число гидролизных ступеней бывает равным валентности кислотного остатка.
Так как при гидролизе этих солей анион подвергается гидролизу, то такой гидролиз называют гидролизом по аниону.
I. Na2S + H2O  NaHS + NaOH
NaHS + NaOH
2Na+ + S2-+ H2O Na+ + HS + Na+ + ОН-
Na+ + HS + Na+ + ОН-
S2- + H2O  HS + ОН-
HS + ОН-
II. NaHS + H2O  NaOH + H2S
NaOH + H2S
Na+ + HS- + H2O  Na+ + ОН + H2S
Na+ + ОН + H2S
HS + H2O  ОН + H2S
ОН + H2S
C увеличением концентрации скопившихся ионов ОН равновесие смещается влево. Поэтому гидролиз протекает только на 1-ой ступени.
4. Соли, образованные слабыми основаниями и слабыми кислотами ((NH4)2S, (NH4)2CO3, HCOONH4, CH3COONH4, Al2S3, Cr2S3), легче подвергаются гидролизу, среда реакции в основном нейтральная, цвет лакмуса (фиолетовый) не меняется. Так как при гидролизе этого типа солей гидролиз обуславливается как катионом, так и анионом, вид гидролиза определяется как по катиону, так и по аниону. Иногда при гидролизе такого типа солей реакция среды зависит от величины константы диссоциации кислоты и основания, полученных в результате диссоциации.
Но так как константа диссоциации (1,8∙ 10-5) гидроксида аммония (NH4OH), образованного при гидролизе карбоната аммония (NH4)2CO3), больше константы диссоциации иона НСО3 (4,8∙ 10-11), раствор проявляет слабое основное свойство,
(NH4)2CO3+H2O  NH4OH + NH4HCO3 молекулярное уравнение
NH4OH + NH4HCO3 молекулярное уравнение
NH4+CO3 +H2O  NH4OH+ HCO3 краткое ионное уравнение
NH4OH+ HCO3 краткое ионное уравнение
Так как гидролиз является обратимым процессом, то если исключить полученные продукты из среды реакции, т.е. при образовании нерастворимых в воде основания и кислоты, гидролиз протекает до конца.
Al2S3+ 6H2O  2A1(OH)3 ↓ + 3H2S ↑
2A1(OH)3 ↓ + 3H2S ↑
Cr2S3 +6H2O  2Cr(OH)3 ↓ +3H2S ↑
2Cr(OH)3 ↓ +3H2S ↑
Факторы, влияющие на гидролиз
Влияние температуры:
Усиление гидролиза при нагревании раствора нормальной соли объясняется возрастанием диссоциации воды, являющейся эндотермическим процессом.
H2O  H+ + ОН- △Н = +57 кДж / моль
H+ + ОН- △Н = +57 кДж / моль
Наоборот, при охлаждении раствора соли гидролиз ослабевает.
Влияние концентрации раствора:
При увеличении концентрации раствора соли (т.е. при добавлении одной и той же соли) гидролиз ослабевает.
Значит, для усиления гидролиза нормальной соли одновременно следует уменьшить концентрацию раствора (путем добавления воды) и увеличить температуру. Эти последовательности выражены посредством представленных графиков.
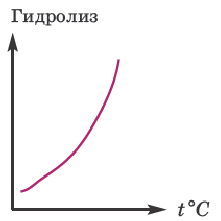
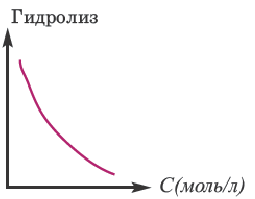
Для ослабления или предотвращения гидролиза следует добавить в раствор вещество или же той же соли, создающих среду. Если при гидролизе соли среда кислая, то при добавлении в раствор кислоты, создающей эту среду, гидролиз ослабевает. Точно так же, если среда основная, то добавлением в раствор этой же щелочи можно ослабить гидролиз. Например, для ослабления гидролиза Na2CO3 в раствор следует добавить создающую среду NaOH, при гидролизе AI2(SO4)3 добавить создающую среду H2SO4 или соответствующую соль.
Растворы солей, подвергающихся гидролизу, нельзя хранить в посуде, изготовленной из амфотерных металлов (Be, Zn и Al). Потому что, независимо от того, кислая это или щелочная среда, эти металлы (Be, Zn, Al), будучи амфотерными, вступят в реакцию с веществом, создающим среду.
Водный раствор любой соли нельзя хранить в посуде, изготовленной из металла, более активного по сравнению с ее катионом. Потому что металл, из которого изготовлена посуда, вытеснит катион соли.
В ряду электрохимической напряженности металлов начиная с Mg, каждый металл вытесняет следующие после него металлы из водного раствора их солей. Щелочные (Li, Na, К) и щелочноземельные металлы (Ca, Sr, Ba) не вытесняют ни один металл из водного раствора их солей, так как они, в первую очередь, вступая в реакцию с водой, выделяют Н2.
Степень гидролиза. Для количественной характеристики гидролиза солей используют понятие степень гидролиза (αг).
Степень гидролиза (αг) равна отношению числа подвергнутых гидролизу молекул (nг) к их исходному числу (Nг), то есть:
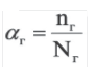 или
или 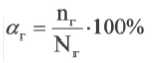
По мере повышения температуры степень гидролиза возрастает. Причиной этого является усиление диссоциации воды под действием температуры. Если в кислую среду, образованную в результате гидролиза, добавить кислоту, а в основную среду добавить щелочь, степень гидролиза уменьшится.
Гидратная теория
Представления о процессе электролитической диссоциации в дальнейшем были развиты в трудах русских ученых Ивана Алексеевича Каблукова и Владимира Александровича Кистяковского. Чтобы понять сущность представлений этих ученых, хотя бы вкратце рассмотрим явления, которые происходят при растворении веществ в воде.
При растворении в воде твердого гидроксида калия KOH или концентрированной серной кислоты H2SO4 происходит явление сильного разогревания. Необходимо осторожно растворять серную кислоту, так как из-за повышения температуры часть воды испаряется и под давлением пара может выбросить кислоту из сосуда. Чтобы этого избежать, серную кислоту тонкой струей наливают в воду (но не наоборот) при постоянном помешивании.
Если растворять аммонийную селитру (нитрат аммония) (NH4NO3) в тонкостенном стакане, поставленном на мокрую дощечку, то наблюдается столь сильное охлаждение, что стакан даже примерзает к ней. Почему при растворении веществ в воде в одних случаях наблюдается процесс разогревания, а в других охлаждения? При растворении твердых веществ происходит явление разрушения их кристаллических решеток и распределения образующихся частиц между молекулами растворителя. При этом необходимая энергия поглощается извне. Значит, разрушение кристаллических решеток твердых веществ (солей, щелочей) при их растворении в воде эндотермический процесс. Почему же при растворении некоторых веществ раствор разогревается?
Как вам известно, выделение теплоты это один из признаков химической реакции. Следовательно, при растворении происходит и химическая реакция. Например, молекулы серной кислоты реагируют с молекулами воды и образуются соединения состава H2SO4 ∙ Н2О (моногидрат серной кислоты) и H2SO4∙ 2Н2О (дигидрат серной кислоты). Иными словами, молекула серной кислоты присоединяет одну или две молекулы воды. Взаимодействие молекул серной кислоты с молекулами воды относится к реакциям гидратации, а вещества, которые при этом образуются, называются гидратами. Процесс же гидратации является экзотермическим.
При растворении твердых веществ (солей, щелочей и др.) в воде происходят как физический, так и химический процессы. Если энергии гидратации бывает больше энергии, которая гратится на разрушение кристаллической решетки вещества, то растворение сопровождается разогреванием, если наоборот охлаждением. Следовательно, растворение - это физико-химический процесс. Такое объяснение процесса растворения и природы растворов впервые было теоретически обосновано великим русским ученым Д.И.Менделеевым, и им была разработана гидратная теория растворов.
При выпаривании раствора вещество (щелочи, соли) обычно выделяется в виде кристаллов, содержащих химически связанную воду. Например, если к сульфату меди (II) (порошок белого цвета) прилить воду, то происходит процесс разогревания и получается раствор голубого цвета. При выпаривании воды выделяется кристаллическое вещество голубого цвета медный купорос, имеющий состав CuSO4∙ 5Н2О.
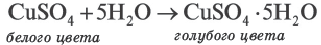
При прокаливании медного купороса (кристаллогидрат сульфата меди(II) происходит выделение (дегидратация) воды.
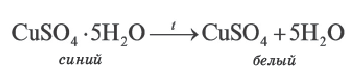
Кристаллические вещества, в состав которых входит химически связанная вода, называются кристаллогидратами, а воду, входящую в состав кристаллов, называют кристаллизационной водой.
| Кристаллогидраты | Гидраты |
| FeSO4∙ 7H2O железный купороса SO4∙ 2Н2О природный гипс Na2CO3 ∙ 10H2O кристаллическая сода Na2SO4 ∙ 10H2O глауберова соль MgSO4 ∙ 7H2O горькая соль CuSO4 ∙ 5H2O медный купорос (синий камень) |
H2SO4∙ H2O |
При изучении процессов гидратации нужно выяснить вопрос: с какими частицами вода вступает в реакцию?
И.А.Каблуков и В.А. Кистяковский независимо друг от друга предположили, что с молекулами воды реагируют ионы электролитов, то есть происходит гидратация ионов. Эта идея в дальнейшем подтвердилась. Так, например, было выяснено, что безводные ионы Cu2+ и SO бесцветны так же, как и безводный сульфат меди (II). Однако при растворении сульфата меди (II) в воде происходит процесс гидратации ионов. При выпаривании этого раствора образуются кристаллы. В узлах их кристаллических решеток находятся гидратированные ионы меди Cu(Н2O)
бесцветны так же, как и безводный сульфат меди (II). Однако при растворении сульфата меди (II) в воде происходит процесс гидратации ионов. При выпаривании этого раствора образуются кристаллы. В узлах их кристаллических решеток находятся гидратированные ионы меди Cu(Н2O)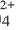 с голубой окраской и бесцветные гидратированные сульфат-ионы (SO4 . Н2О)2. Оба иона образуют кристаллы медного купроса CuSO4. 5Н2О.
с голубой окраской и бесцветные гидратированные сульфат-ионы (SO4 . Н2О)2. Оба иона образуют кристаллы медного купроса CuSO4. 5Н2О.
Установлено также, что при диссоциации молекул кислот получаются не свободные ионы водорода, а их гидраты - ионы гидроксония (Н3О+) или оксоний.
НNO3+nН2O H3O+ + NO
H3O+ + NO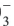 ∙(n-1)H2O
∙(n-1)H2O
В краткой форме H+ + H2O → H3O+
Растворение галогеноводородов, щелочей, концентрированных HNO3 и H2SO4 является экзотермическим, а растворение большинства солей эндотермическим процессом.
В водном растворе всех неорганических кислот, кроме H2SiO3, всегда присутствует ион гидроксония.
Поскольку в большинстве случаев число молекул воды, присоединенных в растворе к иону, неизвестно, уравнения процессов электролитической диссоциации в краткой форме можно записать так:
NaOH Na+ + ОН
Na+ + ОН
NaCl  Na+ + Cl
Na+ + Cl
Na3PO4  3Na+ + PO
3Na+ + PO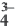
HNO3  H+ + NO
H+ + NO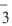
H2SO4  H+ + HSO
H+ + HSO
HSO4  H+ + SO
H+ + SO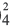
Теория электролитической диссоциаци
Электролиты и неэлектролиты:
Проводит ли раствор поваренной соли электрический ток? А раствор сахара?
Вы хорошо знаете, что металлы обладают свойством проводить электрический ток. Проводят ли электрический ток другие вещества? Об этом мы узнаем из следующего опыта.
Соберем прибор, показанный на рис. 14, поместим его электроды в поваренную соль и подключим к сети постоянного электрического тока. Лампочка не загорается.
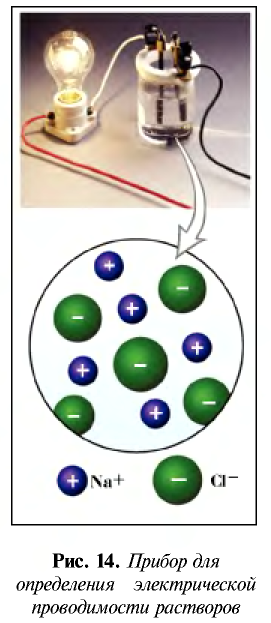
При опускании электродов в дистиллированную воду лампочка также не загорается. Следовательно, твердая поваренная соль и дистиллированная вода не пропускают электрический ток.
Теперь опустим электроды в водный раствор поваренной соли. Лампочка загорается. Следовательно, водный раствор поваренной соли проводит электрический ток.
Таким способом можно проверить электрическую проводимость любого вещества.
В зависимости от проводимости или непроводимости электрического тока все вещества подразделяются на две группы: электролиты и неэлектролиты.
- Вещества, водные растворы или расплавы которых проводят электрический ток, называются электролитами. К электролитам относятся кислоты, щелочи и соли,
- Вещества, водные растворы или расплавы которых не проводят электрический ток, называются неэлектролитами.
К неэлектролитам относятся вещества с неполярной ковалентной связью, метан, диоксид углерода, сахар, спирты и дистиллированная вода.
Электролиты проводят электрический ток только в растворенном в воде или расплавленном состоянии. В кристаллическом состоянии они плохо проводят или вообще не проводят электрический ток.
Элементы знаний, умений и навыков: электролиты, неэлектролиты, умение определять электропроводимость различных веществ.
Почему электролиты проводят электрический ток только в водном растворе или в расплаве
Почему водные растворы или расплавы электролитов проводят электрический ток, а водные растворы неэлектролитов не пропускают его?

На этот вопрос дал ответ в 1887 г. шведский ученый С. Аррениус, создавший теорию электролитической диссоциации. За научные исследования в области электролитов С. Аррениус в 1903 г. был удостоен Нобелевской премии.
Согласно этой теории, все электролиты — соли, кислоты, а также щелочи — при растворении в воде или в расплаве разделяются на ионы. Например:
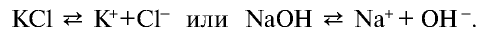
Ионы — это положительно заряженные (катионы) или отрицательно заряженные (анионы) частицы. Частицы могут быть представлены также одним или группой из нескольких атомов. Однако атомы и ионы резко отличаются друг от друга. Так, натрий, обладая едким свойством, является сильным восстановителем, хлор, будучи сильным ядом, является окислителем. А поваренная соль, состоящая из ионов натрия и хлора, вам хорошо известна (табл. 18).
Таблица 18
Электронное строение атомов и ионов натрия и хлора
| Атом натрия | Ион натрия |
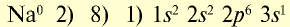 |
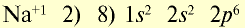 |
| Атом хлора | Ион хлора |
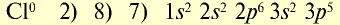 |
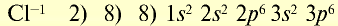 |
Распад на ионы соединений с ионной связью при образовании водных растворов называется диссоциацией. Этот процесс можно объяснить следующим образом. Вы уже знаете, что поваренная соль в твердом состоянии не пропускает электрический ток. При растворении в воде она разделяется на ионы, так как:
- кристаллы поваренной соли представляют собой соединения с ионной связью и в узлах их кристаллической решетки расположены ионы (см. рис. 15);
- молекула воды образована за счет полярной ковалентной связи и имеет строение, показанное на рис. 16;
- поваренная соль при растворении в воде диссоциирует по схеме, показанной на рис. 17.
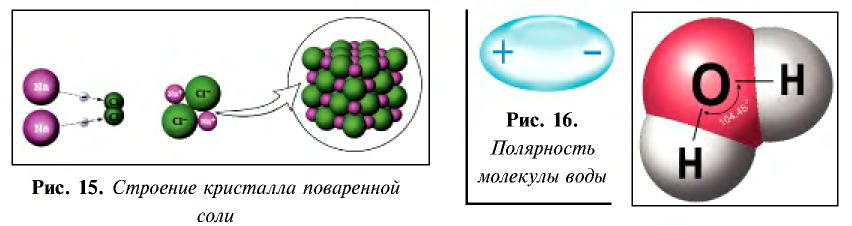
Таким образом, при растворении в воде кристаллы поваренной соли под воздействием поляризованных молекул воды образуют гидра-тированные ионы.
Атомы водорода и металлов превращаются в катионы, отдавая электроны, а атомы аммиака — присоединяя протоны за счет электронной пары, не участвующей в образований химической связи (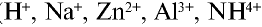 ).
).
Кислотные остатки и гидроксильные группы являются анионами. В электрическом поле движение ионов происходит следующим образом (см. рис. 18).
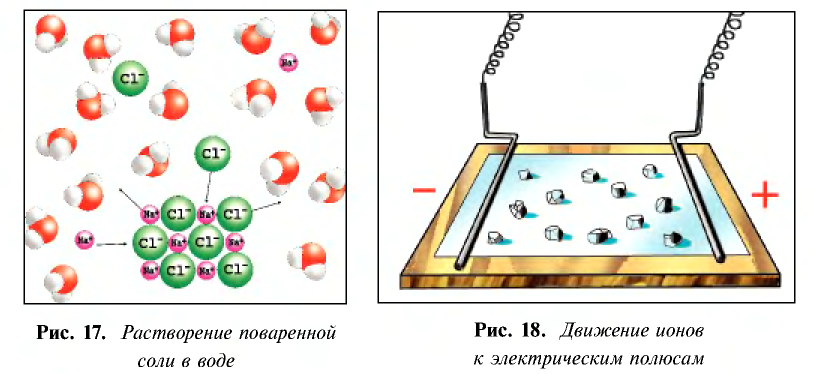
Положительно заряженные ионы притягиваются катодом. Поэтому их называют катионами.
Отрицательно заряженные ионы притягиваются анодом, поэтому их называют анионами.
Соли и щелочи при плавлении также делятся на ионы за счет усиления колебательных движений частиц, приводящих к ослаблению связей между ними.
Кислоты представляют собой сильно поляризованные молекулы и при растворении в воде тоже распадаются на ионы, но этот процесс происходит у них иначе, чем у солей и щелочей:
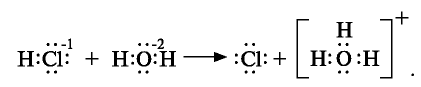
При растворении хлорида водорода в воде атом водорода отдает электрон и переходит в молекулу воды. В результате образуется ион хлора с одним лишним электроном и ион Н30+ (гидроксония) с одним присоединенным протоном (ядро атома водорода). Следовательно, при растворении в воде НС1, 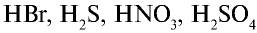 и других кислот образуется ион
и других кислот образуется ион 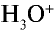 (гидроксоний). Ион гидроксония образует ионы воды и водорода:
(гидроксоний). Ион гидроксония образует ионы воды и водорода:
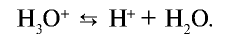
Изучая донорно-акцепторную связь, вы узнали, что 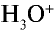 — вещество, образованное посредством донорно-акцепторной связи.
— вещество, образованное посредством донорно-акцепторной связи.
Уравнение диссоциации кислот обычно записывают в более кратком виде.
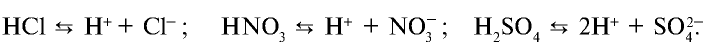
Элементы знаний, умений и навыков: элекролитическая диссоциация, теория электролитической диссоциации, катионы, анионы, ионы, ионная кристаллическая решетка, гидроксоний.
Диссоциация кислот, щелочей и солей
При диссоциации каких веществ образуются только ионы водорода?
Кислоты
Все кислоты, растворимые в воде, диссоциируют. При их диссоциации образуются ионы водорода и кислотный остаток:

Диссоциация многоосновных кислот протекает в несколько этапов:

Общие свойства кислот — кислый вкус, изменение цвета индикатора, способность вступать в реакцию с основаниями, основными оксидами и солями — объясняются образованием ионов водорода при их диссоциации. Исходя из этого можно дать следующее определение кислотам.
— Кислотами называются сложные вещества, при диссоциации которых в качестве катиона образуются только ионы водорода.
Основания
При диссоциации всех водорастворимых оснований выделяются катионы металла (ион гидроксида аммония  ) и анионы гидроксида (
) и анионы гидроксида (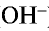 ):
):
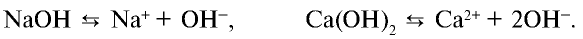
Все свойства, присущие водорастворимым основаниям — изменение цвета индикатора, способность вступать в реакцию с кислотами, кислотными оксидами и солями,— зависят от ионов 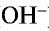 , образующихся при их диссоциации.
, образующихся при их диссоциации.
— Основаниями называются сложные вещества, при диссоциации которых в качестве аниона образуются только ионы гидроксида (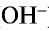 ).
).
Соли
При диссоциации солей образуются катионы металла (в аммониевых солях катион  ) и анионы кислотного остатка:
) и анионы кислотного остатка:
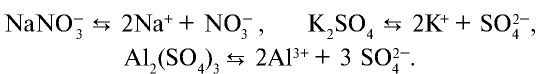
Кислые соли диссоциируют, помимо ионов металла, на ионы водорода:
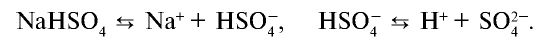
При диссоциации солей не образуются общие для всех солей ионы, поэтому они не имеют общих свойств.
— Солями называются сложные вещества, при диссоциации которых наряду с катионами металла образуются анионы кислотного остатка (а в кислых солях и катионы водорода).
Элементы знаний, умений и навыков: кислоты, щелочи и соли с точки зрения теории электролитической диссоциации. Многостадийная диссоциация.
Сильные и слабые электролиты
Почему уксусная кислота считается слабым электролитом?
— Отношение числа диссоциированных молекул к исходному числу растворенных молекул называется степенью диссоциации электролита, которая обозначается буквой а:
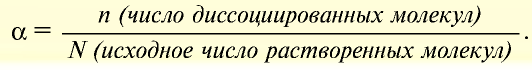
Степень диссоциации выражается в долях единицы или в процентах.
Если степень диссоциации равна 0,5, то это значит, что каждая из двух молекул распалась на ионы. Если а — 1, то на ионы распались все молекулы. При выражении степени диссоциации в процентах ее значение определяется так: если из ста молекул распались на ионы 85, то а будет равна 85%. Степень диссоциации зависит от природы растворенного электролита и растворителя, концентрации раствора, температуры среды. Поэтому вместе со степенью диссоциации указываются концентрация раствора и температура. Например, степень диссоциации 0,05 М серной кислоты при 18°С составляет 58 %.
— Электролиты с относительно высокой степенью диссоциации называются сильными.
Они практически полностью диссоциируют в растворах любой концентрации. Большинство солей (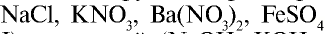 ), кислот (
), кислот (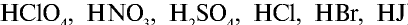 ) и щелочей (
) и щелочей (
 ) считаются сильными электролитами.
) считаются сильными электролитами.
— Электролиты, степень диссоциации которых низка даже в разбавленных растворах, называются слабыми.
Все органические и некоторые неорганические кислоты (H2C03, НС10, H,S, HN02, H2C03, H2Si03, НС102 и др.), гидроксид аммония, нерастворимые гидроксиды металлов, вода считаются слабыми электролитами.
Таблица 19
Характер кислот
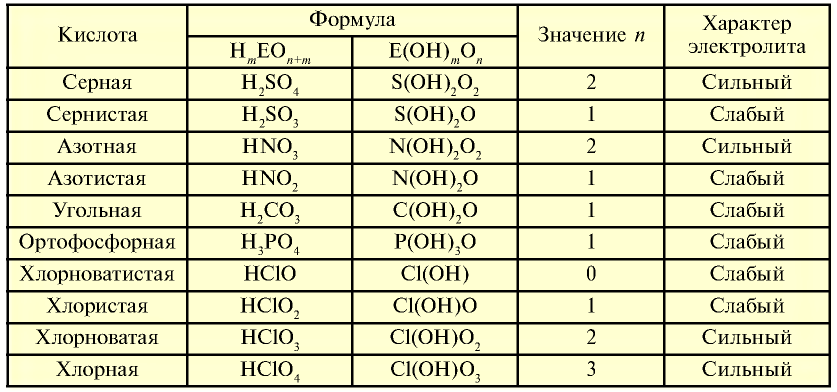
На основе общих формул кислородсодержащих кислот 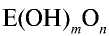 можно определить их характер. При n < 2 кислота считается слабой, при n
можно определить их характер. При n < 2 кислота считается слабой, при n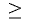 2 — сильной. Характер кислот в зависимости от числа атомов кислорода, не входящих в состав
2 — сильной. Характер кислот в зависимости от числа атомов кислорода, не входящих в состав  группы, представлен в табл. 19.
группы, представлен в табл. 19.
Сравнение характера электролитов по степени их диссоциации приемлемо только для растворов с одинаковой концентрацией, в остальных случаях этот способ неудобен. Поэтому для сопоставления характера слабых электролитов используется константа диссоциации.
В водных растворах слабые электролиты диссоциируют частично, так как в растворе между молекулами и ионами слабого электролита возникает равновесие. Например,
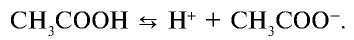
Отношение произведения равновесных концентраций ионов Н+ и 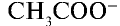 k концентрации уксусной кислоты является константой диссоциации уксусной кислоты:
k концентрации уксусной кислоты является константой диссоциации уксусной кислоты:
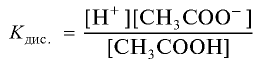
где К — константа диссоциации,
[Н+] — молярная концентрация ионов водорода,
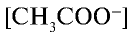 — молярная концентрация ионов ацетата,
— молярная концентрация ионов ацетата,
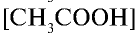 — концентрация молекул уксусной кислоты.
— концентрация молекул уксусной кислоты.
Константа диссоциации электролита зависит от природы электролита и растворителя, а также от температуры, но не зависит от концентрации раствора. Последняя служит количественной характеристикой диссоциации соединений. Чем больше константа диссоциации, тем сильнее диссоциирует электролит.
Ионообменные реакции
Какие индикаторы используются для определения среды раствора?
Что такое индикатор?
Реакции, протекающие в водных растворах электролитов, называются ионообменными, так как осуществляются с участием ионов, которые образуются при диссоциации электролита (табл. 20).
Уравнения ионообменных реакций составляются путем записи ионных формул диссоциировавшего сильного электролита, молекулярных формул слабых электролитов, не растворимых в воде осадков, а также выделившихся газообразных веществ.
Ионообменные реакции подразделяются на три группы.
Реакции нейтрализации
Вы знаете, что индикаторы изменяют свою окраску в зависимости от среды раствора (рис. 19).
Например, прильем к кислотному раствору (красного цвета) с лакмусовой добавкой немного щелочи. При этом окраска раствора станет фиолетовой. Это объясняется тем, что среда раствора стала нейтральной:
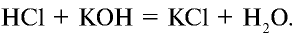
Запишем уравнение в ионном виде (вода очень слабый электролит и почти не распадается на ионы):

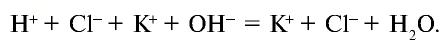
Сокращенное ионное уравнение реакции:
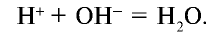
Следовательно, сущность реакции нейтрализации состоит в том, что при связывании ионов Н+, создающих кислотную среду, с ионами 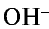 , создающими щелочную среду, образуется вода.
, создающими щелочную среду, образуется вода.
Реакции, протекающие с образованием не растворимого в воде осадка
Реакции, протекающие с образованием не растворимого в воде осадка, идут до конца. Например,
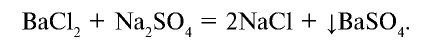
Образовавшийся в результате этой реакции сульфат бария не растворяется в воде, не делится на ионы.
Уравнение реакции в ионном виде:
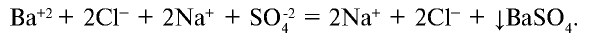
Ионы бария и сульфата, образовавшиеся при диссоциации электролита, связываясь друг с другом, образуют осадок (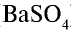 ). Запишем сокращенное ионное уравнение реакции:
). Запишем сокращенное ионное уравнение реакции:
Составьте уравнение реакций между растворами 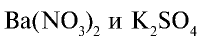 . Обратите внимание на их ионное уравнение.
. Обратите внимание на их ионное уравнение.
Реакции, протекающие с образованием газообразного вещества
Реакции, протекающие с образованием газообразного вещества, также идут до конца. Например,
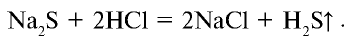
Запишем уравнение реакции в ионном виде:
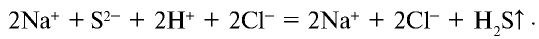
Сокращенное ионное уравнение реакции:
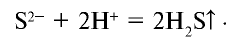
Следовательно, сущность этой реакции состоит в том, что при связывании ионов 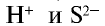 образуется нерастворимое в воде газообразное вещество (табл. 20).
образуется нерастворимое в воде газообразное вещество (табл. 20).
Составьте уравнения реакций между растворами хлорида аммония и едкого натра в молекулярном, ионном и кратком ионном виде. Сравните сокращенное ионное уравнение с сокращенным ионным уравнением предыдущей реакции.
Таблица 20
Характерные свойства ионов
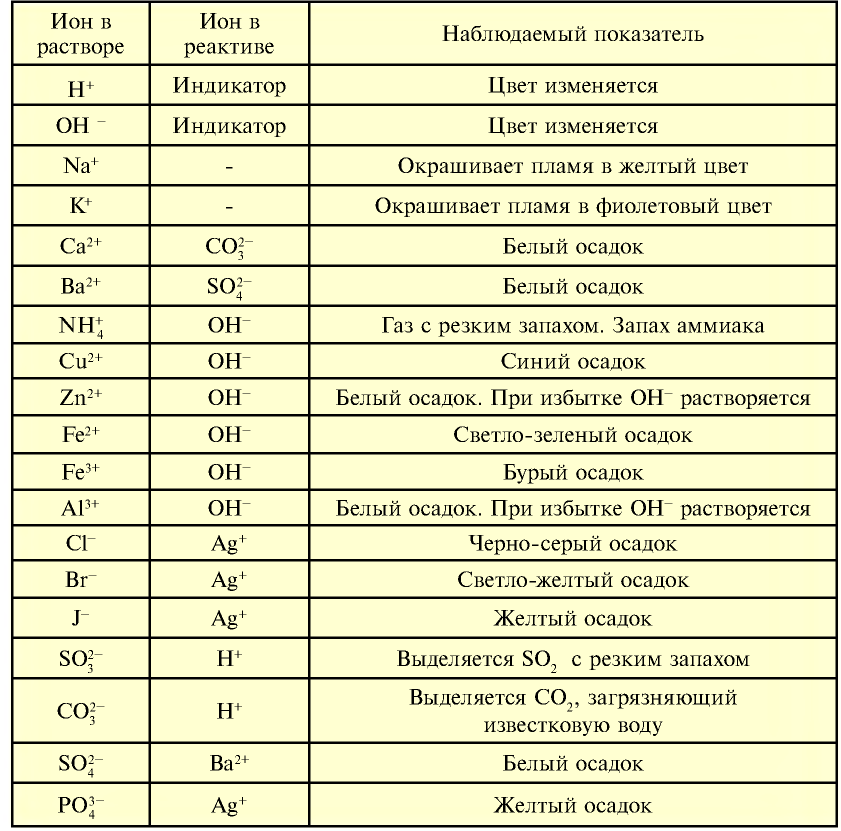
Элементы знаний, умений и навыков: характерные свойства ионов, условия протекания до конца реакций между растворами электролитов.
Гидролиз солей
Происходят ли химические реакции при растворении солей в воде?
Чистая вода является очень слабым электролитом, ее степень диссоциации равна 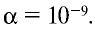 Но тем не менее она незначительно, но делится на ионы:
Но тем не менее она незначительно, но делится на ионы: 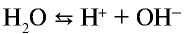 . Концентрации ионов
. Концентрации ионов 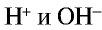 в чистой воде одинаковы:
в чистой воде одинаковы: 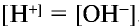 . При этом среда, содержащая равные количества ионов
. При этом среда, содержащая равные количества ионов 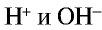 , является нейтральной, среда с избыточным количеством ионов Н+ — кислотной, а среда с избыточным количеством ионов
, является нейтральной, среда с избыточным количеством ионов Н+ — кислотной, а среда с избыточным количеством ионов 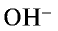 — щелочной.
— щелочной.
Водные растворы отдельных солей изменяют цвет индикатора, что свидетельствует о том, что произошла химическая реакция (табл. 21).
Таблица 21
Отношение отдельных солей к индикаторам

При изучении ионообменных реакций вы узнали, почему реакции растворов электролитов идут до конца и при связывании ионов в растворе образуются недиссоциирующие вещества. Рассмотрим, чем обусловлены изменения, указанные в табл. 21.
1. Водный раствор соли нитрата калия не изменяет цвет индикатора:
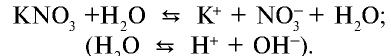
Ион калия К+ образует с ионом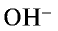 , возникшим в незначительном количестве при диссоциации воды, соединение КОН. Будучи сильным электролитом, КОН полностью распадается на ионы:
, возникшим в незначительном количестве при диссоциации воды, соединение КОН. Будучи сильным электролитом, КОН полностью распадается на ионы: 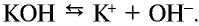 Вещество
Вещество  , образованное в результате связывания ионов
, образованное в результате связывания ионов 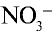 и Н+, также является сильным электролитом и разделяется на ионы:
и Н+, также является сильным электролитом и разделяется на ионы: 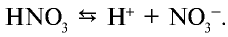
Следовательно, среда водных растворов солей, образованных сильным основанием и сильной кислотой, является нейтральной. То есть такие соли не гидролизуются.
— Слово "гидролиз" (от грен."gidro" — вода, "lizis" — отделение) означает разделение.
2. Соль нитрат алюминия является продуктом взаимодействия слабого основания и сильной кислоты. Такие соли гидролизуются. О гидролизе соли нитрата алюминия можно судить по изменению цвета индикатора:
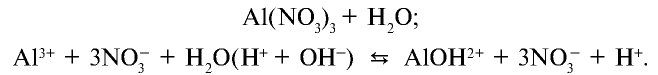
Ионы 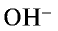 , образующиеся при диссоциации воды, связываясь с ионом
, образующиеся при диссоциации воды, связываясь с ионом 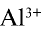 , образуют недиссоциирующий ион
, образуют недиссоциирующий ион 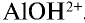 . В результате в растворе наблюдается избыток ионов Н+ , что создает кислотную среду.
. В результате в растворе наблюдается избыток ионов Н+ , что создает кислотную среду.
В этом процессе ион 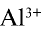 превращается в ион
превращается в ион 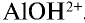 , а
, а 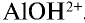 , связываясь с еще одним ионом
, связываясь с еще одним ионом 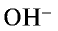 , превращается в ион
, превращается в ион 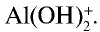 . Процесс продолжается, и накапливающиеся в растворе ионы Н+ останавливают диссоциацию воды и, следовательно, образование А1(ОН)г Для завершения процесса
. Процесс продолжается, и накапливающиеся в растворе ионы Н+ останавливают диссоциацию воды и, следовательно, образование А1(ОН)г Для завершения процесса 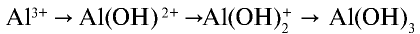 необходимо избавляться от избыточных ионов Н+.
необходимо избавляться от избыточных ионов Н+.
— Среда водных растворов солей, образованных слабым основанием и сильной кислотой, является кислотной.
3. Соль карбонат натрия является продуктом взаимодействия сильного основания и слабой кислоты. В водных растворах таких солей также происходит химический процесс. О гом, что среда является щелочной, можно узнать по изменению цвета индикатора (см.табл. 21).
При растворении в воде солей, образованных сильными основанием и слабой кислотой
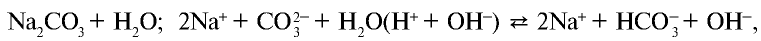
анион слабой кислоты связывается с ионом Н+, возникшим при диссоциации воды, и образует недиссоциирующий ион 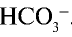 . Ион
. Ион 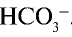 связывая очередной ион Н+, должен образовать
связывая очередной ион Н+, должен образовать 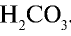 . Однако этого не происходит, так как ионы
. Однако этого не происходит, так как ионы 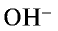 в растворе препятствуют диссоциации очередной молекулы воды. Для завершения процесса гидролиза необходимо избавляться от избыточных ионов
в растворе препятствуют диссоциации очередной молекулы воды. Для завершения процесса гидролиза необходимо избавляться от избыточных ионов 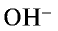 .
.
— Среда водных растворов солей, образованных сильным основанием и слабой кислотой, является щелочной.
4. Соли, образованные слабым основанием и слабой кислотой, полностью гидролизуются с образованием слабого основания и слабой кислоты:
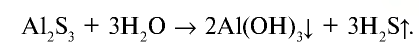
Среда же раствора определяется относительной силой образовавшихся основания и кислоты. Следовательно, если сильнее основание, среда слабощелочная, если сильнее кислота, среда слабокислотная, если же силы основания и кислоты равны, среда будет нейтральной.
- Реакции между солями и водой называются гидролитическими.
- Образование слабого электролита в результате взаимодействия ионов, возникших при диссоциации соли, с водой называется гидролизом.
Элементы знаний, умений и навыков: нейтральная среда, кислотная среда, щелочная среда, гидролиз солей, образованных сильным основанием и сильной кислотой, гидролиз, слабокислотная и слабощелочная среда.
Влияние различных факторов на гидролиз солей
Какое влияние оказывает повышение температуры на гидролиз солей?
Гидролиз солей зависит от природы солей, концентрации раствора и температуры. Соли, образованные слабым основанием и слабой кислотой, гидролизуются полностью. С повышением температуры процесс гидролиза солей усиливается, так как равновесие ионов Н+ и 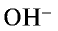 в молекуле воды смещается вправо. Иногда гидролиз солей, не происходящий при обычных условиях, при высокой температуре протекает в несколько стадий. Например, гидролиз соли
в молекуле воды смещается вправо. Иногда гидролиз солей, не происходящий при обычных условиях, при высокой температуре протекает в несколько стадий. Например, гидролиз соли 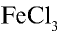 происходит в три стадии, тогда как в обычных условиях гидролиз этой соли осуществляется только на первой стадии:
происходит в три стадии, тогда как в обычных условиях гидролиз этой соли осуществляется только на первой стадии:
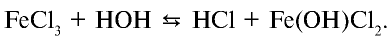
Однако при кипячении раствора осуществляется и вторая стадия гидролиза:
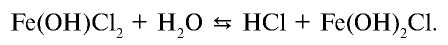
Если нагревание продолжить, происходит и третья стадия этого процесса:
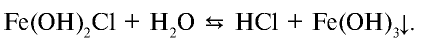
Степень гидролиза повышается при разбавлении растворов. Это можно наблюдать на примере гидролиза соли 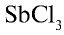 :
:
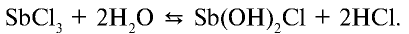
Если раствор соли разбавить водой, равновесие реакции сместится вправо и в осадок выпадет 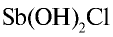 (или антимонил хлорид — SbOCl).
(или антимонил хлорид — SbOCl).
Таким образом, для ослабления процесса гидролиза в растворах необходимо сохранять низкую температуру и высокую концентрацию растворов. Кроме того, гидролиз солей можно предупредить путем обеспечения кислотной среды в растворах солей, образованных сильной кислотой и слабым основанием, и щелочной среды в растворах солей, образованных слабой кислотой и сильным основанием.
Пример №1
Сколько граммов сульфата бария выпадет в осадок, если смешать 104 г 5%-ного раствора хлорида бария и 71 г 10%-ного раствора сульфата натрия?
Решение:
1) найдем массу и количество вещества хлорида бария в растворе:
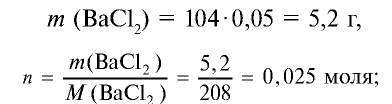
2) найдем массу и количество вещества сульфата натрия в растворе:
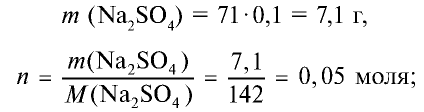
3) запишем уравнение реакции взаимодействия растворов 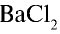 и
и 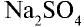 и продолжим вычисления:
и продолжим вычисления:
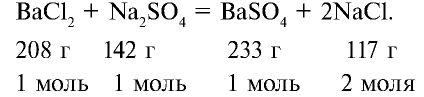
В соответствии с уравнением реакции 1 моль хлорида бария реагирует с 1 молем сульфата натрия, в результате чего выпадает 1 моль осадка сульфата бария. Молярные соотношения веществ, указанных в условиях задачи, следующие: 0,025 моля 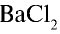 , 0,05 моля
, 0,05 моля 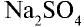 . Следовательно, в реакции участвует 0,025 моля сульфата натрия, а 0,025 моля остаются в излишке. А в результате реакции выпадают в осадок 0,025 моля
. Следовательно, в реакции участвует 0,025 моля сульфата натрия, а 0,025 моля остаются в излишке. А в результате реакции выпадают в осадок 0,025 моля 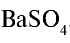 .
.
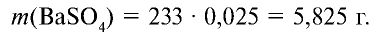
Ответ: образуется 5,825 г осадка.
Пример №2
104 г 5 % -ного раствора хлорида бария смешали с 71 г 10 %-ного раствора сульфата натрия. Сколько граммов сульфата бария выпало в осадок?
Решение. 1. Найдем массу и количество вещества хлорида бария в растворе:
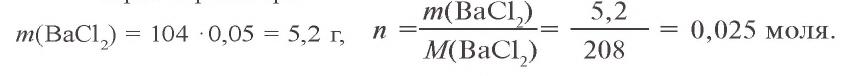
2. Теперь найдем массу и количество вещества сульфата натрия в растворе: 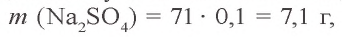
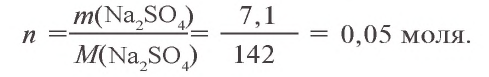
3, Запишем уравнения реакции взаимодействия 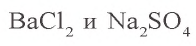 и продолжим вычисления:
и продолжим вычисления:
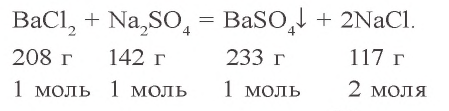
Согласно уравнению реакции, при взаимодействии 1 моля хлорида бария с 1 молем сульфата натрия в осадок выпадает 1 моль сульфата бария. Молярные соотношения веществ, данные в условии, следующие: 0,025 моля 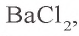 , 0,05 моля
, 0,05 моля 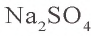 . Значит, в реакции участвует 0,025 моля сульфата натрия, а 0,025 моля остаются в излишке. В результате реакции образуется 0,025 моля осадка
. Значит, в реакции участвует 0,025 моля сульфата натрия, а 0,025 моля остаются в излишке. В результате реакции образуется 0,025 моля осадка 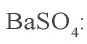
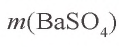 = 233 · 0,025 = 5,825 г.
= 233 · 0,025 = 5,825 г.
Ответ: образуется 5,825 г осадка.
Пример №3
Внимательно рассмотрите табл.7. Для определения иона, содержащегося в растворе, воспользуйтесь необходимыми реактивами и запишите молекулярное, ионное и краткое ионное уравнения происходящего процесса. Например, для определения иона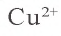 необходим ион
необходим ион 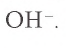 В результате выпадает синий осадок
В результате выпадает синий осадок 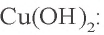
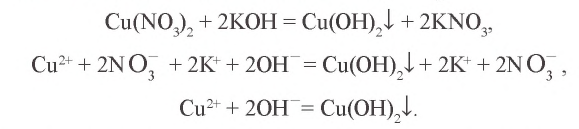
Вы также можете подобрать необходимые реактивы для определения четырех произвольных ионов и записать уравнения протекающих реакций.
Пример №4
Воздействуя на раствор хлорида железа(III) раствором карбоната калия, невозможно получить карбонат железа(III). Почему?
Решение. 1. Хлорид железа(III) – соль, образованная слабым основанием и сильной кислотой: 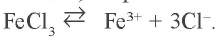 .
.
2. Карбонат калия – соль, образованная сильным основанием и слабой кислотой: 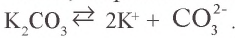 .
.
3. 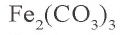 — соль, образованная слабым основанием и слабой кислотой. Водный раствор этой соли полностью гидролизуется. Значит, в растворе не содержится соль
— соль, образованная слабым основанием и слабой кислотой. Водный раствор этой соли полностью гидролизуется. Значит, в растворе не содержится соль 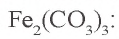
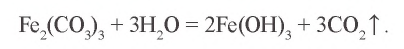
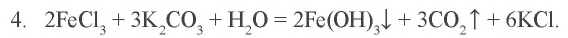
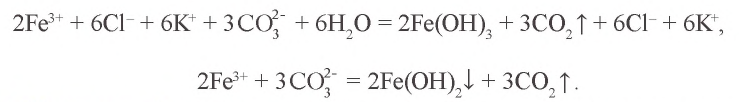
Пример №5
К 50 г 10,6 %-ного раствора карбоната натрия добавили избыточное количество раствора сульфата алюминия. Объясните происшедший процесс. Какой газ и в каком объеме (н.у.) выделился при этом?
Решение. 1. Найдем массу чистой соли 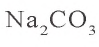 в 50 г 10,6 %-ного раствора карбоната натрия:
в 50 г 10,6 %-ного раствора карбоната натрия: 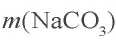 = 50 · 0,106 = 5,3 г.
= 50 · 0,106 = 5,3 г.
2. Запишем уравнения химической реакции
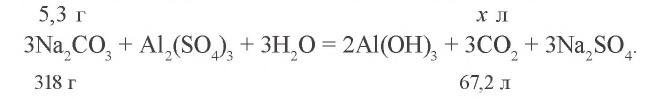
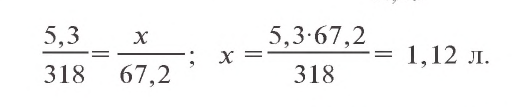
Ответ: образуется 1,12 л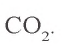
Объясним ионообменные реакции между солями, взятыми для реакции:
a) 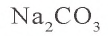 — соль, образованная сильным основанием и слабой кислотой
— соль, образованная сильным основанием и слабой кислотой
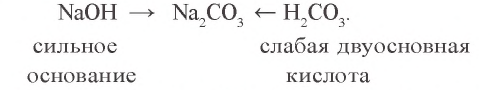
В растворе соли 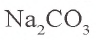 имеется катион натрия и анион карбоната:
имеется катион натрия и анион карбоната: 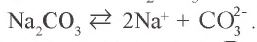
В растворе еще есть вода. Вода — очень слабый электролит:
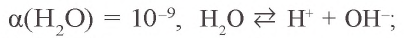
б). 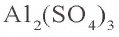 - соль, образованная слабым основанием и сильной кислотой:
- соль, образованная слабым основанием и сильной кислотой:
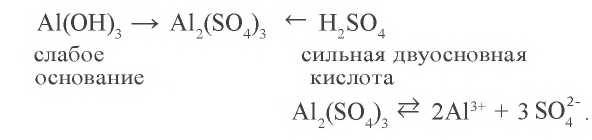
Содержащаяся в растворе вода, хотя и незначительно, диссоциирует на ионы 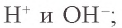 ;
;
в) при добавлении к раствору карбоната натрия раствора сульфата алюминия между указанными выше ионами происходит химический процесс:
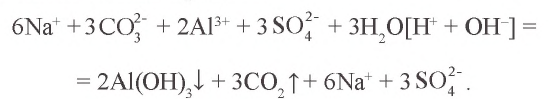
Значит, в результате ионообменной реакции образуются осадок гидроксида алюминия и углекислый газ.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |