
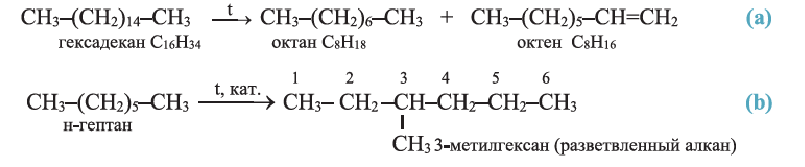
Углеводороды в химии - виды, классификация, формулы и определения с примерами
Содержание:
Углеводороды - вещества, молекулы которых состоят из атомов углерода и водорода.
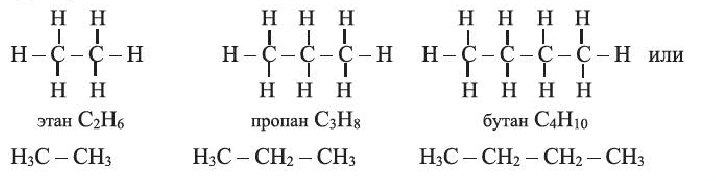
• Ациклические углеводороды, в молекулах которых атомы углерода соединены одинарной С-С связью, называются предельными углеводородами. Например:
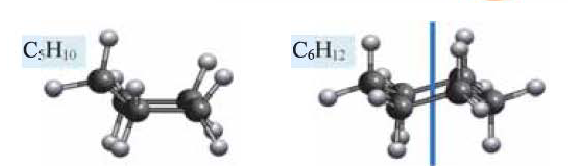
Ниже приведены рисунки моделей молекул метана, этана и бутана (а, b, с). Из моделей следует, что молекула метана, а также любой атом углерода в молекуле другого предельного углеводорода имеет тетраэдрическое строение.
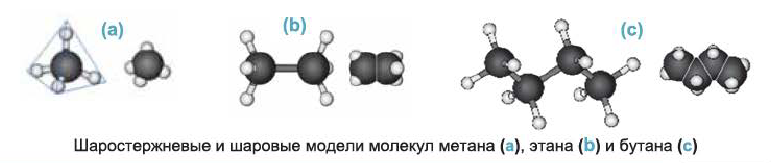
Шаростержневые и шаровые модели молекул метана (а), этана (b) и бутана (с)
По Международной номенклатуре предельные углеводороды называют алканами. На предыдущей странице приведены формулы некоторых алканов. Первый представитель алканов -метан 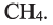
Сравнивая формулы метана (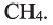 ), этана
), этана 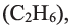 пропана
пропана 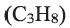 и других алканов, можно заметить, что каждый алкан по составу отличается от предыдущего на
и других алканов, можно заметить, что каждый алкан по составу отличается от предыдущего на 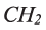 — метиленовую группу. Группу
— метиленовую группу. Группу  называют гомологической разностью.
называют гомологической разностью.
• Вещества, принадлежащие к одному классу и отличающиеся друг от друга на одну или несколько метиленовых групп, называют гомологами.
Метан  этан
этан 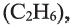 пропан
пропан 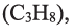 бутан
бутан 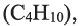 пентан
пентан 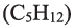 и др. - гомологи друг друга. Гомологи, расположенные в порядке возрастания их молекулярных масс, образуют гомологический ряд. Рассматриваемый ряд является гомологическим рядом предельных углеводородов.
и др. - гомологи друг друга. Гомологи, расположенные в порядке возрастания их молекулярных масс, образуют гомологический ряд. Рассматриваемый ряд является гомологическим рядом предельных углеводородов.
Состав всех членов ряда можно выразить одной общей формулой. Например, состав алканов можно выразить общей формулой 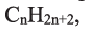 а их относительную молекулярную массу выражением
а их относительную молекулярную массу выражением 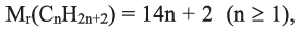 где n - обозначает число атомов С в молекуле алкана.
где n - обозначает число атомов С в молекуле алкана.
Вычисления связанные с составом и строением алканов:
Относительная молекулярная масса алкана равна 44. Назовите алкан и вычислите общее число 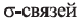
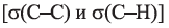 в его молекуле.
в его молекуле.
Решение.
Из выражения 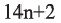 находим число атомов углерода в молекуле, составляем структурную формулу алкана и по ней вычисляем число
находим число атомов углерода в молекуле, составляем структурную формулу алкана и по ней вычисляем число 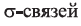
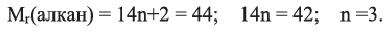
Значит алкан - это пропан. Из его структурной формулы 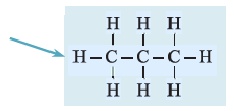 находим:
находим:
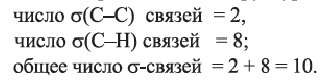
Нахождение в природе: Метан в природе образуется при разложении остатков растительных и животных организмов без доступа воздуха (в болотах, каменноугольных шахтах). Поэтому его иногда называют рудничным или болотным газом, Метан составляет основную часть (80-97%) природного газа. Он присутствует и в попутных нефтяных газах.
Физические свойства: Метан - газ без цвета и запаха, примерно в 2 раза легче воздуха. Этан, пропан и бутан - также газы. Следующие 11 представителей алканов 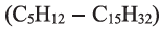 - жидкости, остальные - твердые вещества. Метан в воде практически не растворим.
- жидкости, остальные - твердые вещества. Метан в воде практически не растворим.
Пропан и бутан при обычной температуре под давлением легко сжижаются.
Химические свойства: Метан — химически малоактивный. При обычных условиях он устойчив к действию кислот, щелочей, окислителей; он не обесцвечивает бромную воду и раствор перманганата калия.
Метан вступает в реакции замещения, окисления и разложения.
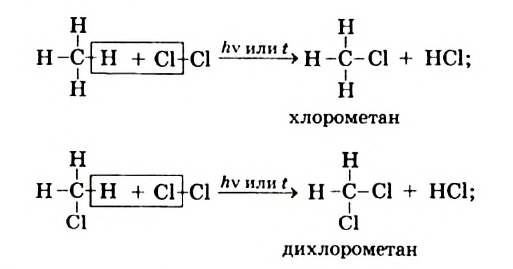
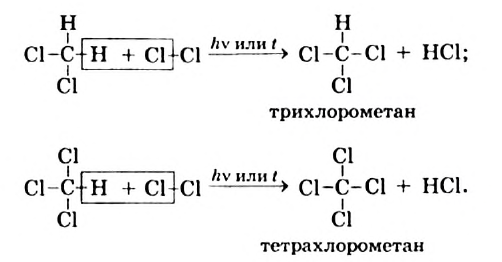
I. В реакциях замещения С-Н связь разрывается и атом H замещается другим атомом. Например, при освещении (hv) или нагревании, атомы хлора последовательно замещает атомы водорода метана, образуя смесь различных хлорпроизводных метана:
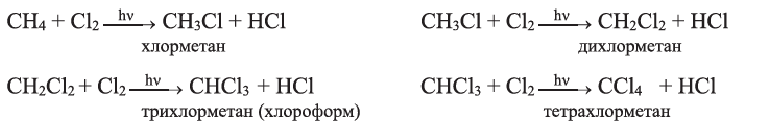
Бром с метаном реагирует аналогичным образом.
II. Метан горит почти бесцветным пламенем, выделяя большое количество тепла. При этом образуются вода и углекислый газ:
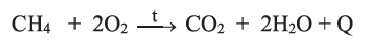
С воздухом метан образует взрывоопасные смеси. Подобные смеси могут накапливаться в шахтах и заводских котельнях, а также в жилых помещениях.
Конверсией метана с водяными парами получают синтез-газ:
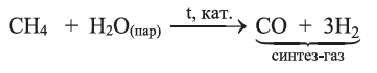
III. При высокой температуре метан разлагается. В зависимости от условий реакции, из метана получают сажу, ацетилен 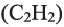 и этилен
и этилен 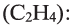
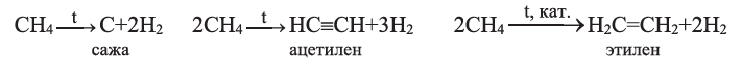
Реакции отщепления молекулы водорода от молекул органических соединений называются реакциями дегидрирования.
Применения: В качестве топлива метан широко используется в быту и промышленности. Из него получают водород, сажу, ацетилен, синтез-газ и др. В качестве сырья метан применяют в производстве метилового спирта, уксусной кислоты, синтетических каучуков и синтетического бензина. Галогенпроизводные метана используются в холодильных установках, в медицине, для тушения пожаров, а также в качестве растворителей. Пропан и бутан в качестве топлива используются на транспорте, иногда в быту.
Это интересн:. Для обнаружения утечки бытового (природного) газа, в него в малых количествах добавляют крайне сильнопахнущий газ - этилмеркаптан  Именно он придает бытовому газу неприятный запах ("запах газа").
Именно он придает бытовому газу неприятный запах ("запах газа").
Это вещество добавляют и в баллоны с пропаном и бутаном.
Непредельные углеводороды. Углеводороды этиленового ряда (алкены)
Ациклические углеводороды, в молекулах которых между атомами С имеется двойная или тройная связь, называются непредельными углеводородами.

Из непредельных ациклических углеводородов рассмотрим алкены, алкадиены и алкины.
Углеводороды этиленового ряда (алкены). Этилен
• Ациклические углеводороды, в молекулах которых между атомами углерода имеется одна двойная связь, называются этиленовыми углеводородами.
По Международной номенклатуре углеводороды этиленового ряда называют алкенами. Общая формула алкенов—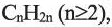 а их относительная молекулярная масса вычисляется выражением
а их относительная молекулярная масса вычисляется выражением 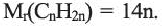 Первый представитель гомологического ряда - этилен
Первый представитель гомологического ряда - этилен 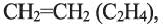 второй - пропилен
второй - пропилен 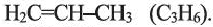 Одновалентный остаток этилена -
Одновалентный остаток этилена -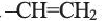 называют винильной группой.
называют винильной группой.
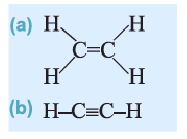
Из молекулярной модели этилена следует, что в молекуле все атомы расположены в одной плоскости. В молекуле этилена четыре 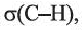 одна
одна 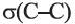 и одна
и одна 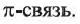 На примере этилена рассмотрим получение, свойства и применения алкенов.
На примере этилена рассмотрим получение, свойства и применения алкенов.
Получение: В лаборатории этилен можно получить отщеплением воды от этилового спирта:
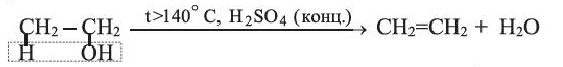
Реакции разложения, протекающие с отщеплением воды, называются реакциями дегидратации.
Физические свойства: Этилен — газ без цвета, запаха, немного легче воздуха; в воде практически не растворим. При обычных условиях первые представители ряда 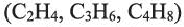 - газы.
- газы.
Химические свойства: По химическим свойствам этилен более активный, чем метан. Он вступает в реакции присоединения, полимеризации и окисления.
I. Реакции присоединения.
1. Этилен в присутствии катализатора присоединяет 1 моль водорода, превращаясь в этан:
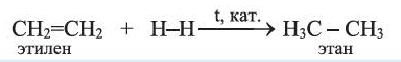
Реакции присоединения водорода к органическим веществам, называются реакциями гидрирования.
2. Этилен присоединяет галогены. Например, если этилен пропустить через желтовато-бурый раствор бромной воды, то этилен присоединит к себе бром и раствор обесцветится. Эту реакцию используют для определения (распознавания) непредельных углеводородов:
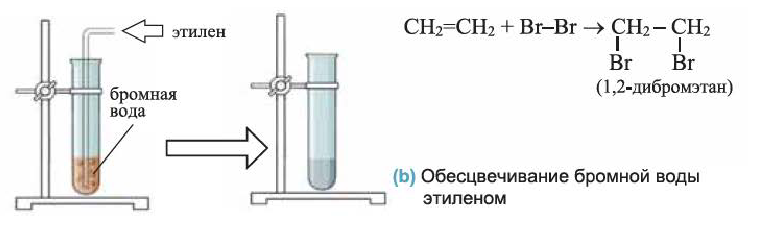
(b) Обесцвечивание бромной воды этиленом
3. В присутствии катализатора этилен присоединяет воду, превращаясь в этиловый спирт:
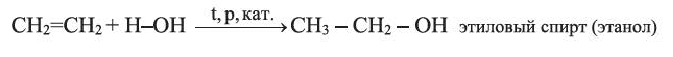
Вычисления, связанные с химическими свойствами алкенов:
Для полного гидрирования 1 моль какого алкена — этилена или пропилена - потребуется большее количество водорода?
Решение:
Поскольку 1 моль этилена и 1 моль пропилена содержат одинаковое (Na) число молекул, а в каждой молекуле имеется но одной С=С связи, которая и гидрируется, то можно заключить, что расход водорода в обоих случаях будет одинаковым.
II. Реакции полимеризации. Полимеризация — реакция присоединения большого числа одинаковых молекул с малыми относительными молекулярными массами, приводящая к образованию высокомолекулярных веществ. Полимеризацию этилена в полиэтилен можно изобразить уравнением:
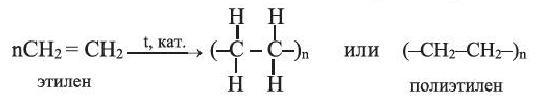
Исходное вещество называют мономером, конечное - полимером.
III. Реакции окисления. Этилен легко окисляется. Например, если этилен пропустить через раствор перманганата калия, то фиолетовая окраска раствора исчезнет. В результате реакции образуется двухатомный спирт — этиленгликоль.
Эта реакция также применяется для определения непредельных углеводородов:
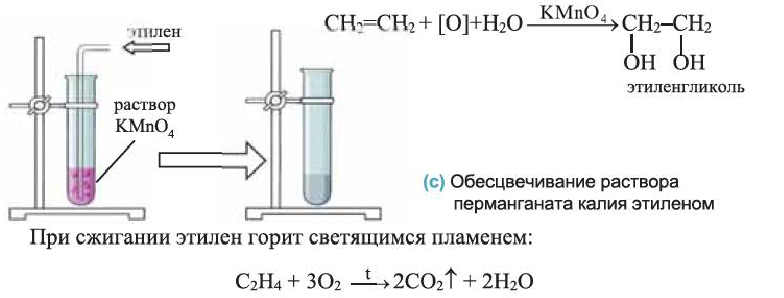
Применение: Алкены используют в производстве полимеров (полиэтилена, полипропилена и др.), растворителей (спирты, ацетон), антифризов (незамерзающих при низкой температуре охлаждающих жидкостей), волокна лавсана, взрывчатых веществ, а также синтетических каучуков.
Определение: Этилен, как непредельный углеводород, определяют по обесцвечиванию бромной воды и раствора перманганата калия.
Ацетиленовые и диеновые углеводороды. Ацетилен
 Ациклические углеводороды, в молекулах которых между атомами углерода имеется одна тройная связь, называются ацетиленовыми углеводородами.
Ациклические углеводороды, в молекулах которых между атомами углерода имеется одна тройная связь, называются ацетиленовыми углеводородами.
По Международной номенклатуре углеводороды ряда ацетилена называют алкинами. Первый представитель алкинов — этин (ацетилен) 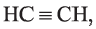 второй - пропин (метилацетилен)
второй - пропин (метилацетилен) 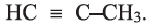 Состав алкинов выражают общей формулой
Состав алкинов выражают общей формулой 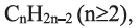 а их относительную молекулярную массу вычисляют выражением
а их относительную молекулярную массу вычисляют выражением 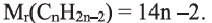
Молекула ацетилена 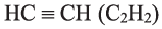 имеет линейное строение (а и b):
имеет линейное строение (а и b):
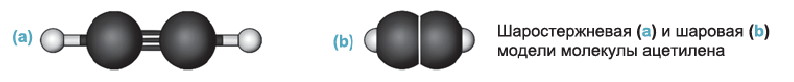
На примере ацетилена рассмотрим получение свойства и применение алкинов.
Получение: В промышленности ацетилен получают из метана и карбида кальция:
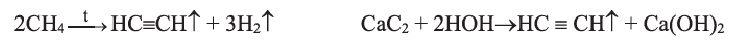
Гидролизом карбида кальция ацетилен получают и в лаборатории.
Физические свойства: Ацетилен - газ без цвета и запаха, легче воздуха, в воде мало растворяется.
Это интересно: Специфический запах ацетилена, получаемого из технического карбида кальция, обусловлен присутствием в нем примесей сероводорода и газа фосфина (РНз) (поэтому такой ацетилен ядовит).
Химические свойства: Ацетилен, как и этилен, вступает в реакции присоединения, полимеризации и окисления.
I. Реакции присоединения. Ацетилен присоединяет водород, галогены, галогеноводороды и воду.
Присоединение водорода идет в две стадии - вначале образуется этилен, затем - этан:
(а) 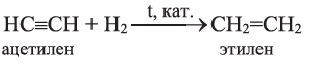 (b)
(b) 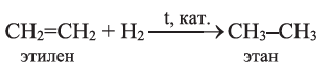
Присоединение галогенов протекает очень легко; например, если ацетилен пропустить через желтовато-бурый раствор бромной воды, то в результате присоединения брома к ацетилену раствор обесцветится. Присоединение идет в две стадии:
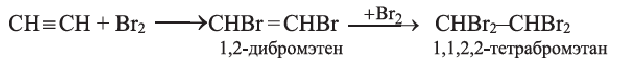
При присоединении 1 моль хлороводорода к ацетилену образуется очень ценный мономер — винилхлорид:
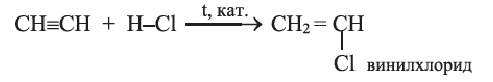
Полимеризацией винилхлорида получают поливинилхлорид (стр. 191).
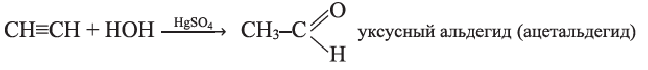
Присоединением воды к ацетилену получают уксусный альдегид — вещество с неприятным запахом (реакция М.Кучерова):
II. Реакции полимеризации. В присутствии катализатора ацетилен димеризуется в винилацетилен-.
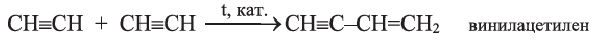
Из винилацетилена получают мономер хлоропренового каучука - хлоропрен.
III. Реакции окисления. Ацетилен, как и этилен, легко окисляется. При пропускании ацетилена через раствор перманганата калия, раствор обесцвечивается. При этом ацетилен окисляется в щавелевую кислоту:

В отличие от метана и этилена, ацетилен на воздухе горит коптящим пламенем. В кислороде ацетилен горит ослепительно ярким пламенем (выделяя большое количество тепла):
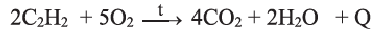
Смеси ацетилена с воздухом или кислородом взрывоопасны.
Применения: Ацетилен используется при резке и сварке металлов, в производстве уксусной кислоты, этилового спирта, синтетических каучуков, поливинилхлоридных смол, клеев, растворителей 
Определение ацетилена: Ацетилен, как непредельный углеводород, определяют по обесцвечиванию бромной воды и раствора перманганата калия при пропускании ацетилена через эти растворы.
Вычисления связанные с строением алканов и алкенов:
Определите пространственное строение молекул этилена и ацетилена и вычислите число 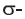 и
и 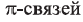 в каждой молекуле.
в каждой молекуле.
Решение.
а) поскольку в молекуле этилена все атомы расположены в одной плоскости, а в молекуле ацетилена - вдоль прямой линии, то молекула этилена имеет плоское строение, а молекула ацетилена - линейное.
b) учитывая, что двойная С=С связь состоит из одной 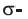 и одной
и одной 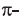 связи, а тройная
связи, а тройная 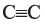 связь из одной
связь из одной 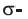 и двух
и двух 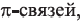 то из структурных формул этилена (а) и ацетилена (b) вычисляем, что в молекуле этилена содержится
то из структурных формул этилена (а) и ацетилена (b) вычисляем, что в молекуле этилена содержится 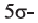 и одна
и одна 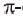 связь, а в ацетилене одна
связь, а в ацетилене одна 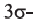 и две
и две 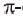 связи.
связи.
• Ациклические углеводороды, в молекулах которых между атомами углерода имеются две двойные связи, называются диеновыми углеводородами. Например,
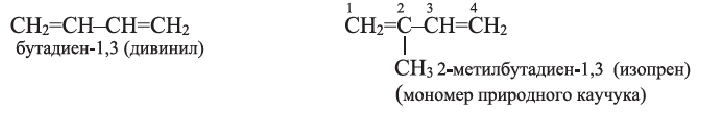
По Международной номенклатуре диеновые углеводороды называют алкадиенами. Первый представитель алкадиенов — пропадиен 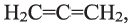 второй - бутадиен-1,3
второй - бутадиен-1,3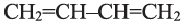 (дивинил). Состав алкадиенов, также как и алкинов, выражается общей формулой
(дивинил). Состав алкадиенов, также как и алкинов, выражается общей формулой 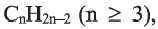 а их относительная молекулярная масса вычисляется выражением
а их относительная молекулярная масса вычисляется выражением 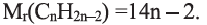
Для алкадиенов характерны реакции присоединения и полимеризации.
Полимеризацией бутадиена-1,3 и его производных получают промышленно важные каучуки:
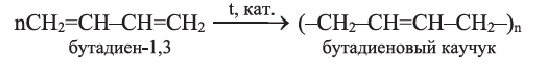
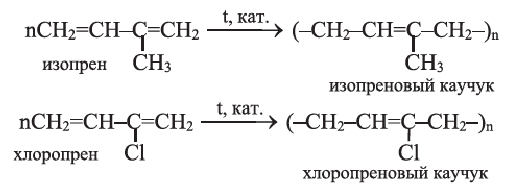
Применение: Дивинил, изопрен и хлоропрен (2-хлорбутадиен-1,3) в качестве мономеров применяются в производстве соответствующих каучуков. Эти каучуки используются в производстве автомобильных шин и камер, а также других резиновых изделий.
Ключевые слова • уксусный альдегид • винилацетилен • щавелевая кислота • синтетические каучуки • реакция димеризации • хлоропрен •
Циклические углеводороды - циклопарафины и ароматические углеводороды
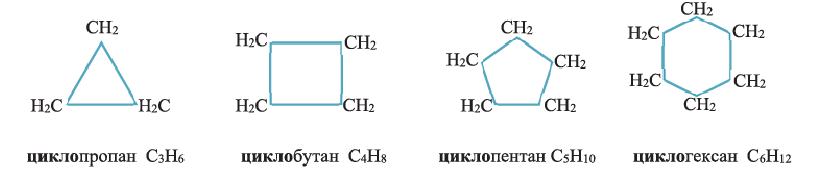
• Циклические углеводороды, в молекулах которых атомы углерода соединены между собой одинарными связями, называются циклопарафинами.
По Международной номенклатуре циклопарафины называют циклоалканами. Первый представитель циклоалканов - циклопропан 
Состав циклоалканов так же, как и алкенов, выражается одной общей формулой 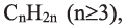 а их относительная молекулярная масса вычисляется из выражения 14n.
а их относительная молекулярная масса вычисляется из выражения 14n.
Названия циклоалканов образуются из названий алканов, с тем же числом атомов углерода, что и в цикле, с добавлением приставки "цикло". Например:
(а) Шаростержневые модели молекул циклолентана и циклогексана
По физическим свойствам циклоалканы похожи на алканы. По химическим свойствам циклоалканы, также, как и алканы, малоактивны.
Получение: В промышленности циклоалканы выделяют из фракций нефти. Циклогексан и его гомологи получают также гидрированием ароматических углеводородов:
Применение. Циклогексан и метилциклогексан используют для получения бензола и толуола, а последние — в производстве красителей и лекарственных веществ. Циклопропан применяется в качестве наркоза.
Ароматические углеводороды
• Углеводороды, молекулы которых содержат одно или несколько бензольных колец, называются ароматическими углеводородами или аренами.
Простейшим представителем ароматических углеводородов является бензол 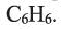 В молекуле бензола 6 атомов углерода, располагаясь в одной плоскости, образуют правильный шестиугольник (b - 1). В молекуле атомы углерода соединены между собой одинарной ст-связью, которая в схеме указана прямыми. Кроме этого, все атомы углерода соединены между собой одной единой 6-электронной 71-связью, что на схеме показано окружностью внутри шестиугольника (b - 2):
В молекуле бензола 6 атомов углерода, располагаясь в одной плоскости, образуют правильный шестиугольник (b - 1). В молекуле атомы углерода соединены между собой одинарной ст-связью, которая в схеме указана прямыми. Кроме этого, все атомы углерода соединены между собой одной единой 6-электронной 71-связью, что на схеме показано окружностью внутри шестиугольника (b - 2):
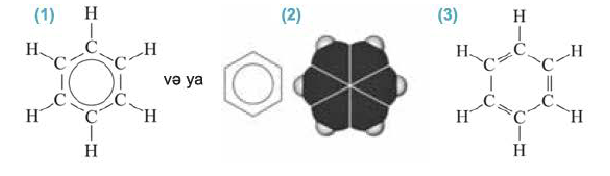
(b) Структурные формулы и шаровая модель молекулы бензола
Бензол получают из продуктов, образующихся при переработке нефти и каменного угля (из каменноугольной смолы стр.167).

Его исследования охватывают области органического синтеза и теоретической органической химии. Он считал углерод четырехвалентным элементом. Впервые предложил строение молекулы бензола (b - 3).
Бензол — бесцветная, летучая, легковоспламеняющаяся жидкость с характерным запахом. В воде не растворяется. При охлаждении он превращается в белую кристаллическую массу с температурой плавления 5,5°С. Кипит при 80,1°С. Бензол и его пары ядовиты. На воздухе горит коптящим пламенем. Не обесцвечивает бромную воду и раствор перманганата калия.
Применение. Бензол используется в производстве анилина, красителей, растворителей, средств защиты растений.
Вычисления на основе уравнения горения циклоалкана:
Для полного сжигания 2 л (н.у.) газообразного углеводорода затрачено 9 л кислорода. Определите формулу углеводорода, если при этом образовалось 6 л 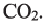
Решение:
Поскольку объемные отношения газов в ходе реакции равны отношениям их стехиометрических коэффициентов, то уравнение реакции можно записать так;
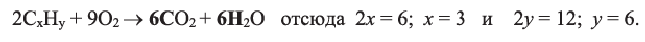
При 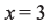 и
и 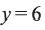 формула углеводорода будет
формула углеводорода будет 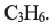
Природные источники углеводородов и их переработка
Почему сжигание нефти, попутных нефтяных газов и каменного угля не считается рациональным способом их использования?
Важнейшими источниками углеводородов являются нефть, природный газ, попутные нефтяные газы и каменный уголь.
Нефть
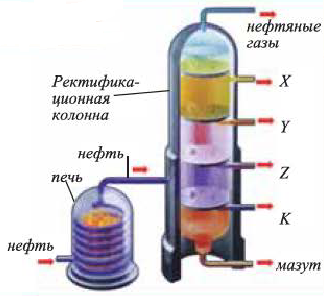
Нефть — маслянистая горючая жидкость от бурого до черного цвета, со специфическим запахом. Она легче воды (0,73—0,97г/мл) и в ней не растворяется. Нефть (сырая) состоит из смеси жидких, твердых и газообразных углеводородов. Поэтому она кипит не при постоянной температуре, а в некотором температурном интервале.
Состав нефти: В состав нефти, добываемой из различных месторождений, входят углеводороды трех видов - алканы, циклоалканы (нафтены) и ароматические углеводороды.
Шкатулка знаний: Соотношение этих трех видов углеводородов в нефти, добытой из различных месторождений, неодинаково. Например, грозненская и ферганская нефть богаты алканами, бакинская нефть - циклоалканами, а татарстанская нефть - ароматическими углеводородами.
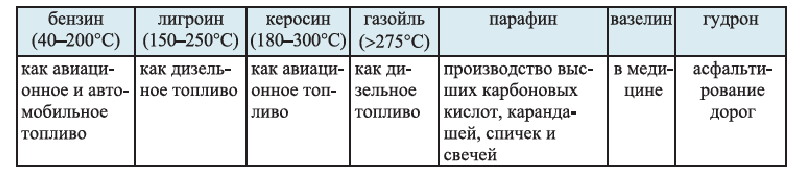
Продукты, получаемые из нефти, и их применение:
В промышленности осуществляют два типа переработки нефти — первичную и вторичную переработку. Первичная переработка нефти состоит в ее фракционной перегонке. Этот процесс проводят в ректификационной колонне. При этом выделяют — бензиновую, лигроиновую, керосиновую и газойлевую фракции. В остатке остается черная вязкая жидкость — мазут.
При дистилляции мазута при пониженном давлении из него получают соляровое и смазочные масла, парафин и вазелин, а также гудрон. (Гудрон - черная твердая масса, остающаяся после перегонки мазута).
Области применения продуктов переработки нефти ((... °С) - температуры кипения фракций)
Бензин, образующийся при первичной переработке нефти, составляет всего 20% от исходной нефти. С целью увеличения выхода бензина осуществляют вторичную переработку.
Вторичной переработке подвергаются, главным образом: мазут, керосин и газойлевая фракция. При этом широко используют процессы термического и каталитического крекинга.
• Процесс образования углеводородов с меньшим числом атомов углерода в результате разложения углеводородов с большим числом атомов углерода, называется крекингом.
В обоих видах крекинга углеводороды состава 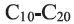 разлагаются на углеводороды бензиновой фракции состава
разлагаются на углеводороды бензиновой фракции состава 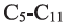 (а). В результате выход бензина удается повысить до 70-80%. В ходе каталитического крекинга наряду с реакциями разложения протекают и реакции изомеризации (b):
(а). В результате выход бензина удается повысить до 70-80%. В ходе каталитического крекинга наряду с реакциями разложения протекают и реакции изомеризации (b):
В отличие от первичной переработки нефти в ходе вторичной переработки происходят химические превращения углеводородов.
Это интересно: Октановое число: Октановое число численно характеризует детонационную устойчивость бензина. Детонация - явление преждевременного воспламенения топлива в двигателе. Если октановое число бензина равно 95, то это значит, что детонационная стойкость этого бензина такая же, как детонационная стойкость смеси, состоящей из 95% изооктана и 5% н-гептана. Чем выше октановое число топлива, тем больше коэффициент полезного действия двигателя.
Природный газ. Попутные нефтяные газы
Наша республика имеет большие запасы природного газа и попутных нефтяных газов.
Природный газ в основном, состоит из метана (80—90%) и его ближайших гомологов — этана, пропана и бутана. Он используется в быту и промышленности в качестве топлива. Он также является источником сырья для химической промышленности (стр. 153).
Попутные нефтяные газы или под давлением растворены в нефти, или расположены над слоем нефти. В их составе содержание метана меньше, чем в природном газе, но содержание его гомологов  - больше. Эти газы также используются как топливо и как источники химического сырья.
- больше. Эти газы также используются как топливо и как источники химического сырья.
Каменный уголь
Каменный уголь, являясь топливом, одновременно — источник химического сырья. Основная переработка каменного угля состоит в его коксовании (пиролизе), то есть в нагревании без доступа воздуха при температуре 1000-1200°С. В ходе коксования образуются следующие основные фракции - кокс, каменноугольная смола, аммиачная вода и коксовый газ.
Кислородсодержащие и азотсодержащие производные углеводородов
В этой главе из кислородсодержащих производных углеводородов вы ознакомитесь со спиртами, карбоновыми кислотами, сложными эфирами и углеводами, а из азотсодержащих производных - с аминокислотами и белками.
Предельные спирты, этанол, этиленгликоль и глицерин
• Производные предельных углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильные (ОН) группы, называются предельными спиртами.
Одноатомные предельные спирты — этанол:
Одноатомные предельные спирты содержат в своем составе одну ОН группу, и поэтому их состав выражают общей формулой R-OH или 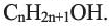 Простейшими их представителями являются метиловый спирт или метанол -
Простейшими их представителями являются метиловый спирт или метанол -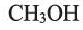 и этиловый спирт или этанол -
и этиловый спирт или этанол - 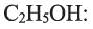
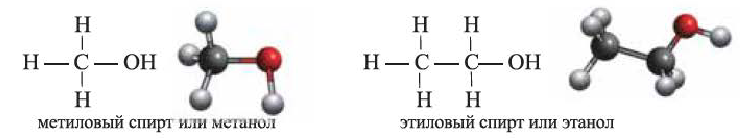
(а) Структурные формулы и шаростержневые модели молекул метилового и этилового спиртов
Получение: Этанол получают в основном гидратацией этилена в присутствии катализатора:
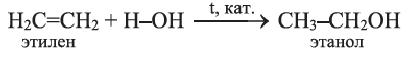
Этанол получают также брожением сахаристых веществ, содержащих в своем составе глюкозу или остатки глюкозы (в присутствии дрожжевых грибков):
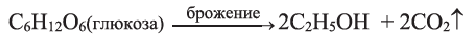
Физические свойства: Этанол (винный спирт) — бесцветная жидкость с (характерным) алкогольным запахом, кипящая при 78°С; легко воспламеняется. Он легче воды и с водой смешивается в любых соотношениях. Многие органические вещества хорошо растворяются в нем.
Этанол — вещество, обладающее наркотическим действием. Для того, чтобы не употребляли внутрь этиловый спирт, используемый для технических нужд, к нему добавляют плохо пахнущие и красящие вещества. Такой спирт называют денатуратом. Раствор спирта, содержащий 96% спирта и 4% воды, называют медицинским спиртом.
Химические свойства: При температуре выше 140°С в присутствии концентрированной серной кислоты этанол дегидратируется, образуя этилен:
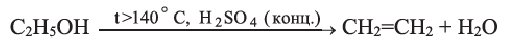
Этанол на воздухе горит слабозаметным синеватым пламенем:
При слабом нагревании с оксидом меди (II) этанол окисляется в уксусный альдегид, обладающий неприятным запахом:
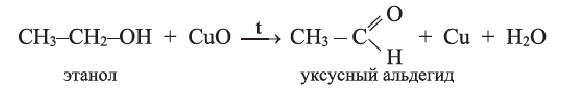
Вычисления связанные с составом спиртов:
Выразите относительную молекулярную массу спиртов 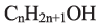 посредством числа атомов углерода в молекуле
посредством числа атомов углерода в молекуле 
Решение:
Учитывая значение 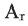 элементов и их индексов в выражении
элементов и их индексов в выражении 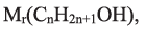 выразим
выразим 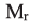 спиртов посредством n.
спиртов посредством n.
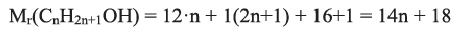
Применение: Этиловый спирт применяется в производстве синтетического каучука, пластмасс, духов, лекарств, лаков и алкогольных напитков. Он используется для консервирования анатомических препаратов, в медицине - для дезинфекции кожи, приготовления настоев и экстрактов.
Метанол — очень ядовитая, обладающая характерным алкогольным запахом, бесцветная жидкость, кипящая при 68°С; с водой смешивается в любых соотношениях.
Многоатомные предельные спирты - этиленгликоль и глицерин:
Предельные спирты, содержащие две и три ОН группы, называются соответственно, двухатомными и трехатомными спиртами. Простейшим представителем двухатомных спиртов является этиленгликоль, а трехатомных — глицерин:
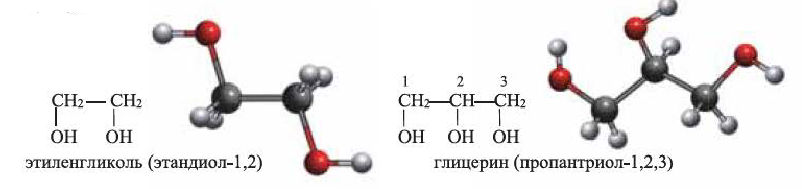
(b) Структурные формулы и шаростержневые модели молекул этиленгликоля и глицерина
Поскольку водные растворы этиленгликоля не замерзают при температурах значительно ниже 0°С, то они зимой применяются в радиаторах автомобилей, тракторов и др. механизмов в качестве антифриза - незамерзающих охлаждающих жидкостей.
Глицерин - бесцветная, сиропообразная, сладкая на вкус, вязкая и гигроскопичная жидкость. С водой смешивается в любых соотношениях. Глицерин, в отличие от этиленгликоля, не ядовит.
Глицерин применяется для получения нитроглицерина (тринитрата глицерина) и динамита. Он используется также в парфюмерии и медицине (в виде мазей) для придания мягкости коже, в кожевенном производстве — для предохранения кож от высыхания, а также в производстве мыла. 1%-ный спиртовой раствор нитроглицерина применяют в качестве сосудорасширяющего средства при сердечно-сосудистых заболеваниях.
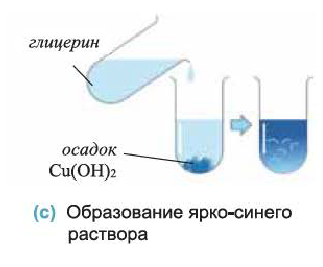
Определение: Определение глицерина и этиленгликоля как многоатомных спиртов основывается на их способности образовывать растворы ярко-синего цвета при взаимодействии со свежеполученным осадком гидроксида меди (II) (с). Одноатомные предельные спирты с гидроксидом меди (II) не реагируют.
Предельные альдегиды, уксусный альдегид
• Производные предельных углеводородов, в молекулах которых углеводородный радикал связан с альдегидной группой 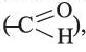 называются предельными альдегидами. Например:
называются предельными альдегидами. Например:
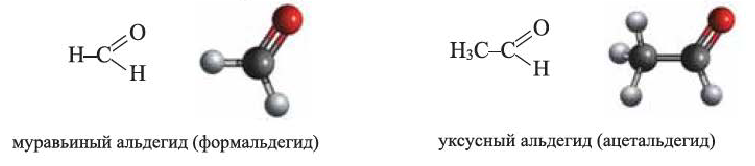
Общая формула альдегидов: R  CHO; только в муравьином альдегиде альдегидная группа связана с атомом Н: H
CHO; только в муравьином альдегиде альдегидная группа связана с атомом Н: H CHO. Группа >С=0 называется карбонильной группой.
CHO. Группа >С=0 называется карбонильной группой.
Получение: Ацетальдегид получают окислением этилового спирта оксидом меди (II), по реакции Кучерова - гидратацией ацетилена и др. способами:
Физические свойства: Ацетальдегид — бесцветная, летучая 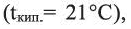 ядовитая жидкость с резким запахом.
ядовитая жидкость с резким запахом.
Формальдегид — ядовитый газ. Его 40%-ный водный раствор называют формалином.
Химические свойства: Ацетальдегид вступает в реакции окисления и присоединения. Например, при действии аммиачного раствора оксида серебра (I)  в воде не растворяется), ацетальдегид легко окисляется в уксусную кислоту. Реакция эта называется реакцией "серебряного зеркала ":
в воде не растворяется), ацетальдегид легко окисляется в уксусную кислоту. Реакция эта называется реакцией "серебряного зеркала ":
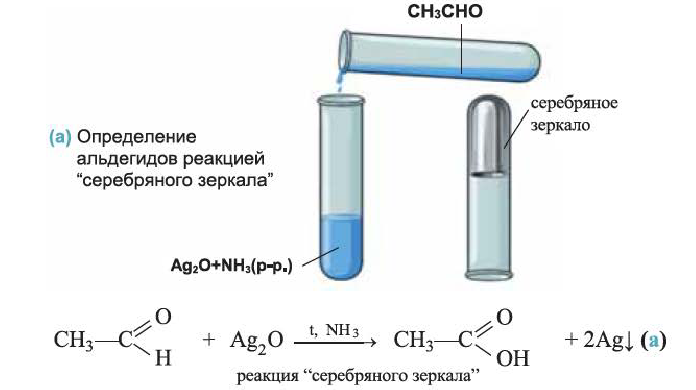
При слабом нагревании уксусный альдегид окисляется и со свежеосажденным гидроксидом меди(II):
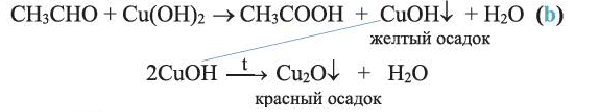
Обе реакции (а, b) используются для определения альдегидов. Альдегиды горят, образуя углекислый газ и воду:
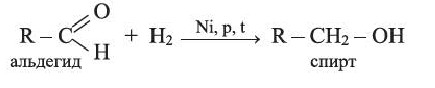
Присоединяя водород, альдегиды восстанавливаются до спиртов:
Вычисления, связанные с составом альдегидов:
Выразите относительную молекулярную массу предельных альдегидов 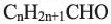 посредством числа атомов углерода (n) в алкильном радикале.
посредством числа атомов углерода (n) в алкильном радикале. 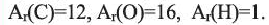
Решение:
Учитывая значения  элементов и их индексов в выражении
элементов и их индексов в выражении 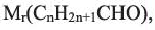 выразим
выразим 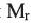 альдегидов посредством n:
альдегидов посредством n:
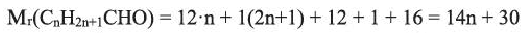
Применение: Из уксусного альдегида получают уксусную кислоту, пластмассы и лекарственные препараты.
Формальдегид используется в производстве различных смол, красителей, лекарственных препаратов. Он применяется для дубления кож, консервирования анатомических препаратов, дезинфекции хирургических инструментов, а также при протравливании семян перед посевом.
Определение: Определение альдегидов основывается на их окислении по реакции "серебряного зеркала" и свежеосажденным гидроксидом меди (II).
Карбоновые кислоты, уксусная кислота и высшие карбоновые кислоты
• Органические соединения, в молекулах которых углеводородный радикал связан с одной или несколькими карбоксильными (-СООН) группами, называются карбоновыми кислотами.
Предельные одноосновные карбоновые кислоты - уксусная кислота Простейшим представителем предельных одноосновных (содержащих одну -СООН группу) карбоновых кислот являются муравьиная и уксусная кислоты:
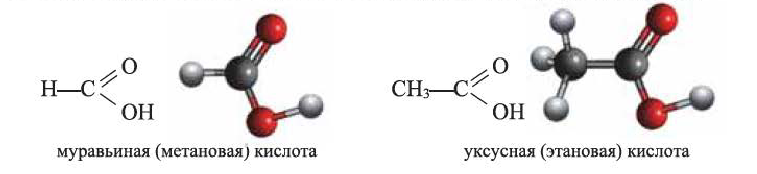
(а) Структурные формулы и шаростержневые модели муравьиной и уксусной кислот
Получение: В промышленности окислением бутана кислородом воздуха в присутствии катализатора получают уксусную кислоту:
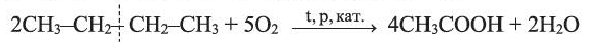
Физические свойства: Уксусная (этановая) кислота - при обычной температуре бесцветная жидкость с резким характерным запахом. С водой смешивается в любых соотношениях; ее 3-9%-ный водный раствор называют столовым уксусом, а 70-80%-ный раствор - уксусной эссенцией.
Химические свойства: Уксусная кислота обладает общими свойствами минеральных кислот: в воде частично диссоциирует; с активными металлами, щелочами, основными оксидами и с солями более слабых кислот вступает в реакции:
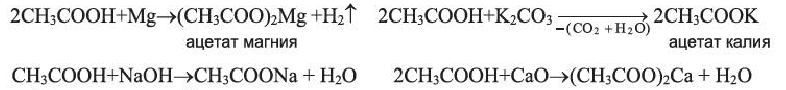
Применение: Уксусная кислота применяется в производстве пластмасс, различных красителей, лекарственных препаратов, ацетатного волокна, негорючей кинопленки и др. Она применяется также при консервировании овощей и как столовый уксус.
Определение: Уксусную кислоту можно отличить по ее характерному запаху.
Высшие  карбоновые кислоты - пальмитиновая, стеариновая и олеиновая
карбоновые кислоты - пальмитиновая, стеариновая и олеиновая
Важнейшими представителями предельных одноосновных высших карбоновых кислот являются пальмитиновая (гексадекановая) и стеариновая (октадекановая) кислоты:
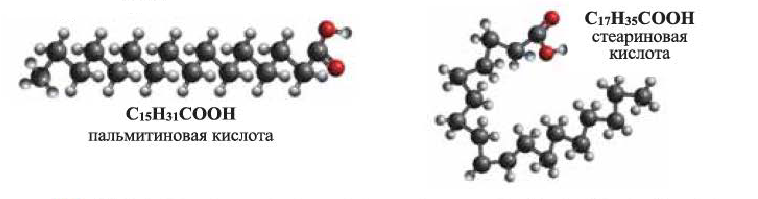
(b) Шаростержневые модели молекул пальмитиновой и стеариновой кислот
Они в виде глицеридов — сложных эфиров глицерина - входят в состав растительных и животных жиров. Пальмитиновая и стеариновая кислоты - твердые вещества белого цвета, не растворяющиеся в воде. Их смесь, называемая стеарином, используют в изготовлении стеариновых свечей. Натриевые соли пальмитиновой и стеариновой кислот являются основной составной частью твердого мыла, а калиевые соли - жидкого мыла.
Из непредельных карбоновых кислот, содержащих в углеводородном радикале одну С=С связь, большое практическое значение имеет олеиновая кислота 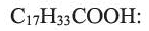
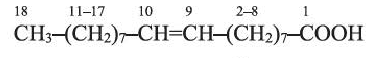
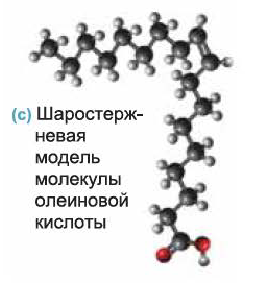
Олеиновая кислота - жидкость без запаха и вкуса. В больших количествах содержится в оливковом, подсолнечном, кукурузном, миндальном маслах.
Вычисления связанные с составом карбоновых кислот
Выразите относительную молекулярную массу предельных карбоновых кислот 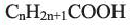 посредством числа атомов углерода (n) в алкильном радикале.
посредством числа атомов углерода (n) в алкильном радикале. 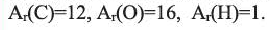
Решение.
Учитывая значения 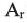 элементов и их индексов выражении
элементов и их индексов выражении 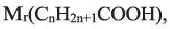 выразим
выразим 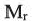 карбоновых кислот посредством n:
карбоновых кислот посредством n:
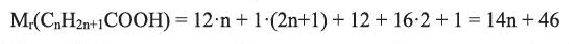
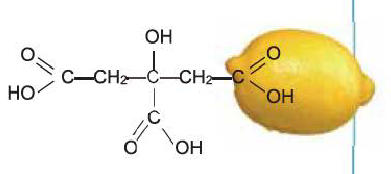
Лимонная кислота проявляет свойство трехосновной карбоновой кислоты. Содержится, в основном, в лимоне и других цитрусовых растениях.
Применяется в пищевой промышленности при приготовлении освежающих напитков и карамельных изделий, а также в фармацевтике.
Сложные эфиры
• Органические соединения, образующиеся в результате взаимодействия карбоновых кислот со спиртами, называются сложными эфирами, а сами реакции — реакциями этерификации:
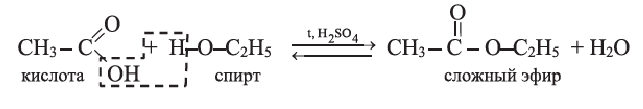
Реакция этерификации - обратимая реакция и протекает в присутствии концентрированной серной кислоты.
Общую формулу сложных эфиров можно представить так: 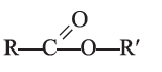
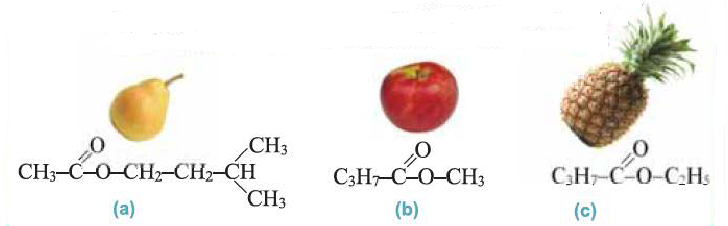
Сложные эфиры одноосновных карбоновых кислот с небольшой молекулярной массой — малорастворимые в воде летучие жидкости, легче воды. Многие из сложных эфиров имеют приятный фруктовый запах. Они содержатся в цветах, фруктах, плодах и ягодах. Специфический аромат этих растений обусловлен присутствием в их составах сложных эфиров (а, b, с).
Это интересно: Изоамиловый эфир уксусной кислоты имеет запах груш (а), метиловый эфир бутановой кислоты — запах яблок (b), этиловый эфир бутановой кислоты — залах ананаса (c).
Сложные эфиры используются в качестве растворителя эфиров целлюлозы. Сложные эфиры в виде фруктовых эссенций, наряду с другими душистыми веществами, применяются в производстве фруктовых соков, освежающих напитков, карамельных изделий, а также в изготовлении духов и одеколонов.
Жиры
• Жиры - сложные эфиры глицерина и одноосновных (главным образом высших) карбоновых кислот. Их общее название — триглицериды.
В состав жиров входят, главным образом, остатки пальмитиновой, стеариновой и олеиновой кислот. Впервые триглицерид стеариновой кислоты (d) был синтезирован М.Бертло в 1854 г:
(d)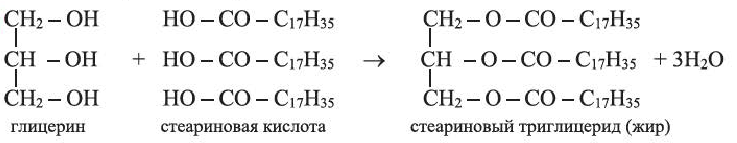
Как правило, твердые жиры образованы предельными высшими кислотами, жидкие жиры (масла) - непредельными высшими кислотами. При гидрировании С=С связей, содержащихся в жидких жирах, они превращаются в твердые жиры. Эта реакция лежит в основе промышленного получения маргарина.
Жиры животного происхождения (говяжий, бараний жир) обычно бывают твердыми, большинство растительных жиров (подсолнечное, кукурузное, оливковое масло) — жидкие жиры.
В технике гидролиз жиров (реакция, обратная реакции (d), широко используется для получения глицерина, карбоновых кислот, мыл, стеарина. Являясь составной частью пищи, жиры играют большую роль в жизни животных и человека. Они являются основным источником энергии в организме.
Мыла и другие моющие средства
• Натриевые и калиевые соли высших карбоновых кислот называются мылами. Натриевые соли образуют твердые мыла, а калиевые соли - жидкие мыла.
Раньше мыла получали гидролизом растительных и животных жиров в присутствии щелочи или соды. Поэтому гидролиз жиров в присутствии щелочи называют омылением.
В настоящее время карбоновые кислоты, используемые в производстве мыл, получают окислением парафинов нефти:
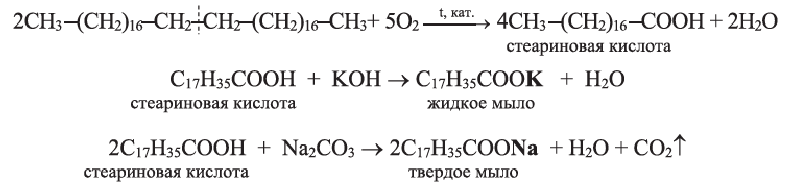
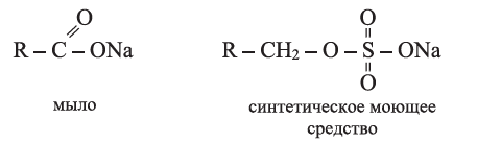
В быту и на производстве вместо мыла используют синтетические моющие средства, например, стиральные порошки. Преимущество синтетических моющих средств состоит в том, что они, в отличие от обычных мыл, не теряют моющие свойства в жесткой воде. В общем виде формулы мыл и синтетических моющих средств можно представить следующим образом:
Углеводы
- Что объединяет муку, древесные опилки, сахар, яблоко, виноград?

Углеводы - органические соединения с общей формулой 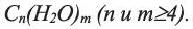
Углеводы подразделяются на моносахариды, дисахариды и полисахариды. Моносахариды — углеводы, неподвергающиеся гидролизу. К ним относятся глюкоза, фруктоза и др. Дисахариды — углеводы, при гидролизе которых из одной молекулы образуются две молекулы моносахарида. К дисахаридам относятся сахароза, мальтоза и др. Полисахариды — углеводы, при гидролизе которых из одной молекулы образуется много молекул моносахаридов. Полисахаридами являются крахмал, целлюлоза и др.
Моносахариды - глюкоза и фруктоза
Глюкоза в больших количествах содержится в виноградном соке (поэтому ее называют виноградным сахаром), меде, спелых фруктах и ягодах. В организме человека глюкоза содержится в мышцах и в крови (до 0,1%). В растениях глюкоза образуется в ходе процесса фотосинтеза:
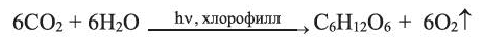
Фруктоза 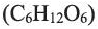 содержится в составе многих фруктов, поэтому ее называют фруктовым сахаром. Фруктоза - важнейшая составная часть меда (50%). Она слаще глюкозы и это объясняет то, почему мед настолько сладкий.
содержится в составе многих фруктов, поэтому ее называют фруктовым сахаром. Фруктоза - важнейшая составная часть меда (50%). Она слаще глюкозы и это объясняет то, почему мед настолько сладкий.
Поскольку молекулярные формулы глюкозы и фруктозы одинаковы, то они являются изомерами друг друга.
Глюкоза используется в медицине для консервирования крови и укрепления ослабленного организма. Она применяется в карамельной промышленности (в производстве карамели, мармелада, помадки и др.), в текстильной промышленности при нанесении узоров на ткани, в синтезе витамина С (аскорбиновой кислоты). В технике брожением глюкозы получают этиловый спирт.
Дисахарид - сахароза
Сахароза, как дисахарид, подвергается гидролизу. При этом образуются молекулы двух моносахаридов - глюкозы и фруктозы.
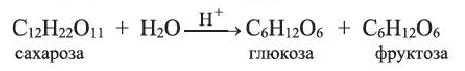
Сахароза содержится, главным образом, в сахарной свекле (12-20%) и сахарном тростнике (14-26%). Поэтому ее называют свекловичным или тростниковым сахаром. Сахароза - основная составная часть сахара. Выделяют ее, в основном, из сахарной свеклы и сахарного тростника.
Полисахариды - крахмал и целлюлоза
Из углеводов более сложное строение имеют крахмал и целлюлоза.
Крахмал — природный полимер 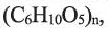 состоящий из остатков глюкозы. Он образуется в растениях в ходе фотосинтеза — вначале глюкоза, затем из нее крахмал:
состоящий из остатков глюкозы. Он образуется в растениях в ходе фотосинтеза — вначале глюкоза, затем из нее крахмал:
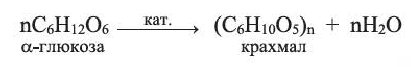
Крахмал получают, в основном, из картофеля, а также из риса и кукурузы.
Крахмал - белое порошкообразное вещество без вкуса. В холодной воде не растворяется, однако в горячей воде набухает, образуя коллоидный раствор, с клеящими свойствами (крахмальный клейстер). Крахмал подвергается гидролизу. Конечным продуктом гидролиза является 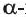 глюкоза*:
глюкоза*:
Крахмал применяется для получения декстринов, патоки (смесь декстринов с глюкозой), использующихся в производстве карамельных изделий, глюкозы и этилового спирта. Его используют как клеящее вещество, а также для накрахмаливания тканей. В медицине крахмал используется для приготовления присыпок, медицинских паст, при изготовлении таблеток и капсул для лекарств.
Определение крахмала основывается на образовании синего окрашивания при его взаимодействии с йодом (а).

(а) Посинение крахмала, содержащегося в картофеле, под влиянием йода
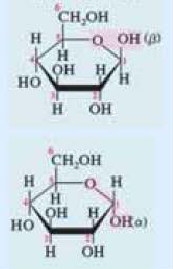
* молекула 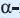 глюкозы отличается от молекулы
глюкозы отличается от молекулы 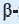 глюкозы лишь пространственным расположением ОН групп, связанных с атомами углерода
глюкозы лишь пространственным расположением ОН групп, связанных с атомами углерода 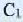 и
и 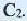
Целлюлоза, по сравнению с крахмалом, более распространенный углевод. Он образует стенки всех растительных клеток. В древесине содержится около 50% целлюлозы, а в волокнах хлопка и фильтровальной бумаге — до 98%.
Целлюлоза, как и крахмал, природный полимер состава 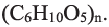 Целлюлозу получают из хлопка, древесины и др.
Целлюлозу получают из хлопка, древесины и др.
Целлюлоза — белое, твердое вещество, в воде и в обычных органических растворителях (спирт, эфир, ацетон) не растворяется. Как и крахмал, целлюлоза при нагревании в разбавленных кислотах подвергается гидролизу: при этом образуется 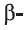 глюкоза*:
глюкоза*:
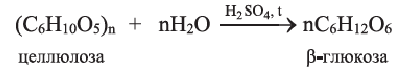
Целлюлоза в виде льна и хлопка используется в производстве тканей. Большое ее количество расходуется в производстве бумаги и этилового спирта. Этиловый спирт получают путем брожения глюкозы, образующейся при гидролизе целлюлозы:
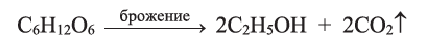
Этиловый спирт, полученный таким путем, называют гидролизным спиртом. Химическим превращением целлюлозы получают вискозный и ацетатный шелка, пластмассы, негорючие кино- и фотоматериалы, а также бездымный порох.
Вычисления, связанные с гидролизом крахмала и брожением глюкозы
Сколько кг глюкозы можно получить гидролизом 324 кг крахмала. Выход глюкозы составляет 80% 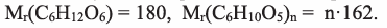
Решение:
Вначале вычислим теоретически ожидаемую (базу потери) массу глюкозы, которую можно получить гидролизом 324 кг крахмала. Так как выход 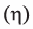 глюкозы составляет 80% (или 0,8), то масса глюкозы полученная на самом деле
глюкозы составляет 80% (или 0,8), то масса глюкозы полученная на самом деле 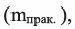 будет равна:
будет равна:
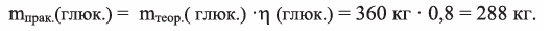
Белки
• Белки (полипептиды) - органические вещества, образованные из остатков аминокислот.
• Аминокислоты - органические соединения, молекулы которых содержат аминную 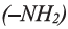 и карбоксильную (-СООН) группы.
и карбоксильную (-СООН) группы.
Аминокислоту можно рассматривать как производное карбоновой кислоты, в углеводородном радикале которого атом Н замещен на группу, например:
группу, например:

Аминокислоты посредством своих функциональных групп — основной —  и кислотной (-СООН) взаимодействуют между собой, образуя полимеры - белки:
и кислотной (-СООН) взаимодействуют между собой, образуя полимеры - белки:
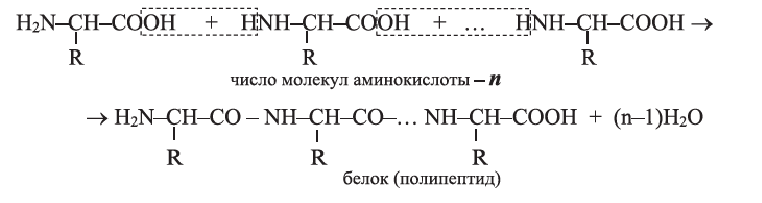
• Реакции образования высокомолекулярного вещества из низкомолекулярного, сопровождающиеся выделением в качестве побочного продукта, например воды, называются реакциями поликонденсации.
Группу атомов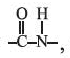 образующуюся в ходе реакции, называют пептидной или амидной группой, а связь C-N - пептидной (амидной) связью.
образующуюся в ходе реакции, называют пептидной или амидной группой, а связь C-N - пептидной (амидной) связью.
В молекуле полимера эта связь многократно повторяется, поэтому полимер называют полипептидом.
Строение и свойства белков:
Белки имеют сложное строение. В настоящее время различают первичную, вторичную, третичную и четвертичную структуры белковой молекулы.
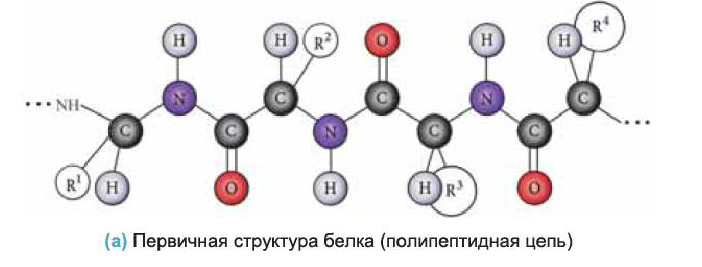
• Последовательность аминокислотных остатков в полипептидной цепи называется первичной структурой белка. Например, первичная структура белка, изображенного внизу, определяется  последовательностью аминокислотных остатков (а).
последовательностью аминокислотных остатков (а).
• Вторичная структура белка — пространственная форма полипептидной цепи в отдельных ее участках. В большинстве природных белков полипептидная цепь имеет спиралеобразную форму (b). Такую форму вторичной структуры белка называют 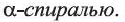
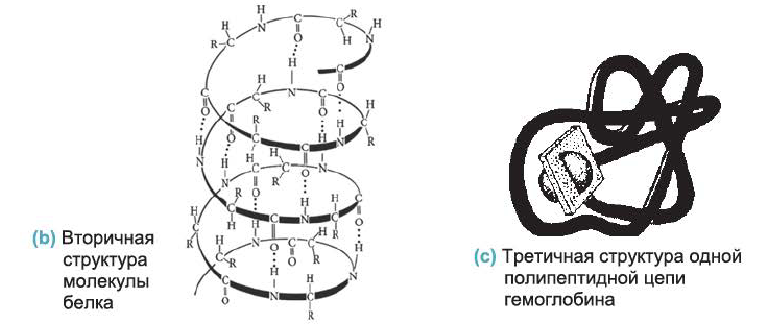
• Третичная структура белка — форма, которую спираль приобретает в пространстве. В простейшем случае третичную структуру белка можно представить в виде клубка, в который свернулась спираль, например, как в случае одной полипептидной цепи гемоглобина (с).

Проводил исследования в области химии белков и ферментов. Выдвинул теорию строения молекулы белка (1888).

Лауреат Нобелевской премии (1902). Исследования посвящены химии углеводов и белков. Синтезировал ряд физиологически активных веществ.
Характерные химические свойства белков определяются их способностью подвергаться гидролизу, денатурации и вступать в цветные реакции. Гидролизом белков получено примерно 20 разных аминокислот:
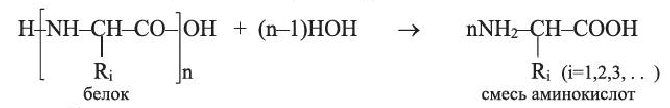
Гидролиз белков лежит в основе процесса пищеварения.
• Денатурация -разрушение вторичной и третичной структуры белка. При варке яиц, приготовлении пищи, свертывании крови или скисании молока и др. мы имеем дело с явлением денатурации белков.
Определение белков. Определение белков основывается на их способности вступать в цветные реакции и на появлении запаха жженых перьев при их сильном нагревании или горении. Например, при действии на белок в щелочной среде водным раствором сульфата меди(II), раствор окрашивается в красно-фиолетовый цвет (d).
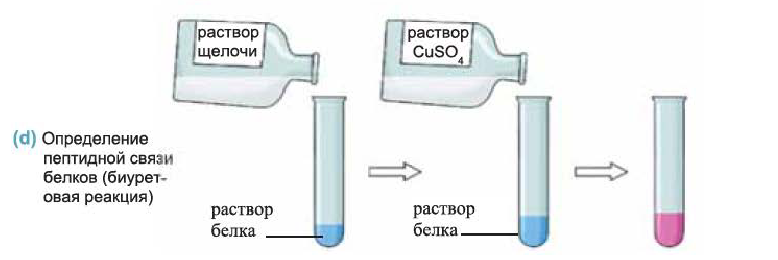
Эта реакция (называется биуретовой реакцией) доказывает наличие пептидных связей в исследуемом веществе.
Значения белков:
Белки регулируют характерные признаки и функции живого организма -рост, движение, деятельность органов чувств, явления иммунитета и др. Недостаток белков в пище может быть причиной серьёзных заболеваний.
В промышленности белки применяются в виде природных волокон (шелк, шерсть), кожи, пластмасс и клеев.
В настоящее время многие белковые вещества — гормоны, ферменты, антибиотики—получают биотехнологическими методами с помощью микроорганизмов.
Поликонденсация аминокислоты и гидролиз полипептида
При поликонденсации аминокислоты образовалось 7,2 г воды и 30,3 г пентапептида. Вычислите 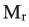 аминокислоты.
аминокислоты.
Решение:
Найдя массу аминокислоты, вступившей в реакцию: 30,3 + 7,2 = 37,5 г из уравнения реакции вычислим 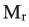 аминокислоты:
аминокислоты:
Высокомолекулярные вещества - полимеры
• Вещества, состоящие из многократно повторяющихся групп атомов, называются полимерами или высокомолекулярными соединениями.
Молекулы полимерных веществ (макромолекулы) имеют большие относительные молекулярные массы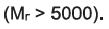
Полимеры получают реакциями полимеризации и поликонденсации.
• Реакции образования высокомолекулярных веществ в результате многократного соединения молекул мономеров друг с другом называются реакциями полимеризации.
Реакция полимеризации характерна, в основном, непредельным соединениям и протекает за счет разрыва двойных или тройных связей в исходных молекулах. Например, реакцию полимеризации этилена схематично можно представить так:
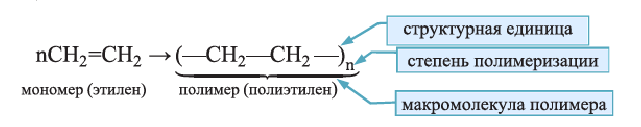
Низкомолекулярные вещества, образующие полимеры, называют мономерами. Группы атомов, многократно повторяющиеся в макромолекуле, называют структурной единицей полимера. Число структурных единиц в макромолекуле называют степенью полимеризации (n). Если обозначить "относительную молекулярную массу" структурной единицы как 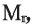 то относительную молекулярную массу полимера
то относительную молекулярную массу полимера 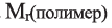 можно выразить как:
можно выразить как: 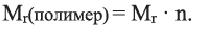
Реакцию полимеризации этилена можно представить следующим образом:
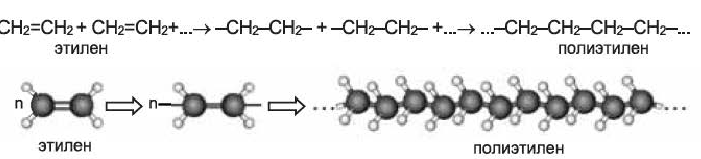
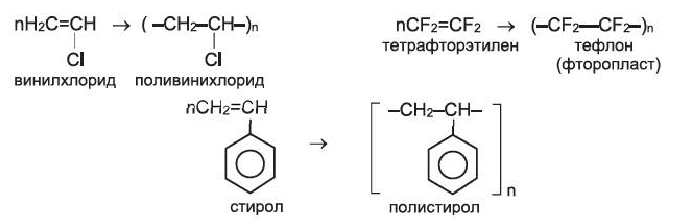
К важнейшим полимерам, получаемым реакцией полимеризации, наряду с полиэтиленом и полипропиленом, относятся также поливинилхлорид, тефлон (политетрафторэтилен), полистирол и др.:
Реакцией поликонденсации образуются белки, в промышленности получают волокна капрона и лавсана (стр. 193). В промышленности совместной поликонденсацией формальдегида с фенолом получают фенолформальдегидную смолу, имеющую важное практическое значение. Реакцию образования фенол-формальдегидной смолы, можно представить так: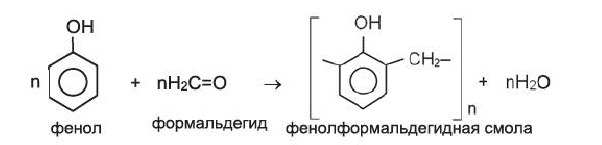
По происхождению полимеры подразделяют на 3 группы: природные (биополимеры), искусственные и синтетические полимеры.
К природным полимерам относятся целлюлоза, крахмал, природный каучук, белки, нуклеиновые кислоты; к искусственным — три- и диацетилцеллюлоза, три- и динитроцеллюлоза, вулканизированный природный каучук; к синтетическим - полиэтилен, полипропилен, лавсан, капрон, бутадиеновый каучук.
По строению макромолекулы различают полимеры линейного (а), разветвленного (b) и сетчатого (с), строения. Линейными полимерами являются полиэтилен низкого давления, целлюлоза, лавсан, капрон, природный каучук, полистирол; разветвленными полимерами — гликоген, полиэтилен высокого давления, сетчатыми полимерами — фенолформальдегидные смолы, резина (вулканизированный каучук) и др.

Вычисления, связанные с относительной молекулярной массой полимера
Вычислите степень полимеризации полиэтилена, если относительная молекулярная масса полимера равна 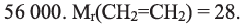
Решение.
Если учесть, что m, то есть 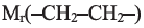 равна 28, то из выражения
равна 28, то из выражения 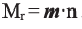 легко вычислить степень полимеризации - n.
легко вычислить степень полимеризации - n.
Пластмассы и волокна
Пластмассы — полимерные материалы, способные приобретать при нагревании заданную форму и сохранять ее после охлаждения.
Из-за своей легкости, большой механической прочности, высокой химической стойкости, хороших теплоизоляционных и электроизоляционных свойств пластмассы находят широкое практическое применение.
Например, такие пластмассы, как полиэтилен, полипропилен, поливинил-хлорид, полистирол и его сополимеры, фенолформальдегидные смолы и др. применяются в различных областях промышленности, сельского хозяйства, в медицине, быту и т.д.
Волокна — природные и синтетические полимеры, способные вытягиваться в длинные гибкие нити, из которых изготавливают пряжу и другие текстильные изделия
Различают волокна природные и химические. Природные или натуральные волокна подразделяются на волокна растительного и животного происхождения (d), например, хлопок, лен, шерсть и шелк.
Химические волокна подразделяются на искусственные и синтетические.
Искусственные ацетатное и вискозное волокна получают химическими превращениями целлюлозы. Синтетические волокна изготавливают из синтетических полимеров; например, капрона, нейлона и лавсана.
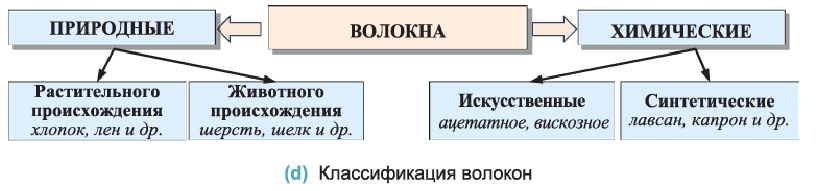
Состав и способы получения волокон будут рассмотрены в последующих классах.
Углеводороды
Углеводороды — соединения, от которых происходят все органические вещества. Они широко распространены в природе; из них почти полностью состоят нефть и природный газ. Эти полезные ископаемые и продукты их переработки используют в качестве топлива, горючего, сырья в производстве полимерных материалов, средств защиты растений, товаров бытовой химии, лекарств и т. п.
Слово «углеводород» происходит от двух слов — «углерод» (общее название простых веществ Карбона) и «водород» (название простого вещества Гидрогена).
Углеводороды — соединения Карбона с Гидрогеном.
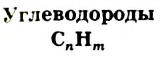
Общая формула углеводородов — 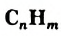 .
.
В 9 классе вы будете изучать насыщенные и ненасыщенные углеводороды. Существуют и другие названия этих соединений — предельные углеводороды, непредельные углеводороды.
Углеводороды, в молекулах которых атомы Карбона соединены друге другом простыми ковалентными связями, называют насыщенными, а имеющие также двойные и или тройные связи — ненасыщенными.
Насыщенные углеводороды получили такое название потому, что каждый атом Карбона в их молекулах использует свои валентные возможности в полной мере, соединяясь с максимальным числом других атомов.
Метан
Простейшим насыщенным углеводородом является метан. Формула этого соединения — 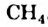 .
.
Распространенность в природе. Метан —-основной компонент природного газа. Кго объемная доля в зависимости от месторождения составляет 85—99 %. Он также содержится в нефти, угольных залежах. В Украине имеются месторождения природного газа; ежегодно его добывают до 20 млрд  .
.
В природе метан образуется при разложении останков растений и животных без доступа воздуха. Поскольку метан нередко выделяется из болот, его иногда называют болотным газом.
Это интересно. По утверждениям ученых метан входит в состав газовых оболочек и твердых частей Юпитера и Сатурна.
Строение молекулы: В молекуле метана, как и в молекулах других органических соединений, атом Карбона четырехвалентный. Чтобы проявлять такую валентность, он должен иметь четыре неспаренных электрона. Это достигается путем возбуждения атома и перехода одного электрона из  -орбитали в вакантную
-орбитали в вакантную  -орбиталь:
-орбиталь:
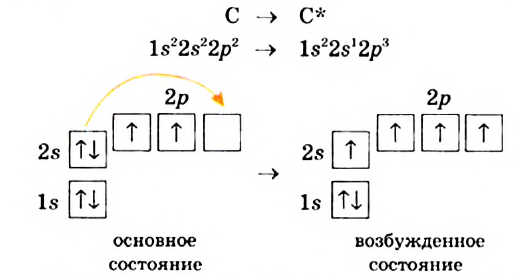
Каждая внешняя орбиталь возбужденного атома Карбона содержит один электрон.
За счет четырех неспаренных электронов атома Карбона и электронов четырех атомов Гидрогена в молекуле метана образуются четыре общих электронных пары:

Приведенные формулы не отражают пространственного строения молекулы метана. В соответствии с ними все атомы в молекуле должны находиться в одной плоскости, а углы между соседними черточками-связями — составлять 90°. На самом деле это не так.
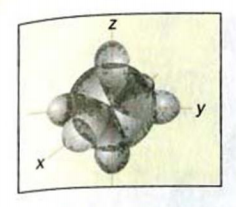
Рис. 45. 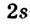 -орбиталь и три
-орбиталь и три 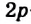 -орбитали атома Карбона
-орбитали атома Карбона
При образовании молекулы метана 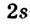 -орбиталь и три
-орбиталь и три 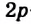 -орбитали атома Карбона (рис. 45) превращаются в четыре одинаковые орбитали, имеющие вид объемных несимметричных восьмерок:
-орбитали атома Карбона (рис. 45) превращаются в четыре одинаковые орбитали, имеющие вид объемных несимметричных восьмерок:
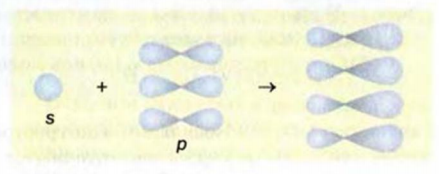
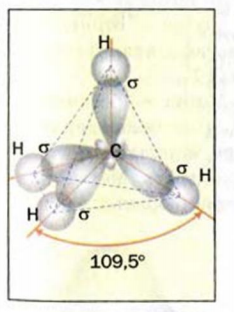
Рис. 46. Размещение орбиталей в молекуле метана
Изменившиеся орбитали размещаются в трехмерном пространстве на одинаковом удалении друг от друга под углами 109,5° (рис. 46).
Больший «лепесток» каждой новой орбитали атома Карбона перекрывается со сферической орбиталью одного из атомов Гидрогена. Так образуются четыре ковалентные связи С-Н. Перекрывание орбиталей атомов Карбона и Гидрогена происходит вдоль линий, которые соединяют центры атомов. Такую кова-лентную связь называют простой, или  -связью.
-связью.
Если соединить линиями центры всех атомов Гидрогена, то получим геометрическую фигуру — тетраэдр' (рис. 46). Поэтому говорят, что молекула метана имеет тетраэдрическое строение. Слово тетраэдр происходит от греческих слов tetra — четыре и hedra — поверхность. Тетраэдр имеет четыре одинаковые грани, которые являются правильными треугольниками.
Модели молекулы метана изображены на ' рисунке 47. Существуют компьютерные программы, с помощью которых можно «построить» модель любой молекулы.
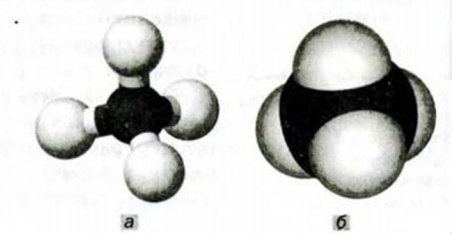
Рис. 47. Модели молекулы метана: а — шаростержневая; б — масштабная. Белые шарики — атомы Гидрогена, черные — атомы Карбона
Поскольку электроотрицательности Карбона и Гидрогена отличаются мало, то ковалентная связь С-Н является малополярной. Однако сама молекула 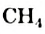 , неполярна; ее невозможно разделить на две части, одна из которых имела бы положительный заряд, а другая — отрицательный. Этим молекула метана отличается от полярной молекулы воды.
, неполярна; ее невозможно разделить на две части, одна из которых имела бы положительный заряд, а другая — отрицательный. Этим молекула метана отличается от полярной молекулы воды.
Физические свойства: Метан — бесцветный газ, не имеющий запаха. При охлаждении до температуры -162 °С (при нормальном давлении) он превращается в жидкость. Метан легче воздуха; этот газ почти не растворяется в воде.
Химические свойства: Метан 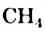 , химически пассивен. Он, например, не проявляет кислотных свойств, как хлороводород
, химически пассивен. Он, например, не проявляет кислотных свойств, как хлороводород 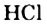 или сероводород
или сероводород 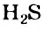 в водном растворе. Причиной этого является очень малая полярность связей С-Н.
в водном растворе. Причиной этого является очень малая полярность связей С-Н.
Метан не взаимодействует с водой (в обычных условиях), металлами, оксидами, основаниями, кислотами, солями. Соединение реагирует с кислородом и галогенами — фтором, хлором, бромом.
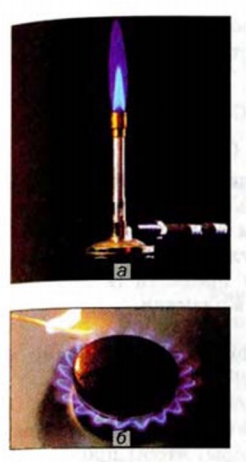
Рис. 48. Горение метана: а — в газовой горелке; б — в конфорке бытовой плиты
Реакция горения. Метан, как и большинство органических соединений, является горючим веществом. На воздухе он горит голубоватым пламенем (рис. 48):
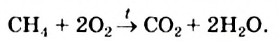
Обратите внимание: в уравнениях реакций с участием органических соединений записывают стрелки, а не знаки равенства.
Определить продукты реакции горения метана можно с помощью опыта, изображенного на рисунке 49. Изменение белого цвета безводного купрум(II) сульфата на голубой свидетельствует об образовании при горении метана водяного пара, который взаимодействует с солью (продукт реакции — медный купорос). Помутнение известковой воды вызывает кальций карбонат, образующийся в результате реакции углекислого газа с раствором кальций гидроксида.
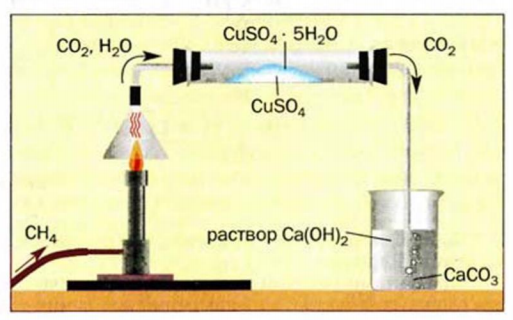
Рис. 49. Обнаружение Продуктов горения метана
Если воздуха (кислорода) недостаточно, то при горении метана может образовываться угарный газ или углерод:
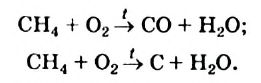
О недостатке кислорода при горении метана может свидетельствовать увеличение яркости пламени (оно становится желтым из-за раскаленных мелких частиц углерода) или появление копоти на поверхности предмета (кастрюли, чайника), находящегося в пламени. Копоть, или сажа, — вещество, которое почти полностью состоит из атомов Карбона.
Смесь метана и воздуха (или кислорода) взрывоопасна. Достаточно искры, чтобы произошел взрыв. Поэтому нужно быть очень осторожным, пользуясь природным газом в быту. Взрывы смесей метана с воздухом, несмотря на меры предосторожности, время от времени случаются в угольных шахтах. Они приводят к гибели шахтеров.
Реакции с галогенами: Метан на свету, а при нагревании — и в темноте, взаимодействует с хлором. Это — реакция замещения. Продуктами реакции замещения в органической химии являются два сложных вещества, а в неорганической химии — сложное и простое. Реакци замещения заключается в последовательном замещении атомов Гидрогена в молекуле метана на атомы Хлора:
Реакцию между органическим соединением и хлором называют реакцией хлорирования, а ее продукты — хлоропроизводными этого соединения.
Хлорирование метана можно проиллюстрировать такой схемой:
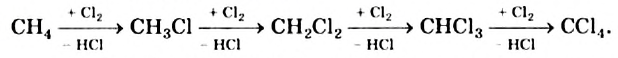
В ней над каждой стрелкой указана формула реагента, а под стрелкой — формула «второстепенного» продукта реакции (в данном случае — хлороводорода). Такую запись последовательных реакций используют в органической химии довольно часто.
Осуществить какую-либо одну стадию взаимодействия метана с хлором не удается; всегда одновременно образуются несколько хлоропро-изводных этого углеводорода.
Реакция метана с бромом происходит аналогично. Со фтором метан взрывается, а с иодом в обычных условиях не взаимодействует.
Реакции с водяным паром и углекислым газом: Метан взаимодействует при высокой температуре в присутствии катализаторов с водяным паром, а также с углекислым газом. Эти реакции имеют практическую значимость. Их осуществляют в промышленности для получения карбон(II) оксида, водорода, горючих газовых смесей:
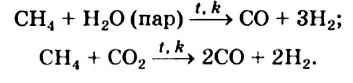
Смесь 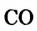 и
и 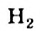 называют синтез-газом. Из нее на химических заводах производят жидкое горючее, некоторые органические вещества.
называют синтез-газом. Из нее на химических заводах производят жидкое горючее, некоторые органические вещества.
Термическое разложение: При сильном нагревании без доступа воздуха метан разлагается на простые вещества:
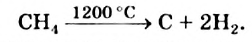
Осуществляя эту реакцию, в промышленности получают водород и сажу — наполнитель резины.
Применение: Метан (природный газ) используют главным образом в качестве топлива — в теплоэнергетике, промышленности, быту. Иногда он служит горючим в автомобильных двигателях.

Рис. 50. Автобус, двигатель которого работает на природном газе
На транспортных средствах устанавливают баллоны с природным газом, находящимся в них под высоким давлением (рис. 50). Метан также является сырьем для производства важных органических веществ.
Физиологическое действие: Метан при длительном вдыхании вызывает отравление, которое иногда приводит к смерти. Для легкости обнаружения утечки газа из газопровода, баллона или плиты к нему на газораспределительных станциях добавляют вещества с очень неприятным запахом. Пользуясь газом в быту, нужно чаще проветривать помещение.
Выводы:
- Метан
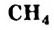 — простейший насыщенный углеводород. Он является основным компонентом природного газа. Молекула соединения имеет тетраэдрическое строение.
— простейший насыщенный углеводород. Он является основным компонентом природного газа. Молекула соединения имеет тетраэдрическое строение. - Метан — бесцветный газ, не имеющий запаха, нерастворимый в воде. Это — химически пассивное соединение, которое взаимодействует с кислородом, галогенами, а при высокой температуре — с водяным паром и углекислым газом.
- Метан (природный газ) используют в качестве топлива и горючего, а также как сырье в химической промышленности.
Гомологи метана (алканы)
Формулы соединений: В предыдущем параграфе шла речь о простейшем насыщенном углеводороде — метане 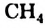 . Выведем формулы насыщенных углеводородов, молекулы которых содержат два и три атома Карбона. Сначала соединим атомы Карбона черточками (как известно, черточкой обозначают простую ковалентную связь):
. Выведем формулы насыщенных углеводородов, молекулы которых содержат два и три атома Карбона. Сначала соединим атомы Карбона черточками (как известно, черточкой обозначают простую ковалентную связь):

Затем от каждого атома Карбона проведем столько дополнительных черточек, чтобы их у него было всего четыре (атом Карбона четырехвалентный):

После этого допишем к каждой черточке атом Гидрогена и получим формулы соответствующих углеводородов:
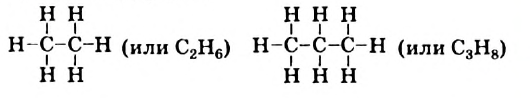
Составленные структурные формулы молекул можно записать в сокращенном виде, оставив черточки только между атомами Карбона: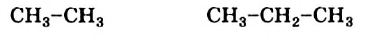
Таким способом можно вывести структурные формулы молекул других углеводородов с простыми ковалентными связями и открытой неразветвленной цепью из атомов Карбона.
Углеводороды 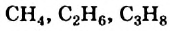 принадлежат к гомологическому ряду метана.
принадлежат к гомологическому ряду метана.
Гомологическим рядом называют ряд органических соединений, молекулы которых имеют сходное строение и отличаются по составу на одну или несколько групп атомов 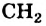 .
.
Группа атомов 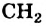 получила название «гомологическая разность». Соединения
получила название «гомологическая разность». Соединения 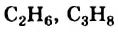 и многие другие являются гомологами метана.
и многие другие являются гомологами метана.
Насыщенные углеводороды, в молекулах которых имеется открытая цепь из атомов Карбона, называют алканами.
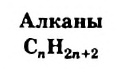
Для того чтобы составить химическую формулу алкана с четырьмя атомами Карбона в молекуле, достаточно добавить к формуле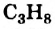 группу атомов
группу атомов 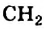 . Получаем:
. Получаем: 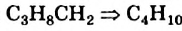 . Эту формулу можно также вывести из формулы метана:
. Эту формулу можно также вывести из формулы метана: 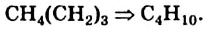
Если алкан содержит 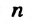 атомов Карбона в молекуле, то его формула —
атомов Карбона в молекуле, то его формула — 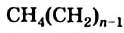 , или
, или 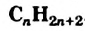 . Вторая формула является общей для этого типа.
. Вторая формула является общей для этого типа.
Названия: Для четырех простейших по составу алканов существуют такие названия: метан, этан, пропан, бутан. Названия остальных алканов происходят от иноязычных числительных (с. 15), которые соответствуют числу атомов Карбона в молекулах соединений (табл. 1). Все названия алканов имеют суффикс -ан, такой же, как и в общем названии этих углеводородов.
Таблица 1

Строение молекул. Вам известно, что молекула метана имеет форму тетраэдра. Выясним пространственное строение молекул других алканов.
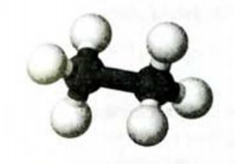
Рис. 51. Шаростержневая модель молекулы этана
В соответствии с моделями молекул этана (рис. 51) и пропана, все атомы в них размещены не на плоскости, а в трехмерном пространстве. В молекулах пропана, бутана (рис. 52), других гомологов метана центры атомов Карбона находятся на ломаной, зигзагообразной линии. Поэтому сокращенные структурные формулы молекул пропана и бутана должны выглядеть так:
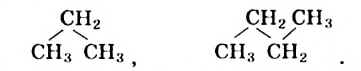
В школьном курсе химии для упрощения используют не зигзагообразные, а линейные структурные формулы молекул углеводородов.
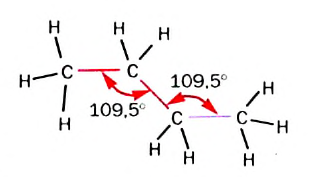
Рис. 52. Зигзагообразная форма карбоновой цепи молекулы бутана
Выводы:
- Насыщенные углеводороды с открытой карбоновой цепью в молекулах называют алканами. Их общая формула —
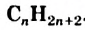 .
. - Ряд органических соединений, имеющих сходные по строению молекулы, отличающиеся по составу на одну или несколько групп атомов
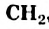 , называют гомологическим рядом.
, называют гомологическим рядом. - Названия большинства алканов состоят из соответствующих иноязычных числительных и суффикса
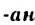 .
. - Молекулы пропана и последующих гомологов метана имеют зигзагообразную карбоновую цепь.
Изомерия:
Для молекулы 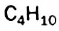 можно построить не только «линейную» карбоновую цепь
можно построить не только «линейную» карбоновую цепь 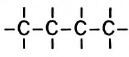 . но и разветвленную:
. но и разветвленную: 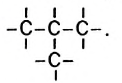
Соответствующие структурные формулы и их сокращенные варианты имеют такой вид:


Каждая формула отвечает определенной молекуле. Таким образом, существуют два насыщенных углеводорода с одинаковыми химическими формулами 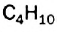 , но с молекулами разного строения — неразветвленного и разветвленного.
, но с молекулами разного строения — неразветвленного и разветвленного.
Соединения, молекулы которых имеют одинаковый состав, но разное строение, называют изомерами, а явление существования таких соединений — изомерией.
С увеличением числа атомов Карбона в молекулах углеводородов количество изомеров резко возрастает. Для соединений  и
и  изомеров не существует. Одну и ту же формулу
изомеров не существует. Одну и ту же формулу 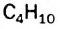 имеют два углеводорода,
имеют два углеводорода, 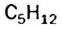 — три.
— три. 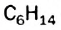 — пять,
— пять, 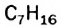 — девять и т. д.
— девять и т. д.
Явление изомерии — одна из причин разнообразия и многочисленности органических соединений.
Если молекула углеводорода имеет неразветвленное («нормальное») строение, то перед его названием записывают букву н и дефис. Например, соединение с формулой 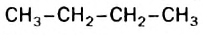 называют н-бутаном. Изомер бутана
называют н-бутаном. Изомер бутана 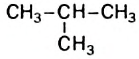 имеет название «изобутан».
имеет название «изобутан».

Рис. 53. Масштабные молекулы: а - этана, б - пропана
Свойства и применение алканов
Физические свойства: Этан, пропан и бутан в обычных условиях (при температуре 20 °С) являются газами, следующие двенадцать гомологов метана — жидкостями (они имеют характерный, «бензиновый» запах), а остальные — твердыми веществами. Температуры плавления и кипения алканов с увеличением числа атомов Карбона в молекулах возрастают.
Гомологи метана — бесцветные вещества. Поскольку их молекулы практически непо-лярны, эти соединения нерастворимы в воде (рис. 54), но хорошо растворяются (во многих случаях — неограниченно) в органических растворителях и друг в друге.

Рис. 54. Смесь гексана (верхний слой) с водой
Распространенность в природе: Небольшие количества этана, пропана и бутана содержатся в природном газе, попутном нефтяном газе (он находится вместе с нефтью в ее месторождениях), а также в газе, который выделяется в угольных шахтах. В состав нефти (рис. 55) входят преимущественно жидкие насыщенные углеводороды, а пчелиного воска и озокерита (горный воск) — твердые.

Рис. 55. Нефть — природный источник гомологов метана
Химические свойства: Как и метан, все его гомологи химически пассивны. Они взаимодействуют с галогенами, горят.
Реакции с галогенами: На свету или при нагревании насыщенные углеводороды реагируют с хлором и бромом. Это — реакции замещения.
Хлорирование этана начинается в соответствии с таким уравнением:
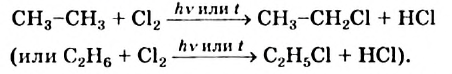
При дальнейшем взаимодействии веществ происходит замещение других атомов Гидрогена на атомы Хлора.
Реакции алканов со фтором сопровождаются разрывом связей 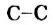 и образованием карбон фторида
и образованием карбон фторида 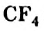 и фтороводорода
и фтороводорода 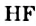 .
.
Реакции с кислородом: Все гомологи метана, как и другие углеводороды, при поджигании горят с образованием углекислого газа и водяного пара. С увеличением молекулярной массы углеводорода пламя становится ярче. Парафиновая свеча, в отличие от природного газа, горит ярко-желтым пламенем (рис. 56, а). Такой цвет обусловлен свечением раскаленных частиц сажи — одного из продуктов термического разложения углеводородов. Эти частицы быстро сгорают. Парафин — смесь твердых углеводородов с количеством атомов Карбона в молекулах от 18 до 35.
Если воздуха (кислорода) недостаточно, часть атомов Карбона окисляется не полностью, и образуется угарный газ или углерод. Такие условия можно создать, поместив в пламя свечи фарфоровую чашку. На ее поверхности появляется копоть — очень мелкие частицы сажи (рис. 56, б).

Рис. 56. Горение парафиновой свечи: а — в обычных условиях; б — при недостаточном доступе воздуха
Применение: Этан, пропан и бутан используют в значительно меньшей степени, чем метан. Смесью сжиженных пропана и бутана заполняют баллоны различной емкости (рис. 57), которые используют в быту для газовых плит. Если вентиль баллона открыть, то из него будет выходить газ, но не жидкость. Пропан-бутановая смесь — один из видов горючего в двигателях внутреннего сгорания.

Рис. 57 Баллон с пропан-бутановой смесью
Гомологи метана с количеством атомов Карбона в молекулах от 6 до 20 являются основными компонентами бензина и керосина.
Неполное сгорание автомобильного горючего, а также выделение из двигателя угарного газа приводят к существенному загрязнению воздуха в городах и на автомагистралях. Для уменьшения вредных выбросов к выхлопной трубе автомобиля присоединяют емкость с катализатором (рис. 58), который способствует превращению угарного газа и остатков горючего в углекислый газ и водяной пар.

Рис. 58. Насадка с катализатором в разрезе
Смеси жидких углеводородов — уайтспирит, петролейныи эфир — используют в качестве растворителей для лаков и красок. Разнообразное применение имеют вазелин (смесь жидких и твердых насыщенных углеводородов) и парафин.
Гомологи метана являются сырьем для производства многих важных органических соединений. Например, из бутана получают значительное количество уксусной кислоты.
Выводы:
- Этан, пропан и бутан при обычных условиях являются газами, а насыщенные углеводороды с большими относительными молекулярными массами — жидкостями или твердыми веществами. Гомологи метана — бесцветные вещества, нерастворимые в воде, но растворяются в органических растворителях и друг в друге.
- Этан, пропан, бутан содержатся в природном и попутном нефтяном газах. Многие алканы входят в состав нефти.
- Гомологи метана химически пассивны. Они вступают в реакции замещения с галогенами, горят.
- Алканы используют в качестве топлива, горючего, а также как сырье для производства органических веществ.
Этилен
Вы знаете, что кроме насыщенных углеводородов существуют ненасыщенные углеводороды. В их молекулах атомы Карбона соединены не только простыми связями, но и кратными (двойными, тройными).
Простейшим углеводородом с двойной связью в молекуле является этилен. Его химическая формула — 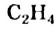 , а электронная и структурная формулы молекулы
, а электронная и структурная формулы молекулы 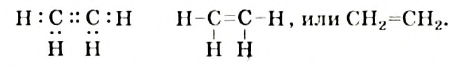
Другое название этого углеводорода — этен. Оно отличается от названия насыщенного углеводорода этана суффиксом ( -ен).
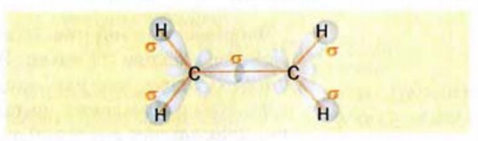
Строение молекулы: В соответствии с исследованиями ученых, все атомы молекулы этилена 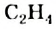 , расположены в одной плоскости, а углы между линиями, которые соединяют центры атомов, составляют по 120° (рис. 59).
, расположены в одной плоскости, а углы между линиями, которые соединяют центры атомов, составляют по 120° (рис. 59).

Рис. 59. Модели молекулы этилена: а — шаростержневая; б — масштабная
Как известно, атом Карбона образует кова-лентные связи за счет четырех неспаренных электронов 2-го энергетического уровня:
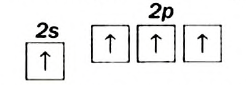
Этот атом соединен в молекуле этилена с другим атомом Карбона и двумя атомами Гидрогена. Он образует с ними три о-связи, в которых принимают участие s-электрон и два р-электрона. Орбитали, в которых находятся эти электроны, изменяют свою форму и становятся одинаковыми:
Оси новых орбиталей располагаются в одной плоскости, а углы между ними составляют по 120°:

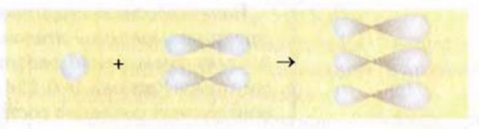
Такие орбитали каждого атома Карбона перекрываются с аналогичной орбиталью другого атома Карбона и со сферическими орбиталями двух атомов Гидрогена:
Четвертый неспаренный электрон атома Карбона, р-электрон, образует с р-электроном другого атома Карбона так называемую 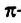 связь. Орбитали этих электронов перпендикулярны к плоскости, в которой находятся центры всех атомов молекулы. Они перекрываются на двух участках - над и под этой плоскостью:
связь. Орбитали этих электронов перпендикулярны к плоскости, в которой находятся центры всех атомов молекулы. Они перекрываются на двух участках - над и под этой плоскостью:
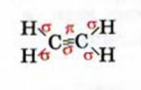
Таким образом, между атомами Карбона в молекуле этилена существует двойная связь, которая состоит из  и
и 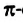 связи.
связи.
Наличие 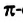 связи существенно влияет на характеристики молекулы этилена. Эта связь обуславливает уменьшение расстояния между центрами атомов Карбона до 0,134 нм (в случае простой ковалентной связи оно составляет 0,154 нм).
связи существенно влияет на характеристики молекулы этилена. Эта связь обуславливает уменьшение расстояния между центрами атомов Карбона до 0,134 нм (в случае простой ковалентной связи оно составляет 0,154 нм).
Физические свойства: Этилен по физическим свойствам похож на метан. Это бесцветный газ, немного легче воздуха, слабо растворяется в воде. При охлаждении до температуры -104 °С при нормальном давлении этилен превращается в жидкость.
Химические свойства: Этилен химически активнее метана. Это обусловлено способностью двойной связи между атомами Карбона легко разрушаться и превращаться в простую связь.
Реакции присоединения (так в органической химии называют реакции соединения). Этилен взаимодействуете простыми веществами — водородом, галогенами, и сложными веществами — галогеноводородами, водой. Продуктами этих реакций являются насыщенные органические соединения.
С водородом этилен реагирует при нагревании и наличии катализатора. При этом двойная связь в молекуле 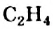 превращается в простую с одновременным присоединением атома Гидрогена к каждому атому Карбона:
превращается в простую с одновременным присоединением атома Гидрогена к каждому атому Карбона:
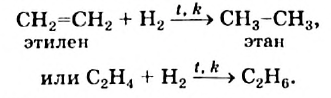
Реакции присоединения водорода к органическим соединениям называют реакциями гидрирования.
Взаимодействие этилена с галогенами сопровождается различными внешними эффектами. Реагируя со фтором, этилен воспламеняется, а смесь хлора с этиленом на свету взрывается. Этилен взаимодействует с бромом (рис. 60) и с его водным раствором — так называемой бромной водой (жидкость бурого цвета):
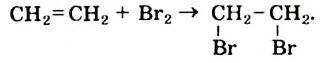
Обесцвечивание бромной воды при пропускании в нее этилена позволяет отличить этот газ от метана и других алканов, которые с растворенным бромом не реагируют.
Этилен также взаимодействует с галоген о водородами:
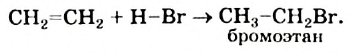
Присоединение этиленом воды (реакция гидратации) происходит в присутствии концентрированной сульфатной кислоты:
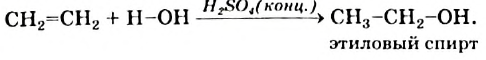
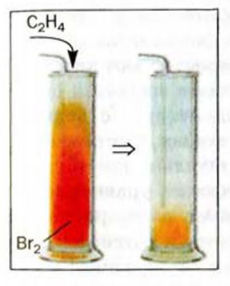
Рис. 60. Взаимодействие этилена с парами брома
Молекулы этилена могут соединяться друг с другом; при этом образуется известное вам вещество — полиэтилен. Эту реакцию, а также свойства ее продукта рассмотрим в следующем параграф.
Реакции окисления: Этилен горит на воздухе более ярким пламенем, чем метан. Продукты полного сгорания этилена — углекислый газ и водяной пар.
Химики, исследуя органические вещества, часто используют неорганическое соединение — калий перманганат, формула которого — 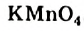 . Это соединение известно вам как марганцовка. Калий перманганат является окислителем. Этилен взаимодействует с водным раствором этой соли, выступая восстановителем. В результате окислительно-восстановительной реакции (химическое уравнение не приводим) фиолетовый цвет раствора калий перманганата исчезает. Метан и другие алканы не взаимодействуют с этим соединением. Поэтому реакцию с калий перманганатом, как и с бромной водой, используют для обнаружения этилена, а также других ненасыщенных углеводородов.
. Это соединение известно вам как марганцовка. Калий перманганат является окислителем. Этилен взаимодействует с водным раствором этой соли, выступая восстановителем. В результате окислительно-восстановительной реакции (химическое уравнение не приводим) фиолетовый цвет раствора калий перманганата исчезает. Метан и другие алканы не взаимодействуют с этим соединением. Поэтому реакцию с калий перманганатом, как и с бромной водой, используют для обнаружения этилена, а также других ненасыщенных углеводородов.
Это интересно. Водный раствор 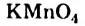 со временем портится: в нем образуется осадок
со временем портится: в нем образуется осадок 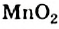 .
.
Получение этилена. В лаборатории этилен получают из этилового спирта:
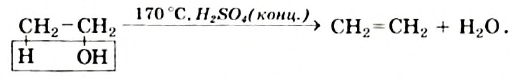
Реакцию отщепления воды от соединения называют реакцией дегидратации.
Применение: Этилен используют в большом количестве как сырье для производства полиэтилена, а также для получения этилового спирта, органических растворителей, других важных веществ. Добавление небольшого количества этилена в воздух теплиц ускоряет созревание овощей и фруктов.
Физиологическое действие: Продолжительное вдыхание воздуха, в котором содержится этилен, отрицательно влияет на нервную систему, приводит к нарушению кровообращения.
Выводы:
- Этилен (этен)
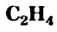 — простейший ненасыщенный углеводород с двойной связью в молекуле. Все атомы молекулы
— простейший ненасыщенный углеводород с двойной связью в молекуле. Все атомы молекулы 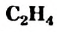 находятся в одной плоскости.
находятся в одной плоскости. - Этилен — бесцветный газ, который чуть легче воздуха, почти нерастворим в воде.
- Благодаря наличию в молекуле двойной связи, этилен вступает в реакции присоединения, взаимодействуя с водородом, галогенами, галогеноводородами, водой, а также окисляется калий пермапганатом.
- Этилен получают в лаборатории из этилового спирта.
- Из этилена производят полиэтилен, другие важные органические соединения.
Полиэтилен
Полимеризация этилена: В определенных условиях молекулы этилена соединяются друг с другом вследствие разрушения двойных связей между атомами Карбона с превращением их в простые связи. Представим это такой схемой:
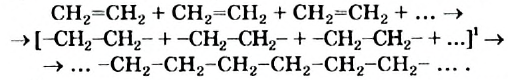
В квадратных скобках показаны молекулы этилена с разрушенными двойными связями.
Взаимодействовать могут сотни и тысячи молекул этилена. Продуктом реакции является полиэтилен. Его очень длинные молекулы образованы соединенными друг с другом группами атомов 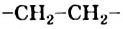 (рис. 61).
(рис. 61).
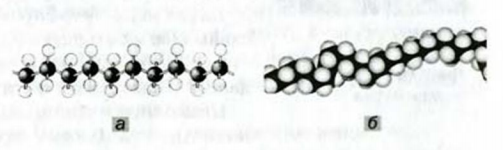
Рис. 61. Модели фрагментов молекулы полиэтилена: а — шаростержневая; б — масштабная
Реакцию соединения многих одинаковых молекул вследствие разрушения кратных связей называют реакцией полимеризации, исходное вещество — мономером, а продукт — полимером. Термины происходят от греческих слов poly — много, monos — один, единственный, meros — часть, доля.
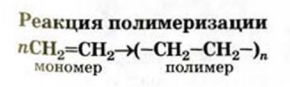
Полимер — соединение, молекулы которого состоит из большого числа одинаковых групп атомов.
Сокращенная запись реакции полимеризации этилена:
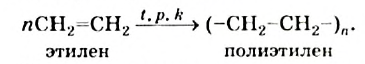
В полиэтилене существуют молекулы различной длины, т. е. с разными значениями 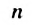 . Интервал значений
. Интервал значений 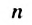 для образца полимера зависит от условий проведения реакции полимеризации — температуры, давления, катализатора.
для образца полимера зависит от условий проведения реакции полимеризации — температуры, давления, катализатора.
Свойства полиэтилена: Определим некоторые физические и химические свойства полиэтилена с помощью эксперимента.
Полиэтилен химически инертен; он не взаимодействует со щелочами, кислотами, не обесцвечивает раствор калий перманганата, а также бромную воду. Как и многие другие органические вещества, это соединение горит на воздухе.
Полиэтилен не растворяется в органических растворителях. Поэтому для их хранения используют полиэтиленовые емкости.
Изделия из полиэтилена морозоустойчивы, но не выдерживают нагревания выше температур 60—100 °С. При высокой температуре соединение разлагается с образованием этилена:
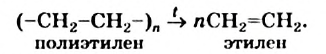
Применение полиэтилена: Полиэтилен является важнейшим полимерным материалом. Изделия из него мы постоянно используем в повседневной жизни. Это — пакеты, упаковочная пленка для пищевых продуктов, различные емкости, игрушки и т. п. (схема 3). Поскольку пленка из полиэтилена хорошо пропускает свет, ею покрывают теплицы для выращивания ранних овощей, цветов, тропических растений. Этот полимер используют в производстве промышленных емкостей, труб, конструкционных деталей, медицинского оборудования, а также как электроизоляционный материал, антикоррозионное покрытие.
Полиэтилен — нетоксичное вещество.
Схема 3

Выводы:
Молекулы этилена в определенных условиях могут соединяться друг с другом. Продуктом такого взаимодействия является полиэтилен. Превращение этилена в полиэтилен — пример реакции полимеризации. Эта реакция происходит за счет разрушения двойных связей между атомами Карбона.
Соединения, молекулы которых состоят из большого числа одинаковых групп атомов, называют полимерами.
Полиэтилен — один из важнейших полимеров. Он не растворяется в воде, химически инертен. Из полиэтилена производят пленку, емкости, различные изделия.
Тефлон
В последнее время существенно расширяется область применения полимера, который является производным полиэтилена; в его молекулах вместо атомов Гидрогена содержатся атомы Флуора. Этот полимер имеет формулу  Его название — тефлон. Соединение образуется в результате реакции полимеризации:
Его название — тефлон. Соединение образуется в результате реакции полимеризации:
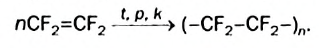
Тефлон внешне напоминает полиэтилен. Он не токсичен, имеет высокую химическую и термическую устойчивость, не поглощает воду, не горит, не разрушается концентрированными кислотами и их смесями, щелочами, окислителями, не растворяется и не набухает ни в одном из растворителей.
Изделия из тефлона можно использовать в интервале температур от -260 до +260 °С.
Тефлон является основой химически и термически устойчивых пластмасс. Его применяют в протезировании, для покрытия поверхности посуды, предназначенной для нагревания (рис. 63). Из тефлона изготовляют детали и фрагменты различного оборудования для химической промышленности, научных исследований, военной и космической техники.

Рис. 63. Посуда с тефлоновым покрытием
Пластмассы
Многие полимеры являются основой пластмасс — материалов, способных под влиянием температуры и давления приобретать определенную форму и сохранять ее.
Пластмассы, кроме полимеров, содержат различные добавки, которые улучшают их свойства, придают окраску, повышают устойчивость к химически агрессивным веществам и изменению внешних условий. Добавками служат измельченная древесина, мел. графит, бумага, различные волокна. Полимеры в таких пластмассах являются связующими компонентами. Некоторые добавки делают пластмассы эластичными. Если к мономеру добавить соединение, которое при нагревании разлагается с выделением газа, то после проведения реакции полимеризации получим материал, похожий на застывшую пену. Его называют пенопластом (рис. 64).
Рис. 64. Пенопласт
Ацетилен
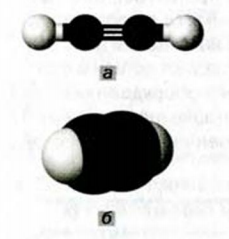
Рис. 65. Модели молекулы ацетилена: а — шаростержневая; б — масштабная
Простейшим ненасыщенным углеводородом с тройной связью в молекуле является ацетилен 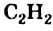 . Электронная и структурная формулы молекулы ацетилена —
. Электронная и структурная формулы молекулы ацетилена —

Этот углеводород имеет и другое название — этин. Оно отличается от названий углеводородов  (этан) и
(этан) и 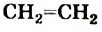 (этен) суффиксом (-ин).
(этен) суффиксом (-ин).
Строение молекулы: Модели молекулы ацетилена представлены на рисунке 65. В соответствии с ними, центры всех атомов в этой молекуле находятся на прямой линии.
В молекуле ацетилена каждый атом Карбона соединен с двумя атомами — другим атомом Карбона и атомом Гидрогена. Поэтому из его четырех неспаренных электронов только два (s- и р-электрон) образуют  -связи. Орбитали, в которых находятся эти электроны, изменяют свою форму и становятся одинаковыми:
-связи. Орбитали, в которых находятся эти электроны, изменяют свою форму и становятся одинаковыми:

Их оси располагаются на одной линии (угол между ними составляет 180°):
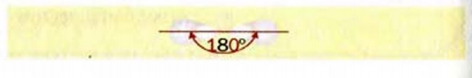
Одна из изменившихся орбиталей каждого атома Карбона перекрывается с такой же орбиталью другого атома Карбона, а вторая — со сферической орбиталью атома Гидрогена. Центры всех атомов молекулы 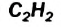 находятся на прямой линии:
находятся на прямой линии:

Оставшиеся два р-электрона каждого атома Карбона принимают участие в образовании двух 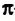 -связей. Орбитали этих электронов, расположенные параллельно, перекрываются:
-связей. Орбитали этих электронов, расположенные параллельно, перекрываются:
Таким образом, в молекуле ацетилена образуется тройная связь. Она состоит из одной  -связи и двух
-связи и двух  -связей.
-связей.
Наличие двух 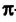 -связей между атомами Карбона приводит к уменьшению расстояния между их центрами. В молекуле ацетилена
-связей между атомами Карбона приводит к уменьшению расстояния между их центрами. В молекуле ацетилена 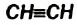 это расстояние составляет 0,120 нм. Поэтому в масштабной модели этой молекулы атомы Карбона в большей степени «входят» друг в друга (рис. 65, б), чем в аналогичной модели молекулы этилена (рис. 59, б).
это расстояние составляет 0,120 нм. Поэтому в масштабной модели этой молекулы атомы Карбона в большей степени «входят» друг в друга (рис. 65, б), чем в аналогичной модели молекулы этилена (рис. 59, б).
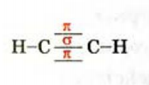
Физические свойства: В обычных условиях чистый ацетилен — бесцветный газ, почти не имеющий запаха. Неприятный запах технического ацетилена, используемого при сварке металлов, обусловлен примесями. Ацетилен немного легче воздуха, почти не растворяется в воде. При температуре - 84 °С и нормальном давлении этот газ превращается в жидкость.
Это интересно: Ацетилен хранят и перевозят в баллонах, содержащих пористый наполнитель, пропитанный раствором этого газа в ацетоне.
Химические свойства: Ацетилен, будучи ненасыщенным углеводородом, вступает в реакции присоединения с галогенами, водородом, некоторыми сложными веществами.
Реакции присоединения: Ввиду наличия в молекуле ацетилена тройной связи реакции присоединения происходят в две стадии. Сначала молекула ацетилена присоединяет одну молекулу реагента (тройная связь между атомами Карбона превращается в двойную), затем — вторую (двойная связь превращается в простую).
Ацетилен, как и этилен, обесцвечивает бромную воду:
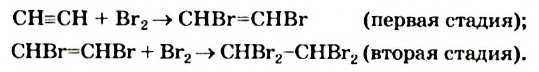
Аналогично ацетилен взаимодействует при низкой температуре с хлором. В обычных условиях смесь этих газов взрывается, появляется пламя и образуется черный дым, состоящий из мелких частиц сажи:
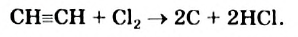
Взаимодействие ацетилена с водородом, как и с галогенами, проходит в две стадии:
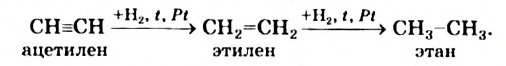
Ацетилен также присоединяет галогеноводороды. Первая стадия одной из реакций:
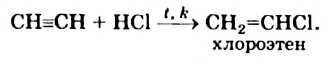 Реакции окисления. Ацетилен, как и другие углеводороды, сгорает в избытке кислорода или воздуха с образованием углекислого газа и водяного пара:
Реакции окисления. Ацетилен, как и другие углеводороды, сгорает в избытке кислорода или воздуха с образованием углекислого газа и водяного пара:
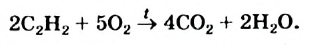
Пламя ацетилена очень яркое (рис. 66); в нем содержится небольшое количество раскаленных частиц углерода. Появление этого простого вещества среди продуктов реакции обусловлено тем, что некоторые атомы Карбона не успевают полностью окислиться, т. е. «перейти» в молекулы 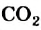 .
.

Рис. 66. Горение ацетилена, образующегося при реакции кальций карбида 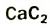 с водой
с водой
Если кислорода недостаточно, пламя становится коптящим вследствие образования заметного количества сажи:
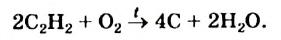
При горении ацетилена в чистом кислороде температура достигает почти 3000 °С. Это используют для сварки и резки металлов.
Работая с ацетиленом, необходимо помнить, что его смеси с воздухом и кислородом взрывоопасны. Ацетилен, как и этилен, окисляется калий перманганатом 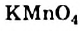 , обесцвечивая водный раствор этого соединения.
, обесцвечивая водный раствор этого соединения.
Получение: В промышленности ацетилен получают термическим разложением природного газа (метана):
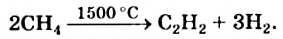
Для того чтобы ацетилен не успел разложиться на простые вещества — углерод и водород, смесь продуктов реакции быстро охлаждают.
Другой способ получения ацетилена используют в лаборатории, а также для технических нужд. Он основан на реакции кальций карбида 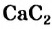 с водой (рис. 66):
с водой (рис. 66):
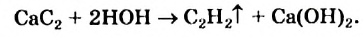
Поскольку для производства этого соединения Кальция нужно создать очень высокую температуру
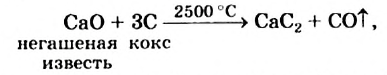
ацетилен, полученный из кальций карбида, является довольно дорогим.

Рис 67. Резка металла с помощью ацетиленовой горелки
Применение: Больше всего ацетилена расходуется на производство этилового спирта, уксусной кислоты, полимеров, органических растворителей. Этот газ используют для сварки и резки металлов. Ацетилен и кислород подводят в специальную горелку, а пламя направляют на металл (рис. 67).
Физиологическое действие: Чистый ацетилен является слаботоксичным веществом. Значительно большую опасность для здоровья представляют примеси в техническом ацетилене.
Выводы:
- Ацетилен (этин)
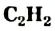 — простейший ненасыщенный углеводород с тройной связью в молекуле. Это бесцветный газ с едва ощутимым запахом, немного легче воздуха, малорастворимый в воде.
— простейший ненасыщенный углеводород с тройной связью в молекуле. Это бесцветный газ с едва ощутимым запахом, немного легче воздуха, малорастворимый в воде. - Ацетилен — горючее соединение. Он вступает в реакции присоединения с галогенами, водородом, некоторыми сложными веществами. Эти реакции происходят в две стадии. Сначала молекула ацетилена присоединяет одну молекулу реагента, затем — другую.
- Для получения ацетилена осуществляют термическое разложение природного газа (метана) или реакцию кальций карбида с водой.
- Ацетилен используют в качестве сырья для производства различных органических веществ, а также для сварки и резки металлов.
Соотношение объемов газов в химических реакциях
Закон объемных соотношений: Важнейшие углеводороды — метан, этан, этилен, ацетилен и др. — существуют в обычных условиях в газообразном состоянии. Газы отличаются от жидкостей и твердых веществ тем, что расстояния между их частицами (молекулами, а в случае инертных газов — атомами) очень большие. Вследствие этого порции различных газов, содержащие одинаковое число молекул, занимают одинаковый объем (при одних и тех же температуре и давлении). Об этом свидетельствует закон Авогадро, с которым вы ознакомились в 8 классе. В соответствии с ним, 1 л метана 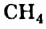 содержит столько молекул, сколько и 1 л этилена
содержит столько молекул, сколько и 1 л этилена 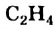 или 1 л ацетилена
или 1 л ацетилена 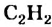 . А в 2 л метана (этилена, ацетилена) число молекул вдвое больше, в 3 л — втрое больше и т. д.
. А в 2 л метана (этилена, ацетилена) число молекул вдвое больше, в 3 л — втрое больше и т. д.
Рассмотрим некоторые реакции, которые происходят с участием газов.
При сгорании метана
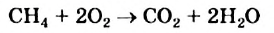
каждая его молекула взаимодействует с двумя молекулами кислорода. Из закона Авогадро следует, что определенный объем метана должен реагировать с вдвое большим объемом кислорода (например, 1 л 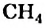 — с 2 л
— с 2 л 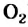 ).
).
Метан при высокой температуре разлагается на ацетилен и водород
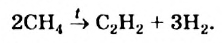
В соответствии с химическим уравнением, из каждых двух молекул метана образуется одна молекула ацетилена и три молекулы водорода. Отсюда соотношение объемов этих газов должно быть таким:
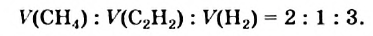
Анализируя результаты опытов с газами, французский ученый Ж. Гей-Люссак в 1808 г. сформулировал закон объемных соотношений:
объемы газов, вступающих в реакцию и образующихся в результате реакции, соотносятся как небольшие целые числа.
Впоследствии выяснилось, что эти числа являются соответствующими коэффициента ми а химических уравнениях.
Закон Гей-Люссака распространяется на все вещества, существующие в газообразном состоянии, — органические и неорганические.
Обращаем ваше внимание на реакции между газами, в которых образуется вода. Это вещество, например, является одним из продуктов горения любого углеводорода. При образовании водяного пара закон объемных соотношений газов распространяется и на него. Если же происходит конденсация пара, то объем вещества уменьшается приблизительно в тысячу раз. В этом случае закон Гей-Люссака но отношению к воде не применим (как и к другим жидким и твердым веществам).
Решение задач с использованием закона объемных соотношений
Задача:
Какой объем водорода необходим для полного превращения 0,8 л ацетилена в этан?
Дано: 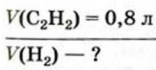
Решение:
1. Составляем уравнение реакции:
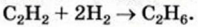
2. Рассчитываем объем водорода, который вствупит в реакцию.
В соответствии с химическим уравнением и законом Гей-Люссака каждый объем ацителена реагирует с вдвое большим объемом водорода.
Рассуждаем так:
1 л ацетилена реагирует с 2 л водорода,
0,8 л ацетилена - с х л водорода.
Отсюда 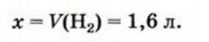
Ответ: 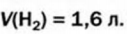
Задача:
Смешали 100 мл ацетилена и 400 мл кислорода. Смесь газов подожгли. Останется ли после реакции один из реагентов? В случае утвердительного ответа вычислить объем остатка этого вещества, считая, что температура и давление до и после реакции были одинаковыми.
Дано: 
Решение:
1. Составляем уравнение реакции:
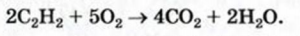
2. В соответствии с законом Гей-Люссака сооотношение реагирующих газов должно быть таким:
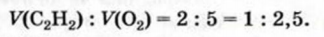
По условию задачи газы взяты в ином соотношении:
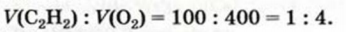
Отсюда следует, что кислород был в избытке, и часть его осталась после реакции.
3. Определяем, какой объем кислорода прореагирует со 100 мл ацетилена.
По закону объемных соотношений
с каждым 2 мл 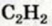 взаимодействует 5 мл
взаимодействует 5 мл 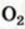 ,
,
со 100 мл 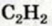 - х мл
- х мл 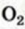 ;
;
Ответ: 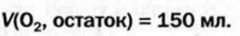
Задача:
Найти формулу газообразного углеводорода, если при полном сгорании 100 мл этого соединения образуется 300 мл углекислого газа и 400 мл водяного пара (объемы соответствуют одинаковым условиям).
Дано: 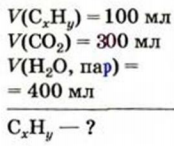
Решение:
1. Записываем схему химической реакции:
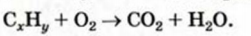
Из схемы видно, что при сгорании углеводорода 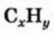 все атомы Карбона "переходят" в молекулы углекислого газа, а атомы Гидрогена - в молекулы воды.
все атомы Карбона "переходят" в молекулы углекислого газа, а атомы Гидрогена - в молекулы воды.
2. Находим соотношение объемов углеводорода, углекислого газа и водяного пара по условию задачи:
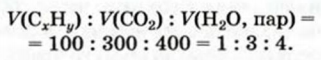
Числа 1, 3 и 4 являются соответствующими коэффициентами в химическом уравнении. Записываем их (естественно, кроме единицы) перед формулами веществ
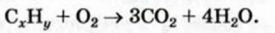
Отсюда 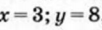 , а формула углеводорода -
, а формула углеводорода - 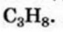
Ответ: формула углеводорода - 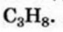
Выводы:
Объемы газов, вступающих в реакцию и образующихся в результате реакции, соотносятся как небольшие целые числа (закон объемных соотношений газов Гей-Люссака). Эти числа являются соответствующими коэффициентами в химическом уравнении.
Справочный материал по углеводородам
Изучение органических соединений начнем с класса углеводородов, которые образуются только из атомов углерода и водорода и представлены огромным количеством веществ.
Углеводороды образованы из следующих классов:
Углеводород Общая формула
Алканы 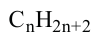
Циклоалканы 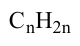
Алкены 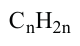
Алкадиены 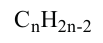
Алкины 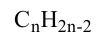
Арены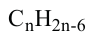
Углеводороды, в составе которых все атомы углерода соединены друг с другом посредством исключительно  (сигма)-связей, называются насыщенными углеводородами. К ним относятся алканы и циклоалканы.
(сигма)-связей, называются насыщенными углеводородами. К ним относятся алканы и циклоалканы.
Общая формула алканов и их гомологический ряд
Алканы - это углеводороды с открытой цепью, т.е. в их молекулах концевые атомы углерода не замыкаются, и имеют общую формулу 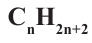
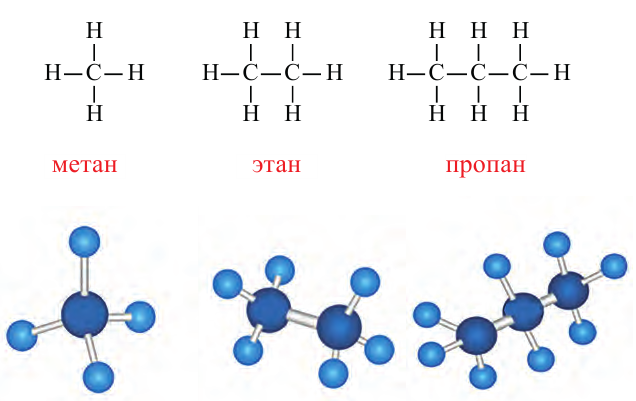
Соединения, входящие в один и тот же класс и схожие по свойствам, а также отличающиеся друг от друга 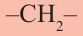 группой называются гомологами. Ряд, образованный гомологами, называется гомологическим рядом.
группой называются гомологами. Ряд, образованный гомологами, называется гомологическим рядом.
Гомологический ряд алканов:
Формула Название
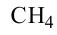 Метан
Метан
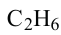 Этан
Этан
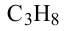 Пропан
Пропан
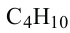 Бутан
Бутан
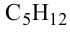 Пентан
Пентан
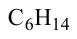 Гексан
Гексан
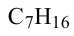 Гептан
Гептан
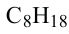 Октан
Октан
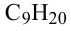 Нонан
Нонан
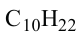 Декан
Декан
Формулы радикалов и их названия
Формула Название
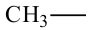 Метил
Метил
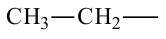 Этил
Этил
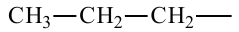 Пропил
Пропил
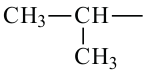 Изопропил
Изопропил
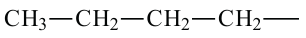 Бутил
Бутил
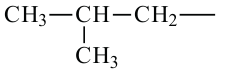 Изобутил
Изобутил
При отщеплении одного атома водорода из молекулы насыщенного углеводорода образуется соответствующий радикал. Общая формула радикалов 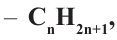 их название образуется заменой суффикса «ан» у соответствующего алкана на суффикс «ил». Например:
их название образуется заменой суффикса «ан» у соответствующего алкана на суффикс «ил». Например:

НОМЕНКЛАТУРА
1) Тривиальная (историческая, эмпирическая, случайная)
2) Рациональная
3) Систематическая
Примечание: Красным цветом обозначены названия веществ по тривиальной номенклатуре, синим цветом - по рациональной номенклатуре, черным цветом - по систематической.
Номенклатура
Историческая номенклатура: Благодаря многочисленным открытиям новых представителей органических соединений, большинство из них получили тривиальные названия (эмпирическую, историческую, случайную). К примеру, первым четырем представителям алканов даны случайные названия: метан, этан, пропан и бутан. Начиная с пентана, названия углеводородов образуются из греческого названия числа, которое соответствует количеству атомов углерода, входящих в состав вещества ("пента"- 5, "гекса"- 6, "гепта"- 7, "окта"- 8, "нона"- 9, "дека"-10), с добавлением к нему суффикса «ан». Например, пентан - 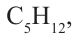 гексан -
гексан - 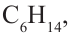
Рациональная номенклатура: Начиная с XIX века органические вещества назывались также по рациональной (с лат. «ratio» - мышление, разум) номенклатуре. Согласно данной номенклатуре, все алканы рассматриваются в качестве производных метана и при их названии самый разветвленный атом углерода принимается как углерод метана. Связанные с центральным углеродом атомы углерода и другие примыкающие к последним атомы углерода вместе образуют заместители. Поочередным названием этих заместителей и последующим добавлением слова «метан» заканчивается название алкана.
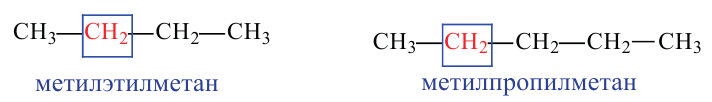
Примечание: если в составе вещества будут два одинаковых радикала, то к названию радикала прибавляется приставка «ди», если будут три одинаковых радикала - «три», четыре одинаковых радикала - «тетра».
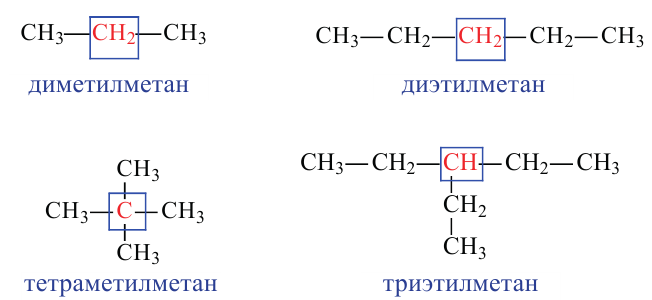
Название алканов по международной номенклатуре
Систематическая номенклатура: В 1892 году в Женеве в рамках Международного конгресса химиков была принята новая номенклатура. Согласно Женевской номенклатуре в веществах нумеруется главная цепь, перед названием радикала указывается номер атома углерода в главной цепи, с которым связан данный радикал.
В 1960 году комиссией Международного союза теоретической и прикладной химии (IUPAC - International Union of Pure and Applied Chemistry) был объявлен новый метод номенклатуры органических веществ. Данная номенклатура образовалась усовершенствованием уже существующей Женевской номенклатуры, т.е. она была упорядочена и в нее были внесены поправки и дополнения. Ей дали название систематической номенклатуры.
Согласно систематической номенклатуре насыщенные углеводороды называются следующим образом:
1. В молекуле углеводорода в качестве главной цепи выбирается самая длинная и разветвленная углеродная цепь.
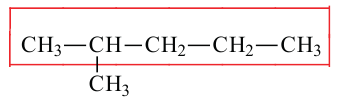
2. Углероды данной цепи нумеруются с того конца, к которому ближе разветвление.
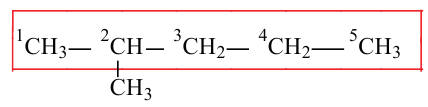
3. Указывается номер атома углерода, связанный с радикалом и название данного радикала (например: 2-метил).
Если одному атому углерода присоединены два одинаковых заместителя, то номер данного атома углерода указывается дважды, а перед названием радикала добавляется приставка «ди» (например: 2,2-диметил). Число одинаковых радикалов по всей цепи также указывают при помощи греческих числительных (два - «ди», три - «три», четыре -«тетра» и т.д.).
4. Если главная цепь имеет различные радикалы, последовательность их названия определяется начальной буквой радикала в алфавитном порядке. После указания всех заместителей в цепи, идет название основной цепи в соответствии с количеством атомов углерода в ней.
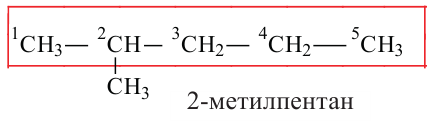
Обратите внимание на название следующих веществ по систематической номенклатуре!
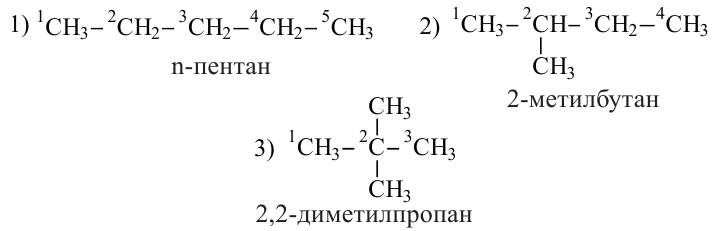
В случаях, когда радикалы находятся в одинаковой отдаленности от обоих концов цепи, нумерация начинается с того ее конца, в котором число углеродов в составе радикала наименьшее:
Первичный углерод - атом углерода непосредственно связан с одним атомом углерода 
Вторичный углерод - атом углерода непосредственно связан с двумя атомами углерода 
Третичный углерод - атом углерода непосредственно связан с тремя атомами углерода 
Четвертичный углерод - атом углерода непосредственно связан с четырьмя атомами углерода 
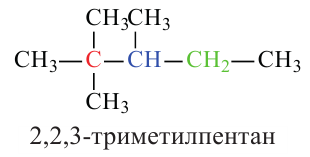
Данное вещество образовано из 5 первичных, 1 вторичного, 1 третичного и 1 четвертичного атома углерода.
Название галогенпроизводных алканов
Согласно международной (систематической) номенклатуре, галогенпроизводные алканов называются следующим образом:
- 1. Атом галогена должен входить в состав главной цепи.
- 2. Нумерацию атомов углерода в главной цепи начинают с того конца, которому ближе атом галогена.
- 3. Последовательность названия радикалов и галогенов также определяется расположением их начальной буквы в алфавите. Затем указывается название основной цепи.
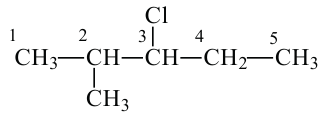 2-метил-3-хлорпентан
2-метил-3-хлорпентан
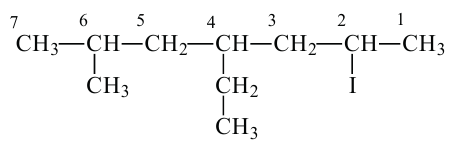 2-йод-6-метил-4-этилгептан
2-йод-6-метил-4-этилгептан
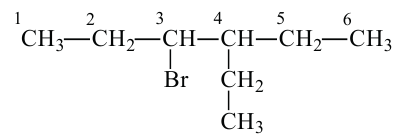 3-бром-4-этилгексан
3-бром-4-этилгексан
Изомерия: Вещества с одинаковой общей формулой, но отличающиеся строением (физическими и химическими свойствами) называются изомерами.
У насыщенных углеводородов изомерия начинается с бутана.
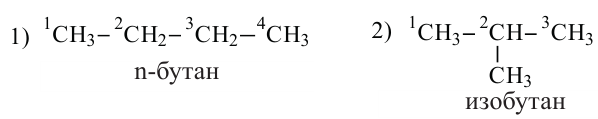
Углеводороды с неразветвленной углеродной цепью называются нормальными  углеводородами. Углеводородами с разветвленной цепыо называются углеводороды нормального
углеводородами. Углеводородами с разветвленной цепыо называются углеводороды нормального  строения, где один или несколько атомов водорода замещаются на углеводородный радикал. С увеличением числа атомов углерода, растет число изомеров вещества.
строения, где один или несколько атомов водорода замещаются на углеводородный радикал. С увеличением числа атомов углерода, растет число изомеров вещества.
Пентан имеет 3 изомера:
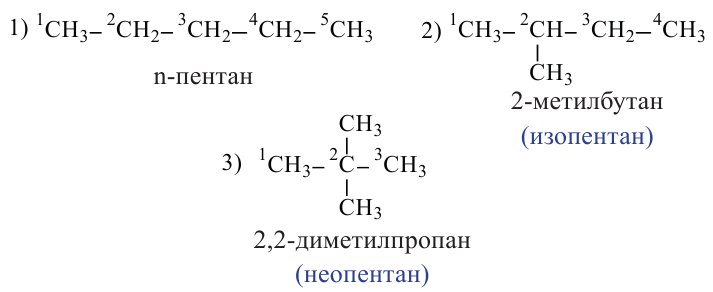
Получение алканов и их физические свойства
Получение: Предельные углеводороды можно получить воздействием натрия на галоидалкилы по методу Вьюрца.
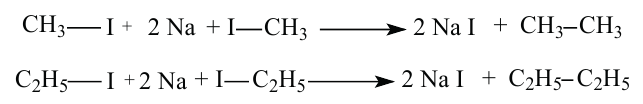
В результате взаимодействия метилйодида и этилйодида с металлическим натрием можно получить 3 вида соединений: этан, бутан, пропан. Реакция протекает следующим образом:
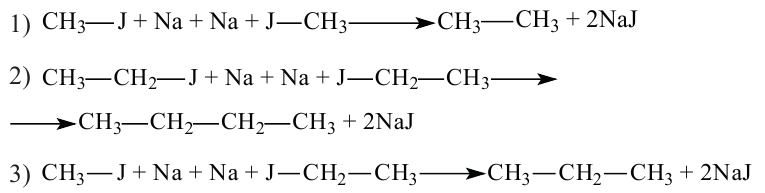
В следующем примере, как и в предыдущем, из 2-метил-2-бромпропана и этилбромида можно получить 3 вида веществ: 2,2,3,3-тетраметилбутан, бутан и 2,2-диметилбутан.
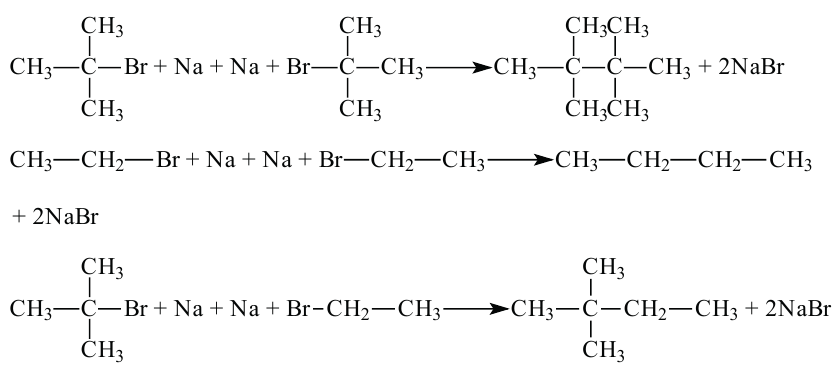
В лаборатории метан можно получить следующим способом:
1. В результате гидролиза карбида алюминия:

2. В результате взаимодействия ацетата натрия с гидроксидом натрия.
Если вместо ацетата натрия использовать соль другой карбоновой кислоты, то образуется другой алкан. Например, из пропионата натрия образуется этан.
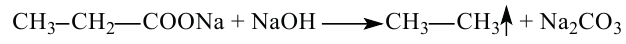
Физические свойства: Метан, этан, пропан, бутан при нормальных условиях являются газами, от 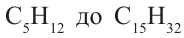 - жидкости, от
- жидкости, от 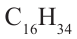 твёрдые вещества.
твёрдые вещества.
Химические свойства алканов
Алканы, в отличие от других углеводородов, проявляют низкую химическую активность и в обычных условиях они не вступают в реакции. В присутствии катализаторов или под действием температуры и света они вступают в реакции замещения.
Горение: Углеводороды горят при высокой температуре и образуют 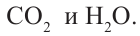 Общая формула реакции горения алканов:
Общая формула реакции горения алканов:
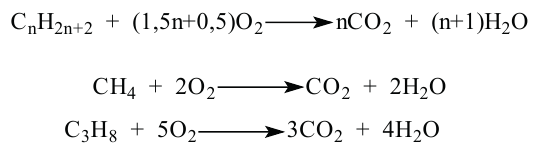
Если метан нагреть при высокой температуре (1500°С), образуются ацетилен и водород.
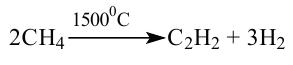
Крекинг: При высокой температуре у насыщенных углеводородов происходит разрыв углеродных цепей, в результате этого образуется смесь алканов и алкенов с меньшим числом атомов углерода. Этот процесс называется термическим крекингом.
Если крекинг проводить в присутствии катализаторов, то процесс называют каталитическим крекингом. При этом образуются углеводороды с разветвленной цепью.
Реакция с галогенами: Под действием света метан вступает в реакцию с хлором и атомы водорода в метане постепенно замещаются атомами хлора.
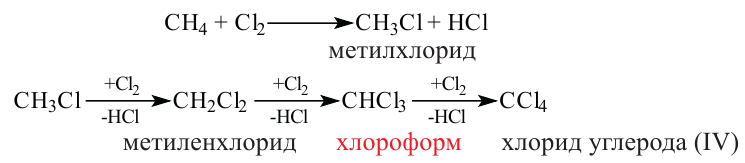
У разветвленных углеводородов, в основном, сначала замещаются хлором атомы водорода у третичного атома углерода, затем у вторичного и в конце у первичного углерода:
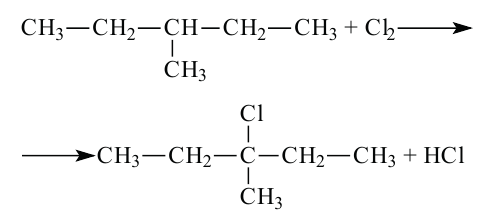
Дегидрирование: Эти реакции используют для получения из алканов соответствующих ненасыщенных углеводородов:
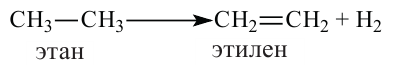
Применение: В виде природного газа метан широко используется в качестве топлива. Из метана получают метиловый спирт, уксусную кислоту, этиловый спирт, синтетический каучук и мочевину Дихлорэтан, хлороформ используют в качестве растворителей. Алканы используют также в качестве горючего.
Циклоалканы и номенклатура циклоалканов, их изомерия и получение
Помимо раннее рассмотренных насыщенных углеводородов с открытой цепью - алканов, существуют углеводороды с закрытой цепью, имеющие циклическое строение. Они называются циклоалканами. Их общая формула выглядит 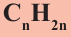
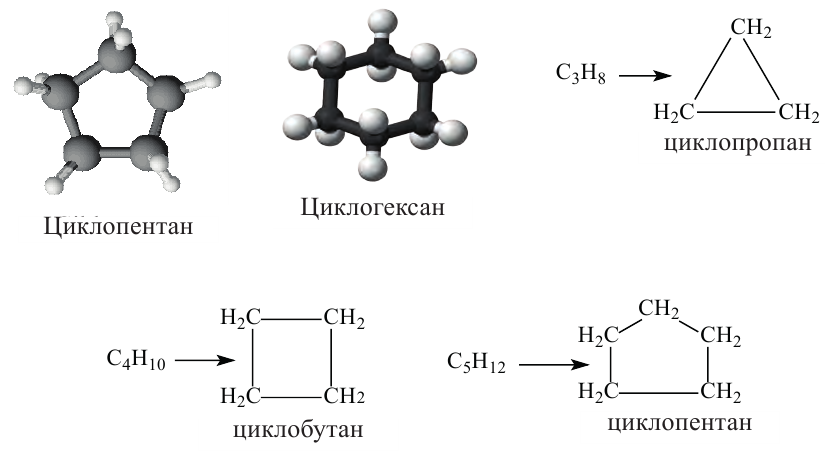
Циклоалканы отличаются от соответствующих алканов недостатком двух атомов водорода в своем составе. Именно за счет отщепления этих атомов замыкается цепь, что можно схематически изобразить следующим образом:
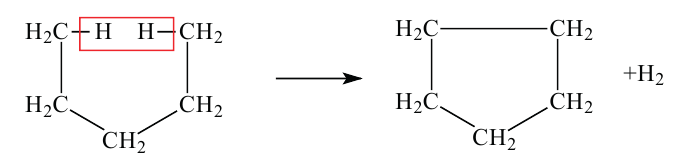
Номенклатура и изомерия: Название циклоалканов по систематической номенклатуре образуется добавлением приставки «цикло» к названию соответствующих насыщенных углеводородов.
Формула алкана Название алкана Название циклоалкана Формула циклоалкан
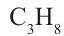 пропан циклопропан
пропан циклопропан 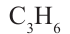
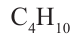 бутан циклобутан
бутан циклобутан 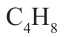
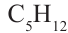 пентан циклопентан
пентан циклопентан 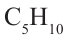
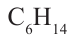 гексан циклогексан
гексан циклогексан 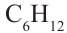
При названии циклоалканов по систематической номенклатуре следуют нижеприведенным правилам:
- В качестве главной цепи принимается цикл.
- Нумерация начинается с того атома углерода в цикле, который связан с радикалом. Нумерация в цикле продолжается в сторону близко расположенного последующего радикала.
- Расположение боковых цепей указывается цифрой.
- Перечисляют радикалы, затем называют основную цепь.
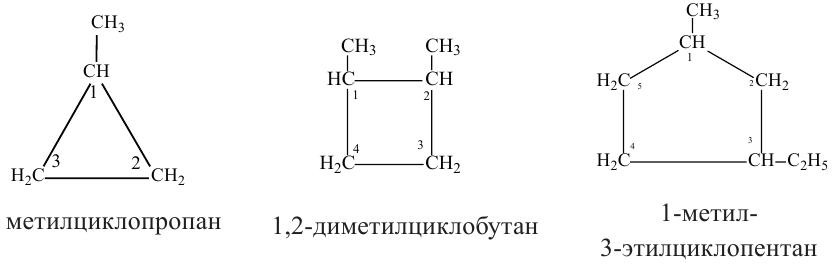
Изомерия: Явление изомерии у циклоалканов обусловлено числом атомов углерода в кольце и расположением радикалов в боковой цепи. Изомерия у циклоалканов начинается с циклобутана.
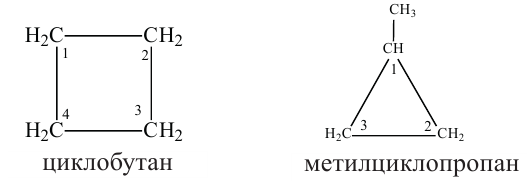
Получение: 1. В лаборатории циклоалканы получают воздействием металлов на дигалогенпроизводные насыщенных углеводородов.
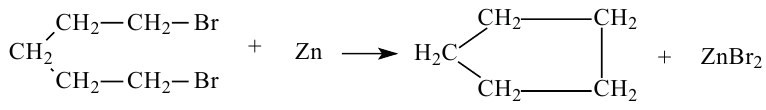
2. Гидрогенизацией бензола и его гомологов получают циклогексан и его производные.
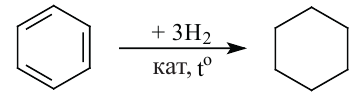
Физические и химические свойства циклоалканов
Физические свойства: Циклоалканы практически не растворяются в воде. Их свойства схожи со свойствами алканов, первые два представителя являются газами, следующие - жидкости, а высшие представители считаются твердыми веществами. С увеличением молекулярной массы температура кипения и плотность циклоалканов увеличивается.
Химические свойства: У циклоалканов, как и у алканов, все связи насыщены, но в отличие от алканов они вступают в реакцию присоединения. Это объясняется разрывом связи между атомами углерода в цикле.
Представители с малыми циклами (циклопропан и циклобутан) по сравнению с соединениями с большими цикла (циклопентан и циклогексан) легче вступают в реакцию присоединения. Причиной тому является неустойчивость структуры малых циклов. Например, реакция гидрогенизации (присоединения водорода) у разных циклоалканов протекает при разной температуре:
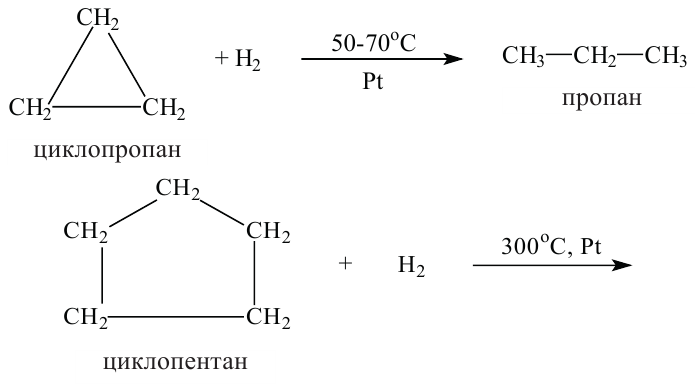
Для соединений большого цикла в основном характерны реакции замещения. Этим свойством они схожи с алканами. Например, реакция цикл ore ксана с хлором протекает следующим образом:
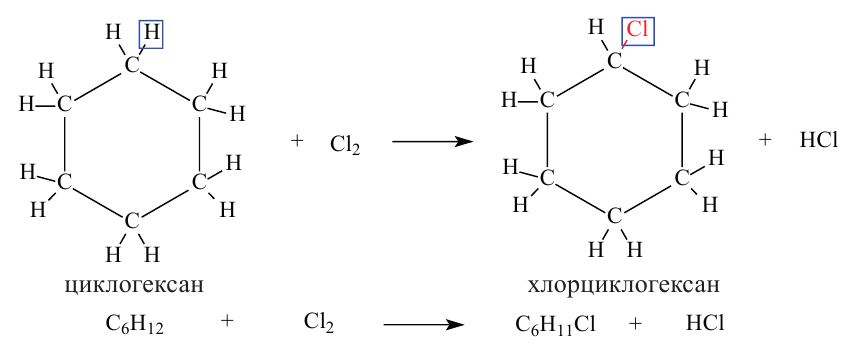
Н.Д. Зелинский дегидрогенизацией циклогексана получил бензол.
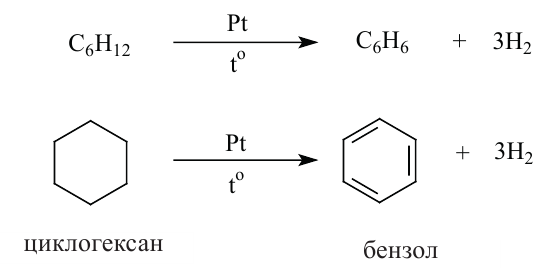
Применение: Хлорпроизводное циклогексана гексахлорциклогексан -  применяется в сельском хозяйстве в качестве инсектицида (средства против вредителей).
применяется в сельском хозяйстве в качестве инсектицида (средства против вредителей).
Алкены и их номенклатура
Углеводороды с открытой цепью, в составе которых содержится одна  связь, называются углеводородами этиленового ряда. Количество водородов в них на 2 атома меньше, чем у соответствующих алканов, так как в составе их молекулы имеется одна двойная связь. Общая формула алкенов
связь, называются углеводородами этиленового ряда. Количество водородов в них на 2 атома меньше, чем у соответствующих алканов, так как в составе их молекулы имеется одна двойная связь. Общая формула алкенов 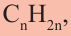 их первым представителем считается этилен. Одновалентный радикал этилена называется виниловым радикалом
их первым представителем считается этилен. Одновалентный радикал этилена называется виниловым радикалом 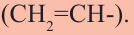
Номенклатура: Согласно систематической номенклатуре, для обозначения алкенов вместо последней буквы «ан» соответствующего алкана добавляется суффиксы «ен» или «илен».
Например:
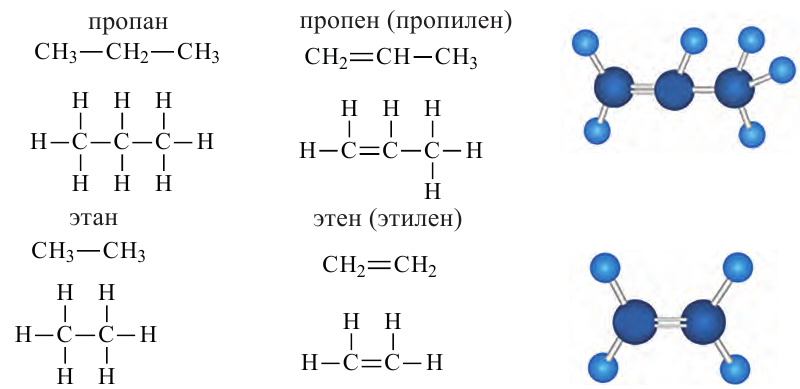
Для обозначения алкенов, согласно систематической номенклатуре, сначала выбирается основная цепь. Двойная связь должна быть в составе основной цепи. Атомы углерода в основной цепи нумеруются с того конца, к которому ближе двойная связь. Как и у алканов, после нумерации основной цепи, радикалы в боковых цепях называются по алфавиту. В конце указывается название основной цепи и расположение двойной связи в ней.
Например:
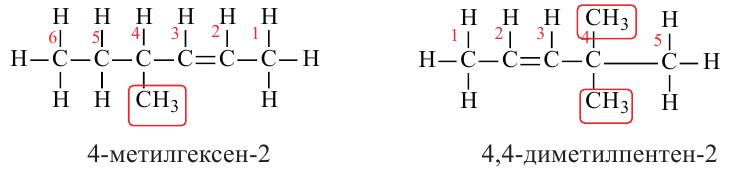
Согласно рациональной номенклатуре, алкены рассматриваются как производные этилена, то есть за основу берут этилен.
Например:
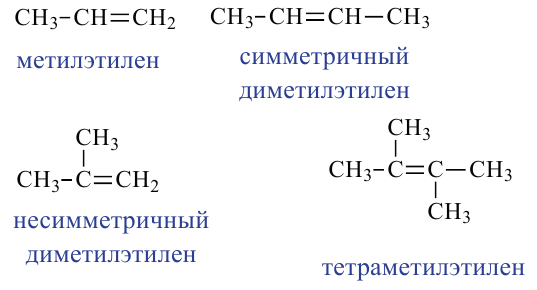
Наименование галогенпроизводных алкенов схоже с наименованением алканов. Только с названием галогена указывается номер углерода в основной цепи, к которому присоединен атом галогена. А также указывают в алфавитном порядке углеродные радикалы в боковой цепи. Например:
 4-метил-5-хлор-4-этилгексен-1
4-метил-5-хлор-4-этилгексен-1
 6-метил-6-хлор-5-этилгептен-2
6-метил-6-хлор-5-этилгептен-2
Изомерия алкенов и их получение
Изомерия: У алкенов существует 3 вида изомерии.
1. Как и у предельных углеводородов, у алкенов существует изомерия цепи. Например:
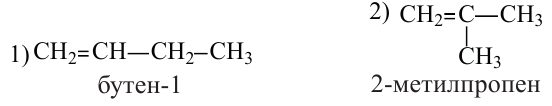
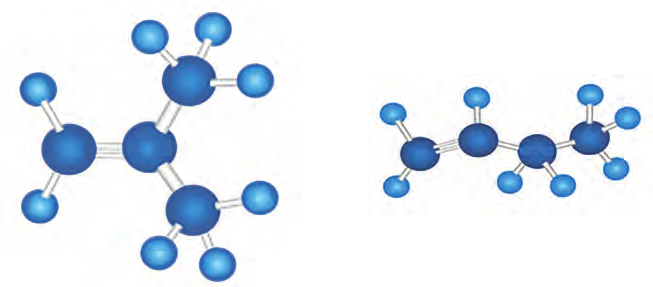
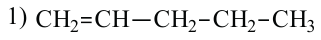 пентен-1
пентен-1
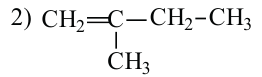 2-метилбутен-1
2-метилбутен-1
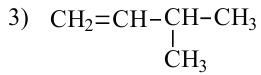 3-метилбутен-1
3-метилбутен-1
2. У алкенов встречается изомерия по положению двойной связи:
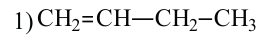 будет-1
будет-1
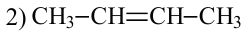 бутен-2
бутен-2
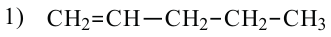 пентен-1
пентен-1
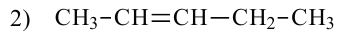 пентен-2
пентен-2
У этиленовых углеводородов возможна также пространственная изомерия.
Пространственная изомерия:
Если углеводород содержит двойную связь между атомами углеродов, то у данного углеводорода может возникнуть геометрическая изомерия, которую обычно называют цис - транс изомерией. Для возникновения такого вида изомерии, атомы углерода, между которыми образуется двойная связь, должны содержать разные радикалы. То есть у каждого из этих углеродов должны быть разные радикалы, например водород и метальная группа, или метальная и этильная группа. По этой причине у бутена -2 возникает цис - транс изомерия. Для удобного рассмотрения данного вида изомерии рассмотрим бутен - 2 как производное этилена.
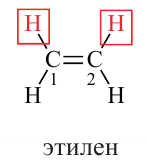
Сверху в картинке мы отметили два атома водорода. Заменим их на метальные радикалы. Образовался бутен - 2. Тот радикал, который заменяет атом водорода, может считаться заместителем. Точно так же определение «заместитель» применяется и для других радикалов как 
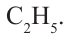 В нашем примере метальные радикалы будут как заместители.
В нашем примере метальные радикалы будут как заместители.
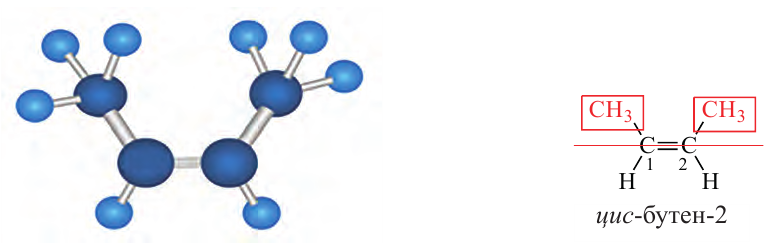
Если одинаковые заместители в разных атомах углерода располагаются в одной и той же стороне двойной связи (оба сверху, или оба снизу), вещество считается цис - изомером. Если повернуть второй углерод на 180° относительно центральной оси, которая проходит через двойную связь, произойдут следующие изменения: заместители окажутся в разных сторонах относительно двойной связи (один сверху, другой снизу), и образуется новый изомер, который называется транс бутеном - 2.
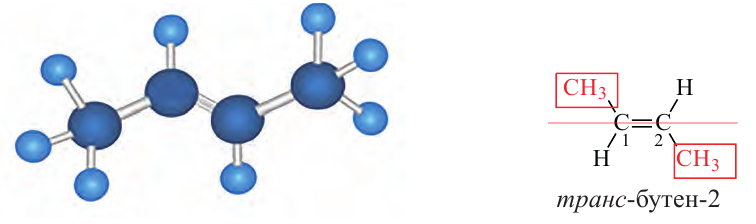
Цис-бутен-2 и транс-бутен-2 отличаются по своим физическим свойствам. Поэтому они являются разными веществами.
Если рассмотреть пентен-2 как производное этилена, где у первого атома углерода есть метальный, а у второго углерода этильный заместитель, можем вывести следующие изомеры.
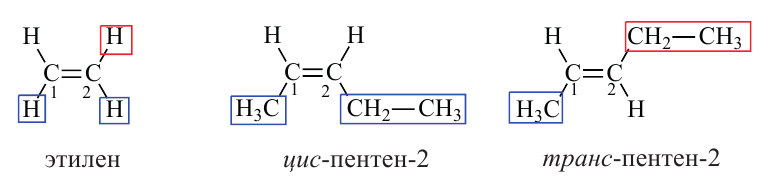
Таким образом, изомер в котором оба заместителя, или незамещенные водороды располагаются в одной и той же стороне, называется цис-изо-мером. Если оба водорода, или заместителя располагаются в различных сторонах, данный изомер называется транс-изомером.
Если у этилена замещены три или четыре водорода, удобнее использовать вместо цис- и транс- изомеров 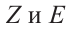 изомерами. (
изомерами. ( -entgegen- напpoтив;
-entgegen- напpoтив;  -zusammen-вмecтe).
-zusammen-вмecтe).
Для такого названия требуется определить самый тяжелый (по молекулярной массе) заместитель каждого углерода в этилене. Если тяжелые заместители обеих углеродов расположены в одной стороне двойной связи, изомер считается  изомером. Если тяжелые заместители расположены в различных сторонах двойной связи, изомер считается
изомером. Если тяжелые заместители расположены в различных сторонах двойной связи, изомер считается  изомером. Ниже приведены примеры:
изомером. Ниже приведены примеры:
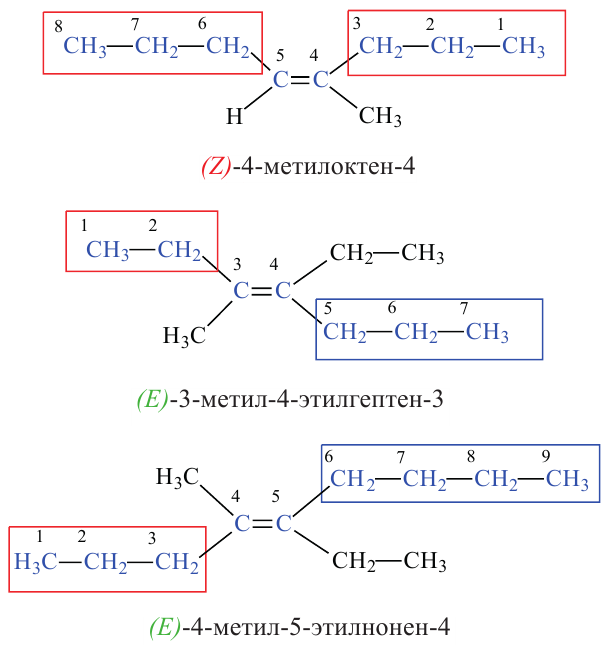
Методы получения:
1. В лабораторных условиях этилен получают при нагревании этилового спирта (в присутствии серной кислоты):

2.Этиленовые углеводороды можно получить при дегидрировании алканов (в присутствии катализатора, при высокой температуре):
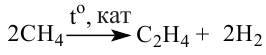
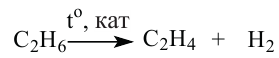
t°, кат
C2H6-► С2Н4 + Н2
3. Этиленовые углеводороды можно получить при взаимодействии дигалогенпронзводных алканов с металлами:
4. Алкены можно получить воздействием спиртового раствора гидроксида калия на моногалогенпроизводные алканов:
Задача с решением №1
При дегидратации неизвестного спирта было получено 5,6 г алкена и 3,6 г воды. Найдите название алкена. Решение задачи:
Напишем уравнение реакции:

Вода и алкен образуется в одинаковых количествах. Следовательно, найдём количество воды.
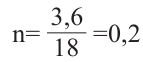 моль воды.
моль воды.
Теперь найдём молекулярную массу алкена.
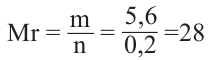
Исходя из общей формулы, находим состав алкена.
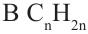 формуле, по массе
формуле, по массе 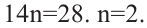
Ответ: 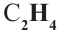
Химические свойства: Химические свойства этилена и его гомологов в основном определяются наличием в их молекулах двойной связи. Они легко вступают в реакцию за счет разрыва двойной связи. По этому для алкенов характерны реакции присоединения.
1. Реакция гидрогенизации. Алкены при высокой температуре и в присутствии катализаторов вступают в реакцию гидрогенизации за счет разрыва двойной связи:
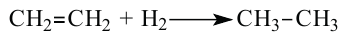
2. Реакция галогенирования. Также за счет разрыва двойной связи алкены вступают в реакцию галогенирования. Например, этилен обесцвечивает бромную воду. Продуктом реакции является дибромпроизводное алкана:

3. Этилен и его гомологи присоединяют также галогеноводороды:

Пропилен и последующие углеводороды ряда этилена реагируют с галогенводородами согласно правилу Марковникова, т.е. водород в составе галогенводорода присоединяется к наиболее, а галоген - к наименее гидрированному атому углерода.

4. Алкены легко окисляются из-за наличия в их молекуле двойной связи. Этилен, окисляясь перманганатом калия в нейтральной среде, образует двухатомный спирт -этиленгликоль:
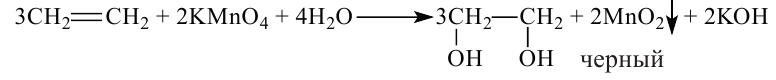
5. Этилен и пропилен вступают в реакцию полимеризации. Полимеризация -процесс соединения многих одинаковых молекул на более крупные молекулы полимера. Полимеризацию этилена можно выразить так:
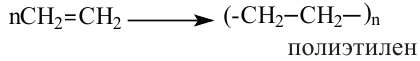
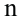 - степень полимеризации. Здесь этилен является мономером, полиэтилен - полимером.
- степень полимеризации. Здесь этилен является мономером, полиэтилен - полимером.
Применение. Продукты полимеризации этилена и пропилена -полиэтилен и полипропилен - используют в технике и в быту.
Алкадиены. Получение и свойства алкадиенов
Углеводороды с открытой цепью, в молекулах которых содержатся две двойные связи, называются алкадиенами. Количество атомов водорода на 4 меньше, чем у соответствующих алканов, так как в составе их молекул имеются две двойные связи. Поэтому общая формула алкадиенов 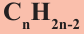
В углеводородах этиленового ряда на два атома водорода меньше, чем у соответствующих алканов, потому что в молекулах алкенов содержится одна  -связь. В соответствии с этим, у диеновых углеводородов на четыре атома водорода меньше, чем у соответствующих алканов, так как в молекулах диенов содержатся две двойные связи. Например, в пропане
-связь. В соответствии с этим, у диеновых углеводородов на четыре атома водорода меньше, чем у соответствующих алканов, так как в молекулах диенов содержатся две двойные связи. Например, в пропане 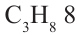 атомов водорода, в пропадиене
атомов водорода, в пропадиене 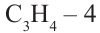 атома водорода.
атома водорода.
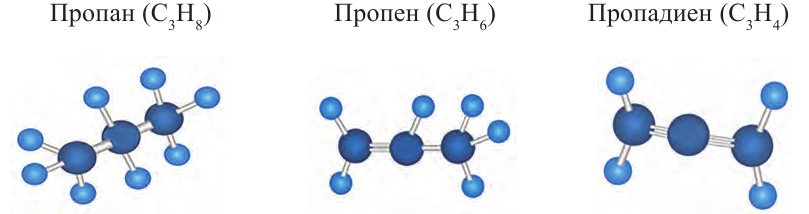
Номенклатура: Согласно систематической номенклатуре для обозначения диеновых углеводородов вместо последней буквы «н» соответствующего насыщенного углеводорода добавляется аффикс «диен», а также указываются атомы углерода с двойными связями. Для названия углеводородов диенового ряда:
- Определяется самая длинная цепь с двумя двойными связями.
- Атомы углерода в основной цепи нумеруются, начиная с конца цепи, к которому ближе двойная связь.
- Затем указывается местоположение радикала. Например,
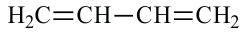 бутадиен-1,3
бутадиен-1,3
Здесь указываются цифры 1 и 3, потому что двойные связи следуют за 1 и 3 атомами углерода. Теперь обратим внимание на название следующей молекулы.
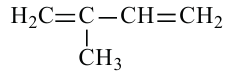 2-метилбутадиен-1,3
2-метилбутадиен-1,3
В данном случае нумерация начинается с того конца, к которому ближе разветвление основной цепи, потому как двойные связи одинаково расположены на обоих концах молекулы.
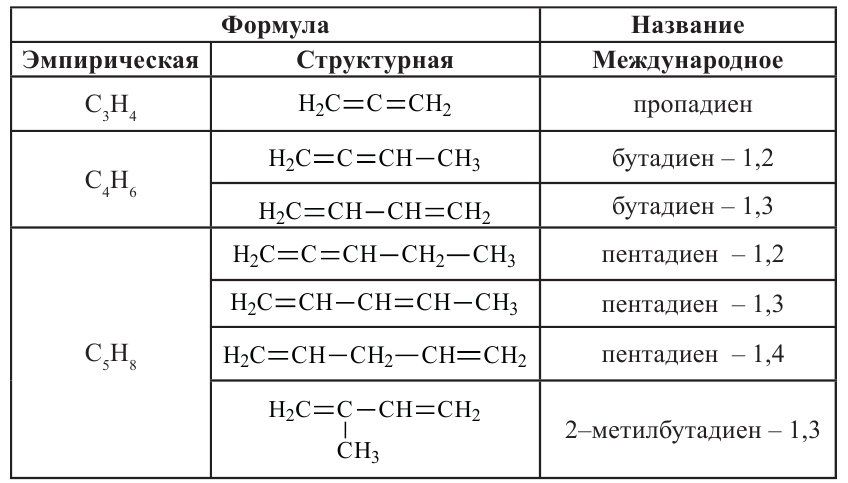
Изомерия: Для алкадиенов характерна изомерия углеродной цепи и изомерия по положению двойных связей.
Получение:
1. С. В. Лебедев синтезировал бутадиен-1,3 из этилового спирта в присутствии катализатора:
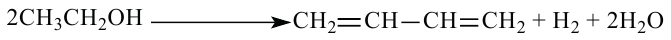
2. Путем дегидрирования бутана при высокой температуре и в присутствии катализатора получают бутадиен-1,3:

Физические свойства:
Физические свойства у диеновых углеводородов изменяются в определенном порядке, как и в гомологических рядах предельных и непредельных углеводородов. Бутадиен-1,3 при нормальных условиях является газом, а 2-метилбутадиен-1,3 - летучая жидкость.
Химические свойства:
Алкадиены, как и алкены, вступают в реакцию присоединения. При воздействии бромом на бутадиен-1,3 происходит присоединение по положению 1,2 или 1,4.
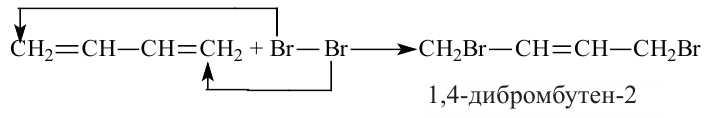
присоединение по положению 1,4
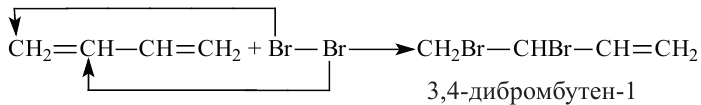
присоединение по положению 1,2
При наличии достаточного количества брома образуется 1,2,3,4-тетрабромбутан:

Общую формулу реакции горения алкадиенов можно выразить следующим образом:
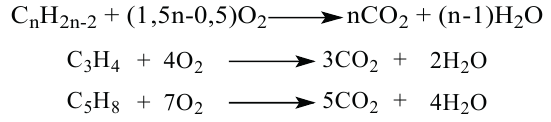
Алкины. Получение и свойства алкинов
Непредельные углеводороды, в молекулах которых содержится одна тройная связь, называются алкинами. Алкинов также называют углеводородами ацетиленового ряда. Общая формула алкинов  первым представителем является ацетилен.
первым представителем является ацетилен.
Номенклатура: Согласно рациональной номенклатуре названия углеводородов ацетиленового ряда производится добавлением слова ацетилен к названию радикала.
Согласно систематической номенклатуре названия алкинов образуются путём замены суффикса -ан у алканов на суффикс -ин.
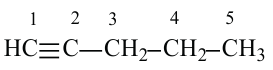 пентин - 1
пентин - 1
 пентин - 2
пентин - 2
 3-метилбутин-1
3-метилбутин-1
Формула Название
Эмпирическая Структурная Рациональная Международная
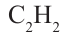
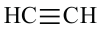 ацетилен этин
ацетилен этин
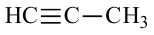 метилацетилен пропин
метилацетилен пропин
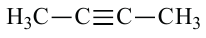 диметилацетилен бутин-2
диметилацетилен бутин-2
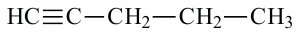 пропилацетилен пентин-1
пропилацетилен пентин-1
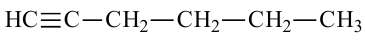 бутилацетилен гексин-1
бутилацетилен гексин-1
Изомерия: У углеводородов ацетиленового ряда наблюдается изомерия, связанная с разветвлением цепи и расположением тройной связи. Например, можем написать два алкина с общей формулой 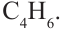
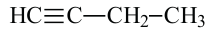 бутин-1
бутин-1
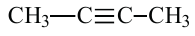 бутин - 2
бутин - 2
Так как общая формула алкинов и алкадиенов одинакова, то есть 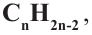 у них наблюдается межклассовая изомерия. Такую изомерию мы можем наблюдать начиная с пропина и пропадиена.
у них наблюдается межклассовая изомерия. Такую изомерию мы можем наблюдать начиная с пропина и пропадиена.
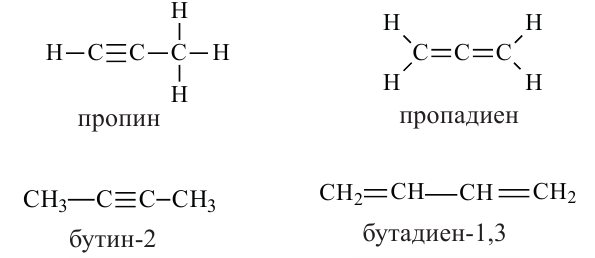
Получение:
1. В промышленности и в лаборатории ацетилен получают гидролизом карбида кальция.
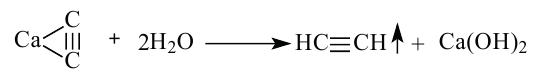
2. Ацетилен также можно получить при пиролизе метана:
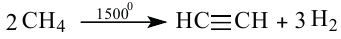
Физические свойства: Ацетилен - газ, легче воздуха, малорастворим в воде, в чистом виде почти без запаха. При увеличении относительной молекулярной массы повышается температура кипения веществ.
Химические свойства:
1. Реакция гидратации. М.Г. Кучеров, воздействуя на ацетилен водой в присутствии катализаторов, получил уксусный альдегид.
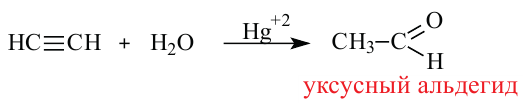
2. Н.Д. Зелинский получил бензол, пропустив ацетилен через нагретый активированный уголь.
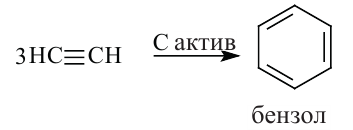
3. Алканы, как и все углеводороды, горят. Продуктами горения являются углекислый газ и вода.
Применение: Ацетилен широко используется в качестве первичного сырья в органическом синтезе. При горении ацетилена в кислороде температура достигает до 3000°С. Это используют для резки и сварки металлов.
Задача с решением №2
Для горения 10 л неизвестного алкина израсходовали 70 л кислорода. Определите неизвестный алкин и все его изомеры.
Решение задачи:
Известно, что общая реакция горения алкинов следующая:
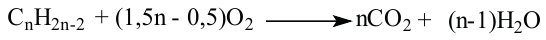
Значит, для горения одного объёма алкина расходуют 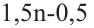 объём кислорода, (здесь
объём кислорода, (здесь 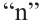 - число атомов углерода). Используя эти данные и приведенные в условии данные составим пропорцию:
- число атомов углерода). Используя эти данные и приведенные в условии данные составим пропорцию:
для горения 1 л алкина--------израсходовано 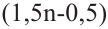 л 02
л 02
для горения 10 л--------израсходовано 70 л
Решим пропорцию:
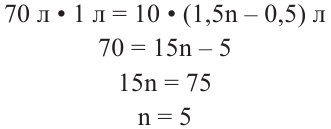
Значит, в составе алкина имеется 5 атомов углерода, т.е. это пентин. Общее количество изомеров у пентина 3.
Ответ: пентин, 3 изомера.
Ароматические углеводороды. Получение и свойства
Арены, или ароматические углеводороды - углеводороды, имеющие в молекуле одно или несколько бензольных колец.
Первым представителем гомологического ряда ароматических углеводородов является бензол 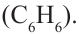 Предварительная структурная формула бензола была предложена немецким ученым А.Кекуле.
Предварительная структурная формула бензола была предложена немецким ученым А.Кекуле.

Современные физические методы исследования доказали, что бензол имеет циклическое строение и все углероды располагаются в одной поверхности.
Номенклатура и изомерия: Если заменить один или несколько водородов в бензольном кольце на углеводородные радикалы, то получатся гомологи бензола.
Если в молекуле бензола атомы водорода замещены несколькими радикалами, то образуются орто-, мета- и пара-производные бензола. Для наименования таких веществ атомы углерода в структурных формулах нумеруют, а обозначения орто-, мета- и пара- пишут сокращенно.
Если отщепить один атом водорода из молекулы бензола, то образуется фенильный  радикал. При отщеплении одного водорода из метальной группы толуола, образуется бензильный
радикал. При отщеплении одного водорода из метальной группы толуола, образуется бензильный  радикал.
радикал.
Получение:
1. Бензол можно получить при дегидрогенизации циклогексана в присутствии катализатора и при высокой температуре.
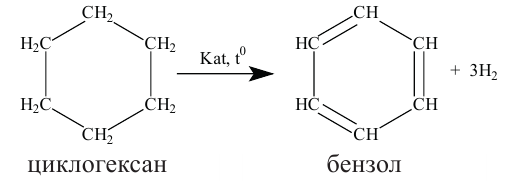
Таким же способом можно получить гомологи бензола.
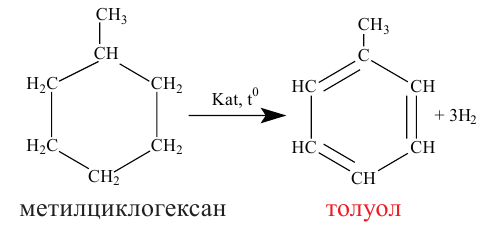
2. Тримеризацией ацетилена получают бензол.
Физические свойства: Бензол - бесцветная, нерастворимая в воде жидкость с характерным запахом. У бензола низкая температура кипения, при охлаждении легко затвердевает и образует белое кристаллическое вещество. С увеличением молекулярной массы ароматических углеводородов увеличивается их температура кипения.
Химические свойства: Бензольное ядро довольно устойчивое и в нормальных условиях не реагирует с большинством других веществ. Однако, если создать нужные условия, бензол может вступать в реакции замещения.
1. В присутствии катализатора 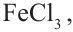 а также при высокой температуре атомы водорода в кольце бензола заменяются на галогены.
а также при высокой температуре атомы водорода в кольце бензола заменяются на галогены.
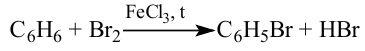
2. Если подействовать на бензол азотной кислотой в присутствии концентированной серной кислоты, то образуется нитробензол. (Реакция протекает при нагревании)
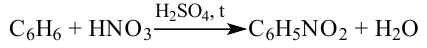
Гомологи бензола вступают в такую реакцию легче, чем бензол:
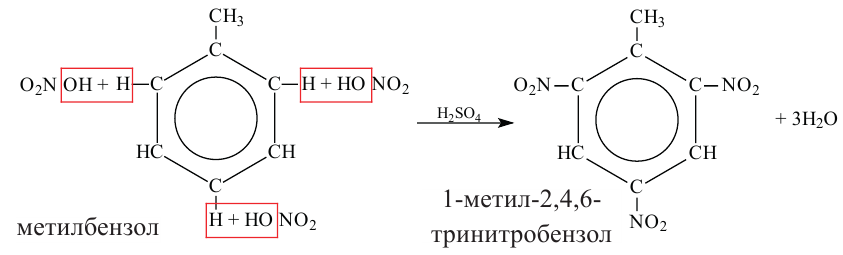
В бензольном кольце электронная плотность распределена равномерно. Но когда к бензолу присоединяются алкильные радикалы, они смещают электронную плотность в сторону бензольного кольца. В результате в положениях 2,4,6 электронная плотность увеличивается, и атомы водорода становятся подвижными и легко подвергаются замещению.
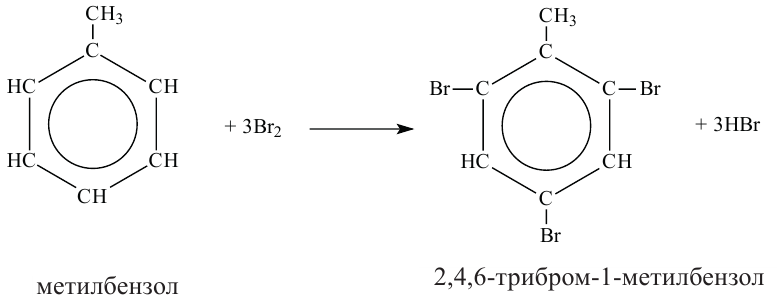
Реакции окисления:
Бензол довольно устойчив к реакциям окисления. Но его гомологи, в отличие от него, легко окисляются. При участии сильных окислителей, как  окисляются боковые радикалы бензольного ядра до карбоксильных групп.
окисляются боковые радикалы бензольного ядра до карбоксильных групп.
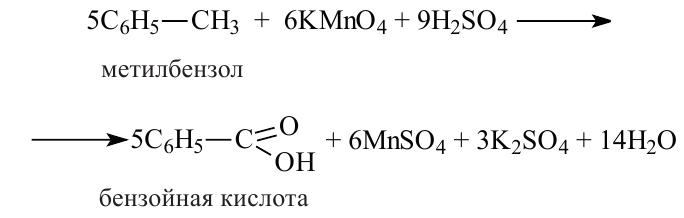
Реакции присоединения:
При воздействии солнечных лучей, бензол вступает в реакции присоединения с молекулами хлора.
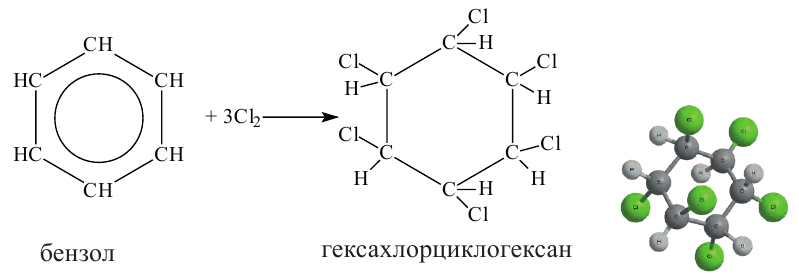
При гидрировании бензол образует циклогексан.
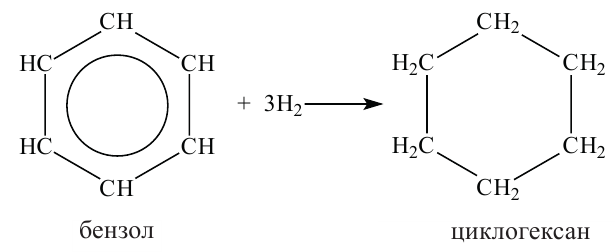
Гибридизация атома углерода в органических соединениях
При гибридизации различные электронные облака (орбитали) смешиваются друг с другом, и образуют одинаковые по форме и энергии гибридные орбитали. Это явление называют гибридизацией, а образованные орбитали - гибридными орбиталями.
Теорию гибридизации предложил Л.Полинг в 1931 году.
В органических соединениях атомы углерода гибридизуются по трем типам: это  гибридизации.
гибридизации.
 - гибридизация. В образовании молекулы метана углерод гибридизуется по типу
- гибридизация. В образовании молекулы метана углерод гибридизуется по типу 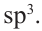 При этом углерод переводит свои внешние электроны в возбужденное состояние. В образовании молекулы метана углерод использует свои один
При этом углерод переводит свои внешние электроны в возбужденное состояние. В образовании молекулы метана углерод использует свои один 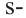 и три
и три 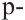 электронные орбитали. Эти четыре орбитали гибридизуются и образуют четыре одинаковых
электронные орбитали. Эти четыре орбитали гибридизуются и образуют четыре одинаковых 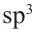 -гибридных орбиталей. Эти новые, гибридные
-гибридных орбиталей. Эти новые, гибридные 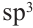 -орбитали располагаются друг относительно друга под углом
-орбитали располагаются друг относительно друга под углом  что придаёт молекуле метана тетраэдрическую форму. В молекуле метана четыре
что придаёт молекуле метана тетраэдрическую форму. В молекуле метана четыре  -гибридные орбитали углерода одинаково покрываются s-орбиталями атомов водорода и образуют четыре одинаковые связи. Перекрывание орбиталей углерода и водорода вдоль линии, соединяющей их ядра, означает образование сигма
-гибридные орбитали углерода одинаково покрываются s-орбиталями атомов водорода и образуют четыре одинаковые связи. Перекрывание орбиталей углерода и водорода вдоль линии, соединяющей их ядра, означает образование сигма  - связи. Гибридизация орбиталей углеродов по типу
- связи. Гибридизация орбиталей углеродов по типу 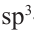 -xapaктepнa ко всем алканам.
-xapaктepнa ко всем алканам.
 -гибридизация. В молекуле этилена одна
-гибридизация. В молекуле этилена одна  орбиталь, а также две
орбиталь, а также две 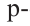 орбитали углерода гибридизуются и образуют три гибридные одинаковые орбитали. Они располагаются в одной плоскости, под углом в
орбитали углерода гибридизуются и образуют три гибридные одинаковые орбитали. Они располагаются в одной плоскости, под углом в 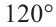 друг от друга. Такой тип гибридизации называется
друг от друга. Такой тип гибридизации называется 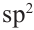 -гибридизацией. Оставшиеся негибридные
-гибридизацией. Оставшиеся негибридные 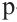 -орбитали углеродов участвуют в образовании
-орбитали углеродов участвуют в образовании 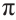 -связи
-связи
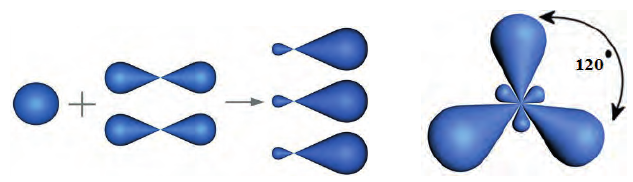
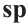 -гибридизация. Если в гибридизации будут участвовать по одной
-гибридизация. Если в гибридизации будут участвовать по одной 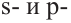 орбитали, такая гибридизация будет называться
орбитали, такая гибридизация будет называться  -гибридизацией. Образованные гибридные
-гибридизацией. Образованные гибридные  -орбитали, располагаются друг от друга под углом в
-орбитали, располагаются друг от друга под углом в 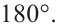 Оставшиеся негибридные две
Оставшиеся негибридные две  орбитали углерода участвуют в образовании
орбитали углерода участвуют в образовании  -связей. В качестве примера к данному типу гибридизации можно привести молекулу ацетилена, где оба атома углерода являются
-связей. В качестве примера к данному типу гибридизации можно привести молекулу ацетилена, где оба атома углерода являются  гибридными. Все атомы углерода, которые образуют одну тройную связь или две двойные связи, бывают
гибридными. Все атомы углерода, которые образуют одну тройную связь или две двойные связи, бывают  гибридными.
гибридными.
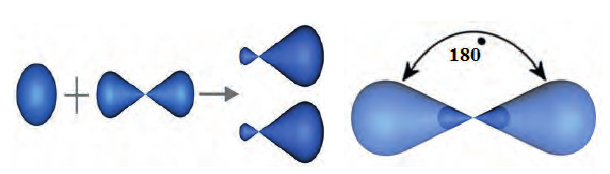
Природные источники углеводородов. Нефть и продукты ее переработки
Важными природными источниками углеводородов являются нефть, природный газ, попутные нефтяные газы и каменный уголь.

Нефть - горючая маслянистая жидкость, состоящая из смеси газообразных, жидких и твердых углеводородов, от желтого или светло-бурого до черного цвета со своеобразным запахом. Помимо углеводородов нефть может содержать кислородсодержащие, серосодержащие и азотсодержащие органические вещества. Состав нефти различен и зависит от месторождения.
Нефть состоит из газообразных, жидких и твердых углеводородов. Газообразные углеводороды выходят из скважин как газ или попутные газы. Если основу нефти составляют жидкие углеводороды, нефть называется парафинового основания. Если нефть богата твердыми углеводородами, она считается асфальтового основания.
Некоторые учёные предполагают, что нефть образовалась из-за воздействия воды на карбиды (углеродные соединения металлов), а другие считают нефть продуктом разложения растений и организмов, которые остались под землей.
Плотность нефти меньше, чем плотность воды. Нефть практически не растворяется в воде. У нее нет постоянной температуры кипения, так как нефть представляет собой смесь различных углеводородов.
В промышленности из нефти получают ракетное топливо, топливо для дизельных двигателей и для двигателей внутреннего сгорания, смазочные масла, парафинное масло, т.е. вазелин и другие продукты.
Для отделения составных частей нефти пользуются различными методами. Самым важным методом является фракционная перегонка нефти. Во фракционной перегонке составные части нефти поэтапно отделяются в зависимости от своей температуры кипения. Во время перегонки первыми отделяются газообразные углеводороды. Различают три основные фракции в процессе перегонки нефти:
 — газолин или бензины.
— газолин или бензины.
 — керосин.
— керосин.
 — остаток нефти, т.е мазут.
— остаток нефти, т.е мазут.
Каждая фракция подвергается повторной перегонке и разделяется на более мелкие фракции. Основные из них приведены ниже.
I. Газолиновая фракция, или фракция бензинов. Данная фракция состоит из углеводородов, в составе которых содержится от 5 до 9 углеродов. Из неё получают следующие продукты:
1. Легкий бензин - газолин или петролейный эфир. Петролейный эфир в основном применяется в качестве растворителя.
2. Фракция среднего бензина в зависимости от области применения подразделяется на авиационый, автомобильный бензин и др. В технике продукты данной фракции служат как топливо двигателей внутреннего сгорания.
3. Тяжелый бензин или лигроин. Продукты этой фракции служат топливом для дизельных двигателей.
II. Керосинная фракция. Данная фракция состоит из углеводородов, которые содержат от 9 до 16 атомов углерода. Керосиновая фракция после хорошей очистки применяется как тракторное топливо и горючее для хозяйственных нужд.
III. Фракция мазута. Данная фракция содержит углеводороды, в составе которых содержится от 16 атомов углерода и выше. Чтобы мазут в процессе перегонки можно было разделять на фракции, его, очевидно, необходимо нагреть не до  как было при перегонке нефти, а значительно выше. Но, оказывается, молекулы углеводородов, входящие в состав мазута, не выдерживают столь сильного нагревания и разлагаются. Поэтому, процесс ведут при пониженном давлении, в так называемых ваакумных установках. Из мазута получают соляровые масла, различные смазочные масла, вазелин, парафин и другие вещества.
как было при перегонке нефти, а значительно выше. Но, оказывается, молекулы углеводородов, входящие в состав мазута, не выдерживают столь сильного нагревания и разлагаются. Поэтому, процесс ведут при пониженном давлении, в так называемых ваакумных установках. Из мазута получают соляровые масла, различные смазочные масла, вазелин, парафин и другие вещества.
После полной перегонки мазутной фракции во фракционной печи остаётся гудрон. Из него изготавливается асфальт.
При прямой перегонке нефти образуется бензин, но при этом выход реакции будет небольшим. Для повышения количества получаемого бензина из нефти, более тяжелые фракции подвергаются к крекингу и получается дополнительный бензин:
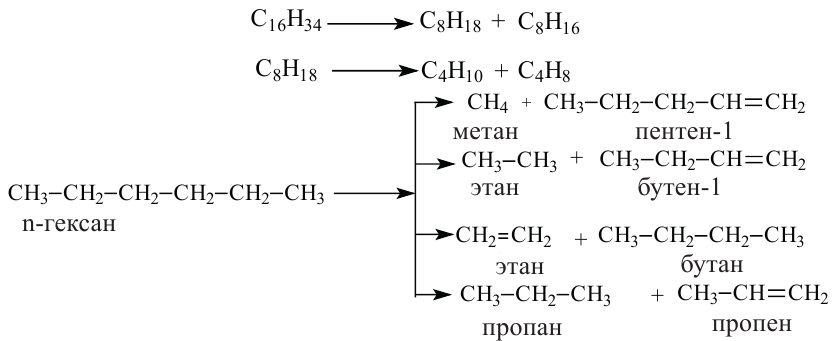
Крекинг нефти повышает количество получаемого бензина. Само слово „крекинг" взято от английского и означает — разложение. При протекании крекинга, углеводороды с большой молекулярной массой расщепляются на более мелкие углеводороды. Но помимо расщепления протекают и другие побочные процессы такие как дегидрогенизация, циклизация, изомеризация, полимеризация.
Нефть подвергается к крекингу двумя способами: термический и каталитический крекинг. Термический крекинг проводится при высокой температуре и давлении. При этом высокомолекулярные углеводороды расщепляются на низкомолекулярные и ненасыщенные углеводороды. Такие углеводороды 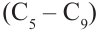 дают бензиновую фракцию.
дают бензиновую фракцию.
Природные источники углеводородов. Природный газ и каменный уголь
Природный газ состоит, в основном, из углеводородов с низкой молекулярной массой, являющиеся газообразными веществами в обычных условиях. Примерно 80 - 98% природного газа составляет метан, а остальную часть его близкие гомологи - этан, пропан, бутан и другие примеси как сульфид водорода, азот, инертные газы, оксид четырехвалентного углерода и пары воды.
Попутные газы, которые выделяются во время добывания нефти, также считаются частью природного газа. Попутные газы содержат меньше метана, но в их составе содержание этана, пропана и бутана выше, чем у обычного природного газа. Побочные газы как сульфид водорода, азот, инертные газы, углекислый газ и вода не исключение для попутных газов, и входят в их состав.
Попутные газы располагаются выше, чем нефтяные залежи, или из-за высокого подземного давления могут растворяться в самой нефти.
Попутные газы, вместе с газами, которые получаются при крекинге нефти, подаются в отдельный фракционный аппарат и разделяются на различные углеводороды. Из них можно получить полиэтилен, поливинилхлорид. Дегидрированием пропана и бутана получают ненасыщенные углеводороды - пропилен, бутилен и бутадиен, из которых в дальнейшем получают каучук и пластмассы.
Характеристика попутных нефтяных газов:
Газосодержащий бензин:
- Состав:пентан,гексан и смесь других углеводородов.
- Применение: Добавляется к бензину для облегчения заведения двигателя.
Пропан и бутан
- Состав: Смесь пропана и бутана.
- Применяется как топливо в виде сжиженного газа.
Сухой газ
- По составу схож с природным газом.
- Служит для получения
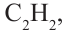
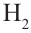 и других веществ, а также применяется как топливо.
и других веществ, а также применяется как топливо.
Природный газ известен тем, что считается оптимальным горючим, так как горит полностью и образует большое количество теплоты.
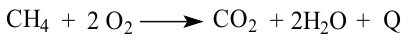
В настоящее время природный газ становится начальным сырьём для синтеза различных органических соединений. При нагревании метана, основную составную часть природного газа, до 1500° С образуются ацетилен и водород.
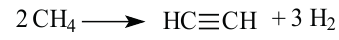
В электрохимических комбинатах из ацетилена получают уксусный альдегид, бензол, уксусную кислоту, этиловый спирт, каучук и другие вещества. Водород служит для синтеза аммиака, азотной кислоты, калиевой, натриевой и аммонийной селитры. Нагревая метан до высоких температур, в участии воды получают угарный газ и водород. Такая смесь называется синтез газом.
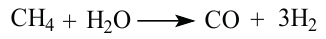
Разработаны множество способов переработки природного газа. Целью переработки газов является преобразование насыщенных углеводородов на ненасыщенные, т.к. именно из ненасыщенных углеводородов можно получить синтетические полимеры как каучук, пластмасса. Наряду с этим, проведение реакций окисления дает возможность получить кислоты, спирты и другие органические вещества.
Каменный уголь: Помимо применения в качестве топлива, каменный уголь применяется в большом количестве в металлургии для получения кокса. Кокс образует нужную температуру, в которой железо плавится и выделяется из железосодержащих руд.
При сухой перегонке каменного угля, которая также называется коксованием, улетучиваются легкие углеводороды и образуется рыхлая субстанция, состоящая из углерода и пепла. Когда полученная субстанция охлаждается, образуются такие газообразные продукты, как каменноугольная смола, аммиачная вода, коксовый газ.
При сухой перегонке каменного угля образуется каменноугольная смола. Эта смола состоит, в основном, из ароматических и гетероциклических соединений. Органические соединения в составе смолы выделяются на разных фракциях, которые различаются по температуре:
- Фракция легких масел.
- Фракция фенола.
- Фракция нафталина.
- Фракция поглощения.
- Фракция антрацена.
- Фракция каменного угля.
Аммиачная вода состоит из аммиака, хлорида аммония и углекислого газа, растворенных в воде. Она применяется для получения азотных удобрений.
Коксовый газ состоит из бензола, толуола, ксилола, фенола, аммиака, сульфида водорода и других веществ. После очистки от аммиака и сульфида водорода образуется ценная смесь углеводородов, которая состоит из бензола и других важных соединений.
Задача с решением №3
Для сжигания метана в составе природного газа потребовался кислород объемом 67,2 л (н.у.) Определите массу (г) углекислого газа, который образуется в данной реакции.
Решение задачи.
Сначала напишем реакцию горения метана.

Как видим, для сжигания одного моля метана требуется 2 моля кислорода, при этом образуется 1 моль углекислого газа. Это значит от двух молей кислорода выделяется один моль углекислого газа. Для начала определим количество кислорода из данного объема.
Если расходуются 2 моля кислорода образуется 1 моль углекислого газа. Если расходуются 3 моля кислорода, то сколько молей углекислого газа может образоваться?
В конце определим массу полученного углекислого газа.
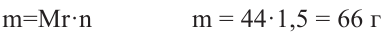
Ответ: 66 г
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |