
Оксигенсодержащие органические соединения в химии с примерами
Содержание:
Оксигенсодержащие органические соединения:
Многие органические соединения содержат в своих молекулах, кроме атомов Карбона и Гидрогена, еще и атомы Оксигена. Среди них — этиловый спирт, сахар, крахмал, уксусная и лимонная кислоты, жиры, некоторые витамины.
Оксигенсодержащие органические соединения делят на классы — класс спиртов, класс карбоновых кислот и др. Общим признаком для соединений каждого класса является наличие в их молекулах определенной группы атомов.
Группу атомов, которая обуславливает характерные химические свойства соединений данного класса, называют функциональной группой.
Примеры функциональных групп и их названия:

Функциональные группы в химических формулах соединений записывают отдельно от «углеводородной» части молекулы: 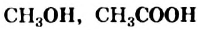
Часть молекулы (группу атомов Карбона и Гидрогена), с которой соединена функциональная группа, называют углеводородным остатком. Таковым в приведенных выше формулах является группа атомов 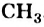 .
.
Вы ознакомитесь с некоторыми оксигенсодержащими органическими соединениями — важнейшими спиртами, карболовыми кислотами, а также с жирами и углеводами.
Спирты
По традиции оксигенсодержащие органические соединения начинают изучать со спиртов.
Спирты — зто производные углеводородов, в молекулах которых один или несколько атомов Гндрогена замещены на гидроксильные группы.
Пример замещения атома Гидрогена на 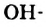 группу — функциональную группу класса спиртов:
группу — функциональную группу класса спиртов:
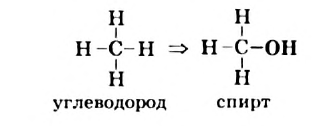
Если в молекуле спирта имеется одна гидроксильная группа, то такой спирт называют одноатомным. В молекулах двухатомных спиртов содержатся две 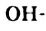 группы, трехатомных — три и т. д.
группы, трехатомных — три и т. д.
В зависимости от наличия в карбоновой цепи кратных связей различают насыщенные и ненасыщенные спирты.
Обозначив углеводородный остаток буквой 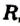 , запишем общую формулу одноатомных спиртов:
, запишем общую формулу одноатомных спиртов: 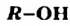 .
.
Если заменить атом Гидрогена в общей формуле алканов на 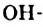 группу, то получим общую формулу насыщенных одноатомных спиртов —
группу, то получим общую формулу насыщенных одноатомных спиртов —
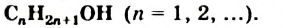
Метанол и этанол
Простейшим насыщенным одноатомным спиртом является метанол, или метиловый спирт, 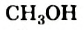 (рис. 68, а). Спирт с двумя атомами Карбона и одной группой
(рис. 68, а). Спирт с двумя атомами Карбона и одной группой  в молекуле имеет формулу
в молекуле имеет формулу 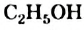 . Его название — этанол, или этиловый спирт (рис. 68, б).
. Его название — этанол, или этиловый спирт (рис. 68, б).
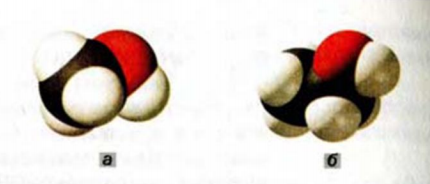
Рис. 68. Масштабные модели молекул: а — метанола; б — этанола. Белые шарики — атомы Гидрогена, черные — атомы Карбона, красные — атомы Оксигена
Это интересно. Тривиальное название метанола 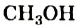 — древесный спирт, этанола
— древесный спирт, этанола 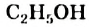 - винный спирт.
- винный спирт.
Строение молекулы спирта:
Молекула одноатомного спирта состоит из двух частей — углеводородного остатка и гидроксильной группы.
Атом Оксигена, как самый электроотрицательный среди всех атомов молекулы спирта, смещает к себе общие электронные пары от двух соседних атомов 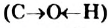 , причем в наибольшей степени — от атома Гидрогена. В результате на атоме Оксигена возникает небольшой отрицательный заряд, а на атоме Гидрогена — положительный заряд. Связь
, причем в наибольшей степени — от атома Гидрогена. В результате на атоме Оксигена возникает небольшой отрицательный заряд, а на атоме Гидрогена — положительный заряд. Связь 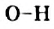 становится достаточно полярной.
становится достаточно полярной.
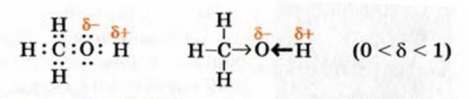
Приводим электронную формулу молекулы метанола, а также ее структурную формулу, в которой показано смещение общих электронных пар к атому Оксигена:
Физические свойства: При обычных условиях метанол и этанол — бесцветные жидкости с характерным «спиртовым» запахом. Температуры кипения этих соединений намного выше, чем соответствующих алканов (рис. 69).
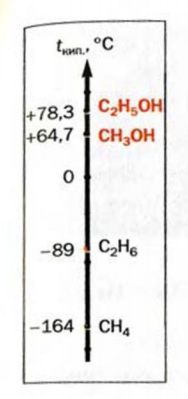
Рис. 69. Температуры кипения некоторых спиртов и алканов
Значительная разница температур кипения углеводорода и спирта обусловлена тем, что в спирте существуют водородные связи1 (рис. 70, а). Молекулы спирта, имея достаточно полярные связи 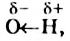 притягиваются друг к другу, а именно — атом
притягиваются друг к другу, а именно — атом  одной молекулы к атому
одной молекулы к атому  другой.
другой.
Водородные связи образуются также между молекулами спирта и воды (рис. 70, б). Благодаря этому метанол и этанол неограниченно растворяются в воде.
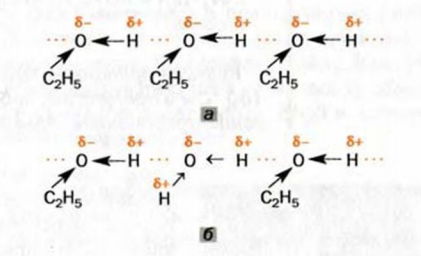
Рис . 70. Водородные связи между молекулами: а — этанола; б — этанола и воды
Химические свойства: Важнейшие реакции спиртов происходят с участием гидроксильных групп их молекул.
Реакции с металлами: Спирты взаимодействуют со щелочными металлами с выделением водорода и образованием солеподобных соединений (рис. 71):
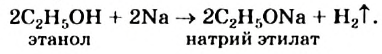
В этой реакции спирт напоминает кислоту. Однако молекула не диссоциирует с образованием катионов Гидрогена, а водный раствор спирта не действует на индикаторы.
Дегидратация: Так называют реакцию отщепления воды от любого соединения. В оопределенных условиях каждая молекула этилового спирта распадается на молекулу этилена и молекулу воды:
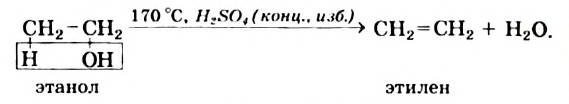
Аналогичная реакция с метиловым спиртом не происходит.
Возможен другой вариант дегидратации спиртов — отщепление каждой молекулы воды за счет гидроксильных групп двух молекул спирта:
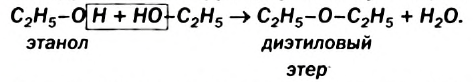
Реакция происходит при температуре 140— 160 °С и в присутствии небольшого количества концентрированной сульфатной кислоты.
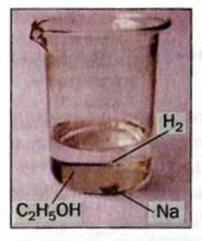
Рис. 71. Реакция этанола с натрием
Окисление: Если добавить спирт к фиолетовому раствору калий перманганата, подкисленному сульфатной кислотой, то окраска жидкости постепенно исчезает (рис. 72). В этой реакции спирт выступает восстановителем и окисляется.

Рис. 72. Окисление этанола калий перманганатом (в присутствии сульфатной кислоты)
Полное окисление спирта происходит если его поджечь на воздухе. Продукты этой реакции - углекислый газ и водяной пар. (рис. 73).

Рис. 73. Горение этанола
Получение спиртов: В промышленности метиловый и этиловый спирты получают в больших количествах, осуществляя такие реакции:
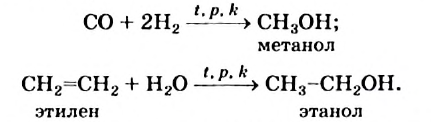
Для получения этилового спирта используют также биохимический метод. Он основан на химическом превращении глюкозы, сахара или крахмала с участием ферментов дрожжей. Соответствующий процесс называют брожением (§ 29). Так еще в древности изготовляли вино из виноградного сока.
Большая часть этилового спирта, производимого промышленностью, содержит незначительное количество воды 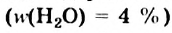 . Название этого продукта — спирт-ректификат.
. Название этого продукта — спирт-ректификат.
Обнаружить воду в спирте можно, добавив несколько его капель к белому порошку безводного купрум(II) сульфата 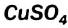 . В результате взаимодействия этой соли с водой образуется кристаллогидрат
. В результате взаимодействия этой соли с водой образуется кристаллогидрат 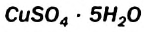 и появляется голубое окрашивание.
и появляется голубое окрашивание.
Применение: Метанол и этанол используют прежде всего как растворители, а также для получения важных органических соединений.
Этиловый спирт — известное дезинфицирующее средство (рис. 74).
Рис. 74. Аптечная бутылочка с этиловым спиртом
Его применяют для приготовления растворов медицинских препаратов и экстрактов лекарственных растений. Этанол является сырьем для производства ликеро-водочных напитков. Смесь бензина с этанолом иногда служит горючим для городского транспорта (например, в Бразилии). Двигатель, который работает на таком горючем (рис. 75), выбрасывает в воздух меньше вредных веществ, чем бензиновый. Поскольку спирт для горючего можно производить из зеленой массы растений и древесины, это позволяет уменьшить количество нефти, перерабатываемой на бензин, и использовать ее как ценное химическое сырье.

Рис. 75. Заправка автомобиля «спиртовым» горючим
Физиологическое действие: При поступлении в организм небольшого количества этилового спирта происходит опьянение. Такое состояние характеризуется нарушением речи и координации движений, потерей памяти и контроля за своими действиями, умопомрачением. Значительные дозы алкоголя приводят к отравлению. У людей, постоянно употребляющих алкогольные напитки, возникает хроническое заболевание — алкоголизм. Его следствиями являются повышенное давление, поражение нервной и сердечно-сосудистой систем, печени, поджелудочной железы. (Аналогично действует этанол и на организмы животных.)
Метанол — ядовитое вещество. Поступление в организм человека 25 г метанола вызывает смерть, а меньшее количество — слепоту.
Выводы:
- Спирты — производные углеводородов, в молекулах которых один или несколько атомов Гидрогена замещены на гидроксильные группы.
- Различают одноатомные, двухатомные, трехатомные спирты. Общая формула насыщенных одноатомных спиртов —
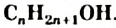 .
. - Важнейшие спирты — метанол
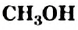 и этанол
и этанол 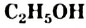 . Это бесцветные жидкости с характерным запахом.
. Это бесцветные жидкости с характерным запахом. - Метанол и этанол — горючие вещества. Они реагируют со щелочными металлами, при нагревании отщепляют воду.
- Промышленность выпускает метанол и этанол в большом количестве. Эти соединения используют в химической промышленности как растворители, а этанол — еще и в медицине, для изготовления ликеро-водочных напитков, иногда — как компонент горючего в двигателях внутреннего сгорания.
- Этанол, попадая в органнизм, вызывает опьянение. Постоянное употребление спиртных напитков приводит к алкоголизму.
- Метанол — чрезвычайно ядовитое вещество.
Глицерин
Простейшим трехатомным спиртом является глицерин 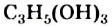 (рис. 76). Название происходит от греческого слова glykys — сладкий. Другое название соединения — глицерол. В природе этого спирта нет, но его производные — жиры — очень распространены в растительном и животном мире.
(рис. 76). Название происходит от греческого слова glykys — сладкий. Другое название соединения — глицерол. В природе этого спирта нет, но его производные — жиры — очень распространены в растительном и животном мире.
Структурная формула молекулы глицерина —
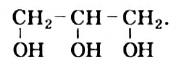

Рис. 76. Масштабная модель молекулы глицерина
Физические свойства: Глицерин — бесцветная вязкая жидкость без запаха, сладкая на вкус. Соединение немного тяжелее воды, смешивается с ней в любых соотношениях с образованием раствора. Глицерин может поглощать влагу (до 40 % своей массы). Это свойство вещества называют гигроскопичностью. Термин происходит от греческих слов hygros — влажный, skoped — наблюдаю.
Глицерин 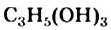 кипит, разлагаясь, при + 290 °С, т. е. при более высокой температуре, чем одноатомный спирт с таким же количеством атомов Карбона в молекуле —
кипит, разлагаясь, при + 290 °С, т. е. при более высокой температуре, чем одноатомный спирт с таким же количеством атомов Карбона в молекуле — 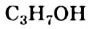 (т. кип. +97 °С). Это и понятно, так как водородных связей в трехатомном спирте значительно больше: в каждой его молекуле содержится три
(т. кип. +97 °С). Это и понятно, так как водородных связей в трехатомном спирте значительно больше: в каждой его молекуле содержится три 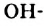 группы.
группы.
Химические свойства: Глицерин реагирует не только с активными металлами, но и с некоторыми нерастворимыми основаниями. Таким образом, он больше напоминает кислоту, чем метанол или этанол. Однако водный раствор глицерина также не изменяет окраски индикаторов.
Реакции с металлами: Глицерин взаимодействует со щелочными металлами (рис. 77):
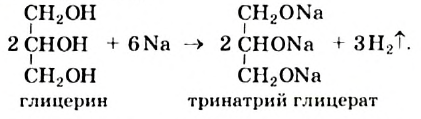

Рис. 77. Реакция натрия с глицерином
Перед проведением соответствующего опыта глицерин необходимо подогреть.
Реакции с нерастворимыми основаниями: Глицерин, в отличие от одноатомных спиртов, вступает в реакции с некоторыми нерастворимыми основаниями.
Горение: При поджигании на воздухе глицерин горит с образованием углекислого газа и водяного пара.
Получение: Глицерин получают в промышленности преимущественно из жиров. Это соединение было впервые получено в 1779 г.
Применение: Глицерин является компонентом мыла, зубных паст, косметических средств, лекарственных препаратов (рис. 78). Благодаря высокой гигроскопичности он защищает кожу от пересыхания. Глицерин добавляют в некоторые пищевые продукты для придания им сладкого вкуса.
Рис. 78. Применение глицерина: а — в косметических средствах; б — в лекарственных препаратах
Глицерин также используют для производства нитроглицерина — одного из сильнейших взрывчатых веществ, сырья для изготовления пороха и динамита. Нитроглицерин в больших дозах ядовит. Однако его 1 %-й спиртовый раствор применяют при заболеваниях сердца в качестве сосудорасширяющего средства (рис. 79).

Рис. 79. Капсулы с раствором нитроглицерина
Выводы:
- Глицерин
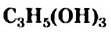 — простейший трехатомный спирт. Это бесцветная вязкая жидкость со сладким вкусом, не имеющая запаха.
— простейший трехатомный спирт. Это бесцветная вязкая жидкость со сладким вкусом, не имеющая запаха. - Глицерин взаимодействует со щелочными металлами, некоторыми нерастворимыми основаниями, горит на воздухе.
- Глицерин получают из жиров. Его используют в производстве косметических средств, лекарственных препаратов, нитроглицерина, иногда — в пищевой промышленности.
Карбоновые кислоты
В материале этого и нескольких последующих параграфов речь пойдет о соединениях класса карбоновых кислот. Эти соединения отличаются от спиртов наличием в молекулах новой функциональной группы — карбоксильной
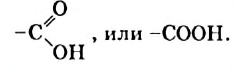
Производные углеводородов, молекулы которых содержат одну или несколько карбоксильных групп, называют карбоновыми кислотами.
Общая формула карбоновых кислот, содержащих в молекулах одну карбоксильную группу,—
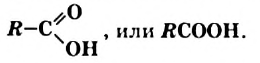
Распространенность в природе: В растительном мире встречаются различные карбоновые кислоты. Тривиальные названия этих соединений зачастую происходят от названий растений, в которых они находятся (табл. 2, рис. 80, а). Карбоновые кислоты обнаружены и в организмах насекомых, млекопитающих, человека (табл. 2, рис. 80, б).

Рис. 80. Обнаружение кислот с помощью универсального индикатора: а — в соке лимона; б — в выделениях муравьев
Классификация: Карбоновые кислоты классифицируют, учитывая особенности состава и строения их молекул.
По числу карбоксильных групп в молекуле кислоты делят на монокарбоновые (молекулы содержат одну группу 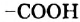 ), дикарбоновые (две группы
), дикарбоновые (две группы 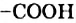 ) и т. д.
) и т. д.
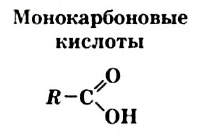
Таблица 2

В зависимости от наличия кратных связей в углеводородных остатках молекул различают насыщенные и ненасыщенные кислоты. Кроме того, карбоновые кислоты делят на низшие (их молекулы содержат менее 10 атомов Карбона) и высшие.
Общая формула насыщенных монокарбоновых кислот — 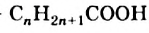 .
.
Молекулы простейших по составу кислот — муравьиной 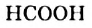 (рис. 81) и щавелевой
(рис. 81) и щавелевой 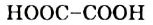 — не имеют углеводородных остатков.
— не имеют углеводородных остатков.
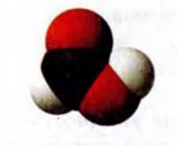
Рис. 81. Масштабная модель муравьиной кислоты
Названия: Для карбоновых кислот чаще употребляют тривиальные названия:
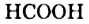 — муравьиная;
— муравьиная;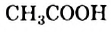 — уксусная;
— уксусная;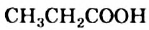 — пропионовая;
— пропионовая;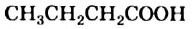 — масляная.
— масляная.
Для простейших монокарбоновых кислот существуют и латинские названия: 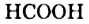 — формиатная кислота,
— формиатная кислота, 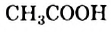 — ацетатная кислота.
— ацетатная кислота.
Среди высших кислот важнейшими являются насыщенные кислоты — пальмитиновая 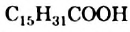 и стеариновая
и стеариновая 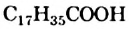 (рис. 82), а также ненасыщенная — олеиновая
(рис. 82), а также ненасыщенная — олеиновая 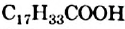 , или
, или 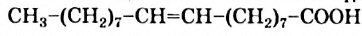 . Раньше эти кислоты получали только из растительных и животных жиров, поэтому их еще называют жирными кислотами.
. Раньше эти кислоты получали только из растительных и животных жиров, поэтому их еще называют жирными кислотами.

Рис. 82. Масштабная модель молекулы стеариновой кислоты
Выводы:
- Карбоновые кислоты — производные углеводородов, молекулы которых содержат одну или несколько карбоксильных групп
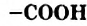 . По количеству этих групп в молекуле различают монокарбоновые, дикарбоновые кислоты и т.д. Кислоты, которые происходят от насыщенных углеводородов, называют насыщенными, а содержащие 10 и больше атомов Карбона в молекулах, — высшими.
. По количеству этих групп в молекуле различают монокарбоновые, дикарбоновые кислоты и т.д. Кислоты, которые происходят от насыщенных углеводородов, называют насыщенными, а содержащие 10 и больше атомов Карбона в молекулах, — высшими. - Общая формула насыщенных монокарбоно-вых кислот —
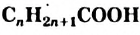 .
. - Карбоновые кислоты распространены в природе.
- Для карбоновых кислот чаще употребляют тривиальные названия, связанные с природными источниками соединений.
Уксусная кислота
Водный раствор уксусной кислоты, известный под названием «уксус», люди умели готовить еще в древности. Ныне промышленность выпускает столовый уксус — раствор с массовой долей кислоты 9 % (рис. 83). Ее используют в каждой семье для различных целей.

Рис. 83. Уксус
Кроме названия «уксусная кислота» химики используют и другое — «этановая кислота». Оно указывает на то, что в молекуле этого соединения, как и в молекуле этана, имеется два атома Карбона.
Строение молекулы: Химическая формула уксусной кислоты — 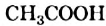 , а структурная формула молекулы (рис. 84) —
, а структурная формула молекулы (рис. 84) —
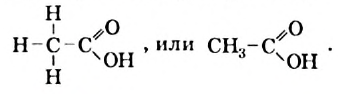
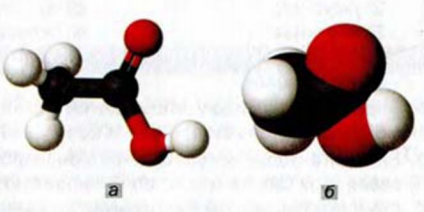
Рис. 84. Модели молекулы уксусной кислоты: а — шаростержневая; б — масштабная
В молекуле уксусной кислоты содержатся углеводородный остаток 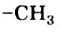 и карбоксильная группа
и карбоксильная группа 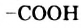 . Атом Оксигена, соединенный с атомом Карбона двойной связью, вызывает сильное смещение общей электронной пары в гидроксильной группе:
. Атом Оксигена, соединенный с атомом Карбона двойной связью, вызывает сильное смещение общей электронной пары в гидроксильной группе:
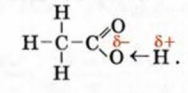
Связь 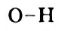 в молекуле уксусной кислоты более полярна, чем в молекулах спиртов. Поэтому соединение проявляет в водном растворе кислотные свойства.
в молекуле уксусной кислоты более полярна, чем в молекулах спиртов. Поэтому соединение проявляет в водном растворе кислотные свойства.
Физические свойства: В обычных условиях уксусная кислота — бесцветная жидкость с резким запахом. При понижении температуры до + 16,7 °С она кристаллизуется, как бы замерзая (рис. 85).

Рис. 85. Бутылка с чистой уксусной кислотой, находящаяся в прохладном помещении
Поэтому чистую уксусную кислоту иногда называют ледяной. Температура кипения соединения равна +118,1 °С. Она выше, чем температура кипения этанола 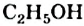 (+78,3 °С). Это обусловлено образованием в кислоте большего числа водородных связей (в ее молекуле — два атома Оксигена, тогда как в молекуле спирта — один).
(+78,3 °С). Это обусловлено образованием в кислоте большего числа водородных связей (в ее молекуле — два атома Оксигена, тогда как в молекуле спирта — один).
Уксусная кислота смешивается с водой в любых соотношениях с образованием раствора.
Химические свойства: Уксусная кислота, как и неорганические кислоты, диссоциирует в водном растворе на катионы Гидрогена и анионы кислотного остатка:
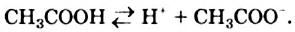
Этот процесс происходит вследствие разрыва ковалентных полярных связей 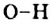 . Образующиеся катионы Гидрогена вызывают изменение окраски индикатора.
. Образующиеся катионы Гидрогена вызывают изменение окраски индикатора.
Уксусная кислота является слабой; в ее растворе содержится значительно больше молекул соединения, чем ионов.
Структурная формула аниона уксусной кислоты —
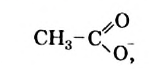
и его название — ацетат-нон. Соли уксусной кислоты называют ацетатами.
Реакции с металлами, оксидами, гидроксидами, солями: Уксусная кислота взаимодействует с металлами (с выделением водорода), основными и амфотер-ными оксидами (рис. 86), основаниями, амфотерными гидроксидами, некоторыми солями слабых кислот (например, с карбонатами).

Рис. 86. Реакция уксусной кислоты с купрум(II) оксидом
Приводим уравнение реакции кислоты с металлом:
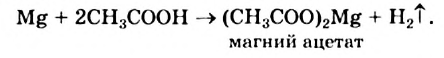
Обратите внимание: в формулах солей органических кислот сначала записывают анионы, затем — катионы.
В нонно-молекулярных уравнениях уксусную кислоту как слабую представляют в недиссоциированной форме:
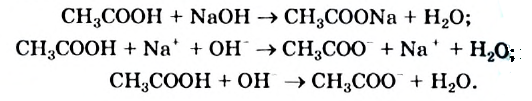
Ацетат-ноны в растворе можно обнаружить, если добавить к нему несколько капель раствора, содержащего катионы  . В результате реакции жидкость окрашивается в темно-красный цвет (рис. 87).
. В результате реакции жидкость окрашивается в темно-красный цвет (рис. 87).

Рис. 87. Реакция соли Феррума(III) с натрий ацетатом
Реакции со спиртами. Эстеры: Уксусная кислота в присутствии концентрированной сульфатной кислоты реагирует с этиловым спиртом. Органическое соединение, которое образуется при этом, относится к классу эстеров (эти соединения ранее называли сложными эфирами):
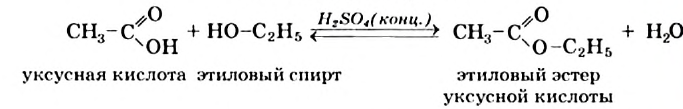 .
.
уксусная кислота этиловый спирт этиловый эстер
Эстеры являются производными карбоновых кислот, в молекулах которых атом Гидрогена карбоксильной группы замещен на углеводородный остаток. Общая формула эстеров —
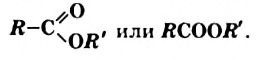
Реакции между спиртами и кислотами называют реакциями эстерификации. Они являются обратимыми (§ 11). Для того, чтобы осуществить прямую реакцию, т. е. получить эстер, нужно удалять это вещество или воду из реакционной смеси (например, перегонкой).
Эстеры с небольшими молекулярными массами — бесцветные жидкости, обычно имеющие приятный запах. Они нерастворимы в воде, но растворяются в органических растворителях.
Эстеры обуславливают запах многих цветов, фруктов, других растений (рис. 88). Немало зстеров являются компонентами духов, различных косметических средств, некоторые содержатся в кондитерских изделиях и напитках.
Рис. 88. Природные источники эстеров
Получение: Уксусную кислоту получают в лаборатории реакцией обмена между ее твердой солью и концентрированной сульфатной кислотой. Взаимодействие соединений осуществляют при нагревании; уксусная кислота выделяется в газообразном состоянии:
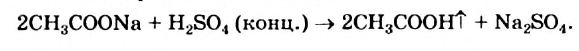
Уксусная кислота образуется при окислении этилового спирта в его водном растворе кислородом воздуха с участием особых бактерий. Реакция происходит, если массовая доля спирта в растворе не превышает 10 %. Процесс называют уксуснокислым брожением. Таким способом (скисанием вина) в древности готовили уксус.
Применение: Уксусная кислота — первая из карбоновых кислот, ставшая известной человеку. Ее широко применяют в химической и пищевой промышленности, домашнем хозяйстве.
Выводы:
- Уксусная кислота
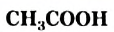 — важнейшая карбоиовая кислота. Это бесцветная жидкость с резким запахом, смешивающаяся с водой в любом соотношении с образованием раствора.
— важнейшая карбоиовая кислота. Это бесцветная жидкость с резким запахом, смешивающаяся с водой в любом соотношении с образованием раствора. - Уксусная кислота является слабой кислотой. Она взаимодействует с металлами с выделением водорода, основнымн и амфотерными оксидами, основаниями, амфотерными гидроксидами, некоторыми солями. Уксусная кислота реагирует со спиртами с образованием эстеров — соединений с общей формулой
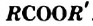 .
. - Уксусную кислоту широко используют в промышленности, домашнем хозяйстве.
Жиры
В природе широко распространены соединения, общее название которых — жиры. Они хорошо известны нам из повседневной жизни (рис. 89).

Рис. 89. Пищевые жиры
Жиры - это эстеры гилцерина и высших карбоновых кислот.
Общая формула жиров —
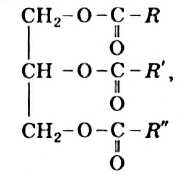
где 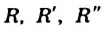 — углеводородные остатки (обычно они разные, но могут быть и одинаковыми).
— углеводородные остатки (обычно они разные, но могут быть и одинаковыми).
Жиры чаще всего образуют насыщенные кислоты — пальмитиновая 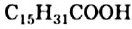 , стеариновая
, стеариновая 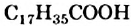 и ненасыщенная олеиновая
и ненасыщенная олеиновая 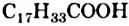 (§ 26). Если в состав молекулы жира входят три остатка стеариновой кислоты, то такой жир имеет название тристеарин, если три остатка олеиновой кислоты — триолеин.
(§ 26). Если в состав молекулы жира входят три остатка стеариновой кислоты, то такой жир имеет название тристеарин, если три остатка олеиновой кислоты — триолеин.
Природные жиры всегда содержат примеси, среди которых — жирные кислоты, витамины, другие биологически важные вещества, вода.
Классификация: В зависимости от происхождения жиры делят на животные и растительные.
Животные жиры (говяжий жир, свиное сало, сливочное масло) содержат преимущественно эстеры глицерина и насыщенных кислот — стеариновой и пальмитиновой. Жиры морских млекопитающих и рыб отличаются высоким содержанием эстеров ненасыщенных кислот, в молекулах которых имеются по меньшей мере четыре двойных связи.
Важнейшими среди растительных жиров являются подсолнечное, оливковое, кукурузное, льняное масло. Они содержат в основном эстеры олеиновой и других ненасыщенных кислот. В кокосовом и пальмовом жирах преобладают производные насыщенных кислот.
Физические свойства: Животные жиры, кроме рыбьего, являются твердыми веществами, а растительные — жидкостями (за исключением кокосового и пальмового).
Запах, цвет и вкус жиров обусловлен, как правило, различными примесями.
Жиры нерастворимы в воде, но хорошо растворяются в бензине, керосине, других органических растворителях. При встряхивании жидких жиров с водой образуются эмульсии (пример такой эмульсии — молоко).
Температуры плавления жиров зависят от того, какими кислотами они образованы. Жиры, молекулы которых содержат остатки насыщенных кислот, имеют более высокие температуры плавления и в обычных условиях являются твердыми. Эстеры ненасыщенных кислот — жидкости.
Это интересно: Жирную посуду моют специальными средствами, которые содержат вещества, отделяющие молекулы жира от поверхности посуды, но не растворяющие его.
Химические свойства: Жиры, как и другие эстеры, в определенных условиях взаимодействуют с водой, а те, которые являются производными ненасыщенных кислот, присоединяют водород, галогены (рис. 90), окисляются калий перманганатом.
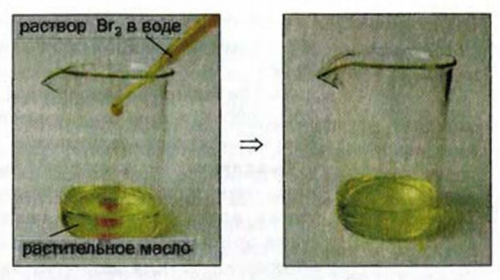
Рис. 90. Взаимодействие растительного масла с бромной водой
Гидролиз (термин происходит от греческих слов hydor — вода и lysis — разложение). Так называют реакцию жира с водой, в результате которой образуются глицерин и соответствующие кислоты. Жир не взаимодействует даже с кипящей водой. Чтобы реакция протекала, необходимо нагреть смесь веществ до температуры 200—250 СС и создать определенное давление либо добавить катализатор (в живых организмах гидролиз жиров происходит с участием ферментов).
Схема реакции гидролиза жира:
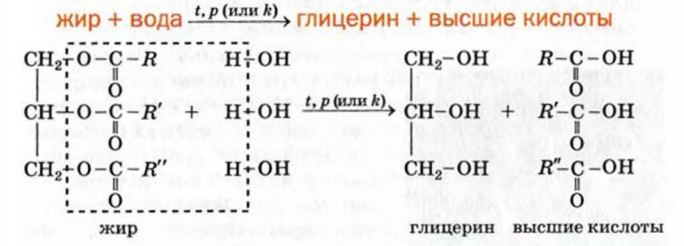
Если гидролиз жиров осуществлять в присутствии щелочи, то, кроме глицерина, образуются смеси солей высших карбоновых кислот — мыла. Этот процесс называют омылением жиров; на нем основано производство мыла.
Гидрирование: Жидкие жиры могут присоединять водород и превращаться в твердые жиры. Для осуществления такой реакции жир нагревают до температуры 160—240 °С и пропускают в него водород в присутствии катализатора:
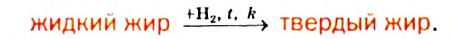
Добавляя к продукту реакции молоко, сливочное масло, витамины А и D, производят заменитель сливочного масла — маргарин.
Рассмотренная реакция важна еще и потому, что из твердых жиров производят качественное мыло.
Термическое разложение: При температуре 250 —300 °С жиры разлагаются с образованием смеси различных соединений.
Окисление: Во влажном воздухе жиры подвергаются гидролизу и окисляются. Продуктами таких превращений являются органические соединения с меньшим числом атомов Карбона в молекулах. Такие вещества чаще всего имеют неприятный запах и горький вкус (вспомните запах и вкус несвежего сливочного масла).
Ненасыщенные жиры окисляются калий перманганатом, другими окислителями.
При горении жиров происходит их полное окисление с образованием углекислого газа и воды, а также выделение значительного количества теплоты:
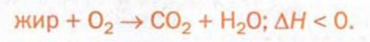
Получение жиров. Впервые синтез жира осуществил французский ученый М. Бертло в 1854 г., нагревая глицерин с высшей карбоновой кислотой в запаянном сосуде. Позже были изобретены другие методы синтеза жиров. Однако все они не получили промышленного применения, поскольку жиры очень распространены в природе и их извлекают из природного сырья (рис. 91).

Рис. 91. В цеху завода по производству растительного масла
Производство растительного масла осуществляют двумя методами. По первому методу высушенные и очищенные от примесей семена подсолнечника, других растений измельчают, нагревают и отжимают под прессом. При этом выделяется масло, которое собирают и очищают. Нагревание необходимо для уменьшения вязкости масла, чтобы оно легче извлекалось из семян под прессом. Кроме того, при повышенной температуре прекращается действие ферментов, которые разлагают жиры и вызывают их прогоркание.
Второй метод заключается в обработке семян нагретым летучим растворителем (гексаном, этанолом), в котором жир растворяется. Затем растворитель удаляют перегонкой.
Основной процесс в производстве твердого жира — вытапливание. Во время этого процесса жир плавится и отделяется от остатков мяса, воды, других веществ. Его очищают и заливают в формы для затвердевания.
Применение: Жиры используют в пищевой промышленности, производстве косметических средств, медицине, технике, для смазки изделий из металла с целью предотвращения коррозии. Переработкой жиров получают глицерин, мыло, олифу, многие другие вещества и материалы. Раньше некоторые жиры использовали как горючие вещества для освещения помещений.
Биологическая роль жиров: Жиры являются одними из важнейших пищевых продуктов. Это — основной источник энергии в организме. При полном окислении 1 г жира в организме выделяется в среднем 39 кДж теплоты, что вдвое превышает энергию, которую «вырабатывает» такая же масса белков или углеводов. Выделение большого количества воды при окислении жира имеет исключительное значение для животных (например, верблюдов), которые вынуждены длительное время жить без воды.
Высокая пищевая ценность жиров обусловлена также растворимостью в них некоторых витаминов (A, D, Е).
Жиры играют важную роль в терморегуляции живых организмов. Они плохо проводят теплоту и поэтому защищают от переохлаждения пингвинов, китов, моржей, тюленей, других животных.
В растениях жир накапливается в семенах для ппитания зародышей.
Выводы:
- Жиры — эстеры глицерина и высших карбоновых кислот.
- Различают животные и растительные жиры. Животные жиры в основном являются твердыми веществами; это — эстеры насыщенных кислот. Растительные жиры — преимущественно жидкости; они происходят от ненасыщенных кислот.
- Жиры не растворяются в воде, но в определенных условиях взаимодействуют с ней, т. е. подвергаются гидролизу. Продуктами таких реакций являются глицерин и высшие карбоновые кислоты. Ненасыщенные жиры реагируют с водородом, галогенами. На воздухе жиры медленно окисляются, а при нагревании разлагаются.
- Жиры имеют высокую энергетическую ценность и являются неотъемлемой составляющей нашего питания. Их используют в пищевой промышленности и других отраслях.
Углеводы. Глюкоза
Углеводы: В каждом растении содержится органическое вещество под названием «целлюлоза». Это вещество, а также крахмал, сахар, глюкоза являются углеводами (термин происходит от слов «углерод» и «вода»). Общая формула соединений этого класса — 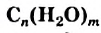 , или
, или 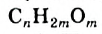 (
(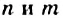 могут иметь значения 3 и больше). При сильном нагревании без доступа воздуха углеводы разлагаются на углерод и воду (рис. 92).
могут иметь значения 3 и больше). При сильном нагревании без доступа воздуха углеводы разлагаются на углерод и воду (рис. 92).
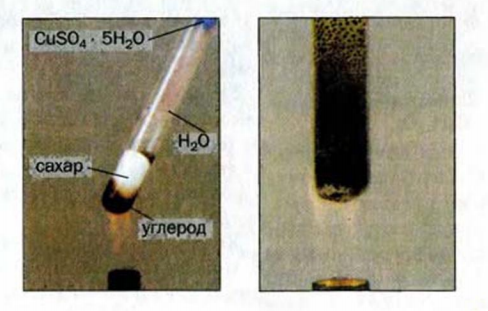
Рис. 92. Термическое разложение углеводов
Одни углеводы состоят из сравнительно небольших молекул, а другие — из молекул, содержащих многие тысячи атомов.
Углеводы — самые распространенные в природе органические соединения; они имеются во всех живых организмах.
В зеленых растениях и некоторых бактериях углеводы образуются в результате фотосинтеза. Это — сложный процесс, при котором происходит образование органических веществ из неорганических (углекислого газа, воды, растворимых солей) при участии солнечной энергии (рис. 93).

Рис. 93. Фотосинтез
Процесс фотосинтеза, осуществляемый растениями, сопровождается выделением кислорода.
Схема фотосинтеза углеводов —
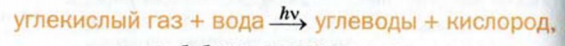
а обобщенное химическое уравнение —
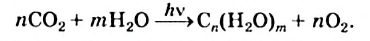
Человек и животные получают углеводы из растений (вместе с пищей, кормами). Эти вещества являются одним из источников энергии для организма, которая выделяется в результате химических реакций с их участием.
Углеводы делят на моносахариды (к ним относятся глюкоза, фруктоза), дисахариды (например, сахароза, или обычный сахар) и полисахариды (крахмал, целлюлоза). Ди- и полисахариды могут в определенных условиях взаимодействовать с водой (подвергаться гидролизу) и превращаться в моносахариды.
Глюкоза: Это — один из важнейших моносахаридов. Соединение иногда называют виноградным сахаром; оно содержится в фруктах (больше всего — в винограде), меде, а в очень малом количестве — в крови человека и животных.
Химическая формула глюкозы — 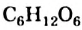 . В молекуле глюкозы имеются различные функциональные группы — пять гидроксильных групп и одна альдегидная
. В молекуле глюкозы имеются различные функциональные группы — пять гидроксильных групп и одна альдегидная 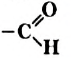 (рис. 94, 95).
(рис. 94, 95).
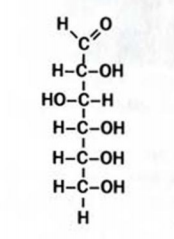
Рис. 94. Структурная формула молекулы глюкозы
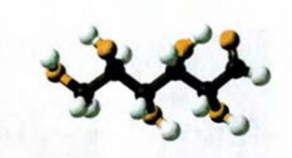
Рис. 95. Шаростержневая модель молекулы глюкозы
Формулу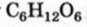 имеет еще один углевод, его название — фруктоза. Молекула этого соединения отличается от молекулы глюкозы своим строением.
имеет еще один углевод, его название — фруктоза. Молекула этого соединения отличается от молекулы глюкозы своим строением.
Физические свойства: Глюкоза — белый порошок или бесцветные кристаллы. Соединение хорошо растворимо в воде, имеет сладкий вкус. Глюкоза менее сладкая, чем сахар.
Химические свойства: Наличие в молекуле глюкозы различных функциональных групп обуславливает способность соединения вступать в реакции, которые являются характерными для каждой группы.
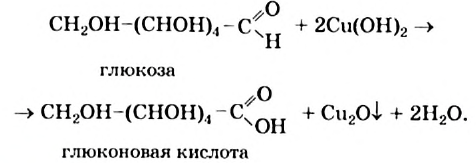
Взаимодействие глюкозы с купрум(II) гидроксидом
В пробирку налейте 1 мл раствора натрий гидроксида и 3—4 капли раствора купрум(II) сульфата. К образовавшемуся осадку купрум(II) гидроксида добавьте 1 мл раствора глюкозы и смесь перемешайте. Осторожно нагрейте содержимое пробирки.
Осуществив опыт, вы убедились в том, что глюкоза взаимодействует с купрум(II) гндроксидом в щелочной среде так же, как и глицерин (трехатомный спирт). Эта реакция подтверждает наличие в молекуле глюкозы нескольких гидроксильных групп.
При добавлении раствора глюкозы к осадку купрум(II) гидроксида и последующем нагревании происходит окисление альдегидной группы 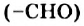 с ее превращением в карбоксильную группу
с ее превращением в карбоксильную группу 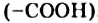 . Продуктом окисления глюкозы является глюконовая кислота, а купрум(II) гидроксид восстанавливается до купрум(I) оксида (в химическом уравнении используем сокращенную структурную формулу молекулы глюкозы):
. Продуктом окисления глюкозы является глюконовая кислота, а купрум(II) гидроксид восстанавливается до купрум(I) оксида (в химическом уравнении используем сокращенную структурную формулу молекулы глюкозы):
Глюкоза вступает в так называемые реакции брожения; они происходят с участием микроорганизмов. Под действием фермента дрожжей глюкоза в водном растворе превращается в этиловый спирт:
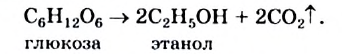
Процесс называют спиртовым брожением. Его издавна используют в виноделии (рис. 96) и пивоварении.

Рис. 96. Брожение виноградного сока
Ферменты молочнокислых бактерий превращают глюкозу в молочную кислоту (это — молочнокислое брожение):
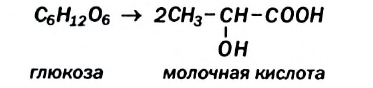
Реакция происходит при квашении овощей, скисании молока.
Получение: В промышленности глюкозу получают, осуществляя в определенных условиях реакции крахмала или сахара с водой.
Применение: Глюкоза является сырьем для кондитерской промышленности (рис. 97, a ). Из нее получают аскорбиновую кислоту (витамин С), кальций глюконат, другие вещества. Глюкозу также используют в медицине как легкоусвояемый и калорийный продукт при истощении или слабости человека (рис. 97, б). Это соединение входит в состав кровезаменяющих жидкостей (рис. 97, в).

Рис. 97. Применение глюкозы: а — печенье с глюкозой; б — сироп с глюкозой; в — раствор глюкозы для инъекций
При окислении глюкозы выделяется необходимая для организма энергия: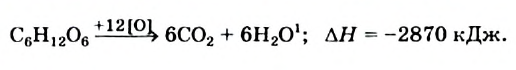
Выводы:
- Углеводы — соединения с общей формулой
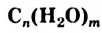 . Они являются одним из основных источников энергии для организма. Эти соединения образуются в зеленых растениях и некоторых бактериях в результате фотосинтеза.
. Они являются одним из основных источников энергии для организма. Эти соединения образуются в зеленых растениях и некоторых бактериях в результате фотосинтеза. - Углеводы делят на моносахариды, дисахариды и полисахариды.
- Глюкоза — важнейший моносахарид. Формула соединения —
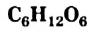 . В молекуле глюкозы имеются различные функциональные группы, которые обуславливают химические свойства соединения.
. В молекуле глюкозы имеются различные функциональные группы, которые обуславливают химические свойства соединения. - Глюкозу применяют в кондитерской промышленности, медицине.
Фруктоза
Фруктоза, или фруктовый сахар, входит в состав многих фруктов и плодов, содержится в меде. Химическая формула фруктозы такая же, что и глюкозы, — 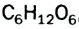 , но в молекуле фруктозы вместо альдегидной группы имеется кетонная группа
, но в молекуле фруктозы вместо альдегидной группы имеется кетонная группа 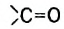 (рис. 98). Глюкоза и фруктоза являются изомерами.
(рис. 98). Глюкоза и фруктоза являются изомерами.
Фруктоза — бесцветное кристаллическое вещество, хорошо растворимое в воде. Соединение в 3 раза слаще глюкозы и в 1,5 раза — обычного сахара (сахарозы).
Фруктозу и ее производные используют в медицине, в питании больных сахарным диабетом.
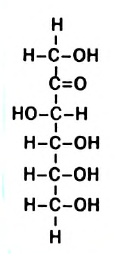
Рис. 98. Структурная формула молекулы фруктозы
Сахароза
Сахароза — соединение, известное каждому; это обычный сахар. Он является важным пищевым продуктом. Больше всего этого вещества содержится в сахарной свекле и сахарном тростнике (рис. 99); массовая доля сахарозы в них может достигать 27 %. Сахароза есть также в листьях и соках деревьев, фруктов, овощей. Она образуется в растениях при фотосинтезе.

Рис. 99. Растения с высоким содержанием сахарозы: а — сахарная свекла; б — сахарный тростник
Формула сахарозы — 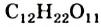 ,. Этот углевод относится к дисахаридам. Его молекула состоит из остатков молекул двух моносахаридов — глюкозы и фруктозы.
,. Этот углевод относится к дисахаридам. Его молекула состоит из остатков молекул двух моносахаридов — глюкозы и фруктозы.
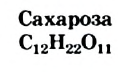
Физические свойства: Сахароза — белое кристаллическое вещество (рис. 100), сладкое на вкус, очень хорошо растворимое в воде (при 20 °С — 203 г вещества в 100 г воды, а при 100 °С — 487 г). Насыщенный раствор сахара имеет высокую вязкость; его часто называют сиропом.

Рис 100. Микрофотография сахарозы
При температуре 184 °С сахароза плавится, а при дальнейшем нагревании начинает разлагаться. Ее расплав приобретает коричневую окраску, и появляется запах подгоревшего сахара. Такое превращение сахара называют карамелизацией (термин происходит от слова «карамель»).
Химические свойства: Сахароза в определенных условиях взаимодействует с водой, а также вступает в реакции, характерные для многоатомных спиртов.
Гидролиз: Под действием ферментов или при нагревании с сильными неорганическими кислотами сахароза подвергается гидролизу. В результате такой реакции из каждой молекулы соединения образуются две молекулы соответствующих моносахаридов:
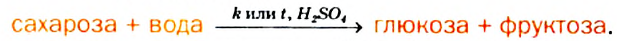
Реакция с купрум(II) гидроксидом: В молекуле сахарозы имеется несколько гидроксильных групп. Поэтому соединение взаимодействует с купрум(II) гидроксидом аналогично глицерину и глюкозе.
ЛАБОРАТОРНЫЙ ОПЫТ № 23 Реакция сахарозы с купрум(II) гидроксидом
В пробирку налейте 1 мл раствора натрий гидроксида и 3—4 капли раствора купрум(II) сульфата. Наблюдайте образование осадка купрум(II) гидроксида. Добавьте в пробирку 1—2 мл водного раствора сахарозы (сахара) и перемешайте смесь. Нагрейте содержимое пробирки, но не до кипения.
При добавлении раствора сахарозы к осадку купрум(II) гидроксида он растворяется; жидкость окрашивается в синий цвет. Но, в отличие от глюкозы, сахароза не восстанавливает купрум(II) гидроксид до купрум(I) оксида.
Дегидратация: При действии на сахарозу концентрированной сульфатной кислоты органическое соединение начинает разлагаться: кислота «отбирает» у молекул сахара молекулы воды. Упрощенная схема превращения:
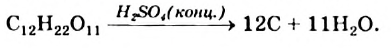
Эту реакцию часто демонстрируют как интересный опыт; его название — «чертов палец». В небольшой химический стакан насыпают (на 1/3—1/4 его объема) растертый сахар-песок и доливают немного воды. Вещества нужно хорошо перемешать стеклянной палочкой. Затем добавляют концентрированную сульфатную кислоту (до половины объема стакана) и быстро перемешивают. Смесь разогревается, темнеет и начинает вспучиваться (рис. 101). Выделяется водяной пар, а сахар превращается в углерод (твердый остаток имеет черный цвет).

Рис. 101. Разложение сахара под действием концентрированной сульфатной кислоты

Рис. 102. Горение сахара
Окисление: Выполнив лабораторный опыт, вы убедились в том, что сахароза не восстанавливает соединение Купрума(II), т. е. не склонна к «мягкому» окислению и превращению в другое органическое соединение.
Полное окисление вещества обычно происходит при его горении. Попробуйте поджечь сахар. Это вам не удастся. Но если на кусочек сахара насыпать немного пепла от сигареты и поднести горящую спичку, сахар загорится (рис. 102). Пепел является катализатором этой реакции.
Получение: Сахарозу производят в большом количестве. На сахарных заводах (рис. 103) свеклу моют, измельчают и промывают горячей водой до полного извлечения сахара из свекловичной стружки. При этом вещества, хорошо растворимые в воде, в том числе и сахароза, переходят в раствор, а те, которые образуют коллоидный раствор (белки, крахмал), остаются в клетках растения. Затем к раствору добавляют суспензию извести. Кальций гидроксид реагирует с органическими кислотами, другими веществами с образованием малорастворимых соединений. Сахароза взаимодействует с известью, превращаясь в растворимый кальций сахарат.

Рис. 103. Цех сахарного завода
Полученный раствор фильтруют и пропускают в него углекислый газ. Кальций сахарат и остаток извести реагируют с углекислым газом с образованием сахарозы и осадка кальций карбоната. Раствор сахарозы фильтруют, дополнительно очищают и выпаривают. Из него кристаллизуется сахар.
Применение: Сахароза — важный пищевой продукт (рис. 104). Сахар используют непосредственно и в составе разнообразных кондитерских изделий. Он является консервантом для фруктов и ягод, поэтому его используют для изготовления варенья, джема и пр. (при этом соотношение масс сахара и плодов должно быть не менее чем 1:1).Сахароза является сырьем для получения спирта, некоторых других органических соединений.

Рис. 104. Сахар
Выводы:
- Сахароза (обычный сахар)
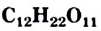 — углевод, известный каждому. Он является важной составляющей нашего питания. Вещество содержится в сахарной свекле, сахарном тростнике.
— углевод, известный каждому. Он является важной составляющей нашего питания. Вещество содержится в сахарной свекле, сахарном тростнике. - Сахароза — белое кристаллическое вещество, имеющее сладкий вкус, хорошо растворимое в воде. В определенных условиях сахароза подвергается гидролизу, превращаясь в глюкозу и фруктозу, взаимодействует с купрум(II) гидроксидом, а при нагревании разлагается.
- Сахар получают из природного сырья в большом количестве. Его используют в качестве пищевого продукта, добавляют в кондитерские изделия. Из сахара производят часть этилового спирта.
Крахмал. Целлюлоза
Крахмал и целлюлоза являются полисахаридами. Эти углеводы, как глюкоза и сахароза, содержатся в растениях. Крахмал и целлюлоза — природные полимеры. Их молекулы состоят из сотен и тысяч групп атомов 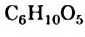 — остатков молекулы глюкозы:
— остатков молекулы глюкозы: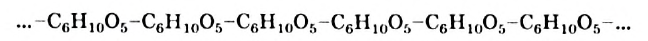
Крахмал и целлюлоза имеют одинаковую общую формулу 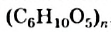 , но значения
, но значения 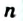 для них разные; молекулы целлюлозы намного длиннее, чем крахмала.
для них разные; молекулы целлюлозы намного длиннее, чем крахмала.
Крахмал: Это вещество, как и сахар, очень важно для человека, поскольку оно входит в состав многих пищевых продуктов.
Крахмал — своеобразный аккумулятор энергии в растениях, необходимый прежде всего для развития их зародышей. Он образуется в листьях и стеблях в результате фотосинтеза и взаимопревращения углеводов:
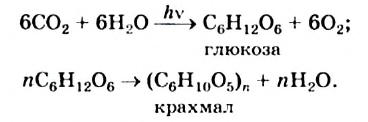
Крахмал накапливается в семенах, клубнях, плодах, корнях растений (рис. 105).

Рис. 105. Содержание крахмала (по массе) в растениях
Физические свойства: Крахмал — белое зернистое вещество, не имеющее запаха и вкуса, не растворяется в холодной воде, а в теплой образует коллоидный раствор. Вязкий раствор крахмала используют в качестве клея (его название — крахмальный клейстер).
Картофельный крахмал внешне похож на пшеничную муку. Его можно отличить от муки по такому эффекту: при растирании крахмала пальцами ощущается поскрипывание вследствие взаимного трения его зерен.
Крахмал, полученный из картофеля, называют картофельной мукой.
При нагревании крахмал не плавится, а разлагается.
Строение: Крахмал — не чистое вещество, а смесь двух полимерных углеводов — амилозы и амилопектина. Эти соединения имеют такую же формулу, что и крахмал, — 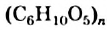 . Амилоза состоит из неразветвленных молекул, а молекулы амилопектина имеют разветвления.
. Амилоза состоит из неразветвленных молекул, а молекулы амилопектина имеют разветвления.
Амилозы в картофельном крахмале в несколько раз меньше, чем амилопектина. Амилоза находится внутри каждого зерна крахмала, амилопектин — в оболочках зерен. При добавлении к крахмалу теплой воды оболочка разрушается, амилоза переходит в раствор, а амнлопектин лишь набухает.
Химические свойства: Под действием ферментов или при нагревании с разбавленными неорганическими кислотами крахмал подвергается гидролизу.
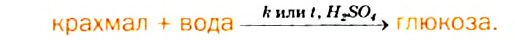
Упрощенное химическое уравнение этого процесса:
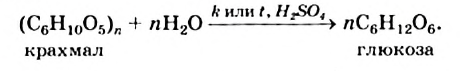
Гидролиз крахмала происходит ступенчато: 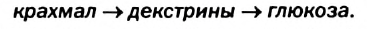
Декстрины — соединения, имеющие такую же формулу, что и крахмал, но меньшую молекулярную массу. Они хорошо растворяются в воде и поэтому легче усваиваются организмом. Декстрины образуются при жарке картофеля, выпекании хлеба.
Смесь продуктов гидролиза крахмала называют патокой. Ее используют в кондитерской промышленности.
Взаимодействие с иодом: Раствор иода дает с крахмалом характерное синее окрашивание (рис. 106), которое при нагревании до 100 °С исчезает, а при охлаждении появляется снова. Так можно отличить крахмал от других органических веществ.

Рис. 106. Обнаружение крахмала: а — в растворе; б — в хлебе; в — в картофеле
Взаимодействие крахмала с иодом
К раствору крахмала, приготовленному в предыдущем опыте, добавьте каплю йодной настойки и зафиксируйте появление характерной окраски.
Нагрейте жидкость до кипения. Охладите содержимое пробирки.
Крахмал отличается от глюкозы и сахарозы тем, что в его растворе не растворяется осадок купрум(II) гидроксида. Как и сахароза, крахмал не восстанавливает соединение Купрума(II). В этом — одно из его отличий от глюкозы.
Получение: Крахмал получают в промышленности преимущественно из картофеля и кукурузы. Сырье измельчают, обрабатывают холодной водой, которая извлекает зерна крахмала. Их отделяют отстаиванием или центрифугированием.
Применение: Крахмал — важный пищевой продукт. Он является сырьем для получения глюкозы, этилового спирта, ацетона, глицерина, лимонной кислоты. Его также используют при изготовлении бумаги, текстиля, некоторых пластмасс, клеев, витаминов, в домашнем хозяйстве. Крахмал добавляют в некоторые пищевые продукты, в частности, в колбасные изделия.
Целлюлоза: Это наиболее распространенный углевод в растительном мире. Целлюлоза выполняет роль «строительного» материала в растениях; она образует оболочки растительных клеток. Этим объясняется другое название вещества — клетчатка.
Целлюлоза содержится в хлопке, льне (рис. 107), камыше, других растениях, в том числе фруктах и овощах. Целлюлоза есть и в муке, мучных изделиях, крупах.

Рис. 107. Содержание целлюлозы (по массе) в растениях
Молекулы целлюлозы имеют неразветвленное строение.
Свойства: Чистая целлюлоза — твердое волокнистое вещество белого цвета, нерастворимое в воде и органических растворителях. Целлюлоза, в отличие от крахмала, не изменяет окраску раствора иода.
Гидролиз: Целлюлоза взаимодействует с водой в таких же условиях, что и крахмал, — при нагревании и наличии сильной кислоты. Этот процесс имеет ступенчатый характер; конечным продуктом является глюкоза. Упрощенное химическое уравнение гидролиза целлюлозы:
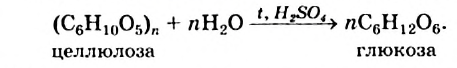
В природных условиях целлюлоза постепенно разлагается. Этот процесс происходит с участием микроорганизмов. Конечные продукты превращения целлюлозы — углекислый газ и вода, а в отсутствие воздуха (например, на дне водоемов) вместо углекислого газа образуется метан.
Получение: Целлюлозу производят из древесины, некоторых растений. Сырье измельчают, обрабатывают при нагревании и небольшом давлении растворами различных реагентов для извлечения примесей. Остаток, который является чистой целлюлозой, высушивают.
Применение: Бумага, картон, разнообразные ткани, волокна, лаки, эмали, некоторые пластмассы, целлофан — все это изготавливают из целлюлозы и ее производных. Целлюлозу используют в производстве бездымного пороха, ацетатного шелка.
Волокна из целлюлозы имеют много ценных качеств. Они прочны, гигроскопичны, легко подвергаются крашению. Вместе с тем эти волокна недостаточно эластичны, плохо сохраняют форму, горят, разрушаются микроорганизмами. Указанные недостатки устраняют, обрабатывая ткани различными веществами.
Это интересно: Целлюлоза, пропитанная кислотой и высушенная, рассыпается в порошок.
- Бумага — один из важнейших материалов на основе целлюлозы. Без нее невозможно представить нашу жизнь. Бумагу изобрели в Китае во II в. до н. э. Ее изготавливали сначала из хлопка, бамбука, а в средние века — также из ветоши. В XVIII ст. для этого начали использовать древесину.
- Ныне промышленность выпускает много видов бумаги — газетную, для печати и письма, упаковочную и т. п. Фильтровальная бумага — почти чистая целлюлоза.
- Крахмал и целлюлоза — полисахариды. Эти углеводы являются природными полимерами. Они имеют одинаковую химическую формулу
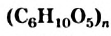 , но с разными значениями
, но с разными значениями 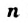 (у целлюлозы они больше).
(у целлюлозы они больше). - Крахмал является смесью двух соединений — амилозы и амилопектина. Он накапливается в картофеле, семенах злаков, других растениях. С водой крахмал образует коллоидный раствор, а в определенных условиях подвергается гидролизу. Крахмал используют в пищевой промышленности, а также как сырье для производства спирта, глюкозы.
- Целлюлоза — главная составляющая растений. Это белое волокнистое вещество, нерастворимое в воде. В присутствии кислоты целлюлоза подвергается гидролизу. Целлюлозу используют в производстве бумаги, картона, волокнистых материалов, натуральных тканей.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |