
Комплексные соединения в химии - формулы и определение с примерами
Содержание:
Комплексные соединения:
Наиболее обширный и разнообразный класс неорганических веществ представляют комплексные соединения. В переводе с латинского complexus означает «сочетание». И действительно, большинство комплексных соединений образуется в результате соединения (сочетания) более простых веществ:
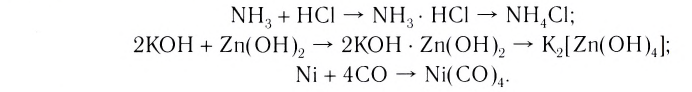
Комплексные соединения, которые образуются в результате таких реакций, обладают свойствами, отличающимися от свойств исходных веществ. Например, аммиак и хлороводород — газы, a 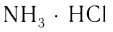
Комплексные соединения имеют большое значение в различных областях науки и техники. Их используют в качестве катализаторов, в производстве синтетических моющих средств и лаков, для получения металлов высокой степени чистоты и разделения смеси металлов, в аналитической химии и медицине, пищевой и фармацевтической промышленности. Особое место занимают комплексные соединения в живой природе. Именно эти соединения образуют активные центры ферментов, многих витаминов, осуществляют перенос кислорода в биологических системах, являются основными участниками большинства ферментативных и фотохимических процессов. Достаточно упомянуть только два таких природных объекта, содержащих комплексные соединения, как хлорофилл и гемоглобин.
У таких соединений есть и второе название — координационные соединения. Это название связано с особенностями их строения, взаимного расположения (координации) всех частиц, входящих в их состав.
Строение и свойства комплексных соединений объясняются координационной теорией, основы которой были заложены швейцарским химиком A. Be line ром в 1893 г. Согласно Вернеру комплексным соединением называется вещество, в узлах кристаллической решетки которого находятся сложные частицы, построенные за счет координации одним атомом (ионом) элекрезультате соединения (сочетания) более простых веществ:
- NH, + HCI — NH3 • HCI — NH4CI;
- 2КОН + Zn(OH)2 - 2KOH • Zn(OH), — K2[Zn(OH)4);
- Ni + 4CO - Ni(CO)4.
Комплексные соединения, которые образуются в результате таких реакций, обладают свойствами, отличающимися от свойств исходных веществ. Например, аммиак и хлороводород — газы, a NH3 ■ HCI — твердая соль, Ni — металл, СО — газ, а продукт их взаимодействия — бесцветная, легко испаряющаяся жидкость.
Комплексные соединения имеют большое значение в различных областях науки и техники. Их используют в качестве катализаторов, в производстве синтетических моющих средств и лаков, для получения металлов высокой степени чистоты и разделения смеси металлов, в аналитической химии и медицине, пищевой и фармацевтической промышленности. Особое место занимают комплексные соединения в живой природе. Именно эти соединения образуют активные центры ферментов, многих витаминов, осуществляют перенос кислорода в биологических системах, являются основными участниками большинства ферментативных и фотохимических процессов. Достаточно упомянуть только два таких природных объекта, содержащих комплексные соединения, как хлорофилл и гемоглобин.
У таких соединений есть и второе название — координационные соединения. Это название связано с особенностями их строения, взаимного расположения (координации) всех частиц, входящих в их состав.
Строение и свойства комплексных соединений объясняются координационной теорией, основы которой были заложены швейцарским химиком A. Be line ром в 1893 г. Согласно Вернеру комплексным соединением называется вещество, в узлах кристаллической решетки которого находятся сложные частицы, построенные за счет координации одним атомом (ионом) электронейтральных молекул или противоположно заряженных ионов и способные к самостоятельному существованию в растворах.
Альфред Вернер
(1866—1919)

Швейцарский химик-неорганик. Один из создателей координационной теории комплексных соединений. Лауреат Нобелевской премии (1913).
Основные представления о строении комплексных соединений
Проведем следующий эксперимент: каплю концентрированного раствора аммиака прильем к раствору сульфата меди(II) CuS04. Образуется голубой осадок гидроксида меди(II) Си(ОН)2, Продолжим добавлять раствор аммиака — осадок растворяется, а раствор приобретает ярко-синий цвет. Если затем добавить к полученному раствору раствор гидроксида натрия — осадок гидроксида меди(II) не образуется:
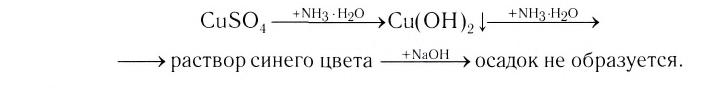
Значит, ионов Си2+ в растворе практически нет. В то же время, ионы S04 легко обнаруживаются в растворе при добавлении BaCl2. Следовательно, при приливании избытка аммиака к осадку гидроксида меди(II) образовалось новое соединение.
Как показывает химический анализ, из раствора можно выделить кристаллы 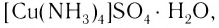 в состав которых входят сложные, или, как их принято называть, комплексные, ионы меди
в состав которых входят сложные, или, как их принято называть, комплексные, ионы меди  Таким образом, мы можем сказать, что при приливании избытка аммиака к раствору сульфата меди(II) произошла следующая реакция:
Таким образом, мы можем сказать, что при приливании избытка аммиака к раствору сульфата меди(II) произошла следующая реакция:
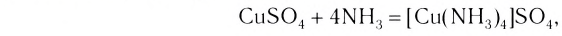
или в сокращенном ионном виде:
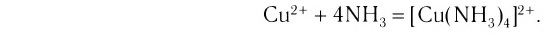
Рассмотрим структуру комплексных соединений. В составе комплексного иона выделяют центральный атом (или ион) — комплексообразователь. В нашем примере — это ион меди(II). В качестве комплексообразователей могут в принципе выступать любые атомы или ионы, но наиболее характерна способность к комплексообразованию для катионов переходных металлов (d-элементов).
Вокруг комплексообразователя группируются (координируются) другие атомы, ионы (чаще анионы) или нейтральные молекулы, которые называются лигандами. Например, лигандами могут выступать нейтральные молекулы: воды Н20, аммиака NH3, оксида углерода(II) СО, этилендиамина  ионы
ионы 
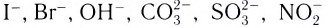 и т. д. Так, в комплексном ионе
и т. д. Так, в комплексном ионе 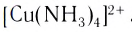 лигандами являются нейтральные молекулы аммиака.
лигандами являются нейтральные молекулы аммиака.
Слово «лиганд» образовано от латинского «ligo» — «связываю». Впервые этот термин в химическую литературу был введен немецким химиком А. Штоком в начале XX в. Однако в современном его значении слово «лиганд» ввел в научную литературу датский ученый Н. Бьеррум.
Число, показывающее, сколько лигандов (ионов или молекул) присоединено к данному комплексообразователю, называется его координационным числом. Так, в комплексном ионе 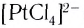 координационное число платины равно 4, а в комплексном ионе
координационное число платины равно 4, а в комплексном ионе 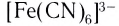 координационное число железа 6. Координационное число зависит от заряда (степени окисления) и размера комплексообразователя, природы и размеров лигандов, а также от условий образования комплексов (концентрация исходных компонентов, температура и т. д.). Координационные числа могут иметь значения от 1 до 12 и даже 14, но чаще встречающиеся — 2, 4, 6. Например, для Ag(I) координационное число равно 2, для Cu(II), Zn(II) — 4, Pt(IV), Fe(III) — 6 и т. д.
координационное число железа 6. Координационное число зависит от заряда (степени окисления) и размера комплексообразователя, природы и размеров лигандов, а также от условий образования комплексов (концентрация исходных компонентов, температура и т. д.). Координационные числа могут иметь значения от 1 до 12 и даже 14, но чаще встречающиеся — 2, 4, 6. Например, для Ag(I) координационное число равно 2, для Cu(II), Zn(II) — 4, Pt(IV), Fe(III) — 6 и т. д.
Лиганды могут образовывать химические связи с комплексообразователей посредством одного или нескольких атомов, входящих в их состав. В зависимости от количества таких атомов лиганды подразделяют на монодентатные и полидентатные (от лат. dentatus — «имеющий зубы»). Пример монодентатного лиганда — аммиак NH3, молекулы которого присоединяются к комплексообразователю посредством атома азота, имеющего одну неподеленную пару электронов:
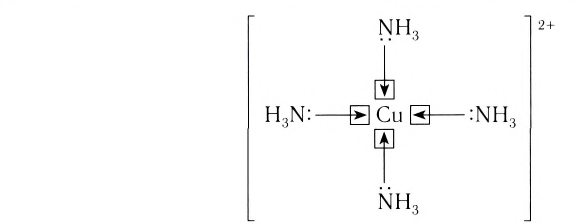
Бидентатными лигандами являются карбонат-ионы 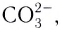 сульфат-ионы
сульфат-ионы 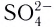 и др. Известны лиганды с большей дентатностью. Координационное число в случае полидентатных лигандов определяется по количеству химических связей между лигандами и комплексообразователем, а не по числу лигандов.
и др. Известны лиганды с большей дентатностью. Координационное число в случае полидентатных лигандов определяется по количеству химических связей между лигандами и комплексообразователем, а не по числу лигандов.
Центральный атом и лиганды образуют внутреннюю сферу — комплексный ион, или комплекс, который способен к самостоятельному существованию в растворе. При написании формул комплексных соединений внутреннюю сферу обычно заключают в квадратные скобки:
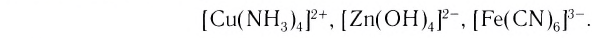
Такие формулы называются координационными.
Заряд комплексного иона определяется алгебраической суммой заряда комплексообразователя и зарядов всех лигандов. Например, в ионе 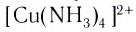 заряд комплексообразователя — иона меди(II) — равен 2+ , лигандами выступают нейтральные молекулы аммиака — их заряд равен 0, значит, заряд комплексного иона:
заряд комплексообразователя — иона меди(II) — равен 2+ , лигандами выступают нейтральные молекулы аммиака — их заряд равен 0, значит, заряд комплексного иона: 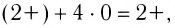 заряд комплексного иона
заряд комплексного иона 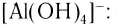
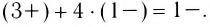
Ионы, окружающие комплексный ион, составляют внешнюю сферу:
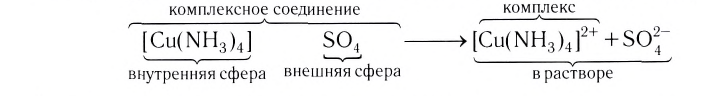
Поскольку комплексные соединения в целом электронейтральны, то частицы внешней сферы нейтрализуют заряд внутренней сферы. При диссоциации комплексного соединения в водных растворах образуются комплексные ионы и ионы внешней сферы. Комплексные соединения могут быть кислотами (например, 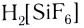 ), основаниями (например,
), основаниями (например, 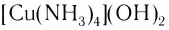 ), солями (например,
), солями (например, 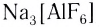 ). Ряд таких соединений используют в качестве реагентов для распознавания различных ионов. Например, так называемые кровяные соли (желтая —
). Ряд таких соединений используют в качестве реагентов для распознавания различных ионов. Например, так называемые кровяные соли (желтая — 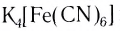 и красная —
и красная — 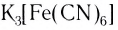 ) служат реагентами на катионы Fe3+ и Fe2+ соответственно:
) служат реагентами на катионы Fe3+ и Fe2+ соответственно:
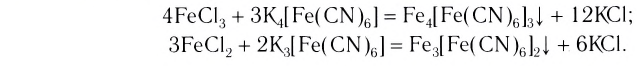
При взаимодействии хлорида железа (III) с раствором желтой кровяной соли 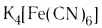 образуется темно-синий осадок берлинской лазури
образуется темно-синий осадок берлинской лазури 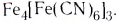 Это соединение было получено в 1704 г. немецким мастером Дисбахом, готовившим краски дня художников. Берлинскую лазурь применяли для окраски тканей, бумаги, в иконописи и при создании фресок.
Это соединение было получено в 1704 г. немецким мастером Дисбахом, готовившим краски дня художников. Берлинскую лазурь применяли для окраски тканей, бумаги, в иконописи и при создании фресок.
- Соединения, имеющие в своем составе комплексные ионы, называются комплексными соединениями.
- В составе комплекса выделяют центральный атом (или ион) — комплексообразователь, к которому присоединено определенное число лигандов — нейтральных молекул или ионов.
- Число лигандов, соединенных с центральным атомом, называют его координационным числом.
Классификация, номенклатура и устойчивость комплексных соединений
Комплексные соединения весьма разнообразны по составу, строению и свойствам. Существует несколько способов классификации комплексных соединений, основанных на различных принципах.
Классификация комплексных соединений
Наиболее распространенной является классификация по природе лигандов. В зависимости от природы лигандов различают:
- аквакомплексы (лиганды — молекулы Н20):
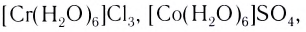
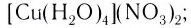
- аммиакаты (лиганды — молекулы NH3):
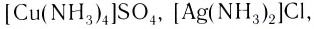
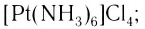
- гидроксокомплексы (лиганды — ионы ОН ):
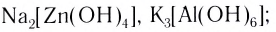
- ацидокомплексы (лиганды — анионы различных кислот):
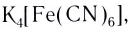
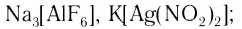
- комплексные соединения смешанного типа:
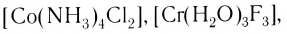
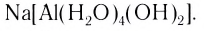
Выделяют также циклические, или хелатные (клешневидные), комплексные соединения, содержащие би- и полидеитатные лиганды, связанные с центральным атомом связями, образованными по разным механизмам:
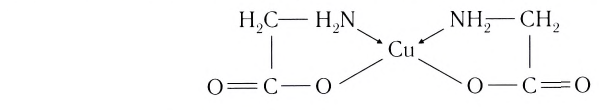
Лиганд, подобно клешням рака, как бы захватывает центральный атом.
На этих и последующих схемах ковалентные связи, образованные за счет неспаренных электронов, обозначены черточками, а образованные по донорно-акцепторному механизму — стрелками.
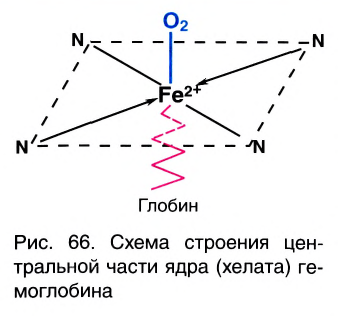
К хелатным соединениям относятся и важнейшие природные комплексы — гемоглобин и хлорофилл. Они имеют примерно одинаковую структуру ядра (порфириновое кольцо). Разница заключается только в том, что у хлорофилла 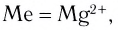 а у гемоглобина — Fe2+. Координационное число данных ионов равно 6, поэтому по вакантным местам присоединяются еще две молекулы других веществ. Например, в гемоглобине по одну сторону хелата (центральной части ядра) присоединяется молекула белка глобина, а по другую — молекула кислорода, благодаря чему это соединение является переносчиком кислорода в крови (рис. 66).
а у гемоглобина — Fe2+. Координационное число данных ионов равно 6, поэтому по вакантным местам присоединяются еще две молекулы других веществ. Например, в гемоглобине по одну сторону хелата (центральной части ядра) присоединяется молекула белка глобина, а по другую — молекула кислорода, благодаря чему это соединение является переносчиком кислорода в крови (рис. 66).
По знаку электрического заряда внутренней сферы различают комплексы:
- катионные (например,
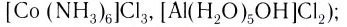
- анионные (например,
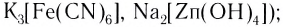
- нейтральные (например,
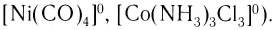
Нейтральные комплексы не имеют внешней сферы и являются неэлектролитами.
Существуют также координационные соединения, состоящие из комплексных катионов и комплексных анионов, например 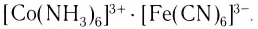 Комплексные соединения классифицируют также по координационному числу, по степени окисления комплексообразователя, по строению и др.
Комплексные соединения классифицируют также по координационному числу, по степени окисления комплексообразователя, по строению и др.
Номенклатура комплексных соединений
Знакомясь с новым классом химических соединений — комплексными соединениями, рассмотрим более подробно основные принципы их номенклатуры.
При написании формулы внутренней сферы комплексного соединения вначале записывают центральный атом (Me), а затем лиганды (L) с указанием их числа n. При этом лиганды, в зависимости от их заряда, располагаются в следующем порядке. Сначала записываются электронейтральные лиганды, а затем — лиганды с отрицательным зарядом:

Название комплексного соединения состоит из названия комплексного иона и названия противоиона. При этом сначала указывается анион в именительном падеже, а затем катион в родительном, независимо от того, какой из этих ионов комплексный (Согласно номенклатурным правилам ИЮПАК порядок названия комплексного соединения обратный. При этом и катион, и анион называют в именительном падеже).
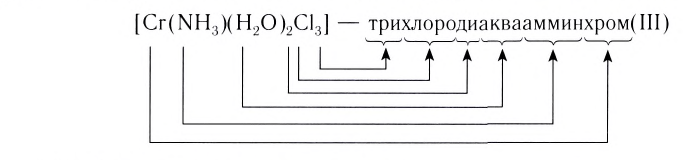
Название комплексного иона строится по схеме 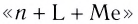 (справа налево по формуле). При этом сначала называют греческое числительное, указывающее число лигандов, слитно с названием лиганда: 1 — моно (обычно опускается), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса и т. д.
(справа налево по формуле). При этом сначала называют греческое числительное, указывающее число лигандов, слитно с названием лиганда: 1 — моно (обычно опускается), 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса и т. д.
Затем называют лиганд. Названия анионных лигандов состоят из полного названия или корня названия соответствующего аниона и соединительной гласной -о-:
Нейтральные лиганды называют так же, как молекулы, например  — бензол. Для некоторых нейтральных лигандов по традиции применяют специальные названия:
— бензол. Для некоторых нейтральных лигандов по традиции применяют специальные названия:

И, наконец, называют центральный атом или ион, указывая римской цифрой в круглых скобках степень окисления центрального атома. Если это комплексный катион, то название центрального атома не меняется:
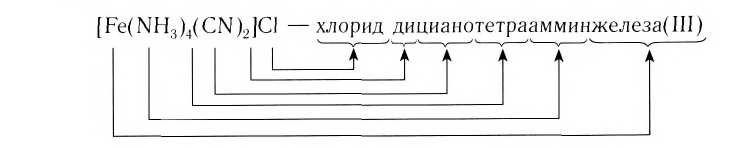
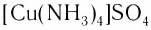 — сульфат тетраамминмеди(II);
— сульфат тетраамминмеди(II);
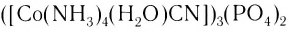 — фосфат цианоакватетраамминкобальта(III).
— фосфат цианоакватетраамминкобальта(III).
В названии комплексного аниона к корню латинского названия комплексообразователя добавляют суффикс -aт:
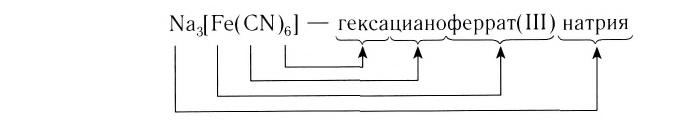
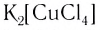 — тетрахлорокупрат(II) калия;
— тетрахлорокупрат(II) калия;
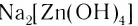 — тетрагидроксоцинкат(II) натрия.
— тетрагидроксоцинкат(II) натрия.
В названии нейтрального комплекса перечисляются все лиганды, а затем указывается русское название комплексообразователя в именительном падеже:
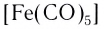 — пентакарбонилжелезо;
— пентакарбонилжелезо;
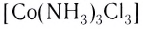 — трихлоротриамминкобальт(III).
— трихлоротриамминкобальт(III).
Устойчивость комплексных соединений
Большинство комплексных соединений при обычных условиях представляют собой твердые вещества, как правило, хорошо растворимые в воде. Ионная связь между внешней и внутренней сферами комплексного соединения при растворении вещества в воде легко разрушается. Происходит первичная диссоциация, которая протекает по типу диссоциации сильных электролитов:
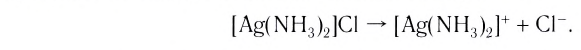
Диссоциация внутренней сферы комплекса, называемая вторичной, протекает по типу диссоциации слабых электролитов и характеризуется наличием равновесия между комплексом, центральным ионом и лигандами:
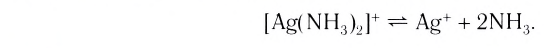
- При написании формулы внутренней сферы комплексного соединения вначале записывают центральный атом (Me), а затем лиганды (L) с указанием их числа n.
- Название комплексного соединения состоит из названия комплексного иона и названия противоиона. Название комплексного иона строится по схеме
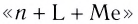 (справа налево по формуле).
(справа налево по формуле). - Различают первичную и вторичную диссоциацию комплексного соединения. Вторичная диссоциация характеризуется наличием равновесия между комплексом, центральным ионом и лигандами.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |