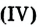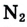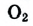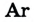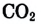Основные законы и понятия химии - формулы, определения с примерами
Содержание:
Химия — это наука о веществах, их строении, свойствах и взаимопревращениях.
Химия — это точная наука, которая, основываясь на том, что все существующее в природе состоит из химических веществ различного вида, изучает их свойства и закономерности превращения из одного вида в другой.
Земля, вода, воздух, небесные тела, все живые и неживые существа, предметы быта, используемые в повседневной жизни, продовольственные товары, лекарственные средства, все приборы и аппараты, применяемые в сельском хозяйстве, промышленности и других отраслях народного хозяйства, — словом, все сущее вокруг нас состоит из веществ. Вещества же — это соединения, образованные в результате связывания между собой в том или ином виде 118 известных на настоящий момент химических элементов. Поэтому химия, определяя свойства веществ, образующихся в результате химических изменений в природе, и устанавливая пути их использования, непосредственно участвует в решении ряда важных для человечества проблем. Не существующие в природе, полученные синтетическим способом полиэтилен, пластмассы, лекарственные вещества (средства), такие волокна, как капрон, нейлон, многие запасные части автомобилей и других технических средств, являются синтетическими химическими веществами.
Природные и синтетические химические вещества широко используются в изготовлении с помощью химических способов искусственных органов для организма человека, лекарств, продовольственных продуктов, одежды, различных предметов, необходимых для жизни, строительных материалов и др.
Поэтому изучение химических и физических свойств веществ считается одной из основных задач химии.
В связи с тем, что нашу жизнь нельзя представить без химии, для понимания сущности происходящих вокруг нас изменений необходимо знать свойства химических веществ и закономерности их превращений.
Для того чтобы в будущем вы стали хорошими специалистами в какой-либо области, вы обязательно должны овладеть элементарными знаниями, умениями и навыками в области химии, поскольку экономист, фермер, рабочий, ученый, врач, правовед, строитель, инженер — словом, представители всех профессий в своей деятельности будут непосредственно связаны с веществами и различной продукцией, изготовляемой из них, а также с химическими процессами.
Человечество издавна использовало для своих потребностей химические вещества и их превращения. В Китае, Египте, Центральной Азии широко пользовались химическими веществами и явлениями в борьбе с вредителями сельского хозяйства, при производстве различных красок, создании архитектурных памятников, изготовлении одежды.
Развитие наук в Европе в средние века отразилось и на химии. В XVII в. немецкий ученый Е. Штапь изложил теорию флогистона, а в XVIII в. русский ученый М. Ломоносов, высказав мысль об элементах и корпускулах, развил представление об атомно-молекулярном учении. Французский ученый А. Лавуазье создал теории о процессах горения и окисления. Английский ученый Дж. Дальтон, основываясь на своих опытах, изложил основы атомистической теории, а в 1869 г. русский ученый Д. Менделеев успешно классифицировал все известные к тому времени химические элементы, создав знаменитую Периодическую систему. А. Бутлеров изложил основы теории строения органических веществ.
К концу XX в. химия стала развиваться еще более интенсивно.
Кроме того, благодаря рациональному использованию месторождений полезных ископаемых началось производство десятков ценных для промышленности химических товаров. Результативным достижением химической науки является изготовление синтетической химической продукции.
Вещество и его свойства
Химия, биология, физика — эго науки, изучающие природу, а природа — эго воздух, земля, вода, Солнце, Луна, растения, животные, люди.
Земля, Солнце, дом, автомобиль, ложка, книга — это тела. Химический стакан, колба, пробирка также относятся к телам. Эти емкости состоят из стекла. Ложка может быть изготовлена из алюминия, серебра. Алюминий, серебро, стекло, вода, сера, мел, сахар, кислород, азот, железо — это вещества.
Тела состоят из веществ.
В природе встречается очень много веществ, и их наличие не зависит от человека.
Хотя мы и не видим воду в воздухе, она имеется в реках и морях. Мы не видим кислород и не думаем о нем, но он присутствует в составе воздуха, мы им дышим.

Рис. I. Вещества йод, бром и хлор
Свойства веществ. Нам известны такие вещества, как сахар, мел, соль, сера, вода, спирт, серная кислота (то, что используется в повседневной жизни). Сахар, соль, мел, сера — это твердые вещества; вода, спирт, серная кислота — жидкости.
Как можно отличить друг от друга перечисленные выше твердые вещества?
Сахар, соль, мел — белого цвета, сера — желтая, значит, эти вещества обладают различным цветом. Если одноцветные вещества сахар, соль, мел поместить в воду, то мел не растворится, а сахар и соль растворятся. Соль и сахар отличаются друг от друга по вкусу.
Все перечисленные здесь жидкие вещества не имеют цвета. Как их можно различить? Спирт обладает резким запахом, вода и серная кислота не пахнут. Но плотность их различна: воды — 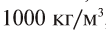
Эти жидкости обладают также различной температурой кипения:
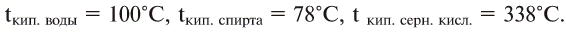
Признаки, по которым одни вещества отличаются от других, называются свойствами веществ.
Цвет, запах, плотность, вкус, агрегатное состояние (твердое, жидкое, газообразное) — это свойства вещества.
Вещества и их свойства не зависят от человека, они воздействуют на наши органы чувств, и мы видим их цвет, чувствуем их вкус и запах, различая их таким образом (рис. 1, 2)

Рис. 2. Различные минеральные вещества, встречающиеся в природе
Атомно-молекулярное учение
Первоначально древнегреческие философы выдвинули идею о том, что мир вокруг нас состоит из очень мелких неделимых частиц — атомов (от греческого atomos — неделимый), но они не имели возможности доказать это опытным путем.
В средние века подобные взгляды постепенно развивались и в странах Европы, а благодаря работам Ломоносова, Дальтона, Авогадро и других ученых были выдвинуты идеи об атомно-молекулярном строении вещества. Эти идеи, основываясь на реальном существовании атомов и молекул, были закреплены принятием конкретных пояснений к этим понятиям на Международном конгрессе химиков в Карлсруэ в 1860 г. Атомно-молекулярное учение было признано всеми учеными, и с его точки зрения стали рассматривать все химические превращения.

Рис.8 Фотоснимок атомов кремния, полученный с помощью электронного микрокопа.
В настоящее время основные положения атомно-молекулярного учения формулируются так:
- Вещества состоят из молекул — мельчайших частиц, сохраняющих все их химические свойства.
- Молекулы состоят из атомов.
- Атомы имеют сложное строение и состоят из электронов, протонов, нейтронов и других микрочастиц.
- Молекулы и атомы находятся в непрерывном движении.
Атомно-молекулярное учение — одна из основных теорий естественных наук, подтверждающая материальное единство мира.
Молекулы не изменяются при физических, но подвергаются изменениям при химических явлениях.
В настоящее время имеется возможность определения порядка связи атомов в молекуле, вычисления массы и размеров отдельной молекулы. Фотоснимки некоторых атомов и молекул получают при помощи электронного микроскопа (рис. 8).
Из курса физики известно, что при изменении температуры изменяется объем тела. Причиной этого является то, что вещества состоят из очень мелких частиц — атомов или молекул, и с повышением температуры расстояние между ними в определенной степени увеличивается, а при охлаждении — уменьшается.
Атомы и молекулы невозможно увидеть, но то, что они действительно существуют, можно увидеть и снять с помощью электронного микроскопа.
На рис. 9 изображен переход вещества (йода) сначала (при нагреве) из твердого состояния в газообразное (пар), а затем (при охлаждении с помощью льда) — из газообразного снова в твердое.
Между молекулами существуют силы притяжения и отталкивания. Молекула обладает массой, размером, химическими свойствами. Молекулы одного вещества отличаются от молекул другого вещества своим составом, массой, размерами и свойствами.
К примеру, состав и строение молекул йода и воды различаются так:

Рис. 9. Переход вещества (йода) из одного состояния в другое
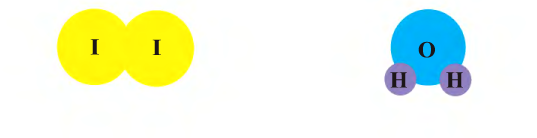
Молекулы находятся в постоянном движении.
Из курса ботаники известно, что английский ученый Броун в 1827 г. под микроскопом наблюдал беспрерывное движение твердых частиц в жидкости. Такое движение носит название броуновского.
Молекулы одного вещества распределяются между молекулами другого вещества, и эго явление называется диффузией.
Броуновское движение, диффузия (например, распространение запаха в воздухе), растворение сахара в воде и подобные этим явления доказывают существование молекул и их беспрерывное движение.
Молекула — это маленькая частица, проявляющая химические свойства вещества.
Молекула представляет собой частицу, состоящую из связанных между собой атомов.
Молекулы состоят из атомов. При разложении воды путем пропускания электрического тока (в специальном приборе) было установлено, что объем газа, образовавшегося в одной трубке, в два раза больше объема газа, собравшегося в другой трубке. Газ, занимающий больший объем, горит. Это водород. Газ, имеющий меньший объем, не горит, но он поддерживает горение. Это кислород. В результате данного опыта из воды образовались водород и кислород, т.е. было установлено, что молекула воды состоит из еще более мелких частиц — атомов водорода и кислорода.
При химических реакциях молекулы распадаются на атомы или изменяют свой состав.
- Атомы при химических реакциях остаются без изменений.
- Из атомов образуются молекулы.
- Атом —> молекула —> вещество — типы движения материи.
- Химическая реакция (изменение) — тип движения атомов. Это химическая форма движения материи.
В природе встречаются атомы, различающиеся по массе, размеру и свойствам.
Определенный тип атомов составляет химический элемент.
В настоящее время известно 118 видов атомов или 118 химических элементов. Объекты живой и неживой природы в основном состоят из этих элементов.
Каждый химический элемент имеет свое название и свой химический знак.
В 1813 г. по предложению шведского химика Я. Берцелиуса химические элементы стали обозначать начальной или начальной и одной из последующих букв латинского названия данного элемента; первая буква всегда прописная, вторая — строчная.
Например, Н (аш) — химический знак водорода, его латинское название Hydrogenium (образующий воду); Hg (Hydrargirum) — химический знак ртути, который представлен первыми буквами ее латинского названия. Сведения о некоторых химических элементах представлены на третьей странице обложки.
Таким образом, химический знак представляет химический элемент в виде одного его атома.
Размеры атомов и их относительная и абсолютная масса
Атомы являются основной единицей, составляющей материю, и в диаметре имеют размер, равный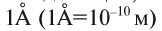 см. рис. 10).
см. рис. 10).
Ангстрем 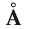 — величина, используемая для измерения размера атомов. Например, диаметр атома хлора равен
— величина, используемая для измерения размера атомов. Например, диаметр атома хлора равен 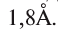 . В настоящее время эта единица измерения используется наряду с единицами измерения по международной системе СИ —нанометр (нм). В этом случае диаметр атома хлора по системе СИ будет иметь размерность 0,18 нм.
. В настоящее время эта единица измерения используется наряду с единицами измерения по международной системе СИ —нанометр (нм). В этом случае диаметр атома хлора по системе СИ будет иметь размерность 0,18 нм.
Абсолютная масса атомов — очень маленькая величина. Например, абсолютная масса атома водорода равна 0,00000000000000000000000000167 кг или 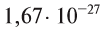 кг. Атом углерода имеет абсолютную массу, равную
кг. Атом углерода имеет абсолютную массу, равную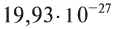 кг. При расчете абсолютной массы использование этих величин вызывает определенные трудности. Поэтому в химии пользуются относительной физической величиной, так называемой относительной атомной массой элемента
кг. При расчете абсолютной массы использование этих величин вызывает определенные трудности. Поэтому в химии пользуются относительной физической величиной, так называемой относительной атомной массой элемента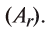
Относительная атомная масса — величина, показывающая, во сколько раз атомная масса элемента больше 1/12 атомной массы элемента углерода.
1/12 часть массы атома углерода равна
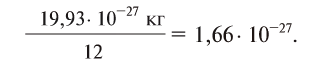

Рис. 10. Расположение атомов германия в структуре кремния
Эта величина называется атомной единицей массы (а.е.м.).

Например, атомная масса кислорода равна  кг, а его относительная атомная масса будет равна:
кг, а его относительная атомная масса будет равна:
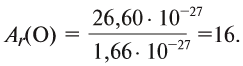
Следовательно, атом кислорода в 16 раз тяжелее 1/12 части атома углерода.
Относительная атомная масса является количественным показателем элемента.
Атомы и молекулы - составные частицы химических веществ
Все соединения имеют определенный химический состав.
Все природные вещества состоят из химических элементов.
Видя разнообразие окружающего нас мира и его непрерывную изменяемость, человек не может не удивляться тому, что мир состоит в основном из 118 элементов. Они распределены и распространены в природе неравномерно; 90% полезных ископаемых в основном состоят из пяти элементов: кислорода, кремния, алюминия, железа и кальция, а тело человека состоит из трех элементов: кислорода, водорода и углерода. Более 20 элементов редко встречаются в природе или могут быть получены лишь в лабораторных условиях.
Химические вещества могут состоять из одного, двух или более элементов. Так, путем пропускания электрического тока через воду можно получить отдельно кислород и водород.
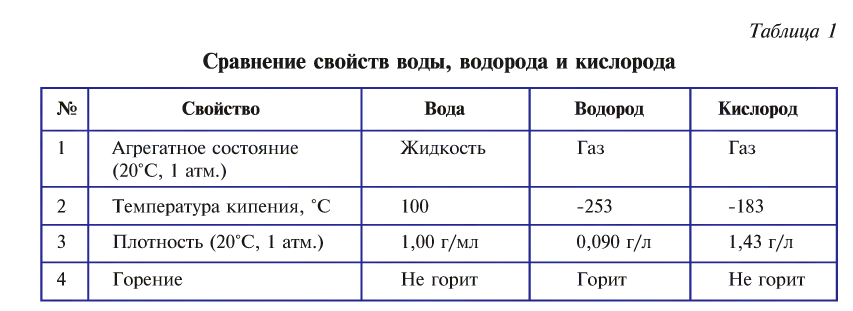
Из табл. 1 видно, что свойства воды резко отличаются от свойств входящих в ее состав элементов. При образовании нового вещества элементы теряют свои прежние свойства.
Следовательно, при пропускании электрического тока через воду ее можно разложить на отдельные вещества.
Химическое соединение — сложное вещество, которое можно разложить на более простые.
Состоящая из водорода и кислорода молекула воды может быть разделена на составляющие ее части. Однако, разлагая водород и кислород, нельзя получить простые вещества. Водород и кислород состоят только из атомов. Следовательно, химическое вещество — это объединение атомов и молекул.
Вещества молекулярного и немолекулярного строения
Вещества в зависимости от составляющих их частиц и их природы разделяются на имеющие молекулярное и немолекулярное строение.
Вещества молекулярного строения состоят из одинаковых молекул, поэтому их состав не изменяется (такие вещества называют дальтонидами, по имени английского ученого Дж. Дальтона, впервые давшего определение этому явлению).
Обычно газообразные вещества имеют молекулярное строение. У жидких и твердых веществ расстояния между молекулами относительно малы, и их силы взаимодействия значительно больше, чем у газообразных веществ. Это и обусловливает их газообразное или твердое агрегатное состояние.
К веществам немолекулярного строения относится большинство твердых веществ, имеющих кристаллическое строение. В узлах кристаллической решетки этих веществ находятся не молекулы, а атомы или другие частицы (ионы).
Газообразные вещества в твердом состоянии также относятся к веществам с молекулярным строением (лед, «сухой лед» — С02, йод, нафталин). Молекулы в кристаллической решетке в отличие атомов или ионов слабо связаны друг с другом. Это обусловливает их высокую летучесть и сравнительно низкую температуру кипения.
Если в узлах кристаллической решетки расположены атомы, такие вещества являются твердыми и обладают высокой температурой плавления (например, алмаз).
Чистые вещества и смеси
Происходящие вокруг нас явления можно объяснить известными нам понятиями о природе и составляющих ее веществах. Для объяснения таяния льда, горения древесины и других явлений необходимо знать их строение. Окружающие нас различные типы веществ можно разделить на отдельные чистые вещества. Что такое чистое вещество?
Вещества бывают двух типов: чистые и смеси, которые состоят из двух или нескольких веществ.
Вещества, имеющие одинаковый состав и свойства во всем объеме, называются чистыми веществами.
Смеси имеют неодинаковый состав и физическими методами могут быть разделены на отдельные чистые вещества (см. рис. 11).
Смеси можно разделить на отдельные компоненты отстаиванием, фильтрованием, перегонкой, экстракцией, действием магнитных полей, сублимацией, хроматографированием, ступенчатым плавлением.
Как было сказано выше, чистые вещества обладают одинаковым составом и свойствами во всем объеме. В этом случае вещество называется гомогенным.
При растворении соли и сахара в воде образуется прозрачный раствор. Подобные растворы-смеси имеют тот же состав и обладают теми же свойствами, что и растворенные в них вещества. Однако они отличаются от чистых веществ различными свойствами, зависящими от количества частиц, составляющих данную смесь (так, стакан воды, содержащий 1 чайную ложку сахара, замерзает при -2°С, а стакан воды, в котором растворена 1 чайная ложка поваренной соли, замерзает при -4°С).
Такие смеси называются гомогенными смесями.
Если мы попробуем растворить почву в воде, то увидим, что почва в воде не растворится и образует муть. Следовательно, данная смесь не состоит из одинаковых частиц. Такой раствор называется гетерогенным, и он может быть разделен на гомогенные составляющие части.
Если в узлах кристаллической решетки располагаются ионы, такие вещества обладают высокой температурой плавления, но они не летучи (поваренная соль).
Между атомами металлов или их положительно заряженными ионами, находящимися в узлах кристаллической решетки, находятся свободные электроны. Поэтому металлы обладают блеском, пластичностью, пропускают тепло и электрический ток.
Свойства веществ, изложенные выше, более подробно будут рассмотрены на уроках химии в 8 классе.
Примером чистого вещества могут служить водяной пар, медная проволока, а к смесям относятся йодированная поваренная соль, мед, молоко, растительные масла.
Чтобы определить свойства вещества, необходимо по возможности получить его в чистом виде. Даже незначительное содержание посторонних частиц может сильно изменить свойства вещества.
В природе нет чистых веществ, все они находятся в виде смеси, состоящей из большого количества различных веществ. Так, в воде всегда содержится множество растворенных солей и газов.
Обычно название смеси происходит от названия компонента, преобладающего в данной смеси (железная ложка на 90% состоит из железа, алюминиевая ложка содержит 99% алюминия).
Для обозначения чистоты химических веществ применяют следующие знаки (символы): т (технически чистый), ч (чистое вещество), ч.д.а. (чистый для анализа), х.ч. (химически чистый), с.ч. (сверхчистый).


Рис. 11. Разделение смеси веществ фильтрованием, отстаиванием (а, б, в), с помощью делительной воронки (г) и хроматографированием (д)
Простые и сложные вещества
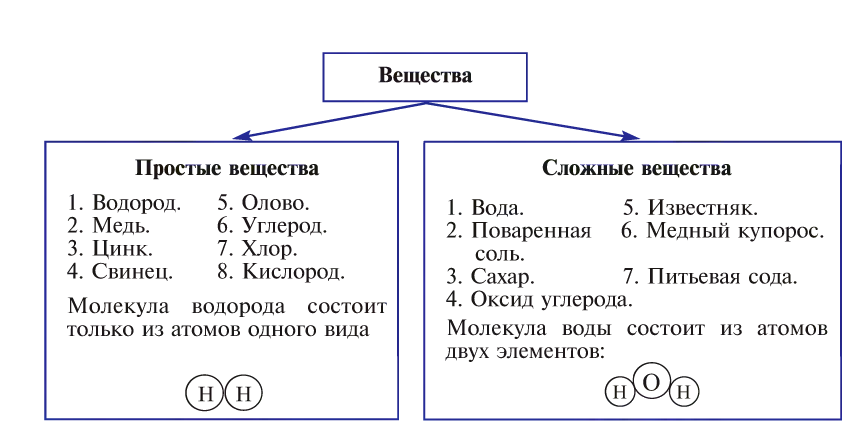
Вещества бывают простыми и сложными.
Вещества, состоящие из атомов одного элемента, называются простыми, например, водород, кислород, железо, сера.
Вещества, состоящие из атомов разных элементов, называются сложными, например, вода, поваренная соль, сахар.
Образование различных простых веществ из атомов одинаковых элементов называется аллотропией.
Классификация веществ в зависимости от их состояния:
Вещество — гомогенное соединение, имеющее определенный химический состав.
Раствор — гомогенное соединение с различным химическим составом.
Каждый из 118 элементов, известных в настоящее время, можно рассматривать как отдельное простое вещество. Вместе с тем некоторые из них могут образовывать ряд простых веществ в виде аллотропических видоизменений. В таких веществах различия определяются количеством или взаимосвязью атомов в их составе.
Углерод может образовывать такие простые вещества, как алмаз, графит, карбин, флюорен.
Сера образует такие простые вещества, как ромбическая и пластическая сера, кристаллическая и аморфная сера.
Фосфор бывает красным, белым и черным (см. рис. 13).
Кислород встречается в виде обычного кислорода и озона.
Явление аллотропии простых веществ наглядно показывает различия между веществом и элементом. Например, химический элемент углерод представляет собой скопление атомов одного вида. Он обладает только ему присущими свойствами. Однако сильно различаются по своим свойствам графит, находящийся в карандаше, и алмаз — драгоценный камень (самостоятельно сравните свойства графита и алмаза).

Рис. 13. Белый и красный фосфор
Графит и алмаз, являясь аллотропическими видоизменениями углерода, могут переходить друг в друга, при этом резко меняются и их свойства.
Несмотря на то, что графит и алмаз воспринимаются как разные вещества, они состоят из атомов углерода. Наличие в их составе элемента углерода можно доказать их горением в кислороде, при котором образуется одно и то же вещество — оксид углерода (IV).
Оксид углерода (IV) — сложное вещество, состоящее из атомов различных элементов — углерода и кислорода.
Количество сложных веществ составляет несколько миллионов.
- Процесс определения состава веществ называется анализом.
- Процесс создания соединений называется синтезом.
- Состав веществ определяется методом анализа.
- Установление составных элементов, образующих соединение, называется качественным анализом.
Определение количества элементов, входящих в состав соединения, называется количественным анализом.
Агрегатное состояние вещества
Вам уже известно, что воздух, кислород, азот и водород являются газообразными веществами; спирт, вода и серная кислота — жидкими веществами; углерод, графит, сера, железо, алюминий — твердые вещества.
А теперь ответим на вопрос, что такое газообразное, жидкое и твердое состояние веществ и какими свойствами обладают вещества в зависимости от своего состояния.
Газ не обладает определенным видом, размером и объемом. Газ принимает форму и вид сосуда, в котором он находится. В сосуд с меньшим объемом его можно поместить путем сжатия, в большом сосуде он, расширяясь, занимает весь объем. Расстояние между молекулами газа больше, чем между молекулами в жидких и твердых веществах.
Жидкости также принимают форму сосуда, но не расширяются, как газы. Жидкости занимают определенный объем, в обычных условиях их трудно подвергнуть сжатию.
Твердое вещество в отличие от газа и жидкости механически устойчиво, имеет определенную форму и занимает определенный объем.
В жидких и твердых веществах расстояние между атомами и молекулами намного меньше по сравнению с газами (см. рис. 14).
Газообразное, жидкое или твердое состояние вещества является его агрегатным состоянием.
Агрегатное состояние вещества зависит от температуры и давления. Вода при температуре выше 100°С имеет газообразное (парообразное) состояние, а при температуре ниже 0°С переходит в твердое (лед)состояние.
Переход из одного состояния в другое (например, превращение льда в воду) — результат физического превращения. При этом не протекает процесс образования нового вещества. Жидкие вещества занимают промежуточное положение между твердыми и газообразными веществами, поскольку они обладают текучестью, легко меняют форму, как газы, и не подвергаются сжатию, как твердые вещества.
При действии на вещества температуры и высокого давления они постепенно переходят из газообразного в жидкое, а затем в твердое состояние.
В отдельных случаях вещества, не переходя в жидкое состояние, могут из газообразного состояния переходить в твердое. К примеру, такими свойствами обладают «сухой лед» — оксид углерода, йод, нафталин (см. рис. 9).
Рис. 14. Газ, жидкость и твердое состояние — агрегатные состояния вещества
Переход вещества из твердого состояния в газообразное минуя жидкое называется сублимацией, или возгонкой.
Химическая формула и выводы на её основе
Каждому атому в составе вещества соответствует свой химический знак. Значит, состав вещества можно выразить на основе соответствующих знаков элементов, составляющих вещество, т.е. иначе говоря, с помощью химической формулы.
Химическая формула — это выражение состава вещества с помощью химических знаков и индексов.
Химическая формула показывает:
- из каких элементов состоит вещество (качественный состав);
- сколько атомов каждого элемента входит в состав одной молекулы вещества (количественный состав);
- одну молекулу вещества.
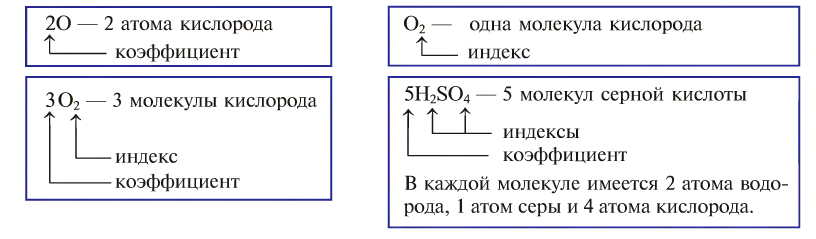
Например, молекула воды состоит из двух атомов водорода (Н), одного атома кислорода (О) и выражается формулой 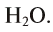 Цифра 2, стоящая справа внизу около химического знака водорода, называется индексом, который показывает число атомов водорода в составе молекулы воды. Цифра, стоящая справа внизу около химического знака в формуле, всегда показывает, сколько атомов этого элемента входит в состав каждой молекулы вещества. Большая цифра, стоящая перед химическим знаком или формулой, называется коэффициентом, который указывает на число отдельных атомов и молекул. Например:
Цифра 2, стоящая справа внизу около химического знака водорода, называется индексом, который показывает число атомов водорода в составе молекулы воды. Цифра, стоящая справа внизу около химического знака в формуле, всегда показывает, сколько атомов этого элемента входит в состав каждой молекулы вещества. Большая цифра, стоящая перед химическим знаком или формулой, называется коэффициентом, который указывает на число отдельных атомов и молекул. Например:
Понятие о валентности
Атом одного элемента может присоединять определенное число атомов другого элемента. Чтобы правильно написать формулу молекулы, нужно иметь представление о важном свойстве элементов — валентности.
Валентностью называется способность атомов одних элементов присоединять определенное число атомов других элементов.
Атом водорода никогда не может присоединить более одного атома другого элемента. Поэтому валентность водорода принята в качестве единой меры определения валентности других элементов.
Если атом элемента присоединяет один атом водорода, то его валентность равна 1 и он считается одновалентным. Если атом элемента присоединяет два или три атома водорода, то он соответственно двух-, трехвалентен и т.д. Например, в веществе НС1 хлор одновалентен, в  кислород двухвалентен, в
кислород двухвалентен, в  азот трехвалентен.
азот трехвалентен.
Некоторые элементы имеют постоянную валентность. Na, К, Н — всегда одновалентны, Са, Mg — всегда двухвалентны, А1 — всегда трехвалентен.
Многие элементы обладают переменной валентностью. Например, железо в FeO двухвалентно, а в 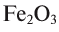 — трехвалентно, медь в
— трехвалентно, медь в 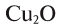 одновалентна, а в СиО — двухвалентна, сера с водородом и металлами двухвалентна
одновалентна, а в СиО — двухвалентна, сера с водородом и металлами двухвалентна 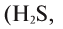 ,
, 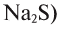 , а в соединениях с кислородом
, а в соединениях с кислородом 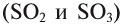 бывает четырех- и шестивалентной. Кислород обычно двухвалентен.
бывает четырех- и шестивалентной. Кислород обычно двухвалентен.
Валентность обычно пишется римскими цифрами либо над химическим знаком элемента: 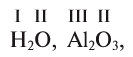 , либо указывается в скобках рядом с химическим знаком элемента или названием: Си (III), Си (I).
, либо указывается в скобках рядом с химическим знаком элемента или названием: Си (III), Си (I).
Валентность элементов можно определить из формулы, и наоборот, на основе валентности можно составить формулу вещества.
В соединении, состоящем из двух элементов, произведение валентности на количество атомов одного элемента равно произведению валентности на количество атомов другого элемента.
Например, молекула 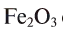 содержит два атома железа (валентность железа равна 3) и три атома кислорода (валентность равна 2). Согласно правилу, 3-2 = 2-3; 6 = 6.
содержит два атома железа (валентность железа равна 3) и три атома кислорода (валентность равна 2). Согласно правилу, 3-2 = 2-3; 6 = 6.
Определение валентности элементов по формуле. Если известна формула бинарного соединения и валентность одного из элементов (n), то валентность второго элемента (m) можно определить по формуле: 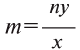 индексы, указывающие на число атомов в соединении). Например, в
индексы, указывающие на число атомов в соединении). Например, в 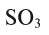 валентность серы равна
валентность серы равна 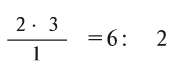 — валентность кислорода, 3 — число атомов кислорода, 1 — число атомов серы.
— валентность кислорода, 3 — число атомов кислорода, 1 — число атомов серы.
В 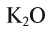 — калий одновалентен, в СаО — кальций двухвалентен, в
— калий одновалентен, в СаО — кальций двухвалентен, в 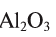 — алюминий трехвалентен, в
— алюминий трехвалентен, в 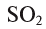 — сера четырехвалентна, в
— сера четырехвалентна, в 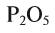 — фосфор пятивалентен.
— фосфор пятивалентен.
Составление формулы по известным валентностям элементов. Зная валентность элементов, мы можем составить формулу бинарного соединения.
Например, бинарное соединение состоит из кислорода и фосфора: валентность кислорода — 2, а фосфора — 5. Формулу этого соединения можно записать как 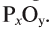 . Согласно правилу, 5х = 2у, если х = 2, а у = 5, то формула этого соединения, состоящего из пятивалентного фосфора и двухвалентного кислорода, будет
. Согласно правилу, 5х = 2у, если х = 2, а у = 5, то формула этого соединения, состоящего из пятивалентного фосфора и двухвалентного кислорода, будет 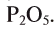
Валентность — важная количественная характеристика элемента.
Графическое изображение формул. Формулы веществ можно изображать графически. При графическом изображении каждая валентность обозначается черточкой (табл. 2).
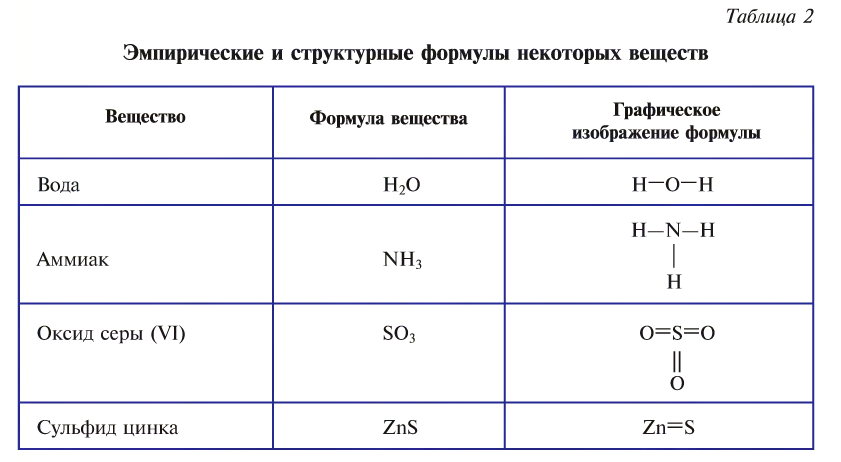
Не забывайте, что при графическом изображении формул сумма валентностей атомов одного элемента в бинарном соединении равна сумме валентностей атомов другого элемента, т.е.mx=ny
Размер, относительная и абсолютная масса молекул
Объемные размеры молекул гак же малы, как и атомов, их диаметр достигает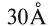 (300 нм). Диаметры большинства молекул находятся в интервале
(300 нм). Диаметры большинства молекул находятся в интервале 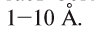
Как и у атомов, их абсолютные массы выражаются очень малыми числами. Например, масса одной молекулы воды составляет 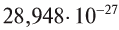 кг. Работа с такими маленькими числами сопряжена с различного рода трудностями. Поэтому целесообразно использовать относительную физическую величину — относительную молекулярную массу
кг. Работа с такими маленькими числами сопряжена с различного рода трудностями. Поэтому целесообразно использовать относительную физическую величину — относительную молекулярную массу 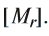
Относительная молекулярная масса вещества — величина, показывающая, во сколько раз масса молекулы вещества больше 1/12 части массы атома углерода — 12.
Относительная молекулярная масса — величина, равная сумме относительных масс атомов, составляющих молекулу. Например, относительная молекулярная масса воды 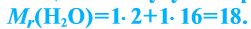
Относительная молекулярная масса — важная количественная характеристика вещества.
Моль
В химии наряду с такими физическими величинами, как масса, объем, плотность, используется также и выражение количества вещества (v) — моль.
Количество вещества — это число частиц, составляющих данное вещество.
Моль — мера количества вещества.
Моль — это количество вещества, содержащее число частиц (атомов, молекул и др.), равное числу атомов в 0,012 кг углерода.
Давайте определим число атомов в 0,012 кг углерода. Для этого разделим 0,012 кг на массу одного атома углерода 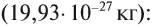
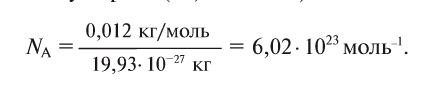
Полученное число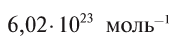 называется числом или постоянной Авогадро по имени итальянского физика и химика Амедео Авогадро (1776—1856) и обозначается
называется числом или постоянной Авогадро по имени итальянского физика и химика Амедео Авогадро (1776—1856) и обозначается 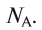 . Значит, моль — это количество вещества, содержащее 6,02-1023 частиц (атомов, молекул и др.).
. Значит, моль — это количество вещества, содержащее 6,02-1023 частиц (атомов, молекул и др.).
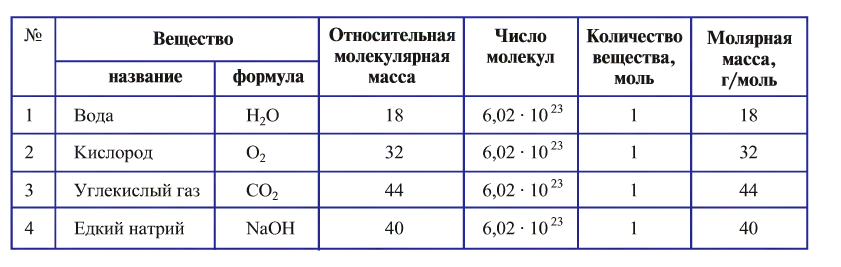
- 1 моль воды содержит
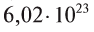 молекул воды.
молекул воды. - 1 моль атомарного кислорода содержит
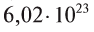 атомов кислорода.
атомов кислорода. - 1 моль молекулярного кислорода содержит
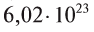 молекул кислорода. Определенному количеству вещества соответствует определенная масса.
молекул кислорода. Определенному количеству вещества соответствует определенная масса.
Отношение массы вещества (т) к его количеству (v) называется молярной массой вещества (М):
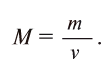
Масса вещества выражается в килограммах (кг) и граммах (г), а количество вещества — в молях. Молярная масса вещества выражается в кг/молях или г/молях.
Вычислим численное значение молярной массы М.
Если v = 1, то m— масса молекул, число которых 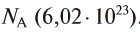
Молярная масса вещества численно равна его относительной молекулярной массе 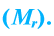
Молярная масса воды — 0,018 кг/моль или 18 г/моль.
Молярная масса кислорода — 0,032 кг/моль или 32 г/моль.
Молярная масса атомарного кислорода — 0,016 кг/моль или 16 г/моль.
Свойства веществ
В природе постоянно происходят изменения, и каждое изменение — это явление. Движение Земли, передвижение человека, таяние льда, кипение и испарение воды, горение спички, растворение сахара в воде, растворение металла в кислоте — все это явления.
При нагревании лед превращается в воду, а вода, испаряясь, переходит в пар. При охлаждении пар превращается в воду, а вода — в лед. Лед, вода, пар — не разные вещества, а различные агрегатные состояния одного вещества — воды. Таяние льда, испарение воды, превращение пара в воду, замерзание воды — это физические изменения. При этом изменяется агрегатное состояние воды, но вода как вещество не подвергается изменению.
Если кусочек мела, которым пишут на доске, превратить в порошок, изменяется форма тела, но мел как вещество не изменяется. Это такие же, как и слом или спилка дерева, физические явления.
При физических изменениях (превращениях) изменяются лишь отдельные свойства вещества или тела: его агрегатное состояние, форма, объем, место расположения (нахождения). При физических явлениях не происходит образования новых веществ.
Теперь нагреем в ложечке сухой сахар. Сахар — твердое, белое, сладкое на вкус вещество без запаха. Сначала сахар плавится. Это — физическое явление. Потом изменяется его цвет. Появляется неприятный запах гари. Из сахара образовалось новое вещество — остаток черного цвета. Это вещество без запаха и вкуса при нагревании, подобно сахару, не плавится. Это уголь (рис. 5). Теперь сахара нет, на его месте образовалось новое вещество с новыми свойствами. Это говорит о том, что произошло химическое превращение — химическое явление.
Явления превращения веществ в другие называются химическими явлениями.
Химические явления называют химическими реакциями.
При горении магния выделяются свет и тепло, а также новое вещество — белый твердый порошок.
При горении серы выделяются свет, тепло и образуется новое вещество — газ с неприятным запахом.
Все приведенное выше может быть примером химических превращений.
Химические явления можно узнать по:
- изменению цвета, запаха, состояния вещества;
- образованию не растворимого в воде осадка;
- образованию газа;
- поглощению или выделению тепла.
Магний горит, а серная кислота — нет. Цинк растворяется в разбавленной серной кислоте, а серебро — нет.
Свойства веществ, вступающих во взаимодействие с другими веществами, называются химическими свойствами.
Физические и химические свойства, характеризующие вещество, в совокупности составляют качество вещества.
При химических превращениях изменяются не только отдельные свойства вещества, но и его качество; образуются новые вещества.
Условия протекания химических реакций
Если обыкновенная свеча стоит на открытом воздухе, никаких явлений не происходит, но если ее зажечь, то начинается химическая реакция. Природный газ в закрытом помещении не взаимодействует с воздухом, но маленькая искра от электрического прибора или тлеющая сигарета при наличии газа могут послужить причиной сильного взрыва. Кусочек железа медленно взаимодействует с кислородом, содержащимся в воздухе (ржавеет), а белый фосфор на воздухе тут же сгорает.
На предыдущем уроке мы говорили о превращениях веществ — химических и физических. Мы узнали, что протекание химических реакций сопровождается образованием новых веществ, исчезновением признаков исходных веществ и появлением признаков новых, поглощением или выделением тепла.
Для протекания химических реакций необходимо выполнение определенных условий.
1. Для протекания некоторых химических реакций необходима подача тепла. Проанализируем приведенные выше явления: свеча стоит на воздухе без изменений, но если поднести к ее фитилю горящую лучину, она начинает плавиться (физическое явление) и гореть (химическое явление) до тех пор, пока не потухнет. Здесь подача тепла необходима для того, чтобы реакция началась, но затем, в процессе реакции, также выделяется

Выделение тепла.

Выделение газа.

Поглощение тепла и прилипание влажной бумаги ко дну колбы во время реакции
Рис.15. Признаки протекания химических реакций
тепло. При горении дерева, бумаги и других горючих материалов происходят такие же явления (рис. 15). Но для некоторых реакций необходима непрерывная подача тепла, так как при прекращении нагревания реакция прекращается. Примером тому может послужить реакция разложения сахара.
2. Молекулы веществ, вступающих в химическую реакцию, должны сталкиваться. Для того, чтобы молекулы веществ соприкасались друг с другом и поверхность взаимодействия была большой, вещества измельчают, превращают в порошок, а если они обладают хорошей растворимостью, то их растворяют. Таким образом облегчается проведение химических реакций.
То же самое необходимо и для протекания реакций между железом и кислородом, фосфором и воздухом: достаточно лишь их соприкосновения друг с другом. Но для большинства веществ этого мало. Например, медь не взаимодействует с кислородом воздуха при комнатной температуре (для этого нужно несколько лет), но чтобы быстро осуществить эту реакцию, необходимо нагреть медь.
Значит, химические реакции сами по себе не протекают, для этого должны создаваться определенные условия, рассмотренные выше.
- Чтобы облегчить протекание реакции, нужно измельчить твердые вещества или при необходимости привести их в порошкообразное состояние, чтобы увеличить поверхность соприкосновения.
- Чтобы ускорить протекание реакции, нужно но возможности пользоваться растворами веществ (рис. 16).
- Для облегчения протекания реакций необходимо нагревание, причем для некоторых — непрерывное.
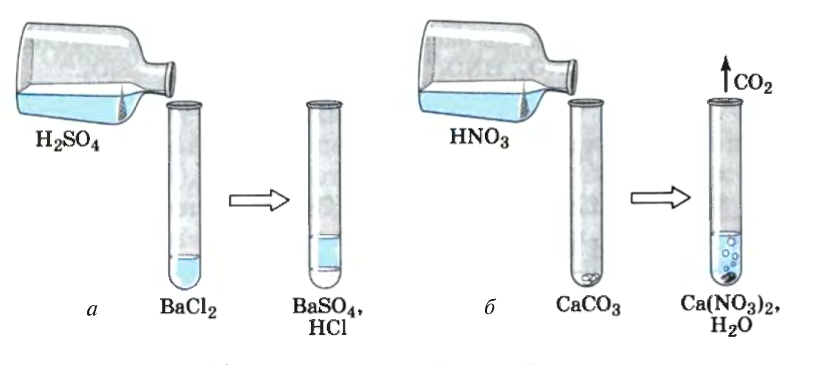
Рис. 16. Образование осадка (а) и газа (б) в растворе
Химические реакции, протекающие в природе или в лаборатории, можно выразить химическими формулами. Например, при реакции между кислородом и водородом образуется вода. Формулы кислорода, водорода и воды известны: 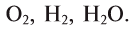
При написании уравнения химической реакции необходимо обратить внимание на следующее. Формулы веществ, вступающих в реакцию, пишутся слева от знака равенства (=), а формулы образующихся веществ — справа. Между исходными и образующимися веществами ставится знак «=».
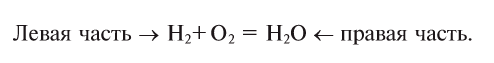
Число атомов в составе веществ, вступающих в реакцию, должно быть равно числу атомов в составе образовавшихся веществ, так как в результате реакции число атомов остается неизменным. Для этого необходимо ставить коэффициенты перед формулами веществ.
В реакции образования воды количество атомов кислорода слева и справа неодинаково, поэтому для уравнивания их числа нужно поставить коэффициент 2 перед молекулой воды:
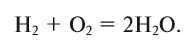
Теперь количество атомов кислорода слева и справа одинаково, но справа атомов водорода стало 4, а слева — 2. Если перед водородом поставить коэффициент 2, получится верное равенство:
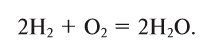
Теперь обе стороны уравнения уравнены. Оно читается так:
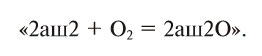
Закон постоянства состава вещества
В процессе изучения различных форм движения материи, зависимостей и связей между природными явлениями человек открывает законы природы.
Химические законы наряду с законами других наук являются отражением законов природы.
Великий мыслитель Абу Али ибн Сина, описывая в труде «Канон врачебной науки» простые и сложные лекарства, говорил, что каждое лекарственное средство имеет определенный состав, изложив тем самым исходные представления о постоянстве состава.
Предложенный в 1799 г. французским ученым Дж. Прустом закон постоянства состава вещества в 1809 г. был признан в научном мире.
Любое чистое вещество независимо от местонахождения и способа получения имеет постоянный состав.
Например, вода состоит из водорода и кислорода (качественный состав). Массовая доля водорода в воде — 11,11%, а кислорода — 88,89% (количественный состав). Воду можно получать различными способами, но в каждом случае чистая вода будет иметь один и тот же состав.
Пероксид водорода 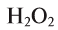 обладает таким же качественным составом, что и вода, но отличается от нее количественным составом. Массовая доля водорода в пероксиде водорода — 5,89%, а кислорода — 94,11%. Пероксид водорода по своим свойствам резко отличается от воды.
обладает таким же качественным составом, что и вода, но отличается от нее количественным составом. Массовая доля водорода в пероксиде водорода — 5,89%, а кислорода — 94,11%. Пероксид водорода по своим свойствам резко отличается от воды.
Количественные изменения приводят к качественным.
Количество и качество находятся в постоянной зависимости.
Английский ученый Дж. Дальтон высказал мысль о том, что соединения образуются при связывании определенного числа атомов одного элемента с определенным числом атомов другого элемента (иначе говоря, соединения образуются при связывании конкретного числа атомов двух или более элементов).
При связывании друг с другом нескольких элементов образуются различные соединения, отличающиеся друг от друга определенным значением отношения масс этих элементов. Например, углерод с кислородом образуют два соединения. Одно из них — оксид углерода (II) содержит 42,88% углерода и 57,12% кислорода. Второе соединение — оксид углерода (IV) содержит 27,29% углерода и 72,71% кислорода. При изучении этих соединений Дж. Дальтон в 1803 г. открыл закон кратных отношений.
Если два элемента образуют друг с другом несколько химических соединений, то масса одного элемента в соединении относится к массе другого приходящегося на него элемента как небольшие целые числа.
Этот закон непосредственно устанавливает конкретное количество элементов, входящих в состав соединения.
Рассчитаем массовое количество кислорода, присоединяемого одним и тем же количеством углерода при образовании оксида углерода (II) и (IV). Для этого попробуем разделить друг на друга величины, показывающие количество углерода и кислорода в обоих соединениях. В результате получается, что на одно и то же количество углерода в оксиде углерода (IV) кислорода приходится в два раза больше, чем в оксиде углерода (II) (табл. 3).
Закон постоянства состава и закон кратных отношений возникли на основе атомно-молекулярного учения. Вещества молекулярного строения состоят из одинаковых молекул. Поэтому естественно, что состав таких веществ постоянен. Если из двух элементов образуется несколько веществ, то их атомы соединяются друг с другом в молекулы разного типа, но определенного состава. Например, оксид углерода (II) СО состоит из одного атома углерода и одного атома кислорода, а оксид углерода (IV) — из одного атома углерода и двух атомов кислорода. Отсюда видно, что кислород присоединяется к определенной массе углерода в отношении 2:1.
— из одного атома углерода и двух атомов кислорода. Отсюда видно, что кислород присоединяется к определенной массе углерода в отношении 2:1.
Закон сохранения массы
Ничто в природе не исчезает бесследно.
При изучении условий протекания многих химических реакций было установлено, что масса исходных веществ количественно равна массе образующихся.
Такие явления наблюдали наши великие предки Абу Райхан Беруни, Абу Али ибн Сина и другие мыслители в своих лабораториях при проведении опытов по нагреванию веществ в запаянных сосудах.
В 1748 г. русский ученый М.В. Ломоносов, проводя опыт в запаянной колбе-реторте, постарайся объяснить это явление. В 1772—1789 гг. французский ученый А. Лавуазье, также проводя опыты в закрытом сосуде, наблюдал неизменность общей массы и воспринял это как своеобразное новшество — новый закон. Так был открыт один из основных законов природы — закон сохранения массы.
Общая масса веществ, вступивших в реакцию, равна общей массе образовавшихся веществ.
На основе этого закона А. Лавуазье сделал важный вывод о том, что атомная масса каждого элемента, вступающего в реакцию, в течение всего процесса не изменяется. А это говорит о том, что атом одного элемента в химической реакции не превращается в атом другого элемента.
При химических реакциях атомы не исчезают, их общее число не изменяется. Атомная масса каждого элемента остается без изменений, поэтому и общая масса веществ не изменяется.
Этот закон показывает, что мы в природе не потребители, а преобразователи. При добыче железной руды из земных недр и изготовлении необходимых изделий число атомов железа на нашей планете не уменьшается, его можно потом восстановить или вообще перевести в трудноделимые формы. Например, при ржавлении железных изделий нельзя восстановить даже 50% затраченного железа. Конечно, расходуя необходимую энергию, можно осуществить любое химическое превращение. Но известно, что энергоресурсы не безграничны. Поэтому ими и вещественными запасами следует пользоваться экономно.
Значит, закон сохранения массы, являясь частным случаем основного закона природы — закона сохранения материи и движения, говорит о том, что из ничего не может возникнуть что-то и, наоборот, только одно переходит в
Закон эквивалентов
Эквивалент — значит равноценный.
Согласно закону постоянства состава, составные части соединения при его образовании связываются друг с другом в строгих количественных соотношениях. Поэтому важное значение в химии приобретают такие понятия, как эквивалент и эквивалентная масса.
Эквивалентностью элемента называется такое его количество, которое связывается с 1 молем атомов водорода или может заместить такое же его количество при химической реакции.
Масса одного эквивалента элемента называется эквивалентной массой (для водорода 1 г/моль).
Например, эквивалент атома кислорода в молекуле воды — 1/2 моль, а его эквивалентная масса равна 16:2 = 8 г/моль.
Обычно эквивалент и эквивалентная масса определяются при изучении состава соединения и того, какое число атомов одного элемента замещается атомами другого. Для этого совсем не обязательно пользоваться водородным соединением этого элемента. Можно использовать вещество в соединении с другим элементом, эквивалент которого известен. Например, при нахождении эквивалента и эквивалентной массы кальция в негашеной извести СаО, зная эквивалентную массу кислорода О по воде — 8 г/моль, можно сказать, что на 40 г/моль Са приходится 16 г/моль О, а на 8 r/моль О, следовательно, будет приходиться 20 г/моль Са, что соответствует его эквивалентной массе.
Многие элементы, связываясь между собой в различных соотношениях, образуют ряд соединений. Значит, в зависимости от количества элемента в соединении его эквивалентность и эквивалентная масса могут принимать различные значения. В таких случаях эквиваленты (эквивалентные массы) одного элемента в различных соединениях относятся друг к другу как небольшие целые числа. В двух соединениях углерода — угарном газе СО и углекислом газе С02 его эквивалентные массы соответственно равны 6 г/моль и 3 г/моль, а их соотношение составляет 6 : 3 = 2 : 1.
Эквивалент сложного вещества — это такое его количество, которое без остатка взаимодействует с одним эквивалентом водорода или любого другого вещества.
Значит, вещества реагируют между собой согласно их эквивалентам. Это — закон эквивалентов.
Вещества взаимодействуют друг с другом в количествах, равных или пропорциональных их эквивалентам.
Массы (объемы) взаимодействующих веществ пропорциональны их эквивалентным массам (объемам).
Эквивалентный объем — объем, занимаемый одним эквивалентом вещества в газообразном состоянии (эквивалентный объем Н — 11,2 л/моль, О — 5,6 л/моль).
Закон Авогадро
Объем газа в известном количестве — величина непостоянная, она зависит от температуры (Т) и давления (Р).
В 1811 г. А. Авогадро, изучая явления, связанные с газами, пришел к следующему выводу.
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Проведенные впоследствии опыты доказали правильность этого утверждения, и этот закон стал называться законом Авогадро.
А. Авогадро определил, что молекулы простых веществ в газообразном состоянии двухатомны
Закон Авогадро применим только к газам. Жидкости и твердые вещества ему не подчиняются, потому что при низких давлениях расстояние между молекулами газов в тысячи раз больше их размеров. Этими размерами можно пренебречь. При одинаковом давлении и температуре расстояние между молекулами различных газов почти одно и то же. Таким образом, одинаковое количество молекул различных газов при одинаковых условиях занимает равный объем.
Объем жидких и твердых веществ из-за межмолекулярного расстояния зависит не только от числа молекул, но и от их размеров.
При очень низких температурах или высоких давлениях межмолекулярное расстояние в газах приближается к размерам молекул в жидком состоянии. Тут закон Авогадро теряет свою силу.
Из предыдущих уроков (см. § 12) известно, что 1 моль любого вещества содержит 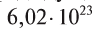 частиц (атомов, молекул). Значит, согласно закону Авога-дро, любой газ, содержащий
частиц (атомов, молекул). Значит, согласно закону Авога-дро, любой газ, содержащий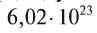 частиц, при одинаковых условиях занимает один и тог же объем.
частиц, при одинаковых условиях занимает один и тог же объем.
Вычислим объем, занимаемый 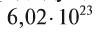 частиц некоторых газов при нормальных условиях (температура 0°С, давление 101,325 кПа). Для этого поделим молярную массу газа М на его плотность р (масса в килограммах 1
частиц некоторых газов при нормальных условиях (температура 0°С, давление 101,325 кПа). Для этого поделим молярную массу газа М на его плотность р (масса в килограммах 1 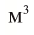 газа при нормальных условиях):
газа при нормальных условиях):
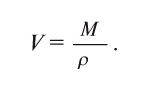
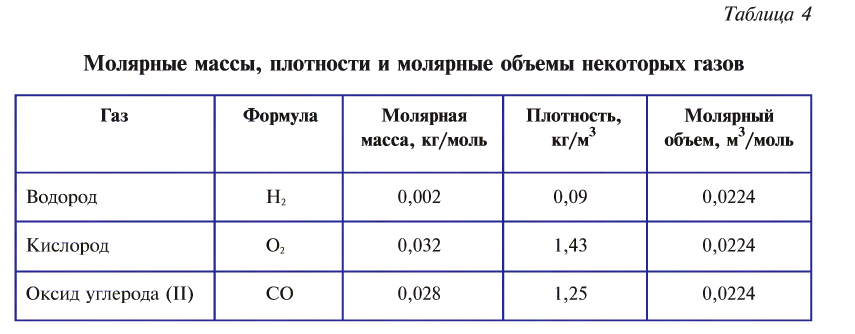
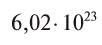 частиц (1 моль) любого газа занимают объем, равный 22,4 л.
частиц (1 моль) любого газа занимают объем, равный 22,4 л.
Отношение объема вещества (V) к его количеству (г) называется молярным объемом:
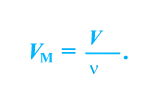
Молярный объем газа выражается в  или л/моль (табл. 4).
или л/моль (табл. 4).
При нормальных условиях 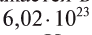 молекул жидкого или твердого вещества занимают различный объем. Например, вода занимает объем, равный 0,018 л.
молекул жидкого или твердого вещества занимают различный объем. Например, вода занимает объем, равный 0,018 л.
Что такое химия
Слово «химия» имеет несколько значений. Так называют науку и учебный предмет. Иногда слово «химия» употребляют как сокращенное название одной из отраслей промышленности.
Химия — естественная наука. На уроках природоведения вы узнали о существовании нескольких наук о природе. К таким наукам относят и химию.
Химия — наука о веществах и их превращениях.
Вещества есть везде — в воздухе, природной воде, почве, в живых организмах (рис. 1). Они существуют не только на Земле, но и на других планетах.
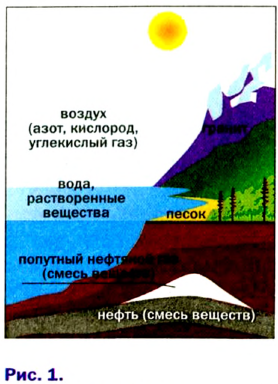
Вещества в природе
В природе происходят превращения одних веществ в другие. Живые существа при дыхании потребляют часть кислорода, который содержится в воздухе, а выдыхают воздух с повышенным содержанием углекислого газа. Этот газ выделяется во время пожаров, при гниении и разложении останков растении и животных. Зеленые листья поглощают углекислый газ и воду, которые вследствие фотосинтеза' превращаются в кислород и другие вещества. В недрах планеты на протяжении миллионов лет происходило образование минералов, нефти, природного газа, угля. Множество химических процессов происходит в реках, морях и океанах.
Вещества и их превращения всегда интересовали человека. Ученые в разные времена осуществляли многочисленные химические эксперименты и стремились объяснить явления, которые наблюдали. Анализируя результаты своих опытов, они выдвигали гипотезы, создавали теории, а затем проверяли их новыми экспериментами. Поэтому химию называют экспериментальной наукой.
Химия и другие науки
Все естественные науки тесно связаны между собой (схема 1), влияют друг на друга и взаимно обогащаются. Обособленное развитие каждой из них невозможно.
Связь химии с другими естественными науками:
- Экология
- Биохимия-Биология
- Физическая химия-Физика
- Космохимия-Астрономия
- Геохимия-Геология
Превращения одних веществ в другие сопровождаются различными физическими явлениями, например выделением или поглощением теплоты, науками .Поэтому химикам необходимо знать физику. Основой существования живой природы является обмен веществ. Ученый-биолог, не сведущий в законах химии, не сможет понять и объяснить этот процесс.
 Термин происходит от греческих слов phos, photos — свет, synthesis — соединение.
Термин происходит от греческих слов phos, photos — свет, synthesis — соединение.
Химические знания необходимы и геологу. Используя их, он успешно будет проводить поиск полезных ископаемых. Врач, фармацевт, косметолог, металлург, кулинар, не имея соответствующей химической подготовки, не достигнут вершин мастерства.
Химия является точной наукой. Перед тем как осуществить химический эксперимент и после его завершения, ученый-химик проводит необходимые расчеты. Их результаты дают возможность сделать правильные выводы. Поэтому деятельность химика невозможна без знания математики.
За последние полтора столетия появились новые науки, которые стремительно развиваются. Среди них — родственные химии биохимия, агрохимия, геохимия, космохимия, физическая химия.
Издавна люди жили в гармонии с природой. Но в последнее время ситуация ухудшилась. Окружающая среда все больше загрязняется из-за внесения чрезмерного количества удобрений в почву, выделения выхлопных газов автомобилей в воздух, вредных веществ различных производств в водоемы, а также бытовыми отходами. Все это приводит к уничтожению растений, гибели животных, ухудшению здоровья людей. Серьезную угрозу для всего живого представляет химическое оружие — особые, чрезвычайно ядовитые вещества. Уничтожение запасов такого оружия требует немалых усилий, средств и времени.
Взаимосвязь человека и природы изучает молодая естественная наука экология .В поле зрения ученых-экологов постоянно находятся проблемы защиты окружающей среды от загрязнений. Сохранение природы для будущих поколений зависит от бережного отношения к ней каждого из нас, от уровня нашей культуры, химических знаний (рис. 2).
.В поле зрения ученых-экологов постоянно находятся проблемы защиты окружающей среды от загрязнений. Сохранение природы для будущих поколений зависит от бережного отношения к ней каждого из нас, от уровня нашей культуры, химических знаний (рис. 2).

Сохраним окружающую среду
 Название происходит от греческих слов oikos — дом, помещение и logos — слово, учение.
Название происходит от греческих слов oikos — дом, помещение и logos — слово, учение.

Схема 2. Химия в жизни человека
Химия в химической промышленности
На химических заводах производят вещества, не существующие в природе, но необходимые людям для обеспечения надлежащего уровня жизни, удовлетворения разнообразных потребностей, сохранения здоровья (схема 2).
Еще в середине XVIII в., в период становления науки химии, выдающийся русский ученый Михаил Васильевич Ломоносов писал: «Широко распростирает химия руки свои в дела человеческие... Куда ни посмотрим, куда ни оглянемся, везде обращаются перед очами нашими успехи ее прилежания». В наше время слова ученого приобрели особую актуальность.
Химии в повседневной жизни
Каждый из нас ежедневно осуществляет превращения веществ, даже не догадываясь об этом. Утром мы моем руки и чистим зубы. При растворении мыла в воде образуются вещества с моющим действием. Зубная паста нейтрализует остатки кислот во рту. Во время приготовления пищи одни вещества превращаются в другие, имеющие новый вкус, цвет, запах. Из питьевой соды, которую добавляют в муку, при нагревании выделяется углекислый газ, разрыхляющий тесто. Уксусом можно удалить накипь в чайнике, а соком лимона — некоторые пятна на одежде. Все эти явления объясняет наука химия.
Химия — учебный предмет
Химию, как и физику, и математику, называют фундаментальной наукой. Поэтому предмет «химия» является обязательным для изучения в школе.
Химические знания помогают выяснить, что происходит с веществами в природе, живых организмах, чем богата наша планета, как изменяется все, что на ней существует. Без этих знаний мы не сможем правильно обращаться с веществами, эффективно и безопасно их использовать.
Выводы:
Химия — наука о веществах и их превращениях. Она является одной из естественных наук и тесно связана с физикой, биологией, математикой, другими науками.
Химией называют также учебный предмет и одну из отраслей промышленности.
Благодаря достижениям химии человек получает и использует различные вещества.
Некоторые вещества, попадая в окружающую среду, загрязняют ее. Одной из важнейших задач человечества и каждого из нас в частности является сохранение природы. Успешное выполнение этой задачи невозможно без применения химических знаний.
Как возникла и развивалась наука химия
Люди издавна осуществляли многочисленные превращения веществ. Научившись добывать огонь, они сжигали древесину, чтобы обогревать свое жилище, готовить пищу. Делая вино, человек использовал процесс брожения, благодаря которому виноградный сахар превращался в спирт. Позже были изобретены способы получения металлов из руд. На превращениях веществ основывалось производство стекла и пороха.
Считают, что химия как ремесло возникла задолго до начала нашей эры в Древнем Египте (рис. 3). Слово «химия» связывают с первым названием этой страны — Кемет . В Египте начали развиваться металлургия, керамическое производство, парфюмерия, крашение тканей, изготовление лекарств. Много тайн, связанных с превращениями веществ, знали только жрецы.
. В Египте начали развиваться металлургия, керамическое производство, парфюмерия, крашение тканей, изготовление лекарств. Много тайн, связанных с превращениями веществ, знали только жрецы.


Рис.3
Химия в Древнем Египте:
а — получение металлов; б — бальзамирование
 По другим гипотезам, слово «химия» происходит от древнегреческого «хюма» — литье металлов или древнекитайского «ним» — золото.
По другим гипотезам, слово «химия» происходит от древнегреческого «хюма» — литье металлов или древнекитайского «ним» — золото.
Над природой веществ размышляли древнегреческие философы. Они утверждали, что все вещества состоят из мельчайших и неделимых частиц — атомов. Но доказать это в то время было невозможно.
Дальнейшее развитие наук происходило в арабских странах. Там химию называли алхимией («ал» — часто употребляемая арабская приставка). Стали развиваться смежные с химией минералогия (наука о минералах), аптечное дело, различные ремесла — ростки современной химической технологии.
В период средневековья алхимией заинтересовались в Европе. Многие произведения арабских и греческих ученых, философов были переведены на латынь. Пытаясь добыть «философский камень», который дал бы возможность превратить любой металл в золото, подарить человеку вечную молодость, вылечить его, ученые проводили множество опытов (рис. 4). Они получили много новых веществ, изучили их свойства. Алхимики изготовляли различные виды лабораторной посуды и оборудования, разработали такие операции в химическом эксперименте, как перегонка, фильтрование. Им принадлежат многочисленные, часто случайные, открытия.


Алхимики за работой
Каждая наука становится настоящей тогда, когда открывают ее законы, а на основании полученных знаний создают теории. Первые теории о превращениях веществ появились в Европе во второй половине XVII в., но были ошибочными. В XVIII в. был открыт закон сохране ния массы веществ при химической реакции (см. § 14). Он оказал положительное влияние на развитие науки химии.
(см. § 14). Он оказал положительное влияние на развитие науки химии.
Современная химия
В настоящее время химия имеет мощный теоретический фундамент. Опираясь на него, ученые прогнозируют существование новых веществ с необходимыми для практического применения свойствами, предлагают и реализуют способы их получения.
Благодаря новым веществам, которые выдерживают высокие температуры, глубокий вакуум, имеют уникальные свойства, человек научился использовать атомную энергию, создал компьютер, проложил дорогу в космос. Традиционные материалы — древесину, стекло, металлы — он успешно заменяет пластмассами. Новые лекарственные препараты помогают человеку восстановить здоровье.
Химики разрабатывают и совершенствуют методы переработки природного сырья — нефти, угля, природного газа, металлических руд, — чтобы получать как можно больше нужных веществ.
Ученые не только изучают вещества и их превращения, но и определяют причины и закономерности таких превращений, исследуют их зависимость от температуры, давления и т. п. Химики работают в хорошо оборудованных лабораториях (рис. 5). Возможности современной химии безграничны.
За значительные мировые достижения в области химии ежегодно одному или нескольким ученым присуждают престижную награду — Нобелевскую премию.
Весомый вклад в развитие химии сделали ученые. Они обогатили теоретическую и экспериментальную химию, получили десятки тысяч новых веществ, разработали сотни методов химического анализа веществ, изобрели многие материалы с полезными свойствами.
Это интересно:
Первая Нобелевская премия в области химии была присуждена в 1901 г. голландскому химику Я. X. Вант-Гоффу за исследование растворов.
 Химическими реакциями называют превращения одних веществ в другие.
Химическими реакциями называют превращения одних веществ в другие.

Рис. 5.Химическая лаборатория
Выводы:
Становление химии происходило на протяжении нескольких тысяч лет.
Химия как наука родилась с открытием закона сохранения массы веществ при их превращениях.
Сейчас ученые-химики получают и исследуют много веществ для их эффективного использования.
Правила работы и техники безопасности в химическом кабинете
Вы уже знаете, что химия — наука о веществах и их превращениях. Ученые-химики осуществляют разнообразные эксперименты с веществами в химических лабораториях, используют современное оборудование, сложные приборы.
Уроки химии проходят в химическом кабинете. В нем обязательно есть вытяжной шкаф, где хранят вредные летучие вещества, проводят опыты, во время которых выделяются газы с резким, неприятным запахом. Вы будете работать с химической посудой, различным оборудованием, многими веществами. Некоторые вещества могут вызвать головокружение, отравление, ожоги, а легковоспламеняющиеся — пожар. Поэтому с ними следует обращаться очень осторожно, а также знать, где в химическом кабинете находятся аптечка и противопожарные средства.
Каждому ученику необходимо знать правила работы в кабинете химии, а также правила техники безопасности и соблюдать их.
Правила работы в химическом кабинете:
- Во время проведения опытов на вашем столе должны находиться реактивы, оборудование, тетрадь, учебник и письменные принадлежности.
- Выполняйте опыт только после того, как определите последовательность своих действий, узнаете о свойствах веществ, которые нужно получить и использовать.
- При малейшем сомнении относительно веществ, оборудования, последовательности и условий выполнения опыта обратитесь с вопросами либо за помощью к учителю или лаборанту.
- Сосредоточьтесь на выполнении каждого опыта, не отвлекайтесь на посторонние дела и не отвлекайте одноклассников.
- Бережно относитесь к имуществу химического кабинета, экономно расходуйте вещества.
- Запрещается выполнять опыты, не запланированные учителем, смешивать какие-либо вещества, сливать жидкости на свое усмотрение, менять условия эксперимента.
- Наблюдения записывайте во время проведения опыта, а результат и выводы — после завершения работы.
- После выполнения опытов уберите рабочее место, вытрите стол тряпкой насухо, вымойте пробирки, другую посуду1 и вместе с оборудованием сдайте учителю или лаборанту.
- Остатки веществ после опытов высыпьте или вылейте в специально предназначенные для этого емкости. Некоторые жидкие вещества и растворы (об этом скажет учитель) можно выливать в раковину. Их остатки смывают проточной водой.
Для проведения химического эксперимента необходимо знать основные виды лабораторной посуды и оборудования, а также уметь пользоваться ими.
Лабораторная посуда
Большая часть посуды для химических опытов сделана из стекла, остальная — из фарфора или пластмассы (рис. 6). Работая со стеклянной посудой, следует иметь в виду, что ее легко разбить и она может треснуть во время нагревания. Фарфоровая посуда предназначена для нагревания, растирания твердых веществ; она термостойкая и более прочная, чем стеклянная.
В химической лаборатории все вещества и растворы содержатся в плотно закрытых банках и бутылках. Их открывают только для того, чтобы взять необходимую порцию вещества или раствора, а потом закрывают. Крышки и пробки кладут на стол внешней поверхностью.
Отбор твердого вещества из банки осуществляют ложкой или шпателем. Определенный объем жидкости отбирают пипеткой или с помощью мерного цилиндра.
Опыты в школе, как правило, выполняют в пробирках. Они изготовлены из тонкого стекла, поэтому работать с ними следует осторожно. В пробирку помещают твердое вещество массой 0,5—1 г, или приблизительно 1/4 чайной ложки, а жидкости наливают 1—2 мл (в пробирке это слой в 1—2 см).
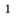 Мыть сильно нагретую стеклянную посуду нельзя, поскольку горячее стекло при попадании на него воды трескается.
Мыть сильно нагретую стеклянную посуду нельзя, поскольку горячее стекло при попадании на него воды трескается.

Рис.6.Лабораторная посуда:
1 — пипетка; 10 — бутылка для хранения жидкостей;
2 — стеклянная пластинка 11 — воронка;
(предметное стекло); 12 — фарфоровая чашка;
3 — стеклянная палочка; 13 — фарфоровая ступка с пестиком;
4 — стеклянная трубка; 14 — капельница;
5 — коническая колба; 15 — баночка для хранения веществ;
6 — плоскодонная колба; 16 — пробирка;
7 — химический стакан; 17 — фарфоровая ложка
8 - - мерный цилиндр;
9 - - кристаллизатор;
Воду в пробирку лучше наливать с помощью промывалки — пластмассового сосуда с водой. Для этого трубку промывалки помещают в пробирку и сжимают рукой пластмассовый сосуд (рис. 7).
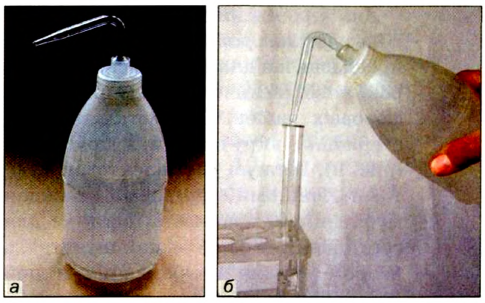
Рис.7.Промывалка(а)и ее использование(б)
Для измельчения твердого вещества используют фарфоровую ступку с пестиком.
Выпаривание растворов осуществляют в фарфоровых чашках или термостойких стаканах. В чашках также прокаливают некоторые твердые вещества.
Если нужно выпарить воду из нескольких капель раствора, то это делают на предметном стекле.
Оборудование
В химическом кабинете имеется различное оборудование (рис. 8).

Рис.8.Лабораторное оборудование:
- 1 — ложка для сжигания веществ;
- 2 — пробиркодержатель;
- 3— штатив для пробирок;
- 4— тренога;
- 5— технохимические весы;
- 6— разновесы;
- 7— пинцет;
- 8 — металлический и фарфоровый шпатели
Для проведения опытов часто используют лабораторный штатив. Он предназначен для закрепления пробирок, колб, химических стаканов, фарфоровых чашек. Это металлический стержень, вкрученный в подставку (рис. 9). Штатив укомплектован муфтами, лапками, кольцами. Каждая муфта имеет два винта: один — для соединения ее со стержнем штатива, а второй — для закрепления в ней лапки или кольца.
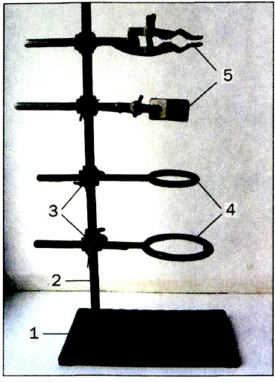
Рис.9.Лабораторный штатив:
- 1 — подставка;
- 2 — стержень;
- 3 — муфта;
- 4 — кольцо;
- 5 — лапка
Пробирку закрепляют в лапке поближе к отверстию, а колбу — за шейку, причем так, чтобы сосуд из лапки не выпадал и его можно было в ней перемещать. Закручивать винт лапки следует без лишних усилий, чтобы не треснуло стекло.
Кольцо служит подставкой для фарфоровой чашки, колбы или химического стакана, в которых нагревают вещества.
Нагревание в химическом кабинете осуществляют, используя спиртовку, сухое горючее, иногда — газовую горелку или электронагреватель.
Спиртовка — стеклянный сосуд определенной формы, в который через металлическую трубку вставлен фитиль — полоска из специальной ткани (рис. 10, а). Спиртовку закрывают колпачком. Перед использованием в нее наливают спирт (до половины объема) и вставляют трубку с фитилем.

Рис.10.Нагревательные приборы:
- а — спиртовка;
- б— гашение пламени колпачком;
- в — газовая горелка
Затем к фитилю подносят зажженную спичку. Чтобы погасить спиртовку, следует накрыть ее колпачком (рис. 10, б), прекратив доступ воздуха к горящему спирту. Нельзя дуть на пламя.
Газовая горелка — металлическое устройство (рис. 10, в), соединенное резиновой трубкой с газовой магистралью. Зажигают газ спичкой, поднося ее к металлической трубке горелки и медленно открывая кран магистрали. Наблюдайте за появлением пламени только сбоку.
Изменяя положение крана, устанавливают высоту пламени 4—5 см. Газ горит едва заметным синим пламенем. Если пламя яркое, нужно увелить доступ воздуха. Это осуществляют с помощью регулятора, размещенного в нижней части горелки. Чтобы погасить газ, закрывают кран магистрали. Не прикасайтесь к верхней части горелки — она долго остается горячей.
Сухое горючее — это кусочки белого горючего вещества, похожие на сахар-рафинад или большие таблетки (рис. 11). Кусочек горючего кладут на термостойкую подставку и поджигают спичкой. Гасят сухое горючее, накрывая его металлическим колпачком или фарфоровой чашкой.

Рис.11.Сухое горючее
Простейшие операции в химическом эксперименте
Обнаружение запаха вещества
Для того чтобы обнаружить запах вещества, содержащегося в пробирке, необходимо рукой «захватить» воздух над пробиркой и направить к носу (рис. 12). Воздух вдыхают осторожно, небольшими порциями.
Перемешивание жидкости в стакане или пробирке
Эту операцию осуществляют с помощью длинной стеклянной палочки (рис. 13, а).
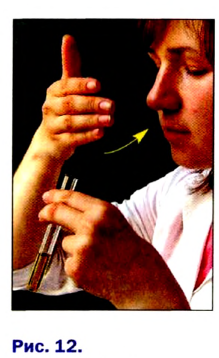
Обнаружение запаха вещества:

Перемешивание жидкости:
а — стеклянной палочкой; б — встряхиванием
Если ее нет, пробирку берут тремя пальцами поближе к отверстию и осторожно встряхивают содержимое (рис. 13, б). Запрещается закрывать отверстие пробирки пальцем, а потом интенсивно встряхивать жидкость.
Переливание жидкости
Бутылку с жидкостью берут в руку так, чтобы закрыть этикетку; тогда остатки жидкости не будут попадать на надпись и повреждать ее. Краем горлышка бутылки с жидкостью касаются отверстия другого сосуда, который держат наклонно, и осторожно наливают в него необходимое количество жидкости (рис. 14, а). Иногда используют воронку.

Рис. 14.
Переливание жидкости:
а — из баночки в пробирку; б — с помощью стеклянной палочки; в — из одной пробирки в другую
Наливать жидкость в стакан из бутылки можно по стеклянной палочке (рис. 14, б).
Жидкость из одной пробирки в другую переливают так, как показано на рисунке 14, в.
Нагревание вещества в пробирке
Пробирку с веществом или раствором закрепляют в ее верхней части в пробирко-держателе или в лапке лабораторного штатива (рис. 15). Пользуясь пробирко-держателем, сначала ослабляют в нем зажим, сдвигая в сторону ручки, вставляют пробирку и, придерживая ее, перемещают зажим в противоположном направлении. После этого зажигают спиртовку или сухое горючее. Сперва равномерно нагревают всю пробирку, а потом, в верхней зоне пламени, ту ее часть, в которой находится вещество. После опыта горячую пробирку не вынимают из пробирко-держателя, а кладут вместе с ним для охлаждения на керамическую или металлическую подставку. Если пробирка была закреплена в штативе, ее оставляют в нем. Спиртовку или сухое горючее гасят.
Нагревание вещества в фарфоровой чашке
В лабораторном штативе с помощью муфты закрепляют кольцо, ставят на него фарфоровую чашку с веществом или раствором. Зажигают спиртовку. Затем кольцо поднимают или опускают в штативе так, чтобы верхняя часть пламени касалась нижней части чашки (рис. 16).

а — закрепленной в пробиркодержателе; Нагревание жидкости
б — закрепленной в штативе в фарфоровой чашке

Выпаривание жидкости на предметном стекле
Выпаривание жидкости на предметном стекле
Предметное стекло закрепляют в пробирко-держателе. С помощью стеклянной палочки, трубки или пипетки наносят на стекло несколько капель раствора и равномерно нагревают над пламенем всю поверхность стекла (рис. 17) до полного выпаривания жидкости. После опыта горячее стекло кладут вместе с пробиркодержателем для охлаждения на керамическую или металлическую подставку.
Правила техники безопасности во время работы в химическом кабинете
- Каждый опыт выполняйте строго по инструкции, имеющейся в учебнике, и в соответствии с рекомендациями учителя.
- Опыты с использованием или образованием вредных летучих веществ, а также газов с резким запахом проводите в вытяжном шкафу с включенным мотором.
- За ходом опыта в пробирке наблюдайте через ее стенки. Нельзя смотреть на вещества в отверстие пробирки, особенно во время нагревания.
- Работая с огнем, будьте особенно внимательны и осторожны!
- Нагревайте пробирку с раствором или веществом равномерно. При этом запрещено наливать или насыпать в нее какое-либо вещество, ставить горячую пробирку в пластмассовый штатив.
- Категорически запрещается брать вещества руками, пробовать их на вкус, рассыпать, разбрызгивать или поджигать.
- Для опытов используйте только чистую лабораторную посуду.
- При попадании на кожу какого-либо вещества стряхните его, смойте достаточным количеством проточной воды и сразу обратитесь к учителю или лаборанту.
- После проведения опытов тщательно вымойте руки с мылом.
- Не употребляйте пищу в химическом кабинете!
- При несчастном случае немедленно обратитесь к учителю.
Эти правила необходимо помнить еще и потому, что некоторые из них могут пригодиться в повседневной жизни. Меры предосторожности при работе с красками, органическими растворителями, моющими средствами, ядохимикатами, другими товарами бытовой химии указаны на упаковках или этикетках (рис. 18).

 Этикетка на банке с лаком
Этикетка на банке с лаком
МЕРЫ ПРЕДОСТОРОЖНОСТИ:
Хранить в плотно закрытой банке в сухом, хорошо проветриваемом помещении, беречь от влаги, тепла и прямых солнечных лучей.
Во время работы с лаком, а также после ее окончания проветрить помещение.
Для защиты рук использовать резиновые перчатки. Не вдыхать, не допускать попадания в глаза, не курить.
Выводы:
Во время проведения химического эксперимента ученики должны соблюдать правила работы и техники безопасности.
На уроках в кабинете химии используют различные виды специальной посуды, лабораторное оборудование, осуществляют необходимые операции с веществами.
Первоначальные химические понятия
Вещества и их свойства:
В повседневной жизни мы сталкиваемся со многими веществами. Среди них — вода, песок, железо, золото, сахар, соль, крахмал, уголь... Продолжать этот перечень можно очень долго. В сотни раз больше веществ используют и получают ученые.
Ныне известно свыше 20 млн веществ. Многие из них существуют в природе (рис. 20). В воздухе есть различные газы; в реках, морях и океанах, кроме воды, — растворенные в ней вещества; в твердом поверхностном слое нашей планеты — многочисленные минералы, горные породы, руды



Искусственно полученные вещества и т. п. Чрезвычайно большое количество веществ находится и в живых организмах.
Алюминия, цинка, ацетона, извести, мыла, аспирина, полиэтилена, многих других веществ в при роде нет. Их выпускает промышленность (рис. 21)
Некоторые вещества, существующие в природе можно получить и в химической лаборатории Так, при нагревании марганцовки выделяется кислород, а при нагревании мела — углекислый газ. Ученые при высокой температуре и давлении превращают графит в алмаз, но кристаллики искусственных алмазов очень мелкие и непригодны для изготовления ювелирных украшений. Получить же полудрагоценный камень малахит с помощью химических опытов не удается.
Неотъемлемым признаком вещества является масса. Световые лучи, магнитное поле не имеют массы и к веществам не относятся.
Вещество — это то, из чего состоит физическое тело.
Физическим телом называют все, что имеет массу и объем. Физическими телами являются, например, капля воды, кристаллик минерала, обломок стекла, кусочек пластмассы, зерно пшеницы, яблоко, орех, а также любой предмет, изготовленный человеком, — часы, игрушка, книга, ювелирное украшение и т. д.
Вещества, используемые для изготовления предметов, оборудования, а также в строительстве и других отраслях, называют материалами (рис. 22). Первыми в истории человечества были природные материалы — древесина, камень, глина. Со временем люди научились выплавлять металлы и стекло, получать известь и цемент. В последние десятилетия на замену традиционным материалам приходят новые, в частности различные пластмассы.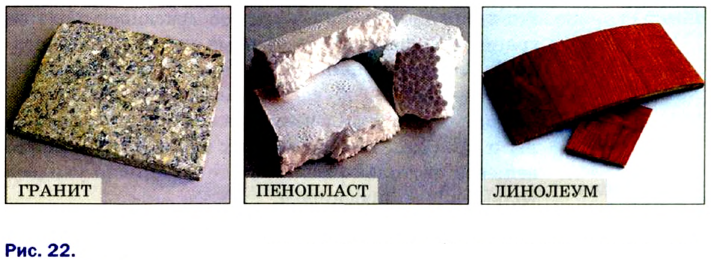
Строительные материалы
Агрегатные состояния вещества
Вещество может существовать в трех агрегатных состояниях — твердом, жидком и газообразном.
При нагревании твердые вещества плавятся, а жидкости закипают, превращаясь в пар. Понижение температуры приводит к обратным превращениям. Некоторые газы при высоком давлении сжижаются. При всех этих явлениях мельчайшие частицы вещества не разрушаются. Таким образом, вещество, изменяя агрегатное состояние, не превращается в другое.
Каждый знает о трех агрегатных состояниях воды, в которых она существует в природе: лед, вода, водяной пар. Но не всякое вещество может быть твердым, жидким и газообразным. Для сахара известны два агрегатных состояния: твердое и жидкое. При нагревании сахар плавится, затем его расплав темнеет, и появляется неприятный запах. Это свидетельствует о превращении сахара в другие вещества. Значит, газообразного состояния для сахара не существует. А такое вещество как графит нельзя расплавить: при температуре 3500 °С он сразу превращается в пар.
Кристаллические и аморфные вещества
Если рассматривать соль и сахар через увеличительное стекло, то можно заметить, что крупинки соли имеют форму кубиков, а сахара — другую форму, но тоже правильную, симметричную. Каждая такая крупинка является кристаллом. Кристалл — это природное физическое тело, имеющее плоские грани (поверхности) и прямые ребра (стыки граней). Следовательно, соль и сахар — кристаллические вещества. К таким веществам относятся лимонная кислота, глюкоза, алмаз, графит, металлы и др. (рис. 23). Во многих случаях кристаллы веществ настолько мелкие, что их можно увидеть только под микроскопом.
Стекло — не кристаллическое, а аморфное вещество. Если его измельчить, то получим бесформенные кусочки, не похожие друг на друга. Аморфными веществами являются также крахмал, мука, полиэтилен и др. (рис. 24).
вещество. Если его измельчить, то получим бесформенные кусочки, не похожие друг на друга. Аморфными веществами являются также крахмал, мука, полиэтилен и др. (рис. 24).
 кристаллические вещества
кристаллические вещества
 аморфные вещества
аморфные вещества
Физические свойства веществ. Все вещества чрезвычайно разнообразны; каждое обладает совокупностью определенных свойств.
Свойства вещества — это признаки, по которым вещество отличается от другого или подобно ему.
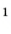 Термин происходит от греческих приставки а- и слова morph
Термин происходит от греческих приставки а- и слова morph — форма.
— форма.
Железо легко отличить от древесины по цвету, особому блеску, а также на ощупь: металл всегда кажется более холодным, так как лучше проводит теплоту. Особенностью железа является то, что оно притягивается к магниту, а древесина — нет. В отличие от железа древесина в воде не тонет, поскольку ее плотность меньше плотности воды, а плотность железа — больше. Железо выдерживает высокую температуру, а древесина сначала темнеет, затем чернеет и загорается.
Свойства вещества, которые определяют наблюдением или измерением, без превращения его в другое вещество, называют физическими.
Важнейшие физические свойства вещества:
- • агрегатное состояние при определенных температуре и давлении;
- • цвет, блеск (или их отсутствие);
- • запах (или его отсутствие);
- • растворимость (или нерастворимость) в воде;
- • температура плавления;
- • температура кипения;
- • плотность;
- • теплопроводность;
- • электропроводность (или неэлектропроводность).
Перечень физических свойств твердых веществ можно расширить, включив в него твердость, пластичность (или хрупкость), а для кристаллических — еще и форму кристаллов. Характеризуя жидкость, указывают, какая она — подвижная или маслянистая.
Такие физические свойства как цвет, запах, вкус, форма кристаллов можно определить визуально, с помощью органов чувств, а плотность, электропроводность, температуру плавления и кипения определяют измерением. Сведения о физических свойствах многих веществ собраны в специальной литературе, в частности — в справочниках.
 нагревание йода
нагревание йода
Физические свойства вещества зависят от его агрегатного состояния. Например, плотность льда, воды и водяного пара различна. Газообразный кислород бесцветный, а жидкий — голубой.
Знание физических свойств помогает «узнавать» немало веществ. Например, медь единственный металл красного цвета. Соленый вкус имеет только поваренная соль. Йод — почти черное твердое вещество, которое при нагревании превращается в темно-фиолетовый пар (рис. 25). В большинстве случаев для определения вещества нужно принимать во внимание несколько его свойств.
Выводы:
Вещество — то, из чего состоит физическое тело. Неотъемлемым признаком вещества является его масса.
Вещество может существовать в трех агрегатных состояниях: твердом, жидком и газообразном. Твердые вещества бывают кристаллическими и аморфными.
Свойства вещества — это признаки, по которым оно отличается от другого вещества или подобно ему. Физические свойства вещества определяют наблюдением или измерением, без превращения его в другое вещество.
Чистые вещества и смеси
Каждое вещество всегда содержит определенное количество примесей. Вещество, в котором почти нет примесей, называют чистым. С такими веществами работают в научной лаборатории, школьном химическом кабинете. Заметим, что абсолютно чистых веществ не существует.
Если содержание примесей в веществе значительно, тогда это — смесь веществ.
 Однородная смесь (водный раствор сахара)
Однородная смесь (водный раствор сахара)
Смесями являются почти все природные вещества, продукты питания (кроме соли, сахара, некоторых других), многие лекарственные и косметические средства, товары бытовой химии, строительные материалы.
Каждое вещество, содержащееся в смеси, называют компонентом.
Существуют однородные и неоднородные смеси.
Однородные смеси
Добавим небольшую порцию сахара в стакан с водой и будем перемешивать, пока весь сахар не растворится. Жидкость будет иметь сладкий вкус. Таким образом, сахар не исчез, а остался в смеси. Но его кристалликов мы не увидим, даже рассматривая каплю жидкости в мощный микроскоп. Приготовленная смесь сахара и воды является однородной (рис. 26); в ней равномерно перемешаны мельчайшие частицы этих веществ.
Смеси, в которых компоненты невозможно обнаружить наблюдением, называют однородными.
Большинство металлических сплавов — также однородные смеси. Например, в сплаве золота с медью (его используют для изготовления ювелирных украшений) отсутствуют красные частицы меди и желтые частицы золота.
Из материалов, которые являются однородными смесями веществ, изготовляют много предметов разнообразного Рис. 27
К однородным смесям принадлежат все смеси газов, в том числе и воздух. Существует немало однородных смесей жидкостей.

Предметы, изготовленные из однородных смесей
Такая смесь образуется при смешивании, например, спирта и воды.
Однородные смеси еще называют растворами, даже если они твердые или газообразные.
По некоторым физическим свойствам однородные смеси отличаются от их компонентов. Так, сплав олова со свинцом, используемый для паяния, плавится при более низкой температуре, чем чистые металлы. Вода закипает при температуре 100 °С, а водный раствор соли — при более высокой температуре. Если воду охладить до температуры 0 °С, она начнет превращаться в лед. Раствор соли при этих условиях остается жидкостью (он замерзает при температуре ниже 0 °С). В этом можно убедиться зимой, когда дороги и тротуары, покрытые льдом, посыпают смесью соли с песком. Лед под действием соли плавится; образуется водный раствор соли, не замерзающий на слабом морозе. А песок нужен для того, чтобы дорога не была скользкой.
Неоднородные смеси
Вам известно, что мел не растворяется в воде. Если его порошок всыпать в стакан с водой, то в образовавшейся смеси всегда можно обнаружить частицы мела, которые видны невооруженным глазом или в микроскоп (рис. 28).

Рис.28.Неоднородная смесь мела и воды
Смеси, в которых компоненты можно обнаружить наблюдением, называют неоднородными.
К неоднородным смесям (рис. 29) относятся большинство минералов, почва, строительные материалы, живые ткани, мутная вода, молоко и другие продукты питания, некоторые лекарственные и косметические средства.
В неоднородной смеси физические свойства компонентов сохраняются. Так, железные опилки, смешанные с медными или алюминиевыми, не теряют способности притягиваться к магниту. Вода в смеси с песком, мелом или глиной замерзает при температуре О °С и закипает при 100 "С.

Рис.29.Неоднородные смеси:
а — смесь воды и серы: б — смесь растительного масла и воды; в — смесь воздуха и воды
Некоторые виды неоднородных смесей имеют специальные названия: пена (например, пенопласт, мыльная пена), суспензия (смесь воды с небольшим количеством муки), эмульсия (молоко, хорошо взболтанные растительное масло с водой), аэрозоль (дым, туман).
Вещества бывают:
1. Чистые вещества
2. Смеси:
а). однородные (растворы)
б). неоднородные (пены, суспензии, эмульсии, аэрозоли)
Методы разделения смесей
Часто возникает необходимость разделить смесь, чтобы получить ее компоненты или очистить вещество от примесей.
Существует много методов разделения смесей. Их выбирают, учитывая тип смеси, агрегатное состояние и различия в физических свойствах компонентов (схема 4). Некоторые методы вам известны из курса природоведения.
Методы разделения смесей:
1.Неоднородных:
а).отстаивание (песок + вода, растительное масло+вода)
б).фильтрование (тырса + вода, песок+вода)
в).действие магнита(железные и древесные опилки)
2.Однородных:
а).выпаривание (водный раствор поваренной соли)
б).перегонка (дистилляция),(нефть, природная вода)
Рассмотрим, как используют некоторые методы разделения смесей.
Процесс фильтрования лежит в основе работы респиратора — устройства, которое защищает легкие человека, работающего в сильно запыленном помещении. В респираторе имеются фильтры, препятствующие попаданию пыли в легкие (рис. 30). Простейший респиратор — повязка из нескольких слоев марли. Фильтр, извлекающий пыль из воздуха, есть и в пылесосе.

Рис.30.Рабочий в респираторе
С помощью магнита в промышленности обогащают железную руду — магнетит. Благодаря способности притягиваться к магниту руда отделяется от песка, глины, земли и др. Таким способом извлекают железо из промышленных и бытовых отходов.
Важным методом разделения однородных смесей жидкостей является перегонка, или дистилляция .Этот метод позволяет очистить природную воду от примесей. Полученную чистую (дистиллированную) воду используют в научно-исследовательских лабораториях, в производстве веществ для современной техники, в медицине для приготовления лекарств.
.Этот метод позволяет очистить природную воду от примесей. Полученную чистую (дистиллированную) воду используют в научно-исследовательских лабораториях, в производстве веществ для современной техники, в медицине для приготовления лекарств.
 Термин происходит от латинского слова distillatio — стекание каплями.
Термин происходит от латинского слова distillatio — стекание каплями.
В промышленности перегонкой нефти (смесь многих веществ, преимущественно — жидкостей) получают бензин, керосин, дизельное горючее.
В лаборатории перегонку осуществляют на специальной установке (рис. 31). При нагревании смеси жидкостей сначала закипает вещество с наиболее низкой температурой кипения. Его пар выходит из сосуда, охлаждается, конденсируется , и образовавшаяся жидкость стекает в приемник. Когда этого вещества уже не будет в смеси, температура начнет повышаться, и со временем закипает другой жидкий компонент. Нелетучие жидкости остаются в сосуде.
, и образовавшаяся жидкость стекает в приемник. Когда этого вещества уже не будет в смеси, температура начнет повышаться, и со временем закипает другой жидкий компонент. Нелетучие жидкости остаются в сосуде.
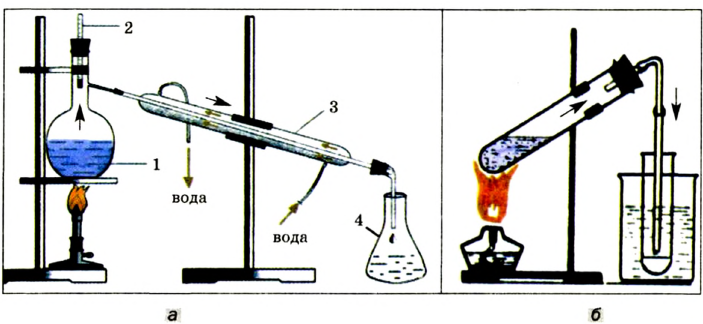
Рис.31.Лабораторная установка для перегонки:
а — обычная;
1 — смесь жидкостей с разными температурами кипения;
2 — термометр;
3 — водяной холодильник;
4 — приемник
б — упрощенная
Разделение различных смесей происходит и в природе. Из воздуха оседают частицы пыли, а во время дождя и снега — капельки воды, снежинки. В результате отстаивания мутная вода становится прозрачной. От нерастворимых веществ вода очищается и при прохождении через песок. После испарения воды на берегах лиманов остаются соли, которые были растворены в ней. Из воды, вытекающей из скважины, выделяются растворенные газы.
 Термин происходит от латинского слова condensatio уплотнение.
Термин происходит от латинского слова condensatio уплотнение.
Выводы:
Каждое вещество содержит примеси. Чистым считают вещество, в котором примесей почти нет.
Смеси веществ бывают однородными и неоднородными. В однородной смеси компоненты невозможно обнаружить наблюдением, а в неоднородной смеси это возможно.
Некоторые физические свойства однородной смеси отличаются от свойств компонентов. В неоднородной смеси свойства компонентов сохраняются.
Неоднородные смеси веществ разделяют отстаиванием, фильтрованием, иногда — действием магнита, а однородные — выпариванием и перегонкой (дистилляцией).
Химические элементы
Атомы
О веществах, их строении размышляли еще древнегреческие философы. Они утверждали, что вещества состоят из атомов — невидимых и неделимых частиц, а в результате их соединения образовался и существует окружающий мир.
 Фильтром в домашних условиях может служить вата или бинт, сложенный в несколько раз. Фильтр необходимо поместить в хозяйственную лейку.
Фильтром в домашних условиях может служить вата или бинт, сложенный в несколько раз. Фильтр необходимо поместить в хозяйственную лейку.
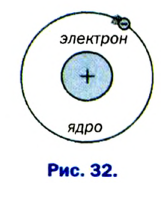 Строение простейшего атома (планетарная модель)
Строение простейшего атома (планетарная модель)
В переводе с греческого слово «атом» означает неделимый».
Доказать существование атомов удалось лишь в XIX в. с помощью сложных физических экспериментов. Одновременно было установлено, что атом не является сплошной, монолитной частицей. Он состоит из ядра и электронов. В 1911 г. была предложена одна из первых моделей атома — планетарная. Согласно этой модели, ядро находится в центре атома и занимает незначительную часть его объема, а электроны движутся вокруг ядра по определенным орбитам, как планеты — вокруг Солнца (рис. 32).
Электрон в тысячи раз меньше атомного ядра. Это отрицательно заряженная частица. Ее заряд — наименьший из существующих в природе. Поэтому величину заряда электрона физики приняли за единицу измерения зарядов мельчайших частиц (кроме электронов, существуют и другие частицы). Таким образом, заряд электрона равен -1. Эту частицу обозначают так: е~.
Ядро атома заряжено положительно. Заряд ядра и суммарный заряд всех электронов атома одинаковы по величине, но противоположны по знаку. Поэтому атом электронейтральный. Если заряд ядра атома составляет +1, то в таком атоме находится один электрон, если +2 — два электрона и т. д.
Атом — мельчайшая электронейтральная частица вещества, состоящая из положительно заряженного ядра и отрицательно .заряженных электронов, которые движутся вокруг него.
Ионы
Атом в определенных условиях может потерять либо присоединить один или несколько электронов. При этом он становится положительно или отрицательно заряженной частицей — ионом .
.
Ион — заряженная частица, образовавшаяся в результате потери атомом или присоединения к нему одного или нескольких электронов.
 Слово «ион» в переводе с греческого означает «идущий». В отличие от электронейтрального атома ион способен перемещаться в электрическом поле.
Слово «ион» в переводе с греческого означает «идущий». В отличие от электронейтрального атома ион способен перемещаться в электрическом поле.
Если атом теряет один электрон, то образуется ион с зарядом +1, а если присоединяет электрон, то заряд иона будет равен -1 (схема 5). В случае потери атомом или присоединения к нему двух электронов образуются ионы с зарядами соответственно +2 или -2.
Образование иона
Образование ионов из атомов
Существуют также ионы, образовавшиеся из нескольких атомов.
Химические элементы. Атомов во Вселенной — бесконечное множество. Их различают по зарядам ядер.
Вид атомов с определенным зарядом ядра называют химическим элементом.
Атомы с зарядом ядра +1 принадлежат одному химическому элементу, с зарядом +2 — другому элементу и т. д.
Понятие «химический элемент» используют для классификации атомов. С аналогичной целью, например, введены сорта фруктов, овощей, цветов и т. п. Следует помнить: химический элемент — не частица и не вещество (так же как название сорта яблок — это не яблоко). Он не имеет агрегатного состояния, плотности, температуры плавления, других физических свойств.
Сейчас известны 115 химических элементов. Заряды ядер их атомов составляют от +1 до +112, а также +114, +116 и +118.
Почти 90 элементов существуют в природе, а остальные (как правило, с наибольшими зарядами атомных ядер) — искусственные элементы. Их получают ученые на уникальном исследовательском
оборудовании. Ядра атомов искусственных элементов неустойчивы и быстро распадаются.
Названия химических элементов, атомов и ионов. У каждого химического элемента есть название. Современные названия элементов происходят от латинских названий (табл. 1). Их всегда пишут с большой буквы.
Названия и символы некоторых химических элементов. Таблица 1
| заряд ядра атома | латинское название элемента | современное | традиционное | символ элемента | произношение симврла |
| +1 | 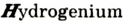 |
гидроген | водород | 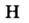 |
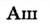 |
| +6 | 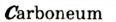 |
карбон | углерод | 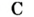 |
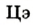 |
| +7 | 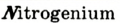 |
нитроген | азот | 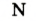 |
 |
| +8 | 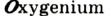 |
оксиген | кислород |  |
 |
| +9 | 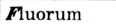 |
флоур | фтор | 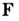 |
фтор |
| +14 | 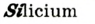 |
силиций | кремний | 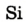 |
Си, силиций |
| +15 | 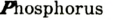 |
фосфор | фосфор |  |
 |
| +16 | 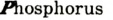 |
сульфур | сера | 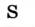 |
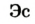 |
До недавнего времени 18 элементов имели другие (традиционные) названия, которые можно найти в выпущенных ранее учебниках по химии, а также в таблице 1. Например, традиционное название одного из таких элементов — водород, а современное — Гидроген.
Названия элементов используют и для соответствующих частиц: атом Гидрогена (водорода), ион Гидрогена (водорода).
С названиями ионов, образовавшихся из нескольких атомов, вы ознакомитесь позже.
Названия химических элементов имеют разное происхождение. Одни связаны с названиями или свойствами (цветом, запахом) веществ, другие — с названиями планет, стран и т. п. Есть элементы, названные в честь выдающихся ученых. Происхождение некоторых названий неизвестно, поскольку они возникли очень давно.
Символы химических элементов
Каждый элемент, кроме названия, имеет еще и сокращенное обозначение — символ, или знак. В наше время используют символы элементов, предложенные почти 200 лет назад известным шведским химиком Й. Я. Берцелиусом (1779—1848). Они состоят из одной латинской буквы (первой в латинских названиях элементов) или двух 1. В таблице 1 такие буквы выделены в названиях элементов курсивом.
Произношение символов почти всех элементов совпадает с их названиями. Например, символ элемента Иода I читается «йод», а не «и», а элемента Феррума Fe — «фэрум», а не «фэ». Все исключения собраны в таблице 1.
В некоторых случаях используют общее обозначение химического элемента — Е.
Символы и названия химических элементов содержатся в периодической системе Д. И. Менделеева.
Периодическая система химических элементов Д. И. Менделеева. В 1869 г. русский химик Дмитрий Иванович Менделеев предложил таблицу, в которой разместил известные к тому времени 63 элемента. Эту таблицу назвали периодической системой химических элементов. В нашем учебнике приведены два ее варианта: короткий (форзац I) и длинный (форзац II).
В периодической системе есть горизонтальные строки, которые называют периодами, и вертикальные столбцы — группы. Пересекаясь, они образуют клетки, в которых содержится важнейшая информация о химических элементах.
Каждая клетка пронумерована. В ней записан символ элемента, а под ним — название (рис. 33).
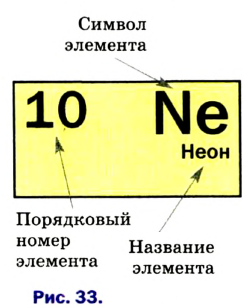 Клетка периодической системы
Клетка периодической системы
Дмитрий Иванович Менделеев (1834—1907)
Выдающийся ученый-химик, член и почетный член академий наук многих стран. В1869 г., в возрасте 35 лет, создал периодическую таблицу (систему) химических элементов и открыл периодический закон — фундаментальный закон химии. Опираясь на периодический закон, изложил химию в своем учебнике «Основы химии», который многократно переиздавался в России и других странах. Провел основательные исследования растворов и разработал теорию их строения (1865—1887). Вывел общее уравнение газового состояния (1874). Предложил теорию происхождения нефти, разработал технологию производства бездымного пороха, внес существенный вклад в развитие науки об измерениях — метрологии.
Номер клетки называют порядковым номером размещенного в ней элемента. Его общее обозначение — Z. Выражение «порядковый номер элемента Неона — 10» сокращенно записывают так: Z(Ne) = = 10. Порядковый номер элемента совпадает с зарядом ядра его атома и количеством электронов в нем. В периодической системе все элементы размещены в порядке возрастания заряда ядер атомов.
Итак, из периодической системы Д. И. Менделеева можно получить такие сведения о химическом элементе:
- • символ;
- • название;
- • порядковый номер;
- • заряд ядра атома;
- • количество электронов в атоме;
- • номер периода, в котором элемент находится;
- • номер группы, в которой он размещен.
Распространенность химических элементов
Одни элементы встречаются в природе «на каждом шагу», другие — чрезвычайно редко. Распространенность элемента в воздухе, воде, почве и т. п. оценивают, сравнивая количество его атомов с количеством атомов других элементов.

Владимир Иванович Вернадский (1863—1945)
Российский ученый-естествоиспытатель. Один из основоположников геохимии. Выдвинул теорию происхождения минералов. Изучал роль живых организмов в геохимических процессах. Разработал учение о биосфере и ноосфере. Исследовал химический состав литосферы, гидросферы, атмосферы. Организатор нескольких научно-исследовательских центров. Основатель школы ученых-геохимиков.
Распределение элементов в разных частях нашей планеты изучает наука геохимия. Значительный вклад в ее развитие внес выдающийся отечественный ученый В. И. Вернадский.
Атмосфера почти полностью состоит из двух газов — азота и кислорода. Молекул азота  в воздухе вчетверо больше, чем молекул кислорода
в воздухе вчетверо больше, чем молекул кислорода  • Поэтому первое место по распространенности в атмосфере занимает элемент Нитроген, а второе — Оксиген.
• Поэтому первое место по распространенности в атмосфере занимает элемент Нитроген, а второе — Оксиген.
Гидросфера — это реки, озера, моря, океаны, в которых растворены небольшие количества твердых веществ и газов. Приняв во внимание состав молекулы воды  , легко прийти к заключению, что в гидросфере больше всего атомов Гидрогена.
, легко прийти к заключению, что в гидросфере больше всего атомов Гидрогена.
Литосфера, или земная кора, — это твердый поверхностный слой Земли. В нем содержится много элементов. Наиболее распространенными являются Оксиген (58 % всех атомов), Силиций (19,6 %) и Алюминий (6,4 %).
Во Вселенной существуют те же элементы, что и на нашей планете. Первое и второе места по распространенности в ней занимают Гидроген (92 % всех атомов) и Гелий (7 %) — элементы, атомы которых имеют простейшее строение.
Выводы:
Атом — мельчайшая электронейтральная частица вещества, которая состоит из положительно заряженного ядра и отрицательно заряженных электронов.
Ион — положительно или отрицательно заряженная частица, образовавшаяся вследствие потери атомом или присоединения к нему одного или нескольких электронов.
Вид атомов с определенным зарядом ядра называют химическим элементом. Каждый элемент имеет название и символ.
Важнейшие сведения о химических элементах содержатся в периодической системе, созданной русским ученым Д. И. Менделеевым.
Почти 90 химических элементов существуют в природе; они различаются по распространенности.
Химические элементы в организме взрослого человека (в процентах от общего количества атомов)
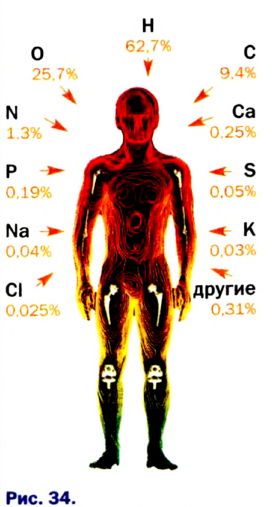
Химические элементы в живой природе
Подсчитано, что в среднем 80 % массы растений приходится на воду. В организмах животных и человека это вещество также преобладает. Следовательно, наиболее распространенным элементом в живой природе, как и в гидросфере, является Гидроген.
Организму человека необходимы более 20 химических элементов. Их называют биоэлементами (рис. 34). Они содержатся в воздухе, воде, а также многих веществах, попадающих в организм вместе с пищей. Карбон, Оксиген, Гидроген, Нитроген, Суль-фур находятся в белках, других веществах, из которых состоит организм. Калий и Натрий содержатся в крови, клеточных жидкостях и т. п. Оксиген, Фосфор и Кальций необходимы для формирования костей. Очень важны для человека Феррум, Флуор, Иод. Недостаток Феррума в организме приводит к малокровию, Флора — служит причиной кариеса, а Иода — замедляет умственное развитие ребенка.
Растениям нужно немного меньше элементов — Карбон, Оксиген. Гидроген, Нитроген, Фосфор, Калий, Магний, Сульфур. Они поступают в растения из воздуха и почвы вместе с углекислым газом, водой, растворенными в ней веществами.
Масса атома
Важной характеристикой атома является его масса. Почти вся масса атома сконцентрирована в ядре. Электроны имеют настолько малую массу, что ею обычно пренебрегают.
Взвесить атомы на весах невозможно, поскольку они чрезвычайно малы. Их массы были определены с помощью расчетов.
Масса атома Урана — самого тяжелого среди всех атомов, которые встречаются на Земле, составляет приблизительно
0,000 000 000 000 000 000 000 4 г.
Записывать и читать это число непросто; можно ошибиться, пропустив ноль или добавив лишний. Существует другой способ его записи — в виде произведения: 4 • 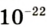 (22 — количество нулей в предыдущем числе)1.
(22 — количество нулей в предыдущем числе)1.
Точное значение массы атома Урана — 3,952 • 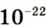 г, а атома Гидрогена, самого легкого среди всех атомов, — 1,673 •
г, а атома Гидрогена, самого легкого среди всех атомов, — 1,673 • 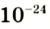 г.
г.
Оперировать очень малыми числами неудобно. Поэтому вместо «абсолютных» масс атомов используют их относительные массы.
Относительная атомная масса
О массе любого атома можно судить, сравнивая ее с массой другого атома. Раньше для сравнения брали самый легкий атом — атом Гидрогена. Сейчас массы атомов сравнивают с 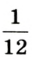 массы атома Карбона (он почти в 12 раз тяжелее атома Гидрогена). Эту маленькую массу назвали атомной единицей массы (сокращенно — а. е. м.):
массы атома Карбона (он почти в 12 раз тяжелее атома Гидрогена). Эту маленькую массу назвали атомной единицей массы (сокращенно — а. е. м.):
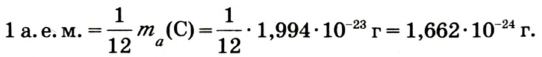
Масса атома Гидрогена почти совпадает с атомной единицей массы: 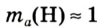 а. е. м. Масса атома
а. е. м. Масса атома
Урана больше ее в 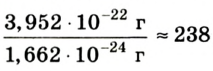 раз. То есть
раз. То есть 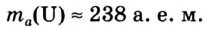
Число, которое получают делением массы атома элемента на атомную единицу массы, называют относительной атомной массой элемента. Эту величину обозначают 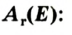 :
: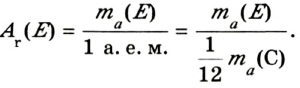
До 1961 г. массы атомов сравнивали с 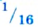 массы атома Оксигена.
массы атома Оксигена.
Индекс возле буквы А — первая буква в латинском слове relativus — относительный.
Относительная атомная масса элемента показывает, во сколько раз масса атома элемента больше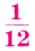 массы атома Карбона.
массы атома Карбона.
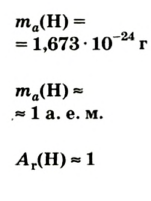
Относительная атомная масса элемента не имеет размерности.
Первую таблицу относительных атомных масс составил почти 200 лет назад английский ученый Дж. Дальтон.
На основании изложенного материала можно сделать такие выводы:
- • относительные атомные массы пропорциональны массам атомов;
- • соотношения масс атомов такие же, как и относительных атомных масс.
Значения относительных атомных масс химических элементов записаны в периодической системе.

Джон Дальтон (1766—1844)
Выдающийся английский физик и химик. Член Лондонского королевского общества (Английской академии наук). Первым выдвинул гипотезу о разных массах и размерах атомов, определил относительные атомные массы многих элементов и составил первую таблицу их значений (1803). Предложил символы элементов и обозначения химических соединений.
Сделав свыше 200 ООО метеорологических наблюдений, изучив состав и свойства воздуха, открыл законы парциальных (частичных) давлений газов (1801), теплового расширения газов (1802), растворимости газов в жидкостях (1803).
 клетка элемента урана
клетка элемента урана
Они определены с очень высокой точностью; соответствующие числа являются в основном пяти- и шестизначными (рис. 35).
В обычных химических расчетах значения относительных атомных масс принято округлять до целых чисел. Так, для Гидрогена и Урана
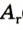 (Н) = 1,0079 = 1;
(Н) = 1,0079 = 1;  (U) = 238,029 = 238.
(U) = 238,029 = 238.
Лишь значение относительной атомной массы Хлора округляют до десятых:
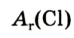 = 35,453 = 35,5.
= 35,453 = 35,5.
Обратите внимание: элементы размещены в периодической системе в порядке возрастания атомных масс.
Выводы:
Атомы имеют чрезвычайно малую массу. Для удобства вычислений используют относительные массы атомов.
Относительная атомная масса элемента является отношением массы атома элемента к 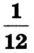 массы атома Карбона.
массы атома Карбона.
Значения относительных атомных масс указаны в периодической системе химических элементов.
Простые и сложные вещества
Атомы в обычных условиях не могут долго существовать поодиночке. Они способны соединяться с такими же или другими атомами, что обуславливает большое разнообразие в мире веществ.
Вещество, образованное одним химическим элементом, называется простым, а вещество, образованное несколькими элементами. — сложным, или химическим соединением.
Простые вещества
Простые вещества делят на металлы и неметаллы. Такую классификацию простых веществ предложил выдающийся французский ученый A.-JI. Лавуазье в конце XVIII в. Химические элементы, от которых происходят металлы, называют металлическими, а те, которые образуют неметаллы, — неметаллическими. В длинном варианте системы Д. И. Менделеева (форзац II) они разграничены ломаной линией. Металлические элементы находятся слева от нее; их значительно больше, чем неметаллических.
Металлы
Каждый из вас может, не задумываясь, назвать несколько металлов (рис. 36). Они отличаются от остальных веществ особым «металлическим» блеском. Эти вещества имеют много общих свойств. Металлы в обычных условиях являются твердыми
Простые вещества делят на металлы и неметаллы. Такую классификацию простых веществ предложил выдающийся французский ученый A.-JI. Лавуазье в конце XVIII в. Химические элементы, от которых происходят металлы, называют металлическими, а те, которые образуют неметаллы, — неметаллическими. В длинном варианте системы Д. И. Менделеева (форзац II) они разграничены ломаной линией. Металлические элементы находятся слева от нее; их значительно больше, чем неметаллических.
Металлы. Каждый из вас может, не задумываясь, назвать несколько металлов (рис. 36). Они отличаются от остальных веществ особым «металлическим» блеском. Эти вещества имеют много общих свойств. Металлы в обычных условиях являются твердыми веществами (только ртуть — жидкость), хорошо проводят электрическии ток и теплоту, имеют в основном высокие температуры плавления (свыше 500 С). Они пластичны; их можно ковать, вытягивать из них проволоку.
Простые вещества 13 элементов — Au, Ag, Си, Hg, Pb, Fe, Sn.Pt.S.C, Zn, Sb и As были

металлы
 Упрощенная модель внутреннего строения металла
Упрощенная модель внутреннего строения металла
Благодаря своим свойствам металлы уверенно вошли в жизнь людей. Об их огромном значении свидетельствуют названия исторических эпох: медный век, бронзовый1 век, железный век.
Сходство металлов обусловлено их внутренним строением.
Строение металлов. Металлы — кристаллические вещества. Кристаллы в металлах намного мельче, чем кристаллы сахара или поваренной соли, и увидеть их невооруженным глазом невозможно.
Атомы в металле «упакованы» очень плотно, поэтому часть электронов постоянно переходит от одних атомов к другим. Именно благодаря этим «свободным» электронам металлы проводят электрический ток. Атомы, которые теряют электроны, превращаются в положительно заряженные частицы — ионы (рис. 37).
Неметаллы. Простых веществ этого типа значительно меньше. К неметаллам относятся азот и кислород (компоненты воздуха), графит (стержни карандашей, материал электрических контактов), алмаз, сера и др. (рис. 38).
 неметаллы
неметаллы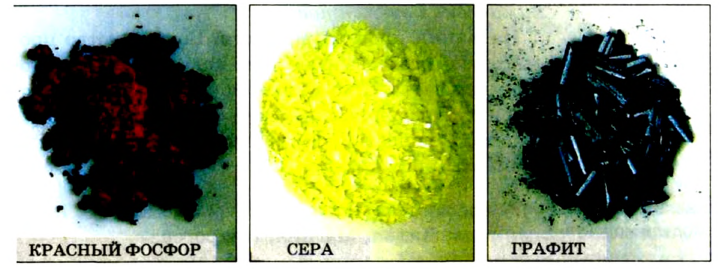
 Бронза- сплав меди с оловом.
Бронза- сплав меди с оловом.
Внешне неметаллы отличаются от металлов прежде всего отсутствием металлического блеска. Только графит и иод имеют слабый блеск. Неметаллы не проводят электрический ток (исключение — графит). В обычных условиях половина неметаллов находится в газообразном состоянии, другие являются твердыми веществами и только бром — жидкостью. Ни одного металла-газа не существует.
Неметаллы заметно отличаются друг от друга.
Строение неметаллов. Часть неметаллов состоит из атомов. В алмазе, графите, красном фосфоре все атомы соединены друг с другом, а в инертных газах — гелии, неоне, аргоне, криптоне, ксеноне и радоне — разъединены.
Другие неметаллы образованы молекулами
Молекула — электронейтральная частица, состоящая из двух или большего числа соединенных атомов.
В каждой молекуле атомы соединены между собой достаточно прочно, а молекулы друг с другом в веществе — очень слабо. Поэтому вещества молекулярного строения имеют невысокие температуры плавления и кипения.
Кислород и озон являются молекулярными веществами. Это простые вещества Оксигена. Молекула кислорода содержит два атома Оксигена, а молекула озона — три (рис. 39).
Не только Оксиген, но и многие другие элементы образуют по два и более простых веществ. Поэтому простых веществ в несколько раз больше, чем химических элементов.
Названия простых веществ
Большинство простых веществ называют так, как и соответствующие элементы. Если названия разные, то они приведены в периодической системе, причем название простого вещества расположено ниже названия элемента (рис. 40).
 модели молекул
модели молекул
 Термин «молекула» происходит от латинского слова moles (масса), уменьшительного суффикса cula и в переводе означает «маленькая масса».
Термин «молекула» происходит от латинского слова moles (масса), уменьшительного суффикса cula и в переводе означает «маленькая масса».
Названия простых веществ записывают внутри предложения с маленькой буквы.
Рис. 40.Клетка периодической системы

Название элемента Название простого вещества
Сложные вещества (химические соединения)
Соединение атомов разных химических элементов порождает множество сложных веществ (их в десятки тысяч раз больше, чем простых).
Существуют сложные вещества с молекулярным, атомным и ионным строением. Поэтому их свойства очень разные.
Молекулярные соединения в основном летучи, нередко имеют запах. Температуры их плавления и кипения значительно ниже, чем соединений с атомным или ионным строением.
Молекулярным веществом является вода. Молекула воды состоит из двух атомов Гидрогена и одного атома Оксигена (рис. 41).
 Модель молекулы воды
Модель молекулы воды
Молекулярное строение имеют угарный и углекислый газы, сахар, крахмал, спирт, уксусная кислота и др. Количество атомов в молекулах сложных веществ может быть разным — от двух атомов до сотен и даже тысяч.
Некоторые соединения имеют атомное строение.
Одним из них является минерал кварц, главная составляющая песка. В нем содержатся атомы Силиция и Оксигена (рис. 42).
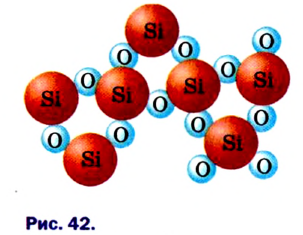 Модель соединения атомного строения (кварца)
Модель соединения атомного строения (кварца)
Существуют также ионные соединения. Это — поваренная соль, мел, сода, известь, гипс и многие другие.
Кристаллы поваренной соли состоят из положительно заряженных ионов Натрия и отрицательно заряженных ионов Хлора (рис. 43). Каждый такой ион образуется из соответствующего атома (§ 6). Взаимное притяжение многих противоположно заряженных ионов обуславливает существование ионных соединений.

Рис. 43.Модель ионного соединения (поваренной соли)
Ион, образовавшийся из одного атома, называют простым, а ион, который образовался из нескольких атомов, — сложным. Положительно заряженные простые ионы существуют для металлических элементов, а отрицательно заряженные — для неметаллических элементов.
Названия сложных веществ
В учебнике до сих пор приводились технические или бытовые названия сложных веществ. Кроме того, вещества имеют и химические названия. Например, химическое название поваренной соли — натрий хлорид, а мела — кальций карбонат. Каждое такое название состоит из двух слов. Первым словом является название одного из элементов, которыми образовано вещество (оно пишется с маленькой буквы), а второе происходит от названия другого элемента.
Органические и неорганические вещества
Раньше органическими веществами называли те вещества, которые содержатся в живых организмах. Это белки, жиры, сахар, крахмал, витамины, соединения, придающие цвет, запах, вкус овощам и фруктам, и др. Со временем ученые начали получать в лабораториях подобные по составу и свойствам вещества, которых нет в природе. Сейчас органическими веществами называют соединения Карбона (за исключением угарного и углекислого газов, мела, соды, некоторых других).
В молекулах органических соединений, кроме атомов Карбона, содержатся, как правило, атомы Гидрогена, нередко — атомы Оксигена, иногда —некоторых других элементов.
Большинство органических соединений способны гореть, а при нагревании в отсутствие воздуха обугливаются (уголь почти полностью состоит из атомов Карбона).К неорганическим веществам принадлежат остальные сложные вещества, а также все простые. Они составляют основу минерального мира, т. е. содержатся в почве, минералах, горных породах, воздухе, природной воде. Кроме того, неорганические вещества есть и в живых организмах.
ВЕЩЕСТВА:
1. простые:
- а).Металлы
- б).Неметаллы
- в).Неорганические вещества
2. сложные (химические соединения)
- а) Органические вещества
- б) Неорганические вещества
Выводы:
Вещества бывают простыми и сложными, органическими и неорганическими. Простые вещества делят на металлы и неметаллы, а химические элементы — на металлические и неметаллические.
Металлы имеют немало общих свойств благодаря сходству их внутреннего строения.
Неметаллы состоят из атомов или молекул и по своим свойствам отличаются от металлов.
Сложные вещества (химические соединения) имеют атомное, молекулярное или ионное строение.
Почти все соединения Карбона принадлежат к органическим веществам, а остальные соединения и простые вещества — к неорганическим веществам.
Химическая формула
У каждого вещества есть название. Однако, по названию нельзя определить, из каких частиц состоит вещество, сколько и каких атомов содержится в его молекулах, ионах, какие заряды имеют ионы. Ответы на такие вопросы дает особая запись — химическая формула.
Химическая формула — это обозначение атома, молекулы, иона или вещества с помощью символов химических элементов и индексов.
Химической формулой атома является символ соответствующего элемента. Например, атом. Алюминия обозначают символом А1, атом Силиция — символом Si. Такие формулы имеют и простые вещества — металл алюминий, неметалл атомного строения кремний.

Химическая формула молекулы простого вещества содержит символ соответствующего элемента и нижний индекс — маленькую цифру, записанную ниже и справа. Индекс указывает на количество атомов в молекуле.
Молекула кислорода состоит из двух атомов Оксигена. Ее химическая формула — 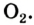 Эту формулу читают, произнося сначала символ элемента, потом — индекс: «о-два». Формулой
Эту формулу читают, произнося сначала символ элемента, потом — индекс: «о-два». Формулой 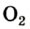 обозначают не только молекулу, но и само вещество кислород.
обозначают не только молекулу, но и само вещество кислород.
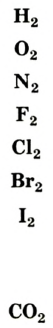
Молекулу 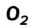 называют двухатомной. Из подобных молекул (их общая формула —
называют двухатомной. Из подобных молекул (их общая формула — 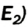 состоят простые вещества Гидрогена, Нитрогена, Флуора, Хлора, Брома, Иода.
состоят простые вещества Гидрогена, Нитрогена, Флуора, Хлора, Брома, Иода.
Озон содержит трёхатомные молекулы, белый фосфор — четырехатомные, а сера — восьмиатомные. (Напишите химические формулы этих молекул.)
В формуле молекулы сложного вещества записывают символы элементов, атомы которых содержатся в ней, а также индексы. Молекула углекислого газа состоит из трех атомов: одного атома Карбона и двух — Оксигена. Ее химическая формула — С02 (читается «цэ-о-два»). Запомните: если в молекуле есть один атом какого-либо элемента, то соответствующий индекс, т. е. 1, в химической формуле не пишут. Формула молекулы углекислого газа является также и формулой самого вещества.
В формуле иона дополнительно записывают его заряд. Для этого используют верхний индекс. В нем цифрой указывают величину заряда (единицу не пишут), а потом — знак (плюс или минус). Например, ион Натрия с зарядом +1 имеет формулу 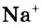 («читается натрий-плюс»), ион Хлора с зарядом -1 —
(«читается натрий-плюс»), ион Хлора с зарядом -1 —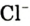 («хлор-минус»), гидроксид-ион с зарядом -1 —
(«хлор-минус»), гидроксид-ион с зарядом -1 —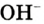 («о-аш-минус»), карбонат-ион с зарядом -2 —
(«о-аш-минус»), карбонат-ион с зарядом -2 — 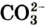 («цэ-о-три-два-минус»).
(«цэ-о-три-два-минус»).
В формулах ионных соединений сначала записывают, не указывая зарядов, положительно заряженные ионы, а потом — отрицательно заряженные (табл. 2). Если формула правильная, то сумма зарядов всех ионов в ней равна нулю.
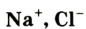 -простые ионы
-простые ионы
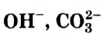 -сложные ионы
-сложные ионы
Таблица 2
Формулы некоторых ионных соединений
|
Название соединения |
Формулы ионов, из которых состоит соединение |
Химическая формула соединения |
Чтение формулы |
|---|---|---|---|
| Поваренная соль | 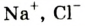 |
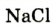 |
Натрий-хлор |
| Мел | 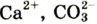 |
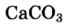 |
Кальций-цэ-о-три |
| Кальцинированная сода | 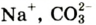 |
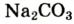 |
Натрий-два-цэ-о-три |
В некоторых химических формулах группу атомов или сложный ион записывают в скобках. В качестве примера возьмем формулу гашеной извести 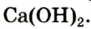 Это ионное соединение. В нем на каждый ион
Это ионное соединение. В нем на каждый ион 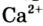 приходится два иона ОН . Формула соединения читается «кальций-о-аш-дважды», но не « кальций-о-аш-два ».
приходится два иона ОН . Формула соединения читается «кальций-о-аш-дважды», но не « кальций-о-аш-два ».
Иногда в химических формулах вместо символов элементов записывают «посторонние» буквы, а также буквы-индексы. Такие формулы часто называют общими. Примеры формул этого типа: 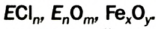 Первой формулой обозначают группу соединений элементов с Хлором, второй — группу соединений элементов с Оксигеном, а третью используют, если химическая формула соединения Феррума с Оксигеном неизвестна и ее следует установить.
Первой формулой обозначают группу соединений элементов с Хлором, второй — группу соединений элементов с Оксигеном, а третью используют, если химическая формула соединения Феррума с Оксигеном неизвестна и ее следует установить.
Если нужно обозначить два отдельных атома Неона, две молекулы кислорода, две молекулы углекислого газа или два иона Натрия, используют записи 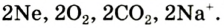 Цифру перед химической формулой называют коэффициентом. Коэффициент 1, как и индекс 1, не пишут.
Цифру перед химической формулой называют коэффициентом. Коэффициент 1, как и индекс 1, не пишут.
Формульная единица
А что означает запись 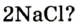 Молекул
Молекул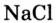 не существует; поваренная соль — ионное соединение, которое состоит из ионов
не существует; поваренная соль — ионное соединение, которое состоит из ионов 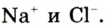 Пару этих ионов называют формульной единицей вещества (она выделена на рис. 44, а). Таким образом, записью
Пару этих ионов называют формульной единицей вещества (она выделена на рис. 44, а). Таким образом, записью 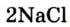 представлены две формульные единицы поваренной соли, т. е. две пары ионов
представлены две формульные единицы поваренной соли, т. е. две пары ионов 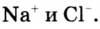
Термин «формульная единица» используют для сложных веществ не только ионного, но и атомного строения. Например, формульной единицей для
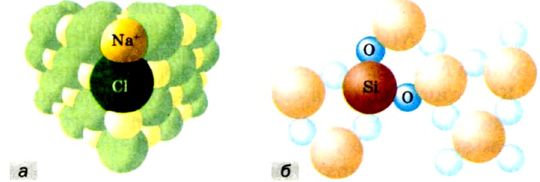
Рис. 44. Формульные единицы в соединениях ионного (а) и атомного строения (б)
кварца 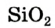 является совокупность одного атома Силиция и двух атомов Оксигена (рис. 44, б).
является совокупность одного атома Силиция и двух атомов Оксигена (рис. 44, б).
Формульная единица — это мельчайший «кирпичик» вещества, его наименьший повторяющийся фрагмент. Этим фрагментом может быть атом (в простом веществе), молекула (в простом или сложном веществе), совокупность атомов или ионов (в сложном веществе).
Пример №1
Составить химическую формулу соединения, которое содержит ионы Назвать формульную единицу этого вещества.
Назвать формульную единицу этого вещества.
Решение
В ионном соединении сумма зарядов всех ионов равна нулю. Это возможно при условии, если на каждый ион 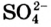 приходится два иона
приходится два иона 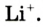 Отсюда формула соединения —
Отсюда формула соединения — 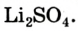
Формульной единицей вещества являются три иона: два иона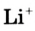 и один ион
и один ион 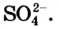
Качественный и количественный состав вещества
Химическая формула содержит информацию о составе частицы или вещества. Характеризуя качественный состав, называют элементы, которые образуют частицу или вещество, а характеризуя количественный состав, указывают:
- • количество атомов каждого элемента в молекуле или сложном ионе;
- • соотношение атомов разных элементов или ионов в веществе.
Пример №2
Описать состав метана 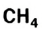 (молекулярное соединение) и кальцинированной соды
(молекулярное соединение) и кальцинированной соды  (ионное соединение).
(ионное соединение).
Решение
Метан образован элементами Карбоном и Гидрогеном (это качественный состав). Молекула метана содержит один атом Карбона и четыре атома Гидрогена; их соотношение в молекуле и в веществе —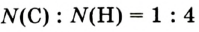 (количественный состав). (Буквой N обозначают количество частиц — атомов, молекул, ионов.)
(количественный состав). (Буквой N обозначают количество частиц — атомов, молекул, ионов.)
Кальцинированная сода образована тремя элементами — Натрием, Карбоном и Оксигеном. Она содержит положительно заряженные ионы 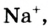 поскольку Натрий — металлический элемент, и отрицательно заряженные ионы
поскольку Натрий — металлический элемент, и отрицательно заряженные ионы 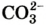 (качественный состав).
(качественный состав).
Соотношение атомов элементов и ионов в веществе таковы:
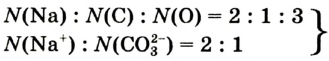 количественный состав
количественный состав
Выводы:
Химическая формула — это запись атома, молекулы, иона, вещества с помощью символов химических элементов и индексов. Количество атомов каждого элемента указывают в формуле с помощью нижнего индекса, а заряд иона — верхним индексом.
Формульная единица — частица или совокупность частиц вещества, представленная его химической формулой.
Химическая формула отражает качественный и количественный состав частицы или вещества.
Валентность химических элементов
Числовые индексы в химических формулах указывают на то, что атомы соединяются друг с другом не произвольно, а в определенных соотношениях.
Способность атома соединяться с определенным количеством таких же или других атомов называют валентностью .
.
Валентность является важным свойством атома. Ее определяют исходя из того, сколько атомов присоединяет данный атом и каким элементам они принадлежат.
Значение валентности атома Гидрогена принято считать равным 1. Этот атом всегда соединяется только с одним атомом. В результате образуются, например, молекулы водорода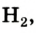 фтороводорода HF, воды
фтороводорода HF, воды 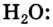

Гидроген — одновалентный элемент.
В молекуле фтороводорода HF атом Флуора связан с атомом Гидрогена. Поэтому значение валентности Флуора, как и Гидрогена, равно 1.
Атом Оксигена удерживает в молекуле воды 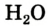 два атома Гидрогена. Отсюда вывод: Оксиген —двухвалентный элемент.
два атома Гидрогена. Отсюда вывод: Оксиген —двухвалентный элемент.
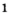 Термин происходит от латинского слова valentia — сила.
Термин происходит от латинского слова valentia — сила.
Такую валентность Оксиген проявляет всегда — ив молекуле простого вещества 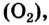 и в молекулах сложных веществ.
и в молекулах сложных веществ.
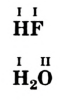
Значение валентности элемента при необходимости указывают в химической формуле римской цифрой над его символом: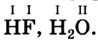 В математических расчетах и тексте для этого используют арабские цифры.
В математических расчетах и тексте для этого используют арабские цифры.
Сведения о валентности элементов в веществе можно представить другим способом. Сначала записывают на определенном расстоянии друг от друга символы каждого атома, находящегося в молекуле. Затем одновалентный атом соединяют с другим одной черточкой, от двухвалентного атома проводят две черточки и т. д.:
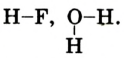
Такие формулы называют графическими. Они показывают порядок соединения атомов в молекулах.
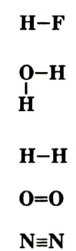
Молекула простого вещества водорода имеет Н-Н графическую формулу Н-Н. Аналогичными являются графические формулы молекул фтора, хлора, брома, иода. Графическая формула молекулы кислорода 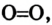 а молекулы азота
а молекулы азота 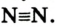
Составляя такие формулы для молекул сложных веществ, следует иметь в виду, что атомы одного элемента, как правило, не соединены между собой.
Из графической формулы молекулы легко определить валентность каждого атома. Значение валентности равно количеству черточек, которые исходят от атома.
Для соединений ионного и атомного строения графические формулы не используют.
Валентность элемента и его размещение в периодической системе
Некоторые элементы имеют постоянную валентность. Гидроген и Флуор всегда одновалентны, а Оксиген — двухвалентен. Другие элементы с постоянной валентностью находятся в I—III группах периодической системы, причем значение валентности каждого элемента совпадает с номером группы. Так, элемент I группы Литий одновалентен, элемент II группы Магний двухвалентен, а элемент III группы Бор трехвалентен. Исключениями являются элементы I группы Купрум (значения валентности — 1 и 2) и Аурум (1 и 3).
Большинство элементов имеют переменную валентность. Приводим ее значения для некоторых из них:
- Плюмбум (IV группа) — 2, 4;
- Фосфор (V группа) — 3, 5;
- Хром (VI группа) — 2, 3, 6;
- Сульфур (VI группа) — 2, 4, 6;
- Манган (VII группа) — 2, 4, 6, 7;
- Хлор (VII группа) — 1, 3, 5, 7.
Из этих сведений вытекает важное правило: максимальное значение валентности элемента совпадает с номером группы, в которой он находится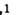 . Поскольку в периодической системе восемь групп, то значения валентности элементов могут быть от 1 до 8.
. Поскольку в периодической системе восемь групп, то значения валентности элементов могут быть от 1 до 8.
Существует еще одно правило: значение валентности неметаллического элемента в соединении с Гидрогеном или с металлическим элементом равно 8 минус номер группы, в которой размещен элемент. Подтвердим его примерами соединений элементов с Гидрогеном. Элемент VII группы Иод в иодоводороде HI одновалентен (8-7=1), элемент VI группы Оксиген в воде  двухвалентен (8 - 6 = 2), элемент V группы Нитроген в аммиаке
двухвалентен (8 - 6 = 2), элемент V группы Нитроген в аммиаке  трехвалентен (8 - 5 = 3).
трехвалентен (8 - 5 = 3).
Определение валентности элементов в бинарном соединении по его формуле
Бинарным называют соединение, образованное двумя элементами.
называют соединение, образованное двумя элементами.
В начале ХIХ в. во взглядах на состав химических соединений господствовал принцип "наибольшей простоты". Так, формулу воды записывали 
 Существует несколько исключений.
Существует несколько исключений.  Термин происходит от латинского слова binarius — двойной; состоящий из двух частей.
Термин происходит от латинского слова binarius — двойной; состоящий из двух частей.
Выяснить значение валентности элемента в соединении нужно тогда, когда элемент имеет переменную валентность. Как выполняют такое задание, покажем на примере.
Найдем значение валентности Иода в его соединении с Оксигеном, которое имеет формулу 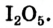
Вы знаете, что Оксиген — двухвалентный элемент. Запишем значение его валентности над символом этого элемента в химической формуле соединения: 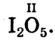 На 5 атомов Оксигена приходится 2 • 5 = 10 единиц валентности. Их нужно «распределить» между двумя атомами Иода (10 : 2 = 5). Из этого следует, что Иод в соединении пятивалентен. Формула соединения с обозначением валентности элементов —
На 5 атомов Оксигена приходится 2 • 5 = 10 единиц валентности. Их нужно «распределить» между двумя атомами Иода (10 : 2 = 5). Из этого следует, что Иод в соединении пятивалентен. Формула соединения с обозначением валентности элементов — 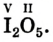
Составление химических формул соединений по валентности элементов
Выполним задание, противоположное предыдущему, — составим химическую формулу соединения Сульфура с Оксигеном, в котором Сульфур шестивалентен.
Сначала запишем символы элементов, образующих соединение, и укажем над ними значения валентности: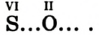 Затем находим наименьшее число, которое делится без остатка на оба значения валентности. Это число 6. Делим его на значение валентности каждого элемента и получаем соответствующие индексы в химической формуле соединения:
Затем находим наименьшее число, которое делится без остатка на оба значения валентности. Это число 6. Делим его на значение валентности каждого элемента и получаем соответствующие индексы в химической формуле соединения: 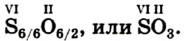
Для проверки химической формулы используют правило: произведения значений валентности каждого элемента на количество его атомов в формуле одинаковы. Эти произведения для только что выведенной химической формулы: 6 • 1 = 2 • 3.
Формулы соединений образованных тремя и более элементами, составляют иначе
Запомните, что в формулах соединений, в том числе бинарных, сначала записывают символы металлических элементов, а потом — неметаллических. Если соединение образовано только неметаллическими элементами и среди них есть Оксиген или Флуор, то эти элементы записывают последними.
Причины соединения атомов друг с другом и объяснение значений валентности элементов связаны со строением атомов. Этот материал будет рассмотрен в 8 классе.
Порядок записи элементов в формуле соединения Оксигена с Флуором такой:
Выводы:
Валентность — это способность атома соединяться с определенным количеством таких же или других атомов.
Существуют элементы с постоянной и переменной валентностью. Гидроген и Флуор всегда одновалентны, Оксиген — двухвалентен.
Значения валентности элементов отражают в графических формулах молекул соответствующим количеством черточек возле атомов.
Произведения значений валентности каждого элемента на количество его атомов в формуле бинарного соединения одинаковы.
Относительная молекулярная масса
Массы молекул, как и атомов, чрезвычайно малы. Поэтому в химии используют относительные массы молекул. Их еще называют относительными молекулярными массами.
Относительная молекулярная масса — это отношение массы молекулы к 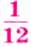 массы атома Карбона.
массы атома Карбона.
Относительную молекулярную массу сокращенно обозначают 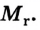 Эта величина, как и относительная атомная масса, не имеет размерности. Математическая формула для ее вычисления, исходя из массы молекулы:
Эта величина, как и относительная атомная масса, не имеет размерности. Математическая формула для ее вычисления, исходя из массы молекулы:
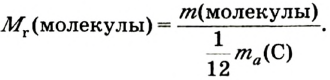
Найдем относительную молекулярную массу кислорода, использовав массы молекулы кислорода 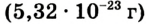 и атома Карбона
и атома Карбона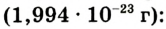
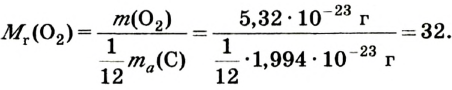
Значительно проще вычислять относительную молекулярную массу, используя относительные атомные массы.
Относительная масса молекулы равна сумме относительных масс атомов, которые входят в ее состав.
Найдем относительные молекулярные массы кислорода и воды, взяв из периодической системы Менделеева значения относительных атомных масс Оксигена и Гидрогена:
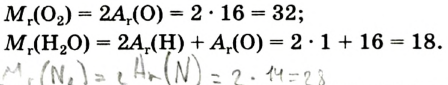
Относительная формульная масса
Для ионов, а также веществ с атомным и ионным строением (они не содержат молекул) вместо термина «относительная молекулярная масса» используют другой — Это «относительная формульная масса». Эту физическую величину обозначают и рассчитывают так же, как и относительную молекулярную массу.
Относительная формульная масса иона
Масса простого иона почти не отличается от массы соответствующего атома, так как ион содержит на один или несколько электронов больше или меньше, чем атом, а масса электрона в тысячи раз меньше массы атома.
Наименьшую массу имеют ионы Гидрогена 
Совпадают также относительные формульные массы простых ионов и относительные атомные массы элементов:

Относительные формульные массы сложных ионов можно рассчитать тем же способом, что и относительные молекулярные массы:
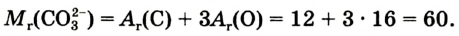
Относительная формульная масса ионного вещества
Вычисление относительной формульной массы поваренной соли осуществляют так:
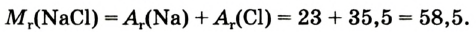
В качестве другого примера возьмем алюминий сульфат  Это соединение состоит из простых ионов
Это соединение состоит из простых ионов 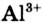 и сложных ионов
и сложных ионов 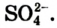 Относительную формульную массу соединения можно вычислить двумя способами.
Относительную формульную массу соединения можно вычислить двумя способами.
1 способ. Используем относительные атомные массы:
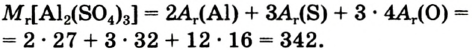
2 способ. Используем относительные формульные массы ионов:
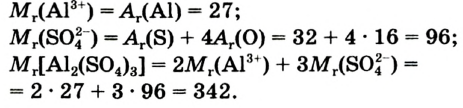
Относительная формульная масса — это относительная масса формульной единицы вещества.
Понятие «относительная формульная масса» является универсальным. Оно может быть использовано для веществ любого строения, а также для ионов — простых и сложных.
Значение относительной формульной массы 100 имеют соединения с формулами 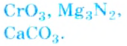
Выводы:
Относительная молекулярная масса — это отношение массы молекулы к 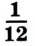 массы атома Карбона или сумма относительных масс атомов, которые входят в состав молекулы.
массы атома Карбона или сумма относительных масс атомов, которые входят в состав молекулы.
Для ионов, веществ атомного и ионного строения используют относительную формульную массу. Ее обозначают и вычисляют так же, как и относительную молекулярную массу.
Массовая доля элемента в сложном веществе
Каждое сложное вещество (химическое соединение) образовано несколькими элементами. Знать содержание элементов в соединении необходимо для его эффективного использования. Например, лучшим азотным удобрением считают то, в котором содержится наибольшее количество Нитрогена (этот элемент необходим растениям). Аналогично оценивают качество металлической руды, определяя, насколько она «богата» на металлический элемент.
Содержание элемента в соединении характеризуют его массовой долей. Эту величину обозначают латинской буквой w («дубль-вэ»). Выведем формулу для вычисления массовой доли элемента в соединении по известным массам соединения и элемента. Обозначим массовую долю элемента буквой х. Приняв во внимание, что масса соединения — это целое, а масса элемента — часть от целого, составляем пропорцию:
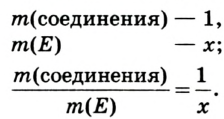 Отсюда:
Отсюда: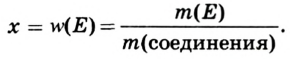
Массовая доля элемента в соединении — это отношение массы элемента к соответствующей массе соединения.
Заметим, что массы элемента и соединения нужно брать в одинаковых единицах измерения (например, в граммах).
Массовая доля не имеет размерности. Ее часто выражают в процентах. В этом случае формула соединениях принимает такой вид: 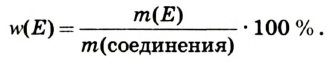
Очевидным является то, что сумма массовых долей всех элементов в соединении равна 1 (или 100 %). Приведем несколько примеров решения расчетных задач. Условие задачи и ее решение оформляют таким образом.
В двух соединениях Сульфура- массовые доли элементов одинаковы и составляют по 0,5(или 50%)
массовые доли элементов одинаковы и составляют по 0,5(или 50%)
Лист тетради или классную доску делят вертикальной линией на две неодинаковые части. В левой, меньшей, части сокращенно записывают условие задачи, проводят горизонтальную линию и под ней указывают то, что нужно найти или вычислить. В правой части записывают математические формулы, объяснение, расчеты и ответ.
Пример №3
В 80 г соединения содержится 32 г Оксигена. Вычислить массовую долю Оксигена в соединении.
Дано:
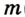 (соединения)
(соединения) 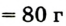
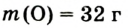
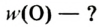
Решение
Рассчитываем массовую долю Оксигена по соответствующей формуле:
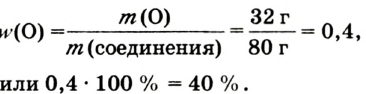 Ответ:
Ответ: 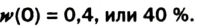
Массовую долю элемента в соединении также вычисляют, используя химическую формулу соединения. Поскольку массы атомов и молекул пропорциональны относительным атомным и молекулярным массам, то
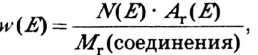
где N(E) — количество атомов элемента в формуле соединения.
Пример №4
Рассчитать массовые доли элементов в метане СН4.
Дано:
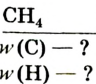
Решение
1. Находим относительную молекулярную массу метана: 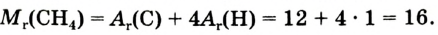
2. Рассчитываем массовую долю Карбона в метане:
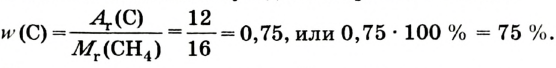
3. Вычисляем массовую долю Гидрогена в метане:
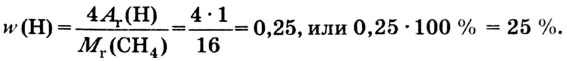
Другой вариант расчета массовой доли Гидрогена: 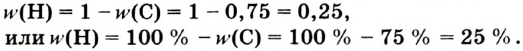
Ответ: 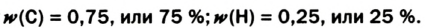
По известной массовой доле элемента можно рассчитать массу элемента, которая содержится в определенной массе соединения. Из математической формулы для массовой доли элемента вытекает:
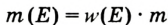 (соединения).
(соединения).
Пример №5
Какая масса Нитрогена содержится в аммиачной селитре (азотное удобрение) массой 1 кг, если массовая доля этого элемента в соединении равна 0,35?
Дано:
 (соединения)
(соединения) 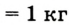
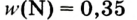
Решение
Вычисляем массу Нитрогена: 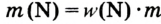 (соединения)
(соединения) 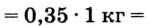
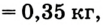 или 350 г.
или 350 г.
Ответ: 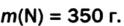
Понятие «массовая доля» используют для характеристики количественного состава смесей веществ. Соответствующая математическая формула имеет такой вид:
Выводы:
Массовая доля элемента в соединении — это отношение массы элемента к соответствующей массе соединения.
Массовую долю элемента в соединении вычисляют по известным массам элемента и соединения или по его химической формуле.
Зная массовую долю элемента, можно рассчитать его массу, которая содержится в определенной массе соединения.
Химические реакции
На уроках природоведения вы узнали, что в природе происходят различные физические и химические явления.
Каждый из вас неоднократно наблюдал за тем, как плавится лед, кипит или замерзает вода. Лед, вода и водяной пар состоят из одних и тех же молекул, поэтому они являются одним веществом (в разных агрегатных состояниях).
Явления, при которых вещество не превращается в другое, называют физическими.
К физическим явлениям относится не только изменение агрегатного состояния веществ, но и свечение раскаленных тел, прохождение электрического тока в металлах, распространение запаха веществ в воздухе, растворение жира в бензине, притяжение железа к магниту. Такие явления изучает наука физика.
Химические явления (химические реакции). Одним из химических явлений является горение.
 Рис.46.Горение спирта
Рис.46.Горение спирта
Рассмотрим процесс горения спирта (рис. 46). Он происходит при участии кислорода, который содержится в воздухе. Сгорая, спирт, казалось бы, переходит в газообразное состояние подобно тому, как вода при нагревании превращается в пар. Но это не так. Если газ, полученный в результате сгорания спирта, охладить, то часть его сконденсируется в жидкость, но не в спирт, а в воду. Другая часть газа останется. С помощью дополнительного опыта можно доказать, что этот остаток — углекислый газ. Таким образом, спирт, который горит, и кислород, который участвует в процессе горения, превращаются в воду и углекислый газ.
Явления, при которых одни вещества превращаются в другие, называют химическими явлениями, или химическими реакциями.
Вещества, вступающие в химическую реакцию, называют исходными веществами, или реагентами, а те, которые образуются, — конечными веществами, или продуктами реакции.
Суть рассмотренной химической реакции передает такая запись:
спирт + кислород 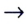 вода + углекислый газ
вода + углекислый газ
исходные вещества (реагенты) конечные вещества (продукты реакции)
Реагенты и продукты этой реакции состоят из молекул. Во время горения создается высокая температура. В этих условиях молекулы реагентов распадаются на атомы, которые, соединяясь, образуют молекулы новых веществ — продуктов. Следовательно, все атомы во время реакции сохраняются.
Если реагентами являются два ионных вещества, то они обмениваются своими ионами. Известны и другие варианты взаимодействия веществ.
Внешние эффекты, сопровождающие химические реакции
Наблюдая за химическими реакциями, можно зафиксировать такие эффекты:
 изменение цвета (рис. 47, а);
изменение цвета (рис. 47, а); выделение газа (рис. 47, б);
выделение газа (рис. 47, б); образование или исчезновение осадка (рис. 47, в);
образование или исчезновение осадка (рис. 47, в); появление, исчезновение или изменение запаха;
появление, исчезновение или изменение запаха; выделение или поглощение теплоты;
выделение или поглощение теплоты; появление пламени (рис. 46), иногда — свечение.
появление пламени (рис. 46), иногда — свечение.
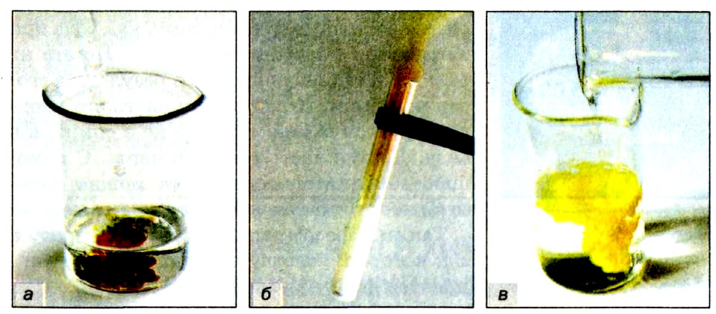
Рис.47.Некоторые внешние эффекты при химических реакциях:
а — появление окраски; б — выделение газа;
в — появление осадка
Химические реакции в природе, повседневной жизни и их значение
В природе постоянно происходят химические реакции. Вещества, растворенные в реках, морях, океанах, взаимодействуют между собой, некоторые реагируют с кислородом. Растения поглощают из атмосферы углекислый газ, из почвы — воду, растворенные в ней вещества и перерабатывают их на белки, жиры, глюкозу, крахмал, витамины, другие соединения, а также на кислород. Очень важны реакции с участием кислорода, который поступает в живые организмы при дыхании.
Вследствие фотосинтеза ежегодно из атмосферы поглощается около 300 млрд т углекислого газа, выделяется 200 млрд т кислорода и образуется 150 млрд т органических веществ.
Многие химические реакции сопровождают нас в повседневной жизни. Они происходят во время поджаривания мяса, овощей, выпекания хлеба, прокисания молока, брожения виноградного сока, отбеливания тканей, горения различных видов топлива, затвердевания цемента и алебастра, почернения со временем серебряных украшений и т. п.
Химические реакции составляют основу таких технологических процессов как получение металлов из руд, производство удобрений, пластмасс, синтетических волокон, лекарств, других важных веществ. Сжигая топливо, люди обеспечивают себя теплом и электричеством. С помощью химических реакций обезвреживают токсичные вещества, перерабатывают промышленные и бытовые отходы.
Протекание некоторых реакций приводит к негативным последствиям. Ржавление железа сокращает срок работы разных механизмов, оборудования, транспортных средств, приводит к большим потерям этого металла. Пожары уничтожают жилье, промышленные и культурные объекты, исторические ценности. Большинство пищевых продуктов портится вследствие их взаимодействия с кислородом, находящимся в воздухе; при этом образуются вещества, которые имеют неприятный запах, вкус и являются вредными для человека.
Выводы:
Физическими явлениями называют явления, при которых каждое вещество сохраняется.
Химические явления, или химические реакции, — это превращения одних веществ в другие. Они могут сопровождаться различными внешними эффектами. Множество химических реакций происходят в окружающей среде, в растениях, организмах животных и человека, сопровождают нас в повседневной жизни.
Схема химической реакции
Существует несколько способов записи химических реакций. Со "словесной" схемой реакции вы ознакомились в § 13. Приводим еще один пример:
- сера + кислород
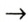 сернистый газ.
сернистый газ.
Эта запись дает мало информации; она не указывает на химический состав реагентов и продуктов.
Этого недостатка лишен другой способ записи — химическая схема реакции. В ней вместо названий веществ содержатся химические формулы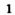 :
:
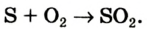
Химическую схему в дальнейшем будем называть просто схемой реакции.
Над стрелкой часто указывают условия, при которых происходит реакция: нагревание 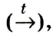 повышенное давление
повышенное давление 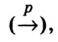 освещение
освещение 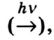 наличие дополнительных веществ
наличие дополнительных веществ 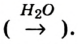 Если продуктом реакции является газ, то после его формулы записывают стрелку, направленную вверх
Если продуктом реакции является газ, то после его формулы записывают стрелку, направленную вверх  а если образуется осадок, — стрелку, направленную вниз
а если образуется осадок, — стрелку, направленную вниз В случаях, когда и продукт, и реагент — газы или нерастворимые вещества, вертикальные стрелки не ставят. Иногда под формулами реагентов и продуктов пишут их названия.
В случаях, когда и продукт, и реагент — газы или нерастворимые вещества, вертикальные стрелки не ставят. Иногда под формулами реагентов и продуктов пишут их названия.
 Для серы здесь и далее будем использовать формулу S, а не
Для серы здесь и далее будем использовать формулу S, а не  которую в действительности имеют молекулы вещества.
которую в действительности имеют молекулы вещества.
Пример схемы реакции с дополнительными обозначениями и названиями веществ:
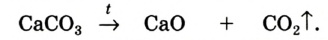
мел негашеная известь углекислый газ
Вам необходимо научиться не только записывать схемы реакций, но и комментировать их. Последнюю схему реакции комментируют так: при нагревании мела образуются негашеная известь и углекислый газ.
Схемы реакций у алхимиков выглядели так:

ртуть сера киноварь
Схема реакции дает возможность сделать важный вывод: все химические элементы во время реакции сохраняются.
Закон сохранения массы веществ при химической реакции
Общеизвестно, что после сжигания бумаги остается пепел, масса которого намного меньше массы бумаги. Если же сильно нагревать (прокаливать) порошок меди или медный предмет на воздухе, то обнаружим противоположное — масса вещества будет возрастать (металл покроется черным налетом).
Осуществим оба химических превращения в закрытых сосудах. Результаты опытов будут другими. Взвесив закрытые сосуды с веществами до и после каждого эксперимента, обнаружим, что суммарная масса веществ в результате реакций не изменяется. Это впервые установил в середине XVIII в. русский ученый М. В. Ломоносов. Не зная об открытии Ломоносова, к аналогичному выводу пришел в 1789 г. французский ученый А.-Л. Лавуазье.
Михаил Васильевич Ломоносов (1711 — 1765)
Выдающийся русский ученый, первый русский академик Петербургской академии наук. Разработал одну из теорий строения веществ (40-е годы XVIII в.). Открыл и сформулировал законы сохранения массы веществ и движения (1748— 1760). Изучал химические свойства металлов, анализировал состав минералов, разработал способы получения минеральных красок, цветного стекла. Внес существенный вклад в развитие «химического языка». Автор книг по истории России, поэт, художник, геолог, географ, инженер, педагог. Один из основателей первого в России Московского университета.

Ломоносов и Лавуазье открыли закон сохранения массы веществ при химической реакции. Он формулируется так:
- масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
Объясним, почему массы пепла и прокаленной меди отличаются от масс бумаги и меди до ее нагревания.
В процессе горения бумаги принимает участие кислород, который содержится в воздухе (рис. 48, а). Следовательно, в реакцию вступают два вещества. Кроме пепла, образуются углекислый газ и вода (в виде пара), которые попадают в воздух и рассеиваются. Их масса превышает массу кислорода. Поэтому масса пепла меньше массы бумаги.
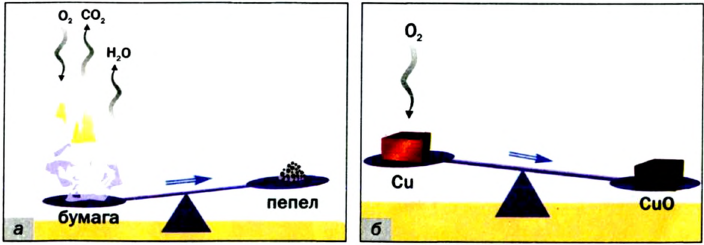
Рис. 48. Реакции бумаги (а) и меди (б) с кислородом
Антуан-Лоран Лавуазье (1743—1794)
Выдающийся французский химик, один из основателей научной химии. Академик Парижской академии наук. Ввел в химию количественные (точные) методы исследования. Экспериментально определил состав воздуха и доказал, что горение — это реакция вещества с кислородом, а вода — соединение Гидрогена с Оксигеном (1774—1777). Составил первую таблицу простых веществ (1789), предложив фактически классификацию химических элементов. Независимо от М. В. Ломоносова открыл закон сохранения массы веществ при химических реакциях.

При нагревании меди кислород воздуха «соединяется» с ней (рис. 48, б). Металл превращается в вещество черного цвета (его формула — СиО, а название — купрум оксид). Очевидно, что масса продукта реакции должна превышать массу меди.
оксид). Очевидно, что масса продукта реакции должна превышать массу меди.
Закон как форма научных знаний
Открытие законов в химии, физике, других науках происходит после проведения учеными многих экспериментов и анализа полученных результатов.

Рис. 49. Опыт, подтверждающий закон Ломоносова — Лавуазье:
а — начало опыта; б — окончание опыта
Закон — это обобщение объективных, независимых от человека связей между явлениями, свойствами и т. д.
Закон сохранения массы веществ при химической реакции — важнейший закон химии. Он распространяется на все превращения веществ, которые происходят и в лаборатории, и в природе.
Химические законы дают возможность прогнозировать свойства веществ и протекание химических реакций, регулировать процессы в химической технологии.
Для того чтобы объяснить закон, выдвигают гипотезы, которые проверяют с помощью соответствующих экспериментов. Если одна из гипотез подтверждается, на ее основе создают теорию. В старших классах вы ознакомитесь с несколькими теориями, которые разработали ученые-химики.
Химическое уравнение
Общая масса веществ при химической реакции не изменяется потому, что атомы химических элементов во время реакции не возникают и не исчезают, а происходит только их перегруппировка. Другими словами, количество атомов каждого элемента до реакции равно количеству его атомов после реакции. На это указывают схемы реакций, приведенные в начале параграфа. Заменим в них стрелки между левыми и правыми частями на знаки равенства:
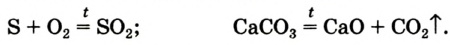
Такие записи называют химическими уравнениями.
Химическое уравнение — это запись химической реакции с помощью формул реагентов и продуктов, которая согласуется с законом сохранения массы веществ.
Существует много схем реакций, которые не соответствуют закону Ломоносова — Лавуазье. Например, схема реакции образования воды: 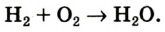
В обеих частях схемы содержится одинаковое количество атомов Гидрогена, но разное количество атомов Оксигена.
Превратим эту схему в химическое уравнение. Для того чтобы в правой части было 2 атома Оксигена, поставим перед формулой воды коэффициент 2: 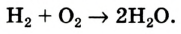
Теперь справа стало четыре атома Гидрогена. Чтобы такое же количество атомов Гидрогена было и в левой части, запишем перед формулой водорода коэффициент 2. Получаем химическое уравнение: 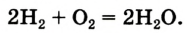
Таким образом, чтобы превратить схему реакции в химическое уравнение, нужно подобрать коэффициенты для каждого вещества (в случае необходимости ), записать их перед химическими формулами и заменить стрелку на знак равенства.
Возможно, кто-то из вас составит такое уравнение: 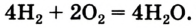 В нем левая и правая части содержат одинаковые количества атомов каждого элемента, но все коэффициенты можно уменьшить, разделив на 2. Это и следует сделать. Ниже представлены различные способы записи рассмотренной реакции.
В нем левая и правая части содержат одинаковые количества атомов каждого элемента, но все коэффициенты можно уменьшить, разделив на 2. Это и следует сделать. Ниже представлены различные способы записи рассмотренной реакции.
Химическое уравнение имеет много общего с математическим.
Словесная схема: водород+кислород вода
вода
Химическая схема: 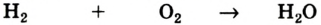
Химическое уравнение: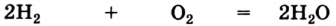
Изображение реакции с помощью моделей молекул:
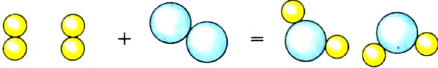
две молекулы молекула кислорода две молекулы воды
Выполним более сложное задание: превратим в химическое уравнение схему реакции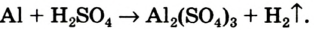
В левой части схемы — 1 атом Алюминия, а в правой — 2. Поставим перед формулой металла коэффициент 2: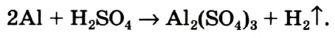
Атомов Сульфура справа в три раза больше, чем слева. Запишем в левой части перед формулой соединения Сульфура коэффициент 3:
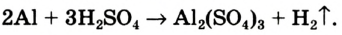
Теперь в левой части количество атомов Гидрогена равно 3 • 2 = 6, а в правой — только 2. Для того чтобы и справа их было 6, поставим перед формулой водорода коэффициент 3 (6 : 2 = 3):
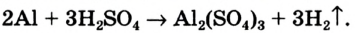
Сопоставим количество атомов Оксигена в обеих частях схемы. Они одинаковы: 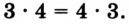 Заменим стрелку на знак равенства:
Заменим стрелку на знак равенства:
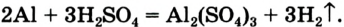
Выводы:
Химические реакции записывают с помощью схем реакций и химических уравнений.
Схема реакции содержит формулы реагентов и продуктов, а химическое уравнение — еще и коэффициенты.
Химическое уравнение согласуется с законом сохранения массы веществ Ломоносова — Лавуазье: масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
Атомы химических элементов во время реакций не появляются и не исчезают, а происходит лишь их перегруппировка.
Как исследуют вещества и химические реакции
Химия — экспериментальная наука. Она не может существовать и развиваться без проведения разнообразных опытов с веществами.
Химический эксперимент
Перед выполнением эксперимента химик должен осознать его цель, найти в научной литературе и проанализировать сведения о соответствующих веществах и химических реакциях. Затем он составляет план эксперимента, определяет условия его осуществления, при необходимости вычисляет массы или объемы веществ, которые нужны для работы. Во время опыта ученый проводит наблюдения, измерения, а
их результаты и вычисления записывает в лабораторный журнал. После эксперимента он анализирует и объясняет полученные результаты, делает выводы.
Исследование веществ
На уроках химии вы будете работать с разными веществами. Вам необходимо уметь описывать их внешний вид, сравнивать с другими веществами, отличать одно вещество от другого. Некоторые навыки вы уже приобрели, выполнив практическую работу и лабораторные опыты.
Химики изучают прежде всего новые, только что полученные вещества. Если вещество содержит примеси, его очищают. Иногда исследуют известные вещества, чтобы подтвердить или уточнить сведения о них.
Изучая вещество, определяют:
- его физические свойства;
- качественный и количественный состав;
- внутреннее строение;
- химические свойства.
Вам известно, что установить качественный состав вещества означает выяснить, какими химическими элементами оно образовано.
Некоторые соответствующие опыты можно провести в химическом кабинете или даже дома. Если соединение содержит ионы Лития, Натрия, Калия, Кальция, Бария, Купрума, то оно окрашивает пламя в характерный цвет (рис. 50). Это используют в пиротехнике для создания зрелищных фейерверков.


Рис. 50.Окрашивание пламени химическими элементами:
а — Литием;
б — Натрием
Определение элемента в веществе по цвету пламени
Зажгите спиртовку. Погрузите в раствор поваренной соли стеклянную палочку и внесите ее в пламя. В какой цвет оно окрашивается?
После охлаждения палочки промойте ее в стакане с водой, погрузите в раствор купрум (И) хлорида  и снова внесите в пламя. Что наблюдаете? Погасите пламя спиртовки колпачком. Какие элементы обнаружены вами в соединениях?
и снова внесите в пламя. Что наблюдаете? Погасите пламя спиртовки колпачком. Какие элементы обнаружены вами в соединениях?
Внутреннее строение вещества, или то, какие частицы (атомы, молекулы, ионы) его образуют, а для твердого вещества — и размещение частиц в нем, исследуют с помощью специальных приборов.
На основании полученных знаний о веществе химик предсказывает его способность вступать в те или иные реакции, а затем проверяет свои предположения экспериментально. Он выясняет, взаимодействует ли вещество с водой, металлами, неметаллами, другими веществами, как ведет себя при нагревании.
Свойства вещества, которые проявляются в его способности вступать в определенные реакции, называют химическими.
Таким образом, изучение химических свойств вещества является завершающим этапом его исследования.
Некоторые вещества (например, металл натрий, неметалл фтор) называют химически активными. Они бурно взаимодействуют со многими другими веществами. Такие реакции могут сопровождаться воспламенением или взрывом. Существуют и химически пассивные вещества. Золото ни при каких условиях не взаимодействует с водой, кислородом, кислотами, а для неметалла гелия химические реакции вообще неизвестны.
Химические свойства вещества зависят от его состава и внутреннего строения.
Для многих веществ изучают их воздействие на живые организмы и определяют, вредными или полезными являются они для растений, животных, человека.
Исследование химических реакций
Представим, что вы получили задание — осуществить химическую реакцию между двумя веществами.
Обычно для этого достаточно смешать вещества, т. е. обеспечить контакт их частиц. Твердые вещества предварительно измельчают для увеличения поверхности контакта реагентов. Если твердое вещество реагирует с раствором другого, то их смесь желательно перемешивать. Тогда частицы веществ будут чаще сталкиваться, а вещества — активнее взаимодействовать.
Изучая химическую реакцию, определяют:
- при каких условиях она происходит;
- быстро или медленно она протекает;
- полностью ли реагенты превращаются в продукты;
- происходят ли одновременно другие (побочные) реакции;
- выделяется или поглощается теплота во время реакции;
- каков состав продуктов реакции.
Химические превращения происходят в различных условиях. Одни вещества принимают участие в них как в чистом виде, так и в растворе, другие — только в определенном состоянии. Немало реакций начинается лишь при нагревании, а некоторые газы взаимодействуют между собой при повышенном давлении.
Иногда для осуществления реакции или ее ускорения к реагентам добавляют постороннее вещество — катализатор . Действие катализатора можно продемонстрировать с помощью такого опыта. Если смешать порошки алюминия и иода, то никаких изменений мы не заметим. Добавление капли воды (катализатор) к смеси вызывает бурную реакцию между простыми веществами (рис. 51):
. Действие катализатора можно продемонстрировать с помощью такого опыта. Если смешать порошки алюминия и иода, то никаких изменений мы не заметим. Добавление капли воды (катализатор) к смеси вызывает бурную реакцию между простыми веществами (рис. 51):
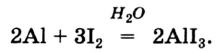
Вам нужно научиться внимательно наблюдать за протеканием химической реакции, описывать все, что происходит с веществами.

Рис. 51. Взаимодействие алюминия с иодом
 Термин происходит от греческого слова katalysis — разрушение.
Термин происходит от греческого слова katalysis — разрушение.
Во время экспериментов возможны ошибки. Они бывают случайными и систематическими. Случайные ошибки возникают из-за неточности записей в лабораторном журнале, невнимательности при взвешивании вещества, определении его объема. Систематические ошибки связаны с погрешностью приборов, наличием примесей в реактивах и обычно не влияют на результат эксперимента.
Исследование химической реакции
Насыпьте в пробирку немного порошка купрум 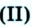 оксида СиО и добавьте 1—2 мл хлоридной кислоты
оксида СиО и добавьте 1—2 мл хлоридной кислоты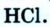 Поставьте пробирку в штатив. Окрасилась ли жидкость после осаждения купрум
Поставьте пробирку в штатив. Окрасилась ли жидкость после осаждения купрум  оксида? Через 5—7 мин. повторите наблюдение. Зажгите спиртовку, закрепите пробирку в пробиркодержателе и осторожно нагрейте сначала всю пробирку, а потом — ту ее часть, в которой находятся вещества. Что наблюдаете? Сделайте вывод о влиянии нагревания на протекание реакции. Напишите уравнение реакции, учитывая, что ее продуктами являются купрум
оксида? Через 5—7 мин. повторите наблюдение. Зажгите спиртовку, закрепите пробирку в пробиркодержателе и осторожно нагрейте сначала всю пробирку, а потом — ту ее часть, в которой находятся вещества. Что наблюдаете? Сделайте вывод о влиянии нагревания на протекание реакции. Напишите уравнение реакции, учитывая, что ее продуктами являются купрум хлорид
хлорид 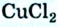 и вода.
и вода.
После проведения серии опытов ученый обнаруживает определенную закономерность. На основании многих закономерностей создается теория. Совокупность теорий является основой каждой науки.
Выводы:
Перед тем как исследовать вещество или химическую реакцию, нужно осознать цель эксперимента и тщательно подготовиться к его проведению.
Во время химического эксперимента наблюдают за веществами, протеканием реакции, осуществляют измерения. Результаты наблюдений и измерений, все вычисления, а также химические уравнения записывают в лабораторном журнале.
После окончания эксперимента формулируют выводы и планируют следующие эксперименты.
Каждое вещество обладает химическими свойствами, которые проявляются в его способности вступать в определенные химические реакции.
Что изучает химия
В целях улучшения и облегчения своих жизненных условий люди постоянно осуществляют сложные превращения, химические процессы, получая таким путём из существующих в природе веществ новые вещества (пластмассы, синтетические каучуки и волокна, лекарственные препараты и др.) (рис. 1).

Изучением и реализацией этих процессов занимается наука химия.
Химия - это наука о веществах, их составе, строении, методах получения, свойствах, превращениях друг в друга и явлениях, сопровождающих эти превращения.
Вещества в природе не остаются в неизменном виде, они постоянно превращаются друг в друга, переходя из одного состояния в другое. Например, в классной комнате с закрытыми дверью и окнами к концу урока в воздухе кислород уменьшается, а количество углекислого газа -увеличивается. Вот почему во время перемены классную комнату следует проветрить. Зелёные растения, поглощая в процессе роста из воздуха углекислый газ, а из почвы - воду и минеральные вещества, вырабатывают из них для себя необходимые органические вещества и обогащают воздух кислородом. Вещества, образовавшиеся в результате разложения остатков растений и животных, делают почву плодородной.
Химия тесно связана с другими науками (биология, физика, математика, медицина, астрономия, география, познание мира, изобразительное искусство и др.) (схема 1).
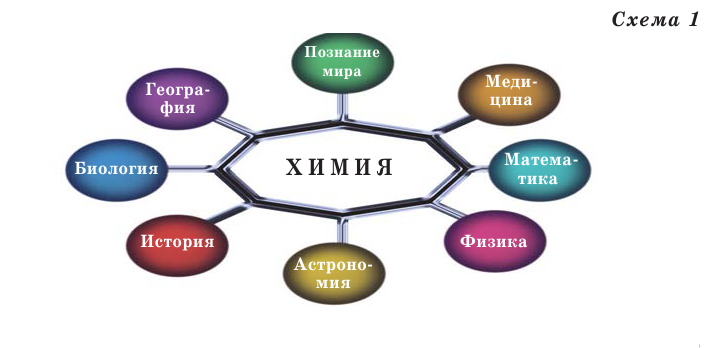
Так, например, строение веществ и их свойства химия изучает совместно с физикой, процессы, протекающие в живых организмах, - с биологией, строение Земли и явления, происходящие в её нижних слоях, - с географией.
Велика роль химии в развитии различных отраслей промышленности и сельского хозяйства. Без использования достижений современной химии невозможно развитие топливно-энергетических комплексов, металлургии, транспорта, связи, строительства, электроники, сферы быта, услуг и др.
Химия - это наука, обладающая чрезвычайно широкими областями применения (схема 2).
Области применения химии
Схема 2

Знакомство с химической лабораторией
Устройство лабораторного штатива:
Устройство железного штатива, используемого в лаборатории, показано на рис. 2. Данный штатив применяется для закрепления приборов, используемых с целью проведения различных химических опытов. Например, при закреплении в штативе пробирки (колбы), она должна быть зажата так, чтобы не выпадала и не лопнула, и в то же время ее можно было передвигать. При сильном сжатии она может лопнуть. Пробирку (колбу) следует закреплять на штативе не на середине, а ближе к отверстию, чтобы легче было ее нагревать.
Чтобы вынуть пробирку из штатива, следует сначала ослабить винт лапки, затем осторожно снять.
При нагревании жидкости в стакане или в колбе на кольцо штатива помещают асбестовую сетку. Нагревание же жидкости в фарфоровой чашке проводится без сетки.
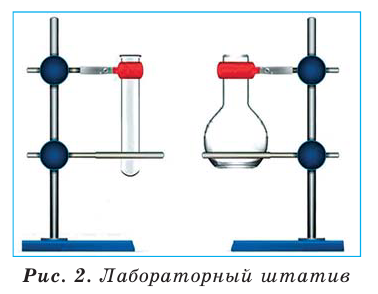
Строение пламени:
Если внимательно вглядеться в пламя, образующееся при горении веществ, в составе которых содержится углерод, то можно увидеть, что оно состоит из трех частей (рис. 3). В его нижней части (3) происходит смешивание газа с воздухом. Если быстро поднести головку спички в эту часть пламени и подержать там некоторое время, то спичка загорается не сразу. Значит, в данной части пламени температура невысокая. Если в нижнюю часть пламени внести стеклянную трубочку и приблизить к ее отверстию зажженную спичку, то появится пламя. Это свидетельствует о том, что в нижней части пламени имеются несгоревшие газы.
Средняя часть пламени (2) является самой яркой. Это объясняется тем, что в данной части под воздействием относительно высокой температуры происходит разложение продуктов, содержащих углерод, при этом частицы угля, сильно накаляясь, излучают свет.
Во внешней части пламени (1) происходит полное сгорание газов, в итоге образуются оксид углерода  и вода
и вода  Вследствие этого, в данной части пламя не светится.
Вследствие этого, в данной части пламя не светится.
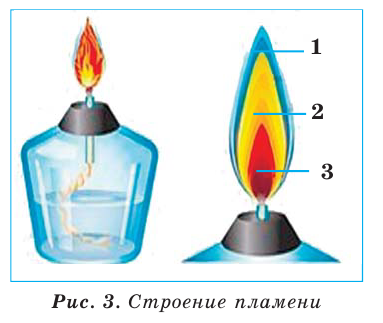
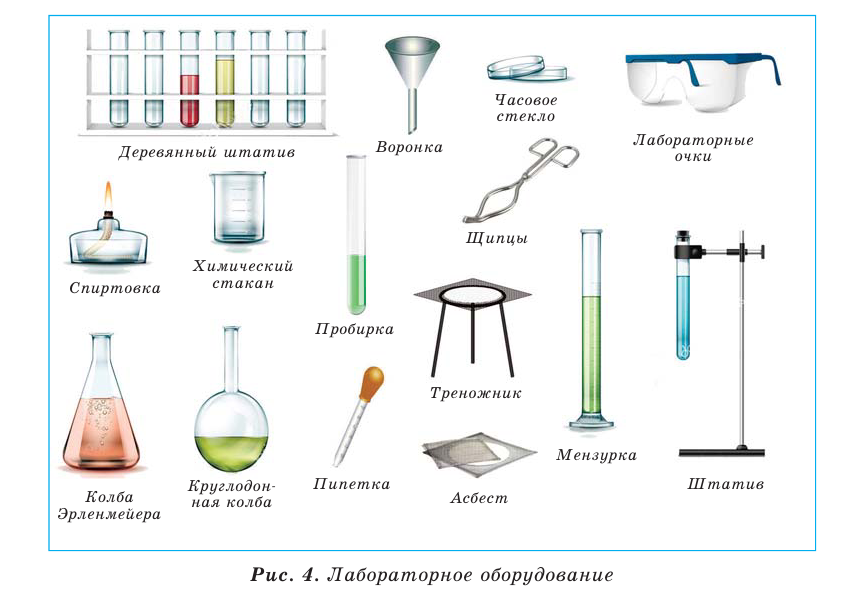
Правила техники безопасности при работе в химической лаборатории
При работе в химической лаборатории с веществами следует строго придерживаться следующих правил техники безопасности.
- Нельзя брать вещества руками, пробовать их на вкус, нюхать с близкого расстояния.
- Для определения запаха веществ следует лёгким движением руки направить выделяющиеся от них газ или пар в сторону носа (рис. 5).

- Брать необходимый реактив следует после изучения этикетки. После их использования надо закрыть их плотно, не спутав пробки, и поставить на место.
- При проведении опыта всегда надо пользоваться чистыми лабораторными сосудами.
- Во время опыта следует использовать вещества по возможности в малых дозах.
- Остатки веществ после проведённого опыта не следует вновь вливать обратно в сосуд с чистым веществом.
- Опыты с летучими, ядовитыми, огнеопасными веществами с плохим запахом обязательно следует проводить в вытяжном шкафу.
- Если кислота пролилась на руку, её надо немедленно промыть большим количеством воды (лучше горячей водой) и раствором 2%-ной соды, после этого смазать вазелином и перевязать бинтом. Если в глаз попала кислота, его надо промыть 2%-ным чистым раствором соды и высушить полотенцем, для устранения боли следует закапать в глаз 1-2 капли касторового масла.
- Если под действием щелочи на коже появится ожог, то это место следует тщательно промыть вначале горячей водой, затем
- 2%-ным уксусом или раствором борной кислоты, намазать борным вазелином или 5% -ным раствором перманганата калия и перевязать бинтом. При попадании щёлочи в глаз вначале следует промыть глаза 1%-ным раствором борной кислоты, а затем закапать 1-2 капли касторового масла.
- При ожоге кожи (рук, лица) фосфором, место от ожога следует промыть 1%-ным раствором медного купороса.
- При отравлении газом пострадавшего следует вывести на свежий воздух и дать понюхать ему раствор аммиака.
- При отравлении различными веществами необходимо использовать следующие обезвреживающие вещества: при отравлении кислотами - оксид магния, известковую воду, смесь муки с водой (болтушка); при отравлении щелочами - 1%-ный уксус или раствор лимонной кислоты; в случае неопознания отравляющего вещества - в качестве универсального обезвреживающего вещества следует принять смесь из 2-х частей активированного угля и 1-ой части оксида магния.
При работе с газовой горелкой, спиртовкой, электронагревателем соблюдайте следующие правила:
- Для того, чтобы зажечь газовую горелку, горящую спичку следует поднести к отверстию горелки и осторожно открывать газовый кран (рис. 6).
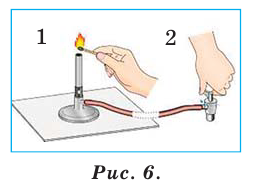
- Если во время работы пламя горелки проскакивает, немедленно закройте газовый кран. После того как горелка остынет, закройте регулятор подачи воздуха и вновь зажгите горелку.
- Если пламя горелки желтого цвета, это значит, что в горелку не поступает достаточно воздуха. В таком случае, следует открыть регулятор подачи воздуха, чтобы пламя стало ярким (рис. 7).
- После завершения работы следует проверить, закрыт ли газовый кран.
- Если в помещении чувствуется запах газа, категорически запрещается зажигать спички.
- При работе со спиртовкой ее не следует зажигать от другой спиртовки, т.к. спирт может пролиться и вызвать пожар (рис. 8, а).
- Для того, чтобы погасить пламя спиртовки, ее следует закрыть колпачком (рис. 8, б).
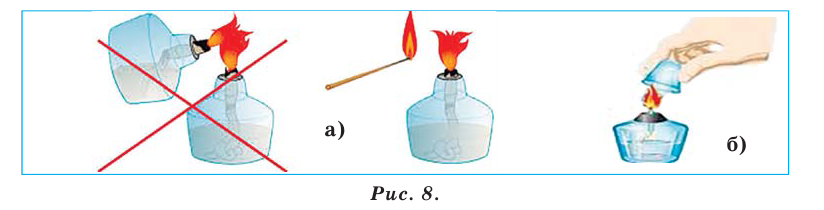
- Прежде чем подключить электронагреватель к сети, следует проверить, не повреждена ли изоляция электрического провода нагревателя.
- После окончания работы обязательно отключите электронагреватель от сети.
- При повреждениях электричеством: следует разъединить контакт сухим деревом или резиновыми перчатками; пострадавшему необходимо производить в течение определённого времени искусственное дыхание, дать кислород; укрыть пострадавшего и со всех сторон поставить нагреватели.
Химия и прогресс человечества
Материал параграфа поможет вам:
- оценить значение новых веществ и материалов в современной жизни;
- выяснить пути развития современной химической технологии;
- понять, почему роль науки химии и химических знаний в наше время возрастает.
Новые вещества. Ученые-химики синтезируют много новых соединений. Они определяют их состав, строение, исследуют свойства, предлагают сферы и способы практического применения этих соединений.
Возрастает количество новых лекарств. Они содержат вещества, которые эффективнее, чем обычные средства, помогают лечить людей, укреплять их здоровье. Благодаря современным лекарственным препаратам удалось победить некоторые болезни, которые ранее считались неизлечимыми.
Сельское хозяйство ныне имеет широкий выбор химических средств защиты растений от болезней и вредителей. Эти вещества успешно применяют и те, кто выращивает овощи и фрукты на приусадебном участке.
Трудно оценить количество производимых косметических средств. Многие из веществ, полученных в химических лабораториях, входят в состав кремов, гелей, лосьонов; они благотворно влияют на кожу, волосы.
Новые вещества применяют и в строительстве. Это красивые и устойчивые краски, лаки, заменители цемента. В последнее время появились эффективные средства бытовой химии — стиральные порошки, клеи, жидкости и пасты для чистки и дезинфекции.
Новые материалы. Сегодня люди уже не могут обойтись без полимеров и пластмасс — на работе, учебе, в повседневной жизни, на отдыхе (схема 4). XX век стал эрой открытия этих веществ и материалов на их основе. Они стремительно входят во все сферы нашей жизни.
Схема 4

В современном строительстве широко используют разные искусственные покрытия, облицовочную плитку, металлопластиковые окна и двери, полимерные герметики и изоляционные материалы. Это позволяет экономить древесину, беречь лесные насаждения.
Из каучука, наиболее распространенного полимера, производят автомобильные шины. В транспортных средствах все больше металлических деталей и оборудования заменяют пластмассовыми. Из искусственных материалов изготовляют современную мебель, предметы домашнего обихода, бытовую технику. Благодаря этому изделия имеют привлекательный вид, они удобны, легки, прочны. Каждый из вас пользуется письменными принадлежностями, папками, различными пленками, пакетами, изготовленными из синтетических полимеров.
За последние десятилетия с внедрением полимеров значительно изменилось и усовершенствовалось спортивное оборудование.
Синтетические волокна являются более долговечными и прочными, чем натуральные. Из искусственных материалов в сочетании с природными производят все больше одежды и обуви.
Это интересно. Пластмассы с наполнителем из алмазной пыли являются прекрасными шлифовальными материалами.
Новые материалы применяют и в медицине. Благодаря химической устойчивости, прочности, совместимости с организмом их используют для протезирования в стоматологии и ортопедии, в хирургических операциях.
Космическая техника выдвигает к новым материалам жесткие требования, среди которых — способность выдерживать высокие температуры и глубокий вакуум, устойчивость к различным излучениям. Своими успехами в освоении космического пространства человечество во многом обязано достижениям химии. Новые химические технологии. Россия является государством с развитой промышленностью. На отечественных заводах производят минеральные удобрения, полимеры и пластмассы, цемент, стекло, нефтепродукты. Основу каждого технологического процесса составляют химические реакции. С учетом результатов научных исследований разрабатываются и внедряются новые технологии с комплексным использованием природного сырья, оптимизируются способы переработки и утилизации промышленных и бытовых отходов.
С химическими технологиями неразрывно связана система мероприятий по охране окружа ющей среды. При участии химиков внедряются аффективные методы очистки воды, удаления вредных веществ из газовых выбросов промы-шленных предприятий и транспортных средств.
Наше поколение стало свидетелем становления новой отрасли науки нанотехнологни. Объектом ее изучения являются частицы, размеры которых выражают в нанометрах (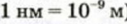 ). По своим свойствам такие частицы отличаются от отдельных атомов и молекул, а также от значительно больших частиц — кристалликов, капелек. Катализаторы, состоящие из наноча-стиц, оказались намного эффективнее обычных, а молекулы лекарственных препаратов, «спрятанные» в частицах такого размера, могут избирательно лечить тот или другой внутренний орган, уничтожать злокачественные опухоли. Наноматерналы являются перспективными для применения и в других сферах.
). По своим свойствам такие частицы отличаются от отдельных атомов и молекул, а также от значительно больших частиц — кристалликов, капелек. Катализаторы, состоящие из наноча-стиц, оказались намного эффективнее обычных, а молекулы лекарственных препаратов, «спрятанные» в частицах такого размера, могут избирательно лечить тот или другой внутренний орган, уничтожать злокачественные опухоли. Наноматерналы являются перспективными для применения и в других сферах.
Химические знания. Химия — один из основных предметов в среднем образовании каждой страны. Знания по химии, которые получают школьники от учителя, из учебников, помогают им правильно обращаться с веществами и материалами, понимать необходимость здорового способа жизни, охраны природы.
Достижения химической науки находят практическое применение. Эту науку, несомненно, ждет успешное развитие и большие перспективы.
Выводы:
Благодаря достижениям химической науки человек использует все больше новых веществ и материалов.
Ученые-химики совершенствуют технологические процессы с целью улучшения переработки сырья и уменьшения загрязнения окружающей среды.
Химические знания нужны людям для правильного обращения с веществами и материалами, эффективного их применения. Они способствуют становлению в обществе здорового образа жизни, формированию экологического сознания.
Место химии среди наук о природе
Различают три основные науки о природе — физику, химию, биологию. Предметом их изучения является материя, то есть всё существующее, сущее, в целом окружающий нас мир, со всем многообразием его существования и превращений.
Неотъемлемым свойством существования материи является движение. Материя находится в непрерывном движении. Формы этого движения — чрезвычайно разнообразны и взаимосвязаны.
Каждая естественная наука изучает определённую форму движения материи. Физика изучает механическое движение — перемещение тел и масс в пространстве, что является простейшей формой движения, а также физические процессы — электромагнитные, гравитационные, ядерные, связанные с механическим движением, но они не сводятся лишь к нему. Это так называемая физическая форма движения материи. Она присуща абсолютно всем материальным объектам, и потому лежит в основе всех других форм движения. Простейшими её носителями являются элементарные частицы — протоны, нейтроны, электроны и другие.
Химия изучает химическую форму движения материи
Химия — это наука о химической форме движения материи, лежащей в основе развития живой и неживой природы.
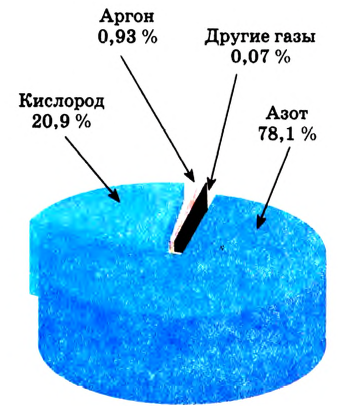
Рис. 130. Состав атмосферы Земли
Химия изучает химическую форму движения материи — химические реакции. Они представляют собой физическую форму движения, например переход электронов от атомов одних элементов к, атомам других элементов, и сопровождаются физическими процессами — поглощением либо высвобождением теплоты или света, изменением цвета и т. д. Но химические процессы не сводятся лишь к физическим формам движения. Простейшим носителем химической формы движения материи является атом, в частности ионизированный.
Итак, химия — это наука о химической форме движения материи, лежащей в основе развития живой и неживой природы. Объектом изучения химии являются химические элементы и их соединения. Именно химические элементы — это те «кирпичики», из которых создана Вселенная. Все химические элементы образовались в результате сложных процессов ядерного синтеза в звёздах и космическом пространстве. Существует много теорий, объясняющих происхождение химических элементов и их распространение на Земле и в Космосе (мы их не рассматриваем).
Наша планета Земля, согласно современным представлениям, образовалась почти 4,7 млрд лет тому назад из рассеянного в околосолнечном пространстве газопылевого вещества. В результате химической эволюции вещества (под влиянием его гравитационного поля, разогрева и частичного расплава в недрах Земли) возникли и сформировались различные по химическому составу, агрегатному состоянию и физическим свойствам геосферные оболочки нашей планеты, например атмосфера, гидросфера, литосфера и биосфера.
Геосферные оболочки Земли: атмосфера, гидросфера,литосфера (земная кора), биосфера
Экзосфера:
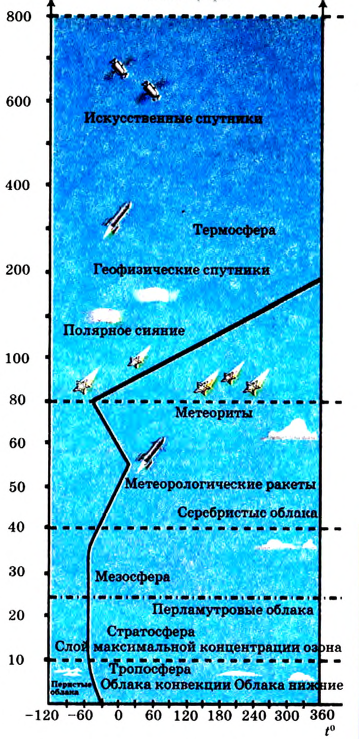
Рис. 131. Строение атмосферы (По Е. П. Митрясовой)
Атмосфера — воздушная оболочка Земли, имеющая определённое строение (рис. 130) и соответствующий состав (табл. 9).
Таблица 9. Приблизительный состав воздуха
| Газ | Доля газа, % | ||
| Название | Формула | Объёмная | Массовая |
|
Азот Кислород Аргон Оксид углерода Другие |
|
78 21 0,93 0,03 0,04 |
75,5 23 1,3 0,05 0,15 |
В состав воздуха входят также пыль, водяной пар и примеси различных газов:  и др. Они отрицательно воздействуют на окружающую среду и здоровье человека.
и др. Они отрицательно воздействуют на окружающую среду и здоровье человека.
Но воздух не всегда был таким. Состав атмосферы изменялся в процессе химической эволюции вещества. Вначале атмосфера (несколько миллиардов лет тому назад) состояла из оксида углерода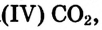 азота
азота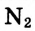 и водяного пара
и водяного пара 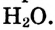 С развитием зелёных растений в атмосфере появляется кислород
С развитием зелёных растений в атмосфере появляется кислород 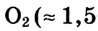 —2 млрд лет). Его содержание с течением времени
—2 млрд лет). Его содержание с течением времени
Кислород 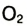 появился в атмосфере Земли
появился в атмосфере Земли  1,5—2 млрд лет тому назад в процессе развития зёленых растений
1,5—2 млрд лет тому назад в процессе развития зёленых растений
возрастало, а в последние 0,5 млрд лет остаётся практически неизменным.
В атмосфере под влиянием ультрафиолетового излучения Солнца происходят различные химические процессы (фото диссоциация, фотоионизация и др.), частично они поглощают губительное излучение Солнца и защищают всё живое на Земле (рис. 138). Но в атмосфере под воз действием природных и в особенности антропогенных факторов наблюдаются также отрицательные явления — озоновые дыры, парниковый эффект (с ними ознакомишься позднее), кислотные дожди и т. д. Атмосферу необходимо защищать от загрязнителей, которые приводят к неблагоприятным последствиям. Следует помнить, что атмосфера — это своеобразный регулятор обменных процессов между Землей и космосом.
Гидросфера — водная оболочка Земли. Воде принадлежит важнейшая роль в геологической истории планеты.
Рис. 132. Процессы, происходящие в атмосфере Земли
Жизнь на Земле зарождалась в воде. Вода стала первоначальной средой для эволюции органического мира. Она входит в состав всех живых организмов. Например, организм человека на 65 % состоит из воды.
Водная оболочка Земли очень тесно связана с газовой оболочкой: атмосфера насыщается водяным паром, а воды Мирового океана поглощают и растворяют атмосферные газы. Поэтому в гидросфере химических элементов больше, чем в атмосфере.
Каждый химический элемент, соединения которого растворимы, осуществляет естественный циклический путь — круговорот.
Круговорот веществ на Земле — это циклические процессы превращения и миграции веществ в природе.
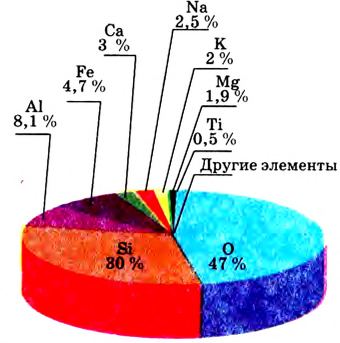
Рис. 133. Состав земной коры. В земной коре есть практически все элементы периодической системы. Но более 99 % её массы составляют 9 элементов:
Вода распространена на Земле очень неравномерно. В морях и океанах сосредоточена основная её масса — 97,3 %. Это солёная вода; кроме кислорода и водорода — компонентов собственно воды, в значительном количестве имеются хлор, натрий, магний, сера, калий, бром, углерод. Морская вода непригодна для употребления. А пресной воды на Земле мало, всего 2,7 %. Известно много районов, где воды катастрофически не хватает, а в некоторых местах она утратила свои свойства и стала непригодна для использования в связи с непродуманными действиями человека. Поэтому проблема охраны водных ресурсов имеет огромное значение.
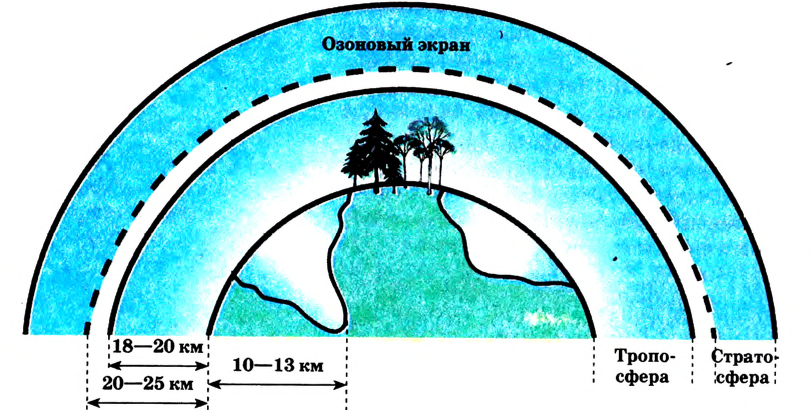
Рис.134.Состав биосферы
Земная кора — верхняя оболочка «твёрдой» Земли. Она имеет разную толщину, её слагают разнообразные горные породы (базальты, граниты, осадочные породы) и минералы (силикаты, алюмосиликаты, карбонаты, сульфиды, сульфаты). В их составе — различные химические элементы, но преобладают кремний, алюминий, железо, кальций, натрий, калий, магний, титан. В земной коре массовая доля данных элементов (вместе с кислородом) составляет почти 99,4 % (рис. 133).
Биосфера — оболочка планеты Земля; включает нижнюю часть атмосферы, гидросферу и верхнюю часть земной коры (рис. 134).
Термин «биосфера» предложил в 1875 г. австрийский учёный Э. Зюсс. Учение о биосфере как активной оболочке Земли, в пределах которой совокупная деятельность живых организмов, в частности человека, проявляется как геохимический фактор планетарного масштаба и значения, создал в 1926 г. российский учёный В. И. Вернадский.
В биосфере живые организмы и среда их обитания органически объединены и взаимодействуют между собой. В живой природе именно вещества осуществляют взаимосвязи между организмами и средой в экосистемах. Человек в процессе своей деятельности часто ухудшает состояние той или иной части биосферы, возникают экологические конфликты, в основе которых лежат реальные химические процессы.
Итак, мы убеждаемся, что материя находится в постоянном движении, изменяется в своей вещественной форме. В результате химическая эволюция веществ способствовала появлению биологической формы движения материи. Она возникла вследствие развития не только веществ, но также их агрегатов, химических систем и процессов, происходящих в этих системах.

Вернадский Владимир Иванович (1863—1945)
Академик и российский естествоиспытатель, создатель геохимии, биогеохимии. Обо гатил науку идеями, которые положили начало развитию ведущих направлений современной минералогии, геологии, гидрогеологии. Начал поиск урана и радия, развил теорию проблем окружающей среды. Инициировал создание Академии наук, её первый президент. Организатор Государственной публичной библиотеки в Киеве, ныне она носит его имя
Клетка — химический реактор. В живой клетке каждую секунду протекают сотни и тысячи химических реакций.
Биологическая форма движения материи невозможна без механической, физической, химической форм, но не исчерпывается ими, поскольку является качественно новой формой движения материи, отличающейся от предыдущих. Простейший носитель биологической формы движения — клетка. В отличие от химических реакций, которые протекают в неживых системах и базируются на столкновении беспорядочно расположенных в пространстве молекул, в клетке взаимодействуют молекулы, закреплённые там пространственно. Живые системы состоят преимущественно из углерода, водорода, азота, кислорода и фосфора. Правильное понимание биологии, в частности молекулярной, базируется на подробном знании структур, свойств и реакционной способности биомолекул. Эти фундаментальные знания приобретаются в процессе изучения химии.
Выводы:
Понятие «материя» охватывает все объекты, системы, свойства, связи и формы движения, реально существующие в мире, от элементарных частиц до Галактик. Особый тип материальных систем — живая материя.Различают несколько основных форм движения материи, например физическая, химическая, биологическая. Такая классификация имеет объективный характер, поскольку отображает объективное развитие материи от простого к сложному, от низших форм к высшим. Одновременно она является классификацией наук, изучающих эти формы движения материи. Следовательно среди наук о природе химия находится между физикой и биологией. Химические знания в значительной степени формируются на основе физических и, в свою очередь, являются основой для накопления биологических знаний. В природе существует круговорот — циклическое движение атомов химических элементов, охватывающее все оболочки Земли. Благодаря циклической миграции атомов осуществляется обмен веществ (и энергии) между земной корой, гидросферой и атмосферой. Определяющий фактор циклической миграции — живое вещество, активно действующее на поверхности земной коры, в нижних слоях атмосферы и Мировом океане. Геохимическая деятельность живого вещества способствовала возникновению особой оболочки Земли — биосферы. На природные процессы значительное влияние оказывает жизнедеятельность человека, в результате которой возникают глобальные экологические проблемы.
Роль химии в жизни общества

Рис. 135. Химическая лаборатория
Изучение химии как одной из фундаментальных естественных наук необходимо для формирования научного мировоззрения, развития образного и логического мышления, творческого роста будущих специалистов. Большое значение имеет химия и в жизни каждого человека, в его повседневной практической деятельности.
«Широко простирает химия руки свои в дела человеческие» — эти слова великого российского учёного Михаила Ломоносова, сказанные им почти 250 лет назад, и в наши дни не утратили своего значения, напротив, звучат с особой силой. Ведь сейчас, как никогда, велика роль химических соединений, процессов и в целом химических знаний в жизни общества. «Век химии», «Век полимеров» — эти образные характеристики не являются преувеличением. Они наглядно отображают объективный факт беспрецедентного по своей значимости, масштабности и последствиям вторжения химии в разнообразнейшие сферы деятельности человека, всей жизни общества.

Рис. 136. Лекарственные препараты

Рис. 137. Ядерный реактор

Рис. 138. Цементовоз
Известно, что наибольшее значение для промышленности и сельского хозяйства, транспорта, обороны страны и бытовых потребностей имеет твёрдое, жидкое и газообразное топливо. Химия занимает ключевые позиции в разработке процессов производства разных видов топлива, создании ракетного топлива и окислителей для него. Совместно с физикой разработаны научные основы получения топлива для ядерных реакторов. В связи с уменьшением запасов природного газа и нефти химики уже сегодня заботятся о топливе будущего. Так, предполагается добыча синтетического газа метана из каменного угля:
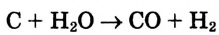 (конверсия угля);
(конверсия угля); 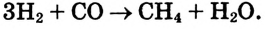
Метод конверсии угля приобретает большое значение также для развития водородной энергетики. Водород как экологически чистое топливо может использоваться всеми видами транспорта.
Не меньшее значение имеет использование этанола  как горючего вместо бензина. Это будет огромным достижением химиков, поскольку продукты сгорания этанола не загрязняют воздух.
как горючего вместо бензина. Это будет огромным достижением химиков, поскольку продукты сгорания этанола не загрязняют воздух.
Итак, химия играет важную роль в современной энергетике.
Промышленное производство невозможно представить без машин и инструментов. Основными материалами для их производства являются металлы и сплавы, которые получают в процессе химической переработки природных минералов. Химия даёт металлургии способы исследования руд с целью определения в них содержания необходимых металлов, способы обогащения сырья и извлечения полезных металлов, интенсификации металлургических процессов, а также способы улавливания, разложения и переработки отходов. Например, доменные шлаки используют для производства шлакоситала — прочного и твёрдого материала, который используется в строительстве.
По комплексу свойств и себестоимости он может конкурировать с любым строительным материалом. Итак, химия имеет большое значение для развития и усовершенствования металлургии.
Благодаря достижениям химии получают не только металлические, но и новые материалы — сверхпроводники, полупроводники, изоляторы, что способствует развитию электротехники и радиоэлектроники. Новые материалы — сверхпрочные, термостойкие и т. д. используются в конструкциях спутников, космических кораблей, ядерных реакторов.

Рис.139.Трубы

Рис. 140. Термостойкие материалы используют в конструкциях ракет
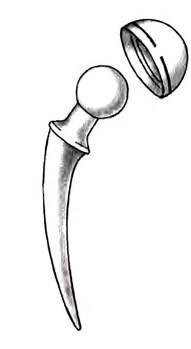
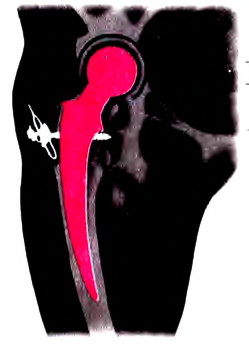
Рис. 141. Искусственный сустав. Из титановых сплавов, сплавов кобальта с хромом (30 %) и молибденом (5—7 %) изготавливают тазобедренный сустав, а для его чашечки используют полиэтилен.
Быстрыми темпами развивается производство полимеров: пластмасс для изготовления деталей машин и механизмов, каучуков для производства шин, покрышек, прокладок; изоляционных материалов; синтетических волокон; искусственной кожи и других кожзаменителей и т. д.
Химия имеет большое значение и для производства продуктов питания. Растениеводству она даёт минеральные и органоминеральные удобрения, средства защиты растений от сорняков, вредителей, болезней, а животноводству — кормовые добавки, витамины, лечебные и санитарные средства. Кроме того, многие процессы пищевой промышленности, которая перерабатывает первичные сельскохозяйственные продукты, тесно связаны с химией — это производство уксуса, спирта, сахара, маргарина, крахмальной патоки, консервантов. Итак, химия глубоко проникла в сельское хозяйство и пищевую промышленность.
Большое значение имеет химия и для здравоохранения. Химические, продукты используют как средства для лечения, дезинфекции, обезболивания, производства кровезаменителей, искусственных суставов, зубных протезов и т. д.
Благодаря таким продуктам, как духи, ванилин, мыло и моющие средства, растворители, лаки, краски, дезинфицирующие вещества, средства для выведения пятен, химия имеет особое значение для человека, его повседневной жизни.
Стремительное развитие химизации во всех отраслях производства сегодня наблюдается во всем мире, что требует переоценки социального значения химии.

Рис. 142. Бетонная плотина
Ещё сравнительно недавно каждое достижение в практическом освоении и изучении химического действия веществ воспринималось как очередное доказательство господства человека над природой и оценивалось как благо для человечества.
А сегодня мы видим другую крайность: появилась своеобразная мода подвергать критике и саму химию, и использование химических продуктов и методов. Химизация производства часто представляется «главным виновником» угрожающего загрязнения окружающей среды, пропагандируется отказ от химизации, от использования искусственных и синтетических продуктов. В сознании обывателя химические продукты ассоциируются с чем-то противоестественным.
Но общеизвестно, что химизация как практическое использование свойств веществ и их превращений в производстве средств жизнедеятельности человека начиналась в те давние времена, когда первобытный человек научился использовать огонь. Реакция горения — это первый химический процесс, практически освоенный человеком и нашедший широкое и разнообразное применение в жизни общества, создании материальных благ, в практическом использовании веществ.
Сегодня химизация — это использование химических процессов и химических материалов во всех отраслях хозяйства, комплексное использование вещества и энергии, которое обеспечивается химическими методами. Элементы

Рис. 143. Анализ качества воды природного водоёма
химизации встречаются даже в тех производствах, где преобладают механические операции и механическая обработка. Например, использование бетона в строительстве, пропитка древесины специальными веществами для уменьшения горючести или гниения, что увеличивает срок использования изделий и, в итоге, повышает производительность труда.
Итак, что касается отрицательного влияния на окружающую среду и здоровье человека, то виновата не собственно химия, а люди, недостаточно химически образованные, либо люди, химические знания которых не достигли функциональности или уже утратили её. Такие люди обычно пренебрегают знаниями о веществах и химических процессах, легко нарушают нормы и правила их использования, проектируют производства без очистных сооружений для их удешевления, закапывают отходы в землю либо сбрасывают в водоёмы, распыляют химикаты и т. д. Их деятельность наносит непоправимый урон здоровью людей и окружающей среде. Такой уровень практической химизации провоцирует столкновение общественного сознания с рядом вопросов химического, технологического, экологического и социального характера.
Завершая базовое химическое образование, ты, безусловно, уже представляешь диалектическую природу химии, её пользу и вред. Понимаешь, каким образом и почему для человечества и природы благом либо злом становятся те могущественные и очень тонкие в своей избирательности химические действия веществ, которые использует человек. И независимо от того, какому профилю обучения ты в дальнейшем отдашь предпочтение, всегда помни о гуманистической направленности химии и старайся реализовать это в своей практической деятельности. Понимая, что такое химия в руках человеческих, всегда совершенствуй свои химические знания, помни об их социальном и общекультурном значении.
Выводы:
Химия как наука не только способствует познанию окружающего мира, это также сфера производственной деятельности человека. С глубокой древности и до наших дней химия всегда служила и продолжает служить человеку, его практической деятельности. Без развития химии невозможно дальнейшее развитие топливно-энергетического комплекса, металлургии, транспорта, строительства, электроники, космической техники, сферы быта и т. д. Проникновение новых веществ и современных материалов, химических методов в основные отрасли промышленного и сельскохозяйственного производства, сферу быта, здравоохранение способствует их прогрессу. Именно поэтому происходит химизация практически всех сфер человеческой деятельности.
Химизация — это использования свойств веществ и материалов, химических процессов и методов анализа в практической деятельности человека, в сфере материального производства. Химизация даёт возможность решать многие вопросы хозяйственной жизни общества, но при этом провоцирует новые проблемы, связанные с состоянием природной среды и здоровьем человека. Современное состояние, химизации остро сталкивает общественное сознание с рядом глобальных проблем (энергетической, сырьевой, продовольственной, экологической), которые волнуют человечество и требуют безотлагательных решений.
Вещества и атомы
Химия так же, как и физика, ботаника, зоология, геология, изучает природу, материальный мир во всём многообразии форм его существования и происходящих явлений.
Все явления в природе и окружающем мире можно разделить на две группы. К первой из них относятся самые разнообразные взаимодействия и изменения тел, при которых меняется только физическое состояние веществ и форма физических тел, образованных этими веществами, а также положение тел в пространстве.
Ко второй группе относятся явления, связанные с превращениями веществ, т. е. с изменением их качественного и количественного состава, строения, физических и химических свойств. Именно эти явления изучает химия.
Химия — это наука о веществах и их превращениях.
Что же такое вещество? Какой физический и химический смысл этого понятия?
Физический смысл понятия «вещество»
Из курса физики вы уже знаете, что материя — это объективная реальность,, т. е. то, что существует независимо от нашего сознания и воспринимается нами с помощью органов чувств или с помощью приборов.
Все разнообразные формы существования материи делятся на два вида: вещество и поле.
Вещество — это материальное образование, состоящее из частиц, имеющих собственную массу. Другими словами, вещество — это материя на разных стадиях её организации от элементарных частиц до сложных образований: элементарные частицы (протоны, нейтроны, электроны и др.)  ядра атомов
ядра атомов  атомы —> ионы
атомы —> ионы молекулы
молекулы  различные агрегаты (объединения) атомов, ионов или молекул в виде твёрдых тел, жидкостей или газов. Поэтому можно сказать, что веществом в физическом смысле является всё то, что обладает массой (более строго — массой покоя). Химический смысл понятия «вещество» рассмотрим в следующем параграфе.
различные агрегаты (объединения) атомов, ионов или молекул в виде твёрдых тел, жидкостей или газов. Поэтому можно сказать, что веществом в физическом смысле является всё то, что обладает массой (более строго — массой покоя). Химический смысл понятия «вещество» рассмотрим в следующем параграфе.
Поле — материальная среда, посредством которой осуществляется взаимодействие между частицами вещества или отдельными телами. Гравитационное, электрическое и магнитное поля — примеры различных видов полей.
Атом
Основным свойством материи, способом её существования является движение. Известны самые различные формы движения материи — физическая, биологическая, геологическая и т. д. Они соответствуют разному уровню организации материи и в то же время связаны между собой и взаимопревращаемы.
Химическая форма движения возникает на уровне атомов. Сейчас вы уже должны хорошо помнить физическое определение понятия атом.
Атом — мельчайшая химически неделимая частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Атомы находятся в природе в различных состояниях. Они могут входить в состав простых и сложных веществ, существовать в виде одиночных атомов или одноатомных ионов. Несмотря на то что общее количество атомов неисчислимо, видов атомов относительно немного. Все атомы данного вида объединяет одно общее качество — одинаковый положительный заряд ядра. Каждый отдельный вид атомов называется химическим элементом.
В Химический элемент — это вид атомов с одинаковым положительным зарядом ядер.
В настоящее время известно 118 химических элементов. Их названия и символы приведены в таблице периодической системы химических элементов на форзаце 1.
Относительная атомная масса
Символ того или иного элемента, а также величина его относительной атомной массы приводятся в клеточках таблицы периодической системы.
Термин «относительный» указывает на то, что это не истинная масса атома, которая выражается в единицах массы, а величина, показывающая, во сколько раз масса данного атома больше массы условного эталона. В качестве такого эталона ещё в начале XIX века английский учёный Дж. Дальтон предложил использовать легчайший из атомов — атом водорода. Но вскоре шведский химик И. Берцелиус ввёл в обиход в качестве эталона кислород, а вернее, 1/16 часть массы его атома. С середины XX века как в физике, так и в химии в качестве единицы атомной массы стали использовать 1/12 часть массы атома углерода, а точнее, одного из его нуклидов — нуклида 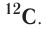 Эта величина получила название атомная единица массы
Эта величина получила название атомная единица массы 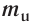 и имеет международное обозначение
и имеет международное обозначение 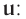
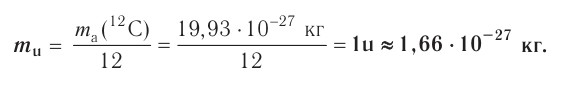
В последнее время её называют постоянной атомной массы.
Сравнивая массы атомов различных элементов с атомной единицей массы, получают численные значения относительных атомных масс химических элементов. Относительная атомная масса обозначается символом  где r — начальная буква латинского слова relativus — относительный.
где r — начальная буква латинского слова relativus — относительный.
Например, масса атома фтора  равна 3,15 •
равна 3,15 • 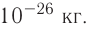 Следовательно, относительная атомная масса фтора:
Следовательно, относительная атомная масса фтора:
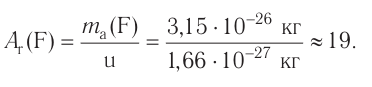
Очевидно, что относительная масса атома углерода  равна 12.
равна 12.
Большинство химических элементов существует в природе в виде смеси нуклидов с разными массовыми числами. Поэтому относительная атомная масса данного элемента является средней величиной массовых чисел всех его природных нуклидов с учётом доли каждого в природной смеси.
В Относительная атомная масса элемента — физическая величина, которая показывает, во сколько раз средняя масса его атомов больше 1/12 части массы атома углерода-12 
По величине относительной атомной массы можно рассчитывать среднюю массу атомов любого элемента X:
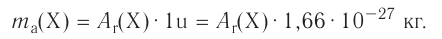
Вещество с физической точки зрения представляет собой материальное образование, обладающее массой (масса покоя).
Химический элемент — вид атомов с одинаковым положительным зарядом ядер.
Химическое вещество и химическая реакция
Мы с вами установили, что химическая форма движения материи возникает на уровне атомов. Атом является веществом в физическом смысле, поскольку обладает массой покоя. Но отдельные атомы не имеют таких свойств, как цвет, запах, плотность, электропроводность и т. п. Атом не находится в каком-то агрегатном состоянии и, следовательно, не имеет ни температуры плавления, ни температуры кипения, т. е. большинства тех свойств, которые присущи химическому веществу.
Молекулы
Как правило, отдельные атомы объединяются между собой в различные агрегаты. Таким образом атомы достигают более устойчивого состояния. Соединяться между собой могут атомы как одного, так и разных химических элементов.
Несколько атомов, например два атома водорода и один атом кислорода, образуют устойчивую группу, способную существовать самостоятельно — молекулу воды 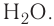 Молекула проявляет определённые химические свойства, т. е. способность вступать в химические реакции с образованием других веществ.
Молекула проявляет определённые химические свойства, т. е. способность вступать в химические реакции с образованием других веществ.
Молекула — наименьшая частица вещества, способная существовать самостоятельно и обладающая его химическими свойствами.
Химический смысл понятия «вещество»
Как правило, отдельные молекулы не обладают такими физическими свойствами, как, например, температуры плавления и кипения, плотность. Такие свойства проявляются только тогда, когда молекулы связаны между собой силами межмолекулярного взаимодействия. Точно так же при объединении отдельных атомов в атомные кристаллы (например, алмаз, графит, металлы) или ионов в ионные кристаллы  проявляются физические и химические свойства соответствующих веществ немолекулярного строения.
проявляются физические и химические свойства соответствующих веществ немолекулярного строения.
Следовательно, только химическое вещество обладает определённым набором как химических, так и физических свойств.
Химическое вещество — это устойчивая совокупность частиц (атомов, ионов или молекул), обладающая определёнными химическими и физическими свойствами.
Каждое химическое вещество обладает определённым составом и строением, от которых зависят его физические и химические свойства.
Простые и сложные вещества
Все вещества можно разделить по составу на два вида. Вещество, которое состоит из атомов одного элемента, называется простым, а состоящее из атомов разных элементов — сложным веществом, или химическим соединением.
Названия большинства простых веществ совпадают с названиями соответствующих химических элементов, поэтому эти понятия необходимо различать (табл. 2).
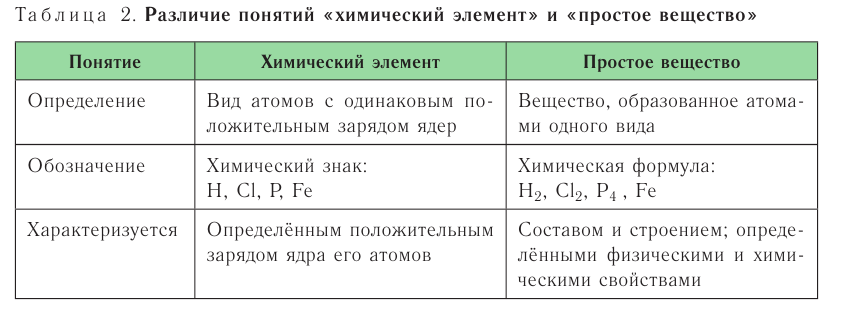
Следует различать качественный состав вещества, который определяется видом атомов элементов, образующих данное вещество, и количественный состав, указывающий число атомов каждого элемента в составе наименьшей структурной единицы (молекулы или формульной единицы) данного вещества.
Вещества молекулярного и немолекулярного строения
Качественный и количественный состав химических веществ отображается в их химических формулах. Формулы веществ молекулярного строения, у которых структурными единицами являются молекулы, называются молекулярными формулами. Примеры молекулярных формул: 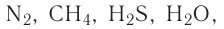
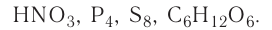
Условно к веществам молекулярного строения относят благородные газы (гелий, аргон и т. д.), рассматривая их атомы как одноатомные молекулы.
Вещества молекулярного строения составляют более 98 % от общего числа известных веществ. При обычных условиях — это газообразные (азот, углекислый газ, ацетилен), жидкие (бром, вода, этиловый спирт) или твёрдые вещества с невысокими температурами плавления (сера, иод, глюкоза).
Вещества немолекулярного строения, как правило, при обычных условиях являются твёрдыми кристаллами. Они состоят из атомов или ионов. Примерами таких веществ являются алмаз, металлы, соли, оксиды металлов, твёрдые основания и др.
Состав простых веществ немолекулярного строения выражается знаками соответствующих элементов без числовых индексов (Fe, Сu, С, Si), а сложных — с помощью эмпирических формул, которые показывают простейшее соотношение числа атомов (или ионов) разных химических элементов в формульных единицах этих веществ.
Следовательно, структурными единицами веществ молекулярного строения являются молекулы, а веществ немолекулярного строения — их формульные единицы.
Вещества молекулярного и немолекулярного строения существенно различаются по своим свойствам (см. табл. 3).
Особенности строения этих двух типов веществ, характер химических связей между частицами в их составе, причины, определяющие различие в свойствах, более подробно мы разберём в главе IV.
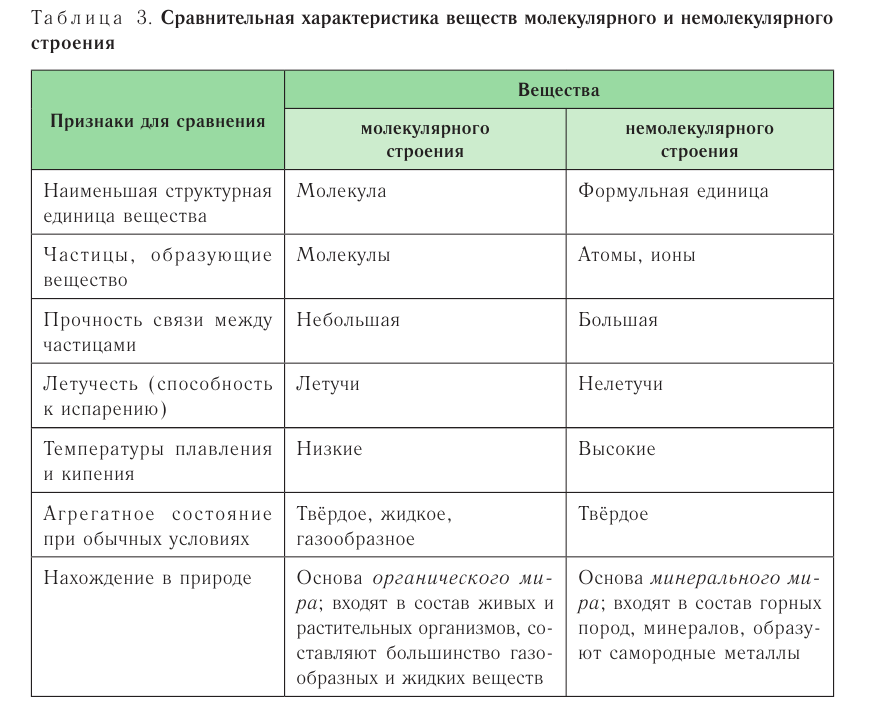
Химическая реакция - что это такое
В самом начале изучения химии вы узнали о том, что атомы — это мельчайшие химически неделимые частицы. Это означает, что в процессе химических превращений они не исчезают и не возникают вновь, а только переходят из одних веществ в другие.
Следовательно, сущность химических реакций сводится к превращению одних веществ в другие без изменения общего числа и природы атомов. При этом меняется состав или строение веществ.
Химическая реакция — это процесс превращения одних веществ в другие без изменения общего числа и природы атомов, из которых состоят эти вещества.
Вопросы, связанные с протеканием химических реакций, подробно рассматриваются в главе V.
Химическим веществом является устойчивая совокупность частиц (атомов, ионов или молекул), обладающая определёнными химическими и физическими свойствами.
Каждое химическое вещество характеризуется определённым качественным и количественным составом, строением, физическими и химическими свойствами.
Структурными единицами веществ молекулярного строения являются молекулы, а немолекулярного — формульные единицы.
Атомы в процессе химических превращений (реакций) не исчезают и не возникают вновь.
Количественные характеристики вещества
Химия как часть естествознания неразрывно связана с наблюдением за происходящими явлениями, их описанием, проведением различных экспериментов и самыми разнообразными количественными измерениями и расчётами. Великий русский химик Д. И. Менделеев говорил: «Наука начинается, когда начинают измерять». В этом заключается научный подход, т. е. метод познания вещества, его свойств, которые выражаются обычно с помощью качественных и количественных характеристик.
Относительная молекулярная и относительная формульная массы вещества
Состав любого вещества определяется формулой его структурной единицы, т. е. молекулярной или эмпирической формулой. Поскольку каждая такая структурная единица состоит из определённого числа атомов химических элементов с определёнными значениями относительных атомных масс, то её масса также может быть выражена относительной величиной.
Такая величина для веществ молекулярного строения носит название относительная молекулярная масса, а для веществ немолекулярного строения — относительная формульная масса. Они имеют одинаковое обозначение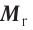 и представляют собой сумму относительных атомных масс всех элементов,, образующих данную структурную единицу вещества, с учётом числа атомов каждого элемента.
и представляют собой сумму относительных атомных масс всех элементов,, образующих данную структурную единицу вещества, с учётом числа атомов каждого элемента.
Например, относительная молекулярная масса фосфорной кислоты 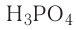 равна:
равна:
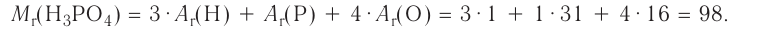
Относительная формульная масса карбоната натрия Na2C03 рассчитывается аналогично:
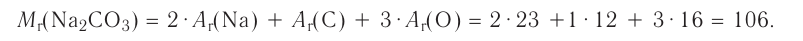
В Относительной молекулярной (формульной) массой вещества Мг называется величина, равная отношению средней массы структурной единицы данного вещества к 1/12 части массы атома нуклида 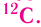
Химическое количество вещества
Абсолютные массы атомов, как вы уже хорошо знаете, очень малы. Однако в обычной химической практике мы имеем дело не с отдельными частицами (атомами, ионами или молекулами): во взаимодействии участвуют такие порции веществ, массы которых измеряются в граммах, килограммах или даже тоннах.
Нетрудно подсчитать, что число частиц, которое содержится в той или иной порции вещества, огромно. Так, в кусочке меди массой 1 г содержится при-
мерно 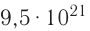 атомов, а в стакане воды массой 200 г находится
атомов, а в стакане воды массой 200 г находится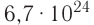 молекул. Пользоваться на практике такими числами затруднительно. Поэтому в химии, физике и других областях естествознания используется физическая величина, характеризующая число частиц в данной порции вещества. Эта величина получила название количество вещества. При химических расчётах, когда речь идёт о химических веществах, эту физическую величину следует называть химическим количеством вещества.
молекул. Пользоваться на практике такими числами затруднительно. Поэтому в химии, физике и других областях естествознания используется физическая величина, характеризующая число частиц в данной порции вещества. Эта величина получила название количество вещества. При химических расчётах, когда речь идёт о химических веществах, эту физическую величину следует называть химическим количеством вещества.
Химическое количество вещества — физическая величина, пропорциональная числу структурных единиц (атомов, молекул или формульных единиц), составляющих данную порцию вещества.
Эту величину обозначают латинской буквой n. Она является одной из семи основных величин Международной системы единиц (СИ) и имеет свою собственную единицу, которая называется моль.
Моль — это химическое количество вещества, которое содержит  структурных единиц (атомов, молекул, формульных единиц).
структурных единиц (атомов, молекул, формульных единиц).
Это число (называемое числом Авогадро) соответствует числу атомов в порции углерода массой 0,012 кг и его легко можно определить, зная массу
одного атома углерода 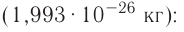
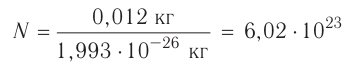 атомов (число Авогадро).
атомов (число Авогадро).
Порции различных веществ, массы которых в граммах численно равны их относительным молекулярным (формульным) массам, содержат одинаковое число структурных единиц.
Величина, равная отношению
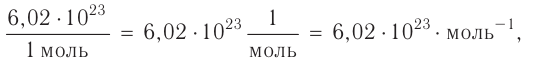
получила название постоянная Авогадро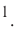 Она обозначается символом
Она обозначается символом 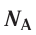 и представляет собой одну из фундаментальных физических постоянных:
и представляет собой одну из фундаментальных физических постоянных:
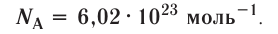
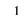 В приведённой формуле цифра 1 в числителе заменяет слово «частиц» (атомов, молекул, ФЕ), поэтому
В приведённой формуле цифра 1 в числителе заменяет слово «частиц» (атомов, молекул, ФЕ), поэтому 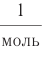 следует понимать как «частиц на моль», моль
следует понимать как «частиц на моль», моль
Число структурных единиц N любой порции вещества и его химическое количество связаны математической зависимостью:
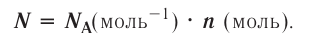
Понятие «моль» используется не только для химических веществ, но и для любых других частиц (протонов, нейтронов, электронов, ионов и т. д.). Например, 1 моль протонов составляет 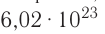 протонов, один моль ионного соединения хлорида натрия NaCl содержит 1 моль ионов натрия и 1 моль ионов хлора, а 1 моль соли сульфата алюминия
протонов, один моль ионного соединения хлорида натрия NaCl содержит 1 моль ионов натрия и 1 моль ионов хлора, а 1 моль соли сульфата алюминия 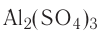 содержит 2 моль ионов алюминия
содержит 2 моль ионов алюминия 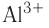 и 3 моль сульфат-ионов
и 3 моль сульфат-ионов 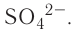 В таких случаях можно просто говорить о моле как о единице количества частиц.
В таких случаях можно просто говорить о моле как о единице количества частиц.
В случае химических веществ необходимо использовать термин «моль» как единицу химического количества вещества.
Молярная масса
Одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но так как каждая такая единица имеет свою собственную массу, то массы одинаковых химических количеств различных веществ будут разными.
Масса порции вещества химическим количеством 1 моль получила название молярная масса. Молярная масса вещества X обозначается символом М(Х) и представляет собой отношение массы данной порции вещества m (в г или кг) к его химическому количеству n (в моль):
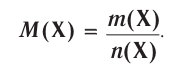
Единица молярной массы в Международной системе единиц — кг/моль. В химии чаще используется дольная единица — г/моль.
Численное значение молярной массы (в г/моль) совпадает с относительными атомной, молекулярной или формульной массой. Например, если A/Fe) = 56, то M(Fe) = 56 г/моль; если 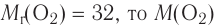 = 32 г/моль; если
= 32 г/моль; если = 100, то
= 100, то  = 100 г/моль.
= 100 г/моль.
Приведённую выше формулу можно представить и в других видах:
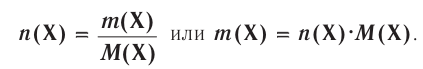
Зная молярную массу вещества, можно рассчитать химическое количество вещества по его массе. Вычислим, например, химическое количество гидроксида натрия NaOH, масса которого равна 100 г. Так как молярная масса гидроксида /Vl(NaOH) = 40 г/моль, то, воспользовавшись формулой n = m/М, находим, что
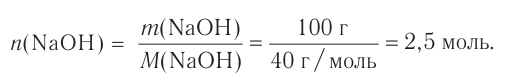
Формула позволяет решить и обратную задачу: найти массу вещества, если известно его химическое количество. Например, определим массу глюкозы  химическое количество которой равно 5 моль. Зная, что молярная масса глюкозы
химическое количество которой равно 5 моль. Зная, что молярная масса глюкозы  = 180 г/моль, по формуле m = n М определяем, что m = 5 моль • 180 г/моль = 900 г.
= 180 г/моль, по формуле m = n М определяем, что m = 5 моль • 180 г/моль = 900 г.
Формула m(Х) = n(Х)- М(Х) позволяет уяснить физический смысл понятия «химическое количество вещества» как величины, связывающей между собой массу и молярную массу вещества.
Таким образом, определённую порцию любого вещества количественно можно охарактеризовать с помощью различных физических величин.
Например, для воды массой 90 г эта схема имеет вид, представленный на рисунке 4.
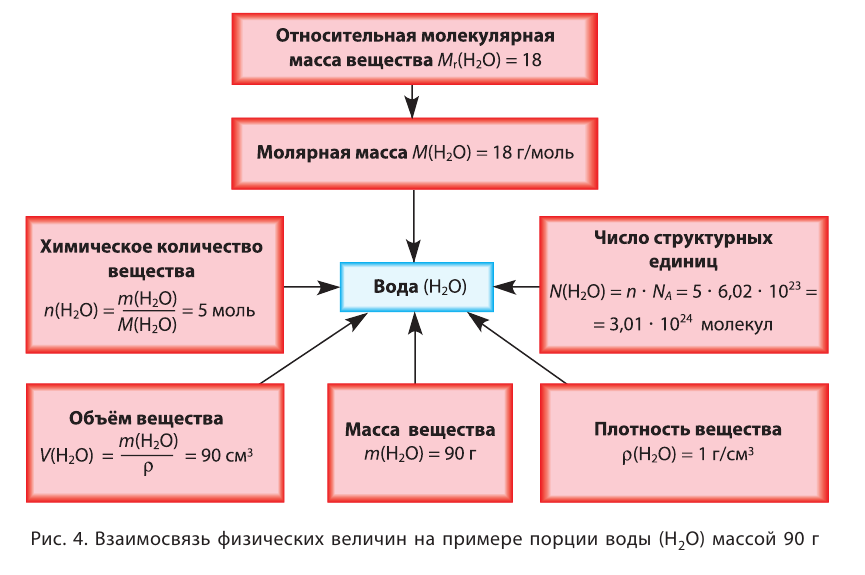
Относительная молекулярная (формульная) масса вещества представляет собой сумму относительных атомных масс всех элементов, образующих данное вещество.
Химическое количество вещества — физическая величина, пропорциональная числу структурных единиц, содержащихся в данной порции вещества.
Моль — единица химического количества вещества, т. е. такое его количество, которое содержит  структурных единиц данного вещества.
структурных единиц данного вещества.
Масса вещества X химическим количеством 1 моль называется его молярной массой М(Х) и представляет собой отношение массы данной порции вещества к его химическому количеству.
Стехиометрические расчёты в химии
Используя количественные характеристики веществ, можно проводить расчёты, связанные с формулами веществ, их количественным составом, а также с количественными изменениями реагентов и продуктов реакции в ходе любого химического процесса.
Основой таких расчётов является стехиометрия — раздел химии, в котором рассматривается количественный состав химических соединений, а также количественные соотношения между реагирующими веществами в химических реакциях. Термин «стехиометрия» (от греч. стехион — основа, элемент и метрейн — измерять) появился на рубеже XVIII—XIX веков, когда усилия химиков были направлены на установление весовых соотношений элементов в соединениях.
В современной химии стехиометрические расчёты имеют фундаментальное значение. Они являются основой количественного химического анализа. Математическую базу любых химических экспериментов в лаборатории составляют стехиометрические расчёты. В химической промышленности знание стехиометрии позволяет вычислять необходимый расход реагентов, выход химических продуктов и эффективность химических процессов.
Закон сохранения массы веществ
Теоретической основой стехиометрических расчётов служат фундаментальные количественные законы химии, часто ещё называемые стехиометрическими законами.
Из курса 7-го класса вам уже известен основной закон химии, сформулированный в XVIII веке великими естествоиспытателями — русским учёным М. В. Ломоносовым и независимо от него французским химиком А. Лавуазье, — закон сохранения массы веществ.
Михаил Васильевич Ломоносов
(1711—1765)
Русский учёный-естествоиспытатель, основатель первого в России Московского университета. Развивал атомно-молекулярные представления о строении веществ, предложил общую формулировку закона сохранения массы веществ и движения, заложил основы физической химии.

Антуан Лоран Лавуазье
(1743—1794)
Французский учёный, один из основоположников современной химии. Дал правильное объяснение процессов горения и дыхания, экспериментально доказал закон сохранения массы веществ в химических реакциях, разработал правила составления названий

Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
С позиций атомно-молекулярного учения сохранение массы веществ объясняется следующим образом. Поскольку при химических реакциях атомы не исчезают и не возникают вновь, их общее число остаётся неизменным. А так как атомы имеют постоянную массу, то и суммарные массы веществ, образованных ими, до и после реакции одинаковы.
Любую химическую реакцию можно изобразить в виде схемы, в которой указаны исходные вещества и продукты реакции, например:
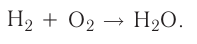
Однако схема даёт качественную информацию о химическом процессе. Количественную информацию о реакции можно получить только из её химического уравнения, записываемого на основе закона сохранения массы веществ. Оно отличается от схемы реакции наличием числовых коэффициентов перед формулами веществ. Эти коэффициенты называются стехиометрическими:
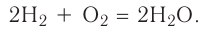
Знак равенства в уравнении реакции означает, что число атомов каждого элемента, а следовательно, и суммарные массы веществ в обеих частях уравнения одинаковы. Соотношение стехиометрических коэффициентов равно соотношению количеств соответствующих веществ. На этом основаны расчёты количеств веществ, их масс или объёмов по уравнениям химических реакций.
Закон постоянства состава
Важнейшей характеристикой (своеобразным паспортом!) вещества является его состав, который в химической практике обычно определяется с помощью качественного и количественного химического анализа.
Ещё в начале XIX века французский учёный Ж- Пруст, исследовав состав некоторых химических веществ, полученных различными способами или привезённых из разных частей света, сформулировал закон постоянства состава.
Всякое чистое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав.
Согласно этому закону каждое чистое вещество всегда состоит из атомов одних и тех же элементов, связанных между собой одинаковыми количественными соотношениями. Например, молекула воды 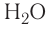 состоит из атомов водорода и кислорода, количественное соотношение которых 2:1, означающее, что на два моля атомов водорода приходится один моль атомов кислорода. Зная молярную (атомную) массу атомов этих элементов, нетрудно установить их массовое соотношение:
состоит из атомов водорода и кислорода, количественное соотношение которых 2:1, означающее, что на два моля атомов водорода приходится один моль атомов кислорода. Зная молярную (атомную) массу атомов этих элементов, нетрудно установить их массовое соотношение:
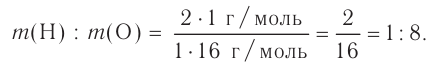
Позже было показано, что закон строго выполняется только в случае молекулярных веществ. Соединения с немолекулярной структурой часто имеют переменный состав, не отвечающий целочисленным соотношениям, что во многом объясняется условиями получения таких веществ. Отклонения от целочисленного соотношения могут быть выражены при записи формул. Например, 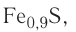
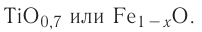 Такие соединения получили название нестехиометрические, в отличие от стехиометрических, где соотношения между числами атомов целочисленные.
Такие соединения получили название нестехиометрические, в отличие от стехиометрических, где соотношения между числами атомов целочисленные.
Массовая доля атомов химического элемента в сложном веществе Как вы уже знаете из курса химии 7-го класса, по химической формуле вещества можно вычислить массовую долю атомов каждого химического элемента в этом веществе, т. е. определить, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля атомов элемента А в сложном веществе 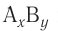 выражается в долях единицы или в процентах и рассчитывается по формуле:
выражается в долях единицы или в процентах и рассчитывается по формуле:
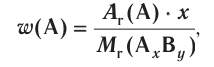
где 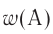 — массовая доля атомов элемента А;
— массовая доля атомов элемента А;
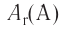 — относительная атомная масса элемента А;
— относительная атомная масса элемента А;
х — число атомов элемента А в формуле вещества;
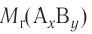 — относительная молекулярная (формульная) масса вещества.
— относительная молекулярная (формульная) масса вещества.
Пример №6
Вычислите массовые доли атомов химических элементов в молекуле воды.
Дано:
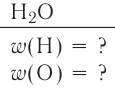
Решение:
1. Рассчитаем относительную молекулярную массу воды: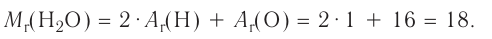
2. Вычислим массовую долю атомов каждого элемента: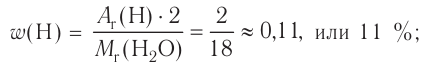
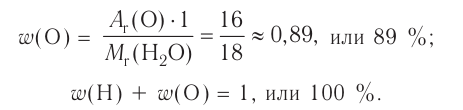
Ответ: 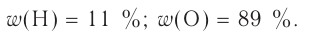
Нетрудно убедиться, что соотношение массовых долей водорода и кислорода в воде численно равно соотношению масс атомов указанных элементов в этом веществе:
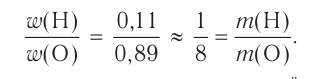
Исходя из соотношения масс или массовых долей атомов элементов в сложном веществе можно установить его эмпирическую (простейшую) формулу, в которой отображается простейшее числовое соотношение между атомами элементов. Эмпирические формулы большинства веществ немолекулярного строения показывают состав их формульных единиц.
Установление формул веществ по массовым долям атомов элементов
Пример №7
Определите эмпирическую формулу вещества, в котором массовые доли натрия, серы и кислорода равны соответственно 32,4, 22,5 и 45,1 %.
Дано:
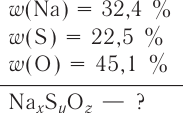
Решение:
1. Обозначим числа атомов натрия, серы и кислорода в эмпирической формуле вещества соответственно х, у и z. Тогда формулу этого вещества можно представить как 
2. Пусть масса порции данного вещества равна 100 г, тогда массы атомов содержащихся в нём элементов будут равны:
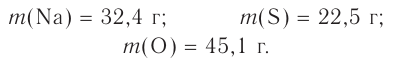
3. Найдём соотношение химических количеств атомов соответствующих элементов в данном веществе:
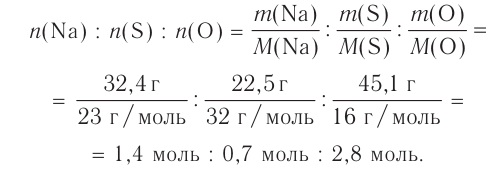
4. Определим эмпирическую формулу вещества, т. е. определим наименьшие целочисленные индексы х, у и z. Для этого разделим каждое из найденных чисел на наименьшее из них, т. е. на 0,7:
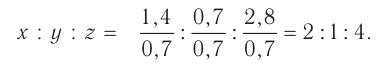
Следовательно, эмпирическая формула вещества: 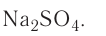
Ответ: 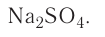
Что касается веществ молекулярного строения, то их истинные, или молекулярные, формулы часто не совпадают с эмпирическими формулами. Например, эмпирическая формула этана 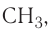 а молекулярная —
а молекулярная —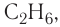 эмпирическая формула бензола СН, а молекулярная —
эмпирическая формула бензола СН, а молекулярная — 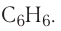 Для нахождения молекулярных (истинных) формул таких веществ необходимо знать их относительные молекулярные массы.
Для нахождения молекулярных (истинных) формул таких веществ необходимо знать их относительные молекулярные массы.
Пример №8
Установите молекулярную формулу углевода, в котором массовые доли атомов углерода, водорода и кислорода равны соответственно 40, 6,67 и 53,33 %. Относительная молекулярная масса вещества равна 180.
Дано:
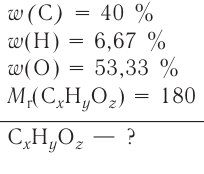
Решение:
1. Найдём мольное соотношение атомов С, Н и О: х : у : 
2. Определим эмпирическую формулу вещества:
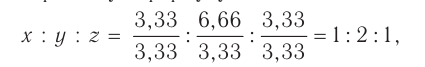
следовательно, эта формула — 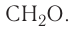
3. Найдём относительную молекулярную массу 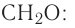
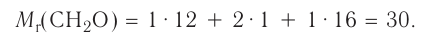
4. Определим соотношение между величинами относительной молекулярной массы углевода и относительной молекулярной массы 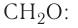

5. Определим молекулярную формулу вещества. Поскольку 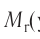 у тлев ода) в 6 раз больше
у тлев ода) в 6 раз больше 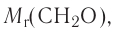 в молекулярной формуле углевода числовые индексы в 6 раз больше, чем в эмпирической:
в молекулярной формуле углевода числовые индексы в 6 раз больше, чем в эмпирической:
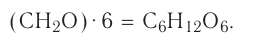
Ответ: молекулярная формула углевода — 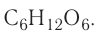
Стехиометрия — раздел химии, рассматривающий количественный состав веществ, а также количественные соотношения между реагирующими веществами в химических реакциях. Соотношение стехиометрических коэффициентов в уравнении реакции равно соотношению химических количеств соответствующих веществ. Соотношение стехиометрических индексов в эмпирической или в молекулярной формуле вещества равно соотношению химических количеств атомов соответствующих элементов в данном веществе.
Газообразное состояние веществ
Вещества могут находиться в трёх агрегатных состояниях: твёрдом, жидком и газообразном (рис. 5). Твёрдое и жидкое состояния объединяются общим названием конденсированное состояние. В общем случае агрегатное состояние вещества определяется температурой и давлением. При очень высокой температуре устойчиво газообразное состояние, при низкой температуре, наоборот, большинство веществ находится в конденсированном состоянии. Повышение давления способствует переходу вещества в конденсированное состояние.
В твёрдом состоянии расстояние между частицами, из которых состоит данное вещество, очень малы (рис. 5), поэтому частицы находятся в непосредственной близости друг к другу, образуя строго упорядоченную структуру.
У жидкостей расстояние между частицами несколько больше (примерно на 10—15 %), но силы взаимодействия между ними ещё достаточно прочны, чтобы не позволить частицам отрываться друг от друга (рис. 5). В отличие от твёрдых тел жидкости не имеют определённой формы: они принимают форму сосуда, в котором находятся.
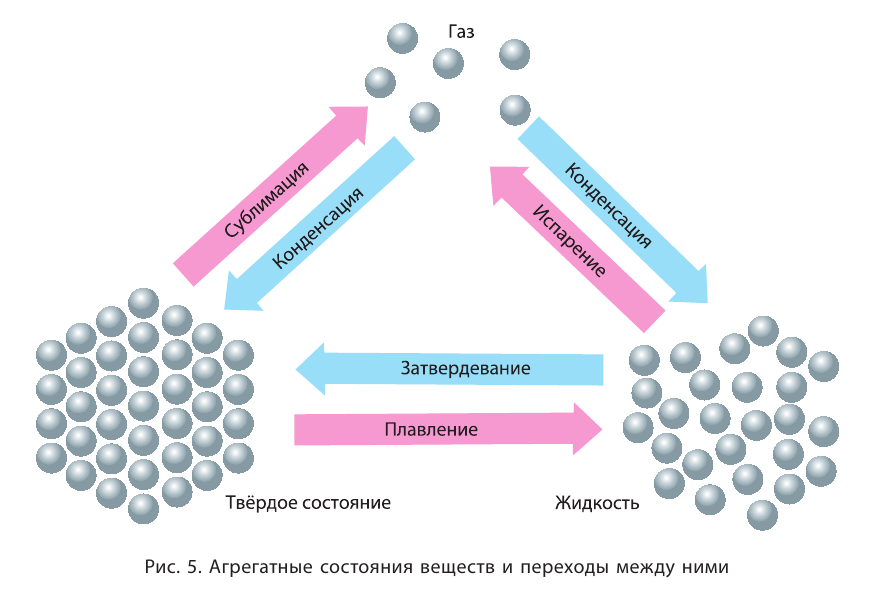
В газах при обычных условиях расстояния между частицами в сотни раз больше размеров самих частиц (молекул). Эти расстояния зависят от внешнего давления и от кинетической энергии молекул, которая, в свою очередь, определяется только температурой. Поэтому объём порции газа определяется не размерами его молекул, а расстояниями между ними, которые зависят от давления и температуры.
Если давление и температура различных газов одинаковы, то и расстояния между молекулами в этих газах также приблизительно одинаковы.
Закон Авогадро
Из последнего заключения следует вполне очевидный вывод, что в равных объёмах различных газов при одинаковых давлении и температуре находится одно и то же число молекул. Именно это предположение высказал в 1811 году в виде гипотезы итальянский учёный Амедео Авогадро. Позже эта гипотеза стала называться законом Авогадро.
В равных объёмах различных газов при одинаковых условиях (давлении, температуре) содержится одинаковое число молекул.
Из закона Авогадро вытекает несколько важных следствий. Первое из них следующее:
если число молекул разных газов одинаково, то при одних и тех же условиях молекулы занимают одинаковый объём.
Молярный объём газов
Поскольку 1 моль любого молекулярного вещества содержит одинаковое число молекул 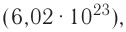 то из этого следует, что любые газообразные вещества химическим количеством 1 моль при одинаковых условиях должны занимать один и тот же объём. Этот объём получил название молярный объём и обозначается
то из этого следует, что любые газообразные вещества химическим количеством 1 моль при одинаковых условиях должны занимать один и тот же объём. Этот объём получил название молярный объём и обозначается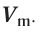

Амедео Авогадро
(1776—1856)
Итальянский химик и физик, один из создателей атомномолекулярного учения. Открыл закон, позволяющий определять количественные характеристики газообразных веществ, названный впоследствии его именем.
Молярный объём газа V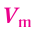 — величина, определяемая отношением объёма данной порции газа V(X) к его химическому количеству n(Х) в этой порции:
— величина, определяемая отношением объёма данной порции газа V(X) к его химическому количеству n(Х) в этой порции:
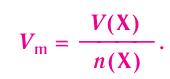
Так как молярный объём газа зависит от температуры и давления, то при проведении различных расчётов используются обычно объёмы газов при нормальных условиях (сокращённо — н. у.). Нормальным условиям соответствует температура О °С и давление 101,325 кПа. В дальнейшем мы будем говорить о газах, находящихся именно при и. у.
Установлено, что при нормальных условиях отношение объёма любой порции газа к его химическому количеству есть величина постоянная, равная  Другими словами, молярный объём любого газа X при нормальных условиях:
Другими словами, молярный объём любого газа X при нормальных условиях:
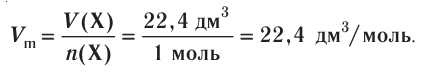
Этот вывод называют вторым следствием из закона Авогадро.
Если преобразовать последнюю формулу в выражение
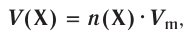
то нетрудно понять, что химическое количество газа является величиной, связывающей его объём с молярным объёмом. Вспомните, что точно так же химическое количество является величиной, связывающей между собой массу и молярную массу вещества:
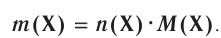
Выразив химическое количество вещества X через отношение 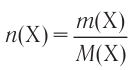 и подставив в формулу
и подставив в формулу 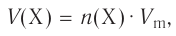 получим соотношение:
получим соотношение:
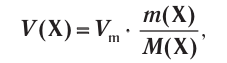
которое позволяет рассчитывать объём порции любой массы данного газа X, и наоборот, зная объём порции определённой массы газа, рассчитывать молярную массу данного газообразного вещества:
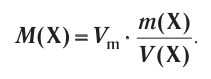
Молярный объём газа при нормальных условиях является важной физикохимической постоянной, которая широко используется при различных химических расчётах. Она даёт возможность использовать объём газа вместо его массы, поскольку на практике значительно легче измерить объём газа, чем его массу.
Пример №9
Рассчитайте объём (н. у.) водорода, который выделится при взаимодействии цинка химическим количеством 0,5 моль с соляной кислотой 
Дано:
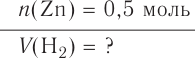
Решение:
1. Запишем уравнение реакции:
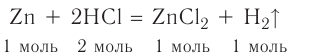
2. Определим химическое количество выделившегося водорода:
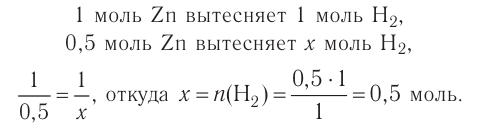
3. Рассчитаем объём водорода:
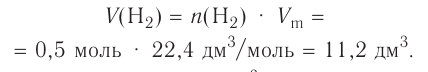
Ответ: объём водорода равен 
Молярная концентрация газообразного вещества
В одном и том же сосуде при разных давлении и температуре может находиться разное количество газа, т. е. на единицу объёма сосуда могут приходиться различные химические количества газообразного вещества X. В таких случаях можно говорить о разной молярной концентрации с(Х) газообразного вещества.
Молярная концентрация газообразного вещества X — величина, равная отношению химического количества данного газа к объёму сосуда:
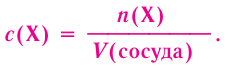
Из формулы следует, что единица молярной концентрации — моль/дм3. 
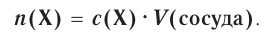
Например, если молярная концентрация кислорода 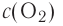 в баллоне равна
в баллоне равна 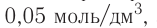 а объём этого баллона равен
а объём этого баллона равен 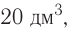 то
то 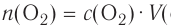 сосуда) =
сосуда) = 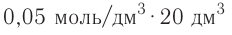 = 1 моль.
= 1 моль.
В равных объёмах различных газов при одинаковых условиях (давлении, температуре) содержится одинаковое число молекул.
Молярный объём газа — это объём его порции химическим количеством 1 моль. При нормальных условиях  молярный объём любого газа является величиной постоянной, равной
молярный объём любого газа является величиной постоянной, равной 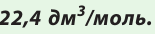
Закон объёмных отношений
На основе закона Авогадро и вытекающих из него следствий мы можем ещё раз констатировать, что объём газа пропорционален его химическому количеству (и следовательно, числу его молекул). Это позволяет дать простое объяснение закону объёмных отношений, установленному французским учёным Ж- Л. Гей-Люссаком в 1807 году.
Жозеф Луи Гей-Люссак
(1778—1850)
Французский химик, один из создателей атомно-молекулярного учения. Открыл закон простых объёмных отношений реагирующих газов. Получил свободный бор, положил начало объёмному анализу, усовершенствовал методы элементного анализа органических веществ.

При неизменных температуре и давлении объёмы вступающих в реакцию газов относятся друг к другу, а также к объёмам образующихся газообразных продуктов как небольшие целые числа.
Рассмотрим реакцию горения аммиака  в кислороде с образованием азота и паров воды. В этом процессе все вещества газообразны (r):
в кислороде с образованием азота и паров воды. В этом процессе все вещества газообразны (r):
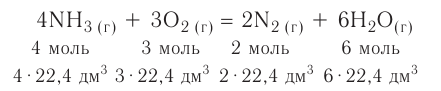
Найдём соотношение объёмов исходных веществ и продуктов реакции: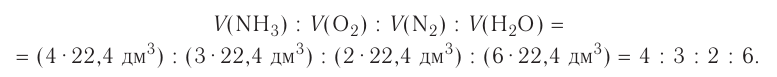 Нетрудно увидеть, что это соотношение объёмов равно соотношению коэффициентов перед формулами соответствующих веществ в уравнении реакции.
Нетрудно увидеть, что это соотношение объёмов равно соотношению коэффициентов перед формулами соответствующих веществ в уравнении реакции.
Например, если объёмы вступающих в реакцию аммиака и кислорода равны соответственно  то в результате реакции образуются азот объёмом
то в результате реакции образуются азот объёмом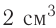 и пары воды объёмом
и пары воды объёмом 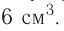
Пример №10
Определите объём (н. у.) кислорода, который прореагирует с оксидом углерода(П) массой 112 г? Каков объём (н. у.) образовавшегося углекислого газа?
Дано:
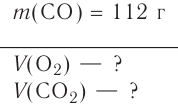
Решение:
1. Найдём химическое количество оксида углерода(II):
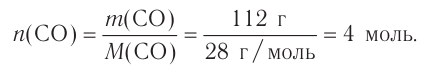
2. Запишем уравнение реакции и определим химические количества веществ:
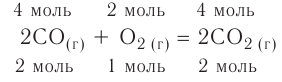
3. Определим объём (н. у.) кислорода:
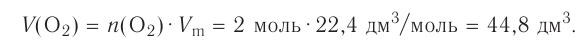
4. Определим объём (н. у.) углекислого газа:
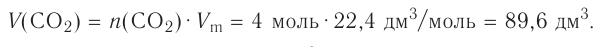
Ответ: объём кислорода — 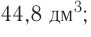 объём углекислого газа —
объём углекислого газа — 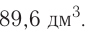
Относительная плотность газов
Если мы имеем два газа А и В одинакового объёма, то эти объёмы в общем виде можно выразить:
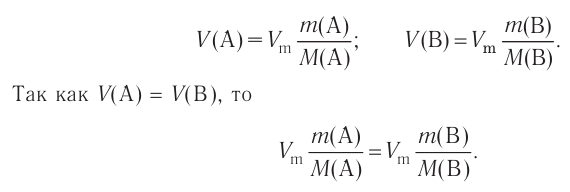
Сокращая обе части уравнения на получаем выражение:
получаем выражение:
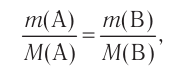
откуда после преобразования приходим к окончательному виду:
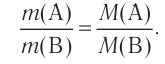
Это и есть формульное выражение третьего следствия из закона Авога-дро: массы одинаковых объёмов двух газов относятся друг к другу как их молярные массы.
В Отношение молярных масс газов А и В называется относительной плотностью газа А по газу В и обозначается символами 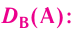
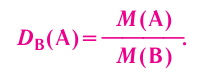
Чаще всего относительную плотность газообразных веществ определяют по отношению к водороду как к самому лёгкому газу или по отношению к воздуху.
Так как молярная масса водорода равна 2 г/моль, то относительная плотность любого газа А по водороду вычисляется по формуле:
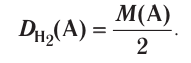
Воздух является смесью газов, поэтому говорят о его «средней молярной массе». Она представляет собой массу 1 моль 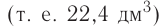 воздуха и равна примерно 29 г/моль:
воздуха и равна примерно 29 г/моль:
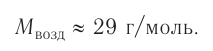
Поэтому относительная плотность любого газа А по воздуху:
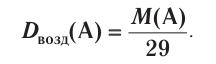
Зная относительную плотность одного газа по другому, можно определить его молярную массу по формулам: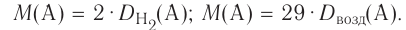
Например, определим молярную массу газа А, плотность которого по водороду равна 15. Так как 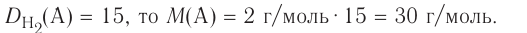
Пример №11
Определите относительную плотность: а) кислорода по водороду; б) углекислого газа по воздуху.
Дано:
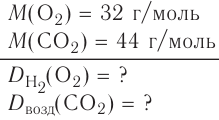
Решение:
1. Найдём относительную плотность кислорода по водороду:
М( А) 29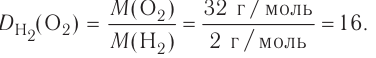
2. Определим относительную плотность углекислого газа по воздуху:
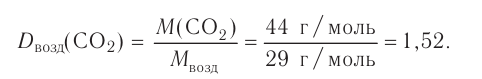
Ответ: относительная плотность кислорода по водороду равна 16, а относительная плотность углекислого газа по воздуху — 1,52.
Соотношение коэффициентов перед формулами газообразных веществ в уравнениях химических реакций соответствует соотношению объёмов этих веществ.
Относительная плотность одного газа по другому — это отношение молярной массы одного газа к молярной массе другого.
Решение задач по теме: Основные понятия и законы химии
Любое вещество представляет собой систему взаимосвязанных частиц (атомов, ионов или молекул), обладающую определёнными физическими и химическими свойствами. Каждое вещество, независимо от его агрегатного состояния, имеет постоянную количественную характеристику — молярную массу М (г/моль), величина которой определяется только качественным и количественным составом.
В то же время отдельная порция вещества характеризуется величиной его химического количества n (моль), массой m (г), объёмом V 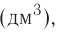 числом структурных единиц N. Если химическое количество вещества равно 1 моль, то такая порция любого вещества при любых условиях характеризуется массой, численно равной молярной массе М и числом структурных единиц 6,02-
числом структурных единиц N. Если химическое количество вещества равно 1 моль, то такая порция любого вещества при любых условиях характеризуется массой, численно равной молярной массе М и числом структурных единиц 6,02- 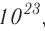 а газообразные вещества при н. у. — ещё и величиной молярного объёма Кт —
а газообразные вещества при н. у. — ещё и величиной молярного объёма Кт — 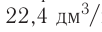 моль.
моль.
Если химическое количество вещества X не равно 1 моль, то масса, число структурных единиц и объём порции этого вещества связаны с вышеуказанными характеристиками простыми математическими зависимостями:
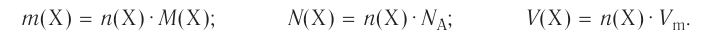
Следовательно, химическое количество вещества п является величиной, связывающей между собой массу и молярную массу, число структурных единиц и число Авогадро, объём и молярный объём.
Взаимосвязь между всеми указанными характеристиками вещества можно выразить единой схемой:
Для веществ в любом агрегатном состоянии
структурных единиц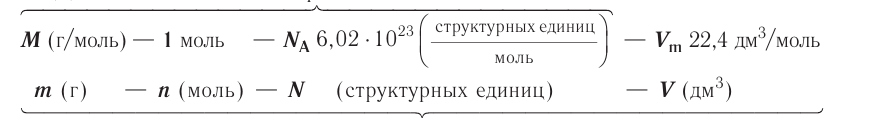
Для газообразных веществ при н. у.
Зная любую из характеристик конкретного вещества, можно рассчитать все остальные.
Пример №12
Определите массу, химическое количество и число молекул углекислого газа в его порции объёмом (н. у.) 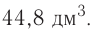
Дано:
Решение:
I. Найдём химическое количество 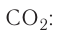
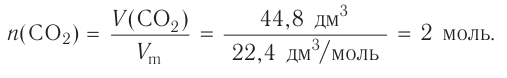
2. Определим молярную массу 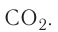
Поскольку 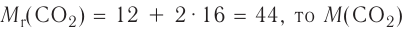 равна 44 г/моль.
равна 44 г/моль.
3. Найдём массу 
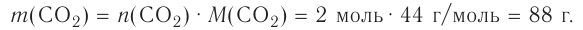
4. Рассчитаем число молекул 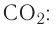
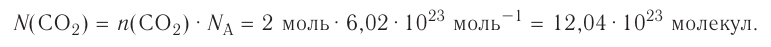
Второй способ решения задач связан с составлением пропорций на основе вышеприведённой схемы:
а) 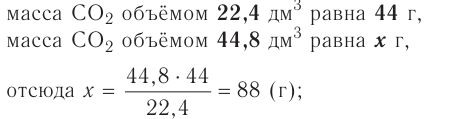
б) количество газа объёмом 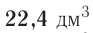 равно 1 моль,
равно 1 моль,
количество газа объёмом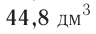 равно у моль,
равно у моль,
отсюда 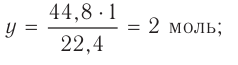
в) в газе объёмом 22,4 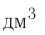 2 3 4 число молекул равно 6,02- 1023, в газе объёмом 44,8
2 3 4 число молекул равно 6,02- 1023, в газе объёмом 44,8 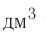 число молекул равно z,
число молекул равно z,
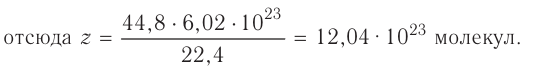
Ответ: масса 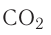 равна 88 г, его химическое количество — 2 моль, число молекул составляет 12,04
равна 88 г, его химическое количество — 2 моль, число молекул составляет 12,04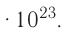
Пример №13
Чему равно число молекул и атомов в порции кислорода химическим количеством 5 моль? Рассчитайте массу и объём данной порции кислорода при н. у.
Дано:
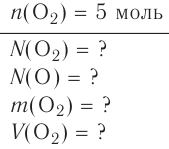
Решение:
1. Рассчитаем число молекул в указанной порции кис-
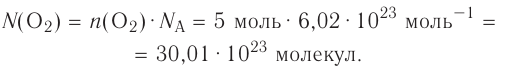 .
.
2. Найдём число атомов кислорода. Поскольку каждая молекула кислорода состоит из двух атомов, то общее число атомов кислорода будет вдвое больше числа молекул, т. е.
состоит из двух атомов, то общее число атомов кислорода будет вдвое больше числа молекул, т. е.
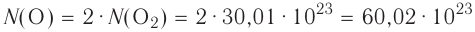 атомов.
атомов.
3. Рассчитаем массу кислорода:
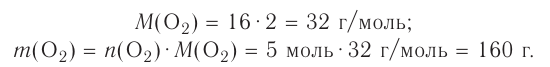
4. Определим объём кислорода при нормальных условиях:
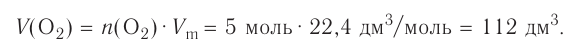
Ответ: в порции кислорода количеством 5 моль содержатся 30,1 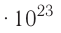 молекул и 60,02
молекул и 60,02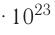 атомов. Масса кислорода равна 160 г, а его объём — 112
атомов. Масса кислорода равна 160 г, а его объём — 112 
Пример №14
При взаимодействии графита (углерода) массой 9 г с серой, масса которой составляла 48 г, образовалось бинарное соединение. Определите его эмпирическую формулу.
Дано:
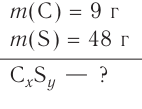
Решение:
1. Найдём химические количества исходных простых веществ:
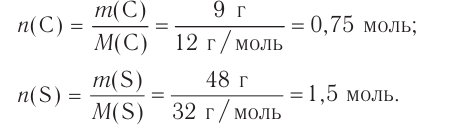
2. Найдём целочисленное соотношение этих химических количеств, равное соотношению индексов х и у, и составим искомую эмпирическую формулу: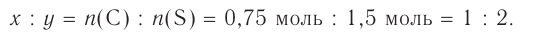 Следовательно, эмпирическая формула соединения —
Следовательно, эмпирическая формула соединения — 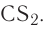
Ответ: формула соединения серы с углеродом — 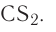
Пример №15
Установите молекулярную формулу вещества с массовой долей углерода 40 %, водорода — 6,67 % и кислорода — 53,33 %. Плотность паров этого вещества по воздуху равна 2,07.
Дано:
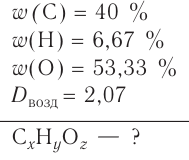
Решение:
1. Пусть масса порции данного вещества равна 100 г. Тогда массы элементов в этой его порции равны:
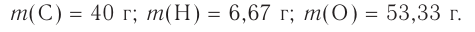
2. Найдём соотношение химических количеств атомов указанных элементов:
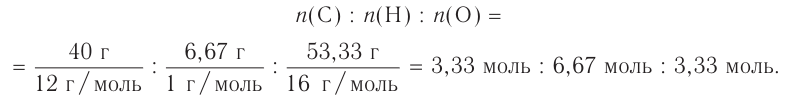
3. Определим эмпирическую формулу вещества, разделив каждое из найденных чисел на наименьшее из них (3,33):
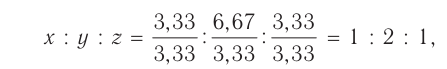
следовательно, эмпирическая формула вещества — 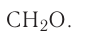
4. Вычислим молярную массу неизвестного соединения по его относительной плотности:
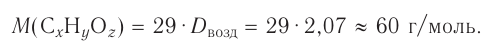
5. Найдём молярную массу 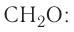
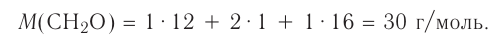
6. Определим соотношение между величинами молярной массы неизвестного вещества и молярной массы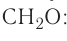
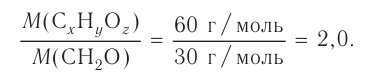
7. Составим молекулярную формулу вещества. Поскольку молярная масса данного вещества в 2 раза больше молярной массы 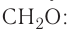 индексы в этой формуле нужно увеличить в 2 раза:
индексы в этой формуле нужно увеличить в 2 раза:
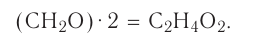
Ответ: молекулярная формула вещества — 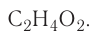
Роль химии в повседневной жизни человека
На всем протяжении своего развития, с незапамятных времен и поныне, химия служила и продолжает служить человеку и его практической деятельности.
Еще в древнейшие времена, задолго до Рождества Христова. человек наблюдал в природе химические явления и пытался использовать их для улучшения условий своего существования. Скисание молока, брожение сладкого сока плодов, действие ядовитых растений привлекали внимание человека.
Прошло время, и человек стал использовать огонь. Неизвестны ни место, ни время, когда человек научился зажигать дерево и поддерживать горение. Неизвестно также, сколько времени прошло с тех пор, как человек начал использовать огонь для приготовления пищи, в гончарном производстве, для обработки и выплавки металлов. Но известно, что еще в древнем Египте возникли ремесла, в основе которых лежали химические процессы (рис. 16, 17). Египтяне получали краски и косметические средства из минеральных веществ, умели красить ткани, изготовлять стекло, керамику, фарфор, добывать золото, бронзу, железо, медь и в совершенстве владели техникой обработки металлов.

Рассмотрите золотую пектораль и саркофаг египетского фараона Тутанхамона (см. вклейку). Даже в наши дни искусство золотых дел мастеров древности вызывает восхищение.
В средние века широкое распространение получила алхимия. Вы уже знаете, что основная задача ее сводилась к поискам «философского камня» — мистического вещества, обладающего якобы способностью неблагородные металлы превращать в золото, возвращать людям молодость и здоровье (рис. 18).

Но и у алхимиков были значительные прогрессивные достижения, связанные с использованием химии на благо человека. К ним можно отнести открытие ряда веществ (фосфор, сурьма, селитра, серная, соляная, азотная, фосфорная кислоты) и разработку методик многих операций (фильтрование, перегонка веществ и др.), которые быстро нашли практическое применение.
Наступивший период ятрохимии (XVI—XVIII вв.) характеризуется стремлением поставить химию на службу медицине.
Основатель ятрохимии Теофраст Парацельс (1493—1541) утверждал, что настоящая цель химии не в изготовлении золота, а в приготовлении лекарств. Дело в том. что ятрохимики рассматривали болезни как нарушение химического равновесия в организме и искали химические средства их лечения. Так, основной целью химии становится поиск и создание лекарственных препаратов.
ТЕОФРАСТ ПАРАЦЕЛЬС (1493—1541)

Врач и естествоиспытатель, один из основателей ятрохимии (медицинской химии). Родился в Швейцарии (настоящее имя Ауреол Теофраст Бомбаст фон Гогенгейм). Работал в Австрии. Франции. Швейцарии. Подверг критическому пересмотру идеи древней медицины. Способствовал внедрению химических препаратов в медицину. В 1530 г написал первое руководство по фармации.
- Какой период в истории химии считается решающим в становлении химии как науки? Кого бы вы назвали основателями современной химии и почему? Обоснуйте свой ответ.
О значении современной химии для человека и его практической деятельности и говорить не приходится, ее роль в жизни общества исключительно велика. Сегодня без развития химии невозможно развитие топливно-энергетического комплекса. металлургии, транспорта, связи, строительства, электроники, сферы быта и пр.
Химическая индустрия снабжает промышленность и сельское хозяйство различными материалами и сырьем. Это топливо, масла, химические волокна, пластмассы, синтетические каучуки, минеральные удобрения, моющие средства, парфюмерные, фармацевтические препараты, кислоты, щелочи, растворители. взрывчатые вещества и многое другое.
Мы убеждаемся, что «широко распростирает химия руки свои в дела человеческие. Куда ни посмотрим, куда ни оглянемся, везде обращаются перед очами нашими успехи ее прилежания».
Эти слова великого русского ученого-естествоиспытателя М. В. Ломоносова (1711—1765), сказанные почти 250 лет назад. и сегодня не утратили своего значения. Напротив, они звучат с особой силой, поскольку сегодня роль химии в жизни общества постоянно возрастает.
Помимо применения веществ и материалов, в различных отраслях промышленности используются химические методы. например катализ, защита металлов от коррозии, обработка деталей химическим способом и др.
Проникновение химических методов, новых веществ и новых материалов в основные отрасли промышленного производства, сферу быта, здравоохранение все в большей мере обеспечивает их прогресс. Поэтому и происходит химизация практически всех сфер человеческой деятельности. Она является объективной закономерностью развития производительных сил общества.
Одновременно развитие современного химического производства немыслимо без монтажа установок, без электроники, измерительной, управляющей, регулирующей техники, научного приборостроения, без улучшения сырьевой базы и энергетического хозяйства.
Таким образом, в развитии химической промышленности отчетливо проявляется тенденция взаимного проникновения и взаимного влияния отдельных отраслей производства и науки.
Такая очень сложная взаимосвязь химической промышленности почти со всеми отраслями хозяйства — это отличительный признак современной химии. Для его обозначения используется понятие «химизация».
Химизация позволяет решать многие важные проблемы хозяйственной жизни общества в целом и отдельного человека в частности.
В то же время химизация порождает и новые проблемы, связанные с состоянием природной среды и, как следствие, с угрозой здоровью человека. Поэтому с ростом химизации углубляется тревог а за будущее человечества и всего живого на нашей планете. В результате получается, что современный уровень практического использования химии остро стал кивает общественное сознание с экологической проблемой, а также и с рядом других глобальных проблем, волнующих все человечество. например с энергетической, сырьевой, продовольственной и др.
Это можно объяснить тем, что химизация во многом по-новому раскрывает социальное значение химии, ее теснейшие и сложнейшие связи с различными сторонами материальной и духовной жизни общества.
Ваша задача заключается в том. чтобы понять и осознать специфическую роль химии в жизни общества. А чтобы облегчить довольно сложный и противоречивый процесс осознания. рассмотрим конкретные примеры.
Значение химии в создании новых материалов
Вы уже знаете, что в промышленности широко используются различные материалы.
Вещество, идущее на изготовление какого-либо физического тела, называется материалом.
Чтобы осуществить любой химико-технологический процесс. нужна аппаратура, изготовленная из таких материалов, которые способны противостоять разнообразным агрессивным воздействиям, в том числе химическим, механическим, термическим. электрическим, а в ряде случаев также радиационным и биологическим.
Химия вносит существенный вклад в создание различных материалов: металлических и неметаллических. Среди металлических материалов чаше всего используются сплавы на основе железа — чугун и сталь (рис. 19), на основе меди—латунь и бронза (рис. 20). на основе алюминия, магния, никеля, ниобия, титана, тантала, циркония и друг их металлов. Из металлических сплавов изготовляют теплообменники, емкости, мешалки, трубопроводы, контактные аппараты, колонны и другие аппараты.

Для улучшения качества металлических материалов используют порошковую металлургию. Она включает процессы производства металлических порошков и изделий из них. Современная порошковая металлургия занимается, во-первых, созданием материалов и изделий с такими характеристиками (состав, структура, свойства), которых в настоящее время невозможно достичь известными методами плавки, во-вторых, изготовлением традиционных материалов и изделий, но при более выгодных технико-экономических показателях производства.
В разработке теоретических основ важнейших процессов порошковой металлургии ведущее место занимает Институт проблем материаловедения.
Среди неметаллических материалов важное значение придается полимерам на основе фенолформальдегидных смол, поливинилхлорида, полиэтилена и фторопластов (рис. 21). Эти материалы, в отличие от металлических, имеют высокую устойчивость в агрессивных средах, низкую плотность, высокую стойкость к стиранию, хорошие диэлектрические и теплоизоляционные свойства. Кроме того, важное значение имеют каучуки и различные материалы на их основе — бутилкаучук, фторкаучук. силиконовые каучуки и др. (рис. 22).

К группе неметаллических материалов относятся и такие традиционные материалы, как керамика, фарфор, фаянс, стекло, цемент, бетон, графит, которые находят все новое и новое применение.
В последнее время требования к материалам неуклонно повышаются. Это объясняется тем. что значительно шире применяются теперь экстремальные воздействия — сверхвысокие и сверхнизкие давления и температуры, ударные и взрывные волны, ионизирующие излучения, ферменты. Поэтому повышается роль химии в создании новых материалов, способных противостоять этим воздействиям.
Особое место среди новых материалов занимают композиты.
Среди композитов выделяют керметы (керамико-металлические материалы), иорпласты (наполненные органические полимеры) и пены (газонаполненные материалы).
В качестве основы (матрицы) используют металлы и сплавы. полимеры, керамику. Применяемые наполнители, особенно для композитов на основе пластмасс, значительно разнообразнее. От них зависит прочность и жесткость композитов.

В России предложены принципиально новые методы получения композитов, например на основе боридов металлов (восстановление оксидов металлов бором в вакууме и карбидом бора). Освоен метод прямого синтеза силицидов из металла и кремния, а также непосредственное восстановление оксидов металла кремнием и многое другое. По многим свойствам — прочности, ударной вязкости, усталостной прочности и др.— композиты значительно превосходят традиционные материалы, поэтому потребности общества в них и вообще в новых материалах непрерывно растут. Но пока еще они очень дорогие. Этим объясняется тот факт, что основными потребителями композитов пока являются авиационная и космическая промышленности.

Значение химии в решении сырьевой проблемы
Сырье — неотъемлемый элемент любого производственного процесса, в том числе и химико-технологического.
Природные материалы, используемые в производстве промышленных продуктов, называются сырьем.
Окружающая нас природа служит неисчерпаемой кладовой. из которой промышленность получает сырье. По мере развития науки и техники все новые и новые полезные ископаемые используются для получения продуктов производства, появляются новые виды сырья, расширяется сырьевая база промышленности.
В связи с бурным развитием промышленности в XX в. резко возрос объем добычи и переработки полезных ископаемых. За последние 40 лет многих полезных ископаемых было добыто больше, чем за всю историю человечества. В настоящее время в мире ежегодно извлекается и перерабатывается 100 млрд т горных пород. А в химическом производстве в качестве сырья используются не только горные породы. Это приводит к тому, что многие сырьевые источники быстро истощаются, в результате чего возникает серьезная сырьевая проблема. Уже сейчас в ряде стран ощущается острая нехватка отдельных видов сырьевых ресурсов. В России например, не хватает такого горючего минерального сырья, как нефть и природный газ.
Несоответствие между запасами и потреблением некоторых видов сырья выдвигает проблему его бережного и рационального использования. В связи с этим химики ставят перед собой следующие основные задачи:
- изыскание и применение дешевого сырья, новых видов альтернативных сырьевых материалов;
- комплексное использование сырья;
- разработка новых эффективных методов рециркуляции, г. е. многократного использования различных видов сырья, например металлов;
- использование отходов в качестве сырья.
В настоящее время химики стараются использовать местное сырье. Это выгодно, поскольку не требует затрат на дальние перевозки. История развития химической промышленности знает немало примеров, когда то или иное вещество из пустой породы или отходов производства превращалось в ценное сырье. Например, хлорид калия KCI в конце прошлого века был пустой породой при добыче поваренной соли из сильвинита (минерал 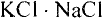 ). В настоящее время сильвинит перерабатывают с целью извлечения хлорида калия KCI как ценного минерального удобрения, а.хлорид натрия NaCI превратился в отход производства.
). В настоящее время сильвинит перерабатывают с целью извлечения хлорида калия KCI как ценного минерального удобрения, а.хлорид натрия NaCI превратился в отход производства.
Многие редкие металлы раньше не находили применения из-за их промышленной недоступности, однако потребности в этих металлах атомной энергетики, микроэлектроники, радиотехники. космической техники, которые сегодня определяют научно-технический прогресс, сделали возможным промышленное извлечение рассеянных элементов.
Комплексное использование сырья направлено на применение всех его основных частей для получения полезных продуктов или материалов. Это означает, что из одного вида сырья можно получать большое количество различных продуктов. Например, в настоящее время древесина используется не только как источник получения мебели, но и как источник огромных материальных ценностей (схема 1).
Химики в ответе за рациональное использование сырья, его комплексную переработку, ликвидацию отходов, многие из которых наносят непоправимый ущерб окружающей среде и здоровью людей. Значит, разработка новых способов комплексного использования сырья имеет огромное значение.
Химия имеет большое значение и в разработке способов перевода уже прореагировавших веществ в их первоначальное состояние для повторного использования (рециркуляция, регенерация сырья).
Например, уже сейчас довольно широко используются металлы в виде вторичного сырья (так называемого скрапа). Около половины мирового производства стали базируется на скрапе.
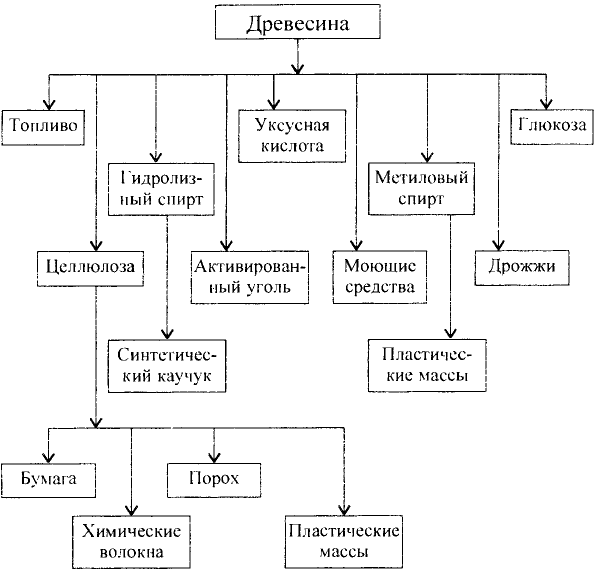
Промышленные и бытовые отходы отравляют водоемы, заражают почву и воздух, загромождают территории. А ведь они являются неиссякаемым источником сырья. Задача химиков заключается в обезвреживании и использовании отходов. С этой целью строят специальные очистные сооружения. В России установлены нормы допустимого содержания веществ в промышленных выбросах и сточных водах. Но главная задача химиков состоит в создании безотходных производств, в которых отходы используются для получения необходимых продуктов. Реализация этой задачи тесно связана с комплексным использованием сырья и комбинированием производств, когда отходы одного завода становятся сырьем для другого. При этом завод перерастает в комбинат.
Значение химии в решении энергетической проблемы
Обеспеченность энергией является важнейшим условием социально-экономического развития любой страны, ее промышленности, транспорта, сельского хозяйства, сфер культуры и быта.
Особенно много энергии потребляет химическая промышленность. Энергия затрачивается на проведение эндотермических процессов, на транспортировку материалов, дробление и измельчение твердых веществ, фильтрацию, сжатие газов и др. Значительного расхода энергии требуют производства карбида кальция, фосфора, аммиака, полиэтилена, изопрена, стирола и др. Химические производства вместе с нефтехимическими являются самыми энергоемкими отраслями индустрии. Вытекая около 7 % промышленной продукции, они потребляют в пределах 13—20 % энергии, расходуемой всей промышленностью.
Источниками же энергии чаще всего служат традиционные невозобновляемые природные ресурсы — уголь, нефть, природный газ. торф, сланцы. В последнее время они быстро истощаются. Особенно ускоренными темпами уменьшаются запасы нефти и природного газа, а ведь они ограничены и невосполнимы. Не удивительно, что это порождает энергетическую проблему.
В различных странах энергетическую проблему решают по-разному, но везде в ее решение значительный вклад вносит химия. Так, химики считают, что и в будущем (примерно еще лет 25—30) нефть сохранит свою лидирующую позицию. Только ее вклад в энергоресурсы заметно сократится и будет компенсироваться возросшим вкладом угля. газа, водородной энергетики, ядерного горючего, энергии Солнца, энергии земных глубин и других видов возобновляемой энергии, включая биоэнергетику.
Уже сегодня химики заботятся о максимальном и комплексном энерготехнологическом использовании топливных ресурсов — уменьшении потерь теплоты в окружающую среду. вторичном использовании теплоты, максимальном использовании местных топливных ресурсов и др.
Разработаны химические методы извлечения вязкой нефти (содержащей высокомолекулярные углеводороды), значительная часть которой остается в подземных кладовых. Для увеличения выхода нефти в воду, которая закачивается в пласт, добавляют поверхностно-активные вещества. Их молекулы располагаются на границе нефть—вода, что увеличивает подвижность нефти.
В будущем восполнение топливных ресурсов связывают с рациональной переработкой угля. Например, измельченный уголь смешивается с нефтью, на полученную пасту действуют водородом под давлением. При этом образуется смесь углеводородов. На получение I т искусственного бензина расходуется около 1 т угля и 1500  водорода. Пока что искусственный бензин дороже получаемого из нефти, но важна принципиальная возможность его получения.
водорода. Пока что искусственный бензин дороже получаемого из нефти, но важна принципиальная возможность его получения.
Весьма перспективной представляется водородная энергетика, предусматривающая сжигание водорода, при котором нет вредных выбросов. Следовательно, это экологически чистая энергетика. Однако для ее развития необходимо решить ряд задач, связанных со снижением себестоимости водорода, созданием надежных средств его хранения и транспортировки. Если эти задачи будут решены, водород станет широко использоваться в авиации, водном и наземном транспорте, промышленном и сельскохозяйственном производствах.
Неисчерпаемые возможности таит ядерная энергетика. Ее развитие для производства электроэнергии и теплоты позволит освободить значительное количество органического топлива. Здесь перед химиками стоит задача создать комплексные технологические системы покрытия энергетических расходов при осуществлении эндотермических реакций с помощью ядерной энергии.
Большие надежды возлагаются на использование солнечной радиации (гелиоэнергетика). В Крыму работают солнечные батареи, фотогальванические элементы которых преобразуют солнечный свет в электричество. Для опреснения воды и отопления жилищ широко используются солнечные термоустановки, преобразующие солнечную энергию в теплоту. Солнечные батареи уже давно применяются в навигационных сооружениях и на космических кораблях. В отличие от ядерной стоимость энергии, получаемой с помощью солнечных батарей, постоянно снижается.
Для изготовления солнечных батарей основным полупроводниковым материалом служит кремний и его соединения. В настоящее время химики работают над созданием новых материалов — преобразователей энергии. Это могут быть различные системы солей как накопителей энергии. Дальнейшие успехи гелиоэнергетики зависят от предложенных химиками материалов для преобразования энергии.
В новом тысячелетии прирост производства электроэнергии будет происходить за счет развития солнечной энергетики, а также метанового брожения бытовых отходов и других нетрадиционных источников получения энергии.
Значение химии в повседневной жизни
В быту мы практически повседневно встречаемся с продуктами химической промышленности и с химическими процессами. Это стирка белья, мытье посуды, уход за полом и мебелью, применение клея, а также приготовление пищи, умывание с мылом, уход за кожей лица и другая личная гигиена, прочее.
В настоящее время бытовая химия — это самостоятельная отрасль промышленности. Ежегодно в мире производится около 30 млн т товаров бытовой химии. Это и моющие, чистящие, дезинфицирующие средства, и средства по уходу за мебелью и полом, для борьбы с насекомыми и защиты растений, средства для отбеливания, подкрахмаливания, подсинивания, различные краски, клеи, автокосметика и др.
В быту широко используются моющие средства. Дело в том. что чистая вода хорошо удаляет с загрязненной поверхности только растворимые в ней вещества. Частицы нерастворимых веществ, но смачивающихся водой (гидрофильных), можно удалить за счет механического воздействия. Если же вещества не смачиваются водой (гидрофобные) и к тому же обладают повышенной вязкостью, то они водой практически не удаляются. Это могут быть жировые загрязнения, воск, стеарин, масла, различные органические вещества и др. В этих случаях применяют мыло, а еще лучше — синтетические моющие средства (CMC), относящиеся к группе поверхностно-активных веществ (ПАВ).
К CMC универсального действия относят стиральные порошки «Кристалл». «Наталка». «Лотос». «Астра», /[ля стирки шерстяных, шелковых и синтетических тканей используют порошки «Экстра». «Новость».
Моющее действие ПАВ объясняется их способностью связывать частицы грязи жирового происхождения с водой.
В зависимости от назначения в состав CMC входят различные щелочные добавки: силикат натрия, сода, фосфаты натрия, облегчающие процесс стирки хлопчатобумажных и льняных тканей, капрона. Но эти CMC нельзя применять при стирке изделий из шерсти и лавсана ввиду их постепенного разрушения под действием щелочной среды. Для подобных изделий применяют CMC, создающие в воде нейтральную реакцию.
При стирке изделий, имеющих загрязнения биологического происхождения, например пятна крови, используют CMC. содержащие ферменты. Но следует помнить, что нельзя стирать в очень горячей воде, поскольку ферменты при температуре выше 40 °С разрушаются.
Некоторые CMC содержат отбеливатели, разрушающие устойчивые загрязнения, придающие ткани серый или желтый цвет.
Отбеливателем может быть перборат натрия 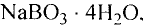 как сама пероксидная соль, так и пероксид водорода
как сама пероксидная соль, так и пероксид водорода 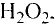 который образуется при гидролизе соли.
который образуется при гидролизе соли.
Многие искусственные волокна способны электризоваться, т. е. накапливать электрические заряды. Отрицательные заряды (электроны) могут накапливать нитрон, лавсан, ацетатные волокна. Положительный заряд (вследствие потери электронов) приобретает поверхность капрона, найлона и отчасти шерсть и шелк. Льняные и хлопчатобумажные ткани впитывают влагу, что и способствует стеканию электрических зарядов. поэтому они не электризуются.
Для предупреждения электризации изделия из синтетических тканей обрабатывают раствором «Антистатик».
Для чистки посуды, раковин в моющие средства часто вводят твердые инертные вещества — абразивы, облегчающие механическое разрушение твердых загрязнений.
Способы применения CMC и других препаратов указываются на упаковках. Их следует придерживаться, тогда использование товаров бытовой химии будет полностью безопасным.
Химическая промышленность выпускает большой ассортимент различных клеев. Прочность сцепления клея по отношению к склеиваемым поверхностям определяется силами межмолекулярного взаимодействия (электростатическими силами) или химическими силами, которые приводят к образованию химических связей.
К числу лучших смол, клеев и лаков относятся эпоксидные. Они обладают высокой прилипаемостью к стеклу, фарфору, металлам, пластмассам, дереву и обладают высоким пределом прочности. В быту широко применяются клеи типа БФ, БФ-2, БФ-5, изготовленные на основе фенолформальдегидных смол.
Выпускается широкий ассортимент средств личной гигиены и парфюмерно-косметических препаратов, средств борьбы с насекомыми и для ухода за автомобилем, пятновыводителей и многое другое. В этой области ведутся научно-исследовательские работы, и ассортимент товаров бытовой химии постоянно расширяется.
Химия и экология
В живой и неживой природе непрерывно идут различные физические, химические, биологические процессы, которые в большинстве случаев взаимосвязаны и находятся в неустойчивом равновесии; наблюдается так называемый круговорот химических элементов и веществ, например кислорода, воды, оксида углерода(IV) и др.
Деятельность человека внесла изменения в естественный круговорот элементов и веществ. В XX веке в связи с научно-техническим прогрессом особенно усилилось воздействие человека на природу, что вызвало различные негативные изменения в окружающей среде: отравление и загрязнение пресных вод, загрязнение Мирового океана и земной атмосферы, опустошение недр, истребление животных и птиц вплоть до исчезновения многих биологических видов и др. В связи с этим особое значение приобретает экология как научная основа рационального природопользования и охраны живых организмов, в том числе и человека.
Бытует мнение, что основной вред окружающей среде наносит химия, химические производства. Это не совсем так. Главными загрязнителями являются теплоэлектростанции, цветная металлургия, транспорт. Например, в атмосферу ежегодно выбрасывается 100 млн т оксида cepы (IV) 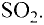 Более половины этого количества приходится на долю теплоэлектростанций. четвертая часть — на долю цветной металлургии и лишь несколько процентов — на долю черной металлургии и основной химической промышленности. То же самое можно сказать о выбросах оксидов азота и оксида углерода(IV), о твердых пылеобразных выбросах и канцерогенных микроэлементах.
Более половины этого количества приходится на долю теплоэлектростанций. четвертая часть — на долю цветной металлургии и лишь несколько процентов — на долю черной металлургии и основной химической промышленности. То же самое можно сказать о выбросах оксидов азота и оксида углерода(IV), о твердых пылеобразных выбросах и канцерогенных микроэлементах.
Химическая промышленность наряду с нефтехимией в действительности ответственна за появление в атмосфере аммиака, сероводорода, хлоридов и фторидов, формальдегида, нафталина. стирола, толуола, метанола, азотной, фосфорной, уксусной и синильной кислот.
В настоящее время в химической промышленности используют различные фильтры, пылегазоуловители, которые значительно уменьшают выброс вредных веществ в атмосферу. Улавливают и оксид серы(IV) 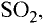 входящий в состав обжиговых газов, а затем направляют его для получения серной кислоты. К сожалению, оксид серы(IV) ТЭЦ пока еще не улавливается. Около ТЭЦ скапливаются громадные количества золы и шлаков, занимающих большие земельные площади. Химики разработали методы их утилизации, например изготовление строительных материалов — цемента, кирпича, плитки.
входящий в состав обжиговых газов, а затем направляют его для получения серной кислоты. К сожалению, оксид серы(IV) ТЭЦ пока еще не улавливается. Около ТЭЦ скапливаются громадные количества золы и шлаков, занимающих большие земельные площади. Химики разработали методы их утилизации, например изготовление строительных материалов — цемента, кирпича, плитки.
Вообще хозяйственная деятельность человека оставляет в природе большие количества различных загрязнителей. Так, при производстве чугуна огромные земельные площади занимают шлаки. Теперь их частично перерабатывают на шлакобетон, шлаковату, которая используется в качестве хорошего теплоизоляционного материала вместо асбеста. Молотый шлак применяют для дорожных покрытий, а фосфошлак — как фосфорное удобрение. Все это дает большой экономический эффект, поскольку экономит природное сырье и энергию на его переработку.
Синтетические полимеры в отличие от природных не разлагаются ферментами и остаются в природе. Когда же их после употребления сжигают, то тем самым только увеличивают загрязнение воздуха. Перед химиками стоит задача разработки способов утилизации синтетических материалов и создания новых полимеров, которые бы разлагались в природе.
Очень остро стоит вопрос о рациональном использовании воды и недопустимости загрязнения водоемов. При этом учитывается. что пресная вода составляет всего лишь около 2.5 % от общего ее количества на Земле. Кардинальное решение проблемы заключается в создании замкнутых (бессточных) технологических систем, когда использованная вода очищается и снова возвращается в производство.
Для России, где развитие производства и урбанизация значительно расширили расходование воды, это особенно важно. Общий объем водопотребления с учетом потерь достиг 30  в год. что составляет 60 % всего стока ее рек.
в год. что составляет 60 % всего стока ее рек.
В настоящее время много сделано по защите вод от загрязнения. На многих заводах построены очистные сооружения (рис. 23), нейтрализаторы, пруды-отстойники с повторным использованием воды, установки биохимической очистки промышленных стоков (Криворожский коксохимический завод) и др. (рис. 24).


Конституция устанавливает, что в интересах настоящего и будущего поколений принимаются необходимые меры для охраны и научно обоснованного рационального использования земли, ее недр, природных ресурсов с целью улучшения окружающей человека среды.
Экологические проблемы, порожденные современным общественным развитием, вызвали во всем мире общественно-политическое движение, выступающее против загрязнения окружающей среды и других отрицательных последствий научно-технического прогресса. В этом плане действует Партия зеленых.
Место химии среди наук о природе, ее значение для понимания научной картины мира
Различают три основные науки о природе — физику, химию, биологию, предметом изучения которых является материя. т. е. весь материальный мир со всем разнообразием его существования и превращений.
Материя существует в пространстве и времени и находится в непрерывном движении. Формы движения материи очень разнообразны. Они взаимно связаны и могут переходить друг в друга.
Каждая естественная наука изучает конкретную форму движения материи. Физика изучает механическое движение — перемещение масс в пространстве, что представляет собой простейшую форму движения, а также физические процессы — электромагнитные, гравитационные, ядерные, которые связаны с механическим движением, но не сводятся к нему.
Химия изучает химическую форму движения материи — химические реакции. Они включают в себя физическую форму движения, например переход электронов от атомов одних элементов к атомам других элементов, и сопровождаются физическими процессами (поглощением или выделением теплоты, света, электроэнергии и пр.). Однако химические процессы не сводятся к физическим формам движения.
Предметом изучения биологии является органическая форма движения материи (жизнь), которая невозможна без механической, химической форм движения, но не исчерпывается ими. а представляет собой качественно новую, отличающуюся от предшествующих, форму движения материи.
Приведенная классификация (и соподчиненность) форм движения носит объективный характер, поскольку отражает объективное развитие материи от простого к сложному, от низших форм к высшим. Вместе с тем она является и классификацией наук, которые эти формы изучают.
Химические знания в значительной степени формируются на основе физических и, в свою очередь, служат основой для формирования биологических знаний. В совокупности эти взаимосвязанные виды знаний дают возможность понять современную научную картину мира.
Она возникает вследствие обобщения и синтеза основных естественнонаучных понятий и принципов. Поскольку науку в общем понимании образует система взаимодействующих между собой отраслей знаний, научная картина мира образуется в результате синтеза знаний, полученных из разных наук.
В этом значении ее называют общей научной картиной мира — она включает представления как о природе, так и о жизни общества.
Изучение химии с помощью знаний о веществах, их составе. строении, свойствах, применении, о химических реакциях и закономерностях их протекания, роли химии в синтезе новых материалов и т. д. дает возможность понять научную картину химической реальности, так называемую химическую картину мира.- Она представляет собой лишь фрагмент, часть материального мира, но без нее невозможно получить целостное представление об общей научной картине мира.
Изучая химию, вы заметили, что многие представления о веществах и их превращениях по мере развития познания и практики изменялись. Так, атомно-молекулярное учение, основные положения которого были разработаны в середине XVIII в. М. В. Ломоносовым и Дж. Дальтоном, имело огромное значение для утверждения научного взгляда на картину мира. Однако с развитием науки оказалось, что не все вещества состоят из молекул, у многих веществ ионное или атомное строение. На основе новых научных взглядов химическая картина мира изменилась, ст&па более совершенной.
Первые синтезы органических веществ из неорганических, которые нанесли сокрушительный удар по виталистическому учению и доказали единство неорганической и органической природы, также привели к изменению взглядов на научную картину мира.
Следующим важным шагом в развитии взглядов на вещество была разработка А. М. Бутлеровым структурной теории, а со временем и открытие Д. И. Менделеевым периодического закона и создание периодической системы химических элементов. В результате природу стали представлять как комплекс взаимосвязанных предметов и явлений, которые находятся в непрерывном движении, изменяются, развиваются.
Успехи естествознания в изучении явления радиоактивности и сложности строения атомов позволили решать вопрос об искусственном получении, целенаправленном превращении химических элементов и высвобождении при этом внутриатомной энергии. Этим снова были внесены изменения в научную картину мира. Она стала еще более совершенной.
Человек все глубже и глубже проникает в тайны микро- и макромира. В связи с последними научными открытиями возникает ряд проблем, решение которых, по мнению ученых, может вызвать создание новых теорий, что также внесет определенные изменения в научную картину мира. Все это свидетельствует о материальности мира, разнообразии форм движения материи, ее познаваемости и неисчерпаемости.
Основные понятия химии
Вы знаете, что химия изучает химические элементы и их соединения, химические превращения различных соединений и те закономерности, которые этими превращениями управляют. Следовательно, одним из важнейших понятий в химии является понятие о химическом элементе.
Химическим элементом называется тип атомов, имеющих одинаковый заряд ядра, равный протонному числу (порядковому номеру) элемента.
Сегодня известно уже 112 химических элементов. Их классифицируют по-разному, в зависимости оттого, какой признак кладется в основу классификации (схема 2).
Каждый элемент имеет свой символ — знак химического элемента. Наличие химической азбуки позволяет отражать состав веществ с помощью химических формул.
- Что такое химическая формула и что она показывает? Покажите на конкретном примере.
Понятно, что. кроме химического элемента, вещество также является одним из основных объектов химии. И это справедливо. поскольку из веществ состоят все окружающие нас тела. Например, капли дождя, иней на ветках, туман над рекой — все это тела, состоящие из одного и того же вещества — воды.
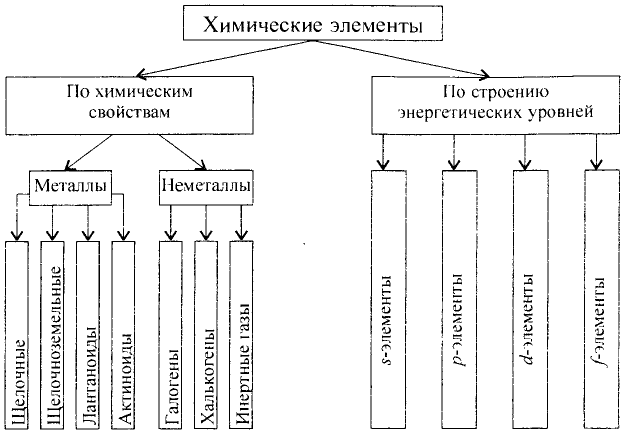
Вещество достаточно полно определяется тремя признаками: 1) занимает часть пространства; 2) обладает массой покоя; 3) построено из частиц за счет сил притяжения и отталкивания.
Химия изучает главным образом вещества, состоящие из атомов, молекул, ионов, радикалов.
В философском смысле вещество - это вид материи, обладающий массой покоя
В настоящее время известно свыше двенадцати миллионов веществ, и этот список чуть ли не ежедневно пополняется. Согласно современным представлениям о химической связи все вещества являются химическими соединениями, поскольку содержат химически связанные между собой атомы элементов: если это атомы одного элемента — простые вещества, если нескольких элементов — сложные. Так, воду можно разложить на водород 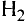 и кислород
и кислород 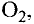 а молекулы
а молекулы 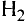 и
и 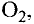 в свою очередь.— на атомы водорода Н и кислорода О. Следовательно, вещества принято разделять на простые и сложные (схема 3).
в свою очередь.— на атомы водорода Н и кислорода О. Следовательно, вещества принято разделять на простые и сложные (схема 3).
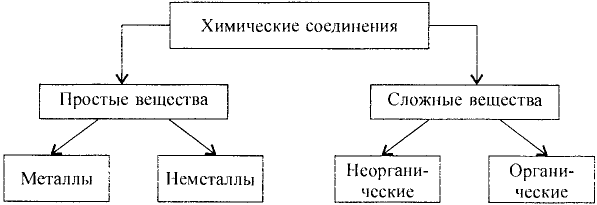
- Дайте определение и приведите примеры простых и сложных веществ, пользуясь схемой 3.
Простые вещества представляют собой формы существования элементов в свободном виде. Некоторым элементам соответствует несколько простых веществ (аллотропных форм), которые могут различаться как по составу, например кислород 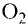 и озон
и озон 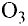 для элемента кислорода, так и по строению кристаллической решетки, например алмаз, графит, карбин для элемента углерода.
для элемента кислорода, так и по строению кристаллической решетки, например алмаз, графит, карбин для элемента углерода.
Каждому веществу присущ набор специфических свойств — объективных характеристик, которые определяют индивидуальность конкретного вещества и тем самым позволяют отличить его от всех других веществ.
Свойства веществ определяются их составом и строением, т. е. характером связей, возникших между атомами, и их пространственным расположением.
Свойства веществ существенно изменяются в зависимости от присутствующих примесей. Поэтому для чистых веществ введено понятие «химический индивид», что означает, состоящий только из атомов (молекул, ионов) определенного вида. Получение абсолютно чистых веществ, очевидно, практически невозможно, хотя в настоящее время используют методы, снижающие содержание примесей до нескольких атомов на  атомов основного элемента.
атомов основного элемента.
Сложные вещества также классифицируют по определенным признакам. Вспомним, к примеру, на какие классы делятся неорганические вещества (схема 4).
Периодическая система химических элементов
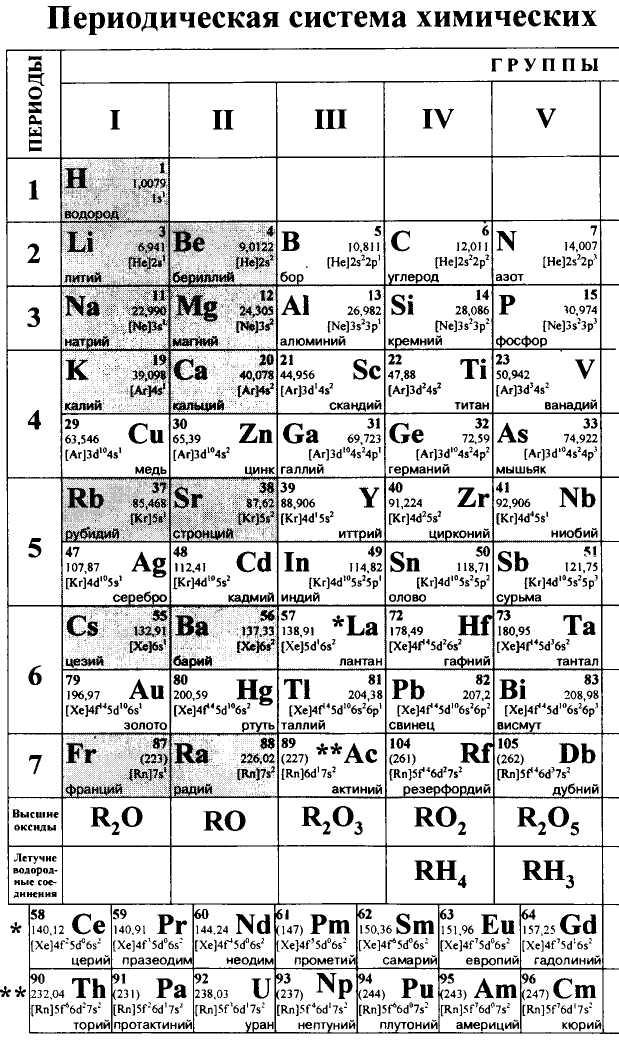
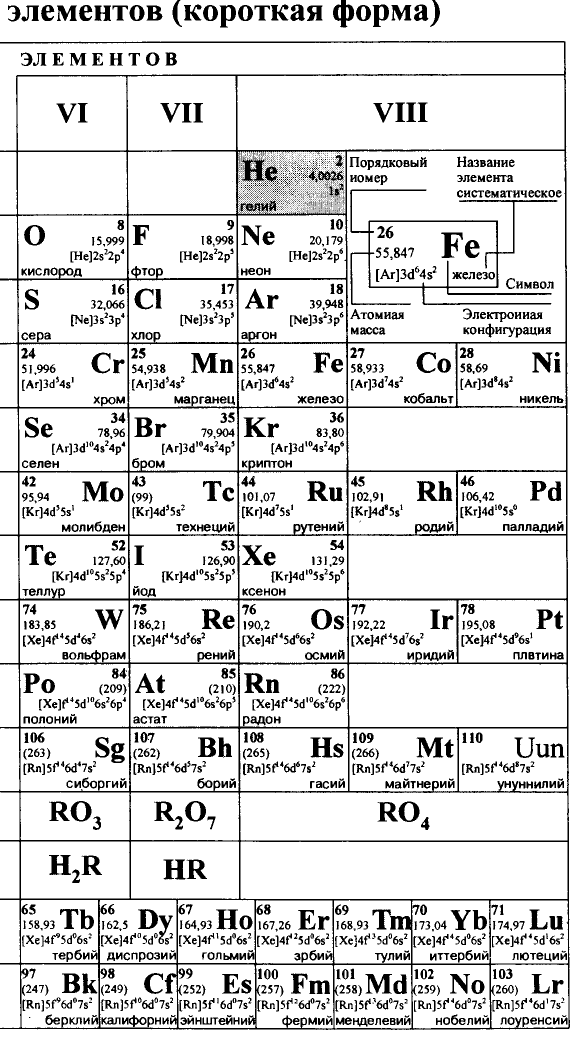
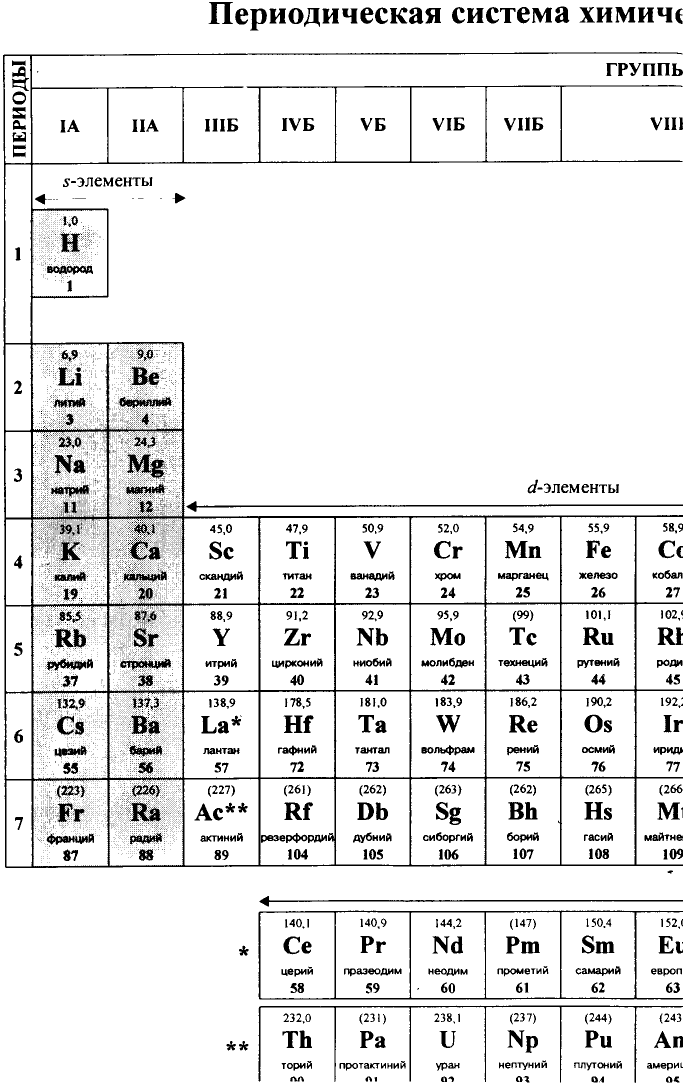
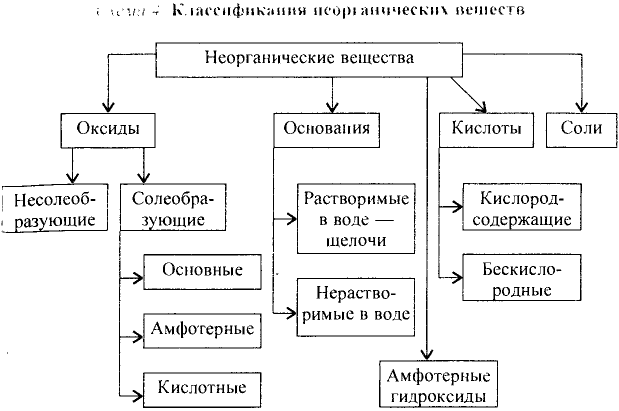
При воздействии на вещества внешних условий в' них происходят различные процессы. В зависимости от изменения вещества, вплоть до образования нового вещества, эти процессы можно разделить на несколько видов.
Физические процессы (плавление, нагревание, испарение, охлаждение, конденсация и др.), изменяя физические свойства вещества, не изменяют строения атомов или молекул, из которых состоит данное вещество, и не приводят к изменению химических свойств, к образованию нового вещества.
Химические процессы изменяют строение атомов и молекул. из которых состоят реагирующие вещества, и в результате образуются новые вещества с новыми химическими и физическими свойствами. Химические процессы — это и есть химические реакции. Их можно изображать с помощью химических уравнений.
- Как вы думаете, какие внешние изменения являются самыми характерными признаками протекания химической реакции?
Физико-химические процессы (например, растворение) являются промежуточными между физическими и химическими процессами. Они, как правило, не вызывают радикальных изменений химических свойств реагирующих веществ.
Ядерные процессы связаны с перестройкой атомов, из которых состоит вещество, и это влечет за собой изменение физических и химических свойств вещества. При этом изменяется протонное число (порядковый номер) этих атомов в периодической системе. Например:
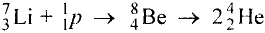
Основные законы химии и атомно-молекулярное учение
Вы уже знаете, что первые попытки объяснить устройство окружающего нас материального мира носили чисто философский характер. Еще древнегреческие философы Левкипп и Демокрит (V—IV вв. до н. э.) утверждали, что все вещества состоят из мельчайших частиц — атомов, которые находятся в постоянном и непрерывном движении: атомы разделены пустым пространством. По представлению этих мыслителей, вещества отличаются друг от друга числом и расположением образующих их атомов. Все происходящие в мире изменения они объясняли соединением и разъединением атомов, предполагая, что у атомов существует внутренний источник движения и они сами способны взаимодействовать друг с другом.
ДЕМОКРИТ
(около 460—370 до н. э.)
Величайший представитель древнегреческой философии, основоположник атомистической гипотезы объяснения мира. Ему принадлежат исследования но астрономии, геологии, зоологии, математике, физике, медицине, логике. Наряду с ним он писал сочинения об искусстве, музыке и поэзии.
Учение древнегреческих философов об атомах выглядит удивительно современно, и нам оно вполне понятно. Но в то время ни одно из его положений не было доказано. И атомистика оставалась просто догадкой, смелым предположением, философской концепцией, не подкрепленной практикой. Это привело к тому, что одна из гениальных догадок человеческого разума постепенно была предана забвению.
Об учении атомистов не вспоминали почти 20 веков. И лишь в первой половине XVII в. учение об атомах вновь возрождается благодаря работам французского философа Пьера Гассенди (1592—1655). Он утверждал, что различные виды атомов, которых в природе совсем немного, соединяясь друг с другом, образуют более крупные частицы — молекулы, из которых построены вещества.
М. В. Ломоносов в XVIII в. развил атомно-молекулярные представления в стройную естественнонаучную систему и впервые ввел их в химию. Собственно, современная химия началась с тех пор, когда были поняты и приняты большинством ученых основные положения о внутреннем строении вещества, представления об атомах как носителях свойств элементов и молекулах как носителях химических свойств различных веществ. Эти представления объединяются в атомно-молекулярное учение и помогают установить те законы, которые принято называть основными законами химии.
МИХАИЛ ВАСИЛЬЕВИЧ ЛОМОНОСОВ (1711—1765)

Русский ученый-энциклопедист. первый российский академик Петербургской АН (с 1745), один из основателей современного естествознания. Поражает широта его научных интересов и глубина проникновения в тайны, природы. Но словам А. С. Пушкина: «Историк, ритор, механик, химик, минералог, художник и стихотворец — он все испытал и все постиг». В своих теоретических представлениях исходил из атомно-молекулярной теории строения вещества и принципа сохранения вещества и движения. Ввел в химию количественные методы исследования. Заложил основы физической химии.
Закон сохранения массы. Исключительное значение для развития химии имело установление закона сохранения массы, являющегося следствием всеобщего закона сохранения материи и движения, сформулированного М. В. Ломоносовым в 1748 г. как всеобщий естественный закон: «Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимается, столько присовокупится к другому: так ежели где убудет несколько материи, то умножится в другом месте... Сей всеобщий закон простирается и в самые правила движения; ибо тело, движущее своей силой другое, столько же оныя у себя теряет, сколько сообщает другому, которое от него движение получает».
В 1756 г. М. В. Ломоносов экспериментально подтвердил это положение, высказанное в виде философской концепции, проводя опыты по обжигу металлов в запаянной реторте.
Независимо от Ломоносова, закон сохранения массы был открыт и введен в химию французским ученым Антуаном Лавуазье в 1789 г., который сделал еще один важный вывод, что при химических реакциях сохраняется не только общая масса веществ, но и масса каждого элемента, входящего в состав реагирующих веществ. Следовательно, при химических реакциях элементы не превращаются друг в друга, а сохраняются.
АНТУАН ЛАВУАЗЬЕ (1743—1794)

Французский ученый, один из основателей современной химии. Экспериментально доказал. что воздух — не простое тело, как считалось в то время, а смесь различных по свойствам газов. Предложил название «кислород» и объяснил ею роль в процессах обжига, горения, дыхания. Дал определение химического элемента. установил химический состав воды, оксидов азота, углекислого газа, серной кислоты. ряда минералов. Доказал закон сохранения массы вещества. Один из основателей термохимии. Гильотинирован в период Французской революции.
Современная формулировка закона сохранения массы следующая:
- масса веществ, вступивших в химическую реакцию, равна массе веществ, получившихся в результате реакции.
Это можно объяснить тем, что в процессе химической реакции происходит только перегруппировка атомов, но число атомов и масса каждого атома остаются постоянными. Если же число атомов каждого элемента, а следовательно их общая масса, не изменяются, то и масса реагентов должна всегда быть равной массе продуктов.
Закон сохранения массы сыграл значительную роль в становлении атомно-молекулярного учения и дальнейшем развитии химии как науки.
На основании закона сохранения массы составляются уравнения химических реакций и производятся практически важные расчеты.
Закон постоянства состава. Следующим шагом в развитии химии явилось установление положения о постоянстве состава веществ, выведенного французским ученым Ж. Прустом:
каждое химически чистое вещество имеет постоянный состав, независимо от условий и способов его получения.
ЖОЗЕФ ПРУСТ (1754—1826)

Французский химик, член Парижской АН (с 1816). Установил закон постоянства состава химических соединений. Открыл гидроксилы металлов, предложил термин «гидрат». Исследовал ряд оксидов и сульфидов металлов. Работал также в области органической химии, выделил глюкозу, открыл аминокислоту лейцин. исследовал камфару, крахмал, сахар.
Например, воду можно получить любым способом:
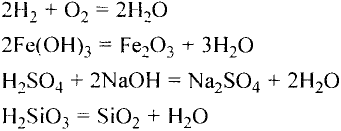
Соотношение атомов водорода и кислорода в молекуле воды всегда 2 : 1, а массовое соотношение 2:16 или 1 : 8 (учитывая. что 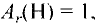 а
а 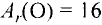 ). Массовые доли водорода и кислорода в химически чистом образце воды соответственно составляют 11.12 % и 88.88 %.
). Массовые доли водорода и кислорода в химически чистом образце воды соответственно составляют 11.12 % и 88.88 %.
Итак, если вещество представляет собой индивидуальное химическое соединение (без примесей), то состав его постоянен и не зависит от способа получения. Отклонение от указанного состава свидетельствует о присутствии примесей. Однако обратное утверждение — каждому определенному составу отвечает только одно химическое соединение — неверно. Например, диметиловый эфир 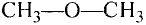 и этиловый спирт
и этиловый спирт 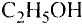 имеют одинаковый химический сослав
имеют одинаковый химический сослав 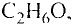 но являются различными химическими соединениями, отличающимися друг от друга структурой молекул, т. е. порядком соединения в них атомов.
но являются различными химическими соединениями, отличающимися друг от друга структурой молекул, т. е. порядком соединения в них атомов.
Вещества с одинаковым химическим составом и различным строением называются изомерами.
Следовательно, количественный состав сам по себе не определяет специфику вещества.
Правильность высказанного Ж. Прустом положения о постоянстве состава веществ отрицал известный в то время авторитет, французский химик К. Бертолле, считавший, что состав вещества может изменяться в определенных пределах.
Вопрос о постоянстве состава веществ стал предметом семилетнего спора между Ж. Прустом и К. Бертолле. В результате тщательной экспериментальной проверки взглядам Ж. Пруста в то время было отдано предпочтение. Высказанное им положение в 1808 г. было признано законом постоянства состава.
В действительности же взгляды обоих ученых были справедливы. Это доказал русский химик академик Н. С. Курнаков, который в начале XX в. сформулировал представление о веществах постоянного состава — дальтонидах и переменного состава — бертоллидах.
Следовательно, закон постоянства состава не является справедливым для всех веществ. В свое время он сыграл важную роль, способствуя укреплению в химии атомно-молеку-лярного учения, поскольку позволил рассматривать химическое соединение как вещество, состоящее из определенных молекул и потому имеющее постоянный состав. В то время (до начала XX в.) считалось, что все вещества состоят из молекул.
- А что вам сегодня известно о составе вещества? Назовите в качестве примера какие-либо частицы, которые, по вашему мнению. входят в состав вещества.
В настоящее время высказанное Ж. Прустом положение законом не считается. Известно, что многие вещества имеют немолекулярное строение. Их состав может меняться в определенных пределах в зависимости от условий получения. Кроме того, даже некоторые вещества молекулярного строения, например полимеры, не имеют постоянного состава.
Закон объемных отношений
Известно, что масса веществ при химических реакциях сохраняется постоянной. В отличие от массы объем реагентов может существенно меняться. Это происходит тогда, когда в реакции принимают участие газообразные вещества или образуются газообразные продукты.
Измеряя объемы газов, вступивших в реакцию и образовавшихся в результате ее, французский ученый Ж. Гей-Люссак в 1808 г. сформулировал закон объемных отношений, известный как «химический» закон Гей-Люссака:
- объемы вступивших в реакцию газов относятся друг к другу и к объемам полученных газообразных продуктов как небольшие целые числа.
ЖОЗЕФ-ЛУИ ГЕЙ-ЛЮССАК (1778—1850)

Французский химик и физик. Открыл газовые законы, названные его именем. Занимался фундаментальными исследованиями п области физической, неорганической и органической химии. Внес весомый вклад в изучение галогенов, фосфорных кислот, щелочных металлов. Содействовал распространению объемных методов в аналитической химии. Открыл циан (1815), разработал метод приготовления щавелевой кислоты. Сконструировал башню с системой свинцовых камер, которая в технологии серной кислоты носит его имя.
При этом считается, что все объемы газов приведены к одинаковым температуре и давлению. Например, при синтезе хлороводорода из простых веществ — водорода и хлора
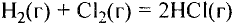
соотношение объемов газов следующее:
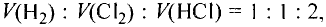
т. е. 1 л водорода соединяется с I л хлора и при этом образуется 2 л хлороводорода. Следовательно, в уравнениях химических реакций коэффициенты перед формулами газообразных веществ соответствуют их объемам.
Закон Авогадро
Выявленную Ж. Гей-Люссаком закономерность объясняет закон, открытый в 1811 г. итальянским ученым Амедео Авогадро.
В равных объемах различных газов при одинаковых условиях (давлении и температуре) содержится одинаковое число молекул.
АМЕДЕО АВОГАДРО (1776—1856)

Итальянский физик и химик. Заложил основы молекулярной теории, открыл один из газовых законов, названный его именем. Определил состав и относительную молекулярную массу многих веществ. Доказал, что молекулы водорода, кислорода, азота, хлора двухатомны. Его работы способствовали дальнейшему развитию атомно-молекулярной теории.
Из закона Авогардо вытекают два следствия.
Следствие первое:
- один моль любого газа при одинаковых условиях занимает одинаковый объем.
При нормальных условиях (давлении в 1 атм (101325 Па) и температуре 273,15 К или 0 °С) объем 1 моль любого газа будет равен 22,4 л. Постоянная  = 22.4 л/моль называется молярным объемом газа при нормальных условиях (н. у.). При любых условиях молярный объем газа — это величина, равная отношению объема газа при данных условиях к количеству вещества этого газа
= 22.4 л/моль называется молярным объемом газа при нормальных условиях (н. у.). При любых условиях молярный объем газа — это величина, равная отношению объема газа при данных условиях к количеству вещества этого газа
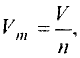
где 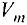 — молярный объем газа,
— молярный объем газа, 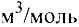 (л/моль): V — объем газа при данных условиях,
(л/моль): V — объем газа при данных условиях, 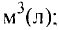 n — количество вещества газа, моль.
n — количество вещества газа, моль.
При стандартных условиях (давлении в 1 атм (101325 Па) и температуре 298,15 К или 25 °С) молярный объем газа равен не 22,4, а 24,4 л/моль.
Молярный объем газа 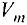 можно вычислить также, зная молярную массу газа М и его плотность.
можно вычислить также, зная молярную массу газа М и его плотность.
Молярный объем газа — это величина, равная отношению молярной массы газа к его плотности
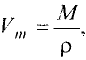
где  — молярный объем газа,
— молярный объем газа,  (л/моль); М — молярная масса газа, кг/моль (г/моль);
(л/моль); М — молярная масса газа, кг/моль (г/моль);  — плотность газа,
— плотность газа,  (г/л).
(г/л).
Следствие второе: масса одного и того же объема газа тем больше, чем больше масса его молекул. Если в одинаковых объемах газов при одних и тех же условиях содержится одинаковое число молекул, то очевидно, что отношение масс одинаковых объемов газов при одних и тех же условиях равно отношению их молярных масс
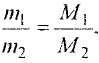
где  — масса определенного объема первого газа;
— масса определенного объема первого газа;  — масса такого же объема второго газа;
— масса такого же объема второго газа; 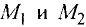 — молярные массы соответственно первого и второго газов.
— молярные массы соответственно первого и второго газов.
Отношение массы определенного объема данного газа к массе такого же объема другого газа (взятого при тех же условиях) называется относительной плотностью первого газа по второму:
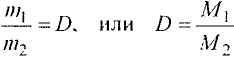
Следовательно, можно утверждать, что
плотности различных газов, взятых при одинаковых условиях, пропорциональны их молярным массам
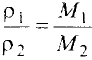
Периодический закон
Основываясь на атомно-молекулярном учении и химических свойствах элементов, Д. И. Менделеев в 1869 г. открыл периодический закон — один из основных законов природы. Современная формулировка периодического закона:
свойства элементов, а также свойства образуемых ими простых и сложных веществ находятся в периодической зависимости от зарядов ядер их атомов.
- Вспомните историю открытия Д. И. Менделеевым периодического закона.
- Расскажите о периодической системе с точки зрения строения атома.
Кроме известной вам так называемой короткой формы изображения периодической системы, используется еще и «длинная» форма, также предложенная самим Менделеевым. Вообще-то существует много вариантов изображения периодической системы и не только в виде таблицы. Но из табличных вариантов в настоящее время наиболее распространенными являются короткая и длинная формы. Они взаимно дополняют друг друга и в целом идентичны. Однако в последнее время длинная форма приобретает большую популярность, поскольку она ярче согласуется со строением атомов химических элементов.
В длинной форме (см. вклейку) большие периоды, так же как и малые, занимают только одну горизонталь, на два ряда не делятся. Слева располагаются s-элементы, в атомах которых заполняются s-орбитали; справа — p-элементы, в атомах которых заполняются p-орбитали. У s- и p-элементов заполняется внешний электронный слой. Среднюю часть больших периодов занимают так называемые переходные элементы, в атомах которых заполняются d-орбитали предвнешнего слоя. Семейства лантаноидов и актиноидов — это f-элементы. У них заполняется третий снаружи слой. Эти семейства, как правило, выносят за пределы таблицы как в короткой, так и в длинной формах. Различие в последовательности заполнения электронных слоев (внешних и более глубоко расположенных) объясняет причину различной длины периодов.
Длинная форма периодической системы включает 16 групп — 8 главных и 8 побочных (подгрупп нет), обозначаемых буквами А и Б. Положение в группах s- и p-элементов определяется общим числом электронов внешнего слоя, а d-элементов — общим числом s-электронов внешнего и d-электронов предвнешнего слоев. Периодическая повторяемость строения внешних электронных оболочек атомов является причиной периодического изменения свойств химических элементов. В этом заключается физическая сущность периодического закона, которая не зависит от формы представления периодической системы элементов.
Открытие в конце XIX в. электрона, радиоактивности, сложного строения атома, элементарных частиц привело к тому, что многие положения классического атомно-молекулярного учения пришлось пересмотреть. Так. еще Д. И. Менделеев говорил об атоме как о химически неделимой частице. Исследование свойств твердых тел показало, что в подавляющем большинстве случаев молекулярная теория к ним неприменима. Кристаллы солей состоят не из молекул, а из ионов, существование которых никак не вытекает из основ атомно-молекулярной теории.
ДМИТРИЙ ИВАНОВИЧ МЕНДЕЛЕЕВ (1834—1907)

Русский химик, разносторонний ученый, педагог, прогрессивный общественный деятель. Открыл периодический закон химических элементов (1869). Создал периодическую систему, которую неустанно совершенствовал. Она получила полное признание еще при жизни Менделеева. Поражает широта интересов ученого: он автор многих фундаментальных исследований но химии, химической технологии, физике, метрологии. воздухоплаванию, метеорологии, сельскому хозяйству, народному просвещению и др. Был избран членом Лондонского королевского общества, Римской. Парижской. Берлинской АН. а также почетным членом многих научных обществ России, Западной Европы и Америки.
И все же основные представления атомно-молекулярной теории прочно вошли в химическую науку. Все открытия физики и химии XX в. привели лишь к сужению границ применимости этой теории, но не поколебали ее основ. Даже современная квантовая химия, в рамках которой нет никакой необходимости рассматривать молекулы как частицы, состоящие из атомов, сохраняет эти представления.
Основы атомно-молекулярного учения широко используются не только в современной химии, но и в физике, биологии, геологии, астрономии и других естественных науках.
Химическая связь
Учение о химической связи — одно из основных в химии. Ведь химические элементы встречаются в природе главным образом не в виде отдельных атомов, а в виде простых или сложных веществ. Лишь немногие химические элементы — гелий Не, неон Ne, аргон Аr, криптон Кr, ксенон Хе — в природных условиях находятся в атомном состоянии (в состоянии одноатомного газа), что объясняется устойчивостью электронных оболочек атомов инертных газов.
Свободные атомы всех остальных химических элементов стремятся образовать более сложные системы — молекулы или иные агрегаты атомов, где последние связаны химическими силами, имеющими электростатическую природу. При этом образуются различные типы химической связи, основные из них — это ковалентная. ионная, металлическая.
Ковалентная связь
Связь, осуществляемая посредством общих электронных пар, называется ковалентной.
Вы уже знаете, что среди свободных атомов различных химических элементов наиболее стабильной электронной конфигурацией обладают атомы гелия  и атомы остальных инертных газов
и атомы остальных инертных газов 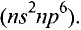 Можно ожидать, что атомы других химических элементов стремятся приобрести электронную конфигурацию ближайшего инертного газа как отвечающую минимуму энергии и, следовательно, наиболее стабильную. Это достигается, например, при образовании общих электронных пар, в одинаковой мере принадлежащих соединяющимся атомам и взаимодополняющих их электронную оболочку до устойчивой конфигурации типа
Можно ожидать, что атомы других химических элементов стремятся приобрести электронную конфигурацию ближайшего инертного газа как отвечающую минимуму энергии и, следовательно, наиболее стабильную. Это достигается, например, при образовании общих электронных пар, в одинаковой мере принадлежащих соединяющимся атомам и взаимодополняющих их электронную оболочку до устойчивой конфигурации типа 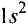 или
или 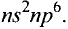 Так образуются. например, молекулы галогенов, метана и многих других органических и неорганических веществ:
Так образуются. например, молекулы галогенов, метана и многих других органических и неорганических веществ:
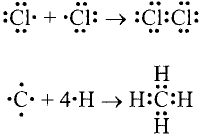
Ковалентная связь, как мы видим на примере хлора, может возникать не только между одинаковыми, но и между разными атомами, как в молекуле метана. Рассмотрим еще пример:
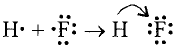
В этом случае образовавшаяся общая электронная пара испытывает более сильное притяжение со стороны атома фтора как более электроотрицательного элемента. Происходит смещение общей электронной пары в сторону более электроотрицательного элемента и образуется полярная ковалентная связь 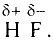
Разновидностью полярной ковалентной связи является связь, образованная по донорно-акцепторному механизму.
Такая связь присутствует в ионах аммония и гидроксония. Например, при взаимодействии аммиака с соляной кислотой образуется хлорид аммония 
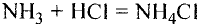
В ионной форме:
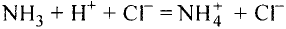
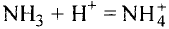
Как же образовался ион аммония  ? За счет чего ион водорода присоединился к молекуле аммиака?
? За счет чего ион водорода присоединился к молекуле аммиака?
В молекуле аммиака  атом азота имеет неподеленную электронную пару, которая переходит на свободную орбиталь иона водорода и становится общей для азота и водорода, в результате чего образуется ион аммония:
атом азота имеет неподеленную электронную пару, которая переходит на свободную орбиталь иона водорода и становится общей для азота и водорода, в результате чего образуется ион аммония:
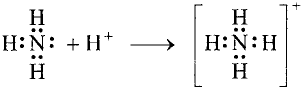
Частичка, предоставившая для образования химической связи неподеленную электронную пару электронов, называется донором, а частичка, принявшая эту пару электронов на свою свободную орбиталь, называется акцептором.
Механизм образования ковалентной связи за счет неподеленной пары электронов одного атома и свободной орбита ли другою называется донорно-акцепторным.
При этом все четыре связи  в ионе аммония
в ионе аммония 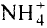 во всех отношениях равноценны (по длине связи, энергии и пр.). Они лишь образовались различными способами.
во всех отношениях равноценны (по длине связи, энергии и пр.). Они лишь образовались различными способами.
Следовательно, известно два механизма образования ковалентной связи:
- Механизм спаривания, когда каждый атом, образуя ко-валентную связь, поставляет по одному электрону для образования общей электронной пары, принадлежащей обоим атомам.
- Донорно-акцепторный механизм, когда электронная пара для образования связи поставляется только одним атомом.
Ионная связь
Химическая связь, обусловленная электростатическим притяжением разноименно заряженных ионов, в которые превращаются атомы в результате отдачи или присоединения электронов, называется ионной.
Устойчивая электронная конфигурация атома (как у ближайшего инертного элемента) может быть достигнута за счет перехода электронов одного свободного атома к другому с образованием ионов, которые соединяются силами электростатического притяжения. Например, при взаимодействии атомов натрия 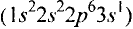 с атомами хлора
с атомами хлора 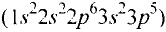 происходит переход электрона с Зp-орбитали атома натрия на 3/>- орбиталь атома хлора. При этом атом натрия превращается в положительно заряженный ион со стабильной конфигурацией ближайшего инертного элемента— неона
происходит переход электрона с Зp-орбитали атома натрия на 3/>- орбиталь атома хлора. При этом атом натрия превращается в положительно заряженный ион со стабильной конфигурацией ближайшего инертного элемента— неона 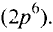 Атом же хлора принимает этот электрон на 3p-орбиталь, превращаясь в отрицательно заряженный ион с электронной конфигурацией
Атом же хлора принимает этот электрон на 3p-орбиталь, превращаясь в отрицательно заряженный ион с электронной конфигурацией 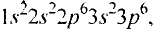 характерной для аргона. Противоположно заряженные ионы прочно удерживаются силами электростатического притяжения. Этот процесс можно отразить схемой:
характерной для аргона. Противоположно заряженные ионы прочно удерживаются силами электростатического притяжения. Этот процесс можно отразить схемой:
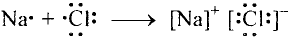
Следовательно, ионную связь можно рассматривать как крайний случай полярной ковалентной связи.
Ионная связь образуется между атомами таких элементов, которые значительно отличаются по своей электроотрицательности. Американский ученый Лайнус Полинг определил электроотрицательность как способность атомов в молекуле притягивать электроны. Чем выше разность электроотрицательностей у атомов, тем выше степень ионности связи.
Провести резкую границу между различными типами химической связи невозможно. Это объясняется тем, что тип связи зависит от различных значений электроотрицательностей атомов элементов, которые взаимодействуют друг с другом, от характера распределения электронной плотности в веществе и др. Поэтому в большинстве соединений химические связи в действительности оказываются промежуточными между неполярной ковалентной и ионной связями, а в «чистом» виде они встречаются редко.
Металлическая связь
Это особый вид связи, обусловленный тем, что у атомов всех металлов имеется избыток орбиталей, но недостаток электронов. Например, рассмотрим строение электронной оболочки атома лития или натрия:
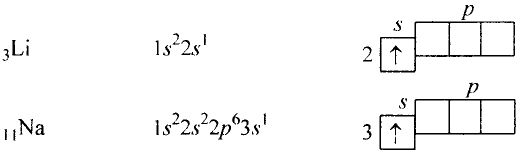
На внешнем электронном уровне единственный валентный электрон занимает одну из четырех орбиталей. В кристалле лития или натрия это позволяет валентным электронам свободно перемешаться в пространстве, переходя с одной орбита-ли на другую. Такие электроны становятся обобществленными (электронный газ), как бы принадлежащими всем атомам лития (натрия) одновременно. Более того, непрерывно перемещаясь между положительными ионами и электростатически притягивая их. эти обобществленные электроны обеспечивают металлическую связь, стабильность металлической решетки.
Металлическая связь — это тип химической связи, обусловленный взаимодействием валентных электронов (электронного газа) с положительно заряженными ионами кристаллической решетки металлов.
Металлическая связь является делокализованной: она не имеет определенной направленности, поскольку в ее образовании принимают участие все атомы куска металла.
Водородная связь
Атомы водорода одной молекулы могут взаимодействовать с атомами очень электроотрицательных элементов (О, N, F) другой молекулы, образуя так называемую водородную связь. Например, в молекуле фтороводорода HF связь между атомами водорода и фтора ковалентная и сильно полярная, поскольку фтор более электроотрицательный элемент. Общая электронная пара сильно смещена к атому фтора (показывается стрелкой). В результате на атоме фтора возникает частичный отрицательный заряд  (дельта минус), а на атоме водорода — частичный положительный заряд
(дельта минус), а на атоме водорода — частичный положительный заряд  (дельта плюс):
(дельта плюс):

(частичные заряды по абсолютному значению меньше 1).
Молекула HF становится полярной, возникает диполь, который может взаимодействовать с диполем другой молекулы за счет электростатического притяжения, образу я водородную связь (обозначается тремя точками):
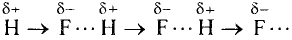
Наряду с электростатическим взаимодействием при образовании водородной связи проявляется и донорно-акцепторное взаимодействие. Это объясняется тем, что атом водорода положительно поляризуется при смещении единственного электрона и, имея очень малые размеры, создает электрическое поле высокого напряжения, вследствие чего он может глубоко внедряться в электронную оболочку соседнего, ковалентно с ним не связанного, отрицательно поляризованного атома. Поэтому водород в данном случае условно называют акцептором, а фтор — донором электронов.
Водородная связь слабее ионной или ковалентной. но она значительно прочнее обычного межмолекулярного взаимодействия.
Водородная связь встречается во многих неорганических и органических веществах (вода, аммиак, спирты, карбоновые кислоты, белки). Например, молекулы воды, где общие электронные пары сильно смещены к кислороду, могут образовывать четыре водородные связи:
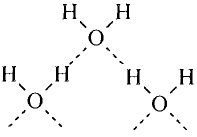
Между молекулами спиртов также возникает химическое взаимодействие — водородная связь:
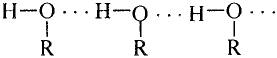
Водородная связь очень распространена в природе. Она играет важную роль при ассоциации молекул, в процессах растворения, кристаллизации, электролитической диссоциации и в других важных физико-химических процессах. Предполагают. что водородная связь играет большую роль в механизме наследственности: действие памяти связывают с хранением информации в молекулярных образованиях с водородными связями.
Строение неорганических и органических веществ
В зависимости от физических условий (температуры и давления) вещества могут существовать в различных агрегатных состояниях: газообразном, жидком, твердом (кристаллическом и аморфном), плазменном.
Плазменное состояние достигается при высоких температурах. когда вещества испаряются, распадаются на атомы, которые превращаются в ионы. Таким образом, плазма — это ионизированный газ.
В газах расстояния между частицами (атомами, молекулами) большие. Вследствие этого газообразное состояние характеризуется слабым взаимодействием частиц и неупорядоченным их расположением (частицы свободно перемещаются и занимают весь предоставленный им объем).
В жидкостях частицы расположены значительно ближе друг к другу, поэтому взаимодействие между ними сильнее, чем в (азах. Структура жидкости характеризуется определенным порядком в расположении частиц, однако он постоянно меняется вследствие теплового движения частиц.
Наиболее упорядоченным является кристаллическое состояние.
Кристаллические решетки
Почти все твердые вещества имеют кристаллическое строение. Структура кристаллических веществ может быть представлена при помощи кристаллической решетки — определенного пространственного расположения частиц (атомов, молекул, ионов). В зависимости от того, какие частицы находятся в узлах решетки и от природы химической связи частиц в кристалле, различают ионные, атомные. молекулярные и металлические кристаллические решетки (рис. 25).
В узлах ионных кристаллических решеток находятся положительно и отрицательно заряженные ионы, как простые, например  так и сложные, например
так и сложные, например  Они связаны друг с другом силами электростатического притяжения. т. е. в ионных кристаллах существует ионная связь. К соединениям с ионными решетками относятся большинство солей и некоторые оксиды.
Они связаны друг с другом силами электростатического притяжения. т. е. в ионных кристаллах существует ионная связь. К соединениям с ионными решетками относятся большинство солей и некоторые оксиды.
В узлах атомных кристаллических решеток находятся атомы. связанные между собой ковалентной химической связью (алмаз, диоксид кремния и др.).
Много веществ с молекулярной кристаллической решеткой, в узлах которой располагаются молекулы, связанные между собой силами межмолекулярного взаимодействия. Это неметаллы. кроме углерода и кремния (водород, кислород, азот, инертные газы), почти все органические вещества и многие неорганические соединения (диоксид углерода, озон, вода и др.).
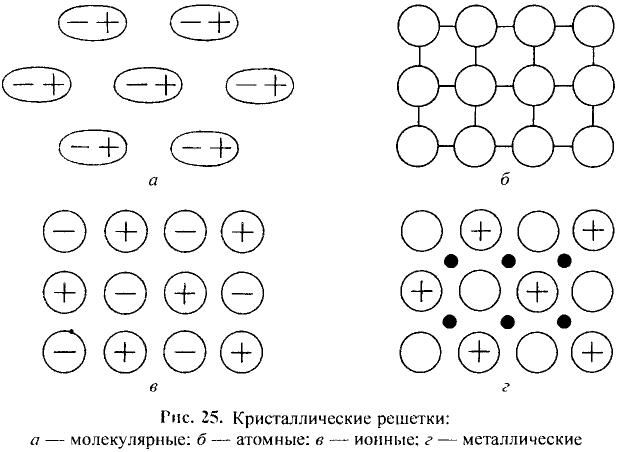
В узлах металлических кристаллических решеток расположены отдельные атомы и положительно заряженные ионы металла, между которыми находится электронный газ (рис. 25, г).
Менее распространено для твердых тел аморфное состояние. В отличие от кристаллических тел вещества в аморфном состоянии не имеют строго регулярного упорядоченного строения и определенной температуры плавления (при нагревании они размягчаются и постепенно переходят в жидкое состояние).
Различие в типе химической связи кристаллов определяет существенное отличие физических и химических свойств веществ с разными кристаллическими решетками. Так, вещества с атомной кристаллической решеткой характеризуются высокой твердостью, тугоплавкостью, нерастворимостью практически ни в каких растворителях.
Вещества с молекулярной кристаллической решеткой, напротив. легкоплавки, летучи, характеризуются небольшой твердостью. Причина в том, что силы межмолекулярного взаимодействия значительно слабее, чем силы ковалентной связи.
Вещества с ионными кристаллическими решетками по прочности занимают промежуточное положение: уступают веществам с атомной решеткой, но превосходят вещества с молекулярной решеткой. Они обладают сравнительно высокой температурой плавления, как правило, нелетучи.
Зависимость свойств кристаллических веществ от типа химической связи между частичками показаны в табл. 4.
Теория химического строения. Понятие «химическое строение» впервые ввел А. М. Бутлеров в 1861 г. Он отмечал, что свойства веществ определяются не только их составом (качественным и количественным), как считалось раньше, но и внутренней структурой молекул, т. е. порядком соединения между собой атомов, входящих в состав молекулы. Этот порядок и является химическим строением молекулы.
АЛЕКСАНДР МИХАЙЛОВИЧ БУТЛЕРОВ (1828—1886)

Русский химик-органик, профессор Казанского (1854—1868). а затем до конца жизни профессор Петербургского университетов, академик Петербургской АН (с 1871). Почетный член Московского и Киевского университетов. Глава большой школы русских химиков-органиков. Создал и обосновал теорию химического строения. Первым объяснил явление изомерии. Получил изобутилен и открыл реакцию его полимеризации. Синтезировал ряд органических соединений, в том числе осуществил первый в истории химии синтез сахаристого вещества (1861). Его труды по гидратации этилена легли в основу одного из современных способов получения этилового спирта.
В понятие «химическое строение» А. М. Бутлеров включал также характер связи атомов и их взаимное влияние друг на друга. Например, водород и кислород, образовавшие воду, настолько изменились от взаимного влияния, что вода уже не имеет свойств ни водорода, ни кислорода, из которых она образовалась, хотя и содержит элементы водород и кислород, входившие ранее в исходные простые вещества.
В молекуле фенола 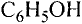 бензольное ядро влияет на гидроксильную группу, усиливая ее кислотность (аналогия со спиртами):
бензольное ядро влияет на гидроксильную группу, усиливая ее кислотность (аналогия со спиртами):
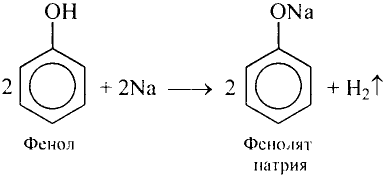
Гидроксильная группа, в свою очередь, влияет на бензольное ядро, облегчая замещение в нем атомов водорода:
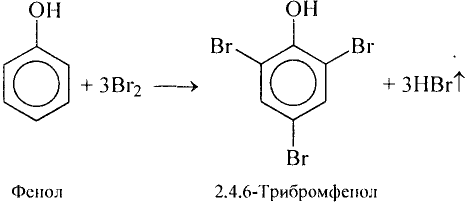
Так, на примерах из неорганической и органической химии мы наблюдаем взаимное влияние атомов.
Вы уже знаете, что химическое строение молекул выражают с помощью структурных формул.
Структурные формулы показывают порядок связи атомов в молекуле, но не отображают взаимного расположения их в пространстве.
Структурные формулы всегда записывают для отдельной молекулы, обозначая черточкой каждую связывающую электронную пару. Они справедливы только для веществ молекулярного строения. К таким веществам относятся большинство органических соединений, кислородсодержащие кислоты (кроме 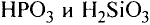 ) и некоторые оксиды неметаллов (
) и некоторые оксиды неметаллов (
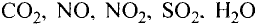 и др.). Так. структурные формулы серной и уксусной кислот
и др.). Так. структурные формулы серной и уксусной кислот

передают порядок расположения атомов в молекулах этих кислот.
Структурные формулы не следует путать с устаревшим графическим изображением формул, где черточкой изображается не общая электронная пара, а степень окисления элемента. Например, графическое изображение формулы хлорида натрия  нельзя считать структурной формулой, поскольку
нельзя считать структурной формулой, поскольку 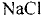 — ионное соединение. В узлах его кристаллической решетки содержатся не молекулы, а ионы
— ионное соединение. В узлах его кристаллической решетки содержатся не молекулы, а ионы 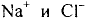 . Между ними нет связи, образованной нарой электронов. Ионы
. Между ними нет связи, образованной нарой электронов. Ионы 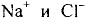 удерживаются вместе благодаря электростатическому притяжению.
удерживаются вместе благодаря электростатическому притяжению.
Представляя химическую структуру как определенную последовательность атомов в молекуле и их взаимное влияние друг на друга, А. М. Бутлерову удалось раскрыть суть явления изомерии, известного со времен Й. Берцелиуса. Это объясняется тем, что порядок соединения атомов в молекуле влияет на свойства веществ.
Изомерия — это явление существования веществ с одинаковым качественным и количественным составом, но различным химическим строением, а потому и разными свойствами.
Теория химического строения, которая вначале была сформулирована как учение о строении органических веществ, оказалась справедливой и для неорганических веществ, имеющих молекулярное строение. В результате она стала общей теорией химии.
Взаимосвязь состава, строения, свойств и применения неорганических и органических соединений
Па протяжении всего курса химии вы изучали свойства различных веществ в неразрывной связи с их составом и строением. Это позволяло характеризовать вещества вполне осмысленно. Например, в самом начале курса вы изучали свойства кислорода, водорода и воды на основе атомно-молекулярных представлений и научились объяснять свойства с точки зрения состава этих веществ.
Затем вы обогатились конкретным материалом о веществах и их свойствах, узнали о видах химической связи и усвоили закономерность о зависимости некоторых физических свойств веществ от типов кристаллических решеток и уже знаете:
- если известно строение веществ, то можно предсказать их свойства, и наоборот: если известны свойства веществ, то можно определить их строение.
Например, вам предлагают определить свойства хлорида калия KCI. Зная, что это вещество с ионной связью, в кристаллах которого между ионами 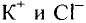 действуют кулоновские силы притяжения, обеспечивая прочную связь, вы приходите к выводу, что хлорид калия — твердое вещество. тугоплавкое, нелетучее (малолетучее). Либо вам предлагают, например, сравнить вещества — фторид натрия NaF, фтор
действуют кулоновские силы притяжения, обеспечивая прочную связь, вы приходите к выводу, что хлорид калия — твердое вещество. тугоплавкое, нелетучее (малолетучее). Либо вам предлагают, например, сравнить вещества — фторид натрия NaF, фтор 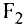 и фтороводород HF и предсказать, какое из них будет наиболее тугоплавким, а какое — самым легкоплавким.
и фтороводород HF и предсказать, какое из них будет наиболее тугоплавким, а какое — самым легкоплавким.
Вы сразу же обращаете внимание на состав и строение этих веществ. Фторид натрия NaF состоит из атомов натрия и фтора, которые резко отличаются друг от друга своей электроотрицательностью. Атом фтора как более электроотрицательный оттягивает на себя единственный электрон с внешней электронной оболочки атома натрия, в результате чего возникают ионы. Значит, это соединение с ионной связью. Отсюда следует, что в узлах кристаллической решетки находятся ионы 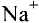 и фтора
и фтора 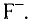 Между ними действуют электростатические силы притяжения, которые сравнительно велики. Поэтому, чтобы расплавить фторид натрия, нужно эти силы преодолеть, разрушить кристаллическую решетку. А это означает, что температура плавления фторида натрия должна быть высокой.
Между ними действуют электростатические силы притяжения, которые сравнительно велики. Поэтому, чтобы расплавить фторид натрия, нужно эти силы преодолеть, разрушить кристаллическую решетку. А это означает, что температура плавления фторида натрия должна быть высокой.
Проанализируем теперь молекулу фтора 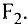 Она состоит из одинаковых атомов, с одинаковой электроотрицательностью, значит, химическая связь ковалентная неполярная. В узлах кристаллической решетки фтора находятся неполярные молекулы Межмолекулярные силы сцепления слабые. Следовательно, фтор должен иметь низкую температуру плавления.
Она состоит из одинаковых атомов, с одинаковой электроотрицательностью, значит, химическая связь ковалентная неполярная. В узлах кристаллической решетки фтора находятся неполярные молекулы Межмолекулярные силы сцепления слабые. Следовательно, фтор должен иметь низкую температуру плавления.
Молекула фтороводорода HF состоит из атомов разных химических элементов, но оба они — неметаллы. Значит, связь между ними ковалентная, но сильно полярная, т. к. электроотрицательность фтора значительно выше, чем у водорода. Силы сцепления между полярными молекулами фтороводорода HF значительно больше, чем между неполярными молекулами фтора 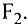 Поэтому температура плавления фтороводорода HF должна быть выше, чем у фтора
Поэтому температура плавления фтороводорода HF должна быть выше, чем у фтора 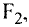 но гораздо ниже, чем у фторида натрия NaF — ионного соединения.
но гораздо ниже, чем у фторида натрия NaF — ионного соединения.
Когда вы приступили к изучению органических веществ, то обнаружили, что закономерность о зависимости свойств веществ от их состава и строения особенно ярко проявляется на примере органических соединений. Проявлению этой закономерности способствует теория химического строения, на основе которой вы изучали органические вещества. Эта теория и раскрыла новую сторону связи между составом, строением и свойствами веществ.
Так. например, если вам предлагают сравнить свойства пропилена  и пропана
и пропана  то вы прежде всего обращаете внимание на состав и строение этих соединений. Качественный состав у них одинаков: эти вещества состоят из атомов углерода и водорода. Но количественный состав различен: на одно и то же число атомов углерода (на три) приходится разное число атомов водорода 6 и 8. В молекуле пропилена не хватает двух атомов водорода до полного насыщения всех валентностей атомов углерода. Значит, пропилен — непредельный углеводород с одной двойной связью
то вы прежде всего обращаете внимание на состав и строение этих соединений. Качественный состав у них одинаков: эти вещества состоят из атомов углерода и водорода. Но количественный состав различен: на одно и то же число атомов углерода (на три) приходится разное число атомов водорода 6 и 8. В молекуле пропилена не хватает двух атомов водорода до полного насыщения всех валентностей атомов углерода. Значит, пропилен — непредельный углеводород с одной двойной связью 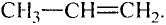 В молекуле же пропана все валентности атомов углерода полностью насыщены атомами водорода, поэтому связи в молекуле ординарные, т. е. простые
В молекуле же пропана все валентности атомов углерода полностью насыщены атомами водорода, поэтому связи в молекуле ординарные, т. е. простые 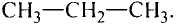
Различие в строении молекул этих углеводородов обусловливает различие и в их химических свойствах. Так, пропилен легко окисляется перманганатом калия  (фиолетовая окраска раствора быстро исчезает), а пропан, будучи насыщенным углеводородом, при этих условиях не окисляется.
(фиолетовая окраска раствора быстро исчезает), а пропан, будучи насыщенным углеводородом, при этих условиях не окисляется.
Пропилен за счет двойной связи вступает в реакции соединения — присоединяет водород, галогены и галогеноводороды:
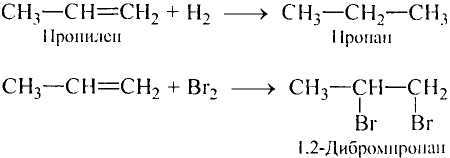
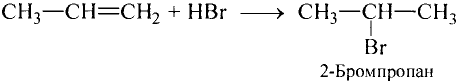
Молекулы пропилена благодаря двойной связи могут соединяться друг с другом, образуя длинные цепи молекул:
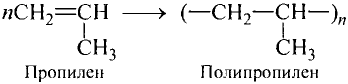
Пропан в реакции соединения с другими веществами и в реакцию полимеризации не вступает, поскольку атомы углерода в его молекуле уже полностью проявили свою валентность, и у них нет больше электронов для установления дополнительных ковалентных связей. Он полностью насыщен атомами водорода.
Однако есть и общее свойство у пропана и пропилена — их горючесть:
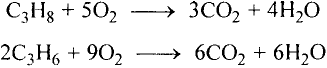
Оно объясняется одинаковым качественным составом этих углеводородов (углерод и водород).
Применение веществ зависит от тех свойств, которыми они обладают. Так. если кислород обладает свойством поддерживать горение и дыхание, то и расходуется он главным образом при сжигании топлива, выплавке чугуна, при резке и сварке металлов, в медицине.
Если метан, например, способен гореть, выделяя огромное количество теплоты, то и используется он в качестве топлива в быту и на производстве. Но в последнее время метан все больше применяют как химическое сырье, что также основано на его свойствах. Так, способность метана разлагаться на простые вещества при сильном нагревании используется для производства сажи, применяемой для получения печатной краски и резиновых изделий из каучука:
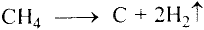
Метан используют как сырье для получения водорода, необходимого для синтеза аммиака и реакций гидрирования в органическом синтезе:

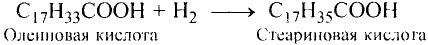
Способность метана вступать в реакции хлорирования используется для получения хлорпроизводных метана:
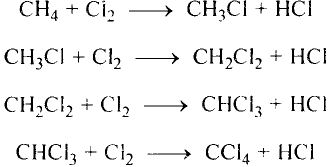
Все хлорпроизводные метана находят практическое применение. Так, хлорметан 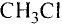 используется в качестве хладоагента в холодильных установках. Остальные хлорпроизводные метана — дихлорметан
используется в качестве хладоагента в холодильных установках. Остальные хлорпроизводные метана — дихлорметан 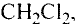 трихлорметан (хлороформ)
трихлорметан (хлороформ) 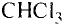 и тетрахлорметан
и тетрахлорметан 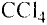 — применяются как растворители. Кроме того, тетрахлорметан
— применяются как растворители. Кроме того, тетрахлорметан 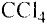 используют для гашения огня в тех случаях, когда для этого нельзя применить воду. Образующийся при хлорировании метана хлороводород используется для получения соляной кислоты HCI.
используют для гашения огня в тех случаях, когда для этого нельзя применить воду. Образующийся при хлорировании метана хлороводород используется для получения соляной кислоты HCI.
Следовательно, помните, надо всегда стараться устанавливать связь между составом, строением, свойствами и применением вещества. В этом состоит основа осознанности ваших знаний, значит, и залог успеха в обучении.
Классификация химических реакций
Вы уже знаете, что одна из основных задач химии — получение веществ с заранее заданными свойствами. Для ее решения необходимо уметь проводить химические реакции и управлять ими.
Химическая реакция, или химическое превращение,— это процесс, при котором из одних веществ образуются другие вещества, отличные по химическому составу и (или) строению.
В настоящее время известно великое множество различных реакций. Вы уже знакомы с некоторыми из них и понимаете, что каждая реакция индивидуальна, поскольку в ней принимают участие конкретные вещества с характерными для них химическими свойствами. Вместе с тем разные химические реакции имеют много общих признаков, что позволяет их классифицировать на основе того или иного признака (табл. 5).

Реакция соединения — это реакция, при которой из двух или нескольких веществ образуется одно новое вещество.
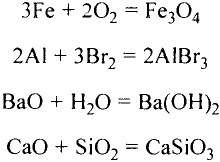
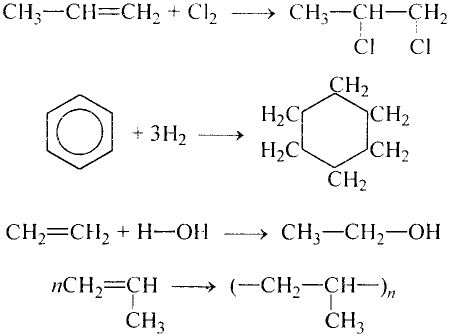
- Выразите словами сущность каждой реакции, уравнения которых приведены выше, назовите все вещества и, где возможно, реакции. укажите условия их осуществления.
Реакция разложения - это реакция, при которой из одного вещества образуется два или несколько новых веществ.
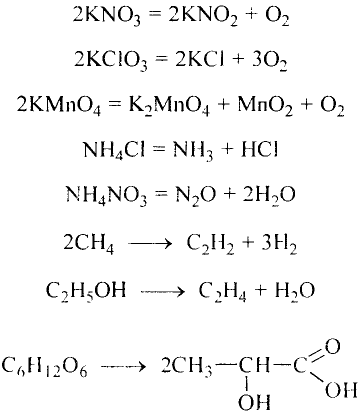
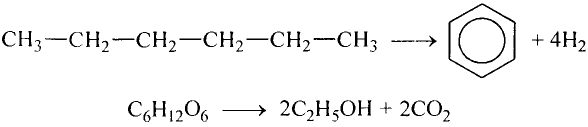
- Выразите словами сущность каждой реакции, уравнения которых приведены выше, назовите все вещества и, где возможно, реакции, укажите условия их осуществления.
Реакция замещения — это реакция между простым и сложным веществами, в процессе которой атомы простого вещества замещают атомы одного из элементов в сложном веществе, в результате чего образуются новое простое и новое сложное вещества.
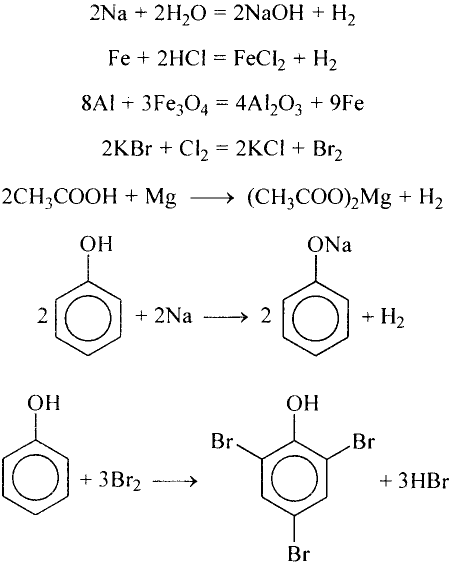
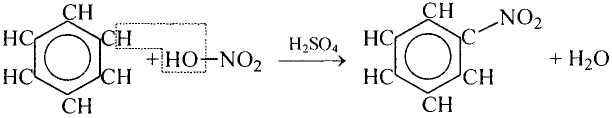
Проанализируйте приведенные примеры и обратите внимание: если в неорганической химии реакция замещения — это реакция между простым веществом и сложным, то в органической химии это не обязательно. Может быть реакция и между двумя сложными веществами, но в процессе ее происходит замещение атомов в одном сложном веществе другим атомом второго сложного вещества или группой атомов.
Реакция обмена — это реакция, в процессе которой два сложных вещества обмениваются своими составными частями.
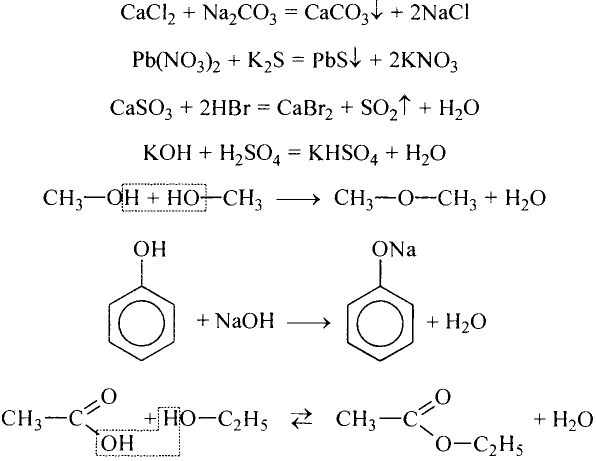
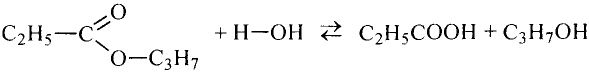
Реакции, в процессе которых изменяются степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Степенью окисления называется условный заряд атома в веществе, вычисленный в предположении, что оно состоит из ионов.
Протекание окислительно-восстановительных реакций и, следовательно, изменение степени окисления атомов обусловлено переходом электронов от одних атомов к другим.
Процесс отдачи электронов веществами называется окислением.
Например:

Вещества, которые в ходе химической реакции отдают электроны, называются восстановителями.
В приведенных выше примерах сера, металлический цинк, бром в степени окисления -1, кислород в степени окисления -2 являются восстановителями.
Процесс приема веществами электронов называется восстановлением.
Например:
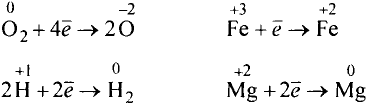
Вещества, которые принимают электроны, называются окислителями.
В приведенных примерах окислителями являются кислород 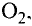 водород в степени окисления +1, железо в степени окисления +3, магний в степени окисления +2.
водород в степени окисления +1, железо в степени окисления +3, магний в степени окисления +2.
В любой окислительно-восстановительной реакции есть вещества, которые отдают и которые принимают электроны, т. е. процессы окисления и восстановления всегда сопутствуют друг другу.
Сущность процессов окисления и восстановления как потери и присоединения электронов впервые определил ученый Л. В. Писаржевский.
ЛЕВ ВЛАДИМИРОВИЧ ПИСАРЖЕВСКИЙ (1874—1938)

Ученый, академик. Организатор и директор института физической химии (ныне Институт физической химии им. Л. Писаржевского). Работал в области термодинамики реакций в растворах. Заложил основы электронной теории катализа. Развил электронно-ионную теорию. Сущность окисления определял как потерю электронов окисляющимся веществом, а восстановления — как присоединение электронов восстанавливающимся веществом. Его электронные представления стали основой для истолкования механизма электрического тока в гальваническом элементе.
По признаку выделения или поглощения энергии химические реакции делятся на экзо- и эндотермические.
Химические реакции, сопровождающиеся выделением теплоты в окружающую среду, называются экзотермическими.
Для них запас энергии продуктов реакции оказывается меньшим, чем запас энергии реагентов, поэтому тепловой эффект в экзотермических реакциях записывается с отрицательным знаком.
Например, сгорание метана, синтез аммиака:
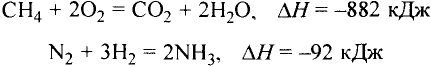
Это означает, что при сгорании 1 моль метана 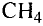 по этой реакции во внешнюю среду выделяется теплота, равная 882 кДж. а при образовании 2 моль аммиака
по этой реакции во внешнюю среду выделяется теплота, равная 882 кДж. а при образовании 2 моль аммиака  выделяется теплота, равная 92 кДж (соответственно на 1 моль
выделяется теплота, равная 92 кДж (соответственно на 1 моль  — 46 кДж).
— 46 кДж).
Химические реакции, сопровождающиеся поглощением теплоты из окружающей среды, называются эндотермическими
Для них запас энергии продуктов больше, чем запас энергии реагентов, поэтому тепловой эффект в эндотермических реакциях записывается с положительным знаком.
Например, образование оксида углерода(II) в результате восстановления диоксида углерода раскаленным коксом:
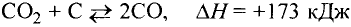
Значит, при образовании 1 моль 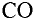 в этой реакции из внешней среды в систему передается 173 (кДж) : 2 (моль) = = 86,5 кДж теплоты.
в этой реакции из внешней среды в систему передается 173 (кДж) : 2 (моль) = = 86,5 кДж теплоты.
Галогенирование это реакция, где действующим агентом является галоген.
Оно осуществляется по типу реакций замещения либо реакций присоединения.
Составляя уравнения реакций, следует помнить, что в качестве галогенирующего агента лучше всего брать хлор или бром. Это объясняется тем, что фтор действует слишком энергично, реагирует с органическими веществами со взрывом и полностью разрушает их. Поэтому для получения фторпроизводных используют не прямое фторирование, а косвенные способы. А йод не способен к реакции йодирования углеводородов по типу замещения, с ним прямое замещение не происходит (из-за энергетических затруднений).
Например:
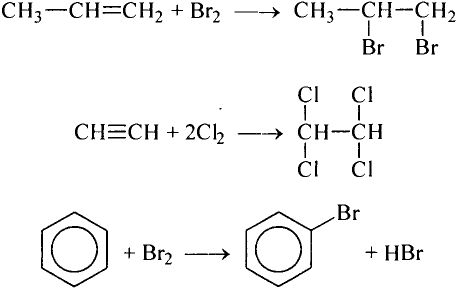
В промышленности чаще всего используется термическое хлорирование насыщенных углеводородов (алканов) и других веществ при температуре порядка 300 °С.
Гидрирование, или гидрогенизация,— это такая реакция, в процессе которой водород присоединяется к веществу.
Как правило, эти реакции происходят в присутствии катализатора (платины, никеля). Например:
Гидратация — это реакции присоединения воды к веществу.
Например, в результате гидратации этилена образуется этанол:
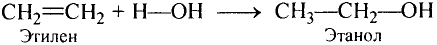
Этот процесс протекает при температуре 300 °С и давлении 7 МПа в присутствии катализатора — ортофосфорной кислоты 
Гидролиз — это обменная реакция между веществом и водой.
Например, гидролиз жира (тристеарина):
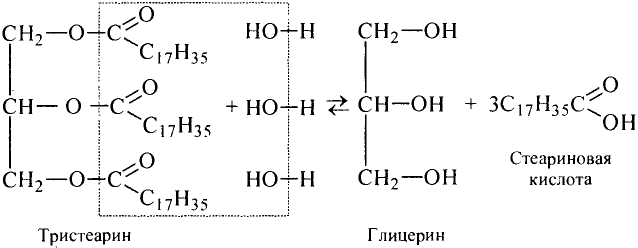
- Вспомните, как происходит гидролиз крахмала. Составьте уравнение реакции.
Нитрование — это реакция введения нитрогруппы  в молекулы органического вещества.
в молекулы органического вещества.
Обычно вещество обрабатывают различными нитрующими агентами, например  но не чистой азотной кислотой, а нитрующей смесью — смесью азотной и серной кислот. Последняя служит водоотнимающим средством.
но не чистой азотной кислотой, а нитрующей смесью — смесью азотной и серной кислот. Последняя служит водоотнимающим средством.
Например, нитрование бензола и целлюлозы:
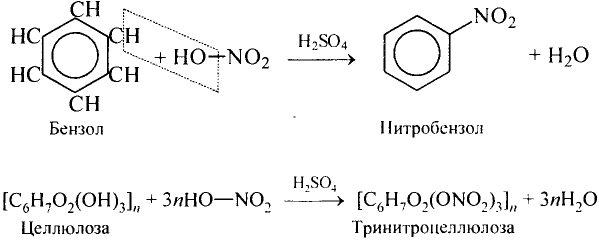
Существуют и другие классификации химических реакций. Все зависит от того, какой критерий положен в их основу. Так, например, по источнику энергии реакции делятся на термохимические, электрохимические и фотохимические, а по состоянию среды — на гомогенные (однородная среда) и гетерогенные (неоднородная среда) и т. д.
Основные закономерности химических реакций
Тепловой эффект реакции. При протекании химических реакций уже имеющиеся в веществе химические связи разрушаются и образуются новые, происходит перестройка электронных структур атомов, молекул, ионов. Для разрыва химических связей в исходных веществах необходимо затратить определенную энергию. При образовании же новых химических связей в продуктах реакции энергия будет выделяться. Поэтому химическая реакция всегда сопровождается изменением энергии системы, выделением или поглощением энергии, т. е. определенным тепловым эффектом.
Тепловой эффект реакции — это теплота, выделенная или поглощенная системой при протекании в ней химической реакции.
В зависимости от того, идет ли реакция с выделением теплоты или сопровождается поглощением теплоты, различают экзо- и эндотермические реакции. К первым, как правило, относятся все реакции соединения, а ко вторым — реакции разложения.
Откуда же берется теплота при химических реакциях? Чтобы ответить на этот вопрос, следует вспомнить из курса физики, что каждое тело имеет определенный запас внутренней энергии.
Внутренняя энергия включает все виды энергии, характеризующие тело: энергию движения молекул относительно друг друга, энергию движения электронов в атомах и атомов в молекулах, ионах. Атомы, ионы, молекулы в твердом теле колеблются, вращаются, перемещаются и т. д.
Поскольку все химические реакции сопровождаются перераспределением внутренней энергии между реагентами и продуктами. то сумма внутренней энергии продуктов отличается от суммы внутренней энергии реагентов. Разница показывает ту теплоту, которая выделяется либо поглощается в ходе реакции.
При постоянном давлении  тепловой эффект реакции совпадает с изменением энтальпии (теплоты) системы, поэтому вместо термина «тепловой эффект реакции» используется термин «энтальпия реакции» (обозначается Н, а изменение энтальпии —
тепловой эффект реакции совпадает с изменением энтальпии (теплоты) системы, поэтому вместо термина «тепловой эффект реакции» используется термин «энтальпия реакции» (обозначается Н, а изменение энтальпии —  ).
).
При экзотермических реакциях система выделяет часть своей внутренней энергии в окружающую среду в виде определенного количества теплоты. Значит, внутренняя энергия системы уменьшается, и изменение энтальпии будет иметь отрицательный знак.
При эндотермических реакциях теплота поглощается, и внутренняя энергия системы, и ее энтальпия возрастают, поэтому изменение энтальпии  будет иметь положительный знак.
будет иметь положительный знак.
Для сравнения тепловых эффектов различных реакций значение этих величин обычно относят к 1 моль вещества и одинаковым условиям, принятым за стандартные.
За стандартные условия, в которых находится вещество, принимают давление в 101325 Па (1 атм) и температуру, равную 298,15 К (25 °С).
Уравнения химических реакций с указанием теплового эффекта называют термохимическими уравнениями.
Например, термохимическое уравнение реакции синтеза I моль воды (поэтому используются дробные коэффициенты):
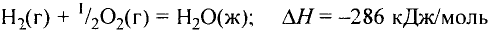
Но в термохимическом уравнении, где используются не дробные, а целочисленные коэффициенты, тепловой эффект реакции должен быть удвоен:
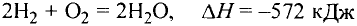
Это означает, что реакция синтеза воды сопровождается выделением количества теплоты, равным 572 кДж.
Рассмотрим другой пример:
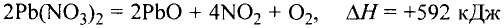
Это означает, что при разложении нитрата свинца(П) поглощается количество теплоты, равное 592 кДж.
Химическое равновесие
Вы знаете, что химические реакции бывают необратимые, когда реагенты полностью превращаются в продукты реакции, и обратимые, которые не доходят до конца, поскольку по мере их протекания в реакционной системе создаются условия для противоположных изменений. Например, если смесь водорода и йода нагревать при температуре 410 °С в закрытом сосуде, то массовая доля исходных реагентов, которые превращаются в йодоводород, составляет только 78 %. Это объясняется тем. что при этих же условиях йодоводород разлагается на йод и водород, по не полностью, а только на 22 %:
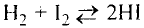
В обоих случаях возникает состояние, которое при данной температуре характеризуется вполне определенным соотношением реагентов, i 1ри этом скорость взаимодействия водорода и йода равняется скорости разложения йодоводорода.
Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции. называется химическим равновесием.
Процессы, которые одновременно протекают в двух взаимно противоположных направлениях (прямом и обратном) называются обратимыми.
Большинство химических реакций обратимы. Они протекают самопроизвольно до установления в системе химического равновесия. После наступления равновесия концентрация исходных веществ и продуктов реакции при данных условиях остаются неизменными. Но при изменении внешних условий равновесие смещается и устанавливается новое состояние равновесия. Оно нарушается, если изменяются температура, концентрация реагентов, давление (для газообразных систем).
Закономерность влияния внешних условий на равновесие обратимых химических реакций установил французский ученый Ле Шателье (1850—1936). Она названа в его честь принципом Ле Шателье:
- если условия, при которых система находится в равновесии, изменить, то равновесие сместится в сторону тех процессов, которые этому изменению противодействуют.
Например, если увеличить концентрацию одного из исходных веществ, то равновесие в системе сместится в сторону той реакции, которая уменьшает концентрацию введенного вещества.
Увеличение давления на газообразную систему будет способствовать смещению равновесия в сторону уменьшения объемов газов. Понижение температуры смещает равновесие в сторону экзотермической реакции, т. е. реакции, идущей с выделением теплоты и тем самым препятствующей понижению температуры.
Скорость химической реакции
Химические реакции протекают с различной скоростью. Одни — практически мгновенно (нейтрализация кислоты щелочью, взрывные реакции), другие — бесконечно медленно, тысячелетиями (химическое выветривание горных пород, например превращение гранита в глину).
О скорости реакции судят по изменению концентрации одного из веществ (реагента или продукта) в единицу времени. При химическом равновесии скорость прямой реакции равна скорости обратной, поэтому изменение концентрации веществ не наблюдается.
На скорость протекания реакции оказывают влияние различные факторы. Прежде всего, природа реагирующих веществ.
Проделаем такой опыт. В три пробирки нальем по 1—2 мл разбавленной соляной кислоты. В одну пробирку опустим небольшой очищенный железный гвоздь, в другую — гранулу цинка, а в третью — стружку магния (площадь поверхности металлов примерно одинакова).
Наблюдения показывают, что магний взаимодействует с соляной кислотой быстрее, чем цинк, а скорость реакции железа еще меньше, чем цинка. Значит, имеет значение природа реагирующих веществ
Скорость реакции зависит от концентрации реагирующих веществ. Для того чтобы произошла реакция, реагирующие частицы (атомы, молекулы, ионы, радикалы) исходных веществ должны столкнуться друг с другом. Чем чаще столкновения, тем быстрее происходит реакция. Понятно, что число столкновений частиц при данной температуре зависит от концентрации реагирующих веществ.
Если реакция протекает между газом и твердым веществом, то ее скорость зависит от частоты соударений молекул газа с твердым веществом на единицу площади его поверхности. Поэтому, чтобы ускорить реакцию, надо увеличить площадь поверхности соприкосновения реагирующих веществ.
На скорость реакции большое влияние оказывает температура. Подавляющее большинство реакций при нагревании протекают быстрее, чем без нагревания.
Катализаторы
Одним из наиболее эффективных средств влияния на скорость реакции является применение катализатора.
Смешаем порошкообразные алюминий (или цинковую пыль) и йод. Мы не замечаем признаков протекания реакции. Очевидно, при стандартных условиях она практически не идет.
Прикоснемся к смеси раскаленной проволокой. Реакция начинается и далее продолжается самопроизвольно. Мы видим, как разогревается реакционная масса.
Теперь к такой же смеси прибавим несколько капель воды. Вскоре мы замечаем протекание реакции: масса смеси раскаляется. происходит бурная реакция с образованием йодида алюминия:
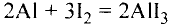
Внешне процесс протекает так же. как и при нагревании. Вода в данном случае выступила в роли катализатора.
Катализатором называется вещество, которое, участвуя в химической реакции, увеличивает ее скорость, оставаясь к концу реакции неизменным.
Реакции, идущие с участием катализатора, называются каталитическими.
Например, получение кислорода из бертолетовой соли:
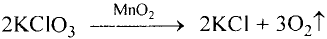
Получение бензола дегидрированием циклогексана при температуре около 300 °С в присутствии платины:
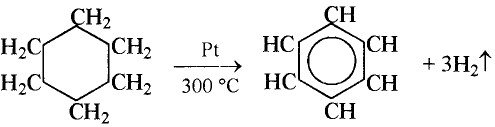
Известны вещества, замедляющие реакции, например коррозию металлов.
Вещества, тормозящие химические реакции, называются ингибиторами.
Эти вещества адсорбируются поверхностью металла и образуют защитную пленку. Ингибиторы применяют для зашиты трубопроводов в газо- и нефтедобывающей промышленности. Их широко используют для регулирования скорости реакций полимеризации, стабилизации каучуков при их переработке, углеводородного топлива, сохранения пищевых жиров и лечебных препаратов и т. д.
Электронную теорию катализа предложил ученый Л. В. Писаржевский.
Современная промышленность широко использует катализаторы. И это понятно, поскольку катализ — наиболее эффективный способ интенсификации промышленного производства.
Катализаторы играют существенную роль в жизнедеятельности организмов. Химические реакции в клетках, тканях, в различных органах происходят под влиянием ферментов — биологических катализаторов. Они очень похожи на неорганические катализаторы, только их активность значительно выше. Они тоже легко отравляются каталитическими ядами, такими как алкоголь, никотин, и теряют свою активность, что пагубно сказывается на здоровье.
Генетическая связь между неорганическими и органическими веществами
Вы уже знаете, что вещественный мир природы чрезвычайно разнообразен и имеете с тем все вещества взаимосвязаны. Но до начала XIX в. считалось, что между неорганическими и органическими веществами существует непреодолимая граница.
Такая точка зрения объясняется тем. что в начале XIX в. благодаря трудам шведского химика И. Берцелиуса. который в 1806 г. ввел в науку термин «органическая химия», начала формироваться наука об органических веществах как самостоятельная отрасль химических знаний.
ЙЕНС-ЯКОБ БЕРЦЕЛИУС (1779—1848)

Шведский химик и минералог, член Стокгольмской АН. затем ее президент (1810—1818). Открыл церий, селен, кремний, цирконий, тантал, ванадий, горий. Обогатил органическую химию сведениями о кислотах и явлениях изомерии. Не менее важен его вклад в химический качественный и количественный анализы и минералогическую химию. Развил атомное учение классическими исследованиями закона кратных отношений. Составил таблицу атомных масс элементов. Открыл катализ. Предложил химические символы элементов (1814), которыми мы пользуемся и поныне.
С одной стороны, обособление органической химии имело положительное значение, поскольку подчеркивало важность этой группы веществ. Но. с другой стороны, такое обособление сыграло отрицательную роль, поскольку закрепляло мнение, что между неорганическими и органическими веществами существует непроходимая пропасть. А это тормозило развитие науки. Это мнение подкреплялось тем. что в то время никому еще не удавалось синтезировать хотя бы одно вещество. считавшееся органическим. В этом ученые усматривали особое своеобразие органических веществ. И. Берцелиус в связи с этим утверждал, что якобы природа имеет в своем распоряжении сверхъестественные силы, которыми химики не владеют. что в живой природе вещества подчиняются другим законам, чем в неживой, и что образование органических веществ происходит при участии «жизненной силы» — Vis V italis.
Первый удар по витализму был нанесен открытием немецкого химика Ф. Велера (ученика И. Берцелиуса). который в 1828 г. из неорганического вещества цианата аммония 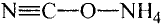 получил мочевину
получил мочевину 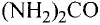 — вещество животного происхождения:
— вещество животного происхождения:
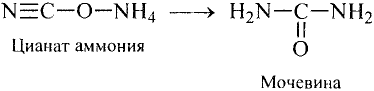
Как выяснилось позже, это был не синтез, а только перегруппировка атомов.
Окончательно опровергли виталистическое учение синтезы таких органических веществ, как анилин (Н. Н. Зинин, 1842), уксусная кислота (Г. Кольбе, 1845), жиры (М. Бертло, 1854), сахаристое вещество (А. М. Бутлеров, 1861). мочевая кислота (И. Я. Горбачевский, 1882). В результате этих синтезов был сделан важный вывод: органические вещества могут быть получены из неорганических. В дальнейшем было осуществлено много различных синтезов органических веществ из неорганических. Все они подтвердили, что вещества генетически взаимосвязаны.
Ярким свидетельством существования генетической связи между неорганическими и органическими веществами является также круговорот биогенных элементов в природе.
Вспомним хотя бы круговорот углерода. Он осуществляется благодаря четко отлаженному в ходе эволюции механизму функционирования двух фундаментальных процессов — фотосинтеза и клеточного дыхания. Вследствие жизнедеятельности растительных организмов (в том числе и фитопланктона Мирового океана), содержащих хлорофилл, углекислый газ из атмосферы и вода из почвы под влиянием солнечной энергии превращаются в органические вещества, в частности углеводы. При этом энергия Солнца переходит в энергию химических связей органических соединений, прежде всего углеводов. Упрощенную схему фотосинтеза можно представить так:
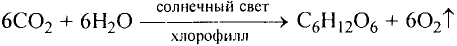
Противоположный фотосинтезу процесс — это клеточное дыхание, при котором происходит расщепление синтезированных из 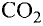 и
и  углеводов. Кислород, выделяющийся во время фотосинтеза, используется всеми организмами (и животными, и растениями) для окисления углеводов. Окисляя органические вещества, живые клетки возвращают
углеводов. Кислород, выделяющийся во время фотосинтеза, используется всеми организмами (и животными, и растениями) для окисления углеводов. Окисляя органические вещества, живые клетки возвращают  в атмосферу (рис. 26). Человек осуществляет, по сути, то же самое, когда сжигает уголь или нефть: он возвращает в атмосферу еще «палеозойский
в атмосферу (рис. 26). Человек осуществляет, по сути, то же самое, когда сжигает уголь или нефть: он возвращает в атмосферу еще «палеозойский  ».
».
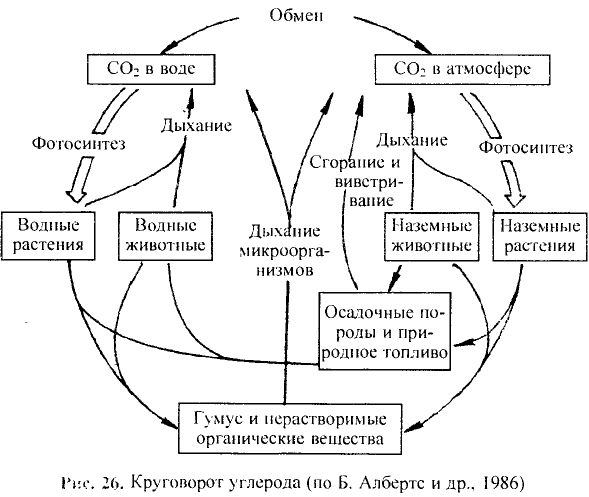
Следовательно, все вещества генетически (от греч: genesis— происхождение) связаны между собой. Генетическая связь состоит в том; что каждое вещество может химически взаимодействовать с веществами других классов. Органические соединения могут взаимодействовать с неорганическими. Их можно синтезировать из неорганических и превращать в неорганические. В этом вы еще раз сможете убедиться, выполнив предложенные задания.
Справочный материал по веществам и атомам
Химия так же, как и физика, ботаника, зоология, геология, изучает природу, материальный мир во всем многообразии форм его существования и происходящих явлений.
Все явления, которые происходят в природе, можно разделить на две группы: к первой относятся самые разнообразные взаимодействия и изменения тел, при которых меняется только физическое состояние веществ, форма физических тел, образованных этими веществами, или положение тел в пространстве.
Ко второй группе относятся явления, связанные с превращениями веществ, т. е. с изменением их качественного и количественного состава, строения, физических и химических свойств.
Предметом химии является изучение явлений второй группы.
Химия — это наука о веществах и их превращениях.
Что такое вещество. Какой физический и химический смысл этого понятия?
Физический смысл понятия «вещество»
Из курса физики вы уже знаете, что материя — это объективная реальность, т. е. то, что существует независимо от нашего сознания и воспринимается нами с помощью органов чувств или с помощью приборов.
Все разнообразные формы существования материи делятся на два вида: вещество и поле.
Вещество — это материальное образование, состоящее из частиц, имеющих собственную массу. Другими словами, вещество — это материя на разных стадиях ее организации — от элементарных частиц до сложных образований: элементарные частицы (протоны, нейтроны, электроны и др.)  ядра атомов — атомы ионы
ядра атомов — атомы ионы  молекулы
молекулы  различные агрегаты (объединения) атомов, ионов или молекул в виде твердых тел, жидкостей или газов. Поэтому можно сказать, что веществом в физическом смысле является все то, что обладает массой (более строго — массой покоя).
различные агрегаты (объединения) атомов, ионов или молекул в виде твердых тел, жидкостей или газов. Поэтому можно сказать, что веществом в физическом смысле является все то, что обладает массой (более строго — массой покоя).
Поле — материальная среда, посредством которой осуществляется взаимодействие между частицами вещества или отдельными телами. Гравитационное, электрическое и магнитное поля, ядерные силы, свет — примеры различных видов полей.
Атом
Основным свойством материи, способом ее существования является движение. Известны самые различные формы движения материи — физическая, биологическая, геологическая и т. д. Они соответствуют разному уровню организации материи и в то же время взаимосвязаны между собой и взаимопревращаемы.
Химическая форма движения возникает на уровне атомов. Сейчас вы уже должны хорошо помнить физическое определение понятия «атом».
Атом — мельчайшая химически неделимая частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Атомы находятся в природе в различных состояниях. Они могут входить в состав простых и сложных веществ, существовать в виде одиночных атомов или одноатомных ионов. Хотя общее количество атомов неисчислимо, видов атомов относительно немного. Все атомы данного вида объединяет одно общее качество — одинаковый положительный заряд ядра. Каждый отдельный вид атомов называется химическим элементом.
Химический элемент — это вид атомов с одинаковым положительным зарядом ядер.
В настоящее время известно 117 химических элементов. Их названия и символы приведены в таблице периодической системы химических элементов на форзаце 1.
Относительная атомная масса
В таблице периодической системы в клеточке, где указан символ того или иного элемента, приводится и величина его относительной атомной массы. Термин «относительный» указывает на то, что это не истинная масса атома, которая выражается в единицах массы, а величина, показывающая, во сколько раз масса атома данного элемента больше массы условного эталона. В качестве такого эталона еще в начале XIX в. английский ученый Дж. Дальтон предложил использовать легчайший из атомов — атом водорода. Но уже вскоре шведский химик Й. Берцелиус ввел в обиход в качестве эталона атом кислорода, а вернее 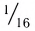 часть его массы. С середины XX в. как в физике, так и в химии стали использовать в качестве единицы атомной массы
часть его массы. С середины XX в. как в физике, так и в химии стали использовать в качестве единицы атомной массы 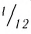 часть массы атома углерода, а точнее, одного из его изотопов — нуклида 12С. Эта величина получила название атомной единицы массы
часть массы атома углерода, а точнее, одного из его изотопов — нуклида 12С. Эта величина получила название атомной единицы массы 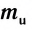 и имеет международное обозначение u:
и имеет международное обозначение u:
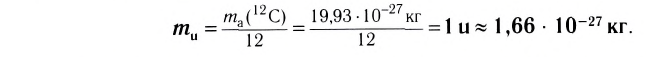
В последнее время ее называют также постоянной атомной массы.
Сравнивая массы атомов различных элементов с атомной единицей массы, получают численные значения относительных атомных масс химических элементов. Относительная атомная масса обозначается символом Аr, где r — начальная буква латинского слова «relativus» — «относительный».
Например, масса атома фтора  равна 3,15 • 10-26 кг. Следовательно, относительная атомная масса фтора:
равна 3,15 • 10-26 кг. Следовательно, относительная атомная масса фтора:
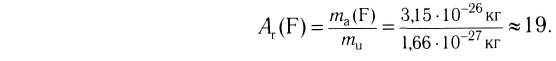
Очевидно, что относительная масса атома углерода  равна 12.
равна 12.
В природе большинство химических элементов существует в виде смеси изотопов с разными массовыми числами. Поэтому относительная атомная масса данного элемента является средней величиной массовых чисел всех его природных изотопов с учетом доли каждого в природной смеси.
Относительная атомная масса элемента — физическая величина, которая показывает, во сколько раз средняя масса атомов данного химического элемента больше 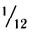 части массы нуклида углерода-12
части массы нуклида углерода-12 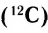 .
.
По величине относительной атомной массы элемента можно рассчитывать среднюю массу атома любого элемента X:
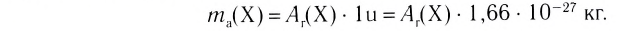
Химическая реакция
В самом начале изучения химии вы узнали о том, что атомы — мельчайшие химически неделимые частицы. Это означает, что в процессе химических превращений они не исчезают и не возникают вновь, а только переходят из одних веществ в другие. Следовательно, сущность химических реакций сводится к превращению одних веществ в другие без изменения общего числа и природы атомов. При этом меняется состав или строение веществ.
► Химическая реакция — это процесс превращения одних веществ в другие без изменения общего числа и природы атомов, из которых эти вещества состоят.
- Вещество с физической точки зрения представляет собой материальное образование, обладающее массой (массой покоя).
- Химический элемент — вид атомов с одинаковым положительным зарядом ядер.
- Атомы в процессе химических превращений (реакций) не исчезают и не возникают вновь.
Определение химического вещества
Мы с вами установили, что химическая форма движения материи возникает на уровне атомов. Атом является веществом в физическом смысле, поскольку обладает массой покоя. Но отдельные атомы не имеют таких свойств, как цвет, запах, плотность, электропроводность и т. п. Атом не находится в каком-то агрегатном состоянии и, следовательно, не имеет ни температуры плавления, ни температуры кипения, т. е. большинства тех свойств, которые присущи химическому веществу.
Молекулы
Отдельные атомы объединяются между собой в более сложные агрегаты. Таким образом атомы достигают более устойчивого состояния. Соединяться между собой могут как одинаковые атомы, так и атомы разных химических элементов.
Несколько атомов, например два атома водорода и один атом кислорода, образуют устойчивую группу, способную существовать самостоятельно, — молекулу воды Н20. Молекула проявляет вполне определенные химические свойства, т. е. способность вступать в химические реакции с образованием других веществ.
Молекула — наименьшая частица вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
Химический смысл понятия «вещество»
Отдельные молекулы также не имеют многих физических свойств, прежде всего температур плавления и кипения, плотности и т. п. Такие свойства проявляются только тогда, когда молекулы начинают связываться между собой за счет сил межмолекулярного взаимодействия. Точно так же у веществ немолекулярного строения только при объединении отдельных атомов в атомные кристаллы (например, алмаз, графит, металлы) или ионов в ионные кристаллы (типа NaCI, K2CO3 и др.) проявляются физические и химические свойства данного химического вещества.
Следовательно, только химическое вещество обладает определенным набором как химических, так и физических свойств.
Химическое вещество — это устойчивая совокупность частиц (атомов, ионов или молекул), обладающая определенными химическими и физическими свойствами.
Физические или химические свойства данного вещества определяются, прежде всего, его составом и строением.
Простые и сложные вещества
Вещество, которое состоит из атомов одного элемента, называется простым, а состоящее из атомов разных элементов, — сложным веществом или химическим соединением.
Названия большинства простых веществ совпадают с названиями соответствующих химических элементов, поэтому необходимо различать эти понятия (табл. 2).

Следует различать качественный состав вещества, который определяется видом атомов элементов, образующих данное вещество, и количественный состав, указывающий число атомов каждого элемента в составе элементарной структурной единицы данного вещества.
Молекулярные и немолекулярные вещества
Качественный и количественный состав химического вещества определяет его формулу. Молекулярные формулы показывают состав веществ молекулярного строения, т. е. веществ, у которых элементарной структурной единицей является молекула. Вода Н20, метан СН4, кислород 02 — примеры простейших молекулярных веществ. Но молекулы могут состоять и из десятков, сотен и тысяч атомов.
Из известных в настоящее время молекул самое большое число атомов (6607) содержит молекула, формула которой 
Условно к молекулярным веществам относят благородные газы (гелий, аргон и т. д.), рассматривая их атомы как одноатомные молекулы.
Молекулярные вещества составляют более 95 % от общего числа известных веществ. При обычных условиях они могут быть твердыми (сера, иод, глюкоза), жидкими (бром, вода, этиловый спирт) или газообразными (азот, углекислый газ, ацетилен).
Вещества немолекулярного строения, как правило, при обычных условиях являются твердыми кристаллами. Они состоят из атомов или ионов. Примерами таких веществ являются алмаз, металлы, соли, оксиды металлов, твердые основания и др.
Состав простого вещества немолекулярного строения выражается знаком соответствующего элемента без индекса (Fe, Си, С, Si), а сложного — с помощью формулы, которая показывает простейшее соотношение числа атомов (или ионов) разных химических элементов, образующих это вещество. Такие формулы, как вам уже известно, называются формульными единицами.
Формульная единица — группа атомов, которая составляет простейшую химическую формулу вещества немолекулярного строения.
Примеры формульных единиц: солей — KCI, Na2S04, оксидов — MgO, Si02, оснований — Са(ОН)2, Fe(OH)3.
Следовательно, молекула является структурной единицей вещества с молекулярным строением, а у веществ немолекулярного строения подобную роль выполняет формульная единица.
Вещества молекулярного и немолекулярного строения существенно различаются по своим свойствам (табл. 3).
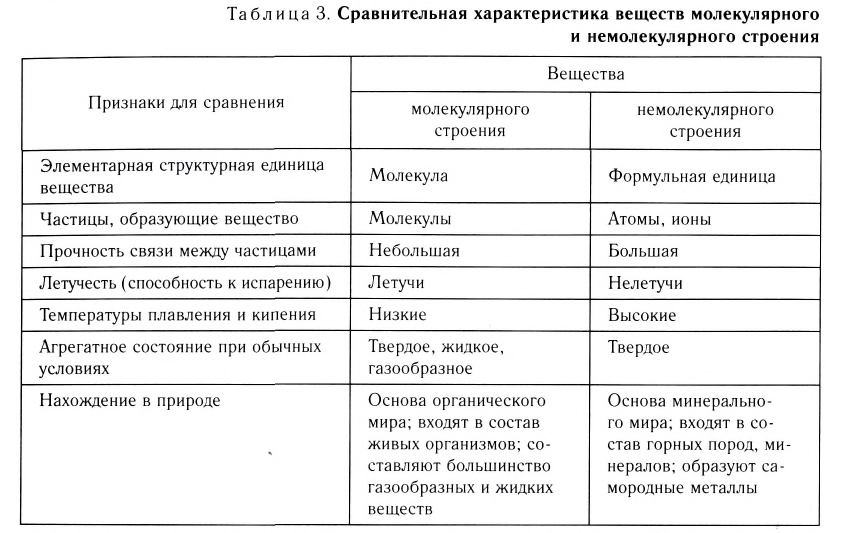
- Химическим веществом является устойчивая совокупность частиц (атомов, ионов или молекул), обладающая определенными химическими и физическими свойствами.
- Каждое химическое вещество характеризуется определенным качественным и количественным составом, строением, физическими и химическими свойствами.
- Структурной единицей веществ молекулярного строения является молекула, а немолекулярного — формульная единица.
Количественные характеристики вещества
Химия как часть естествознания неразрывно связана с наблюдением за происходящими явлениями, их описанием, проведением различных экспериментов и самыми разнообразными количественными измерениями и расчетами. Великий русский химик Д. И. Менделеев говорил: «Наука начинается, когда начинают измерять». В этом заключается научный подход, т. е. метод познания вещества, его свойств, которые выражаются обычно с помощью качественных и количественных характеристик.
Относительная молекулярная и относительная формульная массы вещества
Состав любого вещества определяется формулой его элементарной структурной единицы, т. е. молекулярной формулой или формульной единицей (ФЕ). Поскольку каждая такая формула состоит из определенного числа атомов химических элементов, характеризующихся определенным значением относительной атомной массы, то и масса структурной единицы может быть выражена относительной величиной.
Такая величина для веществ молекулярного строения носит название относительной молекулярной массы, а для веществ немолекулярного строения — относительной формульной массы. Они имеют одинаковое обозначение Мr и представляют собой сумму относительных атомных масс всех элементов, образующих данную структурную единицу вещества, с учетом числа атомов каждого элемента.
Например, относительная молекулярная масса фосфорной кислоты Н3Р04 равна:
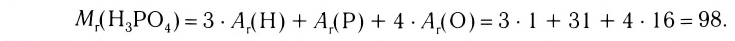
Относительная формульная масса карбоната натрия Na2C03 рассчитывается аналогично:
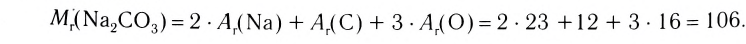
Относительной молекулярной (формульной) массой вещества Мr называется величина, равная отношению средней массы элементарной структурной единицы данного вещества к  части массы нуклида углерода-12
части массы нуклида углерода-12 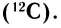
Химическое количество вещества
Абсолютные массы атомов, как вы уже хорошо знаете, крайне малы. Однако в обычной химической практике мы имеем дело не с отдельными частицами (атомами, ионами или молекулами): во взаимодействии участвуют такие порции веществ, массы которых измеряются в граммах, килограммах или даже тоннах. Нетрудно подсчитать, что число частиц, которые содержатся в той или иной порции вещества, огромно. Так, уже в кусочке меди массой 1 г содержится примерно 9,5 • 1021 атомов, а в стакане воды массой 200 г находится 6,7 • 1024 молекул. Пользоваться на практике такими числами затруднительно. Поэтому в химии, физике и других областях естествознания используется физическая величина, характеризующая число частиц в данной порции вещества. Эта величина получила название количество вещества. При химических расчетах, когда речь идет о химических веществах, эту физическую величину следует называть химическим количеством вещества.
Химическое количество вещества — физическая величина, пропорциональная числу элементарных структурных единиц (атомов, молекул или формульных единиц), составляющих данную порцию вещества.
Эту величину обозначают латинской буквой n. Она является одной из семи основных величин Международной системы единиц (СИ) и имеет свою собственную единицу, которая называется моль.
Моль — это химическое количество вещества, которое содержит столько же элементарных структурных единиц этого вещества (атомов, молекул, формульных единиц), сколько атомов содержится в углероде-12 массой 12 г (или 0,012 кг).
Число атомов в углероде массой 0,012 кг (т. е. в порции химическим количеством 1 моль) легко определить, зная массу атома углерода (1,993 • 10-26 кг):
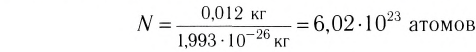 (число Авогадро).
(число Авогадро).
Порции различных веществ, массы которых в граммах численно равны их относительным молекулярным (формульным) массам, содержат одинаковое число элементарных единиц.
Величина, равная отношению
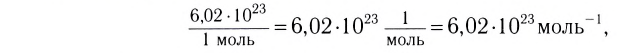
получила название постоянной Авогадро. Постоянная Авогадро обозначается символом NA. Она представляет собой одну из фундаментальных физических постоянных:

Число структурных единиц N любой порции вещества и его химическое количество связаны зависимостью:
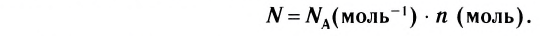
Понятие «моль» используется не только для химических веществ, но и для любых других частиц (протонов, нейтронов, электронов, ионов и т. д.). Например, 1 моль протонов составляет 6,02 • 1023 протонов, 1 моль ионного соединения хлорида натрия NaCl содержит 1 моль ионов натрия и 1 моль ионов хлора, а 1 моль соли сульфата алюминия AI2(S04)3 содержит 2 моль ионов алюминия А13+ и 3 моль сульфат-ионов  В таких случаях можно просто говорить о моле как о единице количества частиц.
В таких случаях можно просто говорить о моле как о единице количества частиц.
В случае химических веществ необходимо использовать термин «моль» как единицу химического количества вещества.
Молярная масса
Одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но так как каждая такая единица имеет свою собственную массу, то массы одинаковых химических количеств различных веществ будут различны.
Масса порции вещества химическим количеством 1 моль получила название молярной массы. Молярная масса вещества X обозначается символом М(Х) и представляет собой отношение массы данной порции вещества m (в г или кг) к его химическому количеству n (в моль):
Единица молярной массы в Международной системе единиц — кг/моль. В химии чаще используется дольная единица — г/моль.
Численное значение молярной массы (в г/моль) совпадает с относительной атомной, молекулярной или формульной массой данного вещества. Например, молярная масса железа — M(Fe) = 56 г/моль, кислорода — М(02) = 32 г/моль, молекулярного вещества глюкозы — М(С6Н1206) = 180 г/моль, а вещества немолекулярного строения карбоната кальция — М(СаС03) = 100 г/моль.
Приведенную выше формулу можно представить и в других видах:
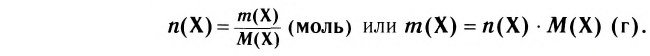
Зная молярную массу вещества, можно рассчитать химическое количество вещества по его массе. Вычислим, например, химическое количество гидроксида натрия NaOH, масса которого равна 100 г.
Так как молярная масса гидроксида M(NaOH) = 40 г/моль, то, воспользовавшись формулой 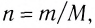 находим:
находим:
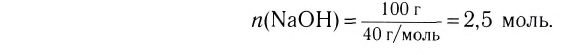
Вторая формула позволяет решить обратную задачу: найти массу вещества, если известно его химическое количество.
Например, определим-массу глюкозы С6Н1206, химическое количество которой n равно 5 моль.
По формуле 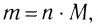 зная, что молярная масса глюкозы М(С6Н1206)= 180 г/моль, определяем:
зная, что молярная масса глюкозы М(С6Н1206)= 180 г/моль, определяем: 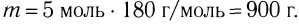
Формула  позволяет уяснить физический смысл понятия химическое количество вещества как величины, связывающей между собой массу и молярную массу вещества.
позволяет уяснить физический смысл понятия химическое количество вещества как величины, связывающей между собой массу и молярную массу вещества.
Таким образом, определенную порцию любого вещества можно количественно охарактеризовать с помощью различных физических величин.
Например, для воды массой 90 г эта схема имеет вид, представленный на рисунке 4.
- Относительная молекулярная (формульная) масса вещества представляет собой сумму относительных атомных масс всех элементов, образующих данное вещество.
- Химическое количество вещества — физическая величина, пропорциональная числу элементарных структурных единиц, содержащихся в данной порции вещества.
- Моль — единица химического количества вещества, т. е. такое его количество, которое содержит 6,02 • 1021 структурных единиц данного вещества.
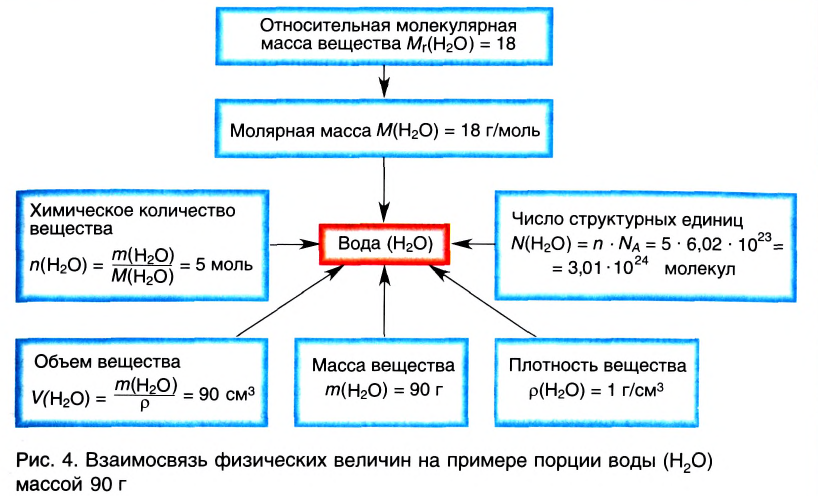
Масса вещества X химическим количеством 1 моль называется его молярной массой М(Х) и представляет собой отношение массы данной порции вещества к его химическому количеству.
Стехиометрические расчеты в химии
Используя количественные характеристики веществ, можно проводить расчеты, связанные с формулами веществ, их количественным составом, а также с количественными изменениями реагентов и продуктов реакции в ходе любого химического процесса.
Основой таких расчетов являются законы стехиометрии — раздела химии, в котором исследуется количественный состав химических соединений, а также количественные соотношения между реагирующими веществами в химических реакциях. Термин «стехиометрия» (от греч. стехион — основа, элемент и метрейн — измерять) появился еще на рубеже XVIII—XIX вв., когда усилия химиков были направлены на установление весовых соотношений элементов в соединениях.
В современной химии стехиометрические расчеты имеют фундаментальное значение. Они являются основой количественного химического анализа. Математическую базу любых химических экспериментов в лаборатории составляют стехиометрические расчеты. В химической промышленности знание стехиометрии позволяет вычислять необходимый расход реагентов, выход химических продуктов и эффективность химических процессов.
Закон сохранения массы веществ
Теоретической основой стехиометрических расчетов служат фундаментальные количественные законы химии, часто еще называемые стехиометрическими законами.
Из курса 8-го класса вам уже известен основной закон химии, сформулированный еще в XVIII в. великими естествоиспытателями — русским ученым М. В. Ломоносовым и независимо от него французским химиком А. Лавуазье, — закон сохранения массы веществ.
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
Михаил Васильевич Ломоносов
(1711—1765)

Русский ученый-естествоиспытатель, основатель первого в России Московского университета. Развивал атомно-молекулярные представления о строении веществ, предложил общую формулировку закона сохранения массы веществ и движения, заложил основы физической химии.
Антуан Лоран Лавуазье
(1743—1794)

Французский ученый, один из основоположников современной химии. Дал правильное объяснение процессов горения и дыхания, экспериментально доказал закон сохранения массы веществ в химических реакциях, разработал правила называния химических соединений.
С позиций атомно-молекулярного учения сохранение массы веществ объясняется следующим образом. Поскольку при химических реакциях атомы не исчезают и не возникают вновь, их общее число остается неизменным. А так как атомы имеют постоянную массу, то и суммарные массы веществ, образованных ими, до и после реакции одинаковы.
Закон верен лишь в практическом смысле. Так как любое химическое взаимодействие сопровождается изменением энергии системы, то, как вам известно из курса физики, должна изменяться и масса системы (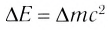 ). Однако, вследствие относительно незначительных энергетических эффектов реакций, изменения массы исключительно малы и не могут быть измерены современными техническими средствами.
). Однако, вследствие относительно незначительных энергетических эффектов реакций, изменения массы исключительно малы и не могут быть измерены современными техническими средствами.
Любую химическую реакцию можно изобразить в виде схемы, в которой указаны исходные вещества и продукты реакции, например:

Однако схема дает только качественную информацию о химическом процессе. Количественную информацию о реакции можно получить только с помощью химического уравнения, основанного на законе сохранения массы веществ. Оно отличается от схемы реакции наличием коэффициентов перед формулами веществ, которые называются стехиометрическими:

Знак равенства в уравнении реакции означает, что число атомных частиц каждого элемента, а следовательно, и суммарные массы веществ в обеих частях уравнения одинаковы. Коэффициенты в уравнении реакции показывают относительные молярные количества исходных веществ и продуктов, т. е. простейшее целочисленное соотношение между числами молей (химическими количествами) каждого вещества. Эти количественные данные позволяют вычислять массы веществ — участников данного процесса.
Закон постоянства состава вещества
Важнейшей характеристикой (своеобразным паспортом!) вещества является его состав, который в химической практике обычно определяется с помощью качественного и количественного химического анализа.
Еще в начале XIX в. французский ученый Ж. Пруст, исследовав составы ряда химических веществ, полученных разными способами или привезенных из разных частей света, сформулировал закон постоянства состава вещества.
Всякое чистое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав вещества.
Согласно этому закону каждое чистое вещество всегда состоит из атомов одних и тех же элементов, связанных между собой одинаковыми количественными соотношениями. Например, молекула воды Н20 состоит из атомов водорода и кислорода, количественное соотношение которых 2:1. Это означает, что на 2 моль атомов водорода приходится 1 моль атомов кислорода. Зная молярную массу атомов этих элементов, нетрудно установить их массовое соотношение:
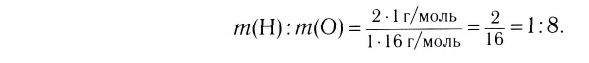
Жозеф Луи Пруст
(1754—1826)

Французский химик, один из основателей атомно-молекулярного учения. Сформулировал и экспериментально обосновал закон постоянства состава вещества. Разработал метод выделения глюкозы, исследовал ряд неорганических и органических соединений.
Позже было показано, что закон строго выполняется только в случае молекулярных веществ. Соединения с немолекулярной структурой часто имеют переменный состав, не отвечающий целочисленным соотношениям, что во многом объясняется условиями получения таких веществ. Отклонения от целочисленного соотношения могут быть выражены при записи формул, например: Fe0,9S, TiO0,7 или Fe1-хО. Такие соединения получили название нестехиометрических в отличие от стехиометрических, где соотношения между числами атомов целочисленные.
Массовая доля элемента
Как вы уже знаете из курса химии 8-го класса, по формулам химических веществ можно вычислять массовые доли каждого химического элемента, который входит в состав данного вещества, т. е. определять, какую часть от общей массы вещества составляет масса атомов данного элемента.
Массовая доля элемента X может быть выражена в долях единицы или в процентах:

где 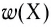 — массовая доля элемента X;
— массовая доля элемента X;
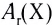 — относительная атомная масса элемента;
— относительная атомная масса элемента;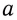 — число атомов элемента в формуле вещества;
— число атомов элемента в формуле вещества; — относительная молекулярная (формульная) масса вещества.
— относительная молекулярная (формульная) масса вещества.
Например, в молекуле воды Н.,0 массовая доля водорода  (Н) = 0,11, или 11 %, а кислорода —
(Н) = 0,11, или 11 %, а кислорода —  (0) = 0,89,"или 89 %.
(0) = 0,89,"или 89 %.
Нетрудно убедиться, что соотношение массовых долей элементов в молекуле воды есть не что иное, как вычисленное нами, исходя из количественного состава этого вещества, массовое соотношение элементов:

Следовательно, зная массовое соотношение элементов в веществе, можно устанавливать его эмпирическую формулу, которая выражает наименьшее целочисленное соотношение между числами атомов элементов, входящих в данное вещество. Такие формулы часто называют простейшими. Для большинства веществ немолекулярного строения эмпирические формулы соответствуют формульным единицам таких веществ.
Установление формул веществ по массовым долям элементов
Пример №16
Найдите эмпирическую формулу вещества, массовые доли натрия, серы и кислорода в котором составляют соответственно 32,4%, 22,5% и 45,1%.
Дано:
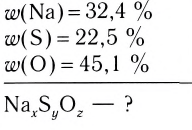
Решение
1. Обозначим числа атомов натрия, серы и кислорода в эмпирической формуле вещества соответственно х, у и z. Тогда формулу этого вещества можно представить как 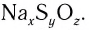
2. Соотношение х : у : z представляет собой количественное (т. е. молярное) соотношение между атомами соответствующих элементов. Поскольку массовые доли каждого элемента в процентах можно рассматривать как массы их атомов в 100 г вещества, то, разделив эти величины на молярные массы атомов, получим соотношение между химическими количествами атомов этих элементов:
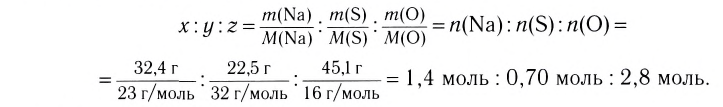
3. Для написания эмпирической формулы с целочисленными значениями индексов необходимо разделить каждый член полученного соотношения на наименьшую величину (0,7):
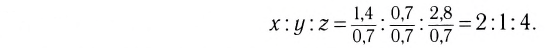
Следовательно, эмпирическая формула вещества: Na2S04.
Ответ: Na2S04.
У молекулярных веществ истинная, т. е. молекулярная, формула не всегда совпадает с эмпирической.
Например, эмпирическая формула этана СН3, а молекулярная — С2Н6, у бензола, молекулярная формула которого С6Н6, эмпирическая — СН. Для нахождения молекулярной (истинной) формулы вещества необходимо знать его относительную молекулярную массу.
Пример №17
Установите молекулярную формулу углевода, массовые доли углерода, водорода и кислорода в котором соответственно равны 40 %, 6,67 % и 53,33 %. Относительная молекулярная масса вещества равна 180.
Дано:
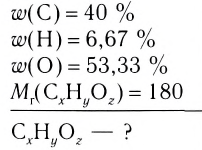
Решение
1. Обозначив числа атомов углерода, водорода и кислорода в эмпирической формуле углевода соответственно х, у и z, запишем ее как 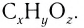
2. Найдем молярное соотношение между атомами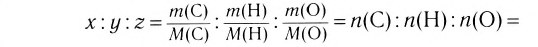
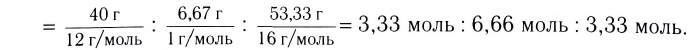
3. Определим эмпирическую формулу вещества:
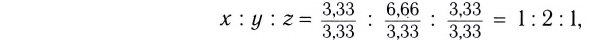
следовательно, эта формула — СН20.
4. Найдем «относительную молекулярную массу» СН20 по эмпирической формуле:
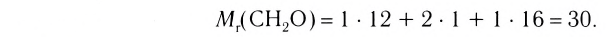
5. Определим соотношение между величинами относительных молекулярной массы углевода и «молекулярной массы» СН20:

т. е. численное значение индексов в молекулярной формуле в 6 раз больше, чем в эмпирической.
6. Установим молекулярную формулу вещества:

Ответ: молекулярная формула углевода С6Н1206.
- Стехиометрия — раздел химии, изучающий количественный состав веществ, а также количественные соотношения между реагирующими веществами в химических реакциях.
- Стехиометрические коэффициенты в уравнении реакции показывают молярные соотношения между исходными веществами и продуктами реакции.
- Стехиометрические индексы в эмпирической формуле вещества выражают наименьшее целочисленное соотношение между числами атомов элементов, входящих в состав данного вещества.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |