
Агрегатное состояние вещества в физике - определение с примерами
Содержание:
Агрегатное состояние вещества:
Бывали ли вы зимой на берегу быстрой горной реки? Посмотрите на рисунок ниже (рис. 2.23). Вокруг лежит снег, замерли на берегу деревья, покрытые инеем, который сияет в солнечных лучах, а речка не замерзает. Чрезвычайно чистая, прозрачная вода разбивается об обмерзшие камни. Почему появился иней? В чем отличие воды и льда? Есть ли между ними сходство? В этом параграфе вы обязательно найдете ответы на эти вопросы.
Разные агрегатные состояния вещества
Вы уже знаете, что вода и лед (снег, иней) — это два разных агрегатных состояния воды: жидкое и твердое. Появление инея на деревьях объясняется просто: вода с поверхности реки испаряется, превращаясь в водяной пар. Водяной пар, в свою очередь, конденсируется и оседает в виде инея. Водяной пар — это третье состояние воды — газообразное.
Приведем еще один пример. Вы, безусловно, знаете об опасности разбить медицинский термометр: в нем содержится ртуть — густая жидкость серебристого цвета, которая, испаряясь, образует очень ядовитый пар. А вот при температуре ниже -39 С ртуть превращается в твердый металл. Таким образом, ртуть, как и вода, может находиться в твердом, жидком и газообразном состояниях.
Практически любое вещество в зависимости от физических условий может находиться в трех агрегатных состояниях: твердом, жидком и газообразном.

В нашем примере с горной рекой (рис. 2.23) присутствуют все три агрегатных состояния воды.
Существует еще одно агрегатное состояние вещества — плазма. Например, ртуть в плазменном состоянии содержится во включенных ртутных лампах (так называемые лампы дневного света). В мегамире плазма является распространенным состоянием вещества, так как именно в этом состоянии находится вещество в недрах звезд.
Водяной пар, вода, лед — это три агрегатных состояния одного и того же вещества, образованного одинаковыми молекулами — молекулами воды. Почему же физические свойства веществ, образованных одинаковыми молекулами, но находящихся в разных агрегатных состояниях, отличаются друг от друга? Вероятно, причина такого отличия заключается в том, что молекулы по-разному двигаются и взаимодействуют.
Какие же свойства имеют вещества в разных агрегатных состояниях? Как при этом двигаются и взаимодействуют молекулы?
Физические свойства твердых тел
Посмотрите внимательно на рис. 2.24. Все изображенные на нем твердые тела отличаются друг от друга: цветом, видом и т. п., они изготовлены из разных веществ. Вместе с тем они имеют и общие свойства, присущие всем твердым телам.
Твердые тела сохраняют объем и форму. Это объясняется тем, что атомы и молекулы твердых тел расположены в позициях равновесия. Силы притяжения и отталкивания между молекулами (атомами) в этих позициях равны друг другу. В случае попытки увеличить или уменьшить расстояние между частицами (т. е. увеличить или уменьшить размер тела) возникает соответственно меж молекулярное притяжение или отталкивание.
Вы знаете, что в соответствии с атомно-молекулярной теорией атомы (молекулы) всегда находятся в движении. Частицы твердых тел практически не передвигаются с места на место — они постоянно двигаются возле определенной точки, т. е. колеблются. Поэтому твердые тела сохраняют не только объем, но и форму.

Кристаллические и аморфные вещества
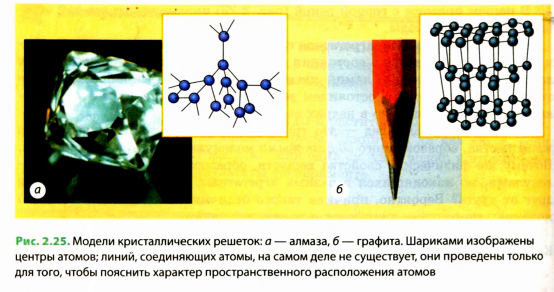
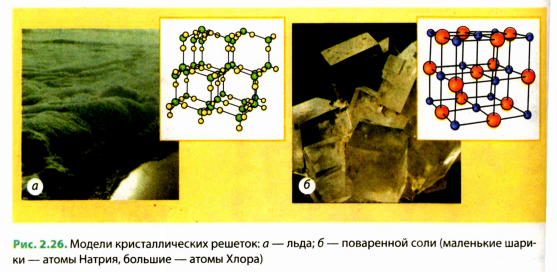
В ходе изучения строения твердых тел с помощью современных методов удалось выяснить, что молекулы и атомы большинства веществ в твердом состоянии расположены в строго определенном порядке, физики говорят: образуют кристаллическую решетку. Такие вещества называются кристаллическими. Примерами кристаллических веществ могут быть алмаз, графит (рис. 2.25), лед, соль (рис. 2.26), металлы и т. п.
Порядок расположения атомов в кристаллической решетке вещества определяет его физические свойства. Так, например, алмаз и графит состоят из одних и тех же атомов — атомов углерода, однако эти вещества весьма отличаются друг от друга, так как атомы в них расположены по-разному (см. рис. 2.25).
Существует группа твердых веществ (стекло, воск, смола, янтарь и т. п.), молекулы (атомы) которых не образуют кристаллической решетки и в целом расположенные беспорядочно. Такие вещества называют аморфными.
При определенных условиях твердые тела плавятся, т. е. переходят в жидкое состояние. Кристаллические вещества плавятся при определенной температуре. Например, лед обычно переходит в жидкое состояние, если температура равна О °С, нафталин — если достигает 80 °С, ртуть — если падает до -39 °С. В отличие от кристаллических, аморфные вещества не имеют определенной температуры плавления. В случае увеличения температуры они переходят в жидкое состояние постепенно (таяние восковой свечи).
Физические свойства жидкостей
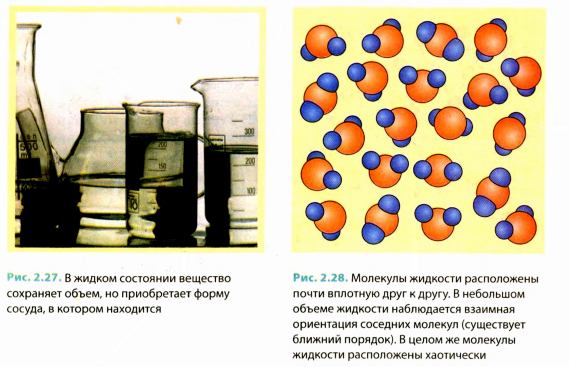
Жидкости легко изменяют свою форму и приобретают форму того сосуда. в котором они содержатся, тем не менее объем жидкости при этом является неизменным (рис. 2.27). Более того, если мы попробуем сжать жидкость, нам это не удастся. Чтобы доказать несжимаемость жидкостей, ученые провели опыт: воду налили в свинцовый шар, который запаяли, а потом сжали мощным прессом. Вода не сжалась, а просочилась сквозь стенки шара.
Способность жидкостей сохранять свой объем объясняется тем, что, как и в твердых телах, молекулы в жидкостях расположены близко друг от друга (рис. 2.28). Молекулы жидкости довольно плотно упакованы, однако они -не только колеблются на одном и том же месте в окружении ближайших ♦соседей», но и довольно легко могут перемещаться по объему, занятому жидкостью. Поэтому жидкости сохраняют объем, но не сохраняют формы — они являются текучим
Физические свойства газов
Слово «газ* происходит от греческого chaos («хаос*, «беспорядок*). И в самом деле, для газообразного состояния вещества характерен полный беспорядок во взаимном расположении и движении молекул.
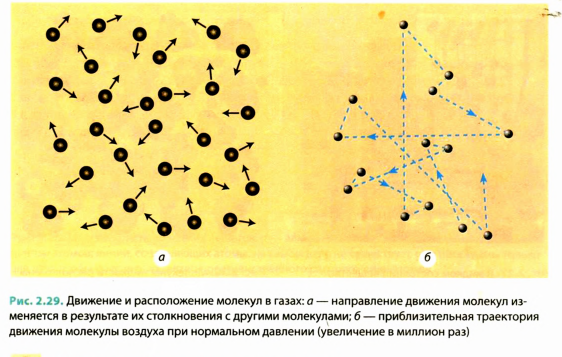
Молекулы газа расположены на расстояниях, которые в десятки и сотни раз превышают размеры молекул. На таких расстояниях молекулы практически не взаимодействуют друг с другом, поэтому молекулы газа разлетаются и газ занимает весь предоставленный объем. Большими расстояниями между молекулами объясняется и тот факт, что газы легко сжать.
Чтобы понять, как двигаются молекулы газа, представим себе движение одной молекулы. Вот она двигается в каком-то направлении, на своем пути сталкивается с другой молекулой, изменяет направление и скорость своего движения и летит дальше, к следующему удару (рис. 2.29). Чем больше количество молекул в сосуде, тем чаще они сталкиваются. Например, каждая молекула, входящая в состав воздуха в классной комнате, сталкивается с другими молекулами и изменяет скорость своего движения приблизительно пять миллиардов раз в секунду.
Итоги:
Практически любое вещество в зависимости от физических условий может существовать в трех агрегатных состояниях: твердом, жидком и газообразном.
Когда вещество переходит из одного состояния в другое, изменяется взаимное расположение молекул и характер их движения, однако состав молекул остается неизменным.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |