
Скорость движения молекул газа - формулы и определение с примерами
Определение скорости движения молекул газа:
Молекулы газа находятся в непрерывном хаотичном движении. Удивительно то, что беспорядочное движение огромного числа молекул газа подчиняется определенной закономерности распределения по скоростям. в таблице 6.2 дано распределение по скоростям для молекул азота (при комнатной температуре и в процентах относительно общего количества молекул).

Из таблицы видно, что 1% от общего числа молекул движется с очень малыми скоростями. Приблизительно половина всех молекул (42%) движется со средними скоростями 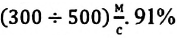
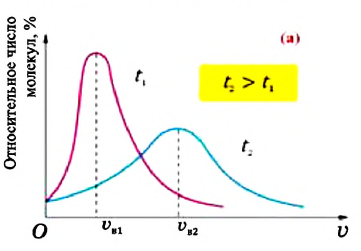
В 1860 году английский физик Джеймс Максвелл (1831-1879), используя теорию вероятности, определил закономерность распределения молекул газа по скоростям и изобразил ее графически (а). Максимум графика соответствует наиболее вероятному значению скорости 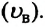 То есть наибольшее количество молекул газа при данных значениях температуры и объема движется со скоростями, близкими к наиболее вероятному значению
То есть наибольшее количество молекул газа при данных значениях температуры и объема движется со скоростями, близкими к наиболее вероятному значению 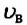 (например, для азота при температуре
(например, для азота при температуре 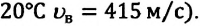 С увеличением температуры растет число молекул, движущихся с большими скоростями, и уменьшается число молекул, обладающих малыми скоростями. В результате увеличивается значение
С увеличением температуры растет число молекул, движущихся с большими скоростями, и уменьшается число молекул, обладающих малыми скоростями. В результате увеличивается значение 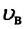 и наблюдается смещение максимума кривой "распределения" в сторону больших скоростей (см.: а).
и наблюдается смещение максимума кривой "распределения" в сторону больших скоростей (см.: а).
Первые экспериментальные исследования по измерению скоростей молекул газа провел в 1920 году немецкий ученый Отто Штерн (1888-1969). Вычисленные им значения для скоростей молекул совпали со значениями, определенными на основе MKT. Научное значение опытов Штерна состоит в том, что скорость молекул газа была определена экспериментально, и в том, что эти опыты подтвердили теоретически установленную закономерность распределения молекул газа по скоростям.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |