Строение вещества в физике - виды, формулы и определения с примерами
Содержание:
Строение вещества:
Из чего состоят вещества? Насколько малыми являются наименьшие частички вещества? Существует ли отличие между молекулами одного и того же вещества? Можно ли сосчитать молекулы в булавочной головке? Эти и другие вопросы мы обсудим подробнее и вместе найдем ответы.
Различия атома и молекулы
Из предыдущего курса «Природоведение* вы уже знаете, что все вещества состоят из мелких частичек — молекул и атомов. Вы также знаете, что первичные составные части вещества — атомы — имеют специальные названия и символы для обозначения каждого из видов атомов. Например: водород (Н), ртуть (Hg), кислород (О), углерод (С). Атомы разных видов отличаются друг от друга по своим химическим свойствам и массе. С физической величиной под названием «масса* вы уже познакомились в § 9. Что такое «химические свойства*, вы узнаете из курса химии.
По положению на 2005 год науке известны только 116 различных видов атомов. «Не может быть,— возразите вы.— Как это, только 116? Каждый из нас с легкостью перечислит 200—300, а может быть, и больше различных веществ*. Да, действительно, в мире существуют миллионы разных веществ. Как же соединить существование только 116 различных видов атомов с миллионами разных веществ? Дело в том, что вещества по большей части состоят из молекул.
Молекулой называется наименьшая частичка вещества, имеющая его основные химические свойства и состоящая из атомов.
Ситуация с разными веществами очень похожа на составление тысяч разных слов из «только" 32 различных букв алфавита. В этом сравнении каждая буква — это, так сказать, отдельный атом, а каждое слово соответствует молекуле, т.е. определенному веществу.
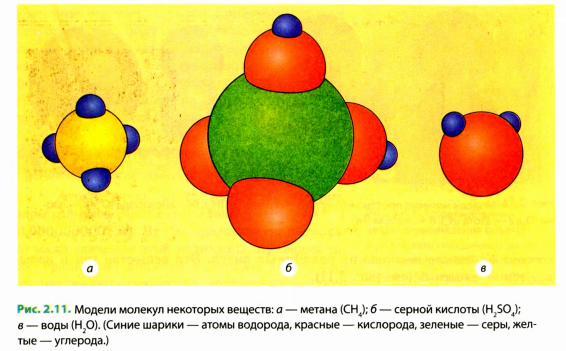
На рис. 2.11, а вы аидите схематическое изображение молекулы метана, состоящей из пяти атомов: четырех атомов водорода и одного атома углерода. Пользуясь нашей аналогией,— это слово из пяти букв. На рис. 2.11, б приведена схема более сложной молекулы серной кислоты, состоящей из семи атомов. Аналог этой молекулы — слово из семи букв. Из приведенных примеров понятно, что каждая новая молекула (новая комбинация атомов) соответствует новому веществу.
Простые и сложные вещества
Продолжим нашу аналогию сравнения веществ со словами. Вы, наверное, знаете, что рядом с обычными словами, состоящими из нескольких разных букв, мы иногда произносим и слова с использованием только одной буквы (например, 
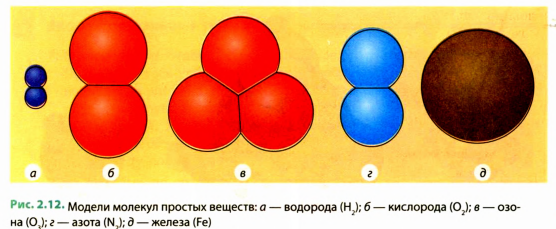
Совершенно очевидно, что слов, состоящих из нескольких букв, намного больше, чем слов из одной буквы. Так же и с веществами. Чаще всего в повседневной жизни мы сталкиваемся с веществами, молекулы которых состоят из атомов нескольких различных видов. Эти вещества так и называются — сложные (см. рис. 2.11).
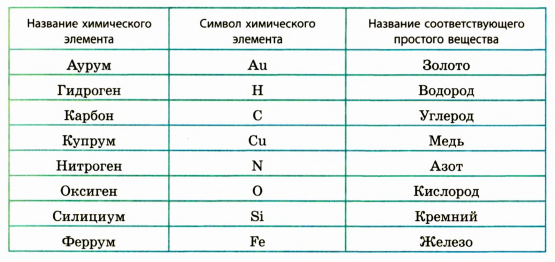
Напомним, что в научной литературе во избежание путаницы применяются разные названия для простых веществ и для химических элементов, из которых эти вещества состоят. Примеры названий простых веществ и соответствующих им химических элементов приведены в таблице.
Наличие промежутков между молекулами
После того как мы познакомились с наименьшими частичками вещества, давайте вспомним некоторые сведения о строении вещества.
В результате проведенных исследований ученые выяснили, что меж ду молекулами (атомами) существуют промежутки. Этот вывод ученых можно легко подтвердить довольно простым опытом. Если смешать 100 мл воды и 100 мл спирта, то объем смеси будет меньше, чем 200 мл. Дело в том, что при смешивании двух жидкостей молекулы воды попадают в промежутки между молекулами спирта. Приведенный опыт можно смоделировать, например, с помощью пшена и гороха (рис. 2.13). Наполните стакан до
половины пшеном, а потом прибавьте столько же гороха. Вы получите двухслойную композицию и полностью заполненный стакан. Аккуратно перемешайте эту композицию, и вы увидите, что объем смеси будет меньшим, чем исходный — часть пшена разместилась в пустотах между горошинами.

Размеры атомов
Атомы очень малы. Выяснено, что раз меры атомов приблизительно равны 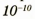 г (0,0000000001 м). Чтобы представить, насколько мало значение этой величины, приведем такое сравнение: диаметр молекулы во столько же раз меньше диаметра яблока, во сколько раз диаметр яблока меньше диаметра Земли.
г (0,0000000001 м). Чтобы представить, насколько мало значение этой величины, приведем такое сравнение: диаметр молекулы во столько же раз меньше диаметра яблока, во сколько раз диаметр яблока меньше диаметра Земли.
О размерах атомов также можно судить из такого примера. Если бы все люди нашей планеты проводили всю жизнь, занимаясь только счетом, то все вместе они смогли бы сосчитать атомы только в одной булавочной головке.
Строение атома
Опыты показали, что атом имеет сложную структуру. Он представляет собой положительно заряженное ядро, окруженное облаком легких частичек — электронов, имеющих отрицательный заряд (рис. 2.14). Масса ядра
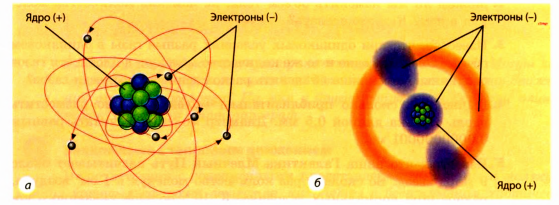
Рис. 2.14. Модели атома: а — планетарная модель: в центре атома — ядро, вокруг ядра вращаются электроны; 6 — современная: электроны как бы «размазаны» по орбиталям — некоторым частям пространства, окружающего ядро. Для наглядности расстояние от ядра до электронов показано в 2—3 раза больше, чем диаметр ядра. На самом деле это расстояние превышает размеры ядра в 100000 раз незначительно отличается от массы атома. Масса же электронов в сравнении с ядром очень мала.
Конечно, приведенные в этом параграфе данные — это только незначительная часть современных сведений об атомах и молекулах. С некоторыми другими их свойствами вы познакомитесь в следующих параграфах, кое о чем узнаете в старших классах.
Итоги:
Все вещества состоят из мелких частичек — молекул или атомов. Между молекулами (атомами) существуют промежутки.
Молекулой называется наименьшая частичка вещества, имеющая его основные химические свойства и состоящая из атомов. Атом имеет сложную структуру и представляет собой положительно заряженное ядро, окруженное облаком легких частичек — электронов, имеющих отрицательный заряд.
Строение вещества
Вокруг нас существует множество физических тел — и все они отличаются друг от друга, в частности, веществом, из которого состоят, и массой.
Атомы
Тела состоят из вещества. Вопрос о строении вещества интересовал ученых еще в глубокой древности.
Одни ученые считали, что вещество можно делить на меньшие части бесконечно. Например, говорили они, каплю воды можно дробить сколько угодно, но и самые малые капли все равно остаются каплями воды! И предела такому делению не видно, из чего эти ученые делали вывод, что такого предела не существует.
Другие же ученые, в числе которых был древнегреческий философ Демокрит, живший в 5-м веке до нашей эры, проявили большую проницательность. Демокрит утверждал, что вещество состоит из крошечных неделимых частиц, настолько малых, что их даже не видно. Например, вода, высыхая, не исчезает, а дробится на мельчайшие, невидимые глазом частицы. Демокрит назвал неделимые частицы вещества «атомами»1.
Так Демокрит, опережая свое время на тысячелетия, высказал гениальную мысль: существовать может даже то, что нс видно глазом! Свое предположение о строении вещества Демокрит выразил знаменитыми словами: «в мире есть только атомы и пустота».
Но лишь через две с половиной тысячи лет, в 19-м веке, ученые получили первые опытные подтверждения атомного строения вещества.
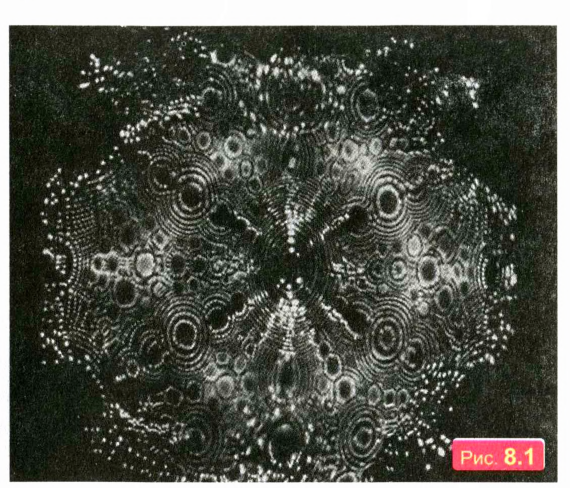
В 20-м веке наука достигла уровня, когда ученые смогли увидеть атомы. На рис. 8.1 вы видите фотографию по верхности острия иглы (из тугоплавкого металла вольфрама), сделанную с помощью специального микроскопа, роль пучков света в котором играли пучки заряженных частиц. Кружки — это изображения отдельных атомов вольфрама!
В многочисленных опытах установлено, что все окружающие нас тела состоят из атомов.
Из атомов состоят и наши собственные тела! Это долгое время казалось непостижимым: как живые существа могут состоять из неживых атомов? Сегодня ответ на этот вопрос уже найден: выяснилось, что строение живых тел очень сильно отличается от строения неживых тел. Об этом мы расскажем в разделе «Хочешь узнать больше?».
Ученым известно сегодня более 100 различных типов атомов. Массы всех атомов приближенно кратны массе самого легкого атома — атома водорода1. Например, масса следующего по массе атома — атома гелия примерно в 4 раза больше массы атома водорода, а масса атома углерода примерно в 12 раз больше массы атома водорода.
Мы не случайно упомянули об углероде: в качестве атомной единицы массы (ее обозначают а. е. м.) принята именно 1/12 массы атома углерода. Например, масса атома водорода равна I а. е. м., масса атома гелия — 4 а. е. м., масса атома кислорода — 16 а. е. м., а масса атома железа — 56 а. е. м.
Молекулы
На достаточно малых расстояниях атомы притягиваются друг к другу, благодаря чему атомы объединяются в молекулы.
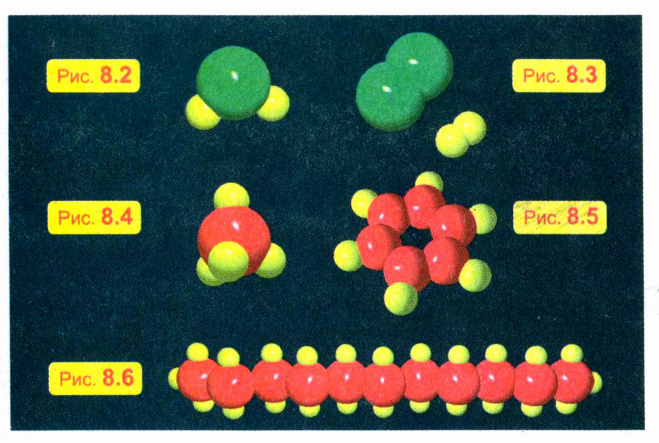
Так, молекула воды состоит из одного атома кислорода и двух атомов водорода. На рис. 8.2 показана модель молекулы воды: атом кислорода условно обозначен зеленым цветом, а атом водорода — желтым. Рядом на рис. 8.3 вы видите модели молекул кислорода и водорода: каждая из них состоит из двух одинаковых атомов.
На рис. 8.4 изображена модель молекулы метана — вещества, которое входит в состав природного газа. Эта молекула состоит из одного атома углерода и четырех атомов водорода. Атомы углерода часто образуют как бы своеобразный «остов» для построения больших молекул. Например, на рис. 8.5 изображена модель «кольцевой» молекулы бензола, в состав которой входят 6 атомов углерода и 6 атомов водорода, а на рис. 8.6 — модель молекулы, состоящей из нескольких десятков атомов.
Среди огромного многообразия молекул, построенных на основе атомов углерода, есть и состоящие из миллионов атомов! Это как раз молекулы, входящие в состав живых существ, в том числе и нас с вами. О таких молекулах мы расскажем в разделе «Хочешь узнать больше?».
Свойства вещества определяются типом его молекул, то есть молекула является мельчайшей частицей данного вещества.
Например, вода состоит из молекул, в состав которых входят атомы водорода и кислорода, но при комнатной температуре вода — жидкость, а водород и кислород — газы.
Ученым сегодня известно несколько миллионов типов молекул. И каждый тип молекул соответствует определенному веществу со своими свойствами.
Размеры молекул и атомов
ПОСТАВИМ ОПЫТ
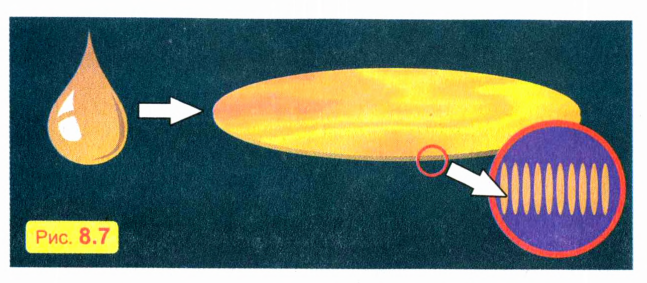
Капнем на поверхность воды капельку масла (лучше взять оливковое масло). Масло растечется по поверхности воды очень тонким слоем. Однако толщина масляной пленки не может быть меньше размера молекулы масла. Это и определяет максимальную площадь пленки (рис. 8.7). Так, опыты показывают, что капелька оливкового масла объемом 1 мм3 растекается по площади не более 1 м2.
Зная объем капельки и площадь масляной пленки, можно оценить длину молекулы масла (эти молекулы имеют удлиненную форму и располагаются на поверхности воды перпендикулярно поверхности). Если из капельки объемом 1 мм3 образуется масляная пленка площадью 1 м2, значит, толщина пленки, равная примерно длине молекулы масла, составляет около 1 нанометра (нм), то есть одной миллиардной части метра! Учтите, что молекула масла состоит из многих атомов.
Наименьшая молекула — одноатомная молекула гелия (около 0,2 нм). Размер молекулы воды, состоящей из двух атомов водорода и одного атома кислорода, немного больше: около 0,3 нм.
Итак, характерной длиной в мире атомов и молекул является 0,1 нм.
Чтобы вы смогли представить размеры молекул, приведем сравнения.
- В одной чайной ложке воды содержится примерно столько же молекул воды, сколько чайных ложек воды содержится в Мировом океане (то есть во всех морях и океанах Земли вместе взятых). Значит, чтобы пересчитать молекулы воды в чайной ложке, нужно было бы потратить столько же времени, сколько для того, чтобы вычерпать чайной ложечкой весь Мировой океан!
- Атом водорода примерно во столько раз меньше сливы, во сколько раз сама слива меньше земного шара. Представьте себе, что огромная Земля состоит вся из слив, — и вы получите некоторое представление о том, как сама слива состоит из атомов!
Живые молекулы
Все живые существа состоят из огромных, чрезвычайно сложно устроенных молекул.
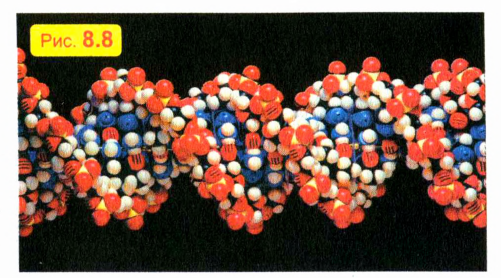
Например, в каждом существе есть особые молекулы, в которых последовательностью атомов «записана» вся так называемая «наследственная информация» — подобно тому, как в книге буквами набран текст.
Только благодаря невероятно тонкой и точной «работе» таких молекул ребенок похож на своих родителей: котенок — на кошку, а слоненок — на слона. Модель короткого фрагмента такой «наследственной» молекулы показана на рис. 8.8. Эти молекулы свернуты в длиннейшие спирали. Чтобы дать вам представление о числе и длине этих молекул, скажем только, что если бы «наследственные» молекулы, содержащиеся в организме одного человека, выстроить в один ряд, то их общая длина была бы в сто раз больше расстояния от Земли до Солнца!
Молекулы, из которых состоят живые существа, часто называют биологическими. Строение и взаимодействие биологических молекул напоминают строение и работу сложных механизмов. Для изучения структуры и действия биологических молекул физика и биология, объединившись, породили новую науку — биофизику. Эта наука изучает строение живых организмов, используя методы не только физики и биологии, но и других наук, например химии и информатики.
Действительно ли атом неделим
В начале 20-го века ученые смогли проникнуть и вглубь атома. Английский ученый Эрнест Резерфорд, «обстреливая» атомы пучками быстрых частиц, установил, что некоторые из этих частиц при столкновении с атомами «отскакивают» назад! Объяснить это можно было только тем, что внутри атома существует крошечное атомное ядро, в котором сосредоточена практически вся масса атома.
Расчеты, сделанные Резерфордом, показали, что размеры атомного ядра примерно в сто тысяч раз меньше размеров атома. То есть, если атом увеличить до размеров цирковой арены, то атомное ядро было бы «маковым зернышком» посреди арены!
Так что Демокрит, утверждавший, что в природе есть только атомы и пустота, недооценил «роль» пустоты: оказалось, что и атомы «наполнены» в основном пустотой!
Ядро имеет положительный электрический заряд, а вокруг ядра движутся очень легкие отрицательно заряженные частицы — электроны. Это напоминает Солнечную систему. Сходство атома с Солнечной системой усиливается еще и тем, что почти вся масса Солнечной системы сосредоточена в Солнце: масса всех планет, вместе взятых, составляет около одной тысячной части массы Солнца.
Исходя из этого, Резерфорд предложил «планетарную» модель атома, согласно которой электроны в атоме движутся вокруг атомного ядра подобно тому, как планеты движутся вокруг Солнца. Однако затем выяснилось, что движение электронов происходит совершенно по другим законам, чем движение планет. Подробнее об этом вы узнаете из курса физики следующих классов.
Таким образом, оказалось, что атом делим: он состоит из атомного ядра и электронов. Сразу же возник вопрос: является ли неделимым атомное ядро?
В последующих опытах (в том числе поставленных тем же Резерфордом) выяснилось, что ядро атома состоит из частиц двух типов — положительно заряженных протонов и нейтронов, не имеющих электрического заряда. Массы протона и нейтрона оказались приблизительно одинаковыми. Это объяснило, почему массы всех атомов приближенно кратны массе атома водорода: ядро атома водорода состоит из одного протона, а ядра всех других атомов состоят из частиц примерно равной массы, как из одинаковых «кирпичиков».
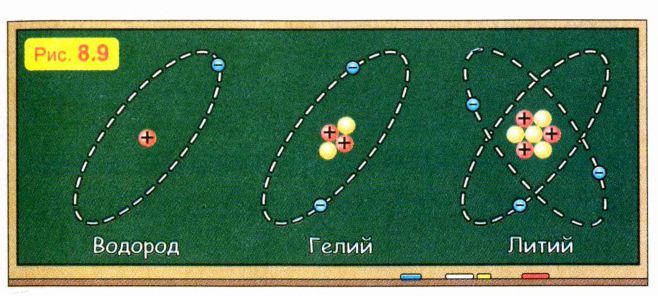
На рис. 8.9 схематически изображено строение простейших атомов — атомов водорода, гелия и лития.
Однако на этом путешествие «вглубь материи» не остановилось: во второй половине 20-го века ученые открыли, что протон и нейтрон — также составные частицы! Подробнее об этом вы тоже узнаете из курса физики следующих классов.
Броуновское движение
В начале 19-го века английский ботаник Роберт Броун, наблюдая в микроскоп крошечные частицы цветочной пыльцы, взвешенные в воде, сделал удивительное открытие. Он увидел, что частицы пыльцы пребывают в «вечной пляске», непрестанно хаотически двигаясь.
Ученый предположил, что частицы пыльцы движутся потому, что они живые, и повторил опыт с растолченными в мельчайшую пыль кусочками камня. Но и частички камня «плясали без устали»! Это движение, которое назвали броуновским, оставалось загадкой в течение 50 лет. Только в конце 19-го века ученые пришли к выводу, что оно обусловлено бомбардировкой этих частиц молекулами воды. Если частица очень мала, удары молекул воды по ней с разных сторон не компенсируют друг друга, что и вызывает непрестанное хаотическое движение частицы.
На рис. 9.1 приведена сделанная с помощью микроскопа фотография, которая хорошо иллюстрирует хаотичность движения броуновских частиц. На этой фотографии отрезками соединены последовательные положения частицы через 1 мин.
Броуновское движение является опытным подтверждением молекулярного строения вещества и движения молекул.
Броуновское движение играет роль «мостика» между макромиром — миром наблюдаемых непосредственно тел — и микромиром — миром молекул и атомов.

С какими скоростями движутся молекулы
Скорости молекул ученые вычислили теоретически в конце 19-го века. Результат оказался поразительным: согласно расчетам, в окружающем нас воздухе молекулы носятся со скоростями артиллерийских снарядов — сотни метров в секунду!
Такие скорости молекул показались некоторым ученым неправдоподобно большими, вследствие чего они ставили под сомнение существование молекул. Однако в начале 20-го века скорости молекул удалось измерить на опыте, и опыт подтвердил теоретические выводы. Согласно расчетам, подтвержденным опытами, с повышением температуры скорость хаотического движения молекул увеличивается.
Почему же мы не ощущаем своей кожей «обстрела» молекулами, движущимися с такими огромными скоростями? Дело в том, что массы молекул чрезвычайно малы, а их удары — очень частые. И поэтому «барабанная дробь» быстрых ударов крошечных молекул проявляет себя как постоянное давление воздуха. Как показывают опыты, при комнатной температуре атомы и молекулы в жидкостях и твердых телах движутся также со скоростями артиллерийских снарядов.
Диффузия
ПОСТАВИМ ОПЫТ
Капнем каплю духов в одном конце комнаты. Через некоторое время запах духов распространится по всей комнате. Как вы догадались, это означает, что молекулы ароматических веществ, входящие в состав духов, «разлетелись» по всей комнате, то есть произошло проникновение молекул одного вещества в другое.
Диффузией называют обусловленное движением молекул взаимное проникновение частиц одного вещества в другое.
Почему же молекулы ароматических веществ не долетели до нас практически мгновенно, раз они движутся со скоростями артиллерийских снарядов? Дело в том, что при своем движении эти молекулы многократно сталкиваются с молекулами, из которых состоит воздух, поэтому их траектории похожи на траектории движения броуновских частиц. Распространению запахов способствуют потоки воздуха.
Диффузия является опытным подтверждением движения молекул.
Диффузия происходит также в жидкостях и даже в твердых телах.
ПОСТАВИМ ОПЫТ
Капните в чашку с водой каплю чернил или йода. Вы увидите, что благодаря диффузии капля «ветвится» и постепенно «тает», придавая слабую окраску всей воде (рис. 9.2—9.4).
Диффузия в жидкостях происходит значительно медленнее, чем в газах, хотя в жидкостях молекулы движутся примерно с такими же скоростями, как и в газах. Дело в том, что в отличие от газов, где молекулы расположены на довольно больших расстояниях друг от друга (в несколько раз больше размеров самих молекул), в жидкостях молекулы расположены практически вплотную. И поэтому в и процессе диффузии одним молекулам приходится как бы «проталкиваться» сквозь плотную «толпу» других молекул. Это и замедляет процесс диффузии. Схематически процесс диффузии в жидкостях изображен на рис. 9.5—9.7.

Обнаружить диффузию в твердых телах намного труднее, чем в жидкостях и газах. Но все-таки можно. Например, был поставлен такой опыт. Под пресс положили отполированные пластины золота и свинца, и через несколько лет в свинце удалось обнаружить атомы золота, а в золоте — атомы свинца: атомы одной пластины проникли в другую пластину вследствие диффузии. Чем же объясняется столь медленная диффузия в твердых телах? Дело в том, что молекулы или атомы твердых веществ расположены обычно не только вплотную, но еще и «стройными рядами». Чтобы «протиснуться» даже сквозь один такой ряд, молекуле приходится предпринимать миллионы «попыток»! В результате скорость диффузии в твердых телах очень мала.
Взаимодействие молекул
О взаимодействии молекул свидетельствует уже само существование жидкостей и твердых тел.
Притяжение молекул
Если бы молекулы не притягивались друг к другу, жидкости и твердые тела сразу распались бы на отдельные молекулы, превратившись в газы: газообразное состояние вещества как раз и соответствует сравнительно слабому взаимодействию молекул.
Молекулы разных тел также притягиваются друг к другу: этим можно объяснить, например, действие клея.
ПОСТАВИМ ОПЫТ
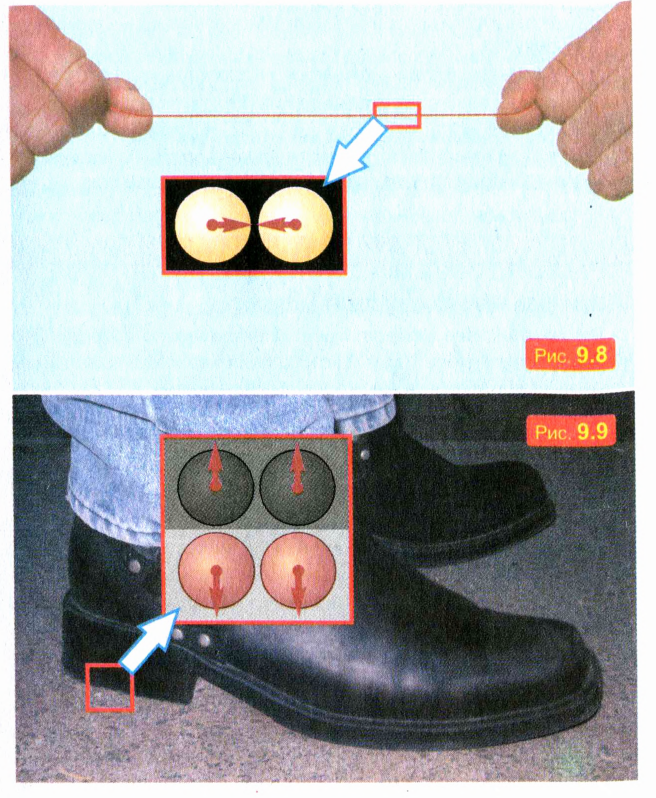
Чтобы получить представление о величине сил притяжения между молекулами, попробуйте разорвать руками капроновую нить сечением 1 мм2. Вряд ли вам удастся это сделать, хотя усилиям всего вашего тела «противостоят» силы притяжения крошечных молекул в малом сечении проволоки или нити. Эти силы схематически показаны на рис. 9.8.
Отталкивание молекул
Если бы молекулы только притягивались, нельзя было бы понять, почему жидкости и твердые тела практически несжимаемы, то есть сильно «противятся» уменьшению их объема.
Это их свойство можно объяснить отталкиванием молекул. Отталкивание молекул обусловливает также взаимодействие твердых тел при непосредственном контакте, когда тела _ «упираются» друг в друга. Например, вы не проваливаетесь сквозь пол потому, что молекулы ваших подошв отталкиваются от молекул, из которых состоит пол. Эти силы отталкивания схематически изображены на рис. 9.9. Таким образом, мы можем сделать вывод, что молекулы взаимодействуют друг с другом: на очень малых расстояниях молекулы отталкиваются, а на несколько больших — притягиваются.
Когда расстояния между молекулами намного больше их размеров, молекулы почти совсем не взаимодействуют.
Основные положения молекулярно-кинетической теории
Исходя из описанных выше наблюдений и опытов, можно сформулировать следующие положения:
- все вещества состоят из мельчайших частиц — атомов и молекул;
- частицы вещества хаотически и непрестанно движутся;
- частицы вещества взаимодействуют друг с другом.
Эти положения лежат в основе молекулярно-кинетической теории — современного учения о строении вещества.
Природа взаимодействия молекул
Взаимодействие молекул имеет электрическую природу. Это взаимодействие носит довольно сложный характер, поэтому мы ограничимся тут только некоторыми пояснениями.
Отталкивание молекул на очень малых расстояниях обусловлено тем, что, когда молекулы расположены вплотную друг к другу, основную роль играет взаимодействие «внешних частей» их атомов, то есть электронов. Электроны заряжены отрицательно, а одноименно заряженные частицы отталкиваются. При увеличении расстояния между молекулами основную роль начинает играть притяжение между положительно заряженными ядрами атомов, входящих в состав одной молекулы, и отрицательно заряженными электронами, входящими в состав атомов другой молекулы. Поэтому отталкивание молекул сменяется их притяжением.
Сложный характер взаимодействия молекул удалось понять только в 20-м веке, когда физики создали квантовую механику — науку о движении и взаимодействии мельчайших частиц вещества. Об основных ее положениях вы узнаете из курса физики старших классов.
Почему движение молекул никогда не прекращается
Движение молекул разительно отличается от движения окружающих нас предметов. Движение предметов, как вы уже знаете, из-за трения замедляется и наконец прекращается. А вот движение молекул не прекращается никогда. Почему же не останавливаются из-за трения молекулы? Дело в том, что вследствие трения механическое движение превращается в хаотическое (тепловое) движение молекул — ведь в результате трения тела нагреваются. Но самим молекулам «передать» энергию своего движения уже некуда — они движутся в пустоте, сталкиваясь только друг с другом. В результате столкновений молекул их энергия только перераспределяется между ними. Вечное движение крошечных молекул сходно в этом смысле с вечным движением огромных планет: планеты, как и молекулы, движутся в пустоте, и поэтому их механическая энергия остается практически неизменной в течение миллионов лет.
Газы
Как вы уже знаете, вещество может находиться в трех состояниях: твердом, жидком и газообразном. Эти состояния вещества называют агрегатными состояниями.
Свойство газов
В этом параграфе мы опишем опыты и наблюдения над газами, а затем расскажем о молекулярном строении газов, которым обусловлены их свойства. Наглядным примером газа является окружающий нас воздух. Мы живем «на дне» огромного воздушного океана глубиной в десятки километров. Это атмосфера. На рис. 10.1 вы видите сделанную из космоса фотографию атмосферы Земли.
Воздух состоит в основном из двух газов — азота (около 80 %) и кислорода (около 20 %). Все живые существа дышат кислородом, находящимся в воздухе (рыбы дышат воздухом, растворенным в воде). Поэтому о чем-то крайне нужном часто говорят: «нужен как воздух».
Воздух кажется нам очень легким. Но и он имеет вес, причем немалый: на каждый квадратный сантиметр поверхности Земли атмосферный воздух давит с силой, равной весу килограммовой гири. Например, на поверхность стола площадью 1 м2 воздух давит с силой, равной примерно весу груженого самосвала (рис. 10.2)! Стол «выдерживает» силу давления воздуха потому, что примерно с такой же силой воздух давит и на нижнюю поверхность стола. О том, что воздух давит и снизу, свидетельствуют воздушные шары (рис. 10.3): они держатся в воздухе только потому, что воздух давит на них снизу с большей силой, чем сверху!
Воздух давит и на поверхность тел живых существ. И не расплющивает он их потому, что ткани их тел оказывают сопротивление воздуху (рис. 10.4).

Давление воздуха вы будете изучать в следующем учебном году. Вы можете «почувствовать» воздух, подставив лицо или руку ветру. На восходящих потоках воздуха парят птицы и дельтапланы (рис. 10.5).

Человек начал использовать силу ветра еще в древности: именно с ее помощью он путешествовал по морям и океанам, открывая и заселяя новые земли (рис. 10.6).
Силу ветра использовали также в ветряных мельницах, а сегодня используют в ветровых электростанциях. Так что «пустой» стакан или тем более «пустая» комната не так уж пусты! Например, масса воздуха в комнате средних размеров примерно равна массе взрослого человека (рис. 10.7).
ПОСТАВИМ ОПЫТ
Погрузите банку вверх дном в воду: вы увидите, что вода не заполняет «пустую» банку (рис. 10.8)! Это происходит потому, что в банке остался воздух. Наклоните банку, и вы увидите, как он выходит из банки пузырьками. Отличительная особенность газов состоит в том, что газ занимает весь предоставленный ему объем.

Именно поэтому, например, мяч при надувании наполняется воздухом равномерно во всем объеме.
Может возникнуть вопрос: если газ занимает весь предоставленный ему объем, то почему атмосфера Земли не «разлетается»? Дело в том, что атмосферу удерживает довольно большая сила притяжения Земли. А вот, например, Луна не «смогла» удержать свою атмосферу, так как ее сила притяжения намного меньше.
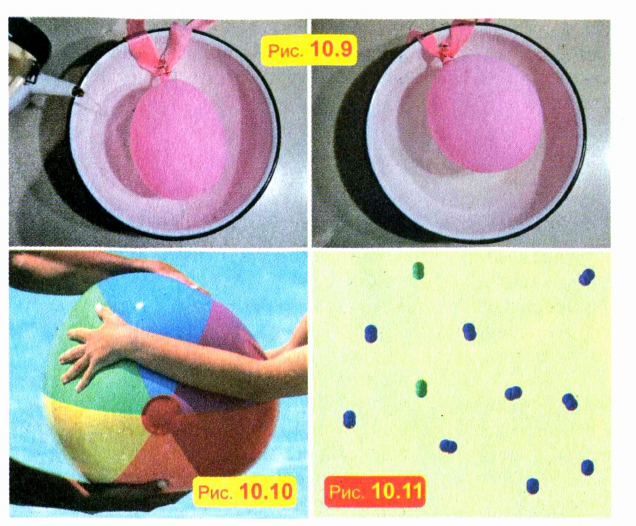
ПОСТАВИМ ОПЫТ
Положите слабо надутый воздушный шарик в кастрюлю и налейте в нее горячую воду. Шарик надуется, хотя масса заключенного в шарике воздуха не увеличилась (рис. 10.9). Это можно объяснить тем, что газы при нагревании расширяются.
При нагревании на тысячу градусов объем газа увеличивается в несколько раз! Способность газа многократно увеличивать свой объем при нагревании используют в тепловых двигателях: нагретый газ толкает поршень, движение которого передается, например, колесам автомобиля. Как мы увидим далее, жидкости и твердые тела при нагревании также расширяются, но значительно меньше, чем газы.
ПОСТАВИМ ОПЫТ
Попробуйте сжать руками какой-либо твердый предмет, скажем, кусок дерева или кирпич. Вряд ли вам это удастся.
Не удастся вам сжать и кожаный мяч, полностью наполненный водой. А вот слабо надутый мяч или шар сжать очень легко (рис. 10.10). Таким образом, в отличие от твердых и жидких тел, газы легко сжимаемы.
Молекулярное строение газов
Сжимаемость газов объясняется тем, что молекулы в газах расположены не вплотную. Например, в окружающем нас воздухе расстояния между молекулами примерно в 10 раз больше размеров молекул. Молекулярное строение газа схематически показано на рис. 10.11.
Находясь «вдали» друг от друга, молекулы газов практически не взаимодействуют друг с другом. Вследствие столкновений движение молекул газа носит хаотический характер. Поэтому газ и заполняет весь предоставленный ему объем.
Жидкости
Самая распространенная на Земле жидкость — вода, хотя, как мы увидим, она обладает некоторыми исключительными свойствами.
ПОСТАВИМ ОПЫТ
Налейте воду в любой сосуд — вода «послушно» примет форму этого сосуда (рис. 11.1).
Этот опыт показывает, что жидкость принимает форму сосуда, в котором она находится.
Обусловлено это тем, что жидкость обладает текучестью, то есть очень легко изменяет свою форму под действием внешних сил. На жидкость в сосуде действуют сила тяжести и давят стенки сосуда — вот почему жидкость и принимает форму сосуда.
Но говорить, что «жидкость не имеет своей формы», все-таки нельзя! Мы расскажем об этом в разделе «Хочешь узнать больше?».
Свойства жидкостей
Легко изменяя свою форму, жидкость в то же время «упорно» противится сжатию, то есть уменьшению объема. Однажды поставили такой опыт. Толстостенную свинцовую сферу через небольшое отверстие заполнили водой, запаяли отверстие и подвергли сферу очень сильному сжатию. И что же получилось? Вода не сжалась, а просочилась сквозь металл: на поверхности свинцовой сферы выступили капли воды!

Этот и подобные ему опыты показывают, что жидкости обладают малой сжимаемостью.
Это жидкости существенно отличаются от легкосжимаемых газов. Можно сказать, что жидкость по своим свойствам напоминает песок: изменить форму песка очень легко, но изменить объем данной массы песка — трудно. Это сходство жидкости с песком, как мы скоро увидим, обусловлено молекулярным строением жидкости.
Объем жидкости трудно не только уменьшить — его настолько же трудно и увеличить. Другими словами, жидкость сохраняет свой объем (при постоянной температуре). Поэтому в отличие от газа жидкость не обязательно занимает весь объем сосуда: например, воду в стакан можно налить до половины (а вот наполнить стакан газом «до половины» невозможно). На границе с воздухом жидкость образует свободную поверхность.
ПОСТАВИМ ОПЫТ
Налейте в стакан воду до половины и медленно наклоните стакан. Вы увидите, что поверхность воды остается горизонтальной. Это обусловлено текучестью жидкости: под действием силы тяжести вода стремится занять как можно более низкое положение. Именно по этой причине вода и выливается из наклоненного сосуда (рис. 11.2).
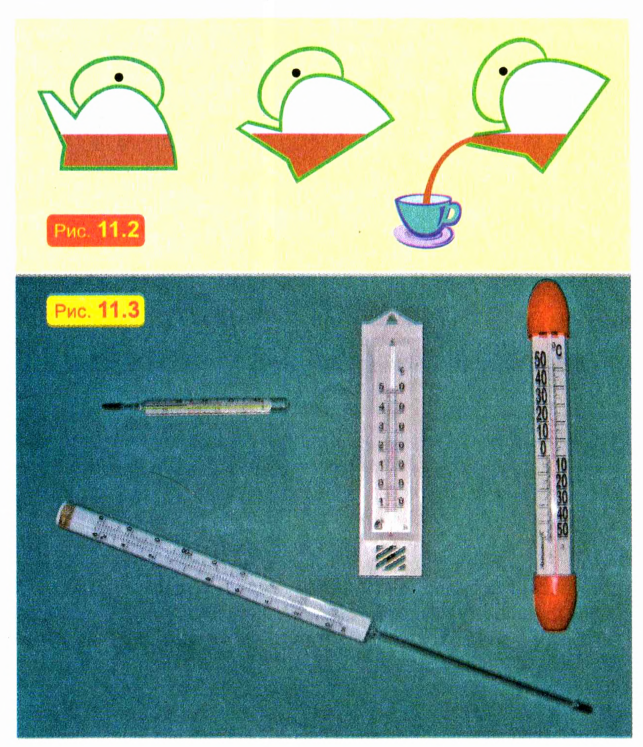
При нагревании жидкости расширяются — значительно меньше, чем газы, но значительно больше, чем твердые тела. Это используют, в частности, при изготовлении жидкостных термометров — приборов для измерения температуры (рис. 11.3).
Поскольку жидкость при нагревании расширяется сильнее, чем твердая «оболочка» термометра, высота столба жидкости вследствие нагревания увеличивается. А чтобы увеличение объема было заметнее, термометр сконструирован так, что жидкость поднимается внутри тонкой трубки. Однако не все жидкости и не всегда при нагревании расширяются! Важным исключением является самая распространенная на Земле жидкость — вода. О ее «поведении» при нагревании мы расскажем в разделе «Хочешь узнать больше?».
Молекулярное строение жидкостей
Схематически расположение молекул в жидкости показано на рис. 11.4.
Молекулы в жидкости расположены вплотную друг к другу, но в этом расположении нет определенного порядка.
Как видно, расположение молекул в жидкости напоминает расположение песчинок в куче песка. Этим и обусловлено упомянутое выше сходство жидкости с песком.

Молекулы жидкости хаотически движутся, но их движение сильно ограничено молекулами-«соседями». Поэтому движение молекул жидкости напоминает движение людей в толпе: молекулы «толкаются», время от времени меняясь местами друг с другом. Именно эти «перескоки» и сообщают жидкости текучесть. Когда на жидкость действуют внешние силы, «перескоки» молекул в одном направлении происходят чаще, чем в других направлениях, вследствие чего форма жидкости изменяется. А поскольку эти «перескоки» происходят очень часто, форма жидкости меняется настолько быстро, что мы говорим: жидкость течет.
Плотность вещества
Тела, состоящие из одинакового вещества, могут иметь различные массы: например, масса воды в полном ведре примерно в 50 раз больше массы воды в полном стакане. И объем воды в ведре примерно в 50 раз больше объема воды в стакане.
Для всех тел, состоящих из одинакового вещества, отношение массы к объему одинаково.
Отношение массы т однородного образца данного вещества к его объему V называют плотностью  этого вещества:
этого вещества: 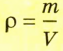
Плотность является характеристикой вещества, а нс конкретного тела. Единицей плотности в SI является 1 кг/м3. Плотность воды равна 1000 кг/м3, а плотность воздуха — примерно 1,3 кг/м3, то есть почти в 770 раз меньше. Плотность воды намного больше плотности воздуха из-за того, что в жидкости, в отличие от газа, молекулы расположены вплотную.
Почему капли круглые
Утверждение, что жидкость «не имеет своей формы», а всегда принимает форму сосуда, не совсем правильно.
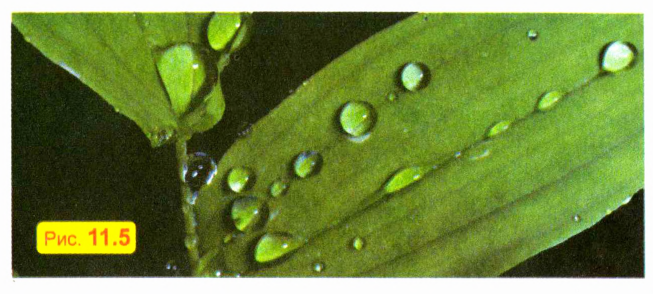
ПОСТАВИМ ОПЫТ
Капните водой на тарелку, смазанную любым жиром (например, сливочным или растительным маслом). Вы увидите, что капли не растекаются, а сохраняют примерно шарообразную форму. Такую же форму имеют и капельки росы на траве и листьях (рис. 11.5). Это обусловлено тем, что жидкость стремится уменьшить площадь своей поверхности, а из всех тел с заданным объемом наименьшую площадь поверхности имеет шар.
При «земных» условиях сила тяжести и давление стенок сосуда «заставляют» жидкость принять форму сосуда. А для малой капли основную роль играет стремление жидкости уменьшить площадь поверхности.
Почему зимой реки и озера не промерзают до дна
Удивительным свойством воды, отличающим ее от других жидкостей, является то, что при нагревании от О °C до 4 °C вода не расширяется, а сжимается, вследствие чего плотность воды максимальна при температуре 4 °C. Благодаря этому зимой «тяжелая» вода с температурой 4 °C опускается на дно рек и озер. Вот почему реки и озера в средних широтах редко промерзают зимой до дна (если они не слишком мелкие). А от этого радость не только рыбам, но и рыбакам — любителям подледного лова.
Твердые тела
Как вы уже знаете, твердые тела сохраняют объем и форму.
Свойства твердых тел
Твердые тела сильно отличаются по своим свойствам.
Во-первых, они отличаются друг от друга твердостью. Например, хорошо известна мягкость графита, из которого делают стержни карандашей. Но есть и «по-настоящему» твердые тела, например стекло или чугун. «Чемпионом» же по твердости считаю! алмаз: он оставляет царапины на любом другом теле. Поэтому из алмаза изготовляют особо твердые режущие инструменты.
Во-вторых, твердые тела отличаются друг от друга хрупкостью. Так, стеклянный стакан — хрупкое тело: при ударе он разрушается. А свинцовый брусок — пластичное тело: при ударе он лишь изменяет форму.
Расширение твердых тел при нагревании
ПОСТАВИМ ОПЫТ
Возьмем металлические шар и кольцо, размеры которых подогнаны так, что при одинаковой температуре шар проходит сквозь кольцо почти без зазора (рис. 12.1). Нагреем шар (рис. 12.2). Мы увидим, что нагретый шар не проходит сквозь кольцо (рис. 12.3). Обусловлено это тем, что твердые тела при нагревании расширяются.
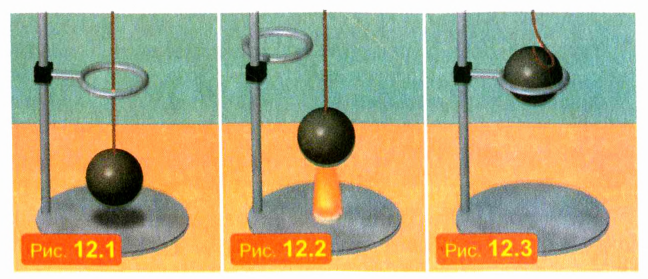
Твердые тела при нагревании расширяются значительно меньше, чем жидкости и газы. Например, стальной метровый стержень при нагревании на 1 °C удлиняется примерно на одну сотую долю миллиметра.
Однако если бы строители и инженеры не учитывали теплового расширения материалов, то это приводило бы к разрушению зданий, мостов и дорог, а также к обрывам линий электропередач! Так, пролет моста при нагревании может удлиниться на несколько сантиметров. Вы, наверное, замечали, что провода линий электропередач заметно провисают, особенно летом (рис. 12.4). Объяснить это провисание очень просто: если бы летом провода были натянутыми, то зимой они просто порвались бы!

Например, в кристалле поваренной соли атомы натрия и хлора строго чередуются, располагаясь в вершинах куба, — поэтому кристаллы соли и имеют форму куба. А в кристалле льда молекулы воды располагаются в вершинах шестиугольников — вот почему узор всех снежинок имеет шестиугольный «каркас». На рис. 12.7 схематически изображена кристаллическая решетка поваренной соли, а на рис. 12.8 — кристаллическая решетка льда.
Кристаллы
Есть два типа твердых тел — кристаллические и аморфные. Рассмотрим сначала кристаллические тела, которые часто называют кристаллами. Примерами кристаллов являются знакомые вам поваренная соль и сахар.
ПОСТАВИМ ОПЫТ
Рассмотрите через увеличительное стекло кристаллики соли или сахара: у них ровные, будто специально срезанные, грани. Можно вырастить и большой кристалл: на рис. 12.5 изображен такой кристалл соли. Очень красивы снежинки (рис. 12.6), являющиеся кристалликами льда. Но как бы ни были разнообразны снежинки, в основе их узора всегда лежит правильный шестиугольник! Правильная форма кристаллов обусловлена тем, что атомы или молекулы в кристаллах расположены упорядоченно, образуя кристаллическую решетку.

Аморфные тела
С аморфными телами вы также встречаетесь каждый день: например, аморфными телами являются стеклянные предметы (рис. 12.9). Аморфные тела обладают текучестью, но значительно меньшей, чем жидкости. Текучесть аморфных тел возрастает с повышением температуры, благодаря чему, например, из капли нагретого стекла можно «выдувать» стеклянные сосуды, подобно тому как выдувают мыльные пузыри. На рис. 12.10 изображена капля «полужидкого» стекла.

Опыты показывают, что стекло обладает некоторой текучестью даже при комнатной температуре. Это подтверждают, в частности, наблюдения за окнами старинных зданий: оконные стекла в них за много лет «оплыли», став толще внизу. Текучесть аморфных тел обусловлена тем, что в аморфных телах нет кристаллической решетки.
На рис. 12.11 схематически изображено молекулярное строение аморфного тела. Оно напоминает молекулярное строение жидкости, поэтому аморфные тела занимают промежуточное положение между жидкостями и кристаллами. Из-за отсутствия кристаллической решетки атомы или молекулы в аморфных телах время от времени «перескакивают» из одного положения в другое. Этим объясняется текучесть аморфных тел: когда на аморфное тело действуют внешние силы, «перескоки» молекул в одном направлении происходят чаще, чем в других, в результате чего форма тела постепенно изменяется1.
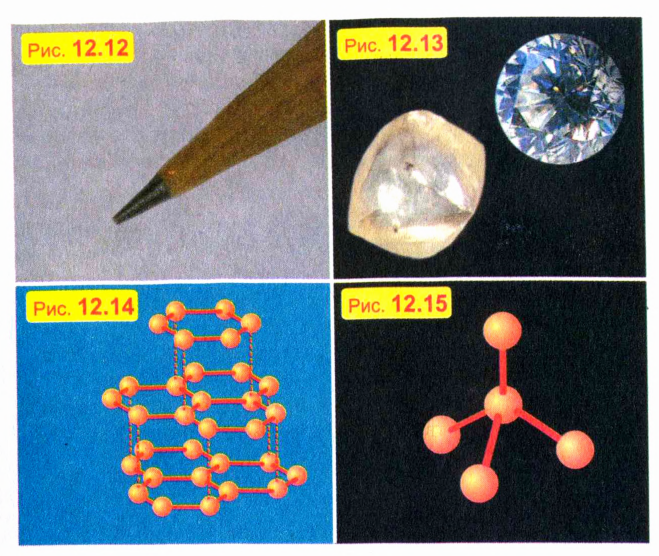
Почему графит мягкий, а алмаз твердый
Свойства кристалла зависят не только от типа атомов, но и от типа кристаллической решетки.
Трудно поверить, например, что мягкий черный графит, из которого делают стержни карандашей (рис. 12.12), и твердый прозрачный алмаз (рис. 12.13) состоят из одинаковых атомов — атомов углерода. Почему же тогда эти два вещества так отличаются по своим свойствам?
Дело в том, что кристаллическая решетка графита имеет слоистую структуру, причем соседние слои слабо связаны друг с другом (рис. 12.14). Поэтому слои легко отделяются друг от друга, чем и объясняется мягкость графита. В кристаллической же решетке алмаза все атомы сильно связаны со своими ближайшими соседями (рис. 12.15). Именно эта жесткая связь атомов и обусловливает уникальную твердость алмаза.
Жидкие кристаллы
Во второй половине 20-го века начали активно изучать и применять искусственно созданные вещества, которые объединяют свойства жидкостей и кристаллов. Их назвали жидкими кристаллами.
Широкое применение жидких кристаллов обусловлено тем, что они очень чувствительны к изменению внешних условий: например, даже при небольшом изменении температуры или давления они могут изменять свой цвет. Благодаря этому жидкие кристаллы широко применяют в разных приборах — например, в жидкокристаллических медицинских термометрах. Особенно широко применяют жидкие кристаллы для изготовления разных дисплеев — от часов и мобильных телефонов до компьютеров и телевизоров.
В расположении молекул жидких кристаллов есть определенная упорядоченность, поэтому эти вещества называют жидкими кристаллами. Но они не имеют кристаллической решетки, поэтому эти вещества называют жидкими кристаллами.
Например, молекулы жидких кристаллов часто имеют удлиненную форму — длина молекулы может в десять и более раз превышать ее «толщину». Причем эти удлиненные молекулы сориентированы одинаково (например, расположены преимущественно вертикально), но центры молекул расположены хаотически. На рис. 12.16 схематично изображено молекулярное строение такого жидкого кристалла.

Итоги
- Все окружающие нас тела состоят из атомов.
- В качестве атомной единицы (а. е. м.) принята 1/12 массы атома углерода.
- Молекулы состоят из атомов.
- Свойства вещества определяются типом его молекул, поэтому молекула является мельчайшей частицей вещества.
- Характерной длиной в мире атомов и молекул является 0,1 нм.
- Опытным подтверждением молекулярного строения вещества и движения молекул является броуновское движение.
- С повышением температуры скорость хаотического движения молекул увеличивается.
- Диффузией называют обусловленное движением молекул взаимное проникновение частиц одного вещества в другое. Диффузия является опытным подтверждением движения молекул.
- Основные положения молекулярно-кинетической теории: 1) все вещества состоят из мельчайших частиц — атомов и молекул; 2) частицы вещества непрестанно и хаотически движутся; 3) частицы вещества взаимодействуют друг с другом.
- Вещество может находиться в трех состояниях: твердом, жидком или газообразном. Эти состояния вещества называют агрегатными состояниями.
- Газ занимает весь предоставленный ему объем.
- Газы при нагревании расширяются.
- Жидкость принимает форму сосуда, в котором она находится. Это обусловлено текучестью жидкости.
- Жидкости мало сжимаемы (сохраняют свой объем).
- На границе с воздухом жидкость образует свободную поверхность.
- Молекулы в жидкости расположены вплотную друг к другу, но в этом расположении нет определенного порядка.
- Плотностью
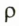 вещества называют отношение массы
вещества называют отношение массы 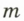 однородного образца данного вещества к объему этого образца
однородного образца данного вещества к объему этого образца 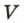 , то есть
, то есть 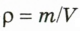 . Плотность характеризует вещество, а не тело.
. Плотность характеризует вещество, а не тело. - Твердые тела сохраняют объем и форму.
- При нагревании твердые тела расширяются.
- Существуют два типа твердых тел — кристаллические и аморфные.
- Атомы или молекулы в кристаллах расположены упорядоченно, образуя кристаллическую решетку.
- В аморфных телах нет кристаллической решетки. Молекулярное строение аморфного тела напоминает молекулярное строение жидкости.
Дискретное строение вещества
Другого ничего в природе нет. Ни здесь, ни там, в космических глубинах: Все — от песчинок малых до планет — Из элементов состоит единых. С. Щипачев
О каких элементах идет речь в вышеприведенных строках из стихотворения «Читая Менделеева»?
Все тела состоят из каких-либо веществ: ручка — из пластмассы, карандаш — из древесины и графита.
Вещества обладают различными, только им присущими свойствами: цветом, запахом, плотностью, текучестью и др. А что общего у всех веществ?
Проведем опыт. В кружку с чаем положим кусочек сахара (рис. 42, а) и размешаем. Крупинки сахара стали невидимыми (рис. 42, б), а чай сладким. Значит, сахар не исчез. Он остался в чае. Но почему крупинки не видны? Они распались на мельчайшие частицы, не видимые глазом.
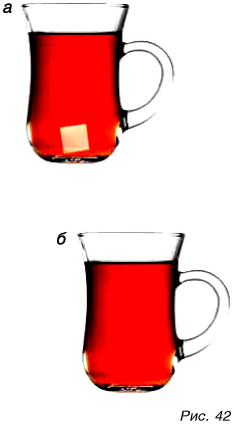
Мельчайшие частицы вещества, способные существовать самостоятельно и сохраняющие основные свойства вещества, называются молекулами.
Не только сахар, но и все другие вещества состоят из мельчайших частиц, т. е. имеют дискретное (прерывистое) строение. Разные вещества состоят из различных молекул, поэтому и свойства их отличаются.
Гипотеза о дискретном строении вещества была выдвинута греческим философом Демокритом (рис. 43) около 25 веков тому назад. Легенда рассказывает, что однажды Демокрит сидел на камне у моря, держал в руке яблоко и размышлял: «Если я сейчас это яблоко разрежу пополам, у меня останется половина яблока; если я затем эту половину снова разрежу на две части — останется четверть яблока; но если я и дальше буду продолжать такое деление, то не приведет ли это к тому, что оставшаяся часть уже не будет обладать свойствами яблока?» Демокрит пришел к выводу, что предел делению существует, и назвал эту последнюю, уже неразрезаемую, неделимую частицу атомом (от греч. atomos — неделимый).

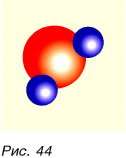
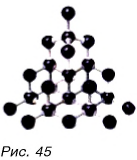
Из атомов состоят молекулы. Некоторые вещества состоят только из атомов. На рисунке 44 изображена модель молекулы воды  Она состоит из одного атома кислорода и двух атомов водорода. А вот алмаз (рис. 45) состоит только из атомов углерода. Всего в природе встречается 92 вида различных атомов. Кроме того, в научных лабораториях получено более 30 видов атомов. Как из 33 букв алфавита образуется множество разных слов, так из атомов образуется множество различных молекул — от самых простых до очень сложных (рис. 46). Из молекул состоит большинство веществ.
Она состоит из одного атома кислорода и двух атомов водорода. А вот алмаз (рис. 45) состоит только из атомов углерода. Всего в природе встречается 92 вида различных атомов. Кроме того, в научных лабораториях получено более 30 видов атомов. Как из 33 букв алфавита образуется множество разных слов, так из атомов образуется множество различных молекул — от самых простых до очень сложных (рис. 46). Из молекул состоит большинство веществ.
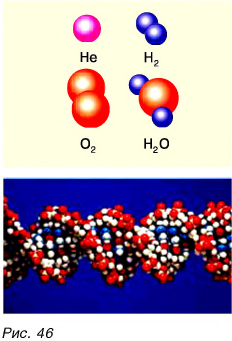
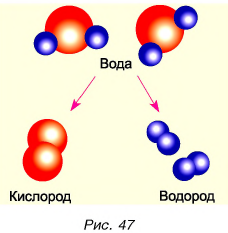
Молекулы вещества можно разделить на атомы. Атомы, соединяясь с другими атомами, образуют новые вещества с новыми свойствами. Например, вода под действием электрического тока может превратиться в газы: водород и кислород (рис. 47). Их свойства отличаются от свойств воды.
При нагревании вода переходит в газ (пар), при охлаждении — в лед. И пар, и вода, и лед состоят из одинаковых молекул (рис. 48).
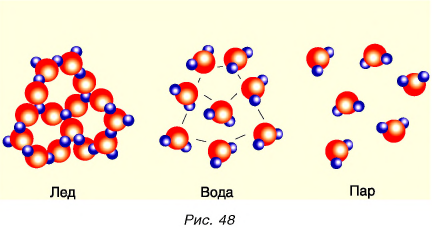
Однако молекулы по-разному взаимодействуют друг с другом, поэтому свойства льда, воды и пара разные.
Дискретное строение вещества подтверждают многие из наблюдаемых нами в повседневной жизни явлений. К ним относится возможность существования вещества (например, 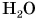 ) в трех состояниях — твердом, жидком и газообразном (рис. 49). Также свидетельством дискретного строения вещества является смешивание и окрашивание жидкостей (рис. 50). Еще один наглядный пример из жизни — это растекание масла по поверхности воды и образование пятна определенной площади (рис. 51).
) в трех состояниях — твердом, жидком и газообразном (рис. 49). Также свидетельством дискретного строения вещества является смешивание и окрашивание жидкостей (рис. 50). Еще один наглядный пример из жизни — это растекание масла по поверхности воды и образование пятна определенной площади (рис. 51).
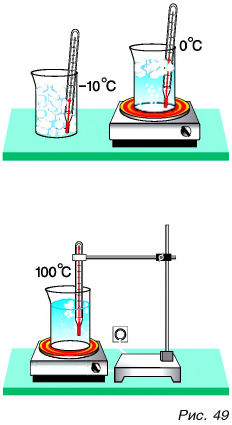


Наблюдать дискретное строение вещества стало возможным после того, как ученые создали микроскопы с высочайшей степенью увеличения. На рисунке 52, а представлена фотография атома водорода, а на рисунке 52, б — структуры поверхности графита. Данные фотографии были получены с помощью самых современных микроскопов при очень высоком увеличении.
Для любознательных:
Представим себе, что мы нанизали па воображаемую нить все молекулы, находящиеся в  воздуха, так, чтобы они касались друг друга. Получившейся нитью можно было бы 200 раз обмотать по экватору земной шар. Так велико число молекул в
воздуха, так, чтобы они касались друг друга. Получившейся нитью можно было бы 200 раз обмотать по экватору земной шар. Так велико число молекул в 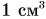 воздуха и так малы их размеры!
воздуха и так малы их размеры!
Есть вещества, молекулы которых во много раз больше по массе и числу атомов, чем, например, молекула воды. Масса молекулы некоторых белковых веществ примерно в 1 000 000 раз больше массы молекулы воды.
Молекула гемоглобина (вещества крови, которое переносит кислород) состоит из 1400 атомов, что примерно в 467 раз больше числа атомов в молекуле воды.
Главные выводы:
- По современным представлениям, вещество имеет прерывистое (дискретное) строение.
- Молекулы — мельчайшие частицы вещества, способные существовать самостоятельно и сохраняющие основные свойства вещества.
- Молекулы состоят из атомов.
Тепловое движение частиц
Мы уже знаем, что все вещества состоят из мельчайших частиц — атомов, молекул. Как ведут себя частицы вещества?
Для получения ответа проведем опыт. В стаканы с холодной и теплой водой бросим по 3 кристаллика марганцовки (перманганата калия) (рис. 53). Уже через несколько минут мы увидим, как вода постепенно окрашиваете,я в розовый цвет. Причем в теплой воде окрашивание идет быстрее (рис. 53, а), чем в холодной (рис. 53, б). О чем говорят результаты опыта?
- Розовый цвет воды указывает на то, что марганцовка растворяется в воде.
- Окрашивание идет по всем направлениям, значит, частицы марганцовки и воды сталкиваются между собой и движутся беспорядочно (хаотически).
- Окрашивание воды в стакане с теплой водой идет быстрее. Это означает, что в теплой воде хаотическое движение и столкновения частиц более интенсивны, чем в холодной.
- Перемешивание веществ, проникновение их друг в друга указывает па то, что между частицами есть расстояния.
Явление взаимного проникновения веществ друг в друга называют диффузией.
Беспорядочное движение частиц вещества, зависящее от степени нагретости вещества, называют тепловым.
Хаотически движутся молекулы в газах. Движение молекул в жидкостях и твердых телах отличается от их движения в газах, но тоже хаотично. Доказательство тому — диффузия. Сидя в своей комнате, мы очень быстро по запаху пищи определяем, что готовит мама на кухне. Распространение запахов — это пример диффузии.
В газах она идет быстрее, чем в жидкостях. Например, если всыпать в стакан с водой ложку соли, то через некоторое время соль растворится, и вода станет соленой. Но на это потребуется время (20—30 мин). Очень медленно идет диффузия в твердых телах. Нужны годы, чтобы частицы одного твердого тела проникли в другое.
Для любознательных:
Следует отметить огромную роль диффузии в природе и технике.
В неживой природе это непрерывное перемешивание газов в земной атмосфере, не позволяющее более тяжелым газам собираться в низинах. Это минерализация воды, т. е. растворение в ней различных неорганических (минеральных) веществ. Чистая, без этих веществ (дистиллированная), вода совершенно безвкусна и мало полезна. Важна диффузия при переносе питательных веществ и кислорода в растениях и других организмах. Путем диффузии осуществляется газообмен в легких и тканях животных. Кислород, содержащийся в воздухе, поступает в кровь, которая доставляет его к клеткам. Углекислый газ из клеток выделяется в кровь, а затем в окружающую среду.
В технике диффузия используется для получения металлов с заданными свойствами. В первую очередь это стали и сплавы алюминия, широко применяемые в авиации. На диффузии основаны процессы пайки, сварки (см. рис.), склеивания материалов и др. С другими доказательствами хаотического движения частиц вы познакомитесь в 8-м и 10-м классах.

Главные выводы:
- Частицы вещества находятся в непрерывном хаотическом движении.
- Интенсивность теплового движения частиц вещества тем больше, чем выше температура.
- Явлением диффузии подтверждается хаотическое движение частиц и наличие расстояний между ними.
Для любознательных:
Рассматривая под микроскопом пыльцу растений в воде, английский ботаник Роберт Броун (1773—1858) обнаружил беспорядочное и непрерывное движение ее частиц. Не зная, как объяснить увиденное, ученый решил, что частицы пыльцы живые. Броун провел опыт, взяв вместо пыльцы мелко истолченную глину. Все повторилось, как и в случае с пыльцой. Частички покрупнее двигались медленно, реже меняя направление движения. Мелкие частички двигались быстро, беспорядочно меняя направление движения. Кроме того, исследуя данное явление, Броун обнаружил, что в горячей воде частички движутся быстрее, чем в холодной.
Ученый так и не смог объяснить причину физического явления, которое позже получило название броуновского движения. Но, несмотря на это, ботаник Броун прочно вошел в историю физики.
Позже причина броуновского движения была точно установлена. Молекулы жидкости, двигаясь хаотично, ударяются со всех сторон о броуновскую частицу. Различное число ударов с разных сторон заставляет частицы непрерывно и беспорядочно двигаться.
Броуновское движение экспериментально подтверждает реальность существования молекул и их тепловое движение.
Взаимодействие частиц вещества
Почему многие твердые тела обладают такой большой прочностью? На стальном тросе, диаметр которого составляет всего 25 мм, можно поднять целый тепловоз. Очень трудно разделить на куски камень. Объяснить перечисленные факты можно взаимным притяжением частиц, из которых состоят твердые тела.
Молекулы (атомы) в твердых веществах притягиваются друг к другу.
Но почему тогда части разбитого стеклянного стакана нельзя без клея соединить в одно целое? В то же время куски пластилина легко соединяются в один кусок. Проделайте опыт с пластилином самостоятельно.
Объяснить эти факты можно, предположив, что притяжение молекул (атомов) проявляется лишь на малых расстояниях между ними. Действительно, если нагреть стеклянные куски до такой степени, чтобы стекло стало мягким (рис. 54), и прижать их друг к другу, они слипнутся в одно целое.

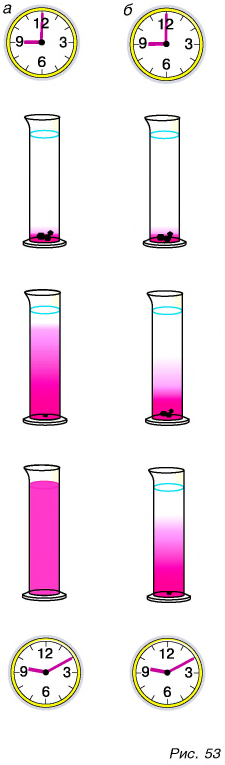
Притягиваются друг к другу и молекулы в жидкостях. Чтобы доказать это утверждение, проведем такой опыт. Подвесим на пружине чистую стеклянную пластинку и отметим положение нижнего конца пружины указателем (рис. 55, а). Поднесем к пластинке сосуд с водой до соприкосновения ее с поверхностью воды, после чего будем опускать сосуд до отрыва пластинки. Растяжение пружины увеличится (рис. 55, б), что указывает на притяжение частиц жидкости (воды) в сосуде и на поверхности стеклянной пластины.
А вот молекулы (атомы) газа практически не притягиваются друг к другу. Дело в том, что в газах частицы находятся на больших расстояниях, чем в жидкостях и твердых телах. Притяжение на этих расстояниях ничтожно мало. Поэтому молекулы газа разлетаются по всему предоставленному газу объему. Например, запах духов из открытого флакона распространяется по всей комнате.
А есть ли между молекулами отталкивание? Проведите такой опыт. Возьмите сплошной резиновый мячик и попробуйте его сжать (рис. 56, а). Легко ли это сделать? Стоит только перестать сжимать мячик, как он тут же восстанавливает свою форму (рис. 56, б). Значит, между частицами резины существует отталкивание. Именно отталкивание частиц затрудняло сжатие мячика, оно же восстановило его первоначальную форму.

Очень важно понять, что притяжение и отталкивание частиц вещества проявляются лишь на малых расстояниях между частицами, т. е. в твердых телах и жидкостях.
Взаимодействие двух молекул условно можно сравнить со взаимодействием двух шариков, скрепленных пружиной (рис. 57, а). При расстоянии 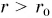 (пружина растянута) шарики притягиваются друг к другу (рис. 57, б), а при расстоянии
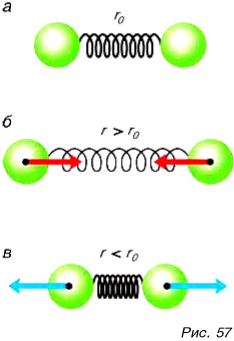
(пружина растянута) шарики притягиваются друг к другу (рис. 57, б), а при расстоянии 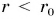 (пружина сжата) — отталкиваются (рис. 57, в).
(пружина сжата) — отталкиваются (рис. 57, в).
Хотя эта модель весьма наглядна, тем не менее она имеет недостаток: на больших расстояниях притяжение, создаваемое пружиной, становится все сильнее. У молекул же, как мы отмечали ранее, оно практически исчезает.
Таким образом, на одних расстояниях (при отдалении частиц) преобладает притяжение, а на других (при сближении частиц) — отталкивание.
Главные выводы
- Частицы твердых веществ и жидкостей (атомы, молекулы) испытывают взаимное притяжение и взаимное отталкивание.
- При сближении частиц твердых веществ и жидкостей преобладает взаимное отталкивание, при удалении на небольшое расстояние — взаимное притяжение.
- У газов взаимодействием частиц можно пренебречь.
Газообразное, жидкое и твердое состояние вещества
Притяжение и отталкивание частиц определяют их взаимное расположение в веществе. А от расположения частиц существенно зависят свойства веществ.
Так, глядя на прозрачный очень твердый алмаз (бриллиант) (рис. 58, а) и на мягкий черный графит (из него изготавливают стержни карандашей) (рис. 58, б), мы не догадываемся, что оба вещества состоят из совершенно одинаковых атомов углерода. Просто в графите эти атомы расположены иначе, чем в алмазе.

Заметим, что на рисунках показаны не сами атомы, а их модели — шарики. В действительности никаких соединительных стержней или проволочек между частицами нет. Это условное изображение расположения атомов в веществе.
Взаимодействие частиц вещества приводит к тому, что оно может находиться в трех состояниях: твердом, жидком и газообразном. Например, лед, вода, пар (см. рис. 48). В трех состояниях может находиться любое вещество, но для этого нужны определенные условия: необходимые давление, температура. Например, кислород в воздухе — газ, но при охлаждении до температуры ниже -193 °С он превращается в жидкость, а при температуре -219 °С кислород — твердое вещество. Железо при нормальном давлении и комнатной температуре находится в твердом состоянии. При температуре выше 1539 °С оно становится жидким, а при температуре выше 3050 °С — газообразным. Жидкая ртуть, используемая в медицинских термометрах, при охлаждении до температуры ниже -39 °С становится твердой. При температуре выше 357 °С ртуть превращается в пар (газ).
Какими свойствами обладают вещества в различных состояниях? Начнем с газов, в которых поведение молекул напоминает движение пчел в рое (рис. 59). Однако пчелы в рое самостоятельно изменяют направление движения и практически не сталкиваются друг с другом. А для молекул в газе такие столкновения не только неизбежны, но происходят практически непрерывно. В результате этих столкновений направления и значения скорости движения молекул изменяются.
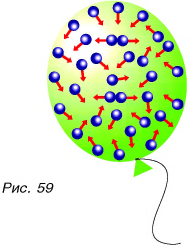
Результатом такого движения и отсутствия взаимодействия частиц при движении является то, что газ не сохраняет ни объема, ни формы, а занимает весь предоставленный ему объем. Каждый из вас посчитает сущей нелепицей утверждения вроде «Воздух занимает половину объема этой комнаты» или «Я накачал воздух в две трети объема мяча». Воздух, как и любой газ, занимает весь объем комнаты и весь объем мяча.
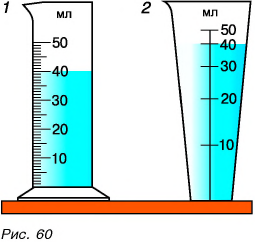
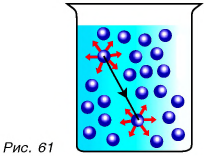
А какие свойства имеют жидкости? Для ответа на вопрос проведем опыт. Перельем воду из мензурки 1 в мензурку 2 (рис. 60). Форма жидкости изменилась, но объем остался тем же. Молекулы не разлетелись по всему объему, как это было бы в случае с газом. Значит, взаимное притяжение молекул жидкости существует, но оно жестко не удерживает соседние молекулы. Они колеблются и перескакивают из одного места в другое (рис. 61), чем и объясняется текучесть жидкостей.
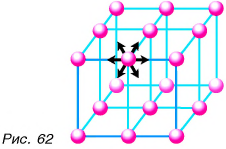
Наиболее сильным является взаимодействие частиц в твердом теле. Оно не дает возможности частицам разойтись. Частицы лишь совершают хаотические колебательные движения около определенных положений (рис. 62). Поэтому твердые тела сохраняют и объем, и форму. Сплошной резиновый мяч будет сохранять форму шара и объем, куда бы его ни поместили: в банку, на стол и т. д.
Главные выводы:
- Из-за хаотичности движения и отсутствия взаимодействия частиц при движении газы занимают весь предоставленный им объем.
- Сохранение объема жидкостями говорит о наличии сил притяжения между их частицами.
- Сохранение формы твердыми телами указывает на то, что притяжение их частиц сильнее, чем частиц жидкости.
Тепловое расширение
Из предыдущих параграфов вам известно, что все вещества состоят из частиц (атомов, молекул и др.). Эти частицы непрерывно хаотически движутся. При нагревании вещества движение его частиц становится более быстрым. Увеличиваются расстояния между частицами, что приводит к увеличению размеров тела.
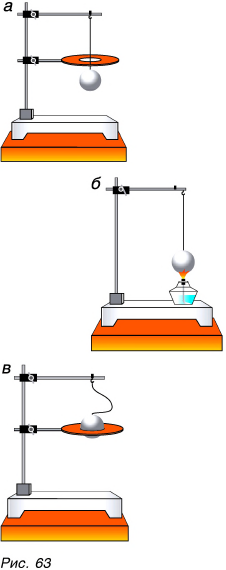
Изменение размеров тела при его нагревании называется тепловым расширением. Тепловое расширение твердых тел легко подтвердить опытом. Стальной шарик, свободно проходящий через кольцо (рис. 63, а)у после нагревания на спиртовке (рис. 63, б) расширяется и застревает в кольце (рис. 63, в). После охлаждения шарик вновь свободно проходит через кольцо. Из опыта следует, что размеры твердого тела при нагревании увеличиваются, а при охлаждении — уменьшаются.
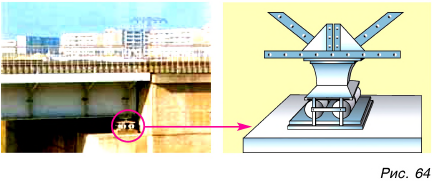
Тепловое расширение различных твердых тел неодинаково. При тепловом расширении твердых тел появляются огромные силы, которые могут разрушать мосты, изгибать железнодорожные рельсы, разрывать провода. Чтобы этого не случилось, при конструировании того или иного сооружения учитывается тепловое расширение. Несущие детали мостов ставят на катки, способные передвигаться при изменениях длины моста зимой и летом (рис. 64). Рельсы на стыках имеют зазор (рис. 65). Провода линий не натягивают сильно (рис. 66), чтобы зимой, сокращаясь, они не разорвались.


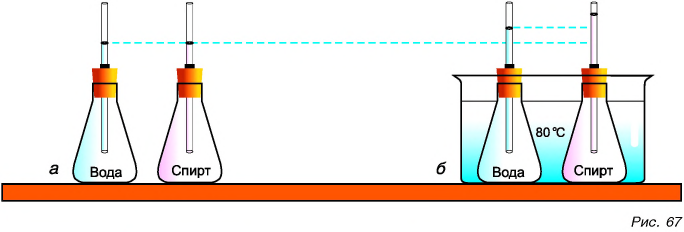
А расширяются ли при нагревании жидкости? Тепловое расширение жидкостей тоже можно подтвердить на опыте. В одинаковые колбы нальем: в одну — воду, а в другую — такой же объем спирта. Колбы закроем пробками с трубками. Начальные уровни воды и спирта в трубках отметим резиновыми кольцами (рис. 67, а). Поставим колбы в сосуд с горячей водой. Уровень воды в трубках станет выше (рис. 67, б). Жидкости при нагревании расширяются. Но уровень в трубке колбы со спиртом выше, чем в трубке колбы с водой. Значит, спирт расширяется больше. Следовательно, тепловое расширение разных жидкостей, как и твердых веществ, неодинаково.
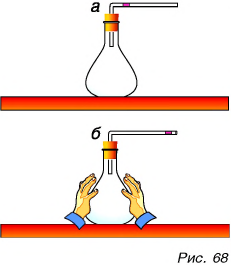
А испытывают ли тепловое расширение газы? Ответим на данный вопрос с помощью опыта. Закроем колбу с воздухом пробкой с изогнутой трубкой. В трубке (рис. 68, а) находится капля жидкости. Достаточно приблизить руки к колбе, как капля начинает перемешаться вправо (рис. 68, б). Это подтверждает тепловое расширение воздуха при его даже незначительном нагревании. Причем, что очень важно, все газы, в отличие от твердых веществ и жидкостей, при нагревании расширяются одинаково.
Для любознательных:
Нельзя после горячего чая сразу пить холодную воду или есть мороженое. Резкое изменение температуры приводит к появлению трещин на эмали зубов. Это объясняется тем, что основное вещество зуба — дентин — и покрывающая зуб эмаль при одном и том же изменении температуры расширяются неодинаково.
Главные выводы:
- Газы, жидкости и твердые тела при нагревании расширяются.
- Тепловое расширение у разных жидкостей и у разных твердых тел неодинаково.
- При увеличении температуры все газы расширяются одинаково.
Измерение температуры
Каждое утро, собираясь на работу или в школу, мы спрашиваем: «Какая на улице температура?», понимая под этим, насколько теплый или холодный наружный воздух.
Что такое температура? Как ее измерить? Достаточно ли для этого наших ощущений тепла и холода?
Температура определяет степень нагретости тела.
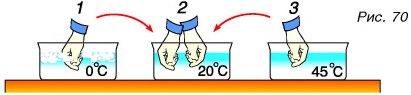
Проведем опыт. Нальем в три сосуда воду разной температуры (рис. 70). Опустим правую руку в сосуд 1 с холодной водой, а левую — в сосуд 3 с горячей водой. Через 2—3 мин обе руки опустим в сосуд 2. По ощущениям правой руки вода в сосуде 2 — теплая, а по ощущениям левой — холодная. Ото говорит о том, что наши ощущения субъективны. Для объективной оценки степени нагретости тела, т. е. его температуры (обозначается буквой t), служит измерительный прибор термометр.
Устройство и действие самого простого термометра было основано на тепловом расширении вещества. Термометр представлял собой стеклянный баллончик, соединенный с тонкой трубкой (капилляром). Баллончик заполнялся ртутью или подкрашенным спиртом. Для изготовления шкалы определялись положения уровней жидкости в трубке при опускании баллончика в тающий снег или лед (рис. 71, а) и кипящую воду (рис. 71, б).
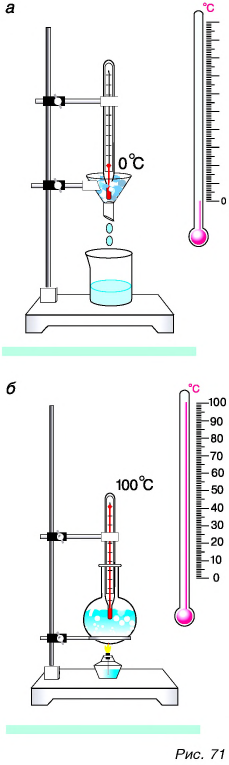
Положение уровня жидкости в трубке, когда баллончик был в тающем льде, принималось за нулевое, а температура тающего льда — за нуль градусов.
Второму положению уровня соответствовала температура кипящей воды, принятая за 100 градусов. Длина столбика между 0 и 100 градусами делилась на 100 равных частей (см. рис. 71, б). Одно деление означало один градус. Такая шкала впервые была предложена шведским ученым А. Цельсием в 1742 г. Поэтому она называется шкалой Цельсия, а единица шкалы — градусом Цельсия (°С).
Именно такая шкала у бытовых термометров (рис. 72, а, б). Особенности в строении имеет медицинский термометр (рис. 72, в). Так как им измеряют температуру тела человека, то цена деления его шкалы 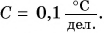 Таким образом, точность измерения медицинским термометром в 10 раз выше, чем точность измерения бытовым термометром, у которого цена деления
Таким образом, точность измерения медицинским термометром в 10 раз выше, чем точность измерения бытовым термометром, у которого цена деления 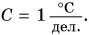
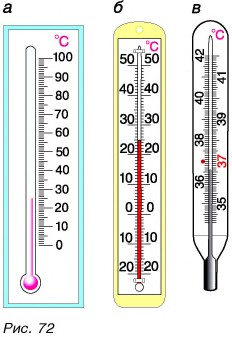
Шкала медицинского термометра имеет нижний и верхний пределы: 35 °С и 42 °С. Вы, очевидно, сами догадались, почему па шкале нет обозначений температуры ниже 35 °С и выше 42 °С. При таких температурах тела человек гибнет. Нормальной для здорового человека считается температура 36,6 °С.
Баллончик медицинского термометра заполняется ртутью. Вблизи баллончика трубка имеет сужение, что не позволяет ртути после того, как измерение закончено и термометр остыл, вернуться назад в баллончик. Этого можно достичь только с помощью резкого встряхивания термометра.
В последнее время все чаще используются цифровые термометры (рис. 73). Они более удобны и безопасны, чем ртутные.

Главные выводы:
- Температура определяет степень нагретости тела.
- Для объективной оценки температуры служит термометр.
- Термометр основан на тепловом расширении вещества.
- Бытовые термометры в нашей республике имеют шкалу Цельсия.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |