
Необратимость тепловых процессов - формулы и определение с примерами
Содержание:
Необратимость тепловых процессов:
В термодинамическом процессе система переходит из начального состояния в конечное через промежуточные состояния.
Что такое обратимый процесс
Обратимым процессом называется процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния.
Например, все чистые механические процессы, которые проходят без трения, считаются примерами обратимого процесса. В частности, колебания тяжелого маятника, подвешенного на длинном крючке, будут близки к обратимому процессу. В этом случае кинетическая энергия практически полностью превращается в потенциальную энергию, то же самое происходит и в обратном порядке. Из-за того, что сопротивление среды мало, амплитуда колебания угасает медленно и процесс колебания продолжается долго.
Любые процессы, которые подвержены сопротивлению или передают тепло от горячего тела к холодному, необратимы. На практике все реальные процессы являются необратимыми процессами.
Процесс, описанный в примере с маятником, тоже является необратимым, так как невозможно полностью избавиться от трения. Поэтому часть механической энергии практически всегда превращается в тепло и безвозвратно расходуется в окружающую среду, т.е. в окружающих предметах происходят изменения, поэтому процесс называется необратимым.
Процесс передачи тепла от теплого тела к холодному тоже является примером необратимого процесса.
В целом в природе не существует обратимых процессов. Реальные процессы все считаются необратимыми. Обратимые процессы – это идеализированное понятие.
Внутренняя энергия
Вам известно, что термодинамическая система состоит из множества молекул и атомов. Система обладает внутренней энергией из-за того, что молекулы всегда находятся в движении, т.е. система обладает кинетической энергией. Вместе с этим, из-за существования силы взаимодействия между молекулами вещества, у молекул имеется потенциальная энергия взаимного действия.
Сумма кинетической энергии беспорядочного движения всех молекул и потенциальной энергии их взаимодействий называется внутренней энергией термодинамической системы.
Не нужно путать внутреннюю энергию тела с механической энергией. Если механическая энергия тела зависит от движения и расположения тела относительно других тел, то внутренняя энергия тела зависит от движения и расположения относительно друг друга частиц, составляющих это тело.
Внутренняя энергия является однозначной функцией термодинамической системы, т.е. каждому состоянию системы соответствует определенное значение внутренней энергии, которое абсолютно не зависит от того, каким образом система пришла в это состояние. Если газ нагреть, скорости молекул и атомов возрастут. Это приведет к росту внутренней энергии. Если изменится давление или удельный объем, то это тоже приведет к изменению внутренней энергии, так как изменится расстояние между молекулами. Значит, потенциальная энергия их взаимодействия тоже изменится.
Обычно внутренняя энергия системы при 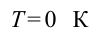
Первый закон термодинамики. Рассмотрим пример нагревающегося чайника. Количество тепла 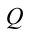 , получаемое чайником, расходуется на согревание воды, т.е. на рост внутренней энергии воды
, получаемое чайником, расходуется на согревание воды, т.е. на рост внутренней энергии воды 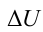 и выполняемую работу
и выполняемую работу 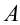 , совершенную против внешних сил (сила тяжести крышки) при подъеме крышки чайника парами воды. Закон сохранения и превращения энергии для этого процесса имеет вид:
, совершенную против внешних сил (сила тяжести крышки) при подъеме крышки чайника парами воды. Закон сохранения и превращения энергии для этого процесса имеет вид:

Это математическое выражение первого закона термодинамики.
Количество тепла, переданное термодинамической системе, равно сумме роста ее внутренней энергии и выполненной работе против внешних сил.
Если в систему передается количество тепла, 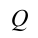 будет иметь положительный знак, если количество тепла расходуется из системы,
будет иметь положительный знак, если количество тепла расходуется из системы, 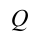 будет иметь отрицательный знак. То же самое для работы, если система совершает работу против внешних сил, работа
будет иметь отрицательный знак. То же самое для работы, если система совершает работу против внешних сил, работа 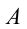 – положительная, если внешние силы совершают работу над системой, то работа
– положительная, если внешние силы совершают работу над системой, то работа 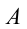 будет отрицательной.
будет отрицательной.
Первый закон термодинамики показывает, что создать вечный двигатель первого рода (на латыни «perpetuum mobile») невозможно. Согласно определению, «perpetuum mobile» первого рода – это непрерывно действующая машина, которая, будучи запущенной один раз, совершает работу без получения энергии извне. В первом же законе термодинамики, который является законом сохранения и превращения энергии, записано, что во всех процессах, встречающихся в природе, энергия сама по себе ниоткуда не появляется и никуда не исчезает, она может только превращаться из одного вида в другой.
Первый закон термодинамики
Первый закон термодинамики можно записать следующим образом:
Изменение внутренней энергии при переходе системы из одного состояния в другое равно сумме работы внешних сил (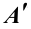 ) и количества тепла, переданного системе:
) и количества тепла, переданного системе:

Хотя первый закон термодинамики описывает закон сохранения и превращения энергии, он не может показать направление прохождения термодинамических процессов. Например, первый закон может показать возможность перехода тепла от горячего тела к холодному, а также возможность перехода от холодного тела к горячему. При этом возникает вопрос: «Какие процессы в природе могут совершаться сами по себе?». На это может ответить второй закон термодинамики.
Второй закон термодинамики
Имеется несколько видов описаний этого закона, самый простой из них – описание Клаузиуса.
Тепло не переходит от тела с низкой температурой к телу с высокой температурой.
На практике тепло воды бесконечного океана может переходить само по себе к телу с более низкой относительно воды температурой. Для того чтобы передать тепло от тела с низкой температурой к телу с высокой температурой, нужно выполнить дополнительную работу. Но количество тепла не полностью расходуется на работу, часть его уходит на нагревание окружающих предметов. С этой точки зрения второй закон термодинамики в интерпретации Планка звучит следующим образом: в природе не существует процессов, в которых количество тепла полностью превращается в работу.
Для того чтобы тепло превратилось в работу, нужны нагреватель и охладитель.
В любых тепловых машинах только определенная часть передаваемой от нагревателя в охладитель энергии превращается в полезную работу. Возникает вопрос: «От каких величин зависит КПД тепловых машин и что нужно сделать, чтобы его увеличить?» На этот вопрос может ответить второй закон термодинамики в интерпретации Карно: Коэффициент полезного действия идеальной тепловой машины определяется только разницей температур, передающих тепло и принимающих тепло.
Законы термодинамики дают представление о том, какие тепловые машины возможно создать и на что нужно обратить внимание, чтобы увеличить их КПД.
Второй вид «perpetuum mobile». Второй вид «perpetuum mobile » основан на идее возможности использования энергии в большом количестве в водах океана без выполнения работы. А второй закон термодинамики утверждает, что без помощи может переходить тепло от горячего тела к холодному, для обратного процесса необходимо выполнить дополнительную работу. Из этого следует, что «perpetuum mobile» второго вида создать невозможно.
Если бы получилось создать «perpetuum mobile» второго рода, человечество обладало бы безграничным источником энергии. Если бы удалось понизить на 10 С температуру воды океана массой 1021 кг, то при этом выделилась бы тепловая энергия в количестве 1024 Дж. Если уголь, дающий такую же энергию, погрузить в железнодорожный состав, то длина состава будет равна 1010 км. Это расстояние почти равно диаметру солнечной системы.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |