
Азот в химии - классификация, получение, свойства, формулы и определения с примерами
Содержание:
Азот — химический элемент и простое вещество:
Неметалл азот N в периодической системе химических элементов открывает VA-группу, в которой также расположены неметаллы фосфор Р и мышьяк As и металлы сурьма Sb и висмут Bi.
Свойства атомов элементов VA-группы, а также свойства их простых веществ закономерно изменяются с ростом их атомного номера: неметаллические свойства ослабевают, а металлические — усиливаются.
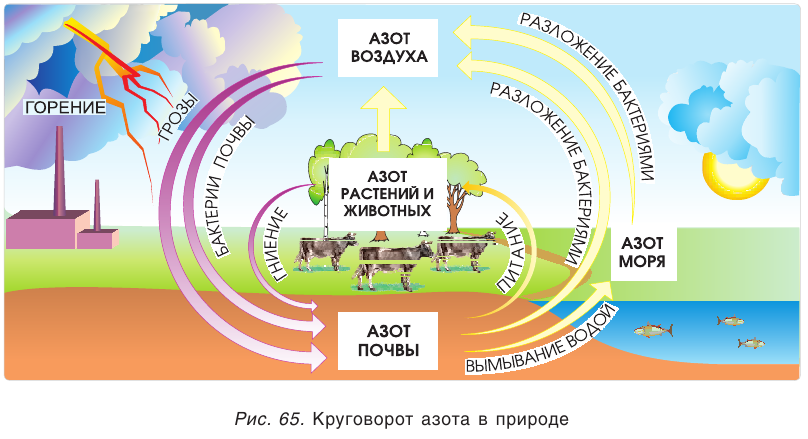
Азот в природе
В природе химический элемент азот находится в виде простого вещества 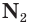
Строение атомов
В атоме азота 7 электронов, из них 5 располагаются на внешнем электронном слое: 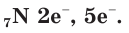 Следовательно, атому азота не хватает трех электронов до завершения внешнего электронного слоя. Поэтому в своих соединениях с металлами и водородом азот обычно проявляет степень окисления, равную –3, как, например, в аммиаке
Следовательно, атому азота не хватает трех электронов до завершения внешнего электронного слоя. Поэтому в своих соединениях с металлами и водородом азот обычно проявляет степень окисления, равную –3, как, например, в аммиаке 
В соединениях с кислородом атом азота проявляет максимальную положительную степень окисления, равную +5, как, например, в азотной кислоте 
Строение и физические свойства простого вещества
Простое вещество азот состоит из двухатомных молекул 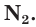 Атомы азота в молекуле связаны между собой тремя общими электронными парами:
Атомы азота в молекуле связаны между собой тремя общими электронными парами:

При обычных условиях азот — бесцветный газ, без вкуса и запаха, не поддерживает дыхания и горения, не ядовит. Молекулы азота неполярны, поэтому азот мало растворим в воде. Животные в атмосфере чистого азота погибают из-за того, что лишаются необходимого для дыхания кислорода. С этим связано название азота, происходящее от греческого а — отрицательная приставка, зое — жизнь, т. е. непригодный для жизни.
При повышении давления растворимость азота в тканях организма человека увеличивается. Это приводит к состоянию «азотного наркоза»: водолаз перестает уверенно управлять своими движениями. Поэтому при погружении на большие глубины вместо сжатого воздуха пользуются искусственной дыхательной смесью, в которой азот заменен гелием.
Химические свойства азота
Простое вещество азот 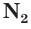 химически малоактивно и, как правило, вступает в химические реакции только при высоких температурах.
химически малоактивно и, как правило, вступает в химические реакции только при высоких температурах.
Окислительные свойства азота проявляются в реакциях с водородом и активными металлами. Так, при высокой температуре (t) и большом давлении (p) азот соединяется с водородом в присутствии катализатора, образуя аммиак:
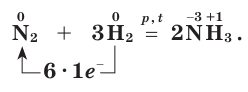
При обычных условиях азот реагирует только с литием, образуя нитрид лития:
6Li + 3N2 = 2Li3N.
С другими металлами азот взаимодействует при высоких температурах.
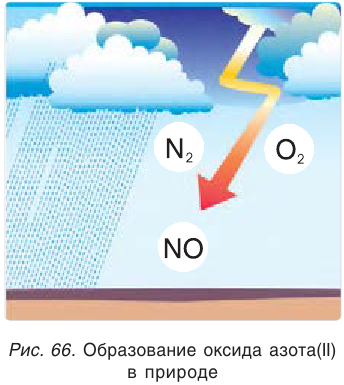
Восстановительные свойства азота проявляются при его взаимодействии с кислородом. Азот реагирует с кислородом при температуре около 3000 °С, образуя оксид азота(II):
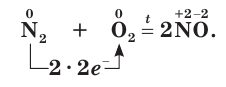
Эта реакция может также протекать при пропускании электрического разряда через смесь газов, например при разряде молнии во время грозы (рис. 66).
Применение азота
Применение азота обусловлено присущими ему свойствами инертного газа. Он используется для продувки и очистки систем трубопроводов и пожаротушения. В атмосфере азота замедляются процессы окисления и гниения, что позволяет увеличить сроки хранения лекарственных препаратов и пищевой продукции — мясных изделий, орехов, чипсов, масла, кофе, пива и др. Поэтому азот используется при их упаковке, а также для создания определенной атмосферы в овощехранилищах.
Жидкий азот, температура которого равна –196 °С, применяется для глубокого охлаждения и вымораживания, в косметологии.
В химической промышленности азот применяется при производстве минеральных удобрений и для синтеза аммиака.
- Простое вещество азот состоит из двухатомных молекул
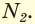
- Азот при комнатной температуре химически малоактивное вещество.
- Азот проявляет восстановительные свойства в реакции с кислородом и окислительные — в реакциях с активными металлами.
Аммиак
Одним из важнейших соединений азота является аммиак  в котором степень окисления азота равна –3. Графическая формула его молекулы представлена на рисунке 67.
в котором степень окисления азота равна –3. Графическая формула его молекулы представлена на рисунке 67.
Молекула аммиака имеет форму пирамиды (рис. 68).
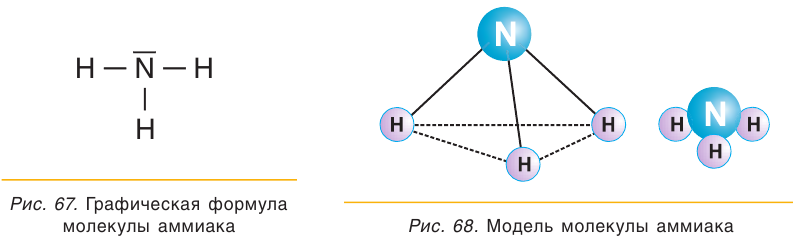
Химические связи между атомом азота и атомами водорода в молекуле  являются ковалентными полярными, общие электронные пары сильно смещены к атому азота. Молекула аммиака полярна и является диполем.
являются ковалентными полярными, общие электронные пары сильно смещены к атому азота. Молекула аммиака полярна и является диполем.
 Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона, расположенному в Северной Африке, на перекрестке караванных путей. Мочевина (NH2)2CO, содержащаяся в моче животных, в жарком климате разлагается особенно быстро. Одним из продуктов разложения и является аммиак.
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона, расположенному в Северной Африке, на перекрестке караванных путей. Мочевина (NH2)2CO, содержащаяся в моче животных, в жарком климате разлагается особенно быстро. Одним из продуктов разложения и является аммиак.
Физические свойства аммиака
Аммиак — бесцветный газ, с резким характерным запахом, ядовит. Он хорошо растворим в воде. В одном объеме воды при комнатной температуре растворяется около 700 объемов аммиака.
Водный раствор с массовой долей аммиака, равной 3 %, в быту называется нашатырным спиртом, под таким же названием он продается в аптеке. В технике водный раствор с массовой долей аммиака, равной 25 %, называют аммиачной водой.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния, не причиняя вреда.
При увеличении давления или охлаждении аммиак легко сжижается. Жидкий аммиак при испарении поглощает много теплоты, поэтому его применяют в холодильных установках, а также для получения искусственного льда в спортивных сооружениях.
Химические свойства аммиака
Для аммиака характерны реакции окисления и соединения.
Степень окисления атома азота в аммиаке равна –3, поэтому аммиак проявляет восстановительные свойства, окисляясь кислородом и другими окислителями. Реакция горения аммиака в кислороде описывается уравнением:
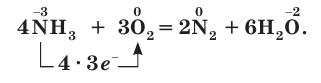
В присутствии катализатора (платины) аммиак реагирует с кислородом с образованием оксида азота(II) NO:
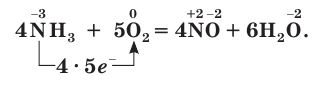
Эта реакция лежит в основе промышленного способа получения азотной кислоты. Подробнее этот процесс вы изучите в 11-м классе.
Запомните!
Смеси аммиака с кислородом или воздухом могут взрываться при нагревании, поэтому они опасны

С водой и кислотами аммиак вступает в реакции соединения. Колбу, заполненную аммиаком и закрытую пробкой со вставленной в нее трубочкой, опустим в воду, к которой добавлено несколько капель фенолфталеина (рис. 69). Внутри колбы начнет бить малиновый «фонтан».
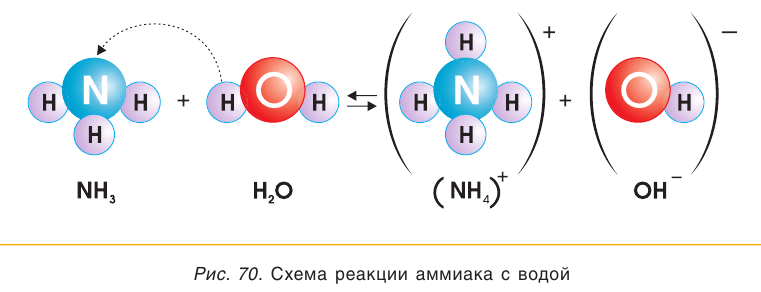
При растворении аммиака в воде происходит химическая реакция с образованием гидрата аммиака 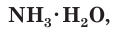 который частично диссоциирует на катионы аммония
который частично диссоциирует на катионы аммония  и гидроксидионы
и гидроксидионы  (рис. 70):
(рис. 70):
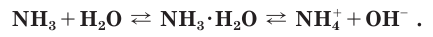
Раствор аммиака в воде (аммиачная вода) за счет присутствия в нем гидроксид-ионов обладает свойствами слабого основания, поэтому в опыте, иллюстрирующем растворимость аммиака в воде, «фонтан» окрашивается в малиновый цвет. Если вместо фенолфталеина в воду добавить лакмус, то раствор окрасится в синий цвет.
Поскольку реакция взаимодействия аммиака с водой обратима, в растворе помимо катионов аммония  и гидроксид-ионов
и гидроксид-ионов  содержатся нейтральные молекулы аммиака и воды. Аммиачная вода пахнет аммиаком, который улетучивается из открытого сосуда или при нагревании.
содержатся нейтральные молекулы аммиака и воды. Аммиачная вода пахнет аммиаком, который улетучивается из открытого сосуда или при нагревании.
При взаимодействии аммиака с кислотами образуются соли аммония, например хлорид аммония  сульфат аммония
сульфат аммония 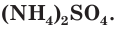 Смочим одну стеклянную палочку концентрированным раствором аммиака, а другую — концентрированной соляной кислотой и поднесем их друг к другу (рис. 71). Появится белый дым, состоящий из мелких кристалликов образующейся соли хлорида аммония:
Смочим одну стеклянную палочку концентрированным раствором аммиака, а другую — концентрированной соляной кислотой и поднесем их друг к другу (рис. 71). Появится белый дым, состоящий из мелких кристалликов образующейся соли хлорида аммония:
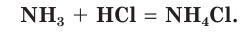
Аммиак способен реагировать и с другими кислотами. Эти реакции протекают без изменения степени окисления атомов азота.
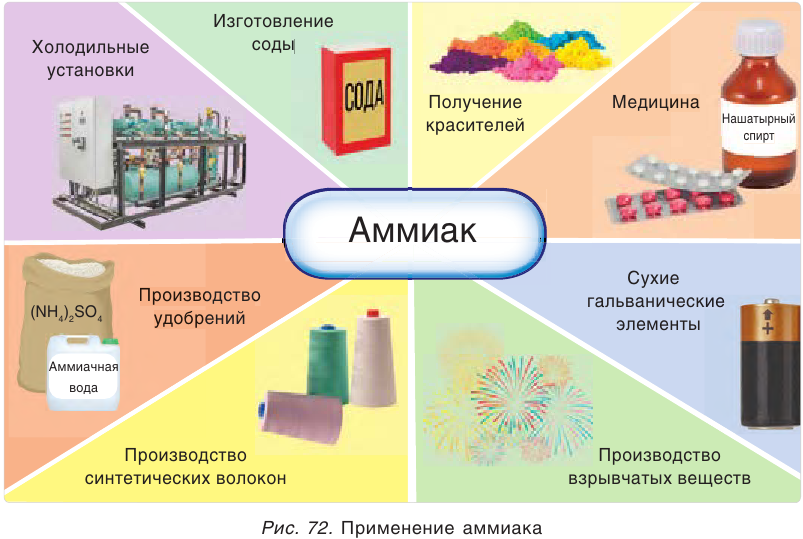
Применение аммиака
По объемам производства в мире аммиак занимает одно из первых мест — ежегодно получают около 100 млн т этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора — аммиачной воды.
Огромные количества аммиака используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов.
Из аммиака получают различные соли аммония и мочевину (карбамид).
Аммиак используется также для получения синтетических волокон, лекарственных препаратов, взрывчатых веществ, красителей (рис. 72).
- Аммиак — бесцветный газ, с резким характерным запахом, хорошо растворим в воде.
- Аммиак окисляется кислородом, проявляя при этом восстановительные свойства.
- Аммиак вступает в реакции соединения с водой и кислотами.
Азотная кислота
Азотная кислота  была открыта алхимиками в раннее Средневековье. В XVII в. нeмeцкий xимик Иoгaнн Pyдoльф Глayбep получил кoнцeнтpиpoвaнную aзoтную киcлoту при взaимoдeйcтвии cepнoй киcлoты с нитратом калия (кaлиeвoй ceлитpой). Метод Глаубера применялся до начала XX в. В настоящее время в промышленности азотную кислоту в больших масштабах получают, используя в качестве исходного вещества аммиак.
была открыта алхимиками в раннее Средневековье. В XVII в. нeмeцкий xимик Иoгaнн Pyдoльф Глayбep получил кoнцeнтpиpoвaнную aзoтную киcлoту при взaимoдeйcтвии cepнoй киcлoты с нитратом калия (кaлиeвoй ceлитpой). Метод Глаубера применялся до начала XX в. В настоящее время в промышленности азотную кислоту в больших масштабах получают, используя в качестве исходного вещества аммиак.


Модель молекулы азотной кислоты представлена на рисунке 73.
Физические свойства азотной кислоты
Азотная кислота  — бесцветная жидкость с резким удушливым запахом, хорошо растворяется в воде, смешивается с ней в любых соотношениях. Пары азотной кислоты токсичны, поэтому обращаться с ней надо с осторожностью.
— бесцветная жидкость с резким удушливым запахом, хорошо растворяется в воде, смешивается с ней в любых соотношениях. Пары азотной кислоты токсичны, поэтому обращаться с ней надо с осторожностью.
Азотная кислота — сильный электролит, в водном растворе практически полностью диссоциирует на ионы:
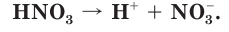
Присутствие в разбавленном водном растворе  ионов водорода можно обнаружить по изменению окраски индикатора: лакмус окрашивается в красный цвет (рис. 74).
ионов водорода можно обнаружить по изменению окраски индикатора: лакмус окрашивается в красный цвет (рис. 74).
Химические свойства азотной кислоты
Подобно другим кислотам, азотная кислота вступает в реакции с осно Ђвными оксидами и основаниями. При этом образуются соли азотной кислоты — нитраты:
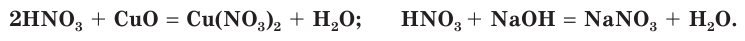
Азотная кислота как сильная кислота взаимодействует с солями более слабых кислот. На рисунке 75 показано растворение раковины моллюска, состоящей в основном из карбоната кальция, под действием азотной кислоты с выделением углекислого газа:
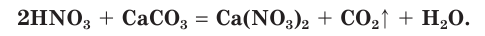
Азотная кислота проявляет окислительные свойства по отношению к металлам, но в отличие от других кислот реагирует с большинством металлов, кроме благородных.




При этом водород обычно не выделяется.
Продуктами взаимодействия азотной кислоты с металлами являются нитраты металлов и соединения азота со степенью окисления атомов меньшей, чем в азотной кислоте. Например, если поместить в колбу обрезки медной проволоки и осторожно (в вытяжном шкафу!) прилить к ним концентрированную азотную кислоту, то сразу начнет выделяться «бурый газ» — оксид азота(IV) (рис. 76):
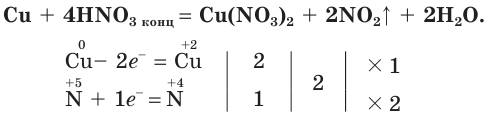
Один объем азотной и три объема соляной кислоты образуют смесь, называемую царской водкой. Она способна растворять даже «царя металлов» — золото.
Азотная кислота способна окислять и другие вещества, как неорганические, так и органические. Поэтому с азотной кислотой надо обращаться крайне осторожно: не проливать, не допускать попадания на кожу (азотная кислота реагирует с белками, вследствие чего на коже образуются желтые пятна), на одежду (разрушаются шерсть и натуральный шелк).
- Азотная кислота — бесцветная жидкость, с резким удушливым запахом, хорошо растворима в воде.
- Азотная кислота вступает в реакции с основными оксидами, основаниями и солями.
- Азотная кислота проявляет окислительные свойства при взаимодействии с металлами.
Применение азотной кислоты и нитратов
Азотная кислота — одноосновная кислота, образующая соли нитраты.
Нитраты:
Из предыдущего параграфа вы уже знаете, что нитраты образуются при взаимодействии азотной кислоты с различными химическими веществами: металлами, оксидами и гидроксидами металлов, солями слабых кислот.
При обычных условиях нитраты — твердые кристаллические вещества. Все они хорошо растворимы в воде.
Нитраты являются сильными электролитами. При диссоциации этих солей в качестве катионов образуются ионы металлов (или аммония), а в качестве анионов — нитрат-ионы:

Нитраты щелочных, щёлочноземельных металлов и аммония называют селитрами. Например,  — калийная селитра,
— калийная селитра,  — аммиачная селитра,
— аммиачная селитра, 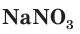 — натриевая селитра,
— натриевая селитра,  — кальциевая селитра. Это связано с тем, что селитры используются в качестве удобрений.
— кальциевая селитра. Это связано с тем, что селитры используются в качестве удобрений.
В больших количествах нитраты ядовиты.
Нитраты участвуют во всех обменных реакциях, характерных для солей. Они взаимодействуют с металлами, при этом более активный металл вытесняет менее активные из растворов их солей:
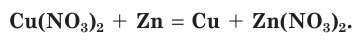
Реакции с кислотами, щелочами и солями протекают, если в результате образуются нерастворимые соединения, а нитрат-ионы остаются в растворе, например:
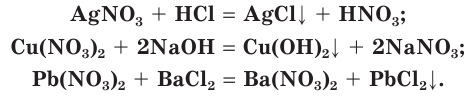
Все нитраты термически неустойчивы. При нагревании они разлагаются с образованием кислорода. Подробнее с этими реакциями вы познакомитесь в курсе химии 11-го класса.
В твердом виде все нитраты — сильные окислители, входящие в состав пиротехнических смесей. Самая известная — черный порох — представляет собой смесь калийной селитры, углерода и серы:
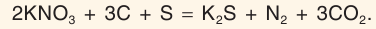
Черный порох появился в Китае в cepeдине XI в. и пpимeнялся для «oгнeнных кoпий» и фейерверков. В Европу попал лишь в XIII в. В 1650 г. белорус Казимир Семенович издал трактат «Великое искусство артиллерии, часть первая», в котором целый раздел посвятил изготовлению черного пороха (см. рис.).

Книга была переведена на многие европейские языки, и чуть ли не два столетия оставалась самой популярной научной работой по артиллерии. В свое время по книге Казимира Семеновича учились Ньютон, российский император Петр I и французский император Наполеон I. Основоположник российской космонавтики К. Э. Циолковский ссылался в некоторых своих работах на труды Казимира Семеновича.
Применение азотной кислоты и нитратов:
Азотная кислота широко используется для получения минеральных удобрений, лекарственных препаратов, взрывчатых веществ и ракетного топлива, полимерных материалов, красителей и т. п.
Очень широка и область применения нитратов. Они используются в качестве удобрений, как окислители — в пиротехнических смесях, для производства стекла.
Нитрат серебра(I)  (ляпис) применяют как противомикробное и противовоспалительное средство.
(ляпис) применяют как противомикробное и противовоспалительное средство.
Нитраты используются для обработки и консервирования пищевых продуктов. Так нитрат натрия NaNO3 в строго определенном количестве добавляют в мясо при изготовлении колбас. Он восстанавливается микроорганизмами до нитрита натрия NaNO2, который препятствует окислению мяса и способствует сохранению розового цвета мясных изделий. Присутствие нитритов в колбасе необходимо еще и по другой причине: они предотвращают развитие микроорганизмов, выделяющих ядовитые вещества.
- Соли азотной кислоты называются нитратами.
- Нитраты — твердые кристаллические вещества, хорошо растворимые в воде.
- Нитраты участвуют во всех обменных реакциях, характерных для солей.
- Азотная кислота и нитраты находят широкое практическое применение.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |