
Кремний в химии - классификация, получение, свойства, формулы и определения с примерами
Содержание:
Кремний — химический элемент и простое вещество
В периодической системе химических элементов кремний Si расположен в третьем периоде в IVА-группе. Чем же он отличается от углерода? Познакомимся со свойствами этого химического элемента и образуемого им простого вещества подробнее.
Кремний в природе
Кремний после кислорода — самый распространенный элемент в земной коре (массовая доля 27,6 %). Земная кора в основном состоит из соединений кремния с кислородом, в состав которых включаются и другие элементы. В природе кремний встречается преимущественно в виде оксида кремния(IV) 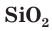

Кремний один из самых распространенных элементов во всей Вселенной. Основной компонент марсианской почвы — кремнезем SiO3, а в лунном грунте на долю этого вещества приходится 41 %. Силикаты металлов обнаружены на Венере и других планетах.
Кремний является важным элементом для нормального существования всех живых организмов. Повышенным содержанием кремния характеризуются морские организмы — диатомовые водоросли, радиолярии, губки (рис. 108). Большое количество кремния накапливают хвощи и злаки, в том числе рис.
Строение атома
В атоме кремния 14 электронов, которые располагаются на трех электронных слоях:
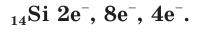
Так же как и у атомов углерода, у атомов кремния на внешнем электронном слое находится по 4 электрона и до его завершения не хватает тоже 4 электрона. Поэтому в своих соединениях кремний проявляет отрицательную степень окисления, равную –4, например в силициде магния 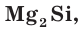 и положительную степень окисления +4, например в оксиде
и положительную степень окисления +4, например в оксиде 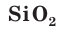 .
.
Строение и физические свойства простого вещества
Кристаллическая решетка кремния аналогична кристаллической решетке алмаза (см. рис. 90). В кристалле кремния каждый его атом соединен с другими атомами четырьмя прочными ковалентными связями. В настоящее время получают кремний 99,9999999 %-й чистоты. Это означает, что среди миллиарда атомов кремния может быть лишь один атом другого элемента.
В отличие от алмаза кремний обладает способностью при определенных условиях проводить электрический ток. Электропроводность кремния возрастает при нагревании или освещении. Именно поэтому он используется в полупроводниковой технике, в том числе для преобразования энергии солнечного излучения в электрическую энергию в солнечных батареях.
Химические свойства кремния
Так же как и углерод, кремний реагирует с другими веществами, как правило, при нагревании.
Взаимодействуя с атомами менее электроотрицательных элементов (металлов), атомы кремния принимают электроны (восстанавливаются), приобретая при этом отрицательные степени окисления:
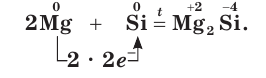
При этом простое вещество кремний проявляет окислительные свойства.
Взаимодействуя с атомами более электроотрицательных элементов, атомы кремния могут отдавать электроны (окисляться), приобретая положительные степени окисления:
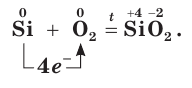
При этом простое вещество кремний проявляет восстановительные свойства.
При очень высоких температурах кремний взаимодействует с углеродом, образуя карбид кремния (карборунд):
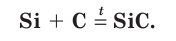
В этой реакции кремний выступает в качестве восстановителя, а углерод — в качестве окислителя. В качестве восстановителя кремний применяют также при промышленном получении металлов из руд.
Структура простого вещества кремния аналогична структуре алмаза.
При взаимодействии с другими веществами кремний может проявлять как восстановительные, так и окислительные свойства.
Оксид кремния(IV). Кремниевая кислота и ее соли
Среди кислородсодержащих соединений кремния наибольшее значение имеют оксид кремния(IV), кремниевая кислота и ее соли — силикаты.
Оксид кремния(IV)
Оксид кремния(IV) представляет собой твердое тугоплавкое вещество (температура плавления 1713 °С), нерастворимое в воде. Высокая температура плавления этого вещества свидетельствует о том, что оно имеет немолекулярное строение.
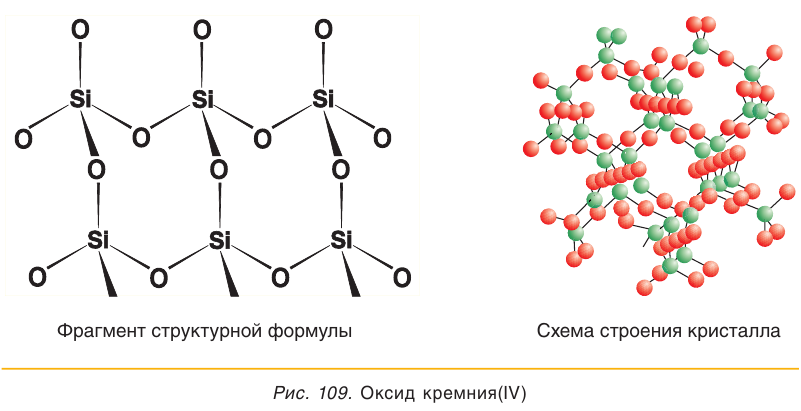
В кристаллах оксида кремния(IV) атомы кремния и кислорода связаны между собой ковалентными связями (рис. 109). Для описания состава таких веществ, как вы помните, пользуются формульными единицами. Состав формульной единицы 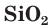 показывает, что в оксиде кремния(IV) на каждый атом кремния приходится по два атома кислорода.
показывает, что в оксиде кремния(IV) на каждый атом кремния приходится по два атома кислорода.
В природе оксид кремния(IV) образует речной песок, горный хрусталь и распространенный на территории Беларуси кремень. Часто в природе минералы на основе SiO3 содержат примеси оксидов железа, алюминия, хрома и других элементов, придающих им определенную окраску. Они используются в качестве поделочных и драгоценных камней (например, цитрин, аметист, яшма, агат и др.).

Оксид кремния(IV) — химически неактивное вещество. Он не растворяется в воде и не взаимодействует с ней. Но как кислотный оксид SiO2 реагирует с основными оксидами, щелочами и некоторыми солями, например карбонатами, при нагревании или сплавлении с образованием солей слабой кремниевой кислоты — силикатов:
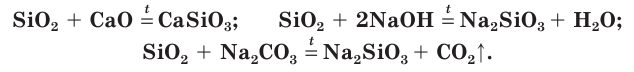
Чистый кристаллический оксид кремния(IV) прозрачен, бесцветен, как вода, и в связи с этим применяется для изготовления оптических приборов. Из расплавленного SiO2 получают так называемое кварцевое стекло. Оно выдерживает нагревание до 1000—1200 °С и устойчиво к резкому перепаду температур. У кварцевого стекла есть еще одно важное достоинство: оно пропускает ультрафиолетовые лучи, что позволяет использовать его в производстве медицинской, научно-исследовательской и промышленной аппаратуры.
Кремниевая кислота
Кремниевую кислоту получают, действуя более сильными кислотами на растворы ее солей. Она образует студенистый осадок, содержащий воду (рис. 110). Кремниевая кислота имеет сложный состав, который условно можно выразить простейшей формулой 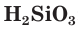 :
:
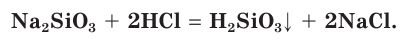
Кремниевая кислота мало растворяется в воде. Она является непрочным соединением — при нагревании или длительном хранении постепенно разлагается на воду и оксид кремния(IV):
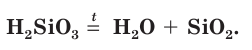
Кремниевая кислота очень слабая.

При обезвоживании осадка кремниевой кислоты образуется пористый аморфный оксид кремния(IV) — силикагель. Он имеет развитую поверхность, поэтому отлично поглощает влагу. В химических лабораториях силикагель используют для осушения газов.
Соли кремниевой кислоты

Из солей кремниевой кислоты растворимы только силикаты щелочных металлов. Силикаты калия и натрия называют растворимыми стеклами, а их концентрированные водные растворы — жидким стеклом. Раньше жидкое стекло широко использовалось в качестве силикатного клея. Концентрированный раствор силиката натрия применяется для пропитки деревянных изделий и тканей для придания им огнеупорных свойств. Приготовим две одинаковые полоски бумаги. Одну из них покроем тонким слоем жидкого стекла и высушим на воздухе. Затем одновременно внесем полоски в пламя спиртовки (рис. 111). Что при этом наблюдается?
Если в разбавленный раствор силиката натрия поместить несколько кристаллов окрашенных солей, то через некоторое время в растворе появятся длинные цветные нити в виде веточек. Получается силикатный «сад» (рис. 112). С особенностями протекания этого процесса вы можете познакомиться, если прочитаете дополнительную литературу.
Природные кремнеземы, силикаты и глина являются сырьем для силикатной промышленности.


В составе силикатов часто встречается третий по распространенности в земной коре после кислорода и кремния элемент алюминий. В этом случае они называются алюмосиликатами. Их состав часто записывают в виде соединения оксидов. Например, состав калиевого полевого шпата выражается формулой 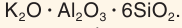 Состав каолинита — главной составной части глин — отвечает формуле
Состав каолинита — главной составной части глин — отвечает формуле  а состав гранита можно описать формулой
а состав гранита можно описать формулой 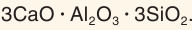
- Оксид кремния(IV) SiO2 является кислотным оксидом. При нагревании или сплавлении SiO2 реагирует с основными оксидами, щелочами и некоторыми солями.
- Кремниевую кислоту H2SiO3 можно получить, действуя более сильными кислотами на растворы ее солей.
- Соли кремниевой кислоты называются силикатами.
- Концентрированные водные растворы силикатов калия и натрия называют жидким стеклом.
Строительные материалы на основе природных оксидов и солей
С древних времен человек старался использовать окружавшие его воду, растительный и животный мир, почву, камни. Именно из камня он сделал первые орудия труда и охоты. На заре возникновения цивилизации появились нехитрые каменные сооружения. Камни надо было скреплять между собой, чтобы сооружение не разваливалось. В связи с этим в обиходе появились вяжущие вещества. Человек научился пользоваться глиной, делать из нее различные изделия. Еще позже возникло производство кирпича и стекла. Так зарождалось строительное ремесло.
Современная строительная индустрия использует неорганические соединения в самом разнообразном виде: материалы из силикатных расплавов (стекло), керамические изделия, вяжущие вещества. Основным источником сырья для производства строительных материалов являются природные соединения: песок, известняк, силикаты, алюмосиликаты, глина.
Керамические материалы
Слово «керамика» происходит от греческого слова керамос — глина, глиняная посуда. Основным сырьем для производства керамики служит глина, которая способна образовывать с водой пластичную массу. Влажной глине можно придать любую форму. При высокой температуре она необратимо твердеет, что и используется в производстве керамических изделий. После обжига керамические изделия получаются пористыми и водопроницаемыми. Поэтому керамику часто покрывают глазурью — легкоплавкими смесями, которые после специальной термической обработки образуют на поверхности изделий стекловидную массу (рис. 113).


Керамика представляет собой один из древнейших искусственных материалов. Керамические изделия были известны человеку с эпохи неолита. Первыми керамическими материалами были кирпич, плитка, посуда и самые разнообразные емкости (см. рис.).

К керамическим изделиям относятся строительный кирпич, черепица, огнеупорные и облицовочные материалы, сантехническое оборудование (ванны, раковины и др.).
Вяжущие строительные материалы
Вяжущие строительные материалы представляют собой вещества или смеси веществ, способные при смешивании с водой образовывать вязкую массу, которая постепенно затвердевает.
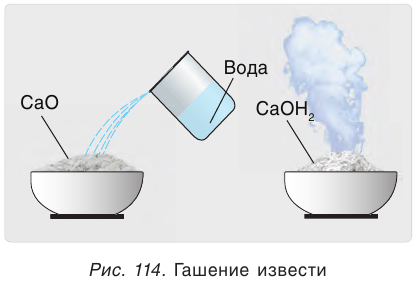
Одним из древнейших строительных материалов является известь. Различают негашеную известь CaO и гашеную известь  Негашеную известь получают при разложении карбоната кальция:
Негашеную известь получают при разложении карбоната кальция:
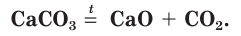
Оксид кальция CaO (негашеную известь) переводят в гидроксид («гасят» водой) и получают гашеную известь 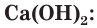
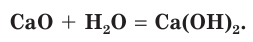
Эта реакция протекает с выделением большого количества теплоты, что приводит к сильному разогреванию смеси (рис. 114). В результате образуется облако водяного пара, как при гашении костра водой. Поэтому данная реакция и называется «гашение извести». Гашеную известь в смеси с песком используют в качестве вяжущего строительного материала.
Другим примером вяжущих строительных материалов является цемент. Если его смешать с водой, то образуется тестообразная масса, которая через некоторое время затвердевает. Это свойство цемента и используется в строительном деле для скрепления, например, кирпичей при сооружении стен. В Беларуси его производят на нескольких предприятиях, крупнейшими из которых являются ОАО «Красносельскстройматериалы» и ОАО «Кричевцементошифер».
Из смеси цемента, песка и воды с добавлением мелкого щебня или гравия получают бетон. Если в бетон ввести каркас из железных стержней, то получается железобетон. Бетон и железобетон широко применяются в строительстве. Введение в бетон химических веществ определенного состава позволяет получать пенобетон, отличающийся легкостью, высокими тепло- и звукоизоляционными свойствами. Важнейшим отличием бетона от известкового раствора является то, что при его затвердевании происходит поглощение воды.
Недавно ученые на основе фосфата магния разработали биобетон. Внешние панели из биобетона после постройки тут же начинают накапливать дождевую воду, становясь идеальной средой для развития лишайников и мхов. Это позволяет создавать вертикальные сады на стенах жилых зданий, реализуя концепцию экогородов (см. рис. вверху). Кроме того, бетон активно используется как дизайнерский материал для изготовления садовой скульптуры (см. рис. внизу), предметов мебели и интерьера.

В качестве вяжущего материала используют также алебастр, который часто называют полуводным гипсом. Его формулу записывают следующим образом 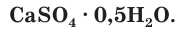 При замешивании с водой полуводный гипс поглощает воду и переходит в гипс
При замешивании с водой полуводный гипс поглощает воду и переходит в гипс 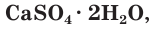 который широко используют в строительстве для изготовления сухой штукатурки, плит и панелей для перегородок, архитектурных деталей зданий (рис. 115).
который широко используют в строительстве для изготовления сухой штукатурки, плит и панелей для перегородок, архитектурных деталей зданий (рис. 115).


Стекло
Чаще всего мы сталкиваемся со стеклами, полученными на основе различных силикатов, поэтому в быту слово «стекло» употребляется для обозначения именно силикатных стекол.
Кроме красивого внешнего вида, стекло обладает низкой теплопроводностью и высокой прозрачностью, что позволяет использовать его для изготовления оконных стеклопакетов. При нагревании стекло легко вытягивается в тонкие, длинные нити, из которых изготавливают стекловату, стекловолокно и стеклоткани. Стекловата и стекловолокно используются в качестве звуко- и теплоизоляторов. Крупнейшим производителем стеклонитей и стеклотканей различного назначения на территории Беларуси является ОАО «Полоцк-Стекловолокно».
Стекольная промышленность Беларуси имеет давнюю историю. В 1717 г. в деревнях Налибоки и Янковичи (ныне Столбцовский район) по образцу Дрезденской мануфактуры Радзивиллы основали Налибокскую стеклянную мануфактуру, где изготавливались зеркала, подсвечники, художественная и бытовая посуда. В 1737 г. в деревне Уречье (ныне Любанский район) была основана Уречская стеклянная мануфактура, которая выпускала изделия из бесцветного и цветного стекла. Эти мануфактуры существовали до середины XVIII в. В 1883 г. помещик Зенон Ленский построил в поселке Березовка (ныне Лидский район) мануфактуру, которая позже, в 1908 г., стала стеклозаводом «Неман», работающим и по сей день.
Стекло не является индивидуальным соединением, а представляет собой сплав нескольких веществ. Для получения стекла (как говорят на производстве, при «варке» стекла) в качестве исходных материалов используют 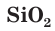 (песок),
(песок), 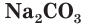 (соду) и
(соду) и 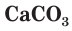 (мел, или известняк). Исходную смесь веществ нагревают до получения расплава при 800—1400 °С и после охлаждения получают обычное оконное стекло, состав которого можно условно описать формулой
(мел, или известняк). Исходную смесь веществ нагревают до получения расплава при 800—1400 °С и после охлаждения получают обычное оконное стекло, состав которого можно условно описать формулой 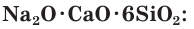
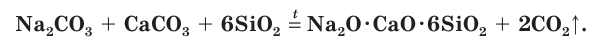
Часто при варке стекла для придания ему специфических свойств и окраски в исходную смесь добавляют разнообразные соли и оксиды.
- Стекло является экологически чистым материалом. Оно может подвергаться вторичной переработке, не загрязняя при этом окружающую среду.
- Основным источником сырья для производства строительных материалов являются природные соединения: песок, глина, известняк, силикаты и алюмосиликаты.
- К строительным материалам относятся стекло, керамика, вяжущие материалы.
Понятие о выходе продукта химической реакции
На практике при проведении химических реакций обычно получается несколько меньшее количество продукта, чем рассчитанное теоретически в соответствии с уравнением реакции. Это может происходить по нескольким причинам.
Многие химические реакции обратимы, т. е. протекают не до конца. Потери веществ могут быть также обусловлены их испарением, частичным растворением (ведь абсолютно нерастворимых веществ нет), потерями при упаривании или фильтровании растворов и т. п. Немаловажное значение имеет оборудование, с помощью которого осуществляется химическая реакция. Негерметичность оборудования, в котором проходят химические процессы, всегда приводит к потерям газообразных веществ. И наконец, часть веществ может не вступить в реакцию или образовать при взаимодействии побочные продукты.
Для оценки полноты протекания процесса пользуются понятием выход продукта химической реакции. Оно подобно понятию «коэффициент полезного действия», которое применяется в физике для характеристики процессов преобразования и использования энергии, работы различных двигателей и механизмов.
Выход продукта химической реакции обозначается буквой греческого алфавита η (эта). Он представляет собой величину, равную отношению реально полученной, т. е. практической массы вещества 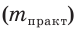 к массе этого вещества, рассчитанной по уравнению реакции, т. е. к его теоретической массе
к массе этого вещества, рассчитанной по уравнению реакции, т. е. к его теоретической массе 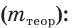
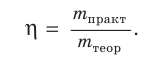
Выход продукта химической реакции — безразмерная величина, например: η(СаО) = 0,75, или 75 %.
Поскольку масса вещества пропорциональна его химическому количеству, то выход продукта реакции можно определять и как отношение соответствующих химических количеств вещества или объемов (для газов):
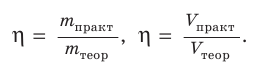
Например, если известно, что в реакции синтеза аммиака
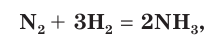
выход продукта составляет 0,75 (η = 0,75, или 75 %), то это означает, что из азота массой 28 г (объемом 22,4 дм3 , химическим количеством 1 моль) мы получим аммиак массой не 34 г (объемом 44,8 дм3 , химическим количеством 2 моль), а массой 34 г 0,75 = 25,5 г (объемом 33,6 дм3 , химическим количеством 1,5 моль).
0,75 = 25,5 г (объемом 33,6 дм3 , химическим количеством 1,5 моль).
Таким образом, выход продукта реакции — это величина, равная отношению реально полученной массы (химического количества, объема) вещества к массе (химическому количеству, объему) этого вещества, рассчитанной по уравнению реакции.
Величина выхода продукта реакции не может превышать 100 %. Если выход равен 100 %, то говорят, что реакция протекает количественно. В этом случае
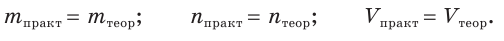
Кроме выражения «выход продукта химической реакции», часто используют и более краткие формы этого понятия: «выход продукта», «выход реакции», «реакция протекает с 90 %-м выходом».
На практике часто приходится рассчитывать химическое количество, массу или объем продукта реакции, если его выход отличается от 100 %, или, наоборот, определять выход продукта реакции. Рассмотрим типы расчетов с использованием этого понятия.
Тип 1. Даны массы (объемы, химические количества) исходного вещества и продукта реакции. Требуется определить выход продукта реакции.
Пример:
При прокаливании гидроксида алюминия 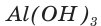 массой 93,6 г получен оксид алюминия
массой 93,6 г получен оксид алюминия 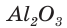 массой 52,02 г. Определите выход продукта реакции
массой 52,02 г. Определите выход продукта реакции
Дано:
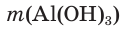 = 93,6 г
= 93,6 г
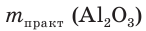 = 52,02 г
= 52,02 г

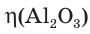 = ?
= ?
Решение
1. Определяем молярные массы гидроксида и оксида алюминия:
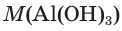 = 27 + 316 + 31 = 78 (г/моль).
= 27 + 316 + 31 = 78 (г/моль).
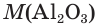 = 227 + 316 = 102 (г/моль).
= 227 + 316 = 102 (г/моль).
2. Находим химические количества гидроксида и оксида алюминия:
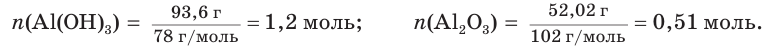
3. Записываем уравнение реакции разложения гидроксида алюминия и производим расчет теоретического химического количества (х) и теоретической массы полученного оксида алюминия:
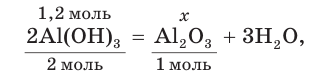
откуда получим: х = 0,6 моль. Это — 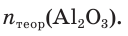
Тогда теоретическая масса оксида алюминия составит:
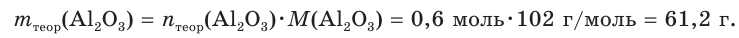
4. Определяем выход продукта реакции (двумя способами):
а) 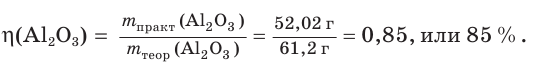
б) 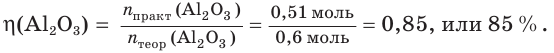
Ответ: выход продукта реакции равен 85 %.
Тип 2. Даны масса (объем, химическое количество) исходного вещества и выход продукта реакции. Требуется определить массу (объем, химическое количество) продукта реакции.
Пример:
Рассчитайте массу нитрата аммония 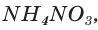 который может быть получен из аммиака объемом 4,48 м3 (н. у.) и необходимого количества азотной кислоты, если выход продукта составляет 90 %?
который может быть получен из аммиака объемом 4,48 м3 (н. у.) и необходимого количества азотной кислоты, если выход продукта составляет 90 %?
Дано:
V(NH3) = 4,48 м3 = 4480 дм3
η (NH4NO3) = 90 %

 = ?
= ?
Решение 1.
Найдем химическое количество аммиака:
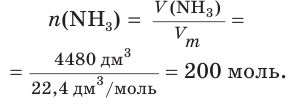
2. Составим уравнение реакции и рассчитаем теоретическое химическое количество 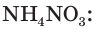
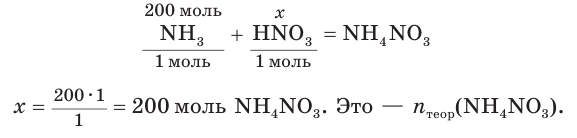
3. Находим теоретическую массу 
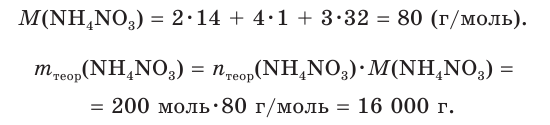
4. Из формулы для определения выхода продукта реакции выражаем  и производим расчет:
и производим расчет:
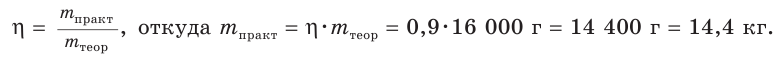
Ответ: практическая масса нитрата аммония равна 14,4 кг.
Тип 3. Даны масса (объем, химическое количество) продукта и выход продукта. Требуется определить массу (объем, химическое количество) исходного вещества.
Пример:
Определите объем (н. у.) водорода, который понадобится для получения аммиака объемом 13,44 м3 (н. у.), если его практический выход равен 20 %.
Дано:
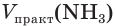 = 13,44 м3
= 13,44 м3
 = 20 % = 0,2
= 20 % = 0,2

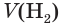 = ?
= ?
Решение
1. Рассчитаем теоретический объем аммиака:
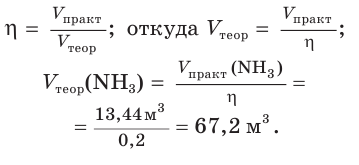
2. Составим уравнение реакции синтеза аммиака и рассчитаем объем (х) водорода:
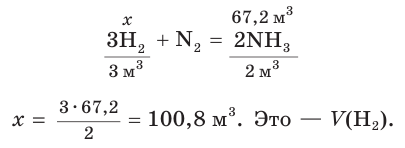
Ответ: для синтеза аммиака потребуется водород объемом 100,8 м3
Выход продукта реакции — это величина, равная отношению реально полученной в результате реакции массы (химического количества, объема) вещества к массе (химическому количеству, объему) этого вещества, рассчитанной по уравнению реакции
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |