
Фосфор в химии - классификация, получение, свойства, формулы и определения с примерами
Содержание:
Фосфор — химический элемент и простое вещество:
В периодической системе химических элементов неметалл фосфор Р расположен в третьем периоде в VA-группе. Рассмотрим свойства этого химического элемента и образуемых им простых веществ более подробно.
Фосфор в природе
Из-за высокой химической активности фосфор в природе в свободном виде не встречается. В почве и в горных породах он содержится в виде солей фосфорной кислоты — фосфатов. Так, фосфат кальция 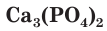


Фосфор поступает в организмы человека и животных с растительной пищей и продуктами питания. Растения, в свою очередь, усваивают фосфор из почвы.
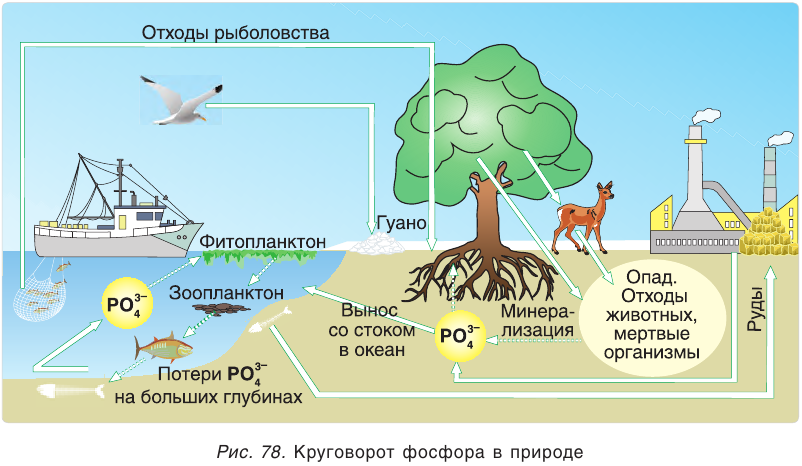
При гниении остатков животных и растений фосфор возвращается в почву. Так осуществляется круговорот фосфора в природе (рис. 78).
Строение атомов фосфора
В атоме фосфора имеется 15 электронов, которые располагаются на трех электронных слоях:
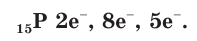
На внешнем электронном слое у атомов фосфора, так же как и у атомов азота, имеется по 5 электронов. В соединениях с металлами и водородом фосфор проявляет степень окисления, равную –3, например в фосфиде кальция 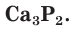 Максимальная положительная степень окисления, проявляемая атомами фосфора в соединениях, равна +5, например в фосфорной кислоте
Максимальная положительная степень окисления, проявляемая атомами фосфора в соединениях, равна +5, например в фосфорной кислоте 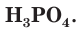 Для атомов фосфора также характерна степень окисления +3, например во фториде фосфора
Для атомов фосфора также характерна степень окисления +3, например во фториде фосфора 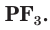
Строение и физические свойства простых веществ
Фосфор образует несколько аллотропных модификаций, которые называются белым, красным и черным фосфором.
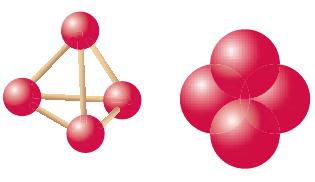

Белый фосфор состоит из молекул  имеющих форму тетраэдра. В таких молекулах каждый из четырех атомов фосфора связан ковалентной связью с тремя остальными (рис. 79). Как молекулярное соединение белый фосфор легкоплавок и летуч. Белый фосфор — сильно ядовитое вещество, воспламеняется на воздухе, светится в темноте. Хранят его под слоем воды.
имеющих форму тетраэдра. В таких молекулах каждый из четырех атомов фосфора связан ковалентной связью с тремя остальными (рис. 79). Как молекулярное соединение белый фосфор легкоплавок и летуч. Белый фосфор — сильно ядовитое вещество, воспламеняется на воздухе, светится в темноте. Хранят его под слоем воды.
Белый фосфор впервые был получен из мочи алхимиком Хённигом Брандтом в 1669 г. в виде массы, светящейся в темноте. Отсюда произошло и название этого элемента (фосфор в переводе с греческого означает «светоносный»).
На свету и при нагревании до 300 °С без доступа воздуха белый фосфор превращается в порошок, цвет которого может быть от красно-бурого до красного и фиолетового (красный фосфор). Красный фосфор не летуч, не растворим в воде, не ядовит.
Красный и черный фосфор, с которым вы подробнее познакомитесь в курсе химии 11-го класса, имеют сложную структуру.
Химические свойства фосфора
Химически фосфор достаточно активен — непосредственно соединяется со многими простыми веществами с выделением большого количества теплоты. При этом фосфор проявляет как окислительные, так и восстановительные свойства.
Окислительные свойства фосфора проявляются при его взаимодействии с наиболее активными металлами. При этом образуются фосфиды:
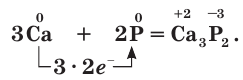
Восстановительные свойства фосфора проявляются при его взаимодействии с кислородом. Но у разных модификаций фосфора химическая активность различна. Например, белый фосфор при комнатной температуре легко окисляется на воздухе с образованием оксида фосфора(III):
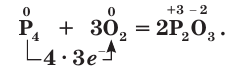


Окисление белого фосфора сопровождается свечением. Белый и красный фосфор при поджигании загораются и горят ослепительно ярким пламенем (рис. 80) с образованием белого дыма оксида фосфора(V):
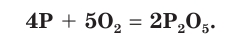
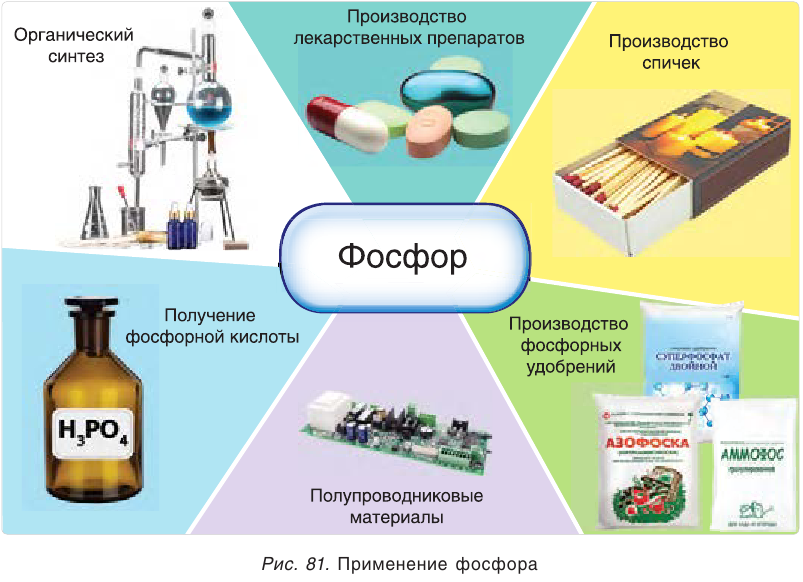
Применение фосфора
Фосфор используют в производстве фосфорной кислоты и фосфорных удобрений, полупроводниковых материалов как компонент покрытий стальных изделий и т. д. (рис. 81). Белый фосфор применяют для изготовления трассирующих боеприпасов как дымообразующее и зажигательное средство, красный фосфор — основной компонент смеси для спичечных коробков.
Современные спички, зажигающиеся при трении о специальную поверхность, были изобретены в Швеции в 1855 г. На боковые поверхности спичечного коробка наносят массу, состоящую из красного фосфора, оксида железа(III) Fe2O3, соединений сурьмы и марганца с примесью измельченного стекла и клея. В состав спичечной головки входят хлорат калия KClO3, сера, наполнители и клей. При трении спичечной головки о фосфорные намазки происходит воспламенение:
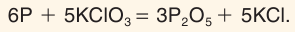
- Фосфор образует несколько аллотропных модификаций — белый, красный и черный фосфор.
- Белый фосфор — сильно ядовитое вещество.
- Фосфор проявляет восстановительные свойства в реакции с кислородом и окислительные — в реакциях с активными металлами.
Кислородсодержащие соединения фосфора
Среди неорганических соединений фосфора наибольшее значение имеют его оксиды, фосфорная кислота 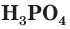 и ее соли.
и ее соли.
Оксиды фосфора
В зависимости от условий окисления фосфора можно получить оксид фосфора(III) 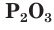 или оксид фосфора(V)
или оксид фосфора(V) 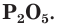
Оксид фосфора(V) представляет собой твердое, белое порошкообразное вещество, которое обладает способностью отнимать воду у многих веществ.
Оксид фосфора(V) используется в химических лабораториях и промышленности в качестве лучшего осушающего и отнимающего воду (дегидратирующего) средства.
При растворении оксида фосфора(V) в воде образуется фосфорная кислота 
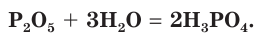
Оксид фосфора(III) и оксид фосфора(V) обладают кислотными свойствами: взаимодействуют с водой, осно Ђвными оксидами и основаниями. С продуктами этих реакций вы познакомитесь в 11-м классе.
Фосфорная кислота и ее соли
В молекуле 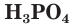 атом фосфора соединен с четырьмя атомами кислорода одной двойной связью
атом фосфора соединен с четырьмя атомами кислорода одной двойной связью 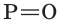 и тремя одинарными связями
и тремя одинарными связями 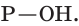 Модель молекулы и графическая формула фосфорной кислоты представлены на рисунке 82:
Модель молекулы и графическая формула фосфорной кислоты представлены на рисунке 82:
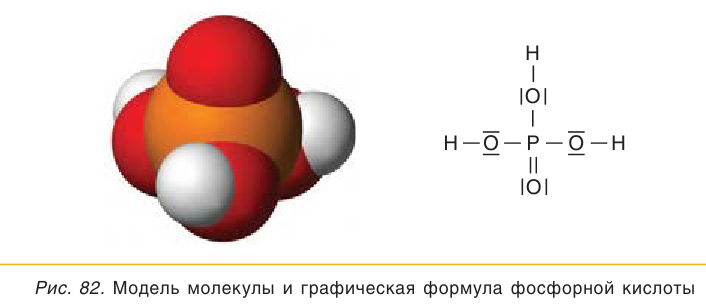
Фосфорная кислота 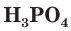 является трехосновной кислотой. Она относится к слабым электролитам и в водных растворах диссоциирует обратимо.
является трехосновной кислотой. Она относится к слабым электролитам и в водных растворах диссоциирует обратимо.
Фосфорная кислота проявляет все свойства, характерные для кислот: изменяет окраску индикаторов, реагирует с металлами, расположенными в ряду активности до водорода, основными оксидами, основаниями и солями.
С водой фосфорная кислота смешивается в любых соотношениях.
Соли фосфорной кислоты называются фосфатами. Большинство этих солей, кроме фосфатов щелочных металлов и аммония, нерастворимы в воде.
Применение фосфорной кислоты и фосфатов
В промышленности, в коммунальном хозяйстве и в быту фосфорную кислоту и ее соли применяют для замедления коррозии металлов, умягчения воды, борьбы с накипью и изготовления различных моющих средств. Пропитка древесины самой кислотой и ее солями делает дерево негорючим. На этой основе сейчас производят огнезащитные краски, негорючие фосфодревесные плиты, негорючий фосфатный пенопласт и другие строительные материалы. Фосфаты широко используются как фосфорные удобрения.
В пищевой промышленности небольшие добавки фосфорной кислоты заметно улучшают вкусовые качества мармелада, лимонадов и сиропов.
Более подробно со свойствами фосфорной кислоты H3PO4 и ее солей вы познакомитесь в курсе химии 11-го класса.
- К наиболее распространенным соединениям фосфора относятся оксиды, фосфорная кислота и ее соли.
- Слабая фосфорная кислота в растворах диссоциирует обратимо.
- Фосфорная кислота проявляет все свойства, характерные для кислот: изменяет окраску индикаторов, реагирует с металлами, расположенными в ряду активности до водорода, основными оксидами, основаниями и солями.
Минеральные удобрения
К важнейшим химическим элементам, необходимым для развития растений, относятся азот, фосфор и калий. Кроме названных, для жизнедеятельности растений важны и другие химические элементы: сера, магний, железо и кальций. Эти семь элементов называют макроэлементами. Кроме них, растениям в очень небольших количествах нужны марганец, кремний, бор, медь, цинк, молибден и др. — их называют микроэлементами (рис. 83).
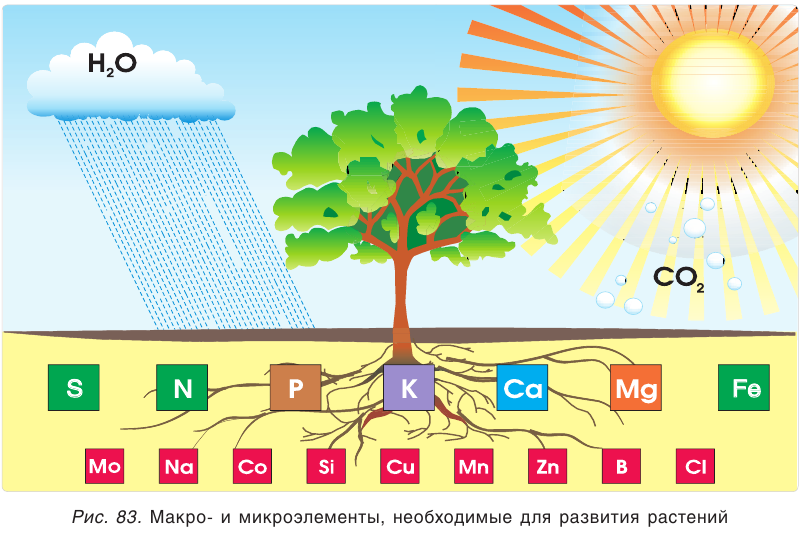
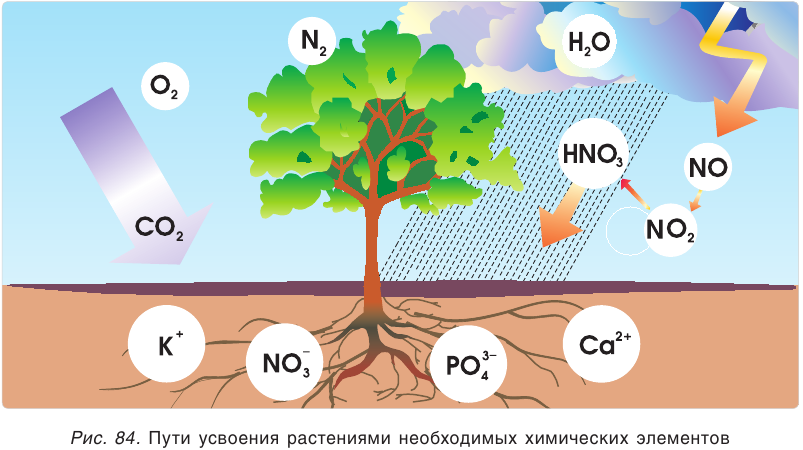
Растения получают необходимые элементы из почвы в виде растворимых соединений. Например, азот растения усваивают либо в виде нитратиона  либо в виде иона аммония
либо в виде иона аммония  фосфор — в виде фосфат-иона
фосфор — в виде фосфат-иона 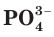 (рис. 84). Если таких соединений в почве мало, их надо добавлять до нормы (вносить удобрения).
(рис. 84). Если таких соединений в почве мало, их надо добавлять до нормы (вносить удобрения).
Удобрения — это вещества, которые содержат химические элементы, необходимые для питания растений, их вносят в почву для повышения урожайности.
Азотные удобрения
Атомы азота входят в состав аминокислот и белков. Но непосредственно из воздуха азот могут усваивать только особые бактерии, которые живут в клубеньках корешков бобовых растений (гороха, фасоли, клевера, люпина, чечевицы) (рис. 85). Все другие растения потребляют азот из солей аммония или нитратов. Каждую осень человек собирает урожай, а значит, забирает из почвы соединения азота, из-за чего почва теряет свою плодородность, поэтому ее необходимо удобрять.
Азотные удобрения делятся на две группы: минеральные и органические. К минеральным азотным удобрениям относятся: сульфат аммония 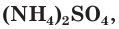 аммиачная вода и жидкий аммиак
аммиачная вода и жидкий аммиак  селитры:
селитры: 
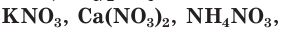 мочевина
мочевина 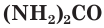 и др.
и др.

Органические азотные удобрения — это навоз, компост (удобрение, получаемое из органических остатков в результате их биологического разложения), помет и зеленые удобрения на основе бобовых растений. Помимо азота, они содержат и другие элементы, необходимые для питания растений.
В большом количестве высококонцентрированные азотные удобрения в Беларуси производятся на ОАО «Гродно Азот» (рис. 86).
Важно знать, что избыточное внесение в почву азотных удобрений приводит к тому, что нитраты попадают в пищевые продукты, загрязняя их и делая непригодными к употреблению. Содержание нитратов в овощах, фруктах и других продуктах не должно превышать предельно допустимой концентрации. При использовании экологически чистых продуктов человек в сутки потребляет нитраты массой 100—200 мг, из них 60—70 % — с овощами, а 10—20 % — с водой.
Фосфорные удобрения
В качестве фосфорных удобрений чаще всего используют кальциевые соли фосфорной кислоты. Одно из распространенных фосфорных удобрений — измельченная горная порода фосфорит (фосфоритная мука), основным компонентом которого является фосфат кальция 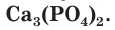 Фосфорит плохо растворим в воде. К хорошо растворимым в воде фосфорным удобрениям относятся двойной суперфосфат и аммофос, с которыми более подробно вы познакомитесь в 11-м классе. Фосфорные удобрения в Беларуси производятся на Гомельском химическом заводе.
Фосфорит плохо растворим в воде. К хорошо растворимым в воде фосфорным удобрениям относятся двойной суперфосфат и аммофос, с которыми более подробно вы познакомитесь в 11-м классе. Фосфорные удобрения в Беларуси производятся на Гомельском химическом заводе.
Фосфорные удобрения повышают урожайность сельскохозяйственных культур, придают растениям зимостойкость и устойчивость к неблагоприятным климатическим условиям, способствуют быстрому созреванию урожая в районах с коротким вегетационным периодом.
Калийные удобрения
В качестве калийного удобрения чаще всего используют хлорид калия KCl, встречающийся в составе различных горных пород (см. § 15).
Важным калийным удобрением является также зола растений, в которой калий находится в виде карбоната калия (поташа) 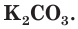 Это вещество хорошо растворимо в воде и легко усваивается растениями. Кроме того, в золе содержатся фосфор, кальций и другие элементы, необходимые для развития растений.
Это вещество хорошо растворимо в воде и легко усваивается растениями. Кроме того, в золе содержатся фосфор, кальций и другие элементы, необходимые для развития растений.
При внесении минеральных удобрений в почву необходимо учитывать состав почвы и ее кислотность, нормы и сроки внесения удобрений, а также погодные условия.
- Удобрения — это вещества, которые содержат химические элементы, необходимые для питания растений; их вносят в почву для повышения урожайности.
- К важнейшим химическим элементам, необходимым для развития растений, относятся азот, фосфор и калий.
| Рекомендую подробно изучить предметы: |
| Ещё лекции с примерами решения и объяснением: |