
Электролиз водных растворов 1. Для вашего варианта запишите катодную, анодную и суммарную
 |
 |
Химия |
 |
 |
Решение задачи |
 |
 |
|
 |
 |
Выполнен, номер заказа №16813 |
 |
 |
Прошла проверку преподавателем МГУ |
 |
 |
|
Напишите мне в чат, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
|
Закажите у меня новую работу, просто написав мне в чат! |
Электролиз водных растворов 1. Для вашего варианта запишите катодную, анодную и суммарную реакции, происходящие в электролизере (см. вариант в табл. 16). 2. Укажите реакцию среды (рН) до электролиза. Изменится или нет рН раствора у анода и катода в процессе электролиза Если изменится, то укажите как: уменьшится или увеличится. 3. По закону Фарадея рассчитайте величину обозначенного через знак « » одного из параметров – массы вещества, выделившегося на катоде m, тока I или времени электролиза t.
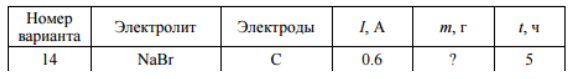
Решение:
соль сильной кислоты и сильного основания, поэтому гидролизу не подвергается, в растворе этой соли среда нейтральная, В процессе электролиза у катода образуются ионы ОН-, поэтому среда становится щелочной, рН увеличивается. Среда у анода не изменяется. По закону Фарадея:

Похожие готовые решения по химии:
- Удельная электропроводность насыщенного водного раствора сульфата бария при 25 0С равна 4,31∙10-4 См/м. Его эквивалентная
- Оцените значение параметра а в уравнении второго приближения теории Дебая-Хюккеля по зависимости среднего ионного
- Найдите значение растворимости сульфата серебра при 298 К: а) в воде; б) в 0,01 М растворе нитрата натрия, если ПР = 1,58∙10-5 .
- Начальные концентрации эфира и щелочи для реакции CH3COOC2H5 + NaOH = CH3COONa + C2H5OH равны 0,025 моль/л.
- Для элемента задана электронная формула внешнего слоя
- Рассчитайте изменение скорости прямой реакции при одновременном изменении условий реакции (вариант в табл.). Если
- Даны уравнения реакций и концентрации веществ. Обозначения:с0 – исходная концентрация, [ ] – равновесная концентрация,
- Даны электроды (см. вариант в табл. 14). 1. Подберите электролиты и обозначьте гальванический элемент,
- Даны электроды (см. вариант в табл. 14). 1. Подберите электролиты и обозначьте гальванический элемент,
- При анализе методом газовой хроматографии смеси толуола (I), этилбензола (2), ксилола (3), стирола (4) к анализируемой пробе массой 2,034 г добавлено 0,4168 г н-октана в качестве внутреннего стандарта
- Для данной окислительно-восстановительной реакции определить её тип; указать восстановитель и окислитель; подобрать коэффициенты методом
- Рассчитать степень извлечения ионов цинка из 200 мл 0,1 Н раствора сульфата цинка катионитом, если на титрование выделенной из катионита в Н+ - форме кислоты израсходовано 18 мл 0,098 М раствора гидро

