
Автор Анна Евкова
Преподаватель который помогает студентам и школьникам в учёбе.
На основании агрегатных состояний веществ, участвующих в реакции, предположите ВаСО3(к) = ВаО(к) + СО2
 |
 |
Химия |
 |
 |
Решение задачи |
 |
 |
|
 |
 |
Выполнен, номер заказа №16953 |
 |
 |
Прошла проверку преподавателем МГУ |
 |
 |
|
Напишите мне в чат, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
|
Закажите у меня новую работу, просто написав мне в чат! |
Описание заказа и 38% решения ( + фото):
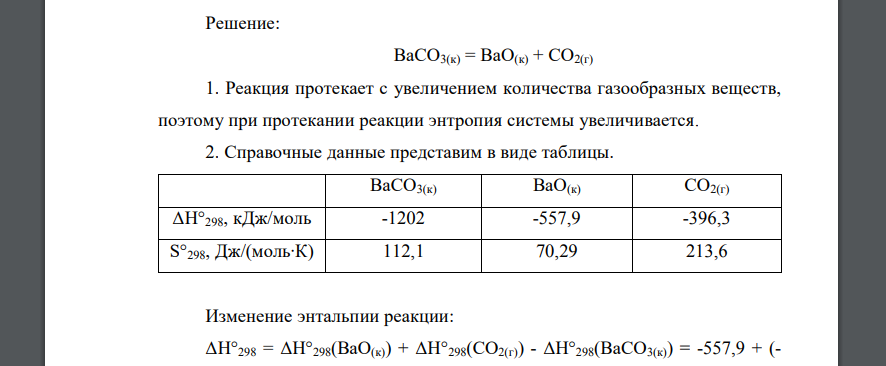
На основании агрегатных состояний веществ, участвующих в реакции, предположите, как должна меняться энтропия системы. 2. Рассчитайте Н 0 298, S 0 298, G 0 298 химической реакции и определить, какой (эндо- или экзотермической) является данная реакция, возможно ли протекание ее при стандартных условиях. 3. Рассчитайте температуру равновесия реакции и укажите, при каких температурах (больших или меньших Тр) реакция будет протекать, и ее константа равновесия будет больше единицы. 4. Рассчитайте величину константы равновесия при Т = Тр + 500 К и сделайте вывод о направлении самопроизвольного протекания реакции при данной температуре. № Уравнение реакции 17 ВаСО3(к) = ВаО(к) + СО2(г)
Решение:
Реакция протекает с увеличением количества газообразных веществ, поэтому при протекании реакции энтропия системы увеличивается. 2. Справочные данные представим в виде таблицы. Изменение энтальпии реакции: следовательно, реакция эндотермическая. Изменение энтропии реакции: Изменение энергии Гиббса реакции: поэтому невозможно самопроизвольное протекание реакции при 3. В состоянии химического равновесия Температуру в состоянии равновесия рассчитаем по формуле 4. Константа равновесия определяется по формуле Константа равновесия равна при данной температуре реакция протекает в прямом направлении

Похожие готовые решения по химии:
- Запишите выражение закона действия масс (ЗДМ) для уравнения реакции данного варианта 2H2(г) + O2(г) = 2H2O
- Запишите выражение для константы равновесия для заданного уравнения реакции А(г) + В(г) = = С(г) + Д(г)
- Проставьте степени окисления элементов в исходных веществах и продуктах реакции MnO2 + KClO3 + KOH = K2MnO4 + KCl + H2O
- Исходя из значений стандартных электродных потенциалов, сделайте вывод, какой из электродов является анодом, какой – катодом Электроды 17 Zn, Со
- Проставьте степени окисления элементов в исходных веществах и продуктах реакции SO2 + HNO3 + H2O = H2SO4 + NO
- Исходя из значений стандартных электродных потенциалов, сделайте вывод, какой из электродов является анодом, какой – катодом Электроды 16 Ni, Zn
- Определите анодные и катодные участки. При необходимости подберите нужный металл согласно заданию Медное изделие + катодное покрытие
- Укажите характер связей в молекуле, для чего изобразите графическую формулу указанного соединения и рассчитайте H2CO3 GaCl3 [Cr(H2O)6]Cl3
- Гальванический элемент составлен из стандартного цинкового электрода и хромового электрода, погруженного в раствор, содержащий ионы Cr3+. Определите
- Дайте обоснование определению примеси сульфатов в сульфадиметоксине в соответствии с требованиями ФС (Приложения № 3, 7)
- Запишите выражение закона действия масс (ЗДМ) для уравнения реакции данного варианта 2H2(г) + O2(г) = 2H2O
- Напишите уравнение реакций, протекающих на нерастворимых электродах при электролизе водного раствора КОН. Какие вещества и в каком объеме можно получить

