
Автор Анна Евкова
Преподаватель который помогает студентам и школьникам в учёбе.
Приведите формулировки основных стехиометрических законов NH3 Mg(OH)2
 |
 |
Химия |
 |
 |
Решение задачи |
 |
 |
|
 |
 |
Выполнен, номер заказа №16953 |
 |
 |
Прошла проверку преподавателем МГУ |
 |
 |
|
Напишите мне в чат, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
|
Закажите у меня новую работу, просто написав мне в чат! |
Описание заказа и 38% решения ( + фото):
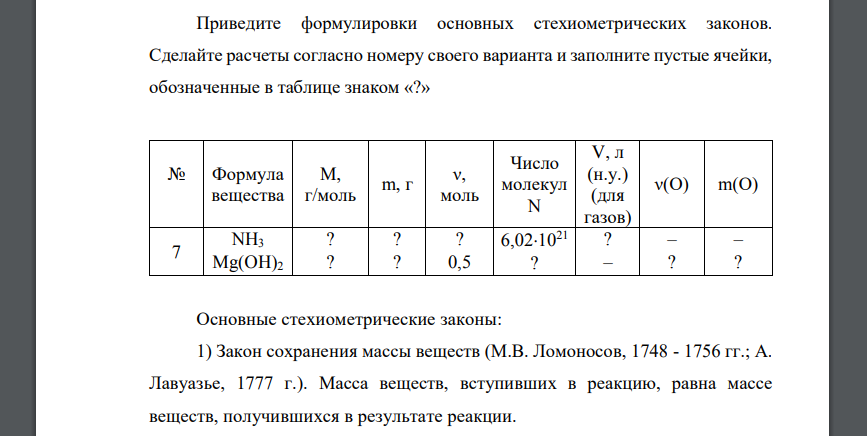
Приведите формулировки основных стехиометрических законов. Сделайте расчеты согласно номеру своего варианта и заполните пустые ячейки, обозначенные в таблице знаком «?» № Формула вещества М, г/моль m, г ν, моль Число молекул N V, л (н.у.) (для газов) ν(О) m(О) 7 NH3 Mg(OH)2 ? ? ? ? ? 0,5 6,021021 ? ? – – ? – ?
Ответ:
Основные стехиометрические законы: 1) Закон сохранения массы веществ (М.В. Ломоносов, 1748 - 1756 гг.; А. Лавуазье, 1777 г.). Масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате реакции. 355 2) Закон постоянства состава (Ж.Л. Пруст, 1801 г.). Каждое чистое соединение независимо от способа его получения всегда имеет один и тот же состав. 3) Закон Авогадро (А. Авогадро, 1811 г.). В равных объемах различных газов при одинаковых температуре и давлении содержится одно и то же число молекул. Важным следствием из закона Авогадро является утверждение: при одинаковых условиях равные количества различных газов занимают равные объемы.
Дано: N(NH3) = 6,02∙1021 Решение
Рассчитаем химическое количество 2. Рассчитаем массу 3. Рассчитаем объем аммиака:
Дано: (Mg(OH)2) = 0,5 моль Решение 1. Рассчитаем массу 2. Рассчитаем количество молекул в 3. Выразим химическое количество кислорода: 5. Масса кислорода равна Ответ:


Похожие готовые решения по химии:
- дайте названия по формулам и укажите формулы по названиям нитрат гидроксокальция, оксид кобальта (III), гидросульфид калия, сульфат алюминия
- Для приведенных элементов (см. задания в таблице 3): 1) укажите строение изотопов 32S,33S,34S,36S
- Укажите характер связей в молекуле, для чего изобразите графическую формулу указанного соединения и рассчитайте NaClO3
- На основании агрегатных состояний веществ, участвующих в реакции, предположите, как должна меняться энтропия системы 6H2O(г) + 4NO(г) = 5O2(г) + 4NH3(г)
- Запишите выражение для константы равновесия для заданного уравнения реакции Н2(г) + СО2(г) = СО(г) + Н2О(г)
- Проставьте степени окисления элементов в исходных веществах и продуктах реакции KNO2 + KMnO4 + H2O = MnO2 + KNO3 + KOH KMnO4 Mn
- Исходя из значений стандартных электродных потенциалов, сделайте вывод, какой из электродов является анодом, какой – катодом Zn, Ag
- Определите анодные и катодные участки. При необходимости подберите нужный металл согласно заданию 1 Железное изделие + протектор
- Напишите уравнения реакций (реакции присоединения, замещения, разложения, отщепления, окислительно-восстановительные): А) гексин
- Какие соединения образуются при взаимодействии 1,4-пентадиена с хлором? Приведите механизм реакций.
- дайте названия по формулам и укажите формулы по названиям нитрат гидроксокальция, оксид кобальта (III), гидросульфид калия, сульфат алюминия
- Дайте обоснование определению подлинности ингредиентов лекарственной смеси: Пилокарпина гидрохлорида

