
Автор Анна Евкова
Преподаватель который помогает студентам и школьникам в учёбе.
На основании агрегатных состояний веществ, участвующих в реакции, предположите, как должна меняться энтропия системы 6H2O(г) + 4NO(г) = 5O2(г) + 4NH3(г)
 |
 |
Химия |
 |
 |
Решение задачи |
 |
 |
|
 |
 |
Выполнен, номер заказа №16953 |
 |
 |
Прошла проверку преподавателем МГУ |
 |
 |
|
Напишите мне в чат, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
|
Закажите у меня новую работу, просто написав мне в чат! |
Описание заказа и 38% решения ( + фото):
На основании агрегатных состояний веществ, участвующих в реакции, предположите, как должна меняться энтропия системы. 2. Рассчитайте Н 0 298, S 0 298, G 0 298 химической реакции и определить, какой (эндо- или экзотермической) является данная реакция, возможно ли протекание ее при стандартных условиях. 3. Рассчитайте температуру равновесия реакции и укажите, при каких температурах (больших или меньших Тр) реакция будет протекать, и ее константа равновесия будет больше единицы. 4. Рассчитайте величину константы равновесия при Т = Тр + 500 К и сделайте вывод о направлении самопроизвольного протекания реакции при даннойтемпературе. № Уравнение реакции 7 6H2O(г) + 4NO(г) = 5O2(г) + 4NH3(г)
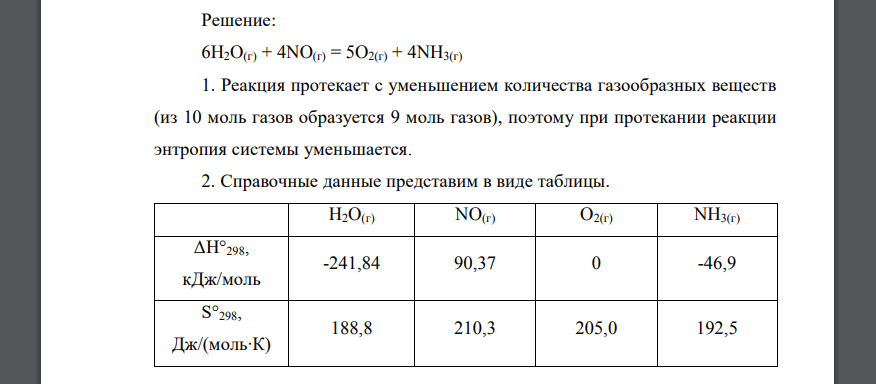
Решение:
Реакция протекает с уменьшением количества газообразных веществ (из 10 моль газов образуется 9 моль газов), поэтому при протекании реакции энтропия системы уменьшается. 2. Справочные данные представим в виде таблицы. По первому следствию из закона Гесса рассчитаем изменение энтальпии реакции: следовательно, реакция эндотермическая. Рассчитаем изменение энтропии реакции: Рассчитаем изменение энергии Гиббса реакции при поэтому невозможно самопроизвольное протекание реакции при 3. В состоянии химического равновесия Тогда температуру в состоянии равновесия рассчитаем по формуле такая температура невозможна. 4. Константа равновесия определяется по формуле изменение энергии Гиббса реакции равно Константа равновесия равна при данной температуре реакция протекает в обратном направлении.


Похожие готовые решения по химии:
- Запишите выражение закона действия масс (ЗДМ) для уравнения реакции данного варианта N2O(г) + H2O(ж) = 2NO(г) + H2(г)
- Запишите выражение для константы равновесия для заданного уравнения реакции H2(г) + Br2(г) = 2HBr(г)
- Проставьте степени окисления элементов в исходных веществах и продуктах реакции Na2SO3 + KIO3 + H2SO4 = I2 + Na2SO4 + K2SO4 + H2O Na2SO3 S
- Исходя из значений стандартных электродных потенциалов, сделайте вывод, какой из электродов является анодом, какой – катодом 7 Ag, Pb
- Приведите формулировки основных стехиометрических законов NH3 Mg(OH)2
- дайте названия по формулам и укажите формулы по названиям нитрат гидроксокальция, оксид кобальта (III), гидросульфид калия, сульфат алюминия
- Для приведенных элементов (см. задания в таблице 3): 1) укажите строение изотопов 32S,33S,34S,36S
- Укажите характер связей в молекуле, для чего изобразите графическую формулу указанного соединения и рассчитайте NaClO3
- Назовите методы количественного определения леводопы и сульфаметоксазола (титриметрические и физико-химические), для
- Обоснуйте и приведите химизм возможных методов количественного анализа производных тропана
- Дайте заключение о качестве таблеток бутадиона 0,15 г по количественному содержанию с учетом требований НД
- Составьте все возможные эмпирические и графические формулы солей, полученные при взаимодействии гидроксида хрома Сr(ОН)3 и серной

