
В сосуде емкостью 10 л установилось равновесие в газовой системе СО + Cl2 ↔ COCl2 + Q. Состав равновесной системы: 11 г СO; 36 г Cl2; 42 г COCl2. Вычислите константу равновесия (КС) и исходные концентрации CO и Cl2. Как изменится численное значение КС при увеличении температуры и почему
 |
 |
Химия |
 |
 |
Решение задачи |
 |
 |
|
 |
 |
Выполнен, номер заказа №17022 |
 |
 |
Прошла проверку преподавателем МГУ |
 |
 |
|
Напишите мне в чат, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
|
Закажите у меня новую работу, просто написав мне в чат! |
В сосуде емкостью 10 л установилось равновесие в газовой системе
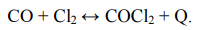
Состав равновесной системы: 11 г СO; 36 г Cl2; 42 г COCl2. Вычислите константу равновесия (КС) и исходные концентрации CO и Cl2. Как изменится численное значение КС при увеличении температуры и почему?
Решение:

Определим исходные. концентрации CO и Cl2. Известно, что в ходе реакции образовалось 0,04 моль/л COCl2. По уравнению реакции видим, что 593 на образование 1 моль COCl2 требуется 1 моль СО и 1 моль Cl2, поэтому на образование 0,04 моль/л COCl2 потребовалось 0,04 моль/л СО и 0,04 моль/л Cl2. Тогда исходные концентрации равны
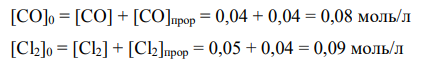
Из условия задачи известно, что при протекании прямой реакции теплота выделяется, т.е. прямая реакция является экзотермической. По принципу Ле-Шателье, при повышении температуры скорость реакции смещается в сторону эндотермической реакции, т.е. влево (в сторону обратной реакции), при этому выход COCl2 уменьшается, константа равновесия КС уменьшается.
Ответ: 20 л/моль; 0,08 моль/л; 0,09 моль/л.

Похожие готовые решения по химии:
- Вычислите концентрацию ионов и их количество, содержащихся в 100 мл 0,01 М раствора HNO2 (КД = 4⋅10–4 ). Запишите уравнение диссоциации и выражение для константы диссоциации, как изменятся значения α и КД HNO2 при уменьшении концентрации раствора
- Определите, сколько граммов щелочи КОН содержится в 500 мл его раствора, рН которого равен 12
- Вычислите стандартную энтальпию образования сульфида цинка (ZnS), используя стандартные энтальпии образования веществ, если известно, что тепловой эффект (∆H°298) реакции
- Рассчитайте изменение энтропии для реакции 2ZnS(кр) + 3О2(г) = 2ZnO(кр) + 2SO2(г), протекающей при постоянном давлении (P =101 кПа ) и T = 998 K. При расчетах принять, что в интервале 298 – 998 К Ср не зависит от Т
- Объясните механизм защиты подземного стального трубопровода с помощью магниевого протектора, если почвенные воды в данной местности имеют ярко выраженный кислотный характер. Приведите электронные уравнения анодного и катодного процессов
- Как будет происходить электролиз водного раствора электролита ZnSO4 (t = 1 ч 15 мин, I = 12 А)? Приведите уравнение диссоциации электролита и поясните возможность участия каждого из образующихся ионов в электродных реакциях
- На нейтрализацию 3,28 г основания израсходовано 2,14 г HCl. Вычислите эквивалент основания. Какую массу магния можно окислить этим же количеством кислоты
- Определите скорость химической реакции N2(г) + 3Н2(г) = 2NH3(г) при исходных концентрациях [N2] = 2 моль/л и [H2] = 8 моль/л и в момент времени, когда концентрация азота уменьшилась на 10%
- Определите скорость химической реакции N2(г) + 3Н2(г) = 2NH3(г) при исходных концентрациях [N2] = 2 моль/л и [H2] = 8 моль/л и в момент времени, когда концентрация азота уменьшилась на 10%
- На нейтрализацию 3,28 г основания израсходовано 2,14 г HCl. Вычислите эквивалент основания. Какую массу магния можно окислить этим же количеством кислоты
- Определите, сколько граммов щелочи КОН содержится в 500 мл его раствора, рН которого равен 12
- Вычислите концентрацию ионов и их количество, содержащихся в 100 мл 0,01 М раствора HNO2 (КД = 4⋅10–4 ). Запишите уравнение диссоциации и выражение для константы диссоциации, как изменятся значения α и КД HNO2 при уменьшении концентрации раствора

