
Изменения термодинамических функций H, S, G в ходе химической реакции позволяют судить об особенностях протекания данной реакции и ее природе
 |
 |
Химия |
 |
 |
Решение задачи |
 |
 |
|
 |
 |
Выполнен, номер заказа №17022 |
 |
 |
Прошла проверку преподавателем МГУ |
 |
 |
|
Напишите мне в чат, пришлите ссылку на эту страницу в чат, оплатите и получите файл! |
|
Закажите у меня новую работу, просто написав мне в чат! |
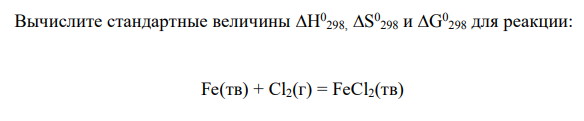
Объясните знак изменения энтальпии и энтропии. Возможно ли самопроизвольное протекание данной реакции при стандартных условиях?
Решение
H (энтальпия), S (энтропия) и G (свободная энергия Гиббса или термодинамический потенциал) являются термодинамическими функциями состояния и обладают общим свойством: их изменение в ходе химической реакции не зависит от пути этой реакции, а определяется только начальными
и конечными веществами. Это позволяет вычислять 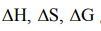 для реакции общего вида aA + bB = cC + dD по формулам:
для реакции общего вида aA + bB = cC + dD по формулам:
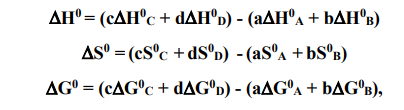

(при этом для стандартных условий T = 298 К). Д
ля реакции, указанной в условии задачи, выписываем необходимые справочные данные:

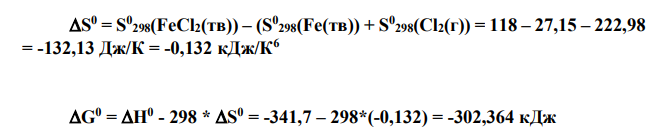
Изменения термодинамических функций H, S, G в ходе химической реакции позволяют судить об особенностях протекания данной реакции и ее природе. H определяет величину теплового эффекта химической реакции. Процесс, характеризующийся величиной H0 говорит о том, что тепло в ходе реакции поглощается, такие реакции называются эндотермическими. В данной реакции величина H < 0, следовательно, тепло выделяется, и реакция является экзотермической.
S характеризует изменение степени неупорядоченности системы. Возрастание энтропии (S 0>0) говорит о возрастании неупорядоченности в расположении и перемещении частиц в ходе химической реакции. Это происходит, например, при превращении твердых веществ в жидкие или газообразные или при увеличении количеств газообразных веществ. Напротив, уменьшение энтропии (S 0<0) cвидетельствует о возрастании упорядоченности системы в ходе реакции. Уменьшение энтропии характерно для реакций, в ходе которых, например, газообразные или жидкие вещества превращаются в твердые, а также для газовых реакций, сопровождающихся уменьшением количеств газообразных веществ.
Для данной реакции рассчитанная величина изменения энтропии S 0 < 0, что свидетельствует об уменьшении (увеличении или уменьшении?) неупорядоченности в данной системе.
Действительно, из уравнения реакции видно, что в ходе реакции из 1 моль газообразных веществ образуется 0 моль газообразных веществ, следовательно, степень неупорядоченности уменьшается (увеличивается или уменьшается?).
Величина G 0 позволяет судить о принципиальной возможности самопроизвольного протекания химической реакции при стандартных условиях: если G 0 < 0, данная химическая реакция принципиально осуществима при стандартных условиях, если же G 0 > 0, то нет (в этом случае осуществима обратная реакция). Состояние химического равновесия в системе отвечает равенству G 0 = 0. Для рассматриваемой в задаче реакции вычисленная величина G 0 составляет -302,364 кДж, т.е. G 0 < 0. Следовательно, данная химическая реакция при стандартных условиях принципиально осуществима (осуществима или не осуществима).

Похожие готовые решения по химии:
- Большинство химических реакций являются обратимыми: одновременно с прямой реакций протекает обратная. В момент выравнивания скоростей прямой и обратной реакций в системе наступает состояние химического равновесия
- Необходимо произвести вычисления и найти недостающие величины в водных растворах величины под номером 113
- Степени окисления атомов в простых веществах (построенных из атомов одного и того же элемента) принимаются равными нулю
- Электрохимическая схема - это условная запись, в которой представлена информация о аноде и катоде с указанием металлов, состава электролитов, а также особенностях конструкции данного гальванического элемента
- Как будет происходить электролиз водного раствора электролита NaNO3 (t = 45 мин, I = 7 А)? Приведите уравнение диссоциации электролита и поясните возможность участия каждого из образующихся ионов в электродных реакциях
- Таким образом, число протонов в ядре численно совпадает с атомным (порядковым) номером элемента в периодической системе Д.И. Менделеева. Число нейтронов можно вычислить по разности между массовым числом и числом протонов
- На основании положения химического элемента № 35 и его электронной формулы составьте прогноз его химических свойств, ответив на следующие вопросы
- Определите тип химической связи (неполярная ковалентная, полярная ковалентная или ионная) в веществах бромид кальция и дибром
- Определите тип химической связи (неполярная ковалентная, полярная ковалентная или ионная) в веществах бромид кальция и дибром
- На основании положения химического элемента № 35 и его электронной формулы составьте прогноз его химических свойств, ответив на следующие вопросы
- Большинство химических реакций являются обратимыми: одновременно с прямой реакций протекает обратная. В момент выравнивания скоростей прямой и обратной реакций в системе наступает состояние химического равновесия
- Компания внедряет онлайн-систему отбора. Затраты на внедрение онлайн системы составят Наименование Сумма, руб. Затраты

